Misurazione del monossido di azoto (No) nasale
Ossido nitrico nasale
Definizione
L’ossido nitrico (NO) è un gas incolore e inodore presente nell’aria espirata attraverso la bocca o il naso. Il NO è prodotto dall’arginina e dall’ossigeno dall’ossido nitrico sintasi (NOS). Esistono forme neuronali ed endoteliali espresse in modo costitutivo e una forma indotta, iNOS, che sembra essere regolata all’interno delle vie respiratorie in risposta a segnali pro-infiammatori. No è venuto alla ribalta per il suo ruolo nella vasodilatazione [58] e successivamente come neurotrasmettitore e mediatore infiammatorio [59]. Il ruolo del NO nelle vie aeree è complesso, possibilmente includendo effetti antibatterici, effetti pro-infiammatori e regolazione del flusso sanguigno e della frequenza del battito ciliario. I livelli di NO espirati (eNO) sono aumentati nell’asma eosinofila [60] e la misurazione di questo è diventata uno strumento standardizzato, ma non ancora diffuso, nella diagnosi e nella gestione dell’asma. Può potenzialmente fornire una misura rapida, a basso costo e obiettiva di infiammazione delle vie aeree inferiore.
Livelli di NO molto più elevati sono prodotti nella parte superiore che nelle vie respiratorie inferiori, con contributi dai seni nasali e in misura minore dalla mucosa nasale [61].
Storia
Questo gas è stato scoperto da Joseph Priestley nel 1772. Vent’anni dopo, Humphry Davy lo sperimentò su sé stesso e su alcuni amici, tra cui i poeti Samuel Taylor Coleridge e Robert Southey. Scoprì così che l’ossido di diazoto attenua considerevolmente la sensazione del dolore, anche quando chi lo assume è ancora semi-cosciente. Fu così che entrò nell’uso medico come anestetico, specialmente presso i dentisti che avevano difficoltà ad avvalersi dell’opera di un medico anestesista e che trovavano conveniente che il loro paziente rimanesse sufficientemente sveglio da poter interpretare eventuali comandi verbali. Per molti anni l’ossido nitrico (monossido di azoto, formula chimica NO), un radicale libero dalla breve emivita, è stato essenzialmente considerato un pericoloso inquinante ambientale, presente nello smog fotochimico e nel fumo di sigaretta. Dalla fine degli anni ’70 è apparsa però chiara l’importanza dell’ossido nitrico in molte funzioni biologiche del nostro organismo; in particolare, a livello dell’apparato respiratorio NO agisce, a basse concentrazioni, come mediatore in una serie di risposte fisiologiche importanti per lo sviluppo del polmone (dilatazione del muscolo liscio, protezione verso stimoli bronco-costrittori, motilità ciliare), e come neurotrasmettitore del sistema nervoso inibitorio non adrenergico-non colinergico; ad alte concentrazioni svolge invece un ruolo come mediatore dell’infiammazione e nei meccanismi citotossici/citostatici di difesa verso agenti patogeni e cellule tumorali. L’utilizzo di analizzatori a chemiluminescenza ha consentito negli anni ’80 a diversi ricercatori di studiare l’ossido nitrico nell’aria esalata di animali ed umani, e questo ha portato, all’inizio degli anni ’90, a scoprire concentrazioni più elevate di NO nell’aria esalata dei pazienti asmatici, aprendo una nuova era nella Medicina Respiratoria
OSSIDO NITRICO NASALE
Le concentrazioni di monossido di azoto esalate e misurate a livello nasale (NO nasale) risultano le più elevate dell’albero tracheobronchiale e i seni paranasali sono stati identificati come fonte principale della molecola nei soggetti normali, suggerendo l’ipotesi che le cNOS nell’epitelio dei seni paranasali ed, in misura minore, nell’epitelio nasale, contribuiscano grandemente alla formazione di NO. Il NO nasale sembra avere diversi ruoli fisiologici a livello della mucosa naso-sinusale essendo implicato nei meccanismi di difesa antibatterici e modulando la frequenza del battito ciliare dell’epitelio respiratorio.
Così come il NO espirato è un buon marker dell’infiammazione bronchiale, il NO nasale sembra essere un buon marker dell’infiammazione naso-sinusale, dal momento che il suo dosaggio è particolarmente elevato nella rinite allergica e nella rinite non allergica con eosinofilia (NARES), soprattutto nelle forme non caratterizzate da ostruzione importante (dove invece i valori si riducono sensibilmente). In un recente lavoro condotto in bambini con rinite allergica, Wang e colleghi hanno dimostrato come la concentrazione di ossido nitrico a livello nasale correli con la severità della malattia e con la qualità di vita del paziente affetto da rinite allergica. Non sorprendentemente, una riduzione dei valori di NO nasale dopo terapia si associa a miglioramento dei sintomi e della qualità di vita.
|
|
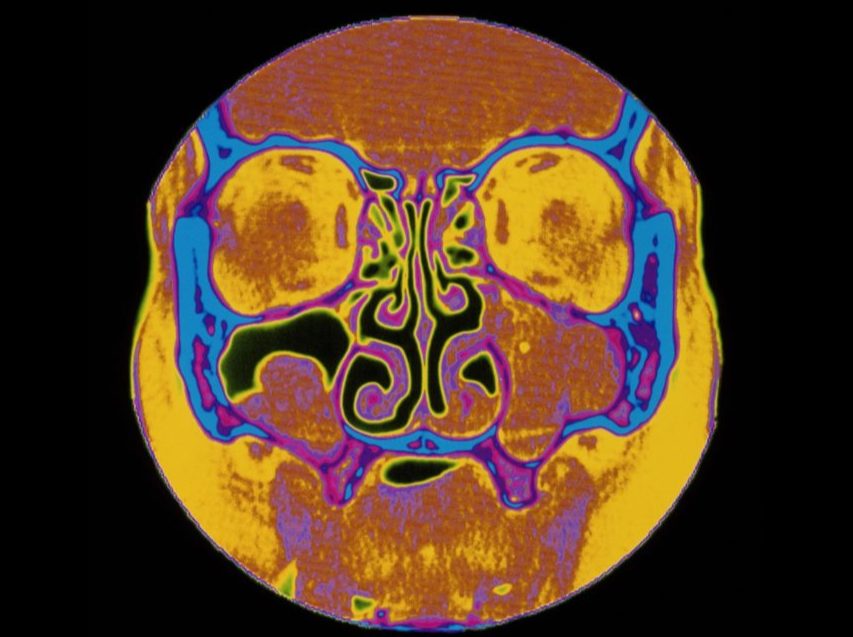
Al contrario, il NO nasale è diminuito nella rinosinusite, in particolare nella forma cronica iperplastica, nella poliposi naso-sinusali non operata e bassissimo nelle discinesie ciliari congenite(sindrome di Kartagener) e nella mucoviscidosi ,la riduzione dei valori è un segno di ridotta pervietà del complesso osteo-meatale, vedi immagine Fig. 3). Inversamente, dei valori elevati suggeriscono la presenza di un’infiammazione nasale con pervietà ostiomeatale [43]. Inoltre, l’ossido nitrico si forma anche nella mucosa nasale da NOS inducibile (iNOS) in risposta all’infiammazione. Il NO e i suoi metaboliti sono tossici per i microrganismi e probabilmente fanno parte del meccanismo di difesa innato delle vie respiratorie. Il NO può anche stimolare la frequenza di battimento delle ciglia all’interno dell’epitelio e regolare il tono vascolare nasale.
Nella rinosinusite/poliposi nasale, la concentrazione di NO nasale si modifica significativamente con il trattamento anti infiammatorio, e quindi il suo monitoraggio rappresenta un mezzo semplice e non invasivo per valutare nel tempo l’efficacia della terapia e l’eventuale necessità di un approccio chirurgico nei casi non responsivi.
A parte questi dati attualmente ammessi nella letteratura internazionale, il dosaggio del NO nasale resta una tecnica di esplorazione funzionale nasale in corso di valutazione sia dal punto di vista teorico che metodologico. La causa esatta della sua produzione nonché il suo ruolo fisiologico e fisiopatologico non sono ancora conosciuti e richiedono quindi la realizzazione di ulteriori studi. La metodologia del dosaggio del NO nasale si fonda sulle linee guida pubblicate dall’American Thoracic Society ma non esiste per il momento una metodica standardizzata.
Tecnica di misurazione
Il calcolo del NO nasale riflette una concentrazione espressa in partiper miliardi (ppb) equivalente ai nanolitri per litro (nl/l). Dipende dal rapporto seguente:Flusso di NO nl/min= concentrazione di NO nl/1 × flusso d’aria l/min
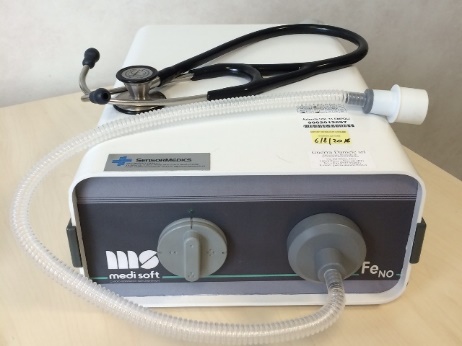
La tecnica consiste nel misurare il flusso di NO nell’aria raccolto dopo il suo passaggio successivo nelle due fosse nasali
 |
 |
Cavo rinofaringeo ostruito da apnea o espirazione orale contro 10cmH2O.
Per fare questo, un captatore è posizionato all’ingresso di una fossa nasale, con l’aiuto di un inalatore adattato monouso, il più delle volte in schiuma, collegato a sua volta all’analizzatore che aspira a flusso noto l’aria della fossa nasale. Il paziente realizza un’apnea o esegue una manovra espiratoria orale forzata contro una resistenza di 10 cmH2O. Queste misure mirano a chiudere il velo palatino per evitare una contaminazione della misurazione del NO nasale da parte del NO orofaringeo ma soprattutto bronchiale, di valore molto più basso. La concentrazione misurata con l’analizzatore nelcaptatore riflette dunque il valore di concentrazione di NO dell’aria ambiente che si è arricchita di gas circolando successivamente nelle due fosse nasali (misura binasale).
Il valore del flusso in aspirazione dell’aria all’ingresso della fossa nasale si deve situare tra 1 e 5 l/min secondo le raccomandazioni dell’ATS.
I valori normali ritrovati in letteratura sono: torace inferiore a 0,02 mg/kg, naso 0,4-0,9 mg/kg e seno 20-25 mg/kg (valori raccolti con l’ausilio di un analizzatore LR 2000 Logan Sinclair e che possono variare con i differenti apparecchi). In patologia, dei valori inferiori a 0,1 mg/kg nelle vie aeree superiori e a 0,01 mg/kg nelle vie aeree inferiori danno elevati sospetti di discinesia ciliare primitiva [19].
Valori soglia FeNO definiti dalle Linee Guida ATS (American Thoracic Society)
La misurazione dell’Ossido Nitrico nasale può essere effettuata fin dai primi anni di vita (vedi immagine sottostante) ed in età pediatrica i valori risultano bassi nelle rino-sinusiti (soprattutto associate ad ipertrofia adenoidea), Ciò ha suggerito il coinvolgimento dell’ossido nitrico nelle infiammazioni ricorrenti nasofaringee a causa d’ipertrofia adenoidea, ma particolarmente bassi nelle discinesie ciliari primitive e nella fibrosi cistica.
 |
 |
Medicina Respiratoria
METABOLISMO DEL MONOSSIDO D’AZOTO
“Il monossido d’azoto (NO) è il principale fattore di regolazione della funzionalità endoteliale ed è stato il primo fattore di cui si è studiato il ruolo nella regolazione del tono vasale. Agli inizi degli anni ‘80 Furchgott e Zawadzki osservarono come l’acetilcolina fosse in grado di indurre rilassamento di preparati di aorta di coniglio, inducendo il rilascio da parte delle cellule endoteliali di una sostanza labile e diffusibile definita inizialmente fattore di rilassamento derivato dall’endotelio (endothelium-derived relaxing factor, EDRF). Questa vasodilatazione avveniva solo in presenza di endotelio integro: se l’endotelio era rimosso, con metodiche meccaniche o enzimatiche, l’acetilcolina non era più in grado di indurre rilassamento e causava vasocostrizione per stimolazione diretta delle cellule muscolari lisce. Successivamente Furchgott e Ignarro identificarono nel monossido d’azoto questo vasodilatatore endogeno responsabile del rilassamento endotelio-dipendente. I prodotti dell’infiammazione e dell’aggregazione piastrinica, come serotonina, istamina, bradichinina, purine e trombina esercitano tutta o parte della loro azione stimolando il rilascio di monossido d’azoto.
L’NO è sintetizzato a partire da L-arginina e ossigeno molecolare per opera dell’enzima nitrossido sintetasi (NOS), che catalizza l’ossidazione dell’azoto contenuto nella L-arginina, producendo NO e citrullina. La NOS è costituita da un omodimero e ciascuna molecola presenta: a) un dominio C-terminale ad azione riducente, contenente i cofattori nicotinammide adenin dinucleotide fosfato (NADPH) e flavin adenin dinucleotide (FAD); b) un dominio N-terminale ad azione ossidante, contenente eme e il cofattire tetraidrobiopterina (BH4); c) un dominio di legame per la Ca-calmodulina (Ca-CAM). Si conoscono almeno tre isoforme di NOS con localizzazione specifica: la nNOS, localizzata prevalentemente nei neuroni del sistema nervoso centrale e periferico e nel muscolo scheletrico; la iNOS, presente in molti tipi cellulari, fra cui cellule muscolari lisce, endotelio e macrofagi; la eNOS, presente nell’endotelio vascolare, nelle piastrine, nei miociti cardiaci e nei neuroni dell’ippocampo. Le isoforme nNOS ed eNOS sono calcio-sensibili, in quanto caratterizzate da un’attività basale modulata dai livelli di calcio intracellulare, mentre la iNOS produce NO in modo calcio indipendente. Nelle cellule, nNOS ed eNOS sono espresse in modo costitutivo, mentre la iNOS, detta appunto “inducibile”, è espressa solamente quando indotta a livello trascrizionale da stimoli specifici come le citochine. Nelle cellule vascolari, la iNOS è espressa in condizioni di infiammazione o infezione e, una volta stimolata, produce elevate quantità di NO. L’endotelio vascolare produce NO grazie sia all’attività di eNOS che di iNOS; è tuttavia da sottolineare che solo la eNOS è responsabile della vasodilatazione NO-mediata.
Grazie alla sua natura di gas e alle sue caratteristiche lipofile, l’NO generato nella cellula endoteliale diffonde facilmente verso la muscolatura liscia sottostante dove innesca un processo di rilassamento vasale. In particolare, NO attiva la guanilato ciclasi che aumenta la concentrazione intracellulare di GMP-ciclico (c-GMP). Il c-GMP attiva la proteina chinasi GMP-ciclico dipendente o PKG che fosforila proteine bersaglio, provocando una diminuzione dei livelli di calcio intracellulare e un conseguente rilassamento della muscolatura liscia “da Samuela Castelnuovo
SIGNIFICATO
Da molti anni è noto che l’asma è una patologia infiammatoria cronica; purtroppo la valutazione funzionale respiratoria (spirometria), l’anamnesi e l’esame clinico non consentono di avere precise informazioni su questo aspetto essenziale della malattia! In particolare, l’asma allergico e un importante “fenotipo” non allergico di asma ad insorgenza in età adulta sono caratterizzati da una infiammazione TH2/eosinofila delle vie aeree: FeNO rappresenta un importante biomarcatore di tale infiammazione. Le informazioni fornite dalla misurazione dell’ossido nitrico (NO) nell’aria espirata sono da ritenere, per la immediata disponibilità dei risultati, complementari a quelle raccolte con la valutazione clinica e con la misura della funzione respiratoria e si sono dimostrate particolarmente utili nella pratica clinica per coadiuvare la spirometria nel formulare la diagnosi di asma bronchiale e nell’identificare la tosse come equivalente asmatico o come espressione di bronchite eosinofila. La misurazione dell’ossido nitrico appare però assai importante nel monitoraggio dell’asma è essenziale per decidere una terapia “anti infiammatoria” e per monitorarne l’efficacia in successivi controlli. Infatti, la presenza di elevati valori di FeNO indica una assai probabile risposta positiva ad una terapia con cortisonici (inalatori e/o sistemici), mentre valori nella norma suggeriscono l’opportunità di non intraprendere o aumentare una terapia potenzialmente “a rischio” per effetti collaterali. Offrendo, quindi, la possibilità di personalizzare il dosaggio degli steroidi inalatori nel trattamento dell’asma, la misurazione dell’NO consente di modulare la terapia a seconda della severità dell’infiammazione con effetti positivi per il paziente, comprendenti una significativa riduzione delle esacerbazioni. Inoltre, poiché la concentrazione di NO nell’aria espirata dei soggetti asmatici diminuisce significativamente con il trattamento antiinfiammatorio, il suo impiego clinico costituisce un mezzo semplice e non invasivo per valutare nel tempo l’aderenza alla terapia e la sua efficacia. L’utilizzo di questa metodica non invasiva è stato “caldamente” raccomandato dalle linee-guida NICE per l’asma (aprile 2014) e valori elevati di FeNO sono considerati un fattore di rischio per riacutizzazioni asmatiche in pazienti adulti allergici (GINA 2018).
OSSIDO NITRICO ALVEOLARE
Negli ultimi anni la tecnologia ha consentito di poter differenziare, nel valore finale di NO esalato (eNO), la quota “bronchiale” (J’awNO) da quella “alveolare/periferica” (CalvNO); risulta quindi possibile, con 3-4 semplici espirazioni di pochi secondi, valutare l’infiammazione delle piccole vie aeree, più subdola, e decisamente meno responsiva agli spray “tradizionali”. Non sorprendentemente, negli ultimi anni è stata più volte evidenziata una correlazione tra elevati valori di NO alveolare ed uno scarso controllo dell’asma/frequenti riacutizzazioni.
La curva ROC è uno strumento fondamentale per la valutazione di un test diagnostico. Ogni punto sulla curva ROC rappresenta una coppia sensibilità / specificità corrispondente ad una particolare soglia di decisione. L’area sotto la curva ROC (AUC) è una misura di quanto bene un test può distinguere tra due gruppi diagnostici (malati /sani). Un test che discrimina perfettamente ha una curva ROC con 100% di sensibilità e di specificità, ed un AUC del 100%.
 |
  |
Nello studio, l’area sotto la curva ROC era pari a 0,822 ed il punto di cut-off ottimale era 22,5 ppb (con sensibilità del 90% e specificità del 62,5%).
In conclusione, la misurazione del FeNO sembra essere uno strumento potenzialmente diagnostico per la differenziazione tra BE ed asma e BE soltanto. Tuttavia, ulteriori studi prospettici su più ampi campioni devono essere eseguiti per espandere le applicazioni cliniche di misura FeNO.
Colantonio D., Brouillette L., Parikh A., Scadding G.K. Paradoxical low nasal nitric oxide in nasal polyposis Clin Exp Allergy 2002 ; 32 : 698-701 [cross-ref]
Ragab S.M., Lund V.J., Scadding G. Evaluation of the medical and surgical treatment of chronic rhinosinusitis: a prospective, randomised, controlled trial Laryngoscope 2004 ; 114 : 923-930 [cross-ref]
Delclaux C., Malinvaud D., Chevalier-Bidaud B., Callens E., Mahut B., Bonfils P. Nitric oxide evaluation in upper and lower respiratory tracts in nasal polyposis Clin Exp Allergy 2008 ; 38 : 1140-1147 [cross-ref]
Torretta S et al. Nasal nitric oxide in children with adenoidal hypertrophy: a preliminary study. Int J Pediatr Otorhinolaryngol. 2010 Jun;74(6):689-93.
1^scheda dell’ossido di diazoto su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
2^(EN) Thermopedia, “Nitrous oxide”
3^Subjective Effects of Nitrous Oxide. William James., Emory University. URL consultato il 1º ottobre 2010.
4^Stefano Canali, Allucinogeni e intuizione mistica. William James e il caso del gas esilarante – PSICOATTIVO, in PSICOATTIVO, 14 agosto 2017. URL consultato il 14 agosto 2017.
5^Laughing Gas, The Internet Movie Database. URL consultato il 1º ottobre 2010.
6^Xavier Seuba, A human rights approach to the WHO Model List of Essential Medicines, in Bulletin of the World Health Organization, vol. 84, n. 5, 1º maggio 2006, pp. 405–411, DOI:2471/blt.04.019133. URL consultato il 21 novembre 2018.
7^Sneader, Walter., Drug discovery : a history, Wiley, 2005, ISBN 0471899798, OCLC 57682419. URL consultato il 21 novembre 2018.
8^Miller AH (1941). “Technical Development of Gas Anesthesia”. Anesthesiology Journal. 2 (4): 398–409. doi:10.1097/00000542-194107000-00004. Archived from the original on 19 December 2014..
9^Salta a:a b c Stephen J Kaar, Jason Ferris e Jon Waldron, Up: The rise of nitrous oxide abuse. An international survey of contemporary nitrous oxide use, in Journal of Psychopharmacology, vol. 30, n. 4, 24 febbraio 2016, pp. 395–401, DOI:1177/0269881116632375. URL consultato il 21 novembre 2018.
10^ Jan van Amsterdam, Ton Nabben e Wim van den Brink, Recreational nitrous oxide use: Prevalence and risks, in Regulatory Toxicology and Pharmacology, vol. 73, n. 3, 2015-12, pp. 790–796, DOI:10.1016/j.yrtph.2015.10.017. URL consultato il 21 novembre 2018.
11^ psychonautwiki.org, https://psychonautwiki.org/wiki/Nitrous_oxide.
12^ Salta a:a b Jay, Mike. “Nitrous oxide: recreational use, regulation and harm reduction.” Drugs and Alcohol Today 8.3 (2008): 22-25..
13^ Abraini JH, David HN, Lemaire M; David; Lemaire (2005). “Potentially neuroprotective and therapeutic properties of nitrous oxide and xenon”. Annals of the New York Academy of Sciences. 1053 (1): 289–300. Bibcode:2005NYASA1053..289A. doi:10.1196/annals.1344.025. PMID 16179534..
14^ Richardson PG., Peripheral neuropathy following nitrous oxide abuse., in Emerg Med Australas., vol. 22, n. 1, 2007, pp. 88-90, PMID 20152009.
15^ Huang MY, Tsai W, Chang WH., Nitrous oxide-induced polyneuropathy in a teenager., in Emerg Med J., vol. 26, n. 3, 2009, p. 186, DOI:10.1093/bja/aem280, PMID 17951609.
16^ Renard D, Dutray A, Remy A, Castelnovo G, Labauge P., Subacute combined degeneration of the spinal cord caused by nitrous oxide anaesthesia., in Neurol Sci., vol. 30, n. 1, 2009, pp. 75-6, PMID 19169627.
17^ Krajewski W, Kucharska M, Pilacik B, Fobker M, Stetkiewicz J, Nofer JR, Wronska-Nofer T., Impaired vitamin B12 metabolic status in healthcare workers occupationally exposed to nitrous oxide., in Br J Anaesth., vol. 99, n. 6, 2007, pp. 812-8, DOI:10.1093/bja/aem280, PMID 17951609.
18^ Jameson M, Roberts S, Anderson NE, Thompson P., Nitrous oxide-induced vitamin B(12) deficiency., in J Clin Neurosci., vol. 6, n. 2, 1999, pp. 164-6, PMID 18639144.
19^ Scott A. Wagner, Michael A. Clark e David L. Wesche, Asphyxial Deaths from the Recreational Use of Nitrous Oxide, in Journal of Forensic Sciences, vol. 37, n. 4, 1º luglio 1992, pp. 13286J, DOI:10.1520/jfs13286j. URL consultato il 21 novembre 2018.
20^ justsayn2o.com, http://justsayn2o.com/nitrous.deaths.html.
22^ Motori truccati, adrenalina e scommesse le notti pericolose delle corse clandestine – Repubblica.it » Ricerca
23^ A. F. Holleman, Wiberg, E., Inorganic Chemistry, San Diego, Academic Press, 2001, ISBN 0-12-352651-5.
24^ Nitrous oxide plant, Sanghi Organization (archiviato dall’url originale il 27 novembre 2013).