(Martini Prosser Audiologia e Foniatria Ed Omega 2011 pag 1-2)
Definizione. Si tratta di un’ipoacusia neurosensoriale insorta od aggravata a seguito dell’insorgenza di alcune condizioni patologiche, piuttosto che all’esposizione ad alcuni fattori ambientali.
Fra le possibili cause, oltre ai farmaci ototossici ed al rumore. di cui si è già parlato, occorre annoverare il diabete mellito, le patologie cardiovascolari, la dieta, l’esposizione a prodotti chimici, l’abuso di alcool e fumo di sigaretta.
Diabete Mellito. L’associazione tra diabete mellito ed ipoacusia è ancora controversa in letteratura, anche se alcuni studi sembrano dimostrare che il diabete possa, interferendo con il microcircolo. aggravare alcune forme di ipoacusia neurosensoriale, Tali Autori riportano che la perdita uditiva neurosensoriale è più comune e più marcata nei pazienti diabetici rispetto ai loro pari età di controllo.
In particolare da studi effettuati su ossa temporali, è stato possibile osservare nei soggetti affetti da diabete mellito rispetto ai controlli, un più evidente ispessimento dell’endotelio a livello della stria vascolare, un’atrofia a carico dei neuroni del ganglio spirale. ed aree di demielinizzazione a carico dell’VIII° NC.
Correlando i dati ottenuti con l’audiometria tonale liminare, diversi Autori hanno cercato di individuare il rapporto tra ipoacusia neurosensoriale e diabete mellito, tuttavia le conclusioni ditali lavori risultano ancora controverse, dal momento che la maggior parte di questi è stato effettuato su piccole popolazioni (scarsa significatività statistica).
Invece, i parametri elettrofisiologici dell’ABR più significativamente alterati nei pazienti diabetici insulino-dipendenti, secondo altri studi condotti da altri Autori, sarebbero la latenza dell’onda V. l’intervallo I-V ed in alcuni casi l’intervallo 1-111. Tali dati indicherebbero uno stato di sofferenza delle vie uditive del tronco encefalo e sarebbero presenti fino anche al 28%o dei soggetti diabetici (Fig. 1).
Malattie cardiovascolari e dislipidemie. E noto che l’orecchio interno è particolarmente vulnerabile all’ipossia. Episodi ischemici locali possono essere causa di danni irreversibili sia a livello centrale che periferico del sistema uditivo.
In particolare, uno stato duraturo di ipossia cocleare, ad esempio indotto da difetti di circolazione locale, può causare un accumulo di mutazioni mitocondrialilmetaboliche a carico delle cellule ciliate direttamente, o indirettamente, per danno della stria vascolare. cui consegue una diminuzione del potenziale elettrico endococleare.
Inoltre, nei soggetti affetti da disturbi dell’assetto lipidico, il rischio di incidenti vascolari di origine aterosclerotica è aumentato. compresa la possibilità di ischernie del distretto vertebro-basilare In particolare, secondo alcuni Autori, l’iperlipidemia correla significativamente con un incremento degli intervalli I-III e I-V nei tracciati ABR.
Esposizione a prodotti chimici. I solventi organici per le loro specifiche caratteristiche chimiche e fisiche presentano una notevole affinità per il tessuto nervoso. La tossicità sul sistema nervoso centrale e periferico dei solventi organici è uniformemente accettata ed i dati al riguardo sono abbastanza concordi.
E stato dimostrato che in lavoratori esposti a solventi come toluene, tricloroetilene. xilene e stirene esiste una probabilità più elevata di sviluppo di ipoacusia neurosensoriale per le alte frequenze. rispetto ai soggetti non esposti. Inoltre i tracciati AER si caratterizzano per un incremento dei valori di latenza delle onde I, III,V, ed un aumento degli intervalli interpicco I-V e III-V
Fig. 1.
Abuso di alcool, fumo di sigaretta e dieta. Nel corso di intossicazione acuta da etanolo, indotta sperimentalmente nelle cavie e nel gatto. sono state riscontrate alle valutazioni uditive elettrofisiologiche. variazioni significative dei valori assoluti di latenza delle onde IL III. IV V. mentre i valori di latenza dell’onda I sono risultati più stabili. Tali alterazioni sono state attribuite da alcuni Autori all’ipotermia cerebrale indotta dall’elevata alcolemia,
Al di là dell’effetto acuto, l’alcool può determinare un danno a livello del tronco encefalo per abuso cronico. Nel corso di etilismo cronico, vi è una maggiore compromissione delle condizioni generali del soggetto. con un coinvolgimento polifunzionale dell’organismo. fl sistema nervoso è frequentemente colpito da neuropatia periferica e centrale (es. mielinosi del ponte. encefalopatia di Wernicke). la cui patogenesi può essere attribuita ad un danno diretto o a deficit tossico-nutrizionali alcool relati, Infatti, alcuni studi in letteratura, riportano che i forti bevitori sono a rischio per lo sviluppo di ipoacusia neurosensoriale (es presbiacusia) più severa rispetto ai controlli: inoltre, in circa il 40% dei soggetti sono stati riscontrati disturbi della velocità di conduzione centrale dello stimolo acustico all’ABR.
L’effetto del fumo di sigaretta è ancora controverso Proprio recentemente, alcuni Autori hanno osservato che il fumo aumenta il rischio di sviluppare forme più severe di presbiacusia con il tempo e che tale effetto sarebbe “dose-dipendente”. più accentuato quindi nei forti fumatori, Anche un elevato indice di massa corporea sarebbe da correlarsi, secondo alcuni studi. ad un a maggiore probabilità di sviluppare forme più severe di presbiacusia.
In conclusione, uno stile di vita sano sarebbe in grado di “proteggere” contro lo sviluppo di ipoacusia neurosensoriale (V presbiacusia.
APPROFONDIMENTO
IPOACUSIA ASSOCIATA A PATOLOGIE EXTRA-AURICOLARI
Definizione. Si tratta di un’ipoacusia neurosensoriale insorta od aggravata a seguito dell’insorgenza di alcune condizioni patologiche, piuttosto che all’esposizione ad alcuni fattori ambientali.
Fra le possibili cause, oltre ai farmaci ototossici ed al rumore. di cui si è già parlato, occorre annoverare il diabete mellito, le patologie cardiovascolari, la dieta, l’esposizione a prodotti chimici, l’abuso di alcool e fumo di sigaretta.
DIABETE MELLITO. Il diabete mellito è risultato significativamente associato con un aumentato rischio di sviluppare improvvisa perdita dell’udito neurosensoriale (SSHL sudden sensorineural hearing loss), La comorbidità della malattia coronarica o retinopatia nei pazienti diabetici sembrano essere associati ad un aumentato rischio di sviluppare SSHL. Il rischio di sviluppare SSHL aumentata con la gravità del diabete. L’associazione tra diabete mellito ed ipoacusia è ancora controversa in letteratura, anche se alcuni studi sembrano dimostrare che il diabete possa, interferendo con il microcircolo. aggravare alcune forme di ipoacusia neurosensoriale, Tali Autori riportano che la perdita uditiva neurosensoriale è più comune e più marcata nei pazienti diabetici rispetto ai loro pari età di controllo,
In particolare da studi effettuati su ossa temporali, è stato possibile osservare nei soggetti affetti da diabete mellito rispetto ai controlli, un più evidente ispessimento dell’endotelio a livello della stria vascolare, un’atrofia a carico dei neuroni del ganglio spirale. ed aree di demielinizzazione a carico dell’Vili NC.
 Correlando i dati ottenuti con l’audiometria tonale liminare, diversi Autori hanno cercato di individuare il rapporto tra ipoacusia neurosensoriale e diabete mellito, tuttavia le conclusioni ditali lavori risultano ancora controverse, dal momento che la maggior parte di questi è stato effettuato su piccole popolazioni (scarsa significatività statistica).
Correlando i dati ottenuti con l’audiometria tonale liminare, diversi Autori hanno cercato di individuare il rapporto tra ipoacusia neurosensoriale e diabete mellito, tuttavia le conclusioni ditali lavori risultano ancora controverse, dal momento che la maggior parte di questi è stato effettuato su piccole popolazioni (scarsa significatività statistica).
Figura 1. audiogramma a toni puri – e potenziale evocato uditivo del tronco encefalico la registrazione di un soggetto di controllo udito normale (A), un paziente diabetico con udito normale (B), e un paziente diabetico con ipoacusia neurosensoriale (C).
Invece, i parametri elettrofisiologici dell’ABR più significativamente alterati nei pazienti diabetici insulino-dipendenti, secondo altri studi condotti da altri Autori, sarebbero la latenza dell’onda V. l’intervallo I-V ed in alcuni casi l’intervallo I-III. Tali dati indicherebbero uno stato di sofferenza delle vie uditive del tronco encefalo e sarebbero presenti fimo anche nel 28°/o dei soggetti diabetici (Fig. 1). La neuropatia autonomica cardiovascolare è una complicanza frequente del Diabete Mellito. Tuttavia, le anomalie dell’ABR puntano verso la presenza di una neuropatia del nervo acustico. I parametri della neuropatia autonomica, di conseguenza peggiorano insieme a diverse anomalie della funzione del tronco cerebrale. I nostri dati supportano l’ipotesi che la neuropatia diabetica può essere rivelato come causa di alcune disfunzioni della periferia e delle vie uditive centrali Tóth F. ed Al.,2003;.,
REFERENCES
Clements RS, Bell DSH. Diagnostic, pathogenetic and therapeutic aspects of diabetic neuropathy. Spect Top Endocrinol Metab 3:1-43, 1983.
Donald MW, Bird CE, Lawson JS, et al. Delayed auditory brainstem responses in diabetes mellitus. J Neurol Neurosurg Psychiatry 44:641-644, 1981.
Ewing DJ, Campbelll W, Clarke BF. Vascular reflexes in diabetic autonomic neuropathy. Lancet 2:1354-1356, 1976.
Fedele 0, Martini A, Cardone C, et al. Impaired auditory brain stem-evoked responses in insulin-dependent diabetic subjects. Diabetes 33:1085-1089, 1984.
Khardori R, Soler NG, Good DC, et al. Brainstem auditory and visual-evoked potentials in type I (insulin-dependent) diabetic patients. Diabetologia 29:362-365, 1986.
Kondo J, Tachibana H, lnuzumi K, et al. Involvement of central nervous system in patients with diabetes mellitus detected by evoked potentials. Rinsho-Byori 38:457-462, 1990.
Lin SW , Lin YS , Weng SF , Chou CW .Risk of developing sudden sensorineural hearing loss in diabetic patients: a population-based cohort study. Otol Neurotol. 2012 Dec;33(9):1482-8.
Martini A, Fedele 0, Comacchio F, et al. Auditory brain-stem-evoked responses in clinical evaluation of diabetic encephalopathy. In C Morocutti, PA Rizzo (eds), Evoked Potentials. Neurophysiological and Clinical Aspects. Amsterdam: Elsevier Science, 1985:231-235.
Martini A, Comacchio F, Fedele D, et al. Auditory brainstem evoked responses in the clinical evaluation and follow-up of insulin-dependent diabetic subjects. Acta Otolaryngol (Stockh) 103:620-627, 1987.
Parving A, Elberling C, Balle V, et al. Hearing disorders in insulin-dependent diabetes mellitus. Audiology 29:113-121,1990.
Tóth F, Varkonyi TT, Rovo L, Lengye C, Legrady P, Jori J, Czigner J, et al. Indagine su Auditory funzione del tronco cerebrale in pazienti diabetici. Int acufene J. 2003; 9 (2) :84-8610.
Várkonyi TT, Tóth F, Rovó L, et al. Impairment of auditory brainstem function in diabetic neuropathy. Diabetes Care 25(3):631-632, 2002.
APPROFONDIMENTO
Diabete di tipo 2 e perdita uditiva (Joann Jovinelly)
·  Dopo anni di tentativi e non riuscendo a trovare una relazione netta tra diabete di tipo 2 e perdita di udito, studi recenti hanno confermato che il rapporto. Nel 2008, il National Institute of Health (NIH) ha rilevato che la perdita dell’udito è due volte più comune nelle persone che sono diabetici
Dopo anni di tentativi e non riuscendo a trovare una relazione netta tra diabete di tipo 2 e perdita di udito, studi recenti hanno confermato che il rapporto. Nel 2008, il National Institute of Health (NIH) ha rilevato che la perdita dell’udito è due volte più comune nelle persone che sono diabetici
· In realtà, secondo l’American Diabetes Association (ADA), circa 35 milioni di persone negli Stati Uniti hanno una qualche forma di perdita dell’udito; molti di loro sia diabetico o pre-diabetica (una condizione in cui il glucosio nel sangue è alto, ma non abbastanza da giustificare una diagnosi di diabete). L’ADA continua, “dei 79 milioni di adulti pensato di avere pre-diabete, il tasso di perdita dell’udito è del 30 per cento superiore rispetto a quelli con normale zucchero nel sangue.”
· Nello studio pilota 2008 NIH pubblicato negli Annals of Internal Medicine, i ricercatori hanno analizzato i dati dalle prove di adulti in età lavorativa di età compresa tra 20 e 69 tra dell’udito. Essi hanno concluso che il diabete porta alla perdita dell’udito da danneggiare i nervi e vasi sanguigni, informazioni confermate da studi autoptici. Studi simili hanno confermato che la perdita dell’udito è dovuta a neuropatia (danni ai nervi), e che i diabetici che soffrono di perdita dell’udito sono anche a maggior rischio di altre complicazioni della malattia, come l’ipertensione , retinopatia, neuropatia in altre parti del corpo, e reni malattia.
Cause di perdita dell’udito con il diabete
· In diabetici di tipo 2, la perdita dell’udito è causata da neuropatia. I piccoli sanguigni vasi e nervi che fanno parte dell’orecchio interno riescono a ottenere sangue o di ossigeno sufficiente a causa di hypergylcemia a lungo termine, e che sono stati danneggiati. Nel corso del tempo, che danno porta alla perdita dell’udito evidente. Questo tipo di perdita dell’udito neurosensoriale si chiama.
I sintomi di perdita dell’udito
· La perdita dell’udito può essere così graduale che non si può notare esso. Bambini e adulti possono sperimentare la perdita dell’udito in qualsiasi momento. Non pensare che sei troppo giovane per perdere l’udito. Ponetevi le seguenti domande se si pensa di poter essere a rischio di perdita dell’udito:
Article Sources:
§ Abdulbari Bener. (2008) Association between hearing loss and Type 2 Diabetes Mellitus in elderly people in a newly developed society. Biomedical Research . 19 (3): 187-193. http://www.biomedres.org/journal/pdf/289.pdf
§ American Diabetes Association. (2011) Diabetes and Hearing Loss. Living With Diabetes. http://www.diabetes.org/living-with-diabetes/seniors/hearing-loss/
§ National Institute of Health. (2008) Hearing Loss Is Common in People With Diabetes. NIH News Release.http://www.nih.gov/news/health/jun2008/niddk-16.htm
Diabete e perdita uditiva (Hearing Impairment): una prospettiva epidemiologica
Il diabete mellito è un gruppo di malattie caratterizzate da alterazioni del metabolismo del glucosio, con conseguente livelli di glucosio nel sangue. Il diabete è di solito classificata come di tipo 1 o tipo 2. Nel diabete di tipo 1, le cellule beta del pancreas non fanno più insulina. Nel diabete di tipo 2, il pancreas continua a produrre insulina, ma una insufficienza cellulare in sensibilità ai risultati di insulina nei livelli di glucosio nel sangue sollevate. Il diabete colpisce circa il 10,7% della popolazione adulta degli Stati Uniti, circa il 40% dei quali non diagnosticata (Cowie et al, 2009;. Dipartimento di Salute e Servizi Umani, 2007 US).
 Le persone con diabete hanno esperienza di una serie di gravi complicazioni mediche. La maggior parte degli adulti con diabete ha rischio di malattie cardiovascolari come l’ipertensione e il colesterolo alto ed il rischio di eventi cardiovascolari avversi come l’ictus o un evento cardiaco fatale che è da due a quattro volte superiore tra gli adulti con diabete rispetto a quelli senza diabete. La retinopatia diabetica è la principale causa di cecità negli Stati Uniti. Tra gli americani, il diabete è anche la principale causa di insufficienza renale. Forme gravi di malattia nervosa diabetica sono una delle principali cause di amputazioni degli arti inferiori. Neuropatie autonomiche diabetici possono influenzare cardiovascolare, gastrointestinale, vescica e la funzione erettile. Perché il diabete è una malattia sistemica con patologia che colpisce vari organi, è ragionevole chiedersi se il sistema uditivo è tra gli organi colpiti.
Le persone con diabete hanno esperienza di una serie di gravi complicazioni mediche. La maggior parte degli adulti con diabete ha rischio di malattie cardiovascolari come l’ipertensione e il colesterolo alto ed il rischio di eventi cardiovascolari avversi come l’ictus o un evento cardiaco fatale che è da due a quattro volte superiore tra gli adulti con diabete rispetto a quelli senza diabete. La retinopatia diabetica è la principale causa di cecità negli Stati Uniti. Tra gli americani, il diabete è anche la principale causa di insufficienza renale. Forme gravi di malattia nervosa diabetica sono una delle principali cause di amputazioni degli arti inferiori. Neuropatie autonomiche diabetici possono influenzare cardiovascolare, gastrointestinale, vescica e la funzione erettile. Perché il diabete è una malattia sistemica con patologia che colpisce vari organi, è ragionevole chiedersi se il sistema uditivo è tra gli organi colpiti.
I primi tentativi di stabilire un’associazione tra diabete e danni all’udito non erano molto convincenti. I ricercatori, utilizzando i dati raccolti con gli ispanici (Salute e Nutrition Examination Study), hanno esaminato le soglie per i toni puri per via aerea a 500, 1000, 2000, e 4000 Hz in base allo stato di diabete, ma hanno trovato una soglia più alta tra le persone con diabete solo a una singola frequenza (500 Hz , Ma, Gomez-Marin, Lee, e Balkany, 1998). I ricercatori nello studio di coorte Framingham, uno degli studi epidemiologici più rispettati basati sulla popolazione, la media per i toni puri per via aerea sopra i 250, 500 e 1000 Hz, così come a 4000, 6000, e 8000 Hz nell’orecchio migliore e nell’orecchio peggiore ; hanno definito ipoacusia la media per i toni puri in dB HL > 40 ma non hanno trovato associazione con il diabete (Gates, Cobb, D’Agostino, e Lupo, 1993; Ma et al, 1998.). Solo gli studi epidemiologici di perdita dell’udito , in un’indagine basata sulla comunità condotta in Beaver Dam, nel Wisconsin, ha rilevato un modesto aumento dell’incidenza di danni all’udito tra gli adulti con il diabete rispetto a quelli senza diabete, quando hanno definito impairment come media per i toni puri superiore a> 25 dB HL nell’orecchio peggiore a 500, 1000, 2000 e 4000 Hz (Dalton, Cruickshanks, Klein, Klein, e Wiley, 1998). Sono stati condotti altri studi per identificare un tale nesso in ambienti industriali o militari e non poteva escludere la possibilità che l’effetto del diabete era limitata a individui che sono stati predisposti a perdita di udito a causa di esposizione al rumore sul lavoro (Ishii, Talbott, Findlay, D ‘ Antonio, e Kuller, 1992; Sakuta, Suzuki, Yasuda, e Ito, 2007). Prove contrastanti non ha consentito di ipoacusia correlata al diabete di guadagnare molta attenzione tra gli scienziati di ricerca, né l’accettazione tra i professionisti sanitari.
Costruire evidenze epidemiologiche dipende da una definizione solida di una condizione, in modo che i risultati possano essere confrontati tra gli studi. Per ipoacusia, tuttavia, è stata stabilita una definizione definitiva. Recentemente, utilizzando i dati degli esami audiometrici della salute e nutrizione in uno studio nazionale, i ricercatori hanno valutato la compromissione dell’udito alle alte frequenza (3000 -, 4000 -, 6000 – e 8000 Hz), così come le medie a frequenze medio basse – (500 -, 1000 – e 2000 Hz), a due livelli di gravità (> 25 e> 40 dB HL), sia l’orecchio, migliore e peggiore (Bainbridge, Hoffman, e Cowie, 2008). I risultati hanno dimostrato che la prevalenza di ipoacusia dipende da come la condizione è definita, ma una maggiore prevalenza di ipoacusia è stata osservata tra gli adulti con diabete diagnosticato , a prescindere dalla definizione utilizzata (vedi Figura 1).
Figura 1.
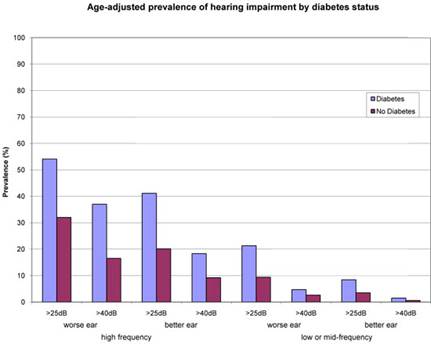
L’analisi ha esaminato il rapporto attraverso una varietà di caratteristiche sociodemografiche. La maggiore prevalenza di ipoacusia tra le persone con diabete si è verificato tra i gruppi di età e livello d’istruzione (vedi Figura 2a) e in entrambi gli uomini e le donne, così come nelle persone che si sono identificati come non-ispanici bianchi o neri non ispanici, e di quelli per i quali la razza o l’etnia informazioni specifiche non era disponibile (vedi Figura 2b).
Figura 2a.

Figura 2b.

La maggiore presenza di ipoacusia non era limitata a quelli che avrebbero potuto essere predisposti alla condizione, come i fumatori, coloro che hanno riportato professionale o esposizione al rumore del tempo libero, o che l’assunzione di farmaci ototossici. Oltre a valutare il diabete diagnosticati, i ricercatori hanno potuto identificare le persone con diabete non diagnosticato dai valori di glicemia a digiuno che erano disponibili per circa la metà dei partecipanti allo studio. Nessuna differenza nella prevalenza è stata osservata tra le persone con diabete diagnosticato rispetto a quelli con diabete non diagnosticato.
 Ulteriori analisi hanno dimostrato un forte legame tra il diabete diagnosticato e la menomazione uditiva nelle persone più giovani rispetto alle persone più anziane. Questa osservazione potrebbe spiegare perché studi precedenti che hanno reclutato gli individui più anziani sono stati in grado di dimostrare una relazione (come è avvenuto per lo studio Framingham) o rivelati solo un’associazione moderata (come nel Epidemiologia della perdita dell’udito Study). Con una varietà di cause concorrenti che si accumulano nel corso della vita contribuendo al deterioramento dell’udito legata all’età, la differenza di prevalenza tra gli adulti con diabete e coloro in cui l’udito non sembra diminuire con l’aumentare dell’età (vedi Figura 2a). Questa idea è supportata quando le soglie medie per i toni puro sono esaminate per gruppi di età. Tra le persone di età 30-39 anni, le soglie medie alle frequenze 3000-8000 Hz sono di 10-16 dB HL maggiori tra le persone con diabete. In ogni successivo gruppo di età di 10 anni, le soglie in entrambi i gruppi aumentano, ma la differenza tra le soglie del gruppo diabetico e quelli del gruppo non diabetico si restringe. Tra quelli tra i 50-59 anni e tra i 60-69 anni, le soglie medie a 3000-8000 Hz sono solo di 4-6 dB HL maggiori per quelli con diabete. Il diabete può essere responsabile di un invecchiamento prematuro dell’orecchio (Bainbridge et al., 2008).
Ulteriori analisi hanno dimostrato un forte legame tra il diabete diagnosticato e la menomazione uditiva nelle persone più giovani rispetto alle persone più anziane. Questa osservazione potrebbe spiegare perché studi precedenti che hanno reclutato gli individui più anziani sono stati in grado di dimostrare una relazione (come è avvenuto per lo studio Framingham) o rivelati solo un’associazione moderata (come nel Epidemiologia della perdita dell’udito Study). Con una varietà di cause concorrenti che si accumulano nel corso della vita contribuendo al deterioramento dell’udito legata all’età, la differenza di prevalenza tra gli adulti con diabete e coloro in cui l’udito non sembra diminuire con l’aumentare dell’età (vedi Figura 2a). Questa idea è supportata quando le soglie medie per i toni puro sono esaminate per gruppi di età. Tra le persone di età 30-39 anni, le soglie medie alle frequenze 3000-8000 Hz sono di 10-16 dB HL maggiori tra le persone con diabete. In ogni successivo gruppo di età di 10 anni, le soglie in entrambi i gruppi aumentano, ma la differenza tra le soglie del gruppo diabetico e quelli del gruppo non diabetico si restringe. Tra quelli tra i 50-59 anni e tra i 60-69 anni, le soglie medie a 3000-8000 Hz sono solo di 4-6 dB HL maggiori per quelli con diabete. Il diabete può essere responsabile di un invecchiamento prematuro dell’orecchio (Bainbridge et al., 2008).
La spiegazione fisiopatologica per la perdita dell’udito legate al diabete è speculativo. Complicanze del diabete, tra cui la retinopatia, nefropatia, e la malattia arteriosa periferica sono principalmente di origine vascolare. Neuropatie diabetiche influenzano la sensazione periferica e varie funzioni autonome. I cambiamenti patologici che accompagnano il diabete possono causare lesioni in modo simile al sistema vascolare od al sistema nervoso dell’orecchio interno. Evidenza istopatologica di coinvolgimento vascolare o di coinvolgimento neurologico ottenuti da pazienti sottoposti ad autopsia con il diabete comprende sclerosi dell’arteria uditiva interna, le pareti dei vasi della stria vascularis e della membrana basilare sono più spessi, è presente demielinizzazione del nervo cocleare ed atrofia del ganglio spirale (Makishima & Tanaka , 1971). Tra i pazienti con diabete è stata anche osservata perdita di cellule cigliate esterne (Fukushima et al., 2006).
L’evidenza epidemiologica che dimostrano una relazione tra diabete e insufficienza dell’udito sta emergendo e deve essere confermati in altri studi. La maggior parte prova viene dalla sezione trasversale analisi in cui l’accertamento del diabete e perdita dell’udito è stato fatto nello stesso punto nel tempo. Studi prospettici volti a verificare se ipoacusia ha un esordio più precoce tra le persone con diabete rispetto tra le persone senza diabete sarebbe stabilire il rapporto temporale e far avanzare la tesi che precede il diabete e sta contribuendo al deficit uditivo.
I dati statunitensi suggeriscono che tra le persone con diabete di età compresa tra 50 e 69 anni tra, hanno più del 70% di deficit uditivo alle alte frequenze e un terzo hanno deficit uditivo a frequenza bassa o media. I dati suggeriscono inoltre che le persone con diabete possono sperimentare la perdita dell’udito in età precoce. Gli Audiologi vedendo pazienti di mezza età con perdita dell’udito inspiegabile dovrebbero informarsi sul eventuale diabete e sulla storia familiare di diabete. I pazienti con diabete dovrebbero essere incoraggiati nei loro sforzi per mantenere un buon controllo della glicemia in conformità con le linee guida della American Diabetes Association (2010). I pazienti che non hanno il diabete, ma che hanno un genitore o un fratello con il diabete dovrebbero essere informati che sono ad aumentato rischio di diabete e possono beneficiare di regolari test del glucosio nel sangue.
References
American Diabetes Association. (2010). Standards of medical care in diabetes—2010. Diabetes Care , 33 (Suppl. 1), S11–S61.
Bainbridge, K., Hoffman, H., & Cowie, C. (2008). Diabetes and hearing impairment in the United States: Audiometric evidence from the National Health and Nutrition Examination Survey, 1999 to 2004. Annals of Internal Med icine , 149, 1–10.
Cowie, C., Rust, K., Ford, E., Eberhardt, M., Byrd-Holt, D, Li, C., … Geiss, L. (2009). Full accounting of diabetes and pre-diabetes in the US population in 1988–1994 and 2005–2006. Diabetes Care, 32, 287–294.
Dalton, D., Cruickshanks, K., Klein, R., Klein, B., & Wiley, T. (1998). Association of NIDDM and hearing loss. Diabetes Care, 21, 1540–1544.
Fukushima, H., Cureoglu, S., Schachern, P., Paparella, M., Harada, T., & Oktay, M. (2006). Effects of type 2 diabetes mellitus on cochlear structure in humans. Archives of Otolaryngology—Head & Neck Surgery, 132, 934–938.
Gates, G., Cobb, J., D’Agostino, R., & Wolf, P. (1993). The relation of hearing in the elderly to the presence of cardiovascular disease and cardiovascular risk factors. Archives of Otolaryngology—Head & Neck Surgery, 119, 156–161.
Ishii, E., Talbott, E., Findlay, R., D’Antonio, J., & Kuller, L. (1992). Is NIDDM a risk factor for noise-induced hearing loss in an occupationally noise exposed cohort? Science of the Total Environment, 127, 155–165.
Ma, F., Gomez-Marin, O., Lee, D., & Balkany, T. (1998). Diabetes and hearing impairment in Mexican American adults: A population-based study. The Journal of Laryngology and Otology, 112, 835–839.
Makishima, K., & Tanaka, K. (1971). Pathological changes of the inner ear and central auditory pathway in diabetics. Annals of Otology, Rhinology & Laryngology, 80, 218–228.
Sakuta, H., Suzuki, T., Yasuda, H., & Ito, T. (2007). Type 2 diabetes and hearing loss in personnel of the Self-Defense Forces. Diabetes Research and Clinical Practice, 75, 229–234.
US Department of Health and Human Services, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases. (2007). National diabetes statistics, 2007. Retrieved from http://diabetes.niddk.nih.gov/dm/pubs/statistics/index.htm .
Diabete Ereditato Per Via Materna e Sordità
Spesso abbreviato in (MIDD) Maternally Inherited Diabetes and Deafness
Su questa pagina:
· Eredità
· Diagnosi
Che cosa è il MIDD?
Il Diabete Ereditato Per Via Materna e Sordità (MIDD) è causata da una mutazione nel DNA mitocondriale (3243 tRNA)ed è una forma di diabete che è spesso accompagnata da perdita dell’udito, soprattutto dei toni alti. Il diabete in MIDD è caratterizzata da livelli elevati di zucchero nel sangue (iperglicemia) derivanti da una carenza di insulina, l’ormone che regola la quantità di zucchero nel sangue. Nel diabete MIDD, la perdita uditiva di solito si presenta prima dei 40 anni La perdita dell’udito è variabile, ma può richiedere un apparecchio. E’ causata di un difetto nella funzione delle cellule beta con normale sensibilità all’insulina, anche se si può verificare dall’infanzia sino alla tarda età . Tipicamente, la perdita dell’udito si verifica prima del diabete.
Alcune persone con MIDD sviluppano una malattia dell’occhio chiamata distrofia maculare della retina, che è caratterizzata da macchie colorate nel tessuto sensibile alla luce che riveste la parte posteriore dell’occhio (retina). Questo disturbo di solito non causano problemi di visione nelle persone con MIDD. Gli individui con MIDD possono anche sperimentare crampi muscolari o debolezza, in particolare durante l’esercizio; problemi di cuore; malattie renali; e costipazione. Gli individui con MIDD sono spesso più brevi rispetto ai loro coetanei.
Ereditarietà materna diabete e sordità (MIDD)
La chiave che identifica le caratteristiche del diabete maternamente ereditati e sordità (MIDD), come suggerisce il nome, sono la presenza di diabete e / o la sordità che vengono ereditate dai bambini di una madre colpita ma non dai figli di un padre colpito
Ereditarietà materna diabete e sordità (MIDD) è causata da un cambiamento o mutazione nel DNA mitocondriale (il cambiamento più comune è conosciuto come 3243 A> G) ed è stato identificato per la prima nel 1992. Come tutti i mitocondri che INH erit vengono ereditate dalle nostre madri T E cambiamento genetico è tramandata da una madre colpita A tutti i suoi figli.  Tuttavia, con questi cambiamenti genetici particolari è molto variabile in quanto le persone che ereditano queste cambiano s sono  colpite .Questo significa che alcuni bambini avranno solo la sordità o solo hanno il diabete o possono avere problemi a all. Ai Padri che hanno MIDD può essere rassicurato che non trasmetteranno la malattia ai loro figli in quanto tutti i mitocondri vengono ereditati dal madre. Ciò significa che, anche se i bambini di entrambi i sessi erediteranno i mitocondri solo le donne colpite passeranno la condizione alla prossima generazione.
E ‘importante fare una diagnosi genetica definita di MIDD come th aiuta è diag n ose la causa della sordità e diabete, aiuta con il trattamento, guide che ulteriori test sono consigliati e aiuta consigli gli altri membri della famiglia.
Perché i mitocondri sono importanti?
Lo scopo principale è di mitocondri per produrre energia all’interno delle cellule producendo una sostanza chiamata ATP questo permette alla cellula di svolgere le loro funzioni correttamente. MIDD tende ad interessare gli organi dove le cellule sono più attivi come il pancreas e la coclea (nell’orecchio) e in alcuni casi la retina (parte posteriore dell’occhio), i muscoli, reni e cervello.
la MIDD colpisce fino al 1% di tutti i diabetici, ma spesso non viene riconosciuto ed è MISD io di natura incerta sia come tipo 1 o diabete di tipo 2 r. L’età media in cui si sviluppa il diabete è di 37 anni, ma si va 11 anni a 68 anni di età e spesso ha bisogno di un trattamento con insulina. Quelli con MIDD sono di solito di peso corporeo normale. MIDD conduce al diabete bec aus E riduce la quantità di insulina da parte delle cellule beta s nel pancreas.
La maggior parte delle persone con MIDD può, all’inizio, essere trattata con cambiamenti nella dieta o compresse. Tuttavia la terapia insulinica è di solito necessario entro 2 anni dalla diagnosi che mostra una ridotta secrezione di insulina. Probabilmente è meglio evitare la metformina, che è un trattamento comunemente usato nel diabete ,in quanto è noto che la metformina può interferire con la funzione mitocondriale e può essere aumentato il rischio di acidosi lattica, anche se questo non è stato riportato .
Quali sono i cambiamenti genetici legati alla MIDD?
Le mutazioni nel MT-TL1, MT-TK, o MT-TE gene sono la causa del MIDD. Questi geni sono presenti nel DNA mitocondriale (3243 tRNA), che fa parte di strutture cellulari chiamate mitocondri. Sebbene la maggior parte del DNA è confezionato in cromosomi all’interno del nucleo cellulare, mitocondri hanno anche una piccola quantità di DNA proprio (noto come DNA mitocondriale o mtDNA).
La MT-TL1, MT-TK, ei geni MT-TE forniscono istruzioni per fare molecole chiamate RNA di trasferimento (tRNA), che sono cugini chimiche del DNA. Queste molecole aiutano a montare blocchi di proteine (aminoacidi) in proteine funzionanti.Il geneMT-TL1 fornisce istruzioni per fare una forma specifica di tRNA che viene designato come tRNA Leu (UUR). Durante il montaggio proteina, questa molecola attribuisce alla leucina (Leu) e lo inserisce nelle posizioni appropriate nella proteina crescente. Analogamente, la proteina prodotta dal gene MT-TK, chiamato tRNA Lys, attribuisce alla lisina (Lys) e lo inserisce proteine stati assemblati. Inoltre, la proteina prodotta dal gene MT-TE, chiamato tRNA Glu,attribuisce alla acido glutammico amminoacido (Glu) e lo aggiunge alle proteine crescenti.
Queste molecole di tRNA sono presenti solo nei mitocondri, ed aiutano ad assemblare proteine che sono coinvolte nella produzione di energia per le cellule. In alcune cellule del pancreas chiamate cellule beta, i mitocondri svolgono anche un ruolo nel controllo della quantità di zucchero (glucosio) nel sangue. In risposta ad elevati livelli di glucosio, i mitocondri aiutano a innescare il rilascio di insulina, che stimola le cellule di assorbire il glucosio dal sangue.
Mutazioni nel MT-TL1, MT-TK, o gene MT-TE riducono la capacità di tRNA di aggiungere amminoacidi alle proteine crescenti, che rallenta la produzione di proteine nei mitocondri e danneggia il loro funzionamento.I ricercatori ritengono che l’interruzione della funzione mitocondriale riduce la capacità dei mitocondri di contribuire a innescare il rilascio di insulina.In persone con questa condizione, il diabete risultati quando le cellule beta non producono abbastanza insulina per regolare efficacemente la glicemia. I ricercatori non hanno stabilito come le mutazioni portano alla perdita o le altre caratteristiche di MIDD dell’udito.
Per saperne di più sulla MT-TE , MT-TK , e MT-TL1 geni e del DNA mitocondriale .
Come fanno le persone ad ereditare il MIDD?
MIDD viene ereditata in un modello mitocondriale, che è anche conosciuto come eredità materna. Questo modello di ereditarietà applica ai geni contenuti nel DNA mitocondriale. Poiché le cellule uovo, ma non cellule spermatiche, contribuiscono mitocondri per l’embrione in via di sviluppo, solo le femmine passano condizioni mitocondriali ai loro figli. Malattie mitocondriali possono apparire in ogni generazione di una famiglia e possono colpire sia i maschi e femmine, ma i padri non passare tratti mitocondriali ai loro figli.
La maggior parte delle cellule del corpo contengono migliaia di mitocondri, ciascuno con una o più copie di DNA mitocondriale. Queste cellule possono avere un mix di mitocondri contenenti DNA mutato e immutata (eteroplasmia). La gravità di MIDD è pensato per essere associato con la percentuale di mitocondri con la mutazione del DNA mitocondriale.
Che dire della sordità?
La sordità è un risultato del nervo all’orecchio essere colpiti in entrambe le orecchie e si sviluppa in circa il 75% delle persone con MIDD che hanno anche il diabete. La perdita dell’udito sviluppa tipicamente in età adulta (anche se possono sviluppare come i bambini o poi nella vita) e di solito è presente prima del diabete. La sordità è più comune negli uomini rispetto alle donne e gli uomini hanno perdita di udito più grave e rapidamente progressiva. La metà di quelli con perdita di udito subire un rapido declino nella loro ha Aring mentre il resto ha una perdita dell’udito lentamente progressiva nel corso di molti anni, la perdita dell’udito è variabile, ma può richiedere un’audizione bilaterale Ai d s.; anche se porta raramente totale sordità. In genere i non udenti si riferisce alla incapacità di ascoltare le frequenze alte. La diagnosi precoce della sordità da audiogrammi periodici nei bambini è importante e tempestiva terapia antibiotica di eventuali infezioni dell’orecchio è anche logico. Gli impianti cocleari hanno avuto successo nei casi di grave perdita di udito in MIDD.
Altre caratteristiche che possono verificarsi nel MIDD
In linea con altri disturbi mitocondriali, il MIDD può, in alcuni pazienti, può provocare altri problemi di salute a parte il diabete e la sordità . .Come per il diabete e sordità vi è una notevole variazione nella misura in cui tale malattia si manifesta . Anche all’interno degli individui della famiglia si può avere un numero variabile di gravità e di caratteristiche cliniche variabile in quanto il diabete da solo può colpire altri organi.
Altre caratteristiche talvolta associate al MIDD:
· La bassa statura è comune nei pazienti MIDD sono spesso magri (indice di massa corporea inferiore a 20).
· Problemi di cuore: è importante sottoporre a screening tutti i pazienti MIDD, nel caso in cui hanno coinvolgimento del cuore che può causare seri problemi con il ritmo del cuore. Ciò include un ECG (e di solito un ecocardiogramma) all’età di 35 anni, o prima, se ci sono delle caratteristiche cliniche o storia di problemi di tutti i membri della famiglia. Negli individui ad alto rischio l‘esame dovrebbe essere condotta ogni anno. Farmaci statine dovrebbero essere usati nei pazienti con fattori di rischio cardiovascolare.
· Miopatia (debolezza muscolare): problemi muscolari o debolezza o crampi possono essere presenti in circa il 40% dei casi di MIDD. T suo genere comporta muscoli prossimali (spalle, glutei e cosce) che vengono utilizzati quando salire le scale e presenta come indotta da esercizio crampi muscolari o debolezza.
· Malattia Renale : Proteine si trova comunemente nelle urine dei pazienti MIDD, in particolare nelle donne. La malattia renale a volte si presenta prima del diabete e della sordità. Il problema renale più comune è chiamato sclerosi glomerulare focale segmentale e alcuni pazienti sviluppano in stadio terminale insufficienza renale. La funzione renale deve essere monitorata ogni anno come parte del check-up di routine del diabete. Le Compresse chiamati ACE inibitori dovrebbero essere utilizzate presto a causa dell’elevato grado di complicazioni renali ed è anche importante un buon controllo della pressione sanguigna.
· Retina : I problemi possono includere una distrofia oculare, comprese lesioni pigmentate e sottile dell’epitelio della retina . Sintomi visivi sono rari ma possono includere perdita visiva, la cecità notturna, punti ciechi e fotofobia alla luci. La maggior parte dei pazienti affetti da questa malattia maculare hanno avuto il diabete per più di 40 anni e sono di età superiore ai 40 anni. Il check-up degli occhi è importante e deve essere effettuata annualmente.
· ictus: nei giovani con di meno di 45 anni di età l’ictus può verificarsi in circa l’1% dei pazienti.
· Malattia gastrointestinale: disturbi gastrointestinali possono essere abbastanza comune nalla MIDD, in particolarmente stipsi.
I test genetici
Il test genetico dovrebbe essere condotto per confermare la diagnosi e può essere fatto utilizzando sangue, saliva o campioni di urina anche se a volte possono essere prese biopsie muscolari.
Famiglia di follow-up
Parenti adulti materni di pazienti con MIDD sono a rischio di sviluppare il diabete, la perdita di udito, insufficienza renale o problemi cardiaci così lungo periodo di follow up di parenti è consigliabile.
· MedlinePlus – Informazioni sanitarie (3 collegamenti)
· Risorse educative – Pagine di informazioni (4 collegamenti)
· Supporto paziente – Per i pazienti e le famiglie (2 collegamenti)
Potreste anche essere interessati a queste risorse, che sono progettati per gli operatori sanitari e ricercatori.
· Genetic Registry Test – Repository di informazioni test genetico (1 link)
· PubMed![]() – La letteratura recente
– La letteratura recente
· OMIM![]() – Catalogo Malattia genetica
– Catalogo Malattia genetica
Quali altri nomi la gente usa per MIDD?
· La sindrome Ballinger-Wallace
· diabete mellito, di tipo II, con sordità
· La sindrome del diabete-sordità maternamente trasmessa
· mitocondriale ereditato il diabete e sordità
· NIDDM con sordità
· diabete mellito non insulino-dipendente con sordità
Per ulteriori informazioni sulla denominazione condizioni genetiche, vedere la Genetics Home ReferenceCondizione Linee guida di denominazione e di come sono condizioni genetiche e geni denominati? nel manuale.
Cosa succede se ho ancora domande specifiche su MIDD?
Chiedi alla Genetica e Malattie Rare Information Center![]() .
.
Malattie Cardiovascolari e Dislipidemie.

E noto che l’orecchio interno è particolarmente vulnerabile all’ipossia. Episodi ischemici locali possono essere causa di danni irreversibili sia a livello centrale che periferico del sistema uditivo,
In particolare, uno stato duraturo di ipossia cocleare, ad esempio indotto da difetti di circolazione locale, può causare un accumulo di mutazioni mitocondrialilmetaboliche a carico delle cellule ciliate direttamente, o indirettamente, per danno della stria vascolare. cui consegue una diminuzione del potenziale elettrico endococleare.
Inoltre, nei soggetti affetti da disturbi dell’assetto lipidico, il rischio di incidenti vascolari di origine aterosclerotica è aumentato. compresa la possibilità di ischernie del distretto vertebro-basilare In particolare, secondo alcuni Autori, l’iperlipidemia correla significativamente con un incremento degli intervalli 1-111 e I-V nei tracciati ABR,
 Anche se è generalmente inteso che l’udito peggiora con l’età avanzata, rimane un certo dibattito sul fatto che la storia rumore di esposizione, modelli alimentari, della salute e del patrimonio genetico degli individui contribuisce maggiormente a questo problema cronico. Negli ultimi dieci anni, e negli ultimi cinque anni in particolare, vi è stato un aumento del numero di studi pubblicati che esaminano i fattori di rischio modificabili che possono contribuire alla perdita dell’udito. Per esempio, ci sono studi in corso che mostrano un rapporto convincente tra acquisite deficit uditivo e la scarsa forma fisica cardiovascolare [ 1 , 2 ] e ipertensione [ 3 ]. Inoltre, disturbi cardio-metaboliche [ 4 , 5 ] (ad esempio, sindrome metabolica, diabete di tipo 2) e comportamenti ad alto rischio, come il fumo [ 6 ], sono stati implicati in difficoltà uditive acquisite. Viceversa, il consumo moderato è stato descritto come un fattore protettivo potenziale [ 7 ].
Anche se è generalmente inteso che l’udito peggiora con l’età avanzata, rimane un certo dibattito sul fatto che la storia rumore di esposizione, modelli alimentari, della salute e del patrimonio genetico degli individui contribuisce maggiormente a questo problema cronico. Negli ultimi dieci anni, e negli ultimi cinque anni in particolare, vi è stato un aumento del numero di studi pubblicati che esaminano i fattori di rischio modificabili che possono contribuire alla perdita dell’udito. Per esempio, ci sono studi in corso che mostrano un rapporto convincente tra acquisite deficit uditivo e la scarsa forma fisica cardiovascolare [ 1 , 2 ] e ipertensione [ 3 ]. Inoltre, disturbi cardio-metaboliche [ 4 , 5 ] (ad esempio, sindrome metabolica, diabete di tipo 2) e comportamenti ad alto rischio, come il fumo [ 6 ], sono stati implicati in difficoltà uditive acquisite. Viceversa, il consumo moderato è stato descritto come un fattore protettivo potenziale [ 7 ].
Quindi, qual è l’ultima parola sulla questione? Fa malattie cardiovascolari causa perdita di udito, o no? È l’esercizio protettivo della funzione cocleare, o è un fattore di rischio? Può perdita di udito essere un’indicazione, o biomarker, per la malattia cardiovascolare di base?
Quello che possiamo dire con sicurezza è che gli stati di malattia, sia cardiovascolari o cardio-metabolico in natura, derivanti da modelli di comportamento generalmente legati alla cattiva alimentazione, mancanza di esercizio fisico, lo stress e il fumo, sono chiaramente legati alla perdita di udito acuità in adulti più anziani. Purtroppo, nessuno dei fattori di rischio di cui sopra sono facilmente modificabile. Inoltre, non vi è alcuna prova che l’inversione del rischio cardiovascolare o malattia può invertire il danno che è già stato fatto per l’orecchio.
Il quadro diventa più triste se si considera che l’attuale stato di salute negli Stati Uniti è in calo. Abbiamo tutti sentito parlare di epidemia di obesità e che l’aspettativa di vita stimata delle prossime generazioni, per la prima volta, è in declino [ 8 ]. Come la nostra società (in particolare le generazioni più giovani) diventa sempre più sedentario e sempre più dipendente dalle densi di calorie, diete nutrizionalmente sparse, ci sono probabilità di vedere un ampliamento di molte malattie / disordini, l’ultimo dei quali è la perdita dell’udito. Secondo Zhan et al. [ 9 ], in uno studio di differenze generazionali in perdita dell’udito prevalenza, ci sono prove che la perdita dell’udito è più bassa negli uomini e nelle donne tra i ‘baby boomer’ rispetto alle generazioni precedenti. Essi offrono la spiegazione che ambientale, stile di vita, o altri fattori modificabili, quali l’efficacia e l’uso diffuso di pressione sanguigna controllare farmaci; contribuire alla corrente eziologia di ipoacusia in adulti più anziani [ 9 ]. Si può sostenere, tuttavia, che la prevalenza ridotta di perdita dell’udito negli ‘baby boomer’ rispetto alla generazione dei loro genitori, come notato da Zhan et al., Vedrà un’inversione nelle generazioni successive.
Che i dati attuali dimostra che le professioni mediche specialistiche, tra cui la specialità di otorinolaringoiatria e delle sue discipline affini, non può più funzionare in un vuoto. Infatti idoneità del paziente, BMI, abitudini alimentari e comportamenti a rischio, come il fumo, possono avere un ampio impatto sul udito, come un esempio. Altri aspetti che possono essere ugualmente colpiti includono la funzione vestibolare, la qualità del sonno, vie aeree, e testa / collo tumore genesi. Non si dovrebbe discutere di un nuovo modello di cura, ma piuttosto, per un modello avanzata, in cui tutti i professionisti otorinolaringoiatria cercano e mantengono collaborazioni con altre specialità, che lo rende un punto di impegnarsi regolarmente i pazienti su tutti gli aspetti della loro salute generale e benessere. Forse, con l’applicazione generalizzata di sistemi elettronici di cartelle cliniche e la crescente popolarità di riviste ad accesso aperto, una nuova era nella comunicazione clinica e la collaborazione scientifica tra le specialità mediche può essere forgiato. Oltre a un rapido processo di peer review, il modello di accesso aperto si presta ad una maggiore social networking, traduzione, e altre funzionalità di accesso digitali che facilitano la diffusione delle informazioni nuove e altrimenti critica.
References
- Hutchinson KM, Alessio H, Baiduc RR (2010) Association between cardiovascular health and hearing function: pure-tone and distortion product otoacoustic emission measures. Am J Audiol 19: 26-35.
- Cristell M, Hutchinson KM, Alessio HM (1998) Effects of exercise training on hearing ability. Scand Audiol 27: 219-224.
- de Moraes Marchiori LL, de Almeida Rego Filho E, Matsuo T (2006) Hypertension as a factor associated with hearing loss. Braz J Otorhinolaryngol 72: 553-540.
- Hwang JH, Wu CC, Hsu CJ, Liu TC, Yang WS (2009) Association of central obesity with the severity and audiometric configurations of age-related hearing impairment. Obesity (Silver Spring) 17: 1796-1801.
- Sunkum AJ, Pingile S (2012) A clinical study of audiological profile in diabetes mellitus patients. Eur Arch Otorhinolaryngol.
- Cruickshanks KJ, Klein R, Klein BE, Wiley TL, Nondahl DM, et al. (1998) Cigarette smoking and hearing loss: epidemiology of hearing loss study. JAMA 279: 1715-1719.
- Popelka MM, Cruickshanks KJ, Wiley TL, Tweed TS, Klein BE, et al. (2000) Moderate alcohol consumption and hearing loss: a protective effect. J Am Geriatr Soc 48: 1273-1278.
- Olshansky SJ, Passaro DJ, Hershow RC, Layden J, Carnes BA, et al. (2005) A potential Decline in Life Expectancy in the United States in the 21st century. N Engl J Med 352: 1138-1145.
- Zhan W, Cruickshanks KJ, Klein BE, Klein R, Huang GH, et al. (2010) Generational differences in the prevalence of hearing impairment in older adults. Am J Epidemiol 171: 260-266.
La Cardiomiopatia dilatativa (DCM), una malattia caratterizzata da dilatazione ventricolare e disfunzione contrattile, è una delle principali cause di insufficienza cardiaca, con una prevalenza di 36,5 per 100 000 individui (Codd MB,ed Al.,1989). Diversi studi indicano che il 25% al 30% del DCM è familiare, Michels VV ,ed Al.,1992; Keeling PJ ed Al.,1995; Grünig E, ed Al.,1998, ma la definizione della posizione genomica dei loci malattia e l’identificazione di geni malattia è stata ostacolata sia dalla significativa mortalità e l’età di insorgenza tardiva di questa malattia. Tuttavia, 7 DCM loci (CMD1A – G) sono stati definiti in questa malattia geneticamente eterogenea. 9101112131415 Anche se non sono stati identificati i geni di malattia in questi loci, due geni malattia per DCM, actina e desmina, sono stati identificati da approcci genici candidati. 1617
Molte sindromi umane mostrano cuore e le orecchie anomalie in associazione con altre patologie d’organo. 18 La sindrome di Alstrom, che è stato recentemente mappata sul cromosoma 2p12 a 13, 19 provoca DCM e ipoacusia , distrofia oculare, ‘obesità non. diabete insulino-dipendente 20 La Sindrome di Rosenberg causa cardiomiopatia X-linked e SNHL con iperuricemia e atassia. 18mutazioni nel tRNA mitocondri perturbano la funzione cardiaca e l’udito, 21,22,23,ma in genere hanno associato encefalomielopatia, miopatie scheletriche, e / o anomalie metaboliche; questi difetti sono ulteriormente distinti per successione matrilineare.
La scoperta della malattia cardiouditive in assenza di altre malattie è rara. L’esempio classico è Jervell e la sindrome di Lange-Nielsen, una malattia caratterizzata da sordità congenita e aritmie cardiache (sindrome del QT lungo); in particolare, in questa malattia, la struttura cardiaca è normale. Studi genetici di Jervell e la sindrome di Lange-Nielsen hanno dimostrato che le mutazioni recessive nel gene sul cromosoma 11p15.5 KVLQT1 o il gene ISK sul cromosoma 21q22.1 a 22.2 2425 causa questo disturbo.
Segnaliamo una nuova sindrome cardiouditiva ereditaria caratterizzate da SNHL postlinguale con DCM e le mappe mostrano una mutazione causale al cromosoma 6q23 a 24 (locus designazione CMD1J). Questo fenotipo unico fornisce vantaggi per l’identificazione di geni candidati e stabilisce un marker precoce per individuare le persone a rischio di malattia cardiaca significativa.
L’associazione tra fattori protrombotici ereditari ed acquisiti in pazienti con improvvisa perdita dell’udito neurosensoriale e le malattie trombotiche in altri siti suggeriscono che un meccanismo multifattoriale può essere alla base della compromissione cocleare microvascolare. Indagini ematologiche, tra cui MTHFR, protrombina, piastrine, e genotipizzazione V di Leiden, può aiutare a individuare i pazienti a rischio potenziale di perdita dell’udito ricorrente e più malattie microvascolari, e potrebbe essere utilmente effettuata nelle perdite improvvise neurosensoriali idiopatiche dell’udito.
References
1. ↵
Petit C. Genes responsible for human hereditary deafness: symphony of a thousand. Nat Genet. 1996;14:385–391.
2. ↵
Morton NE. Genetic epidemiology of hearing impairment. Ann N Y Acad Sci. 1991;630:16–31.
3. ↵
Reardon W. Genetic deafness. J Med Genet. 1992;29:521–526.
4. ↵
Proctor C. Diagnosis, prevention and treatment of hereditary sensorineural hearing loss. Laryngoscope. 1997;87:1–60.
5. ↵
Codd MB, Sugrue DD, Gersh BJ, Melton LJ. Epidemiology of idiopathic dilated and hypertrophic cardiomyopathy: a population-based study in Olmsted County, Minnesota, 1975–1984. Circulation. 1989;80:564–572.
6. ↵
Michels VV, Moll PP, Miller FA, Tajik AJ, Chu JS, Discoll DJ, Burnett JC, Rodeheffer RJ, Chesebro JH, Tazelaar HD. The frequency of familial dilated cardiomyopathy in a series of patients with idiopathic dilated cardiomyopathy. N Engl J Med. 1992;326:77–82.
7. ↵
Keeling PJ, Gang Y, Smith G, Seo H, Bent SE, Murday V, Caforio ALP, McKenna WJ. Familial dilated cardiomyopathy in the United Kingdom. Br Heart J. 1995;73:417–421.
8. ↵
Grünig E, Tasman JA, Kücherer H, Franz W, Kübler W, Katus HA. Frequency and phenotypes of familial dilated cardiomyopathy. J Am Coll Cardiol.1998;31:186–194.
9. ↵
Messina DN, Speer MC, Pericak-Vance MA, McNally EM. Linkage of familial dilated cardiomyopathy with conduction defects and muscular dystrophy to chromosome 6q23. Am J Hum Genet. 1997;61:909–917.
10. ↵
Olson TM, Keating MT. Mapping a cardiomyopathy locus to chromosome 3p22–25. J Clin Invest. 1996;97:528–532.
11. ↵
Kass S, MacRae C, Graber HL, Sparks EA, McNamara D, Boudoulas H, Basson CT, Baker PB III, Cody RJ, Fishman MC, Cox N, Kong A, Wooley CF, Seidman JG, Seidman CE. A genetic defect that causes conduction system disease and dilated cardiomyopathy maps to 1p1–1q1. Nat Genet.1994;7:546–551.
12. ↵
Durand JB, Bachinski LL, Bieling LC, Czernuszewicz GZ, Abchee AB, Yu QT, Tapscott T, Hill R, Ifegwu J, Marian AJ, Brugada R, Daiger S, Gregoritch JM, Anderson J, Quinones M, Towbin JA, Roberts R. Localization of a gene responsible for familial dilated cardiomyopathy to chromosome 1q32.Circulation. 1995;92:3384–3380.
13. ↵
Krajinovic M, Pinamonti B, Sinagra G, Vatta M, Severini GM, Milasin J, Falaschi A, Camerini F, Giacca M, Mestroni L. Linkage of familial dilated cardiomyopathy to chromosome 9. Am J Hum Genet. 1995;57:846–852.
14. ↵
Bowles KR, Gajarski R, Porter P, Goytia V, Bachinski LL, Roberts R, Pignatelli R, Towbin JA. Gene mapping an autosomal dominant familial dilated cardiomyopathy to chromosome 10q21–23. J Clin Invest. 1996;98:1355–1360.
15. ↵
Siu BL, Niimura H, Osborne JA, Fatkin D, MacRae C, Solomon S, Benson DW, Seidman JG, Seidman CE. Familial dilated cardiomyopathy locus maps to chromosome 2q31. Circulation. 1999;99:1022–1026.
16. ↵
Olson TM, Michels VV, Thibodeau SN, Tai YS, Keating MT. Actin mutations in dilated cardiomyopathy, a heritable form of heart failure. Science..1998;280:750–752.
17. ↵
Li D, Tapscoft T, Gonzales O, Burch PE, Quinones MA, Zoghbi WA, Hill R, Bachinski LL, Mann DL, Roberts R. Desmin mutation responsible for idiopathic dilated cardiomyopathy. Circulation.. 1999;100:461–464.
18. ↵
Gorlin RJ, Toriello HV, Cohen MM, eds. Hereditary Hearing Loss and its Syndromes. New York: Oxford University Press; 1995:1–457.
19. ↵
Collin GB, Marshall JD, Cardon LR, Nishina PM. Homozygosity mapping at Alstrom syndrome to chromosome 2p. Hum Mol Genet. 1997;6:213–219.
20. ↵
Michaud JL, Heon E, Guilbert F, Weill J, Puech B, Benson L, Smallhorn JF, Shuman CT, Buncic JR, Levin AV, Weksberg R, Breviere GM. Natural history of Alstrom syndrome in early childhood: onset with dilated cardiomyopathy.Pediatrics. 1996;128:225–229.
21. ↵
Santorelli FM, Mak SC, El-Schahawi M, Casali C, Shanske S, Baram TZ, Madrid RE, DiMauro S. Maternally inherited cardiomyopathy and hearing loss associated with a novel mutation in the mitochondrial tRNA(Lys) gene (G8363A). Am J Hum Genet. 1996;58:933–939.
22. ↵
Tranchant C, Mousson B, Mohr M, Dumoulin R, Welsch M, Weess C, Stepien G, Warter JM. Cardiac transplantation in an incomplete Kearns-Sayre syndrome with mitochondrial DNA deletion. Neuromusc Disord. 1993;3:561–566.
23. ↵
Kearns TP. External ophthalmoplegia, pigmentary degeneration of the retina, and cardiomyopathy: a newly recognized syndrome. Trans Ophthal Soc UK. 1965;63:559–625.
24. ↵
Tesson F, Denjoy I, Leibovici M, Donger C, Barhanin J, Faure S, Gary F, Coumel P, Petit C, Schwartz K, Guicheney P. A novel mutation in the potassium channel gene KVLQT1 causes the Jervell and Lange-Nielsen cardioauditory syndrome. Nat Genet. 1997;15:186–189.
25. ↵
Schulze-Bahr E, Wang Q, Wedekind H, Haverkamp W, Chen Q, Sun Y, Rubie C, Hordt M, Towbin JA, Borggrefe M, Assmann G, Qu X, Somberg JC, Breithardt G, Oberti C, Funke H. KCNE1 mutations cause Jervell and Lange-Nielsen syndrome. Nat Genet. 1997;17:267–268.
26. ↵
Vasan R, Larson M, Levy D, Evans J, Benjamin, E. Distribution and categorization of echocardiographic measurements in relation to reference limits the Framingham heart study: formulation of a height- and sex specific classification and its prospective validation. Circulation. 1997;6:1863–1873.
27. ↵
Monolio TA, Baughman KL, Rodeheffer R, Pearson TA, Bristow JD, Michaels V, Abelmann WH, Harlan WR. Prevalence and etiology of idiopathic dilated cardiomyopathy (summary of a national heart, lung, and blood institute workshop). Am J Cardiology. 1992;69:1458–1466.
28. ↵
Raffin M, Thornton A. QMASS Speech Audiometry. Vol I. Minneapolis, Minn: Qualitone Inc; 1988.
29. ↵
Methods for Calculation of the Articulation Index. American National Standards Institute; 1969:S3–S5.
30. ↵
Watkins H, MacRae C, Thierfelder L, Chou YH, Frenneaux M, McKenna W, Seidman JG, Seidman CE. A disease locus for familial hypertrophic cardiomyopathy maps to chromosome 1q3. Nat Genet. 1993;3:333–336.
31. ↵
Whitehead Mapping Project. Available at: http://www.genome.wi. mit.edu/index.html. Accessed February 29, 2000.
32. ↵
Sanger Center Chromosome 6 Mapping Group Web site. Available at: http://www.sanger.ac.uk/HGP/Chr6. Accessed February 29, 2000.
33. ↵
Genbank. Available at: http://www.ncbi.nlm.nih.gov/index.html. Accessed February 29, 2000.
34. ↵
Hidai H, Bardales R, Goodwin R, Quertermous T, Quertermous EE. Cloning of capsulin, a basic helix-loop-helix factor expressed in progenitor cells of the pericardium and the coronary arteries. Mech Dev. 1998;73:33–43.
35. ↵
Quaggin SE, Vanden Heuvel GB, Igarashi P. Pod-1, a mesoderm-specific basic-helix-loop-helix protein expressed in mesenchymal and glomerular epithelial cells in the developing kidney. Mech Dev. 1998;71:37–48.
36. ↵
Robb L, Mifsud L, Hartley L, Biben C, Copeland NG, Gilbert DJ, Jenkins NA, Harvey RP. Epicardin: a novel basic helix-loop-helix transcription factor gene expressed in epicardium, branchial arch myoblasts, and mesenchyme of developing lung, gut, kidney, and gonads. Dev Dyn. 1998;213:105–113.
37. ↵
Lu J, Richardson JA, Olson EN. Capsulin: a novel bHLH transcription factor expressed in epicardial progenitors and mesenchyme of visceral organs.Mech Dev. 1998;73:23–32.
38. ↵
O’Neill ME, Marietta J, Nishimura D, Wayne S, Van Camp G, Van Laer L, Negrini C, Wilcox ER, Chen A, Fukushima K, Ni L, Sheffield VC, Smith RJ. A gene for autosomal dominant late-onset progressive non-syndromic hearing loss, DFNA10, maps to chromosome 6. Hum Mol Genet. 1996;5:853–856.
39. ↵
Drici MD, Arrighi I, Chouabe C, Mann JR, Lazdunski M, Romey G, Barhanin J. Involvement of IsK-associated K+ channel in heart rate control of repolarization in a murine engineered model of Jervell and Lange-Nielsen syndrome. Circ Res. 1998;83:95–102.
40. ↵
Vetter DE, Mann JR, Wangemann P, Liu J, McLaughlin KJ, Lesage F, Marcus DC, Lazdunski M, Heinemann SF, Barhanin J. Inner ear defects induced by null mutation of the Isk gene. Neuron. 1996;17:1251–1264.
41↵
Capaccio P 1 , Cuccarini V , Ottaviani F , Fracchiolla NS , Bossi A , Pignataro L . Prothrombotic gene mutations in patients with sudden sensorineural hearing loss and cardiovascular thrombotic disease.
Ann Otol Rhinol Laryngol. 2009 Mar;118(3):205-10.
ESPOSIZIONE A PRODOTTI CHIMICI. I solventi organici per le loro specifiche caratteristiche chimiche e fisiche presentano una notevole affinità per il tessuto nervoso. La tossicità sul sistema nervoso centrale e periferico dei solventi organici è uniformemente accettata ed i dati al riguardo sono abbastanza concordi.
E stato dimostrato che in lavoratori esposti a solventi come toluene, tricloroetilene. xilene e stirene esiste una probabilità più elevata di sviluppo di ipoacusia neurosensoriale per le alte frequenze. rispetto ai soggetti non esposti. Inoltre i tracciati AER si caratterizzano per un incremento dei valori di latenza delle onde I, III, V, ed un aumento degli intervalli interpicco I-V e III-V
Fig I ABR e MLR in soggetti diabetici normoacusici risulta evidente l’aumento di latenza dell’onda V e la desincronizzazione del tracciato (particolarmente evidente in b) (da Martini et al, 1987).
OTOTOSSICI PROFESSIONALI
Solventi organici
I derivati del benzene (toluene, stirene, xilene) appartengono alla classe degli idrocarburi aromatici monociclici e sono assorbiti prevalentemente per via inalatoria. Non sono stati osservati effetti ototossici in tutti i lavoratori esposti a derivati benzenici, e la gravità del danno, qualora si manifesti, sembra correlata a diversi parametri tra i quali principalmente la diversa suscettibilità individuale all’azione di questi tossici.
Livello d’azione: le alterazioni isto funzionali più evidenti, conseguenti all’azione tossica dei solventi considerati, si manifestano principalmente a livello dei distretti anatomici più ricchi in lipidi, quali il sistema nervoso centrale e periferico, il fegato ed il midollo osseo, ma spiccano comunque per gravità e frequenza i disturbi del sistema nervoso e dell’epitelio stato-acustico. I disturbi audiovestibolari da inalazione dei vapori di derivati benzenici costituiscono l’iniziale e spesso unica manifestazione dell’ototossicità dei solventi organici. La complessità delle funzioni del labirinto, le sue elevate esigenze metaboliche ed energetiche e la sua discreta capacità di adattamento alle noxae chimiche spiegano perché l’area labirintica sia quella che più precocemente di ogni altra manifesta i segni di una sofferenza da agenti tossici (Pollastrini et al., 1994).
In uno studio condotto su 53 soggetti esposti cronicamente a vapori di benzene sono state valutate le alterazioni più precoci a carico delle funzioni vestibolo-oculomotorie e del sistema uditivo, conseguenti all’inalazione di derivati benzenici alle concentrazioni normalmente ammesse per l’aria degli ambienti di lavoro. I lavoratori sono stati sottoposti. oltre che ad una batteria di test vestibolari ed oculomotori, anche ad una serie di esami audiologici. Al termine dello studio i dati ottenuti dall’audiometria tonale liminare sono risultati nel range di normalità, mentre i’ audiometria vocale sensibilizzata, considerata strumento sensibile di diagnosi di lesioni corticali comprendenti la corteccia uditiva, ha evidenziato una riduzione di vario grado dell’intellegibilità in una percentuale superiore al 50% dei soggetti. In 24 soggetti le lesioni erano bilaterali mentre in 7 soggetti interessavano solo l’orecchio sinistro. Tale rilievo ha consentito di ipotizzare, come già evidenziato in passato (Larsby et al., 1980; Odkvist et ah, 1982), che nella esposizione cronica ad idrocarburi aromatici si può avere un interessamento della corteccia cerebrale, anche se lesioni del tronco encefalico possono essere alla base di risposte alterate quando vengano interessate le vie uditive. In questo studio il riflesso stapediale, ritenuto un test attendibile e sensibile per la diagnosi precoce di patologie del tronco encefalico, è risultato normale (Pollastrini et al., 1994).
Esposizioni multiple: alcuni studi condotti su animali da esperimento hanno dimostrato che gli effetti ototossici dei solventi, quando si ha un’esposizione combinata, mostrano interazioni additive, taluni sinergiche, altri antagonistiche.
Effetto sinergico con il rumore: da tempo è noto che il rumore interagisce in modo sinergico con i solventi organici nella patogenesi dell’ipoacusia (Dayal et al., 1975; Young et al., 1987).
In uno studio recente è stato dimostrato che l’esposizione contemporanea a rumore e solventi organici, anche a concentrazioni inferiori ai TLV, determina un danno uditivo (da insulto coclearie e corticale) maggiore della sola esposizione a rumore (Sliwimska-Kowalaska et al., 2001).
Toluene
Livello d’azione, caratteristiche del danno e progressione: numerosi studi hanno dimostrato insorgenza di ipoacusia ed evidenziato danni cocleari in topi esposti a toluene (Morata et aL, 1994). L’esame morfòlogico della coclea degli animali esposti ha mostrato perdita o danno delle cellule ciliate della parte basale della coclea.
In uno studio condotto su cavie esposte a bassi livelli di toluene (250, 500, 1000 ppm per 8 ore giorno, per 5 giorni/settimana, per 1-4 settimane) è stato osservato un danno uditivo conseguente ad alterazione del metabolismo energetico delle cellule ciliate, in particolare è stata osservata una diminuzione dell’attività enzimatica di succinato deidrogenasi nella regione cocleare delle medie frequenze. Tale alterazione insorge acutamente, e nonostante sia stata osservata una progressione della disfunzione uditiva da I a 4 settimane di esposizione, questi soggetti non hanno sviluppato un danno permanente, infatti non si è assistito a morte delle cellule ciliate. Questo studio evidenzia quindi un danno precoce al sistema uditivo della cavia esposta a basse dosi di toluene per deficit nel metabolismo energetico delle cellule ciliate (McWilliams et al., 2000).
In uno studio condotto su topi esposti a toluene è stato dimostrato che il danno interessa principalmente le alte frequenze (Johnson et al., 1988).
In un altro studio nel quale animali da esperimento sono stati esposti a livelli di toluene di 1750 ppm (per 6 ore/die, 5 giorni a settimana, per un mese) è stato osservato un deficit uditivo sia per frequenze di 12-14 kHz che 3-4 kHz (Books et al., 1999).
Effetto sinergico con il rumore: in uno studio trasversale sugli effetti dell’esposizione a rumore e solventi. Morata e collaboratori (1993) hanno dimostrato che esiste una interazione tra esposizione a rumore (88-98 dB) ed esposizione a toluene (100-365 ppm) nella genesi del danno uditivo. In un altro studio Morata e collaboratori (1997) hanno evidenziato che la prevalenza di ipoacusia in soggetti esposti a rumore e toluene, anche se al di sotto dei valori limite, era maggiore rispetto a gruppi di non esposti al solvente.
Altri studi hanno dimostrato che la simultanea esposizione a toluene e rumore determina un aumento della suscettibilità agli effetti uditivi di entrambi gli agenti (Morata et al.. 1994).
Relazione dose-risposta: in uno studio condotto su 193 donne non fumatrici e astemie esposte a toluene è stato dimostrato. suddividendo la casistica per classi di esposizione. che l’ipoacusia insorta in conseguenza a tale esposizione aveva un andamento dose-risposta, essendo correlata sia al tempo che all’intensità dell’esposizione (Lee-B-K et al., 1988).
Stirene
Tra i solventi organici l’ototossicità del toluene è stata spesso osservata in studi su animali.
Lo stirene è strutturalmente simile al toluene ed è ototossico per i topi.
Caratteristiche del danno e progressione: in alcuni studi è stato dimostrato che in lavoratori esposti a stirene in industrie plastiche non sono osservabili danni all’udito evidenziabili con l’audiometria; in particolare, in uno studio condotto da Sass-Kortsac e collaboratori (1995) su un gruppo di lavoratori di un’industria plastica, esposti a livelli di stirene inferiori a 50 ppm, non sono state osservate alterazioni a carico degli esami audiometrici.
E stato invece evidenziato un innalzamento della soglia uditiva in lavoratori esposti a bassi livelli di stirene.
Relazione dose-risposta: in questo studio l’innalzamento della soglia era direttamente proporzionale alla concentrazione di stirene nell’area respirabile. Inoltre è stata osservata una relazione dose-dipendente tra aumento della concentrazione di stirene nell’area respirabile, acido mandelico urinario e innalzamento della soglia uditiva.
Livello d’azione: molte sostanze ototossiche agiscono a livello dell’area cocleare corrispondente alle alte frequenze essendo questa la più suscettibile agli insulti dei farmaci.
I solventi organici, al contrario, determinano un danno iniziale che interessa le medie frequenze (Crofton et al., 1994), anche se studi condotti su animali esposti a stirene hanno evidenziato un coinvolgimento anche delle alte frequenze. Ciò ha condotto ad ipotizzare che l’ototossicità da stirene evidenzi una progressione dalle medie verso le alte frequenze (Marioka et aL, 1999).
Effetto sinergico con il rumore: esposizione a stirene e rumore hanno effetto additivo nell’insorgenza del danno acustico (Morioka et al., 1999; Morata et al., 199.3).
Tricloro etilene
Livello d’azione e caratteristiche del danno: già da tempo è stato dimostrato che l’esposizione a tricloroetilene può determinare l’insorgenza di ipoacusia neurosensoriale con coinvolgimento delle alte frequenze in lavoratori esposti, anche se alcuni studi condotti su animali da esperimento hanno evidenziato l’insorgenza di ipoacusia a livello delle medie-alte frequenze (Rebert et al., 1991).
In uno studio più recente condotto su topi esposti a livelli di tricloroetilene variabili da 400 a 3200 ppm è stato osservato un calo uditivo corrispondente alle medie frequenze negli animali esposti alle dosi più alte di tricloroetilene (Crofton et al., 1997).
Solfuro di carbonio
Caratteristiche del danno: in uno studio effettuato per valutare il potenziale contributo di test audiologici ed otoneurologici per evidenziare intossicazioni da solfuro di carbonio sono stati testati 259 lavoratori esposti a varie concentrazioni di solfuro di carbonio (da 30 a 900 mg/m3) e a livelli di rumore compresi tra 84-88 dB. I test condotti su questo gruppo hanno evidenziato un aumento di incidenza di sintomi di patologie vestibolari ed ipoacusia neurosensoriale rispetto a quelli condotti su un gruppo di lavoratori esposti agli stessi livelli di rumore ma non esposti a solfuro di carbonio.
Effetto sinergico con il rumore: numerosi studi hanno dimostrato che l’incidenza di ipoacusia è maggiore negli esposti contemporaneamente a solfuro di carbonio e rumore ed inoltre che il grado di ipoacusia è maggiore nei co-esposti rispetto agli esposti agli stessi livelli di rumore, ma non a solfuro di carbonio (Morata et al., 1994).
Monossido di carbonio
Livello d’azione e caratteristiche del danno: numerosi autori hanno ipotizzato che il meccanismo attraverso il quale il monossido di carbonio provoca un danno a livello della coclea sia di tipo ischemico o da ipossia ipossica. In uno studio compiuto su ratti acutamente esposti a monossido di carbonio, è stata osservata una buona corrispondenza tra livelli ematici di carbossiemoglobina e declino della funzione cocleare, inoltre la sede preferenziale del danno è risultata essere localizzata alle alte frequenze (Tawackoli et al., 2001).
Effetto sinergico con il rumore: numerosi studi hanno dimostrato che la simultanea esposizione a monossido di carbonio e rumore incrementa il danno uditivo di quest’ultimo. Tossico e rumore hanno effetto sinergico (Young et al., 1987; Fechter et al.. 1995; Cary et al., 1997; Morley et al., 1999).
Ciò è stato spiegato tramite l’osservazione che il rumore può indurre danno cocleare riducendo la disponibilità di ossigeno nei tessuti attraverso un aumento della richiesta metabolica, e tale effetto associato all’ipossia indotta da tossici quali il monossido di carbonio facilita l’insorgenza del danno cocleare negli esposti a rumore e monossido di carbonio (Cary et al., 1997).
Cianuri
Livello d’azione, caratteristiche del danno e progressione: nello stesso studio di Tawackoli. descritto per il monossido di carbonio, gli animali da esperimento sono stati esposti acutamente anche a cianuro di potassio. In questo caso si è osservato che il danno cocleare, dopo somministrazione di cianuro. era più precoce rispetto a quello che si è osservato dopo esposizione a CO. Anche nel caso del cianuro si è osservato un maggior coinvolgimento delle alte frequenze. E stato però ipotizzato che la somministrazione di cianuro di potassio determini una pro53
Linee guida per la formazione continua e Faccreditamento del Medico del Lavoro: rumore
gressiva distruzione della stria vascolare cocleare, interferendo con i canali di trasporto elettronico a livello di questa struttura metabolicamente attiva, mentre si ritiene che il bersaglio dell’azione ototossica del CO non sia la stria vascolare cocleare (Tawackoli et al., 2001).
Metilmercurio
Caratteristiche del danno: in topi esposti a dosi di metilmercurio di 4-8 mg/Kg è stato osservato un deficit uditivo per tutte le frequenze indagate (da 4 a 78 kHz) con maggior coinvolgimento delle alte frequenze (Books et al.. 1985).
Pesticidi
I dati riportati in letteratura circa l’ototossicità dei pesticidi sono ancora discordanti. In particolare. in un recente studio effettuato su 631 agricoltori è stata osservata una netta associazione tra deficit dell’udito e utilizzo di pesticidi. Tale risultato è però difficilmente interpretabile poiché la raccolta di informazioni sull’esatta tipologia di pesticidi utilizzati e il quantitativo è risultata difficoltosa. Inoltre l’operazione di applicazione dei pesticidi genera rumore. il che può contribuire all’ aggravamento dell’ ipoacusia (Beckett et al., 2000).
In un altro studio condotto su 9 lavoratori addetti allo spargimento di pesticidi da più di 20 anni è stato osservato un deficit uditivo conseguente a neurotossicità cronica (Horowitz et al.. 1999).
Statistiche sulla Ototossicità
L’Ototossicità può colpire chiunque riceve un trattamento CON I farmaci sopra elencati. Tuttavia, la probabilità di sviluppare ototossicità è altamente dipendente quale farmaco viene somministrato, alla durata dell’uso, e diversi altri fattori sottostanti, come funzione renale e l’uso di altri farmaci ototossici allo stesso tempo.
Circa il 10% delle persone che prendono antibiotici aminoglicosidici esperienza ototossicità, anche se fino al 33% è stata riportata anche in pazienti adulti, con una probabilità del 3% di tale danno sia permanente. In generale, ototossicità si verifica più comunemente negli adulti che nei bambini e neonati, dove il tasso di incidenza è di circa il 2%. Tossicità vestibolare da aminoglicosidi è documentato a verificarsi in circa il 4% dei pazienti adulti e circa il 2% dei pazienti trattati con il rapporto gentamicina perdita dell’udito.
Nei pazienti in trattamento con il cisplatino agente anti-cancro, ototossicità può verificarsi in circa il 50% dei pazienti. La velocità e la gravità di ototossicità è maggiore nei bambini e nei pazienti che hanno avuto precedente radioterapia alla testa e al collo. Circa il 60% dei bambini trattati con chemioterapia a base di platino esperienza di perdita dell’udito.
C’è una incidenza 6% e 0,7% di ototossicità dai diuretici, furosemide e acido etacrinico, rispettivamente. Fino al 1% dei pazienti riferisce ototossicità da aspirina, anche se questo si verifica più frequentemente negli anziani.
Fattori di rischio per Ototossicità
Ci sono alcuni fattori che possono mettere i pazienti ad aumentato rischio di ototossicità:
- Dose e la durata della terapia
- Velocità di infusione e la dose cumulativa di vita
- Funzione renale alterata, che può portare ad un rapido accumulo del farmaco ototossico
- La somministrazione concomitante di un altro farmaco ototossici (ad esempio aminoglicosidi e di diuretici dell’ansa)
- Età
- Perdita dell’udito preesistente, sordità neurosensoriale
- L’esposizione durante la gravidanza
- Precedente esposizione di testa e di radiazione del collo (per gli agenti chemioterapici)
- Suscettibilità genetica
- Storia familiare di ototossicità
Progressione dell’ Ototossicità
I sintomi di ototossicità possono verificarsi rapidamente o apparire mesi dopo la somministrazione. Spesso, nelle prime fasi, ototossicità non diagnosticata, come quando la perdita dell’udito è molto minimale o ristretta ad alti suoni acuti. E ‘di solito quando la perdita dell’udito raggiunge le frequenze vocali basse che i pazienti notano nulla, e da quel momento si è già verificato un danno permanente.
Gli aminoglicosidi sono noti per la loro capacità di provocare la perdita permanente dell’udito, normalmente precedute da tinnito acuto e una graduale perdita dell’udito che inizia nelle frequenze più alte. Perdita di sensibilità vestibolare può anche essere permanente, e può causare visione del paziente di oscillare o rimbalzo.
Sintomi di aspirina e tossicità chinino sono dipendente dalla dose e sono generalmente reversibili. Essi sono caratterizzati da acufene e perdita di udito lieve. Grandi dosi di chinino, tuttavia, sono stati conosciuti per causare la perdita permanente dell’udito, in particolare nei pazienti anziani che assumono farmaci a lungo termine per i crampi alle gambe.
Gli agenti chemioterapici sono cause ben note di perdita che può essere grave e permanente dell’udito. La perdita dell’udito solito inizia come una perdita di alte frequenze in entrambe le orecchie, e progredisce ad una perdita di tutte le frequenze. La perdita dell’udito presenta come una sensazione di sentire voci soffocate. Effetti vestibolari (ad esempio perdita di equilibrio, incoordinazione, vertigini ) sono anche comuni. La perdita dell’udito si verifica in genere dopo 1-2 settimane di trattamento, anche se spesso può essere ritardata fino a 6 mesi dopo il trattamento.
Diuretici possono causare ronzio nelle orecchie o ridurre l’udito. Questo è di solito reversibile quando il trattamento viene interrotto.
I sintomi più comuni sperimentato da ototossicità sono:
- Acufene o ronzio nelle orecchie
- Perdita di udito bilaterale o unilaterale
- Vertigini
- Incoordinazione dei movimenti
- Instabilità dell’andatura
- Visione oscillante o rimbalzare
Come viene diagnosticata l’Ototossicità?
Diversi test audiologici sono disponibili specifici che il medico può svolgere.Essi comprendono varie udito e prove di equilibrio. Questi dovrebbero essere effettuate prima dell’inizio del trattamento con un noto agente ototossico, così come durante il trattamento e dopo l’interruzione del trattamento.
- Tono di prova Pure conduzione aerea: Può rilevare piccolissime variazioni anche prima comparsa di acufeni, come la maggior parte agenti ototossici producono la perdita dell’udito nelle più alte frequenze per primo.La diagnosi precoce permette la modifica del trattamento prima frequenze vocali sono interessati.
- Pure tono osso di conduzione: Utilizzato per determinare la funzione neurosensoriale.
- Test di riconoscimento delle parole
- Test di Romberg: prova Balance per rilevare il danno vestibolare.
Per i neonati ei pazienti criticamente malati che sono allettati o coma, test alternativi sono disponibili:
- Emissioni otoacustiche (OAE): prevede l’utilizzo di un microfono per misurare i segnali che sono prodotte dalla coclea.
- Risposta uditivi del tronco encefalico (ABR): Misure funzione uditiva che utilizza le risposte prodotte dal nervo uditivo e il tronco encefalico. Aiuta a differenziare sensoriale da perdita dell’udito neurale.
Come un paziente recupera da ototossicità dipende dal tipo di farmaco e la dose e la durata del trattamento. Di solito la perdita dell’udito dal trattamento con cisplatino è irreversibile, considerando che si verificano da salicilati e chinino è più spesso reversibile.
La maggior parte delle sostanze chimiche ambientali sono associati con la perdita permanente dell’udito. Mercury è stato associato a problemi di equilibrio permanente.
Se i sintomi sono diagnosticati precocemente, allora la probabilità di guarigione è molto più alta. Tuttavia, la maggior parte dei pazienti non si accorgono di eventuali variazioni significative fino a quando è troppo tardi.
Come si tratta l’Ototossicità ?
Attualmente non ci sono trattamenti disponibili per ototossicità, oltre a ritirare il farmaco non appena si sospetta la tossicità. La prevenzione è fondamentale per evitare la perdita permanente dell’udito. Quando un noto agente ototossico è prescritto, l’udito frequenti e prove di equilibrio dovrebbero essere condotte, in particolare nei pazienti che sono ad alta funzione risk.Kidney deve essere misurato prima di iniziare un farmaco ototossico.
Perdita di udito acuto spesso passa inosservato, e non è fino a quando una parola pronunciata non può essere sentito che i pazienti cercano di trattamento. A questo punto, il danno è in genere irreversibile. Questo è il motivo per test dell’udito regolari sono così importanti.
Ove possibile, i farmaci ototossici deve essere evitato, specialmente in combinazione.
I trattamenti disponibili sono volte a ridurre l’effetto del danno e ripristinare la funzione. Per ipoacusia grave e permanente, l’amplificazione usando apparecchi acustici o impianti cocleari può essere l’unica opzione di trattamento. Per ripristinare la funzione equilibrio perduto, terapia fisica può essere usato per aiutare riqualificare il cervello a sviluppare altri modi per mantenere l’equilibrio. Questo è spesso successo nei pazienti più giovani.
La ricerca ha scoperto che l’assunzione di taurina o un altro antiossidante (es. Vitamina E ) con il farmaco ototossico può essere in grado di ridurre l’ototossicità.
 ABUSO DI ALCOOL, FUMO DI SIGARETTA E DIETA. Nel corso di INTOSSICAZIONE ACUTA DA ETANOLO, indotta sperimentalmente nelle cavie e nel gatto. sono state riscontrate alle valutazioni uditive elettrofisiologiche. variazioni significative dei valori assoluti di latenza delle onde I. III. IV V. mentre i valori di latenza dell’onda I sono risultati più stabili. Tali alterazioni sono state attribuite da alcuni Autori all’ipotermia cerebrale indotta dall’elevata alcolemia,
ABUSO DI ALCOOL, FUMO DI SIGARETTA E DIETA. Nel corso di INTOSSICAZIONE ACUTA DA ETANOLO, indotta sperimentalmente nelle cavie e nel gatto. sono state riscontrate alle valutazioni uditive elettrofisiologiche. variazioni significative dei valori assoluti di latenza delle onde I. III. IV V. mentre i valori di latenza dell’onda I sono risultati più stabili. Tali alterazioni sono state attribuite da alcuni Autori all’ipotermia cerebrale indotta dall’elevata alcolemia,
Al di là dell’effetto acuto, l’alcool può determinare un danno a livello del tronco encefalo per abuso cronico.
Nel caso di etilismo cronico, vi è una maggiore compromissione delle condizioni generali del soggetto. con un coinvolgimento polifunzionale dell’organismo. fl sistema nervoso è frequentemente colpito da neuropatia periferica e centrale (es. mielinosi del ponte. encefalopatia di Wernicke). la cui patogenesi può essere attribuita ad un danno diretto o a deficit tossico-nutrizionali alcool relati, Infatti, alcuni studi in letteratura, riportano che i forti bevitori sono a rischio per lo sviluppo di ipoacusia neurosensoriale (es presbiacusia) più severa rispetto ai controlli: inoltre, in circa il 400/o dei soggetti sono stati riscontrati disturbi della velocità di conduzione centrale dello stimolo acustico all’ABR.
 In letteratura il ruolo del FUMO DI SIGARETTA come fattore predisponente lo sviluppo di ipoacusia è ancora dibattuto. Secondo alcuni autori può essere considerato un fattore di rischio per lo sviluppo di ipoacusia neurosensoriale (Siegelaub et al. 1974: Thomas et al., 1981; Cruickshanks et al., 1998; Starck et al., 1999). Secondo altri invece non è evidenziabile alcuna connessione tra insorgenza di ipoacusia neurosensoriale e fumo di sigaretta.
In letteratura il ruolo del FUMO DI SIGARETTA come fattore predisponente lo sviluppo di ipoacusia è ancora dibattuto. Secondo alcuni autori può essere considerato un fattore di rischio per lo sviluppo di ipoacusia neurosensoriale (Siegelaub et al. 1974: Thomas et al., 1981; Cruickshanks et al., 1998; Starck et al., 1999). Secondo altri invece non è evidenziabile alcuna connessione tra insorgenza di ipoacusia neurosensoriale e fumo di sigaretta.
Livello d’azione, caratteristiche del danno: non solo il ruolo del fumo di sigaretta come fattore predisponente lo sviluppo di ipoacusia è ancora controverso, ma anche le ipotesi proposte per spiegare il meccanismo d’azione che può condurre ad tan danno al sistema uditivo non sono state ancora definitivamente chiarite.
A tal proposito sono stati ipotizzati danni cocleari diretti mediati dalla nicotina (Lehnhart et al., 1984). E stato inoltre suggerito che i più elevati livelli di carbossiemoglobina dei fumatori possano ridurre la disponibilità di ossigeno per l’organo del Corti (Chung et al., 1982).
Proprio recentemente, alcuni Autori hanno osservato che il fumo aumenta il rischio di sviluppare forme più severe di presbiacusia con il tempo e che tale effetto sarebbe “dose-dipendente”. più accentuato quindi nei forti fumatori, Anche un elevato indice di massa corporea sarebbe da correlarsi, secondo alcuni studi. ad un a maggiore probabilità di sviluppare forme più severe di presbiacusia.
In conclusione, uno stile di vita sano sarebbe in grado di “proteggere” contro lo sviluppo di ipoacusia neurosensoriale ( presbiacusia). Si è visto che il fumo ha un effetto sinergico sull’insorgenza di fenomeno di Raynaud e sull’aumento della pressione diastolica. Di conseguenza è ipotizzabile che l’aggravamento del grado di ipoacusia neurosensoriale in soggetti fumatori ed esposti a rumore possa essere spiegato da cause vascolari (Starkh et al., 1999). In supporto a questa ipotesi c’è inoltre l’osservazione che il fumo aumenta il livello di PAF in LDL e HDL che può indurre allo sviluppo di aterosclerosi mediata dal fumo. Aterosclerosi prematura può inoltre essere correlata all’innalzamento dei livelli di carbossiemoglobina. La risultante formazione di placche aterosclerotiche nei vasi del sistema vertebrobasilare può indurre effetti sulla circolazione a livello cocleare. Ciò può determinare l’insorgenza di episodi ischemici e il rallentamento della circolazione cocleare, specialmente durante l’esposizione a rumore, quando la richiesta energetica cellulare a questo livello è maggiore (Starkh et al., 1999).
Fumo passivo Collegato a perdita dell’udito nei bambini
Pubblicato il 19 settembre 2011 da Adam Bernstein
Un nuovo studio tra gli adolescenti ha trovato che l’esposizione al fumo passivo (SHS) può portare il tipo più comune di perdita dell’udito, perdita dell’udito neurosensoriale (SNHL). Questo tipo di ipoacusia in genere non può essere corretta chirurgicamente o medico.
 Il fumo passivo è la combinazione di fumo rilasciata dalla combustione di prodotti del tabacco con il fumo esalato dai fumatori.Più le 7.000 sostanze chimiche sono in fumo passivo, e almeno 250 di loro sono noti per essere nocivi. Circa il 60% dei bambini americani sono esposti a questo fumo, che è stata implicata in precedenza identificato – e ora una nuova – problema di salute associati.
Il fumo passivo è la combinazione di fumo rilasciata dalla combustione di prodotti del tabacco con il fumo esalato dai fumatori.Più le 7.000 sostanze chimiche sono in fumo passivo, e almeno 250 di loro sono noti per essere nocivi. Circa il 60% dei bambini americani sono esposti a questo fumo, che è stata implicata in precedenza identificato – e ora una nuova – problema di salute associati.
In un nuovo studio, Anil K. Lalwani, MD, e una squadra di New York University Langone Medical Center, hanno valutato i fattori di rischio per la perdita dell’udito senso neurosensoriale tra 1.533 non fumatrici ragazzi dai 12 ai 19 anni che avevano partecipato al National Health and Nutrition Examination . Survey 2005-2006 I risultati appaiono nel luglio 2011 di Archives of Otolaryngology – Head and Neck Surgery .
Sulla base delle risposte degli adolescenti alle domande circa la loro salute, la storia medica, l’esposizione al fumo passivo, e ogni auto-riconoscimento di problemi di udito, nonché i risultati del test del sangue per la cotinina (un guasto nicotina-prodotto) e test dell’udito, i ricercatori hanno determinato che gli adolescenti esposti al fumo passivo hanno avuto perdita di udito più bassa e ad alta frequenza rispetto a quelli con nessuna esposizione.
Inoltre, la maggior parte (80%) dei ragazzi non si rendevano conto che avevano perso parte del loro udito. Gli esami del sangue hanno inoltre rivelato che il livello di cotinina è aumentato, così ha fatto il tasso di perdita dell’udito.
 La perdita dell’udito è solitamente classificato in base al quale parte del sistema uditivo è interessato. Il tipo di perdita dell’udito valutati in questo studio, SNHL (ipoacusia neurosensoriale) si verifica quando l’orecchio interno (coclea) o channals nervosi dall’orecchio interno al cervello sono danneggiate. SNHL è il tipo più comune di perdita permanente dell’udito, e di solito non può essere chirurgico o medico corretto.
La perdita dell’udito è solitamente classificato in base al quale parte del sistema uditivo è interessato. Il tipo di perdita dell’udito valutati in questo studio, SNHL (ipoacusia neurosensoriale) si verifica quando l’orecchio interno (coclea) o channals nervosi dall’orecchio interno al cervello sono danneggiate. SNHL è il tipo più comune di perdita permanente dell’udito, e di solito non può essere chirurgico o medico corretto.
Ipoacusia neurosensoriale può essere causata da trauma cranico, una malformazione dell’orecchio interno, la malattia, i farmaci che sono tossici per il sistema uditivo, la genetica o eredità, esposti a rumori forti, e l’invecchiamento. Con SNHL, gli individui hanno una ridotta capacità di sentire i suoni deboli, e anche quando le voci sono abbastanza forte da sentire, possono essere attutito o poco chiare.
Una serie di studi hanno chiamato fumo passivo come uno dei principali problemi di salute nei bambini. Un nuovo studio di Pediatrics rileva che fumano l’esposizione aumenta il rischio di disturbi neurocomportamentali nei bambini, tra cui difficoltà di apprendimento, ADHA, e disturbi della condotta.
In una grande analisi retrospettiva dei dati provenienti da 192 paesi, i ricercatori hanno riportato in Lancet nel gennaio 2011 che in tutto il mondo, il 40 per cento dei bambini sono stati esposti a fumo passivo nel 2004, e quella dei 603.000 decessi attribuiti al fumo passivo, il 28 per cento erano bambini. I maggiori oneri di malattia sono stati associati con infezioni respiratore inferiori nei bambini di età inferiore ai 5 anni (quasi 6 milioni di casi) e asma nei bambini (651.000).
Gli autori del nuovo studio negli Archives sottolineano che “gli adolescenti che sono esposti a SHS possono avere bisogno di essere più strettamente monitorati per la perdita dell’udito”, e che “dovrebbero essere istruiti sui fattori di rischio per la perdita dell’udito, come da diporto e da lavoro esposizione al rumore.
BIBLIOGRAFIA
Blanchet C, Erostegui C, Sugasawa M, Dulon D. Acetylcholine-induced potassium current of guinea pig outer hair cells: its dependence on a calcium influx through nicotinic-like receptors. J Neurosci.1996;16:2574-2585.
Lyons RA. Passive smoking and hearing loss in infants. Ir Med J.1992;85:111-112.
Guth PS, Norris CH. The hair cell acetylcholine receptors: a synthesis. Hear Res.1996;98:1-8.
McCartney JS, Fried PA, Watkinson B. Central auditory processing in school-age children prenatally exposed to cigarette smoke. Neurotoxicol Teratol.1994;16:269-276.
McFadden B, Pittman A (2008) Effect of minimal hearing loss on children’s ability to multitask in quiet and in noise.Lang Speech Hear Serv Sch 39: 342-351.Maffei G, Miani P. Experimental tobacco poisoning: resultant structural modification of the cochlea and tuba acustica. Arch Otolaryngol.1962;75:386-396.
National Center for Health Statistics. Data from the National Health Survey: cigarette smoking and health characteristics, July 1964-June 1965. Vital Health Stat 10.1967;34:11,
Shapiro SL. Are you smoking more but hearing less? Eye Ear Nose Throat Monthly.1964;43:96-100.
Talaat HS, Metwaly MA, Khafagy AH, Abdelraouf HR (2014) Dose passive smoking induce sensorineural hearing loss in children?Int J Pediatr Otorhinolaryngol 78: 46-49.
Zelman S. Correlation of smoking history with hearing loss. JAMA.1973;223:920.
Siegelaub AB, Friedman GD, Adour K, Seltzer CC. Hearing loss in adults: relation to age, sex, exposure to loud noise and cigarette smoking. Arch Environ Health.1974;29:107-109.
Weiss W. How smoking affects hearing. Med Times.1970;98:84-89.
- Fabry DA, Davila EP, Arheart KL, Serdar B, Dietz NA, et al. (2011) Secondhand smoke exposure and the risk of hearing loss.Tob Control 20: 82-85.
