IPOACUSE FLUTTUANTE Parole chiave : Sordità fluttuante, Fistola perilinfatica, Dilatazione dell’acquedotto del vestibolo, Dilatazione dell’acquedotto cocleare, Sordità autoimmune
L’ipoacusia fluttuante è un’entità nosologica tuttora non ben definita. Si tratta di una patologia in cui la soglia uditiva di un orecchio (o di entrambi) è soggetta a variazioni nel tempo. Non esiste una definizione precisa della sordità fluttuante, come, per esempio, per le sordità improvvise. Essa può essere clinica : episodi di sordità ravvicinati, più o meno regressivi, che possono lasciare delle sequele (Sauvage JP,e Al 2004.1. Essa può essere audiometrica, definita per alcuni come una variazione superiore a 10 dB tra due audiogrammi successivi (Marlin S., e Al,2006); oppure come una fluttuazione di 30 dB almeno su due ottave (Kakigi A. e Al,2003) .. Il quadro di sordità fluttuante raggruppa numerose entità differenti e complesse che è difficile sistematizzare. Le si può considerare secondo la loro evoluzione e si contrappongono, allora, le sordità fluttuanti con restitutio ad integrum uditiva, alle sordità fluttuanti con deterioramento progressivo dell’udito. Le si può considerare in funzione dell’età di comparsa, schematicamente, con le sordità del bambino che orientano verso le cause genetiche, le sindromi malformative o, anche, le cause infettive neonatali; le sordità dell’adulto devono far sospettare, in primo luogo, una sordità autoimmune o una malattia sistemica, quando sono bilaterali, oppure una fistola perilinfatica, quando sono monolaterali ed esiste un contesto traumatico associato.

Fig.1
Spesso si tratta di ipoacusie neurosensoriali che, pur avendo una modalità d’insorgenza simile all’ipoacusia improvvisa, recuperano spontaneamente i valori audiologici precrisi. Proprio il ripetersi nel tempo di queste poussèes di ipoacusia, non necessariamente accompagnate da risentimento vestibolare, giustifica il termine “fluttuanti”. Alcune evolvono verso una rilevante sordità, a volte bilaterale. La causa più frequente è la malattia di Ménière (Fig.1) con vertigini parossistiche presenti sin dall’inizio, oppure che si manifestano in un secondo momento dopo un intervallo di 6 mesi. Quando sono bilaterali, si deve pensare alla sifilide, alle malformazioni cocleari, alle malattie autoimmuni. Spesso la causa rimane sconosciuta. Il loro trattamento è tuttora dubbio.
Le sordità improvvise e fluttuanti sono due entità cliniche caratterizzate da una sordità di percezione senza causa individuabile che si sviluppano rapidamente: in pochi secondi, alcuni minuti o in qualche ora, al massimo 72 ore. [Tran Ba Huy P, 2002 ] La sordità improvvisa comporta un solo episodio irreversibile o più o meno regressivo. La sordità fluttuante comporta diversi episodi ravvicinati più o meno regressivi che possono lasciare delle sequele. Quando la sordità improvvisa si verifica nel quadro di una malattia conosciuta, oppure è rivelatrice di questa malattia, in Francia viene abitualmente indicata col termine di «sordità improvvisa». [Martin C, 2000 ]
Queste due entità non hanno altri criteri obbligatori dell’audiometria tonale con curve audiometriche in grado di assumere tutte le forme, posto che esse restino sordità di percezione pure con una perdita uditiva di almeno 30 dB [Tran Ba Huy P, 2002 ] su tre frequenze audiometriche contigue. Per quanto riguarda i sintomi associati, si ammette che una sordità improvvisa possa accompagnarsi ad acufeni e vertigini. Al contrario, quando una sordità fluttuante predomina sulle frequenze basse, si associa a vertigini parossistiche ed è di eziologia sconosciuta, per definizione, prende il nome di malattia di Ménière. [Ménière’s disease,1995 ] Rimane la difficoltà di trattare una patologia di cui si ignora la causa. Questa sfida potrebbe essere vinta da indagini cliniche prospettiche metodologicamente rigorose. Nel caso delle sordità improvvise, è difficile ottenere dimostrazioni dell’efficacia di un trattamento per il fatto che quasi due terzi dei pazienti recuperano in meno di 15 giorni. [Mattox DE, 1989 ] Quanto alle sordità fluttuanti, la loro nosologia deve ancora essere precisata prima di intraprendere studi simili.
In alcuni casi però, il ripetersi di tali episodi può indurre un progressivo deterioramento delle strutture neurosensoriali cocleari. e determinare quindi l’insorgenza di un’ipoacusia neurosensoriale di entità medio-grave.
L’iter diagnostico inizialmente è quindi di ricercare e riconoscere una causa poiché il sintomo «sordità improvvisa o sordità fluttuante» diventa un’entità clinica solo nel momento in cui non si è trovata alcuna eziologia. Questa delimitazione del soggetto è frustrante, ma non deve portare alla rinuncia. In effetti, si è concordi nel ritenere che vi siano molteplici eziopatogenesi sottostanti.
Il bilancio eziologico è negativo perché manca di esplorazioni dirette dell’orecchio interno. Il meccanismo eziologico ditale affezione rimane oscuro, La maggior parte degli Autori concorda per una sofferenza cocleare su base idropica come nella malattia di Ménière. Raggruppa probabilmente varie patologie: infezioni virali, blocchi microcircolatori, processi autoimmuni, rotture membranose(v. ipoacusia improvvisa). Le diagnosi differenziali principali sono con il neurinoma dell’acustico e le dissecazioni arteriose vertebrobasilari che possono manifestarsi con una sordità improvvisa. Per sperare un giorno di chiarire la loro diagnosi, bisogna conoscere le patologie in grado di interessare l’orecchio interno e le vie uditive. Bisogna anche seguire i numerosi lavori che tentano di conoscerne la fisiopatologia.
Soprattutto in caso di bilateralità è necessario escludere le malformazioni cocleari (es. EVA), le patologie autoimmuni, la sifilide.
Clinicamente l’ipoacusia fluttuante si caratterizza per un deficit uditivo che tende a manifestarsi improvvisamente per poi risolversi, completamente o parzialmente, nel giro di alcune ore o giorni. L’ipoacusia tende a ripresentarsi altre volte nel tempo con la stessa modalità, con frequenza imprevedibile e senza chiari fattori scatenanti. Possono concomitare acufeni.
In alcuni casi l’ipoacusia fluttuante può rappresentare il sintomo d’esordio di una malattia di Ménière, in cui la sintomatologia vertiginosa si manifesta in un secondo momento dopo un intervallo di alcuni mesi.
La diagnosi (strumentale) si avvale dell’esame audiometrico, che eseguito in fase acuta, dimostra la presenza di un deficit neurosensoriale. per lo più. localizzato inizialmente alle basse e medie frequenze, di lieve-media entità.
I principali elementi prognostici sono: la gravità della sordità, il tipo di curva audiometrica (ascendente, piatta o discendente) e la presenza di vertigini. È difficile dimostrare l’efficacia dei trattamenti per la frequenza di regressioni spontanee precoci
Il trattamento dell’ipoacusia fluttuante è tuttora dubbio e reso difficile dal fatto che la causa è per lo più sconosciuta. E inoltre difficile dimostrare l’efficacia dei vari trattamenti anche per la frequente regressione spontanea.
E stato proposta la combinazione di corticosteroidi e farmaci vasoattivi, Sono stati proposti anche altri trattamenti: carbogeno, antivirali, ecc.
Epidemiologia
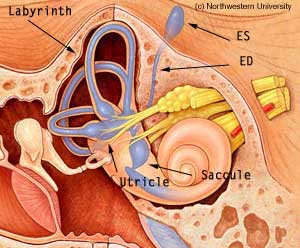
La dilatazione dell’acquedotto del vestibolo (Fig.2)
|
|
Non esistono stime a proposito delle sordità fluttuanti al di fuori della malattia di Ménière. Sono probabilmente molto basse. La dilatazione dell’acquedotto del vestibolo[endolymphatic duct (ED on figure above)] è la malformazione più frequente dell’orecchio interno. La sua incidenza è valutata tra lo 0,64% Levenson M.J., 1989 ; 9 e il 4% Koesling S.ed Al., 2006 ; secondo i criteri radiologici scelti. La sua prima descrizione è stata pubblicata nel 1978 da Valvassori, che constatava che questa anomalia colpiva due femmine per un maschio e che era associata ad altre malformazioni dell’orecchio interno nel 60% dei casi Clemis J., Valvassori G. 1978 ; 11. Questa malformazione può essere associata a vari gradi di sordità, che può essere progressiva, fluttuante o brusca [Phelps P.D. ed Al., 1997 ; Ramirez-Camacho R. ed Al., 2003], Fig.2 |
Eziopatogenesi
La causa di sordità improvvise e di sordità fluttuanti senza vertigini rimane misteriosa nonostante gli sforzi di ricercatori e clinici e malgrado i progressi nelle conoscenze sulla fisiologia cocleare. La maggior parte degli studi sono stati indirizzati soprattutto sulle sordità improvvise.
Eziologie genetiche e non genetiche sono coinvolte nelle sordità fluttuanti del bambino. In uno studio già vecchio Brookhouser P.E ed Al., 1998, basato su 229 bambini che presentavano una sordità progressiva o fluttuante, le eziologie supposte sono correlate nel 14% dei casi a una causa ereditaria, nel 14% dei casi a fattori di rischio neonatali, nell’8% dei casi a meningiti, nell’8% dei casi a idrope, nel 5% dei casi a fistole perilinfatiche e nel 4% dei casi a un trauma cranico, mentre, nel 47% dei casi, la causa presunta è incerta.
La possibilità di una causa virale o infettiva è una spiegazione comoda, spesso data al soggetto giovane. È noto in effetti che numerosi microrganismi possono provocare delle sordità improvvise: quelli della sifilide, della malattia di Lyme; e di virus: parotite, virus della varicella-zoster (VVZ), herpes simplex (VHS), virus para-influenzale, morbillo e rosolia. Il meccanismo alla base è sia una labirintite che una neurite. Il problema è di sapere se si può chiamare in causa un’infezione nella genesi di una sordità improvvisa al di fuori di qualsiasi contesto clinico evocatore di tale infezione.
Infezioni da spirochete
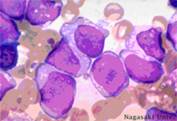
 La sifilide (Fig.3) è spesso asintomatica ed è una causa nota di sordità improvvisa o fluttuante che può essere trattata con penicillina G con qualche speranza di successo. È quindi sempre utile prescrivere i test fluorescent treponemal antibody absorption (FTA-Abs) e microhemagglutination- Treponema pallidum (MHA-TP). Tuttavia, bisogna ricordare la possibilità di avere reazioni crociate con il virus Epstein-Barr (EBV), il bacillo della lebbra e altre treponematosi. Vi è anche il fatto che tre quarti dei casi sono falsi-positivi in rapporto a un semplice cicatrice sierologica.
La sifilide (Fig.3) è spesso asintomatica ed è una causa nota di sordità improvvisa o fluttuante che può essere trattata con penicillina G con qualche speranza di successo. È quindi sempre utile prescrivere i test fluorescent treponemal antibody absorption (FTA-Abs) e microhemagglutination- Treponema pallidum (MHA-TP). Tuttavia, bisogna ricordare la possibilità di avere reazioni crociate con il virus Epstein-Barr (EBV), il bacillo della lebbra e altre treponematosi. Vi è anche il fatto che tre quarti dei casi sono falsi-positivi in rapporto a un semplice cicatrice sierologica.
 Nella malattia di Lyme, (Fig.4) è stato riportato il 10-15% dei casi con una sordità improvvisa, vertigini o una paralisi facciale. Questi effetti compaiono nel quadro di una neuroborelliosi tardiva. In Sud America, alcuni Autori ritengono che la malattia decorre più frequentemente in modo silente [21] e consigliano lo studio sistematico della sierologia nel siero e nel liquido cefalorachideo in caso di sordità improvvisa. Tuttavia, la tecnica enzyme-linked immunoassorbent assay (Elisa) fornisce molti falsi-positivi a causa di reazioni crociate con sifilide, mononucleosi, meningite tubercolare, leptospirosi e artrite reumatoide. Il tasso di immunoglobuline Ig M è elevato solo per pochi giorni dopo l’infezione. Quanto ai livelli di IgG, l’aumento è spesso tardivo ed è soprattutto utilizzato per confermare retrospettivamente la diagnosi. Il test sierologico immunoblot è più specifico del test Elisa. In realtà, nelle sordità improvvise, se si tiene conto solo di una sierologia per la diagnosi della malattia di Lyme, non c’è alcuna differenza clinica ed evolutiva tra i pazienti sieropositivi e quelli sieronegativi. In particolare, l’utilizzo di un’antibioticoterapia con ceftriaxone o amoxicillina non aumenta il tasso di recupero uditivo. [Lorenzi MC, ed Al. 2003]
Nella malattia di Lyme, (Fig.4) è stato riportato il 10-15% dei casi con una sordità improvvisa, vertigini o una paralisi facciale. Questi effetti compaiono nel quadro di una neuroborelliosi tardiva. In Sud America, alcuni Autori ritengono che la malattia decorre più frequentemente in modo silente [21] e consigliano lo studio sistematico della sierologia nel siero e nel liquido cefalorachideo in caso di sordità improvvisa. Tuttavia, la tecnica enzyme-linked immunoassorbent assay (Elisa) fornisce molti falsi-positivi a causa di reazioni crociate con sifilide, mononucleosi, meningite tubercolare, leptospirosi e artrite reumatoide. Il tasso di immunoglobuline Ig M è elevato solo per pochi giorni dopo l’infezione. Quanto ai livelli di IgG, l’aumento è spesso tardivo ed è soprattutto utilizzato per confermare retrospettivamente la diagnosi. Il test sierologico immunoblot è più specifico del test Elisa. In realtà, nelle sordità improvvise, se si tiene conto solo di una sierologia per la diagnosi della malattia di Lyme, non c’è alcuna differenza clinica ed evolutiva tra i pazienti sieropositivi e quelli sieronegativi. In particolare, l’utilizzo di un’antibioticoterapia con ceftriaxone o amoxicillina non aumenta il tasso di recupero uditivo. [Lorenzi MC, ed Al. 2003]
Ipotesi virale
Il primo a prenderla in seria considerazione è stato van Dishoeck nel 1957. Si Vedrà più avanti il dettaglio degli aspetti clinici e di laboratorio a favore e quelli contrari. Mentre è fuori di dubbio che l’agente virale riveste un ruolo causale diretto nelle sordità improvvise che si manifestano in corso di mononucleosi, herpes zooster oticus, parotite epidemica, rosolia e morbillo, il nesso causale è molto più sfumato per le assai più frequenti virosi delle vie aerodigestive.
Secondo Jaffe(1975) e Miyake(1988) i virus possono modificare la microcircolazione cocleare. Uno dei meccanismi potrebbe essere l’ipercoagulabilità, l’emoagglutinazione, l’edema endoteliale, tutti fenomeni secondari all’infezione virale. Nel dettaglio gli autori suggeriscono una diminuzione della deformabilità dei globuli rossi (lesione diretta della membrana cito-plasmatica dell’emazia) ed un effetto “sludge”. Si creerebbe quindi una perturbazione del microcircolo cocleare che ridurrebbe l’ossigenazione ed altererebbe la composizione ionica dell’endolinfa, con evidente sofferenza dell’organo del Corti.
|
Viremia |
Aumento della permeabilità vascolare |
|
Contaminazione dell’orecchio interno
|
Iperviscosità ematica |
|
|
Diminuzione del flusso ematico cocleare |
|
Alterazione del funzionamento enzimatico e degenerazione cellulare della coclea |
Ipossia |
|
Carenza di ATP+ Accumulo di radicali liberi dell’ O2
|
Diminuzione della glicolisi aerobia e aumento della glicolisi anaerobia |
|
|
Acidosi |
Tabella 1: Perturbazione del microcircolo cocleare secondario ad un’infezione virale (possibile interferenza sulla perfusione cocleare)
Ipotesi immunologica
Si comincia a parlare razionalmente di meccanismo immuno-mediato con Veldman nel 1986 e Mac Cabe nel 1991.
In analogia a quanto accade in altre condizioni patologiche come nel lupus eritematosus sistemico, la poliarterite nodosa, o la sindrome di Cogan, si dovrebbero rilevare autoanticorpi specifici per l’orecchio interno, nonché la formazione di immunocomplessi nella stria vascolare, nel sacco e nel dotto endolinfatico . Ed
infatti Therrocha(2002) dimostra anticorpi specifici e non, contro epitopi antigenici dell’orecchio interno in corso di ipoacusia improvvisa (collagene, cardiolipidi, fosfolipidi) ma, attenzione, anche contro le cellule endoteliali, come nelle varie vasculiti autoimmuni sistemiche.
Anche in questo caso ritorna dunque in primo piano l’effetto perturbante della patologia immunomediata sulla microcircolazione cocleare.
Se poi si pensa al fatto che questi anticorpi possono essere scatenati da agenti virali, sembra dimostrarsi come ciascuna delle ipotesi illustrate non debba necessariamente escludere le altre.
Ipotesi metabolica
Recenti lavori (Tiede, 2009)postulano come l’evento finale di tre importanti noxae patogene (rumore, ototossicità, invecchiamento)sia l’apoptosi, la morte delle cellule ciliate. La novità sta nell’avere individuato nell’eccesso di radicali liberi la causa scatenante(Tiede, 2009; Cotanche, 2008) (tavola2).
Si ricorda come i radicali liberi provengono dall’attività enzimatica mitocondriale, che appare molto elevata in condizione di stress funzionale (rumore, ototossicità, invecchiamento).
Orientamenti eziologici
Malformazioni dell’orecchio interno
Nell’adulto, diversi meccanismi o patologie appaiono essere responsabili di variazioni pressorie dei liquidi dell’orecchio interno, il che provoca una sintomatologia fluttuante. Si riscontrano le malformazioni descritte nel bambino e, in particolare, le dilatazioni dell’acquedotto del vestibolo (Figura 3, Figura 4, Figura 5 ) e della coclea. Queste anomalie devono essere sospettate sistematicamente in caso di sordità improvvisa che compare dopo una puntura lombare, una rachianestesia e un barotrauma dell’orecchio interno.
Malattia di Ménière Fig.5
Si riscontra anche la malattia di Ménière Herman P, ed Al.2003. . Benché il termine di Ménière non si debba applicare alle forme puramente cocleari o semplicemente vestibolari ,, la malattia può iniziare con una sordità fluttuante isolata. L’elemento semeiologico che orienta verso una patologia pressoria in genere, e, quindi, verso un’idrope, è una sordità fluttuante sulle  frequenze gravi in audiometria. Il test al glicerolo è positivo in circa il 60% dei casi: i criteri più comunemente riconosciuti sono un miglioramento di 10 dB almeno su due delle tre frequenze 500, 1 000 e 2 000 Hz 32.
frequenze gravi in audiometria. Il test al glicerolo è positivo in circa il 60% dei casi: i criteri più comunemente riconosciuti sono un miglioramento di 10 dB almeno su due delle tre frequenze 500, 1 000 e 2 000 Hz 32.
 Le circostanze dell’ipotensione endocranica sono o ricondotte a un gesto, puntura lombare , Michel O., Brusis T.,1992 rachianestesia Wang L.P., ed Al., 1993 , chirurgia della fossa posteriore o rachidea Walsted A., Walsted A., ed Al., 1994 o spontanee Christoforidis G.A., ed Al.,1998. . L’ipopressione si definisce quando il valore pressorio scende sotto i 60 cmH2O. La deplezione di LCS provoca una deplezione di liquido perilinfatico attraverso un acquedotto cocleare troppo pervio, responsabile di un’idrope. La terapia si basa sul riposo, poiché la sintomatologia si attenua con la nuova produzione di liquor. Sono state proposte la somministrazione di caffeina, di glucocorticoidi o di mineralcorticoidi, così come delle infusioni intradurali di soluzione fisiologica (5 ml/h) fino alla scomparsa dei segni uditivi 5. In caso di perdita documentata e localizzata al momento della realizzazione di una rachianestesia, un blood patch con iniezione di 30 ml di sangue autologo nello spazio peridurale permette di realizzare un coagulo di riempimento.
Le circostanze dell’ipotensione endocranica sono o ricondotte a un gesto, puntura lombare , Michel O., Brusis T.,1992 rachianestesia Wang L.P., ed Al., 1993 , chirurgia della fossa posteriore o rachidea Walsted A., Walsted A., ed Al., 1994 o spontanee Christoforidis G.A., ed Al.,1998. . L’ipopressione si definisce quando il valore pressorio scende sotto i 60 cmH2O. La deplezione di LCS provoca una deplezione di liquido perilinfatico attraverso un acquedotto cocleare troppo pervio, responsabile di un’idrope. La terapia si basa sul riposo, poiché la sintomatologia si attenua con la nuova produzione di liquor. Sono state proposte la somministrazione di caffeina, di glucocorticoidi o di mineralcorticoidi, così come delle infusioni intradurali di soluzione fisiologica (5 ml/h) fino alla scomparsa dei segni uditivi 5. In caso di perdita documentata e localizzata al momento della realizzazione di una rachianestesia, un blood patch con iniezione di 30 ml di sangue autologo nello spazio peridurale permette di realizzare un coagulo di riempimento.
Idrope post-traumatica Shea J.J., ed Al., 1995.
Shea suggerisce tre meccanismi che possono portare a un’idrope post-traumatica. La fistola perilinfatica è stata descritta sopra. Il secondo meccanismo ipotizzato è il trauma diretto del labirinto membranoso che può provocare, a causa della reazione infiammatoria locale, un’ipersecrezione di liquido endolinfatico responsabile di un’idrope transitoria. Il terzo meccanismo è un ostacolo meccanico alla circolazione dei liquidi del labirinto per lesione anatomica del labirinto osseo: blocco del canale endolinfatico per rimaneggiamenti fibroinfiammatori locali.
Idrope e otosclerosi Fig.7 Shea J.J., ed Al.,1994
La sordità fluttuante può essere secondaria alla chirurgia, facendo sospettare una fistola perilinfatica. Essa può essere primitiva: può trattarsi di un’associazione fortuita, ma l’otosclerosi può produrre un’idrope e Shea descrive tre meccanismi:
 • per difetto di riassorbimento di liquido, a causa di un focolaio che avvolge il canale o il sacco endolinfatico;
• per difetto di riassorbimento di liquido, a causa di un focolaio che avvolge il canale o il sacco endolinfatico;
• per alterazione del liquido endolinfatico nella sua composizione e nella sua densità;
• per alterazione del microcircolo locale: questa alterazione è stata dimostrata a livello del legamento spirale e non si può escludere una lesione vascolare lungo il canale e il sacco che altera il bilancio produzione/riassorbimento.
Istologia del diritto dell’orecchio interno ( Fig.7 ) mostra una coclea circondato da otospongiosis attivo (AO) all’interno di un focolaio otosclerotico inattiva (IO). Normale stria vascolare, idrope endolinfatica (H), estroflessione della membrana di Reissner (freccia), (S)
Sordità fluttuanti
Il paziente ricorre al medico per episodi di sordità unilaterali fluttuante in alcune ore, alcuni giorni o alcune settimane. Acufeni e sensazione di orecchio pieno sono quasi sempre segnalati da parte del paziente che si lamenta di avere l’orecchio tappato a intermittenza. Gli acufeni sono soprattutto a bassa frequenza a tipo di ronzio. Spesso, il paziente tenta senza successo di disostruire l’orecchio con manovre di Valsalva.
Anamnesi: Deve essere accurata alla ricerca di argomenti a favore (Tabella 2) :
§ di una malattia di Mènière: vertigini parossistiche;
§ di una fistola perilinfatica: sordità che si aggrava per gradi, storia di traumi pregressi, di rumori d’acqua, presenza di vertigini scatenate da cambiamenti di posizione, dai rumori forti (fenomeno di Tullio), dal soffiarsi il naso, dal sollevare un grosso peso oppure da sforzo violento alla defecazione;
§ di una malattia autoimmune : cheratite interstiziale, episodi di infiammazione della cartilagine del padiglione auricolare, lesioni renali ecc.
Nella maggior parte dei casi, la sordità è isolata senza altro segno associato.
|
Tabella 2 – Malattie rivelate da una sordità fluttuante. [ Martin C 1998] |
|||||||||
|
Audiogramma preliminare tonale: fatto al momento dell’episodio di sordità, mostra una sordità di percezione che predomina il più delle volte sulle basse frequenze, ma sono possibili tutte le forme di curve. [ Martin C., 1998 ]
Studio cocleovestibolare: completano l’audiometria tonale la ricerca di un segno di fistola, un test di Frazer. Il test di Metz, i PEA sono di solito in favore di una sordità di tipo endococleare. Si devono provare i test osmotici.
VNG con prova del calore: ricerca un interessamento vestibolare di tipo distruttivo sviluppato senza gravi disturbi in favore di un neurinoma se monolaterale o in favore di una patologia immunologica se è bilaterale.
Bilancio biologico: sierologia per la sifilide, VES, fondo dell’occhio, radiografia polmonare sono gli esami richiesti soprattutto in caso di sordità fluttuante bilaterale (Tabella 3).
|
Tabella 3 – Esami ematochimici ed immunitari «massimalisti». [ Tran Ba Huy P, Manach Y 2002 ] |
||||||||
|
||||||||
|
PCR: proteina C reattiva ; VES: velocità di eritrosedimentazione; ALT: alanina aminotrasferasi; AST: aspartato aminotransferasi; LDH: latticodeidrogenasi; CMV: citomegalovirus; HIV: virus dell’immunodeficienza umana; HBV: virus epatite B; HSV: virus herpes simplex; HVZ: virus herpes zoster; ANCA: autoanticorpi citoplasmatici antineutrofili. |
Studio per immagini: una sordità fluttuante predominante sulle frequenze acute, dei PEA precoci di tipo retrococleare impongono una RMN con gadolinio alla ricerca di una lesione della fossa posteriore, in particolare un neurinoma dell’acustico. Se esiste un’anomalia dell’orecchio esterno, l’esame tomografico delle rocche è necessario per ricercare una malformazione cocleare responsabile di idrope labirintica: sindrome di Mondini (Fig. 8) , sindrome dell’acquedotto largo.
Figura 8 :
Malformazione cocleare bilaterale tipo Mondini. Paziente di 51 anni che si era presentato con sordità di percezione fluttuante destra. Rare vertigini mal sistematizzate. Sordità di percezione bilaterale predominante sul lato destro con curva audiometrica piatta. Anomalie del padiglione auricolare. Precedenti di intervento per palatoschisi. A. Scansione assiale della rocca destra. Dilatazione del vestibolo. B. Scansione assiale della rocca sinistra. Dilatazione del vestibolo. C. Difetto di angolatura del padiglione auricolare.
Vi sono solo pochi dati della letteratura sull’evoluzione delle sordità fluttuanti. Nel 1976, su 52 pazienti colpiti da sordità fluttuante di cui 16 bilaterali, Martin [ Martin H, Martin C ,1997 ] dimostra che in 26 casi, vertigini e acufeni erano associati evocando sia dall’inizio che successivamente una malattia di Menière in 24 casi e una vertigine di Lermoyez in due. In quasi tutti questi pazienti, la curva audiometrica era di tipo A. Nei restanti 26 casi, le successioni di caduta uditiva, spesso notevole e improvvisa, erano seguite da recuperi il cui ritmo era molto variabile, talvolta accompagnati da acufeni a timbro acuto. La curva audiometrica era molto spesso di tipo C ma anche di tipo A. Il recupero uditivo poteva essere spontaneo o apparentemente indotto dal trattamento medico. L’evoluzione a lungo termine non è stata sempre peggiorativa. In molti pazienti, per un lungo periodo di tempo, è stata osservata sordità di percezione fluttuante per le frequenze basse, poi tardivamente una flessione verso le frequenze acute.
Così, la maggior parte delle sordità fluttuanti si integrano in una malattia di Menière sin dall’inizio o secondariamente. La malattia rimane puramente cocleare prima che appaiano le vertigini e che si possa essere quindi autorizzati a parlare di malattia di Menière. Un intervallo di 6 mesi è classico, ma può essere molto più lungo. Per definizione, la malattia di Menière comporta vertigini e in nessun caso si è autorizzati a parlare di forma cocleare della malattia di Menière perché nessun elemento permette di predire questo tipo di evoluzione. La fase più o meno lunga senza vertigini si spiegherebbe con il fatto che l’idrope esordisce all’apice della coclea. Il carattere fluttuante della sordità si spiega con la teoria delle rotture membranose di Schuknecht con contaminazione potassica della perilinfa seguita da cicatrizzazioni che spiegano il recupero uditivo. Nella teoria di Tonndorf, la dilatazione del canale cocleare provoca una rigidità della membrana basilare all’apice e quindi una sordità predominante per le basse frequenze. Le variazioni di sordità sarebbero soltanto il riflesso delle variazioni di distensione del canale cocleare. Le lunghe fasi senza vertigini si spiegherebbero anche con il fatto che la valvola otricoloendolinfatica(detta di Bast) resterebbe a lungo continente.
Se non si trovano altre cause, non esistono altre ipotesi patogenetiche al di fuori della malattia di Mènière. Sono stati a volte ipotizzati un conflitto arterovenoso o degli equivalenti emicranici. [ Baloh RW 1997 ]
Nel bambino, [ Dinces EA, ed Al.,2001 ] la diagnosi di fluttuazione è particolarmente difficile. L’origine immunologica potrebbe essere più frequente con test di trasformazione immunoblastica positivo. Spesso, la sordità fluttuante è bilaterale. Bisogna ricercare in particolare una storia clinica evocatrice di fistola perilinfatica. Essa deve essere quindi confermata con l’esplorazione chirurgica. La terapia cortisonica può essere proposta soltanto nei casi in cui la presunzione di eziologia autoimmune è forte. A questa età i risultati sembrano poco probanti e gli effetti collaterali troppo importanti.
Sordità fluttuanti monolaterali
Fistole perilinfatiche Fig.9
 Il termine di fistola perilinfatica indica una comunicazione tra le cavità dell’orecchio interno e dell’orecchio medio, o a livello della finestra cocleare o a livello della finestra vestibolare o attraverso una deiscenza traumatica o erosiva, soprattutto a livello del rilievo del canale semicircolare orizzontale o del promontorio. Questa entità è soggetta a numerosi dibattiti. Mentre non vi sono dubbi quando sono visualizzati dei segni diretti (pneumolabirinto, rima di frattura translabirintica, lisi del canale semicircolare laterale, che complicano un’otite cronica colesteatomatosa), essa è soggetta a controversie di fronte a qualsiasi patologia cocleovestibolare fluttuante monolaterale e post-traumatica.
Il termine di fistola perilinfatica indica una comunicazione tra le cavità dell’orecchio interno e dell’orecchio medio, o a livello della finestra cocleare o a livello della finestra vestibolare o attraverso una deiscenza traumatica o erosiva, soprattutto a livello del rilievo del canale semicircolare orizzontale o del promontorio. Questa entità è soggetta a numerosi dibattiti. Mentre non vi sono dubbi quando sono visualizzati dei segni diretti (pneumolabirinto, rima di frattura translabirintica, lisi del canale semicircolare laterale, che complicano un’otite cronica colesteatomatosa), essa è soggetta a controversie di fronte a qualsiasi patologia cocleovestibolare fluttuante monolaterale e post-traumatica.
I meccanismi traumatici lesivi che portano a lesioni della finestra cocleare sono rappresentati dal «colpo di pistone», che corrisponde a un brutale affondamento della staffa nella finestra, per una brutale compressione (blast timpanico e ricompressione rapida in discesa in immersione, per esempio). I meccanismi traumatici lesionali che provocano delle lesioni della finestra cocleare sono stati sistematizzati da Goodhill [Goodhill V. 1971/2]: via implosiva con rottura della finestra cocleare verso la scala tympani per una brutale iperpressione nella cassa del timpano (manovra di Valsalva intempestiva, breve e violenta) e via esplosiva con rottura della finestra per brutale iperpressione dei liquidi perilinfatici, secondaria a un’iperpressione del LCS, che può essere indotta da una manovra di Valsalva forzata e che richiede una pervietà aumentata del canale cocleare. Tuttavia, una sintomatologia fluttuante regressiva in un contesto traumatico può anche essere dovuta a un’idrope traumatica [Klingmann C., ed Al ,2004; Shea J.J., ed Al 1995].
Clinica
Il segno clinico è un’ipoacusia fluttuante, provocata dagli sforzi (tosse, defecazione, ecc.) o dal rumore (fenomeno di Tullio). Gli acufeni sono spesso presenti e variabili nella loro intensità. Infine, esistono spesso delle vertigini associate. Portmann propone l’uso di una scala diagnostica per valutare la probabilità di fistola Portmann D., ed Al., 2005 ; . Un punteggio superiore o uguale a 7 è fortemente suggestivo di fistola (Tabella 4 ).
Tabella 4 – Punteggio per sospetto di una fistola perilinfatica (secondo [Portmann D., ed Al., 2005 ].
Bilancio funzionale strumentale
L’audiometria oggettiva una sordità di percezione. Una sordità mista, in questo contesto, deve far sospettare in prima intenzione una lesione stapedia.
L’audiometria posizionale è interessante solo quando è positiva, cioè con un guadagno di 10 dB su più di tre frequenze in audiometria tonale, tenendo l’orecchio malato verso l’alto per 30 minuti (rispetto alle soglie audiometriche con il capo eretto e il paziente seduto) Hazell J.W., ed Al.,1992 , oppure con una perdita di 10 dB su più di tre frequenze, con l’orecchio malato rivolto verso il basso.
La timpanometria presenta un interesse diagnostico quando l’esame scatena un nistagmo realizzando il segno della fistola.
La prova calorica calibrata, in assenza di una perforazione timpanica e dopo la regressione dell’eventuale emotimpano, evidenzia spesso un’ipovalenza sul lato leso.
Diagnostica per immagini
La diagnostica per immagini di riferimento nella diagnosi delle fistole perilinfatiche è la TC dell’orecchio medio. Il segno diretto della fistola è la presenza di aria nel vestibolo: ciò esce dal contesto delle sordità fluttuanti ed è identificato su immagini precoci dopo il trauma. I segni indiretti si basano sullo studio delle densità delle finestre, sulla presenza di un’eventuale rima di frattura in prossimità, sull’esistenza di una lussazione stapedia e sulla presenza di un versamento liquido minimo nella cassa.
Quando gli elementi di sospetto di fistola sono notevoli, può essere proposta un’esplorazione chirurgica per l’esplorazione delle finestre e il riempimento.
Lesioni pressorie dell’orecchio interno: idrope
L’elemento clinico che orienta prioritariamente verso un’idrope è la comparsa di una sordità fluttuante sulle frequenze gravi, per le ragioni descritte in precedenza, vale a dire la dilatazione più facile a livello della porzione apicale del canale cocleare.
La timpanometria esclude un’alterazione della pervietà tubarica.
Sul piano audiometrico, si tratta di una sordità di percezione. I test osmotici hanno un interesse fondamentale: l’ingestione di una sostanza altamente osmotica crea un gradiente di osmolarità tra il settore vascolare e il settore labirintico, che induce uno spostamento di liquidi verso il settore vascolare e riduce la pressione labirintica. Questo effetto ha come conseguenza un miglioramento o un ripristino delle prestazioni uditive. Si utilizza tradizionalmente il glicerolo alla dose di 1,5 g/kg, in un soggetto a digiuno. Si può usare del mannitolo per via endovenosa.
Si realizza un’audiometria tonale prima della somministrazione della soluzione osmotica e 3-4 ore dopo. Classicamente, il test è considerato positivo se si ha un guadagno di 10 dB su almeno due delle tre frequenze seguenti: 500, 1 000 e 2 000 Hz. Herman P, ed Al.,2003. .
L’elettrococleografia registra tre tipi di potenziali:
• il potenziale microfonico, di origine sensoriale, poco utilizzato, che può essere eliminato con una stimolazione alternata;
• il potenziale di sommazione (PS), di origine sensoriale: in caso di idrope, questo potenziale è elevato e diminuisce al momento dei test osmotici;
• il potenziale d’azione composito (PA) di origine neurale: esso aumenta dopo la somministrazione di sostanze osmotiche.
Con un rapporto PS/PA superiore a 0,35, può essere affermata l’idrope Eggermont J.J.1979. In caso di idrope, questo rapporto PS/PA diminuisce dopo la somministrazione di una sostanza osmotica.
Marchbanks Measurement System-10 Tympanic Displacement Analyser (MMS-10)
Il principio di questo apparecchio è di determinare deboli variazioni di volume nel meato acustico esterno, indotte dai movimenti della membrana timpanica al momento della contrazione del muscolo della staffa. Questo spostamento dipende dalla posizione di riposo della platina della staffa, che è essa stessa in funzione della pressione del liquido perilinfatico Reid A., ed Al.,1989. In caso di iperpressione del liquido perilinfatico, la staffa a riposo è sospinta verso la cassa del timpano e la contrazione del muscolo della staffa induce uno spostamento all’interno e, quindi, un minimo spostamento timpanico all’interno. Dieci stimoli sonori a 20 dB al di sopra della soglia del riflesso stapedio su 1 000 Hz sono presentati sull’orecchio controlaterale all’orecchio testato. Lo stimolo dura 0,5 secondi e l’intervallo tra i due stimoli è di 5 secondi. Lo spostamento della membrana timpanica è calcolato come media sulle dieci stimolazioni e sono considerati due parametri: Vi (in nanolitri) è definito come lo spostamento massimo all’interno e Vm (in nanolitri) come lo spostamento medio a partire dal momento in cui è raggiunto Vi, fino all’interruzione della stimolazione. Dei valori negativi di Vi e Vm sono correlati ad alte pressioni perilinfatiche, mentre dei valori vicini a 0 oppure positivi indicano una bassa pressione Rosingh H.J., ed Al.,1996. Questo test non è praticabile in caso di perforazione timpanica e in caso di abolizione del riflesso stapedio, di lesione ossiculare e di patologia tubarica.
Test di valutazione funzionale del legamento anulare della staffa e di studio della conduttanza acustica G (TEFLAG)
Questo test permetterebbe di valutare la compliance del legamento anulare, misurata attraverso la frequenza di risonanza che si trova intorno ai 1 000 Hz, la suscettanza caratterizzata dall’autore come l’allungamento del sistema vibrante e la conduttanza, che è l’inverso delle forze resistive del legamento anulare. La frequenza di risonanza è direttamente legata alla pressione o alla tensione che si esercita sul legamento anulare. In caso di idrope, questa tensione aumenta e l’autore descrive un aumento della frequenza di risonanza (1 300 Hz) Camicas-Van Gout M., ed Al.,1999. .
In caso di sordità fluttuante bilaterale, sono, ovviamente, da ricercare le eziologie descritte precedentemente. A volte si deve, tuttavia, anche orientare l’iter diagnostico verso la ricerca di malattie sistemiche o autoimmuni. Sono raccomandati tre esami di base: il laboratorio con ricerca di proteinuria o di ematuria (lesione renale), un esame oftalmologico con lampada a fessura e fondo dell’occhio e degli esami di laboratorio specifici e non specifici. Il bilancio non specifico ricerca dei marcatori dell’infiammazione (fibrinogeno, proteina C reattiva [PCR]), un emocromo con conta piastrinica, uno ionogramma, una creatininemia, un dosaggio delle frazioni C3 e C4 del complemento, il fattore reumatoide, gli anticorpi antinucleari, gli anticorpi anticitoplasma dei polimorfonucleati neutrofili (ANCA) (e i loro sottotipi P [perinucleare] e C [citoplasmatico]) e i complessi immuni circolanti. Il bilancio specifico permette la diagnosi di lesione autoimmune dell’orecchio interno:
• autoimmunità cellulare mediante studio della reattività dei linfociti del paziente (inibizione della migrazione linfocitaria, trasformazione linfoblastica) testata contro estratti di orecchio interno;
• autoimmunità umorale mediante ricerca di autoanticorpi nel siero del paziente, con immunofluorescenza (su sezione di osso temporale) oppure con western blot (individuazione di proteine di estratti di orecchio interno che reagiscono con gli anticorpi del paziente) oppure con metodo enzyme-linked immunosorbent assay [Elisa] (che quantifica gli autoanticorpi).
Malattie sistemiche
La lesione dell’orecchio è associata ad altre lesioni viscerali.
 Questa sindrome associa una cheratite interstiziale, bilaterale, una sordità di percezione che evolve per puntate, aggravandosi progressivamente, una sindrome vestibolare spesso improvvisa e, in un terzo dei casi, una lesione multiviscerale: segni generali (febbre, dimagrimento), segni digestivi (diarree, rettorragie), segni neurologici (comizialità, neuropatia periferica, disturbi della coscienza), segni cardiovascolari (trombosi, stenosi arteriose) e disturbi locomotori (artralgie, mialgie). Si possono osservare un’epatosplenomegalia, delle adenopatie e delle pleuropneumopatie. Sul piano laboratoristico, si possono riscontrare dei complessi immuni circolanti, una caduta del complemento e un’iperleucocitosi. La malattia evolve per puntate e la terapia corticosteroidea, utile al momento delle puntate, sembra avere pochi risultati sull’evoluzione uditiva.
Questa sindrome associa una cheratite interstiziale, bilaterale, una sordità di percezione che evolve per puntate, aggravandosi progressivamente, una sindrome vestibolare spesso improvvisa e, in un terzo dei casi, una lesione multiviscerale: segni generali (febbre, dimagrimento), segni digestivi (diarree, rettorragie), segni neurologici (comizialità, neuropatia periferica, disturbi della coscienza), segni cardiovascolari (trombosi, stenosi arteriose) e disturbi locomotori (artralgie, mialgie). Si possono osservare un’epatosplenomegalia, delle adenopatie e delle pleuropneumopatie. Sul piano laboratoristico, si possono riscontrare dei complessi immuni circolanti, una caduta del complemento e un’iperleucocitosi. La malattia evolve per puntate e la terapia corticosteroidea, utile al momento delle puntate, sembra avere pochi risultati sull’evoluzione uditiva.
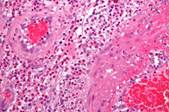
Policondrite atrofizzante Fig.11 Yetiser S., ed Al.,2001.
 È una connettivite che si caratterizza per un’infiammazione delle cartilagini che evolve per puntate. La sordità può essere fluttuante, brusca o progressiva. La lesione della cartilagine tubarica, all’origine di un’alterazione della pervietà tubarica, può essere responsabile di un fattore trasmissivo associato. Le cartilagini interessate sono quelle dell’orecchio, del naso e della laringe. Alle artralgie delle grosse articolazioni si possono associare delle lesioni oculari (congiuntivite, cheratite, uveite, sclerite), cardiovascolari (valvulopatie, aneurismi arteriosi), renali (glomerulonefrite necrotizzante a depositi di immunoglobuline) e cutanee. Sul piano laboratoristico, la presenza di anticorpi anticollagene di tipo II è evocatrice. Il trattamento si basa sui trattamenti immunosoppressori e sulla terapia corticosteroidea.
È una connettivite che si caratterizza per un’infiammazione delle cartilagini che evolve per puntate. La sordità può essere fluttuante, brusca o progressiva. La lesione della cartilagine tubarica, all’origine di un’alterazione della pervietà tubarica, può essere responsabile di un fattore trasmissivo associato. Le cartilagini interessate sono quelle dell’orecchio, del naso e della laringe. Alle artralgie delle grosse articolazioni si possono associare delle lesioni oculari (congiuntivite, cheratite, uveite, sclerite), cardiovascolari (valvulopatie, aneurismi arteriosi), renali (glomerulonefrite necrotizzante a depositi di immunoglobuline) e cutanee. Sul piano laboratoristico, la presenza di anticorpi anticollagene di tipo II è evocatrice. Il trattamento si basa sui trattamenti immunosoppressori e sulla terapia corticosteroidea.
Periarterite nodosa Fig.12 Tsunoda K., ed Al.,2001.
 È una vasculite necrotizzante che colpisce le arterie di calibro medio. La sordità è raramente fluttuante, ma più spesso brutale o progressiva. Le lesioni associate sono renali (insufficienza renale cronica, ipertensione arteriosa), digestive (infarto mesenterico), neurologiche (mononeuriti, polinevriti e accidenti vascolari cerebrali). Si riscontra la presenza di ANCA di tipo P. Il trattamento si basa sulla terapia corticosteroidea e sugli immunosoppressori.
È una vasculite necrotizzante che colpisce le arterie di calibro medio. La sordità è raramente fluttuante, ma più spesso brutale o progressiva. Le lesioni associate sono renali (insufficienza renale cronica, ipertensione arteriosa), digestive (infarto mesenterico), neurologiche (mononeuriti, polinevriti e accidenti vascolari cerebrali). Si riscontra la presenza di ANCA di tipo P. Il trattamento si basa sulla terapia corticosteroidea e sugli immunosoppressori.
Poliartrite reumatoide Fig.13
 La lesione otologica è, in questo caso, neurogena (alterazione dei potenziali evocati uditivi). È, il più delle volte, presente il fattore reumatoide, poco specifico; gli anticorpi antipeptide ciclico citrullinato (CCP), molto specifici, lo sono più raramente. Il trattamento di fondo si basa sul metotrexate, sugli anti-tumor necrosis factor (TNF), sugli anti-CD20 oppure sugli immunosoppressori.
La lesione otologica è, in questo caso, neurogena (alterazione dei potenziali evocati uditivi). È, il più delle volte, presente il fattore reumatoide, poco specifico; gli anticorpi antipeptide ciclico citrullinato (CCP), molto specifici, lo sono più raramente. Il trattamento di fondo si basa sul metotrexate, sugli anti-tumor necrosis factor (TNF), sugli anti-CD20 oppure sugli immunosoppressori.
Sindrome degli antifosfolipidi Fig.14
 È una malattia che si caratterizza per delle trombosi vascolari a ripetizione, con una possibile lesione dell’orecchio interno, e per la presenza di anticorpi antifosfolipidi (antiprotrombinasi e anticardiolipina).
È una malattia che si caratterizza per delle trombosi vascolari a ripetizione, con una possibile lesione dell’orecchio interno, e per la presenza di anticorpi antifosfolipidi (antiprotrombinasi e anticardiolipina).
Lupus eritematoso disseminato Fig.15
 È una connettivite caratterizzata dalla presenza di anticorpi antinucleari. La presenza di anticorpi antifosfolipidi sarebbe un fattore peggiorativo Compadretti G.C., ed Al.,2005.
È una connettivite caratterizzata dalla presenza di anticorpi antinucleari. La presenza di anticorpi antifosfolipidi sarebbe un fattore peggiorativo Compadretti G.C., ed Al.,2005.
Sindrome di Susac Fig.16 [Ayache D., ed Al.,2000 ; Clement P., ed Al.,2003 ; Grover N. ed Al.,2011 ]
 È una microangiopatia dell’orecchio interno, cerebrale e retinica, da cui il suo acronimo SICRET syndrome (small infarction of cochlear, retinal and encephalic tissue). Questa patologia interessa la donna giovane (20-40 anni). Essa deve essere ipotizzata davanti ad ogni sordità fluttuante associata a segni neurologici (disturbi della memoria, confusione, atassia, cefalee e disturbi visivi). La diagnosi si basa sul fondo dell’occhio (ostruzione dei rami dell’arteria centrale della retina) e sulla RM (lesione diffusa della sostanza bianca di origine ischemica). La terapia si basa sulla terapia corticosteroidea, sugli immunosoppressori, sulla plasmaferesi e sugli anticoagulanti.
È una microangiopatia dell’orecchio interno, cerebrale e retinica, da cui il suo acronimo SICRET syndrome (small infarction of cochlear, retinal and encephalic tissue). Questa patologia interessa la donna giovane (20-40 anni). Essa deve essere ipotizzata davanti ad ogni sordità fluttuante associata a segni neurologici (disturbi della memoria, confusione, atassia, cefalee e disturbi visivi). La diagnosi si basa sul fondo dell’occhio (ostruzione dei rami dell’arteria centrale della retina) e sulla RM (lesione diffusa della sostanza bianca di origine ischemica). La terapia si basa sulla terapia corticosteroidea, sugli immunosoppressori, sulla plasmaferesi e sugli anticoagulanti.
Si tratta di una sordità neurosensoriale fluttuante, progressiva e asimmetrica che progredisce per diversi anni e che è potenzialmente rapidamente reversibile sotto immunosoppressori 49. Essa coesiste, nel 15-30% dei casi, con una malattia autoimmune di tipo sistemico (cfr. supra). Gli autoanticorpi sembrano svolgere un ruolo fondamentale e se ne riscontra una grande varietà, contro i principali antigeni dell’orecchio interno che sono:
• il collagene di tipo II, che si esprime sulla membrana tectoria e sul legamento spirale. La presenza di anticorpi anticollagene II è, quindi, un indicatore, probabilmente non specifico (presenza in altre patologie) e legato a una buona corticosensibilità;
• la proteina P0, associata al nervo acustico (proteina della mielina). È possibile la ricerca degli anticorpi anti-P0;
• la proteina Raf-1; essa è presente nel labirinto membranoso; la presenza di anticorpi antiproteina Raf-1 non è, peraltro, specifica;
• la beta-actina, presente in tutte le cellule non muscolari e nelle cellule ciliate dell’organo di Corti. La presenza di anticorpi potrebbe compromettere il loro funzionamento;
• l’alfatubulina, presente nelle cellule di sostegno dell’organo di Corti, e le cellule neurosensoriali;
• la proteina colina COCH (o coclina), presente esclusivamente nell’orecchio interno dell’uomo, che è un precursore della colina fortemente espressa nella coclea e nel vestibolo.
 Nella sua forma omozigote, sono state descritte delle sordità fluttuanti improvvise. Esse sarebbero associate a un fenomeno vascolare e ostruttivo, a causa della rigidità e della deformazione delle emazie, scatenate in particolare dall’ipossia. Occorre, quindi, pensarvi in un soggetto di razza nera.
Nella sua forma omozigote, sono state descritte delle sordità fluttuanti improvvise. Esse sarebbero associate a un fenomeno vascolare e ostruttivo, a causa della rigidità e della deformazione delle emazie, scatenate in particolare dall’ipossia. Occorre, quindi, pensarvi in un soggetto di razza nera.
Arterite temporale a cellule giganti o malattia di Horton Fig.18
 Arterite che interessa il più delle volte i rami dell’arteria carotide e, in particolare, l’arteria temporale (cefalee, disturbi visivi transitori, claudicatio dei masseteri), occorre pensarvi anche davanti a un quadro menieriforme con accelerazione della velocità di sedimentazione. La diagnosi si basa sulla biopsia dell’arteria temporale.
Arterite che interessa il più delle volte i rami dell’arteria carotide e, in particolare, l’arteria temporale (cefalee, disturbi visivi transitori, claudicatio dei masseteri), occorre pensarvi anche davanti a un quadro menieriforme con accelerazione della velocità di sedimentazione. La diagnosi si basa sulla biopsia dell’arteria temporale.
 Può essere presente una sordità fluttuante e le soglie sarebbero correlate alla stanchezza e al grado di gravità dell’ipotiroidismo Anand V.T., ed Al.,1989 .
Può essere presente una sordità fluttuante e le soglie sarebbero correlate alla stanchezza e al grado di gravità dell’ipotiroidismo Anand V.T., ed Al.,1989 .
Diagnosi differenziale (cause di sordità improvvise e fluttuanti)
Numerose malattie sono responsabili di sordità improvvise e di sordità fluttuanti. Uno studio esauriente è stato realizzato da J.-B. Booth nel 1997 .. (562 riferimenti bibliografici). La difficoltà è di trovare la relazione tra sordità e quadro eziologico. Talvolta, questa relazione è evidente. Talvolta, essa è dubbia. Per farsi un’opinione, è utile conoscere le patologie in grado di essere in causa, anche se molto rare. È anche interessante conoscere il risultato dei trattamenti in caso di causa accertata, in particolare virale, vascolare o immunologica. Si possono classificare queste malattie in funzione della sede anatomica della lesione(Tabella 5) . Uno dei problemi è che la stessa malattia può ledere la funzione uditiva a vari livelli anatomici. Peraltro, molte cause coesistono in uno stesso paziente
|
Tabella 5 – Cause di sordità di percezione improvvise e fluttuanti. [Tran Ba Huy P, ed Al.2002] |
|||||||||||||||||||||
|
DIAGNOSI DIFFERENZIALE
L’ipoacusia improvvisa è per definizione idiopatica, non riconoscendosi mai una causa certa. È dunque nell’ambito della diagnostica differenziale che si inserisce la problematica delle patologie rivelate da una sordità improvvisa.
Diagnosi differenziale (cause di sordità improvvise e fluttuanti)
Numerose malattie sono responsabili di sordità improvvise e di sordità fluttuanti. Uno studio esauriente è stato realizzato da J.-B. Booth nel 1997 . (562 riferimenti bibliografici). La difficoltà è di trovare la relazione tra sordità e quadro eziologico. Talvolta, questa relazione è evidente. Talvolta, essa è dubbia. Per farsi un’opinione, è utile conoscere le patologie in grado di essere in causa, anche se molto rare. È anche interessante conoscere il risultato dei trattamenti in caso di causa accertata, in particolare virale, vascolare o immunologica. Si possono classificare queste malattie in funzione della sede anatomica della lesione(Tabella 6) . Uno dei problemi è che la stessa malattia può ledere la funzione uditiva a vari livelli anatomici. Peraltro, molte cause coesistono in uno stesso paziente. Alcune di queste sono molto rare, ma è comunque impor-tante concepirne il sospetto (Tab. 6).
Cocleari
Infiammatorie: batteri, spirochete, virus
Traumatiche
Vascolari
Ematologiche (anemia, embolia, disturbi della coagulazione)
Malattie autoimmuni, vasculiti
Idrope endolinfatica compreso la malattia di Ménière
Malattie metaboliche
Malattie ossee della capsula otica
Ototossici
Varie: sclerodermia, colite ulcerativa, sarcoidosi
Retrococleari e sistema nervoso centrale
Meningite in tutte le sue forme
Sclerosi o placche
Atassia di Friedreich
Sclerosi laterale amiotrofica
Sindrome di Vogt-Koyanagi-Koyanagi
Xeroderma pigmentoso
Tumori della fossa cranica posteriore (schwannoma vestibolare)
Sordità centrale
Idiopatica
Febbre tifoide. Fig.20
 La sordità, a volte bilaterale, compare tra la 2a e la 3a settimana. Il recupero è incostante.
La sordità, a volte bilaterale, compare tra la 2a e la 3a settimana. Il recupero è incostante.
Brucellosi. Fig.21
 L’VIII paio è uno dei nervi cranici più spesso colpito dalla neurobrucellosi (5% delle brucellosi). La lesione può comparire tardivamente, diversi mesi dopo l’esordio dei sintomi, ed essere accertata con un’emocoltura positiva per Brucella melitensis. I pazienti che presentano una neurobrucellosi hanno un’alterazione dei PEA, anche in assenza di sordità improvvisa. [ Thomas R, ed Al 1993 ] La terapia antibiotica con tetraciclina e rifampicina è abitualmente inefficace.
L’VIII paio è uno dei nervi cranici più spesso colpito dalla neurobrucellosi (5% delle brucellosi). La lesione può comparire tardivamente, diversi mesi dopo l’esordio dei sintomi, ed essere accertata con un’emocoltura positiva per Brucella melitensis. I pazienti che presentano una neurobrucellosi hanno un’alterazione dei PEA, anche in assenza di sordità improvvisa. [ Thomas R, ed Al 1993 ] La terapia antibiotica con tetraciclina e rifampicina è abitualmente inefficace.
Micoplasmi. Fig.22
 mycoplasma pneumoniae è una causa comune di infezioni respiratorie. Una lesione neurologica si verifica nel 5% dei casi. Numerose pubblicazioni dimostrano la coesistenza di un’infezione polmonare, seguita da otite media e da sordità profonda che più o meno regredisce con la doxiciclina. Le miringiti bollose si associano a sordità di percezione nella quasi totalità dei casi. [ Hariri MA., 1990 ] La sordità è quasi sempre moderata ma alcuni postumi persistono nel 20% circa dei casi. Il ruolo del mycoplasma pneumoniae è stato dimostrato solo raramente, ma bisogna sottolineare la difficoltà di avere dei prelievi utili.
mycoplasma pneumoniae è una causa comune di infezioni respiratorie. Una lesione neurologica si verifica nel 5% dei casi. Numerose pubblicazioni dimostrano la coesistenza di un’infezione polmonare, seguita da otite media e da sordità profonda che più o meno regredisce con la doxiciclina. Le miringiti bollose si associano a sordità di percezione nella quasi totalità dei casi. [ Hariri MA., 1990 ] La sordità è quasi sempre moderata ma alcuni postumi persistono nel 20% circa dei casi. Il ruolo del mycoplasma pneumoniae è stato dimostrato solo raramente, ma bisogna sottolineare la difficoltà di avere dei prelievi utili.
Labirintiti batteriche di origine otitica.
 Chlamydia trachomatis e Chlamydiae psittaci possono essere causa di sordità fluttuante bilaterale con disturbi dell’equilibrio che evolvono verso una cofosi bilaterale. La combinazione a sintomi oculari, cheratite interstiziale e uveite, ha permesso di isolare Chlamydiae psittaci. Il trattamento con doxiciclina non ha permesso il recupero. [ Booth JB 1997]
Chlamydia trachomatis e Chlamydiae psittaci possono essere causa di sordità fluttuante bilaterale con disturbi dell’equilibrio che evolvono verso una cofosi bilaterale. La combinazione a sintomi oculari, cheratite interstiziale e uveite, ha permesso di isolare Chlamydiae psittaci. Il trattamento con doxiciclina non ha permesso il recupero. [ Booth JB 1997]
 Nel tifo esantematico, causato dalla Rickettsia prowazekii, quando compare la sordità è precoce ed è sempre grave.
Nel tifo esantematico, causato dalla Rickettsia prowazekii, quando compare la sordità è precoce ed è sempre grave.
[ Friedman I, Frohlich A,1993]
Spirochetosi Fig.25
La sifilide e la malattia di Lyme (Borrelia burgdorferi) sono già state ricordate (vedi sopra).
Parotite. Era responsabile di sordità nello 0,1% dei casi. La sordità può apparire qualunque sia la gravità della parotite e anche in sua assenza. Nella maggior parte dei casi, è una cofosi o una sordità grave monolaterale quasi sempre definitiva che passa inosservata nel bambino. La sordità è solo eccezionalmente bilaterale e completa. Disturbi vestibolari esisterebbero nel 45% dei casi. La labirintite virale sarebbe di origine ematogena, colpirebbe la stria vascolare, creando gravi alterazioni nel sistema endolinfatico. Dal punto di vista anatomopatologico, si tratta di una labirintite. Il virus della parotite è stato messo in evidenza nella perilinfa di soggetti deceduti che hanno presentato negli anni precedenti una sordità improvvisa.
[ Westmore GA, Pickard BH,1979 ]
Morbillo e rosolia. Fig.26 [ Kobayashi H, ed Al.,1994 ]
 Sono malattie note da lungo tempo per essere causa di sordità. Questa si sviluppa di solito contemporaneamente all’eruzione. Tipicamente, è bilaterale e asimmetrica e predomina sui suoni acuti. I programmi mondiali di vaccinazione dovrebbero far scomparire queste tre malattie infantili. È stata riportata una sordità bilaterale dopo vaccinazione contro morbillo e parotite. [ Hulbert TV, ed Al.,1991 ]
Sono malattie note da lungo tempo per essere causa di sordità. Questa si sviluppa di solito contemporaneamente all’eruzione. Tipicamente, è bilaterale e asimmetrica e predomina sui suoni acuti. I programmi mondiali di vaccinazione dovrebbero far scomparire queste tre malattie infantili. È stata riportata una sordità bilaterale dopo vaccinazione contro morbillo e parotite. [ Hulbert TV, ed Al.,1991 ]
Varicella. Fig.27

Essa colpisce eccezionalmente il sistema nervoso centrale. Sono state descritte sordità bilaterali definitive.
Herpes zoster otico. Fig.28
 Comporta sordità improvvisa, vertigini, paralisi facciale ed eruzione nella zona di Ramsay-Hunt. La sordità è molto spesso totale. Generalmente, la diagnosi viene posta precocemente e si può intraprendere un trattamento con acyclovir a condizione che le funzioni renali siano normali. Le sequele sono tuttavia molto frequenti. La RMN in T1 con gadolinio dimostra, nell’herpes zoster otico, che si può avere un enhancement non soltanto del nervo facciale, ma anche dei nervi vestibolare e cocleare. Questo enhancement persisterebbe 6 settimane e talvolta fino a 6 mesi dopo l’esordio dei sintomi. [ Downie AC, ed Al.,1994] Al di fuori dello zoster otico caratteristico, si pone il problema di sapere se il HVZ può essere in causa nelle sordità improvvise o fluttuanti.
Comporta sordità improvvisa, vertigini, paralisi facciale ed eruzione nella zona di Ramsay-Hunt. La sordità è molto spesso totale. Generalmente, la diagnosi viene posta precocemente e si può intraprendere un trattamento con acyclovir a condizione che le funzioni renali siano normali. Le sequele sono tuttavia molto frequenti. La RMN in T1 con gadolinio dimostra, nell’herpes zoster otico, che si può avere un enhancement non soltanto del nervo facciale, ma anche dei nervi vestibolare e cocleare. Questo enhancement persisterebbe 6 settimane e talvolta fino a 6 mesi dopo l’esordio dei sintomi. [ Downie AC, ed Al.,1994] Al di fuori dello zoster otico caratteristico, si pone il problema di sapere se il HVZ può essere in causa nelle sordità improvvise o fluttuanti.
Mononucleosi infettiva. Fig.29
 Può raggiungere il sistema nervoso centrale nell’1% dei casi e in
Può raggiungere il sistema nervoso centrale nell’1% dei casi e in ![]() particolare essere responsabile di sordità improvvise di solito bilaterali e molto spesso transitorie. I casi descritti sono soggetti giovani e quasi tutti di sesso femminile. [ Booth JB .,1997]
particolare essere responsabile di sordità improvvise di solito bilaterali e molto spesso transitorie. I casi descritti sono soggetti giovani e quasi tutti di sesso femminile. [ Booth JB .,1997]
Febbre di Lassa. Fig.30
 Questo virus, il cui reservoir è rappresentato dal ratto, è responsabile di una febbre emorragica africana, fatale nel 30-70% dei casi. Circa il 30% dei pazienti colpiti presenta una sordità bilaterale nell’80% dei casi. Tra quelli che sopravvivono, il 15% conserva una sordità definitiva; possono recuperare, ma le terapie antivirali non sembrano ridurne la gravità. Il meccanismo sarebbe emorragico. Ciò rimette in discussione il fatto che il meccanismo lesivo dei virus potrebbe essere quello vascolare. Non ci sono dati disponibili sulla relazione tra sordità improvvisa e una forma inapparente di febbre di Lass a. [ Cummings D, ed Al.,1990 ]
Questo virus, il cui reservoir è rappresentato dal ratto, è responsabile di una febbre emorragica africana, fatale nel 30-70% dei casi. Circa il 30% dei pazienti colpiti presenta una sordità bilaterale nell’80% dei casi. Tra quelli che sopravvivono, il 15% conserva una sordità definitiva; possono recuperare, ma le terapie antivirali non sembrano ridurne la gravità. Il meccanismo sarebbe emorragico. Ciò rimette in discussione il fatto che il meccanismo lesivo dei virus potrebbe essere quello vascolare. Non ci sono dati disponibili sulla relazione tra sordità improvvisa e una forma inapparente di febbre di Lass a. [ Cummings D, ed Al.,1990 ]
AIDS. Fig.31
 L’HIV può raggiungere l’orecchio esterno, medio e interno.
L’HIV può raggiungere l’orecchio esterno, medio e interno.
[ Linstrom CJ, ed Al.,1993 ] Inoltre, agenti opportunistici quali Toxoplasma, Pneumocystis carinii o Aspergillus possono provocare una meningite con le proprie sequele uditive. L’HIV aumenta il rischio di manifestare una sifilide. Infine, un tumore del sistema nervoso centrale come un linfoma o, più raramente, una metastasi da sarcoma di Kaposi può ledere la funzione uditiva più o meno improvvisamente. Casi di sordità improvvise e di sordità fluttuanti sono stati descritti nel corso delle infezioni HIV al di fuori dei meccanismi descritti sopra. Sono spesso bilaterali.
Protozoarie Fig.32
 Per diffusione ematogena, il toxoplasma gondii può raggiungere il sistema nervoso centrale, ma molto raramente nel soggetto immunocompetente. Le lesioni dell’udito sono eccezionali nelle toxoplasmosi acquisite. La lesione talvolta bilaterale può presentare uno sfasamento di diversi mesi tra le due orecchie.
Per diffusione ematogena, il toxoplasma gondii può raggiungere il sistema nervoso centrale, ma molto raramente nel soggetto immunocompetente. Le lesioni dell’udito sono eccezionali nelle toxoplasmosi acquisite. La lesione talvolta bilaterale può presentare uno sfasamento di diversi mesi tra le due orecchie.
Benché non rientrino nel quadro delle sordità improvvise quando il trauma è evidente, si può porre talvolta il rapporto con un trauma o un intervento iatrogeno. I traumi della rocca e fistole perilinfatiche: realizzano una comunicazione anomala tra i compartimenti liquidi e perilinfatici dell’orecchio interno e l’orecchio medio. La perilinfa filtra attraverso una deiescenza della fine-stre rotonda od ovale o di uno dei canali semicircolari24-25. Questa perdita di liquidi altera la trasmissione meccanica dello stimolo sonoro. Il trauma può essere esterno con iper-pressione o ipo-pressione improvvisa trasmessa o dallo spazio cefalorachidiano all’orecchio medio (tipo esplosivo) o dall’interno attraverso la tuba di Eustachio in occasione di un starnuto violento o dall’esterno grazie ad una perforazione traumatica in occasione o di uno schiaffo (tipo implosivo). Secondo quest’ultimo meccanismo, è stato descritto un caso di sordità improvvisa dopo salto da una scogliera26. Questo stesso meccanismo è proposto per le sordità improvvise che sopraggiungono nel quadro di un incidente automobilistico con esplosione di “air bag”27. La fistola può essere diagnosticata dal test audiometrico di Frazer che paragona le curve raccolte in posizione seduta ed in decubito laterale sul lato sano. Questo test è positivo se si ottiene una variazione delle soglie di almeno 10 dB su due frequenze. È soprattutto l’associazione di manifestazioni vertiginose o di instabilità breve scatenate dai cambiamenti di posizione, dalle variazioni di pressione (immersione, starnuti, tosse, sforzi) o per suoni forti che depongono in favore di tale diagnosi. Il segno della fistola è particolarmente utile ma ritrovato raramente
Le diminuzioni di pressione intracranica
Una sordità improvvisa può osservarsi dopo una diminuzione della pressione intracranica secondaria ad una puntura lombare, ad una mielografia, o secondaria a chirurgia del rachide28. Il meccanismo supposto è quello di una perdita di liquido cefalorachidiano che abbassa la pressione intra-cranica sotto i 60 mm H2O. A causa della permeabilità dell’acque-dotto cocleare, questa diminuzione di pressione provoca una diminuzione di pressione perilinfatica che a sua volta induce una iperpressione endolinfatica relativa, realizzando un’idrope endolinfatica di origine peri-linfatica. Lo stesso meccanismo è alla base della fistola perilinfatica. La diagnosi si basa sulla misurazione diretta della pressione del liquido cefalorachidiano o sulle misurazioni indirette di spostamento timpanico (apparecchio di Marchbranks), sui segni radiologici nella RMN. Il tratta-mento terapeutico consiste empiricamente nel riposo a letto, nell’assun-zione di caffeina e di corticosteroidi e nella tecnica definita “blood-patch” che consiste nell’iniezione di sangue autologo nello spazio epidurale nelle vicinanze del sito della puntura lombare precedente realizzando così un coagulo che colma la breccia.
Quando i pazienti sono al telefono durante un temporale.
Può essere coinvolta dopo irradiazione della parotide o del rinofaringe. C’è una correlazione tra la dose ricevuta dall’orecchio interno e il grado della sordità di percezione. Il peggioramento avviene per fasi più o meno brusche e può essere ritardato rispetto alla fine dell’irradiazione. L’esame anatomopatologico delle ossa temporali mostra lesioni delle strutture membranose dell’orecchio interno. [ Smouha EE, Karmody YS 1995 ]
Casi di sordità improvvisa compaiono dopo un intervento chirurgico. Essi sono generalmente ascritti a un microembolismo nel territorio cocleare dell’arteria labirintica. Tuttavia, differenti studi non mostrano rischi particolari per interventi sulle coronarie, o che necessitano di ipotermia. [ Ness JA, ed Al.,1993 ]
 Sono stati descritti alcuni casi di sordità dopo anestesia per patologie non otologiche. [In-Hoo Kim,ed Al.2008] Molti di questi pazienti erano stati operati in precedenza di stapedotomia.
Sono stati descritti alcuni casi di sordità dopo anestesia per patologie non otologiche. [In-Hoo Kim,ed Al.2008] Molti di questi pazienti erano stati operati in precedenza di stapedotomia.
[ Hochermann M, Reimer A,1987 ] In questi casi, deve essere sospettata una fistola perilinfatica.
Mielografia, rachidea, chirurgia del rachide
A volte si riscontra una sordità transitoria, spesso associata a sintomi vestibolari. La sordità colpisce le basse frequenze. Di solito è bilaterale ed è associata a cefalea. In effetti, nelle rachianestesie, è stato portato in causa il diametro dell’ago perché favorente la perdita di liquido cefalorachideo negli spazi subaracnoidei provocando una ipopressione endocranica. In questi pazienti, se l’acquedotto cocleare è permeabile, [ Michel O, Brusis T 1992 ] avviene anche una fuga di perilinfa con ipopressione perilinfatica e idrope labirintica. È stata suggerita la tecnica del blood patch, che utilizza una iniezione di 10 mL di sangue autologo nello spazio epidurale nelle vicinanze del sito della puntura lombare precedente.
Sono state portate in causa nella sordità improvvisa anche le estrazioni dentarie. La sordità può insorgere qualche ora o qualche giorno dopo. [ Farrel RW, ed Al.,1991 ]
Mentre le cause vascolari sono spesso invocate per spiegare le sordità improvvise, è raro riscontrare casi in cui una tale causa sia certa.
Accidenti ischemici periferici
La sordità improvvisa associata a violente vertigini entra nel quadro di un accidente ischemico nel territorio vertebrobasilare, per esempio una trombosi dell’arteria cerebellare antero-inferiore . L’esecuzione sistematica di una RMN dovrebbe aumentare la frequenza della loro scoperta. In tal modo, in 37 pazienti colpiti da sordità improvvisa, la RMN sistematica con, quando necessaria, angiografia convenzionale dell’arteria vertebrale ha permesso di scoprire 11 accidenti vascolari costituiti e fra di essi tre dissecazioni vertebrobasilari. Queste dissecazioni, annunciate classicamente da violente rachialgie, ma non sempre, sono caratterizzate da un ematoma intramurale interessante l’origine dell’arteria cerebellare antero-inferiore [ Nagahata M, ed Al.,1997 ] visibile in T1 o da uno sdoppiamento del lume dell’arteria basilare nelle sequenze 3 D spoiled gradient-recalled acquisition in steady state (SPGR). L’angiografia può anche dimostrare una dilatazione aneurismatica di questa arteria, responsabile di sordità improvvise a ripetizione. [ Rinehart R, ed Al.,1992 ] In altri casi, la sordità improvvisa associata a paralisi facciale è compresa nel quadro clinico di un accidente ischemico del tronco cerebrale. Numerose osservazioni di sordità improvvise sono state riportate dopo manipolazioni vertebrali nei soggetti giovani. Una stenosi o una dissecazione di un’arteria vertebrale o del tronco basilare ha potuto quindi essere messa in evidenza.
Sono caratterizzate dalla comparsa di un quadro clinico con trombosi a ripetizione, comprese le embolie polmonari. Sono stati pubblicati casi di sordità improvvisa. [ Einer H, ed Al1994 ]
 Alcuni casi di sordità improvvise bilaterali sono stati pubblicati, associati ad anemia grave con livelli di emoglobina inferiori a 6,5 g/dl con deficit in ferro. Le trasfusioni non hanno dato alcun miglioramento. Dei casi di sordità improvvise sono stati descritti nelle anemie aplasiche e anche nella sindrome di Fanconi. C’era sempre una caduta improvvisa del numero delle piastrine subito prima della sordità. [ Ogawa K, Kanzaki J ,1994 ]
Alcuni casi di sordità improvvise bilaterali sono stati pubblicati, associati ad anemia grave con livelli di emoglobina inferiori a 6,5 g/dl con deficit in ferro. Le trasfusioni non hanno dato alcun miglioramento. Dei casi di sordità improvvise sono stati descritti nelle anemie aplasiche e anche nella sindrome di Fanconi. C’era sempre una caduta improvvisa del numero delle piastrine subito prima della sordità. [ Ogawa K, Kanzaki J ,1994 ]
 I n questa patologia, la viscosità del sangue può essere moltiplicata per 8, mentre la massa eritrocitaria circolante può essere moltiplicata per 3. Tuttavia, i casi di sordità improvvisa sono rari e non sembrano migliorare con il salasso. [ Booth JB ,1997 ]
I n questa patologia, la viscosità del sangue può essere moltiplicata per 8, mentre la massa eritrocitaria circolante può essere moltiplicata per 3. Tuttavia, i casi di sordità improvvisa sono rari e non sembrano migliorare con il salasso. [ Booth JB ,1997 ]
Drepanocitosi Fig.36
 Nella forma omozigote, le sordità di percezione progressive sono frequenti e sarebbero legate alla riduzione del FEC per ostruzione delle piccole arteriole e dei capillari da parte di globuli rossi deformati e rigidi. Si pensa che le prime perdite uditive improvvise possono iniziare fin dalla prima infanzia. Sordità improvvise possono insorgere a qualsiasi età. La sordità può anche essere di tipo fluttuante. Si deve ipotizzarla quando il paziente è di origine africana. [Odetoyinbo O, Adekile A .,2002 ]
Nella forma omozigote, le sordità di percezione progressive sono frequenti e sarebbero legate alla riduzione del FEC per ostruzione delle piccole arteriole e dei capillari da parte di globuli rossi deformati e rigidi. Si pensa che le prime perdite uditive improvvise possono iniziare fin dalla prima infanzia. Sordità improvvise possono insorgere a qualsiasi età. La sordità può anche essere di tipo fluttuante. Si deve ipotizzarla quando il paziente è di origine africana. [Odetoyinbo O, Adekile A .,2002 ]
 Le sordità di percezione in tale patologia sarebbero frequenti e legate a una iperviscosità ematica che rallenta il FEC. Sordità improvvise sono state descritte, talvolta bilaterali, a volte recidivanti. Esse potrebbero essere migliorate dalla plasmaferesi. Il meccanismo è differente dalle vertigini che sono legate a depositi di macroglobuline sulla cupola. Nel caso di sordità improvvise, si tratterebbe di emorragie labirintiche. [ Booth JB ,1997]
Le sordità di percezione in tale patologia sarebbero frequenti e legate a una iperviscosità ematica che rallenta il FEC. Sordità improvvise sono state descritte, talvolta bilaterali, a volte recidivanti. Esse potrebbero essere migliorate dalla plasmaferesi. Il meccanismo è differente dalle vertigini che sono legate a depositi di macroglobuline sulla cupola. Nel caso di sordità improvvise, si tratterebbe di emorragie labirintiche. [ Booth JB ,1997]
 Le sordità improvvise riscontrate nelle leucemie acute sono note da molto tempo. Sarebbero legate a tre meccanismi:
Le sordità improvvise riscontrate nelle leucemie acute sono note da molto tempo. Sarebbero legate a tre meccanismi:
[ Booth JB ,1997 ] infiltrazione leucocitaria, emorragie o labirintiti infettive. Una sordità improvvisa a bascula è stata rivelatrice di leucemia linfoide cronica. La chemioterapia può dare eccellenti risultati.
Malattie autoimmuni
L’insorgenza di sordità improvvise è descritta in un certo numero di malattie autoimmuni non organo-specifiche.
Lupus eritematoso sistemico Fig.39
 È un’affezione infiammatoria del tessuto connettivo di origine sconosciuta che si verifica nelle donne giovani e anche nei bambini. Il siero di questi pazienti contiene anticorpi antinucleo. Sordità improvvise bilaterali e deficit cocleovestibolari improvvisi sono stati riscontrati in questa patologia con livelli elevati di anticorpi anticardiolipina solitamente correlati a episodi di trombosi arteriosa o venosa. [ Vyse T, ed Al.,1994 ]
È un’affezione infiammatoria del tessuto connettivo di origine sconosciuta che si verifica nelle donne giovani e anche nei bambini. Il siero di questi pazienti contiene anticorpi antinucleo. Sordità improvvise bilaterali e deficit cocleovestibolari improvvisi sono stati riscontrati in questa patologia con livelli elevati di anticorpi anticardiolipina solitamente correlati a episodi di trombosi arteriosa o venosa. [ Vyse T, ed Al.,1994 ]
 Policondrite atrofizzante Fig.40
Policondrite atrofizzante Fig.40
In questa patologia infiammatoria intermittente distruttiva della cartilagine e del tessuto connettivo dell’occhio, sono tipici la sordità mono o bilaterale a esordio improvviso e i disturbi vestibolari. [ Albers FW, ed Al.,1991 ]
Vasculiti sistemiche Fig.41
 Esse sono attualmente in piena riclassificazione in funzione della grandezza dei vasi colpiti, dell’introduzione di test per gli autoanticorpi citoplasmatici antineutrofili (ANCA) e le loro sotto-classi in tipo c (citoplasmatica) e tipo p (perinucleare) e gli autoanticorpi cellulari anti-endoteliali circolanti (AECA).
Esse sono attualmente in piena riclassificazione in funzione della grandezza dei vasi colpiti, dell’introduzione di test per gli autoanticorpi citoplasmatici antineutrofili (ANCA) e le loro sotto-classi in tipo c (citoplasmatica) e tipo p (perinucleare) e gli autoanticorpi cellulari anti-endoteliali circolanti (AECA).
Periarterite nodosa (PAN) Fig.42
 È una malattia caratterizzata da infiammazione e necrosi segmentaria di arterie muscolari di medio calibro con ischemia secondaria del tessuto irrorato dai vasi colpiti. Sordità improvvise e fluttuanti, a volte con interessamento vestibolare, sono descritte nel corso dell’evoluzione di questa malattia ma sono raramente inaugurali. Lo studio anatomopatologico dell’osso temporale mostra un’ostruzione dell’arteria cocleare comune. [ Schuknecht HF, Donovan ED 1986 ]
È una malattia caratterizzata da infiammazione e necrosi segmentaria di arterie muscolari di medio calibro con ischemia secondaria del tessuto irrorato dai vasi colpiti. Sordità improvvise e fluttuanti, a volte con interessamento vestibolare, sono descritte nel corso dell’evoluzione di questa malattia ma sono raramente inaugurali. Lo studio anatomopatologico dell’osso temporale mostra un’ostruzione dell’arteria cocleare comune. [ Schuknecht HF, Donovan ED 1986 ]
 Diversa, ma simile alla periarterite nodosa tipica, associa una sordità a una cheratite con lacrimazione (crying deafness). Le sindromi deficitarie cocleovestibolari mono o bilaterali rapidamente progressive, perfino repentine, fanno parte del quadro clinico. La RMN [ Booth JB ,19976] e l’esame anatomopatologico [ Schuknecht HF, Nadol JB ,1994 ] suggeriscono che si tratti di una vasculite ostruttiva della stria vascolare.
Diversa, ma simile alla periarterite nodosa tipica, associa una sordità a una cheratite con lacrimazione (crying deafness). Le sindromi deficitarie cocleovestibolari mono o bilaterali rapidamente progressive, perfino repentine, fanno parte del quadro clinico. La RMN [ Booth JB ,19976] e l’esame anatomopatologico [ Schuknecht HF, Nadol JB ,1994 ] suggeriscono che si tratti di una vasculite ostruttiva della stria vascolare.
Sordità improvvise sono state descritte in corso di altre malattie autoimmuni con vasculite: [6] arterite di Takayasu con vasculite dell’aorta nella donna giovane orientale o malattia delle donne senza polso; malattia di Kawasaki che compare nel bambino con vasculite coronarica; malattia di Behçet, malattia infiammatoria polisistemica che inizia con ulcerazioni della bocca simili ad afte.
Arterite temporale a cellule giganti Fig.44
 Si tratta di una malattia infiammatoria dei grandi vasi che colpisce più spesso i rami della carotide, in particolare l’arteria temporale (cefalea, disturbi visivi transitori, claudicatio del massetere e della lingua), caratterizzata da un forte aumento della VES che supera 100 mm alla prima ora. La diagnosi si effettua mediante biopsia dell’arteria temporale. Sono state riportate sordità improvvise e fluttuanti. Si deve prenderle in considerazione [ McKennan KX, ed Al.,1993 ] quando un soggetto anziano presenta una sindrome distruttiva cocleovestibolare improvvisa, mono o bilaterale, o una pseudomalattia di Menière con una VES elevata e quando il quadro si completa più o meno rapidamente con paralisi facciale, disturbi della visione, paralisi del decimo nervo cranico. La RMN mostra lesioni ischemiche multiple, recenti, soprattutto nel territorio vertebrobasilare, che corrispondono a un’occlusione dell’arteria vertebrale.
Si tratta di una malattia infiammatoria dei grandi vasi che colpisce più spesso i rami della carotide, in particolare l’arteria temporale (cefalea, disturbi visivi transitori, claudicatio del massetere e della lingua), caratterizzata da un forte aumento della VES che supera 100 mm alla prima ora. La diagnosi si effettua mediante biopsia dell’arteria temporale. Sono state riportate sordità improvvise e fluttuanti. Si deve prenderle in considerazione [ McKennan KX, ed Al.,1993 ] quando un soggetto anziano presenta una sindrome distruttiva cocleovestibolare improvvisa, mono o bilaterale, o una pseudomalattia di Menière con una VES elevata e quando il quadro si completa più o meno rapidamente con paralisi facciale, disturbi della visione, paralisi del decimo nervo cranico. La RMN mostra lesioni ischemiche multiple, recenti, soprattutto nel territorio vertebrobasilare, che corrispondono a un’occlusione dell’arteria vertebrale.
Granulomatosi di Wegener Fig.45
 Caratterizzata all’inizio da lesioni infiammatorie granulomatose delle vie aeree superiori, è stata descritta una sordità improvvisa allo stadio di vasculite disseminata. Il trattamento comprende la ciclofosfamide associata ai corticosteroidi.
Caratterizzata all’inizio da lesioni infiammatorie granulomatose delle vie aeree superiori, è stata descritta una sordità improvvisa allo stadio di vasculite disseminata. Il trattamento comprende la ciclofosfamide associata ai corticosteroidi.
La sordità improvvisa è stata descritta come il sintomo rivelatore di una sarcoidosi29-30 o di una periartrite nodosa31.
Idrope endolinfatica e malattia di Menière Fig.46
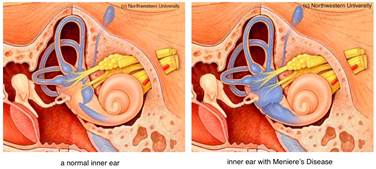 Nel 1985, il «Committe on Hearing and Equilibrium of the American Academy of Otolaryngology – Head and Neck Surgery» ha deciso che il termine Menière non doveva più essere applicato alle forme puramente cocleari o vestibolari della malattia. [ Committee on hearing and equilibrium Guidelines 1995 ] Si sa tuttavia che la malattia di Menière può esordire con sordità improvvisa predominante sulle frequenze basse o con una sordità fluttuante monolaterale che si completa secondariamente con vertigini parossistiche in circa il 10% dei casi. [ Yamasoba T, [ McKennan KX, ed Al.,1994 ] In questi pazienti, in più del 60% dei casi, il test al glicerolo era positivo e c’era un aumento significativo del rapporto potenziale di sommazione/potenziale d’azione (SP/AP) al PEA.
Nel 1985, il «Committe on Hearing and Equilibrium of the American Academy of Otolaryngology – Head and Neck Surgery» ha deciso che il termine Menière non doveva più essere applicato alle forme puramente cocleari o vestibolari della malattia. [ Committee on hearing and equilibrium Guidelines 1995 ] Si sa tuttavia che la malattia di Menière può esordire con sordità improvvisa predominante sulle frequenze basse o con una sordità fluttuante monolaterale che si completa secondariamente con vertigini parossistiche in circa il 10% dei casi. [ Yamasoba T, [ McKennan KX, ed Al.,1994 ] In questi pazienti, in più del 60% dei casi, il test al glicerolo era positivo e c’era un aumento significativo del rapporto potenziale di sommazione/potenziale d’azione (SP/AP) al PEA.
Insufficienza renale Fig.47[ Booth JB ,1997 ]
 Il danno uditivo non è legato all’insufficienza renale ma al trattamento stesso. Antibiotici aminoglicosidici e diuretici hanno una posologia difficile da adattare. Durante l’emodialisi, le variazioni osmotiche sono responsabili di sordità fluttuanti. Si tratta soprattutto di fluttuazioni sulle frequenze basse. Dopo trapianto, sono state osservate sordità improvvise di cui alcune sono inspiegabili mentre altre sono legate a uno stato d’ipercoagulabilità
Il danno uditivo non è legato all’insufficienza renale ma al trattamento stesso. Antibiotici aminoglicosidici e diuretici hanno una posologia difficile da adattare. Durante l’emodialisi, le variazioni osmotiche sono responsabili di sordità fluttuanti. Si tratta soprattutto di fluttuazioni sulle frequenze basse. Dopo trapianto, sono state osservate sordità improvvise di cui alcune sono inspiegabili mentre altre sono legate a uno stato d’ipercoagulabilità
Sindrome di Alport. Fig.48
 Si tratta di una nefrite ereditaria che provoca una sordità neurosensoriale progressiva e spesso simmetrica. Sono stati riportati alcuni casi di sordità improvvisa. L’esame della stria vascolare mostra una sua degenerazione.
Si tratta di una nefrite ereditaria che provoca una sordità neurosensoriale progressiva e spesso simmetrica. Sono stati riportati alcuni casi di sordità improvvisa. L’esame della stria vascolare mostra una sua degenerazione.
Nefropatia da Iga. Fig.49
 Sono stati riportati casi di sordità improvvisa reversibili conseguenti a terapia cortisonica endovenosa.
Sono stati riportati casi di sordità improvvisa reversibili conseguenti a terapia cortisonica endovenosa.
Diabete mellito Fig.50
 Un rapporto tra sordità e diabete è sospettato da tempo ma sembra difficile da dimostrare sul piano statistico. [Virtaniemi J, ed Al.,1994 ] Nel caso delle sordità improvvise, la causa potrebbe essere una neuropatia periferica, ma nei diabetici insulinodipendenti, i PEA non sono di tipo retrococleare. Inoltre, il tasso di recupero non differisce dal gruppo controllo, fatta eccezione forse per quel che riguarda le frequenze acute. L’esame dell’osso temporale dei soggetti diabetici mostra la presenza quasi costante di una microangiopatia della stria vascolare e dei microvasi del sacco endolinfatico.
Un rapporto tra sordità e diabete è sospettato da tempo ma sembra difficile da dimostrare sul piano statistico. [Virtaniemi J, ed Al.,1994 ] Nel caso delle sordità improvvise, la causa potrebbe essere una neuropatia periferica, ma nei diabetici insulinodipendenti, i PEA non sono di tipo retrococleare. Inoltre, il tasso di recupero non differisce dal gruppo controllo, fatta eccezione forse per quel che riguarda le frequenze acute. L’esame dell’osso temporale dei soggetti diabetici mostra la presenza quasi costante di una microangiopatia della stria vascolare e dei microvasi del sacco endolinfatico.
Iperlipidemia Fig.51
 Anche se l’ipercolesterolemia sembra aggravare le sordità professionali, l’iperlipidemia e i fattori di rischio vascolari non sono più frequenti nelle popolazioni con sordità improvvisa. [ Ullrich D, ed Al.,1992 ]
Anche se l’ipercolesterolemia sembra aggravare le sordità professionali, l’iperlipidemia e i fattori di rischio vascolari non sono più frequenti nelle popolazioni con sordità improvvisa. [ Ullrich D, ed Al.,1992 ]
Ipotiroidismo Fig.52
 La relazione tra ipotiroidismo e sordità è stato oggetto di molti studi da quando era stato constatato che tali pazienti presentavano una sordità fluttuante le cui soglie erano correlate alla fatica e alla gravità dell’ipotiroidismo. L’analisi dei PEA mostrerebbe una correlazione tra le latenze dei PEA e la compliance al trattamento sostitutivo dopo tiroidectomia totale. Queste correlazioni sono tuttora in discussione. [ Anand VT, ed Al.,1989 ]
La relazione tra ipotiroidismo e sordità è stato oggetto di molti studi da quando era stato constatato che tali pazienti presentavano una sordità fluttuante le cui soglie erano correlate alla fatica e alla gravità dell’ipotiroidismo. L’analisi dei PEA mostrerebbe una correlazione tra le latenze dei PEA e la compliance al trattamento sostitutivo dopo tiroidectomia totale. Queste correlazioni sono tuttora in discussione. [ Anand VT, ed Al.,1989 ]
Patologia dell’osso temporale Fig.53
 Le lesioni ossee dell’osso temporale possono essere causa di sordità improvvisa: metastasi, istiocitosi X (Fig.53) , mieloma. Lo studio dell’osso temporale ha potuto talvolta rivelare un’emorragia negli spazi perilinfatici. È stato anche descritto un osteoma del condotto uditivo interno. [ Clerico DM, ed Al.,1994 ]
Le lesioni ossee dell’osso temporale possono essere causa di sordità improvvisa: metastasi, istiocitosi X (Fig.53) , mieloma. Lo studio dell’osso temporale ha potuto talvolta rivelare un’emorragia negli spazi perilinfatici. È stato anche descritto un osteoma del condotto uditivo interno. [ Clerico DM, ed Al.,1994 ]
Ototossicità Fig.54
 Oltre ad aminoglicosidi e diuretici, sono stati incriminati numerosi farmaci e molecole chimiche. L’interferone è responsabile di sordità correlata alle dosi ricevute ma reversibile alla sospensione del trattamento. Gli anticoncezionali orali sono stati incriminati in molti casi di sordità improvvisa con un meccanismo di trombosi.
Oltre ad aminoglicosidi e diuretici, sono stati incriminati numerosi farmaci e molecole chimiche. L’interferone è responsabile di sordità correlata alle dosi ricevute ma reversibile alla sospensione del trattamento. Gli anticoncezionali orali sono stati incriminati in molti casi di sordità improvvisa con un meccanismo di trombosi.
[ Hanna GS ,1986 ] La sordità è di norma reversibile. La sieroterapia antitetanica è responsabile di neuropatie periferiche e sono stati descritti casi di sordità improvvisa che si manifesta 48 ore dopo l’iniezione. [ Booth JB ,1997 ] Si tratta probabilmente di una reazione da ipersensibilità. L’intossicazione da monossido di carbonio è una causa classica di sordità improvvisa. Il gas, combinato con l’emoglobina, forma carbossiemoglobina che causa un’anossia cocleare. In caso di intossicazione acuta, la sordità è bilaterale ed è spesso asimmetrica. Si possono avere dei recuperi. Sono stati descritti casi di sordità fluttuante.
Varie
§ Casi di sordità improvvisa sono stati descritti nella rettocolite ulceroemorragica. La causa è probabilmente una vasculite.
§ Le forme neurologiche della sarcoidosi rappresentano il 5% dei casi di malattia. L’VIII paio di nervi cranici è frequentemente interessato sotto forma di una sordità fluttuante o improvvisa, a volte bilaterale con uno sfasamento di diversi mesi tra i due lati. Talvolta sono associati sintomi vestibolari. La lesione, a volte inaugurale, si produce con l’intermediazione di una meningite granulomatosa. La diagnosi può essere stabilita solo in base al riscontro di lesioni polmonari tipiche, di lesioni granulose cutanee, congiuntivali o lacrimali. La biopsia di una di queste lesioni o di un’adenopatia sopra-claveare può condurre alla diagnosi mostrando i granulomi epitelioidi. I corticosteroidi sono efficaci.
Cause retrococleari
 Esse possono tutte essere responsabili di sordità improvvise, ma soprattutto le meningiti batteriche, in particolare la meningite da pneumococco. Più raramente sono in causa lesioni meningee in corso di leptospirosi, di tubercolosi o di criptococcosi. Le sordità sono spesso totali e bilaterali. Anche quando sono parziali, l’audiometria vocale è più alterata di quanto non lascerebbe prevedere l’audiometria tonale.
Esse possono tutte essere responsabili di sordità improvvise, ma soprattutto le meningiti batteriche, in particolare la meningite da pneumococco. Più raramente sono in causa lesioni meningee in corso di leptospirosi, di tubercolosi o di criptococcosi. Le sordità sono spesso totali e bilaterali. Anche quando sono parziali, l’audiometria vocale è più alterata di quanto non lascerebbe prevedere l’audiometria tonale.
 Raramente la sclerosi multipla si manifesta attraverso un’ipoacusia improvvisa Couturier L.,2001; Cummings D ed Al.,1990; – Dauman B, ed Al.,1985 ; Deguine O, Gardini B 2000 . La sordità in questa patologia è molto meno frequente delle vertigini. È la constatazione di anomalie neurologiche associate, anche minori, che devono orientare verso questa diagnosi. La RMN mostra tuttavia che il numero di sordità improvvise che precedono una sclerosi a placche è in aumento. [ Drulovic B, ed Al.,1993 ] Si deve sospettare alla scoperta di una placca di demielinizzazione localizzata sul sito di entrata della radice dell’VIII o sul tronco cerebrale con anomalie ai PEA.
Raramente la sclerosi multipla si manifesta attraverso un’ipoacusia improvvisa Couturier L.,2001; Cummings D ed Al.,1990; – Dauman B, ed Al.,1985 ; Deguine O, Gardini B 2000 . La sordità in questa patologia è molto meno frequente delle vertigini. È la constatazione di anomalie neurologiche associate, anche minori, che devono orientare verso questa diagnosi. La RMN mostra tuttavia che il numero di sordità improvvise che precedono una sclerosi a placche è in aumento. [ Drulovic B, ed Al.,1993 ] Si deve sospettare alla scoperta di una placca di demielinizzazione localizzata sul sito di entrata della radice dell’VIII o sul tronco cerebrale con anomalie ai PEA.
mori della fossa posteriore Fig.57
 Secondo le casistiche, si ritiene che il 10-15% dei neurinomi dell’acustico si presentano come una sordità improvvisa. Può trattarsi di una sordità improvvisa classica, con amputazione delle frequenze acute. In altri casi, si tratta di una sordità improvvisa che recupera dando l’impressione che il trattamento sia efficace. Qualunque sia il meccanismo patogenetico, ischemico o tumorale, due conclusioni meritano di essere sottolineate: 1- un recupero uditivo anche totale non esclude la possibilità di un neurinoma. Questo può essere con-fermato dai risultati recenti di Nageris e Popovtzer che hanno mostrato come il recupero completo dell’udito dopo un episodio di sordità improv-visa è identico sia in caso di neurinoma dell’acustico che di ipoacusia improvvisa idiopatica7; 2- la RMN con gadolinio deve essere un esame sistematico4-8.Il quadro più caratteristico è quello di una sordità improvvisa recidivante con segni premonitori omolaterali, vertigini o acufeni a testimonianza di un processo evolutivo. È possibile la confusione con la malattia di Menière, con la differenza che la sordità è predominante sulle frequenze acute invece di quella basse. Lo screening mediante lo studio dei PEA rimane valido benché siano stati riportati alcuni casi di neurinomi con PEA normali. È raro che questi ultimi non diventino di tipo retrococleare quando si ripetono a 6 mesi di intervallo. Altri tumori della fossa cranica posteriore possono essere chiamati in causa: un tumore primitivo o secondario del tronco cerebrale ,un meningioma o metastasi da cancro della mammella, della prostata, una sordità improvvisa è stata descritta anche come primo sintomo in una meningite carcinomatosa metastatica di un tumore polmonare primitivo10.. Sordità improvvise sono state descritte nel contesto di meningiti carcinomatose. [ Civantos F, Choi YS, 1992 ] In realtà, è ancora la risonanza magnetica nucleare che permette la diagnosi di questi tumori.
Secondo le casistiche, si ritiene che il 10-15% dei neurinomi dell’acustico si presentano come una sordità improvvisa. Può trattarsi di una sordità improvvisa classica, con amputazione delle frequenze acute. In altri casi, si tratta di una sordità improvvisa che recupera dando l’impressione che il trattamento sia efficace. Qualunque sia il meccanismo patogenetico, ischemico o tumorale, due conclusioni meritano di essere sottolineate: 1- un recupero uditivo anche totale non esclude la possibilità di un neurinoma. Questo può essere con-fermato dai risultati recenti di Nageris e Popovtzer che hanno mostrato come il recupero completo dell’udito dopo un episodio di sordità improv-visa è identico sia in caso di neurinoma dell’acustico che di ipoacusia improvvisa idiopatica7; 2- la RMN con gadolinio deve essere un esame sistematico4-8.Il quadro più caratteristico è quello di una sordità improvvisa recidivante con segni premonitori omolaterali, vertigini o acufeni a testimonianza di un processo evolutivo. È possibile la confusione con la malattia di Menière, con la differenza che la sordità è predominante sulle frequenze acute invece di quella basse. Lo screening mediante lo studio dei PEA rimane valido benché siano stati riportati alcuni casi di neurinomi con PEA normali. È raro che questi ultimi non diventino di tipo retrococleare quando si ripetono a 6 mesi di intervallo. Altri tumori della fossa cranica posteriore possono essere chiamati in causa: un tumore primitivo o secondario del tronco cerebrale ,un meningioma o metastasi da cancro della mammella, della prostata, una sordità improvvisa è stata descritta anche come primo sintomo in una meningite carcinomatosa metastatica di un tumore polmonare primitivo10.. Sordità improvvise sono state descritte nel contesto di meningiti carcinomatose. [ Civantos F, Choi YS, 1992 ] In realtà, è ancora la risonanza magnetica nucleare che permette la diagnosi di questi tumori.
 Sono stati riportati casi di infarto temporale bilaterale da occlusione dei rami terminali delle due arterie cerebrali medie, con una sordità centrale. Questi casi compaiono in generale in un contesto di embolismo in rapporto con la sostituzione di valvole mitraliche. Il recupero avviene in 2 -3 mesi, ma lascia spesso un’agnosia uditiva. Si può anche trattare di piccole lesioni ischemiche situate nella porzione posteriore del putamen che interrompono le fibre tra corpo genicolato mediale e lobi temporali. Nell’infarto del tronco cerebrale, l’audiometria può rimanere normale e sono alterati solo i PEA. L’insufficienza vertebro-basilare si manifesta con manifestazioni vertigi-nose. Possono tuttavia associarsi ad una sordità percettiva talvolta bila-terale17, spesso severa, ma con un calo peggiore nell’audiometria vocale che l’audiometria tonale non lascerebbe sospettare. Le otoemissioni acu-stiche sono in linea di massima negative18. Può trattarsi di un meccani-smo acuto, come la dissezione arteriosa dei vasi vertebro-basilari19 che può sopraggiungere dopo manipolazioni del rachide cervicale20. L’ipoacusia improvvisa può riscontrarsi anche nel quadro di patologie subacute: insufficienza vertebro-basilare emodinamica21, o di malformazioni congenite: “megadolico basilare”22. Nel ubbio di una tale eziologia l’esecuzione di un’angio-RMN e/o di un eco-doppler possono dirimere eventuali dubbi. Bisogna inoltre sottolineare il valore di una sordità improvvisa bilaterale come predittiva di un infarto dell’AICA1. Basandosi su dei dati necrosco-pici, Gussen ha proposto un meccanismo fisiopatogenetico secondo cui un’arteriosclerosi vertebro-basilaire prolungata potrebbe essere all’origine di una rottura prematura della membrana di Reissner23.
Sono stati riportati casi di infarto temporale bilaterale da occlusione dei rami terminali delle due arterie cerebrali medie, con una sordità centrale. Questi casi compaiono in generale in un contesto di embolismo in rapporto con la sostituzione di valvole mitraliche. Il recupero avviene in 2 -3 mesi, ma lascia spesso un’agnosia uditiva. Si può anche trattare di piccole lesioni ischemiche situate nella porzione posteriore del putamen che interrompono le fibre tra corpo genicolato mediale e lobi temporali. Nell’infarto del tronco cerebrale, l’audiometria può rimanere normale e sono alterati solo i PEA. L’insufficienza vertebro-basilare si manifesta con manifestazioni vertigi-nose. Possono tuttavia associarsi ad una sordità percettiva talvolta bila-terale17, spesso severa, ma con un calo peggiore nell’audiometria vocale che l’audiometria tonale non lascerebbe sospettare. Le otoemissioni acu-stiche sono in linea di massima negative18. Può trattarsi di un meccani-smo acuto, come la dissezione arteriosa dei vasi vertebro-basilari19 che può sopraggiungere dopo manipolazioni del rachide cervicale20. L’ipoacusia improvvisa può riscontrarsi anche nel quadro di patologie subacute: insufficienza vertebro-basilare emodinamica21, o di malformazioni congenite: “megadolico basilare”22. Nel ubbio di una tale eziologia l’esecuzione di un’angio-RMN e/o di un eco-doppler possono dirimere eventuali dubbi. Bisogna inoltre sottolineare il valore di una sordità improvvisa bilaterale come predittiva di un infarto dell’AICA1. Basandosi su dei dati necrosco-pici, Gussen ha proposto un meccanismo fisiopatogenetico secondo cui un’arteriosclerosi vertebro-basilaire prolungata potrebbe essere all’origine di una rottura prematura della membrana di Reissner23.
Malattia di Creutzfeldt-Jakob Fig.59
 Vi si riscontrano casi di sordità improvvisa corticale.
Vi si riscontrano casi di sordità improvvisa corticale.
Encefaliti corticali Fig.60
 Nell’encefalite diffusa corticale può sopraggiungere una sordità centrale più o meno fluttuante con audiometria tonale normale. Il recupero è possibile, ma spesso tardivo, anche con terapia cortisonica. Casi di encefalite subacuta, in donne nel loro 3o o 4o decennio, caratterizzati da sordità improvvisa o fluttuante associata a occlusione delle arterie retiniche sono stati descritti senza altre manifestazioni sistemiche. La sordità unilaterale o bilaterale predomina sulle frequenze basse e medie. In alcuni di questi pazienti, con sintomi in progressione, una terapia con ciclofosfamide ha interrotto l’evoluzione.
Nell’encefalite diffusa corticale può sopraggiungere una sordità centrale più o meno fluttuante con audiometria tonale normale. Il recupero è possibile, ma spesso tardivo, anche con terapia cortisonica. Casi di encefalite subacuta, in donne nel loro 3o o 4o decennio, caratterizzati da sordità improvvisa o fluttuante associata a occlusione delle arterie retiniche sono stati descritti senza altre manifestazioni sistemiche. La sordità unilaterale o bilaterale predomina sulle frequenze basse e medie. In alcuni di questi pazienti, con sintomi in progressione, una terapia con ciclofosfamide ha interrotto l’evoluzione.
Trattamento
Aumentare il flusso ematico e l’ossigenazione cocleari
Vasodilatatori
Essi si propongono di aumentare la gittata sanguigna cocleare e di aumentare le pressioni parziali di O 2 nei liquidi endo e perilinfatici. Un vasodilatatore che agisce per via sistemica dovrebbe poter aumentare la gittata cocleare senza abbassare il flusso ematico cerebrale. Non si è mai potuto dimostrare nell’uomo un tale effetto collaterale. [ Kronenberg J, 1992]
Al contrario, gli esperimenti sugli animali mostrano che farmaci vasocostrittori come l’angiotensina causano paradossalmente un leggero aumento della PO2 nei liquidi perilinfatici. Al contrario, una vasodilatazione prodotta da questi farmaci è seguita da un’azione opposta. In realtà, le misure di PO2 negli spazi perilinfatici mostrano che esiste una correlazione diretta tra l’ossigenazione dell’orecchio interno e la pressione arteriosa. I farmaci vasodilatatori dovrebbero quindi essere abbandonati. [ Wilkins SA, 1987]
Soluzione a basso peso molecolare: destrano
Questo prodotto era usato contro la ipercoagulabilità. Tuttavia, questo farmaco ha provocato incidenti in caso di insufficienza cardiaca o di emorragia. Non è stato osservato alcun beneficio nel caso della sordità improvvisa. [ Kronenberg J, 1992]
Inalazioni di carbogeno
Si tratta di una miscela di 95% di ossigeno e di 5% di gas carbonico. Questa miscela gassosa è conosciuta come vasodilatatore cerebrale. Avrebbe la proprietà di aumentare la pressione parziale di ossigeno dei liquidi perilinfatici. Effetti benefici sono possibili ma non ancora chiaramente provati. [ Kallinen J, 2001] .
Emodiluizione
Essa consiste nel realizzare un salasso, centrifugare le emazie e reiniettare nel paziente il suo stesso plasma. In altri protocolli, il sangue prelevato è sostituito, volume per volume, con succedanei del plasma (gelatine, soluzioni per infusione endovenosa). Il monitoraggio dell’emodiluizione si fa pesando le sacche di sangue e misurando con regolarità l’ematocrito su tubo capillare. La riduzione dell’ematocrito comporta un abbassamento della viscosità e una riduzione della resistenza alla circolazione di ritorno e, dunque, un aumento della frequenza cardiaca. Nei microcircoli, il ridotto numero di globuli rossi provoca un’accelerazione della perfusione. Ciò permette di mitigare il rallentamento circolatorio nei territori patologici a bassa gittata. L’ossigenazione fornita dal plasma è aumentata. Se si analizza la curva del flusso in ossigeno in rapporto al valore dell’ematocrito, riducendo progressivamente l’ematocrito, si aumentano progressivamente le capacità di trasporto dell’ossigeno [ Dauman B,1985 ]. Questo si fa fino a un valore ottimale che si situa nell’uomo su un ematocrito tra 28 e 31%. Al di sotto, si verifica il contrario e la quantità di ossigeno trasportato si riduce. In pratica, l’emodiluizione dovrebbe ridurre il valore iniziale dell’ematocrito del 25% per raggiungere un valore ottimale del 30%. Il prelievo sarebbe in tal modo di 12 mL/kg di peso corporeo senza superare la soglia di 15 mL con un prelievo che può raggiungere 890 mL per un soggetto di 80 kg. La metà del prelievo deve essere raggiunta in 20 minuti, essendo la durata dell’emodiluizione compresa tra 40 e 60 minuti. In tali condizioni, i rischi sono coronarici per l’aumento della gittata e del lavoro cardiaco. Può comparire ipotensione 4 – 8 ore dopo l’inizio del prelievo. Ciò richiede quindi un monitoraggio della pressione e la conservazione delle vie venose. L’emodiluizione persiste per 21 giorni. È controindicata in gravidanza, nel postoperatorio immediato e nel bambino i cui compartimenti idrici sono differenti con rischio di shock, d’ipotensione arteriosa e anche di anuria.
Ossigeno iperbarico
Si tratta di ossigeno puro somministrato a una pressione superiore alla pressione atmosferica con aumento della quantità di O2 disponibile a livello cellulare e saturazione tissutale di questo gas. Si avrebbe un aumento della pressione parziale di O2 perilinfatica e una lieve riduzione del FEC. Il paziente è posizionato in una camera iperbarica e sottoposto a una pressione di 2,2 atmosfere per 90 minuti dopo essersi assicurati di una funzione tubarica normale. I protocolli variano da un centro all’altro: una seduta al giorno per 10 giorni consecutivi o due sedute al giorno per 5 giorni. Si deve notare che spesso compare un fattore trasmissionale a causa di catarro tubarico post-terapia. Il trattamento con ossigeno iperbarico è controverso. Si tratta di un trattamento astenizzante, non esente da rischi di fibrosi polmonare. Tuttavia, alle pressioni generalmente utilizzate, le complicanze sono rare. Alcuni centri vi trovano un interesse terapeutico, altri no. [ Couturier L, 2001 ;] 11
Defibrinogenazione (Batroxobin)
Una riduzione del fibrinogeno ematico diminuisce la viscosità ematica. [ Shiraishi T, 1993 ] .I fibrinolitici hanno l’effetto di abbassare il tasso del fibrinogeno ematico. L’obiettivo non è di sciogliere un trombo, ma di diminuire la viscosità sanguigna: è un modo di aumentare la gittata del microcircolo. Tali tecniche sono state testate in contrapposizione con i corticosteroidi in uno studio in doppio cieco, randomizzato. Esisterebbe una differenza significativa. Ma gli effetti collaterali dei fibrinolitici non sono banali: dolori toracici, vertigini, nausea ecc…
Terapie ipolipemizzanti
Dieta e terapia farmacologica sono state proposte anche 1 mese dopo l’esordio della sordità in pazienti in cui l’iperlipidemia era di 230 mg/dl o più.[ Kojima Y, 2001 .]
Prostaglandine
Esse sono sintetizzate dalla parete vascolare dei vasi della stria vascolare e del legamento spirale. In caso di sordità improvvisa, la somministrazione di prostaglandina E1 o di prostaciclina è stata tentata nella speranza di ottenere l’effetto antiaggregante delle piastrine e vasodilatatore che si è dimostrato efficace nella malattia di Raynaud grave. Sfortunatamente, i risultati restano dubbi e il trattamento difficile da gestire. Sono tuttora in corso altri studi sull’effetto delle prostaglandine sulla sordità fluttuante. L’uso di prostaglandina E2 migliora transitoriamente la sordità fluttuante di questi pazienti come farebbe la furosemide. [ Booth JB A Kerr Scott-Brown’s otolaryngology. London: Butterworth-Heinemann: 1997]
Corticosteroidi
I corticosteroidi agiscono sui processi infiammatori e autoimmuni e più in generale sui processi risultanti da danni fisici, chimici, ischemici e ipossici. I protocolli utilizzati sono molto variabili. Generalmente 1 mg/kg per 10 giorni quindi dosi decrescenti. Il protocollo di Stennert utilizzato nella paralisi facciale è stato suggerito in caso di ricovero: [ Tran Ba Huy P, 2002 :81] metilprednisolone: g1 – g2: endovenosa lenta, se il peso è < 70 kg: 100 mg × 2/die e se peso > 70 kg: 120 mg × 2/die; g3 – g4: per via orale, 80 mg × 2/die; g5 – g6: 100 mg/die; g7 – g10: 75 mg/die. Il monitoraggio del trattamento comprende misurazioni regolari della pressione arteriosa, il bilancio idroelettrolitico e glucidico. In caso di controindicazioni, è stata proposta la via transtimpanica [ Gianoli GJ, 2001 ] .
Trattamento antipertensivo
mannitolo e diuretici sono utilizzati soprattutto nelle sordità fluttuanti per analogia con le sordità fluttuanti della malattia di Menière. Per quanto riguarda il mannitolo, è uno zucchero che potrebbe spostare l’acqua dei liquidi intralabirintici in direzione del plasma in caso di somministrazione breve, e spostare l’endolinfa verso la perilinfa in caso di perfusione prolungata. [ Tran Ba Huy P, 2002] Se ne possono prescrivere 500 ml al 10% in 6 ore associati a 2 g di KCl e una dieta senza sale.
Antivirali
Per il momento, soltanto uno studio sperimentale su modello animale di labirintite virale da HSV1 suggerisce che la somministrazione di acyclovir associato a corticosteroidi migliora la rapidità del recupero in confronto all’acyclovir o al cortisonico da soli [ Stokroos RJ, 1999 ].
Riposo a letto
È alla base del trattamento se si privilegia l’origine da rottura membranosa. Si ritiene che il riposo affretti la cicatrizzazione del labirinto membranoso. Si devono quindi evitare anche gli sforzi che provocano una pressione endocranica come sollevare grossi pesi, in caso di stipsi o durante gli sforzi sessuali.
Indicazioni, discussione
Il dogma dell’urgenza è stato recentemente rimesso in discussione. Nessuno studio ha potuto provare l’efficacia di un trattamento precoce. Tenuto conto del recupero spontaneo nei primi 15 giorni, il ritardo di trattamento seleziona i casi sfavorevoli e una terapia precoce seleziona quelli con prognosi buona.
La scelta della terapia non è unanime, ma in pratica, è inconcepibile non trattare (Tran Ba Huy P, ed Al.2002).Il ricovero ha almeno il merito di obbligare al riposo e di isolare ma non esistono valutazioni al riguardo e il suo valore è ancora da dimostrare).
L’impiego dei corticosteroidi è attualmente il trattamento meno discusso. Esistono studi versus placebo, ma i loro risultati sono contraddittori. Mattox DE, Lyles CA 1989 e Simmons 1968 hanno rilevato che 20 su 28 pazienti non trattati (71%) recuperano l’udito completamente o in buona parte rispetto a 63 su 88 trattati con corticosteroidi (72%). Wilson WR, ed Al.,1980 hanno isolato un gruppo di 67 pazienti con una sordità improvvisa che predomina sulle frequenze acute o sulle frequenze basse, escludendo i pazienti in cui la sordità è predominante sulle frequenze medie dato che questi recuperano quasi costantemente. In questo gruppo, senza trattamento, ha osservato il 32% di recuperi spontanei (11/34 pazienti) e con corticosteroidi: 61% (20/33 pazienti). [Moskowitz D, ed Al., 1984, hanno dimostrato che 24 pazienti su 27 (89%) trattati con corticosteroidi recuperava per lo meno il 50% dell’udito, rispetto a quattro su nove pazienti non trattati (44%). Veldman JE,ed Al, 1993 hanno osservato il 50% di miglioramento (6/12) nel gruppo con corticosteroidi e il 32% senza corticosteroidi (6/19). Tutti questi studi hanno imperfezioni metodologiche: troppo pochi pazienti, gruppi non omogenei ecc. La tendenza è tuttavia a dimostrare una certa efficacia, tranne per quanto riguarda il tipo audiometrico [ Kitajiri SK,ed Al. 2002]
Esistono dunque pochi elementi per sostenere un protocollo piuttosto che un altro. Il rapporto della Società francese di ORL 2002 (81)suggerisce il protocollo di Stennert utilizzato nella paralisi facciale, ma sottolinea che nessun trattamento ha dato prova della sua efficacia reale nell’uomo.
Metilprednisolone liofilizzato in soluzione iniettabile: g1 – g2, endovenosa lenta; se < 70 kg: 100 mg × 2/die; se > 70 kg: 120 mg × 2/die; g3 – g4: 80 mg × 2/die; g5 – g6: 100 mg/die; g7: 75 mg/die.
Pentossifillina 400: 2 fiale/die a g1 e g2; 3 fiale/die da g3 a g7.
Quindi in via ambulatoriale: metilprednisolone 16 mg o prednisolone 20 mg: 4 compresse/die a dosi decrescenti fino a g18 per stadi ogni 2 giorni; pentossifillina 400: 3 compresse/die.
Il rapporto non precisa le eventuali indicazioni all’emodiluizione, all’ossigeno iperbarico ecc.
Il protocollo personale degli Autori comporta una prescrizione di carbogeno per sei sedute quotidiane di 20 minuti ognuna con un flusso di 3-5 l/min. I presidi terapeutici possono essere utilizzati diversamente secondo le scuole: forti dosi di corticosteroidi (200 mg/die), ossigeno iperbarico [ Deguine O, 2000] emodiluizione [ Dauman B, 1985] in seconda intenzione. In genere viene stabilita una politerapia «shotgun regimen». Per gli Autori del rapporto, ci si trova, dunque, ancora nella necessità di realizzare studi prospettici.
Conclusione
Il meccanismo intimo delle sordità improvvise e fluttuanti è ancora da scoprire. Nelle sordità improvvise, alcuni quadri clinici di diversa eziologia possono essere sospettati sulla morfologia audiometrica, ma nessuna delle cause attualmente proposte possono essere comprovate su paziente vivente. Fatta eccezione per la malattia di Ménière, le sordità fluttuanti hanno dato luogo a molto rari studi. La speranza è ancora di scoprire l’esame complementare o l’esame radiografico che permetta di scoprire quel che succede nell’orecchio interno. Per il momento, l’approccio diagnostico consiste nel non sottovalutare patologie suscettibili di richiedere una cura specifica: neurinoma dell’acustico, accidente cerebrovascolare, sifilide, immunopatie. La valutazione dei trattamenti non è sempre stata realizzata perché il tasso di recuperi spontanei è elevato. Tuttavia, la maggior parte degli Autori propone una terapia. Riposo e cortisonici sono i meno discussi. Né i corticosteroidi, né i trattamenti a obiettivo vascolare hanno dimostrato la loro efficacia. Il ricovero stesso non ha dimostrato una qualche superiorità rispetto ai trattamenti ambulatoriali. L’utilità di una terapia precoce nemmeno. Nelle sordità improvvise, sarebbero necessari studi prospettici ma sono difficili da realizzare perché si tratta di una patologia rara e perché ogni singolo centro non può riunire grandi casistiche omogenee. Inoltre, esistono numerosi parametri in grado di influire sulla probabilità di recupero: il ritardo del trattamento studiato, l’età del paziente, la coesistenza di vertigini e il tipo di curva audiometrica. Altre molecole dovrebbero essere testate. Non si dispone di modelli sperimentali che permettano di scegliere tali molecole prima di proporle per una sperimentazione umana. Giocoforza è quindi, per il momento, gestire i pazienti con modestia e con il minimo di limiti e di rischi terapeutici.
Le sordità fluttuanti restano un’entità complessa, in quanto mal definita. La loro origine può essere legata a cause malformative o traumatiche e la diagnosi si basa, prima di tutto, sulla diagnostica per immagini; tuttavia, esse sono, a volte, la manifestazione di patologie genetiche, sindromiche o meno, e di patologie autoimmuni o infiammatorie che richiedono una consulenza multidisciplinare con il ricorso rispettivo ai pediatri, ai genetisti e agli internisti.
Riferimenti
Albers FW, Majoor MH, Van Der Gaag R Corneal autoimmunity in a patient with relapsing polychondritis. Eur Arch Otorhinolaryngol 1992 ; 249 : 296-299 [crossref]
Ayache D., Plouin-Gaudon I., Bakouche P., Elbaz P., Gout O. Microangiopathy of the inner ear, retina and brain (Susac syndrome). Report of a case Arch Otolaryngol Head and Neck Surg 2000 ; 126 : 82-84 [cross-ref]
Alexiou C, Arnold W, Fauser C, Schratzenstaller , Gloddek B, Fuhrman S , e al. Sudden sensorineural hearing loss. Does application of glucocorticoids make sense. Arch Otolaryngol Head Neck Surg 2001 ; 127 : 253-258
Anand VT, Mann SB, Dash RJ, Mehra YN Auditory investigations in hypothyroidism. Acta Otolaryngol 1989 ; 108 : 83-87 [crossref]
Asakura M., Kato I., Takahashi K., Okada T., Minami S., Takeyama I., e al. Increased platelet agregability in patients with vertigo, sudden deafness and facial palsy Acta Otolaryngol [suppl] 1995 ; 520 (Pt2) : 399-400 [cross-ref]
Baker SR, Lilly DJ Hearing loss from acute carbon monoxide intoxication. Ann Otol Rhinol Laryngol 1977 ; 86 : 323-328
Baloh RW Neurotology of migraine. Headache 1997 ; 37 : 615-621 [crossref]
Bichey B.G., Hoversland J.M., Wynne M.K., Miyamoto R.T. Changes in quality of life and the cost-utility with cochlear implantation in patients with large vestibular aqueduct syndrome Otol Neurotol 2002 ; 23 : 323-327 [cross-ref]
Booth JB Sudden and fluctuant sensorineural hearing loss. A Kerr Scott-Brown’s otolaryngology. London: Butterworth-Heinemann: 1997; 1-82.
Cadoni G, Agostino S, Manna R, De Santis A, Fetoni AR, Vulpiani P , e al. Clinical associations of serum antiendothelial cell antibodies in patients with sudden sensorineural hearing loss. Laryngoscope 2003 ; 113 : 797-801 [crossref]
Cama E., Alemanno M.S., Bellacchio E., Santarelli R., Carella M., Zelante L., e al. Identification of a novel mutation in the SLC26A4 gene in an Italian with fluctuating sensorineural hearing loss Int J Pediatr Otorhinolaryngol 2009 ; 73 : 1458-1463 [cross-ref]
Camaro Da Silva D.P., Montovani J.C., Oliveira D.T., Fioravanti M.P., Tamashiro I.A. The large vestibular aqueduct syndrome: a cause of neurosensory dysacusia Pro Fono 2008 ; 20 : 133-135
Camicas-Van Gout M., Negrevergne M., Portmann D., Lahrizia R., Dauman R., Darrouzet V., e al. Impedancemétrie multifréquentielle et maladie de Ménière : analyse des résultats du Teflag Rev Laryngol Otol Rhinol 1999 ; 120 : 317-321
Clement P., Conessa C., Dot C., Kossowski M., Flocard F., Poncet J.L. Syndrome de Susac ou microangiopathie cochléo-encéphalo-rétinienne Ann Otolaryngol Chir Cervicofac 2003 ; 120 : 49-53
Clemis J., Valvassori G. The large vestibular aqueduct syndrome Laryngoscope 1978 ; 88 : 723-728
Brookhouser P.E. Fluctuating and progressive sensorineural hearing loss in children Pediatric Otology and Neurotology Philadelphia: Lippincott-Raven Publishers (1998). 617-626
Christoforidis G.A., Mehta B.A., Landi J.L., Czarnecki E.J., Piaskowski R.A. Spontaneous intracranial hypotension: report of four cases and review of the literature Neuroradiology 1998 ; 40 : 636-640 [cross-ref]
Civantos F, Choi YS, Applbaum EL Meningeal carcinomatosis producing bilateral sudden hearing loss: a case report. Am J Otol 1992 ; 13 : 369-371
Clerico DM, Jahn AF, Fontanella S Osteoma of the internal auditory canal: case report and literature review. Ann Otol Rhinol Laryngol 1994 ; 103 : 619-623
Committee on hearing and equilibrium Guidelines for the diagnosis and evaluation of therapy in Menière’s disease. Otolaryngol Head Neck Surg 1995 ; 113 : 181-185
Compadretti G.C., Brandolini C., Tasca I. Sudden sensorineural hearing loss in lupus erythematous associated with antiphopholipid syndrome. Case report and review Ann Otol Rhinol Laryngol 2005 ; 114 : 214-218
Couturier L Surdité brutale : deux études divergent sur l’intérêt de l’oxygénothérapie hyperbare. Quot Méd 2001 ; 6988 : 21
Cummings D, McCormick JB, Bennett D, Samba JA, Farrar B, Machin SH , e al. Acute sensorineural deafness in Lassa fever. JAMA 1990 ; 264 : 2093-2096
Dauman B, Poisot D, Cross AM, Mehsen M Hémodilution, oxygénothérapie hyperbare et vasodilatateurs dans les surdités brusques. J Fr ORL 1985 ; 34 : 93-96
Deguine O, Gardini B Surdités d’apparition brutale. Rev Prat 2000 ; 50 : 1695-1700 Dinces EA, Yang S,
Balogun AO Pediatric fluctuating sensorineural hearing loss: problems in medical management. Laryngoscope 2001 ; 111 : 21-25 [crossref]
Downie AC, Howlett DC, Koefman RJ, Banerjee AK, Tonje KA Prolonged contrast enhancement of the inner ear on magnetic resonance imaging in Ramsay Hunt syndrome. Br J Radiol 1994 ; 67 : 819-821 [crossref]
Drulovic B, Ribaric-Jankes F, Kostic VS, Sternic N Sudden hearing loss as the initial mono-symptom of multiple sclerosis. Neurology 1993 ; 43 : 2703-2705 Eggermont J.J. Summating potentials in Ménière’s disease Arch Otorhinolaryngol 1979 ; 222 : 65-75
Einer H, Tengborn L, Axelsson A, Edström S Sudden Sensorineural hearing loss and hemostatic mechanisms. Arch Otolaryngol Head Neck Surg 1994 ; 120 : 536-540
Farrel RW, Pemberton MN, Parker AJ, Buffin JT Sudden deafness after dental surgery. Br Med J 1991 ; 303 : 1034
Fetterman BL, Luxford WM, Saunders JE Sudden Bilateral sensorineural Hearing loss. Laryngoscope 1996 ; 106 : 1347-1350 [crossref]
Finizia C, Jönsson R, Hanner P Serum and cerebral fluid pathology in Patients with Sudden Hearing Los. Acta Otolaryngol 2001 ; 121 : 823-830
Fong R.S., Beste D.J., Murray K.J. Pediatric sensorineural hearing loss after temporal bone radiation Am J Otol 1995 ; 16 : 793-796
Fraser G.R. Association of congenital deafness with goitre (Pendred syndrome): a study of 207 familiesAnn Hum Genet 1965 ; 28 : 201-249
Fraser F.C., Sproule J.R., Halal F. Frequency of the branchio-oto-renal syndrome in children with profound hearing loss J Med Genet 1980 ; 7 : 341-349 [cross-ref]
Friedman I, Frohlich A, Wright A Epidemic typhus fever and hearing loss: a histological study. J Laryngol Otol 1993 ; 107 : 275-283
Fuse T, Hayashi T, Oota N, Fukase S, Asano S, Kato T , e al. Immunological responses in acute low-tone sensorineural hearing loss and Menière’s disease. Acta Otolaryngol 2003 ; 123 : 26-31 [crossref]
Gagnebin J, Maire R Infection screening in sudden and progressive idiopathic sensorineural hearing loss. A retrospective study of 182 cases. Otol Neurotol 2002 ; 23 : 160-162 [crossref]
Gianoli GJ, Li JC Transtympanic steroids for treatment of sudden hearing loss. Otolaryngol Head Neck Surg 2001 ; 125 : 142-146 [crossref]
Goodhill V. Sudden deafness and round windows ruptures Laryngoscope 1971 ; 81 : 1462-1474 [cross-ref]
Goodhill V. Inner ear barotrauma Arch Otolaryngol 1972 ; 13 : 70-72
G Grover N., Whiteside O.J., Ramsden J.D. Susac syndrome: outcome of unilateral cochlear implantation J Laryngol Otol 2011 ; 125 : 856-858 [cross-ref]
ussen R Sudden hearing loss associated with cochlear membrane rupture. Arch Otolaryngol Head Neck Surg 1981 ; 107 : 598-600
Guyot JP, Thielen K Évolution des surdités brusques sans traitement. Schweiz Med Wochenschr [suppl] 2000 ; 116 : 93S-96S [crossref]
Hall SJ, McGuigan JA, Rocks MJ Red blood cell deformability in sudden sensorineural deafness: another aetiology. Clin Otolaryngol 1991 ; 16 : 3-7 [crossref]
Hanna GS Sudden deafness and the contraceptive pill. J Laryngol Otol 1986 ; 100 : 701-706
Hariri MA Sensorineural hearing loss in bullous myringitis. A prospective study in eighteen patients. Clin Otolaryngol 1990 ; 15 : 351-353 [crossref]
Hazell J.W., Fraser J.G., Robinson P.J. Positional audiometry in the diagnosis of perilymphatic fistula Am J Otol 1992 ; 113 : 21-25
Hegarty JL, Patel S, Fischbein N, Jackler RK, Lalwani AK The value of enhanced magnetic resonance imaging in the evaluation of endocochlear disease. Laryngoscope 2002 ; 112 : 8-17 [crossref]
Herman P, Hervé S, Portier F, Tronche S, De Waele C, Tran Ba Huy P. Maladie de Ménière. EMC (Elsevier Masson SAS, Paris), Oto-rhino-laryngologie, 20-205-A-10, 2003.
Hochermann M, Reimer A Hearing loss after general anesthesia. A case report and review of the literature. J Laryngol Otol 1987 ; 101 : 1079-1082
Honings J., Pennings R.J., Hoefsloot L.H., Joosten F.B., Cremers C.W. Head trauma as eliciting event in transient deterioration of sensorineural hearing loss and vertigo in Pendred/EVA syndrome Int J Pediatr Otorhinolaryngol Extra 2008 ; 3 : 177-181 [cross-ref]
Hulbert TV, Larsen RA, Davis CL, Holtom PD Bilateral hearing loss after measle and rubella vaccination in an adult. N Engl J Med 1991 ; 325 : 134
Hultcrantz E Sudden deafness-A critical Evaluation of Pathogenesis and cure. Otorhinolaryngol Nova 1999 ; 9 : 178-189 [crossref] In-Hoo Kim, Jin-Kyoung Kim, Si-Ra Bang, ,Woo-Seok Sim, . and Ik-Soo Chung, Sudden Sensorineural Hearing Loss after General Anesthesia – A case report – Korean Journal of Anesthesiology. 2008 Mar;54(3):359-362 http://dx.doi.org/10.4097/kjae.2008.54.3.359
Kakigi A., Sawada S., Takeda T., Takeuchi S., Higashiyama K., Azuma H., e al. Electrocochleographic findings in cases of auto immune disease with sensorineural deafness Auris, Nasus Larynx 2003 ; 30 : 349-354 [cross-ref]
Kallinen J, Laurikainen E, Bergroth L, Grenman R A follow-up study of patients suffering from sudden sensorineural hearing loss. Acta Otolaryngol 2001 ; 121 : 818-822
Katholm M, Johnsen NJ, Siim C, Willumsen L Bilateral sudden deafness and acute aquired toxoplasmosis. J Laryngol Otol 1991 ; 105 : 115-118
Khonishi K, Yamane H, Igushi H Local substances regulating cochlear blood flow. Acta Otolaryngol [suppl] 1998 ; 553 : 40-46
Kemperman M.H., Stinckens C., Kumar S., Huygen P.L., Joosten F.B., Cremers C.W. Progressive fluctuant hearing loss, enlarged vestibular aqueduct and cochlear hypoplasia in brancio-oto-renal syndrome Otol Neurol 2001 ; 22 : 637-643 [cross-ref]
Kemperman M.H., Koch S.M., Kumar S., Huygen P.L., Joosten F.B., Cremers C.W. Evidence of progression and fluctuation of hearing impairment in branchio-oto-renal syndrome Int J Audiol 2004 ; 43 : 523-532 [cross-ref]
Klingmann C., Benton P., Schellinger P., Knauth M. A safe treatment concept for divers with acute inner ear disorders Laryngoscope 2004 ; 114 : 2048-2050 [cross-ref]
Kobayashi H, Susuki A, Nomura Y Unilateral hearing loss following rubella infection in an adult. Acta Otolaryngol [suppl] 1994 ; 514 : 49-51 [crossref]
Koesling S., Rasinski C., Amaya B. Imaging and clinical findings in large endolymphatic duct and sac syndrome Eur J Radiol 2006 ; 57 : 54-62 [cross-ref]
Kojima Y, Ito S, Furuya N Hearing improvement after therapy for hyperlipidemia in patients with chronic-phase sudden deafness. Ann Otol Rhinol Laryngol 2001 ; 110 : 105-108
Kronenberg J, Almagor M, Bendet E, Kushnir D Vasoactive therapy versus placebo in the treatment of sudden hearing loss: a double blind clinical study. Laryngoscope 1992 ; 102 : 65-68
Levenson M.J., Pariser S.C., Jacobs M., Edelstein D.R. The large vestibular aqueduct syndrome in childrenArch Otolaryngol Head And Neck Surg 1989 ; 115 : 54-58
Linstrom CJ, Pincus RL, Leauitt EB, Urbina MC Otologic neurotologic manifestations of HIV-related diseases. Otolaryngol Head Neck Surg 1993 ; 108 : 680-687
Lorenzi MC, Bittar RS, Pedalini ME, Zerati F, Yoshinari NH, Bento RF Sudden Deafness and Lyme disease. Laryngoscope 2003 ; 113 : 312-315 [crossref]
Madden C., Wiley S., Schleiss M., Benton C., Meinzen-Derr J., Greinwald J., e al. Audiometric, clinical and educational outcomes in a pediatric symptomatic congenital cytomegalovirus population with sensorineural hearing loss Int J Pediatr Otorhinolaryngol 2005 ; 69 : 1191-1198 [cross-ref]
Marlin S., Feldmann D., Blons H., Loundon N., Rouillon I., Garabedian E.N., e al. GJB2 and GJB6 mutations: genotypic and phenotypic correlations in a large cohort of hearing impaired patients Arch OtoLaryngol Head Neck Surg 2005 ; 131 : 481-487 [cross-ref]
Martin H, Martin C Les surdités fluctuantes. Ann Otolaryngol Chir Cervicofac 1977 ; 94 : 679-699 Martin C Les surdités fluctuantes. OPA Prat 1998 ; 121 : 1-6 [crossref]
Martin C, Mosnier I, Robier A, Bertholon P, Dubreuil C, Chobaut JC , e al. La pathologie vasculaire en ORL. Part du vasculaire dans les manifestations cochléo-vestibulaires. Rapport de la société française d’ORL 2000 : 237-258 [crossref]
Mattox DE, Lyles CA Idiopathic sudden sensorineural hearing loss. Am J Otol 1989 ; 10 : 242-247
Maturo S., Horlbeck D. Enlarged vestibular aqueduct syndrome: a case of bilateral sudden sensorineural hearing loss in a child Int J Pediatr Otorhinolaryngol Extra 2006 ; 1 : 142-144 [cross-ref]
Mazzoni A Internal auditory artery supply to the petrous bone. Ann Otol Rhinol Laryngol 1972 ; 81 : 13-21
McKennan KX, Nielsen SL, Watson C, Wiesner K Meniere’s syndrome: an atypical presentation of giant cell arteritis (temporal arteritis). Laryngoscope 1993 ; 103 : 1103-1107
Mercier E, Quere I, Chabert R, Lallemant JG, Daures JP, Berlan J , e al. The 20210A allele of the prothrombin gene is an independent risk factor for perception deafness in patients with venous thromboembolic antecedents [letter]. Blood 1999 ; 93 : 3150-3152
Michel O, Brusis T Hearing loss as a sequel of lumbar puncture. Ann Otol Rhinol Laryngol 1992 ; 101 : 390-394
Mom T, Avan P, Bonfils P, Gilain L Vulnerability of the gerbil cochlea to sound exposure during reversible ischemia. Hear Res 1999 ; 136 : 65-74 [crossref]
Mom T, Porret C, Carvahlo S, Laurent S, Velin JF, Crestani S , e al. Analyse des oto-émissions acoustiques en cas de surdité brusque. Communication à la société française d’ORL. Rev Off Soc Fr ORL 2003 ; 80 : 110
Moskowitz D, Lee KJ, Smith HW Steroid use in idiopathic sudden sensorineural hearing loss. Laryngoscope 1984 ; 94 : 664-666
Mosnier I, Bouccara D, Sterkers O Les surdités brusques en 1997 : hypothèses étiopathogéniques, conduite à tenir, facteurs pronostiques, traitements. Ann Otolaryngol Chir Cervicofac 1997 ; 114 : 251-266
Nagahata M, Hosoya T, Fuse T, Aoyagi M, Yamaguchi K Arterial dissection of the vertebrobasilar systems: a possible cause of acute sensorineural hearing loss. Am J Otol 1997 ; 18 : 32-38
Ness JA, Stankiewicz JA, Kaniff T, Pifarre R, Allegretti J Sensorineural hearing loss associated with aortocoronary bypass surgery: a prospective study. Laryngoscope 1993 ; 103 : 589-593
Nobutoki T., Sasaki M., Fukumizu M., Hanaoka S., Sugai K., Anzai Y., e al. Fluctuating hearing loss, episodic headache and stroke with platelet hyperaggregability: coexistence of auditory neuropathy and cochlear hearing loss Brain Dev 2006 ; 28 : 55-59 [cross-ref]
Nozawa I, Imamura S, Mizukoshi A, Honda H, Okamoto Y Clinical study of acute low-tone sensorineural hearing loss: survey and analysis of glycerol test and orthostatic test. Ann Otol Rhinol Laryngol 2002 ; 111 : 160-164
Odetoyinbo O, Adekile A Sensorineural hearing loss in children with sickle cell anemia. Ann Otol Rhinol Laryngol 1987 ; 96 : 258-260
Ogawa K, Kanzaki J Aplastic anemia and sudden sensorineural hearing loss. Acta Otolaryngol [suppl] 1994 ; 514 : 85-88 [crossref]
Ohinata Y, Makimoto K, Haginomori SI, Araki M, Takahashi H Blood viscosity and plasma viscosity in patients with sudden deafness. Acta Otolaryngol 1994 ; 114 : 601-607 [crossref]
Pelisse JM, Perles B, Jobert F, Charpy N, Fabiani F, Baril C À propos de 100 surdités brusques traitées en 10 ans : relations avec la maladie de Barlow. J Fr ORL 1988 ; 37 : 459-469 Phelps P.D.,
Mahoney C.F., Luxon L.M. Large endolymphatic sac: a congenital deformity of the inner ear shown by magnetic resonance imaging J Laryngol Otol 1997 ; 111 : 754-756
Pirodda A, Ferri GG, Modugno GC, Borghi C Systemic hypotension and the development of acute sensorineural haring loss in young healthy subjects. Arch Otolaryngol Head Neck Surg 2001 ; 127 : 1049-1052
Pitkäranta A, Vasama JP, Julkunen I Sudden deafness and viral infections. Otorhinolaryngol Nova 1999 ; 9 : 190-197 Portmann D., Souza Leao F., Bussières R., Noyon P. Validation de l’échelle clinique pour le diagnostic des fistules périlymphatiques Rev Otol Laryngol Rhinol 2005 ; 126 : 243-248
Psifidis A.D., Psillas G.K., Daniilidis J.C. Sudden sensorineural hearing loss: long-term follow-up resultsOtolaryngol Head Neck Surg 2006 ; 134 : 809-815 [cross-ref]
Ramirez-Camacho R., Ramon Garcia Berrocal J., Arellano B., Trinidad A. Familial isolated unilateral large vestibular aqueduct syndrome ORL J Otorhinolaryngol Relat Spec 2003 ; 65 : 45-48 [cross-ref]
Reid A., Marchbanks R.J., Bateman D.E., Martin A.M., Brighwell A.P., Pichard J.D. Mean intracranial pressure monitoring by a non-invasive audiological technique: a pilot study J Neurol Neurosurg Psychiatry 1989 ; 52 : 610-612 [cross-ref]
Ren T, Laurikainen E, Quirk WS, Miller JM, Nuttal AL Effects on stellate ganglion stimulation on bilateral cochlear blood flow during increases in blood presure in human. Ann Otol Rhinol Laryngol 1993 ; 102 : 378-384
Rinehart R, Harre RG, Roski RA, Dolan KD Anevrysm of the anterior inferior cerebellar artery producing hearing loss. Ann Otol Rhinol Laryngol 1992 ; 101 : 705-706
Roman S, Aladio P, Paris J, Nicolla R, Triglia JM Prognostic factors of sudden hearing loss in children. Int J Pediatr Otorhinolaryngol 2001 ; 61 : 17-21 [crossref] Rosingh H.J., Wit H.P., Albers F.W. Non-invasive perilymphatic pressure measurement in normal hearing subjects using MMS 10 tympanic Displacement analyser Acta Otolaryngol 1996 ; 116 : 382-387 [cross-ref]
Sauvage JP, Puyraud S, Khalifa N. Surdités brusques et fluctuantes. EMC (Elsevier Masson SAS, Paris), Oto-rhino-laryngologie, 20-183-A-10, 2004.
Shea J.J., Xianxi G., Orchik D.J. Endolymphatic hydrops associated with otosclerosis Am J Otol 1994 ; 16 : 348-357Schuknecht HF, Donovan ED The pathology of idiopathic sudden sensorineural hearing loss. Arch Otolaryngol Head Neck Surg 1986 ; 243 : 1-15 [crossref]
Schuknecht HF, Nadol JB Temporal bone pathology in a case of Cogan syndrome. Laryngoscope 1994 ; 104 : 1135-1142
Schultz P, Arbusow V, Strupp M, Dieterich M, Rauch E, Brandt T Highly variable distribution of HSV-1-specific DNA in human geniculate, vestibular and spiral ganglia. Neurosci Lett 1998 ; 252 : 139-142
Shaia FT, Sheehy JL Sudden sensorineural hearing impairment: a report of 1220 cases. Laryngoscope 1976 ; 86 : 389-398
Shea J.J., Ge X., Orchik D.J. Traumatic endolymphatic hydrops Am J Otol 1995 ; 16 : 235-240
Shiraishi T, Kubo T, Okumura S, Naramura H, Nishimura M, Okusa Hearing recovery in sudden deafness patients using a modified defibrinogenation therapy. Acta Otolaryngol [suppl] 1993 ; 501 : 46-50
Simmons FB Theory of membrane breaks in sudden hearing loss. Arch Otolaryngol Head Neck Surg 1968 ; 88 : 68-74
Smouha EE, Karmody YS Non-osteitic complications of therapeutic radiation to the temporal bone. Am J Otol 1995 ; 16 : 83-87
Soucek S, Michael L The ear in the acquired immunodeficiency syndrome: II. Clinical and audiologic investigation. Am J Otol 1996 ; 17 : 35-39
Stinckens C., Huygen P.L., Joosten F.B., Van Camp G., Otten B., Cremers C.W. Fluctuant progressive hearing loss associated with Ménière like vertigo in three patients with the Pendred syndrome Int J Pediatr Otorhinolaryngol 2001 ; 61 : 207-215 [cross-ref]
Stokroos RJ, Albers FW, Krikke AP, Casselman JW Magnetic resonance imaging of the inner ear in patients with idiopathic sudden sensorineural hearing loss. Eur Arch Otorhinolaryngol 1998 ; 255 : 433-436 [crossref]
Stokroos RJ, Albers FW, Schirm J Therapy of idiopathic sudden sensorineural hearing loss: antiviral treatment of experimental herpes simplex virus infection of the inner ear. Ann Otol Rhinol Laryngol 1999 ; 108 : 423-428
Takasaki T, Higashikawa M, Motoyama S, Sugita K, Kurane I Serum antibodies to human herpesvirus 7, human herpesvirus 6 and cytomegalovirus in patients with idiopathic facial nerve palsy and sudden deafness. J Laryngol Otol 1998 ; 112 : 617-621
Therrocha JR, Ramirez-Camacoj IR Sudden sensorineural hearing loss: supporting the immunologic theory. Ann Otol Rhinol Laryngol 2002 ; 111 : 989-997
Thomas R, Kameswaran M, Murugan V, Okafor BC Sensorineural hearing loss in neurobrucellosis. J Laryngol Otol 1993 ; 107 : 1034-1036
Tomasi J.P., Gersdorff M. Autoimmune inner ear disease: diagnostic and treatments Acta Otorhinolaryngol Belg 2002 ; 56 : 371-374
Tran Ba Huy P, Manach Y Les urgences en ORL. Conduite à tenir en urgence face à une surdité brusque. Rapport de la société française d’ORL 2002 : 207-225
Tran Ba Huy P., Sauvaget E. Les maladies pressionnelles de l’oreille interne Pathologie pressionnelle en ORL : Rapport de la SFORL (2005).
Tsunoda K., Akaogi J., Ohya N., Murofushi T. Sensorineural hearing loss as the initial manifestation of polyarteritis nodosa J Laryngol Otol 2001 ; 115 : 311-312
Ueda T, Murai T, Nario K, Fujita N, Miyahara H, Matsunaga T Inner ear blood flow in the rat after unilateral occlusion in the vertebrobasilar system. Acta Otolaryngol [suppl] 1998 ; 533 : 36-39 [crossref]
Ullrich D, Aurbach G, Drobik C A prospective study of hyperlipidemia as a pathogenic factor in sudden hearing loss. Eur Arch Otorhinolaryngol 1992 ; 249 : 273-276 [crossref]
Unal M, Katircioglu S, Karatay MC, Suoglu Y, Erdamar B, Aslan I Sudden total bilateral deafness due to asymptomatic mump infection. Int J Pediatr Otorhinolaryngol 1998 ; 45 : 167-169 [crossref]
Vasama JP, Linthicum FH Idiopathic sudden sensorineural hearing loss: temporal bone histopathologic study. Ann Otol Rhinol Laryngol 2000 ; 109 : 57-59
Vass Z, Shore SE, Nutall AL, Miller JM Direct evidence of trigeminal innervation of the cochlear blood vessels. Neuroscience 1998 ; 84 : 559-567 [crossref]
Veldman JE, Hanada T, Meeuwsen T Diagnostic and therapeutic dilemmas in rapidly progressive sensorineural hearing loss and sudden deafness. A reappraisal of immune reactivity in inner ear diseases. Acta Otolaryngol 1993 ; 113 : 303-306 [crossref]
Virtaniemi J, Laakso M, Nuutinen J, Karjalainen S, Vartiainen E Hearing thresholds in insulin-dependent diabetic patients. J Laryngol Otol 1994 ; 15 : 109-113 [crossref]
Vrabec JT, Payne DA Prevalence of herpesviruses in cranial Nerve Ganglia. Acta Otolaryngol 2001 ; 121 : 831-835
Vyse T, Luxon LM, Walport MJ Audiovestibular manifestations of the antiphospholipid syndrome. J Laryngol Otol 1994 ; 108 : 57-59
Wackym PA Molecular temporal bone pathology: II. Ramsay Hunt syndrome (herpes zoster oticus). Laryngoscope 1997 ; 107 : 1165-1175 [crossref]
Walsted A., Nielson O.A., Borum P. Hearing loss after neurosurgery. The influence of cerebrospinal fluid pressure J Laryngol Otol 1994 ; 108 : 637-641
Wang L.P., Lundberg L., Magnusson M., Törnebrandt K. Auditory function after spinal anesthesia Rev Anesth 1993 ; 18 : 162-165
Westmore GA, Pickard BH, Stern H Isolation of mumps virus from the inner ear after sudden deafness. Br Med J 1979 ; 1 : 14-15 [crossref]
Wilkins SA, Mattox DE, Lyles A Evaluation of a a shotgun regimen for sudden hearing loss. Otolaryngol Head Neck Surg 1987 ; 97 : 474-480
Wilson WR, Byl FM, Laird N The efficacity of steroids in the treatment of idiopathic sudden hearing loss. Arch Otolaryngol Head Neck Surg 1980 ; 106 : 772-776
Wilson WR The relationship of the herpesvirus family to sudden hearing loss: a prospective clinical study and literature review. Laryngoscope 1986 ; 96 : 870-877
Yamasoba T, Kikuchi S, Yagi M, Higo R, O’Uchi T, Tokumaru A Sudden sensorineural hearing loss associated with slow blood flow of the vertebral system. Ann Otol Rhinol Laryngol 1993 ; 102 : 873-877
Yamasoba T, Kikuchi S, Sugasawa M, Harada T Acute low-tone sensorineural hearing loss without vertigo. Arch Otolaryngol Head Neck Surg 1994 ; 120 : 532-535
Yeo SW, Park SN, Park YS, Suh BD, Hari H, Choi HB , e al. Different distribution of HLA Class II alleles according to response to corticosteroid therapy in sudden sensorineural hearing loss. Arch Otolaryngol Head Neck Surg 2001 ; 127 : 945-949
Yetiser S., Inal A., Taser M., Ozkaptan Y. Otolaryngological aspects of relapsing polychondritis: course and outcome Rev Laryngol Otol Rhinol 2001 ; 122 : 195-200
Yoon TH, Paparella MM, Schachern PA, Alleva M Histopathology of sudden hearing loss. Laryngoscope 1990 ; 100 : 707-715