- OTOTOSSICITÀ: ASPIRINA ED ANTINFIAMMATORI NON STEROIDEI
Parole chiave : , derivati salicilati, a
|
· OTOTOSSICI EXTRAPROFESSIONALI DA FARMACI
|
|
Che cosa è l’Ototossicità
l’Ototossicità è, molto semplicemente, l’avvelenamento dell’orecchio (oto = orecchio, tossicità = avvelenamento), che deriva dalla esposizione a farmaci o sostanze chimiche che danneggiano l’orecchio interno o il nervo cocleovestibolare . Poiché nell’orecchio interno c’è sia l’organo uditivo ,che dell’equilibrio, l’ototossicità può provocare disturbi di uno o entrambi questi sensi. Tali danni possono portare a perdita uditiva temporanea o permanente, e / o a perdita dell’equilibrio. Le sostanze ototossiche includono diversi farmaci (ad esempio antibiotici aminoglicosidi , alcuni agenti anti-cancro , ciclo diuretici , farmaci anti-malarici e l’aspirina ), ed altre sostanze ambientali (ad esempio mercurio, piombo e arsenico). La tabella elenca alcuni dei farmaci ototossici più comunemente usati e le sostanze.
|
|
|
|
Normale organizzazione organo di Corti |
Stereociglia danneggiate dalla somministrazione di aminoglicosidi |

Tabella 1. Sostanze comuni note per essere associate con ototossicità 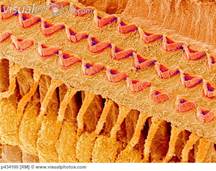
|
Tipo / gruppo |
Denominazione della sostanza ototossiche |
|
Antibiotici aminoglicosidici |
Gentamicina, streptomicina, tobramicina, neomicina, netilmicina, kanamicina, amikacina, diidrostreptomicina, ribostamicina |
|
Antibiotici non aminoglicosidi |
Vancomicina, eritromicina |
|
Diuretici dell’ansa |
Furosemide, acido etacrinico, bumetanide, torsemide |
|
Agenti chemioterapici |
Cisplatino, carboplatino, mostarda azotata |
|
Salicilati |
Aspirina |
|
Antinfiammatori non steroidei |
|

Salicilati e antinfiammatori non steroidei
Livello d’azione e caratteristiche del danno: generalmente salicilati e FANS determinano danni uditivi reversibili sulle alte frequenze. Questi includono Advil, Nuprin, Motrin (ibuprofene), Aleve, Naprosyn, Anaprox (Naproxen), Feldene, Dolobid, Indocin, Lodine, Relafin, Toradol, Volteran, i salicilati: Aspirina, Disalcid, Bufferin, Ecotrin, Trilisate, Ascriptin, Empirin, Excedrin, Fiorinal. Arthrotec (diclofenac e misoprostel) è stato associato con l’acufene e la riduzione dell’udito (Bombardier, Peloso et al. 1995). Secondo alcuni autori il danno da rumore può essere esacerbato dall’assunzione ditali farmaci. mentre secondo altri ciò non si verifica. Il meccanismo fisiopatogenetico alla base del1 ototossicità dei salicilati appare multifattoriale; studi morfologici hanno escluso danni cocleari permanenti. Dati morfologici, elettrofisiologici e in vitro hanno osservato un coinvolgimento delle cellule ciliate esterne, ed appare possibile un danno mediato dalla diminuzione della perfusione cocleare. La diminuzione delle prostaglandine. mediata da salicilati e FANS. associata all’aumento dei leucotrieni sembra spiegare l’ototossicità di questi farmaci (Jung et al., 1993).
Idrocodone in combinazione con acetaminofene (es. Vicodin), è stata anche associata con perdita di udito (Friedman, Casa et al 2000.. Oh, Ishiyama et al 2000). Un simile caso di sordità associata a MethodOne è stato anche segnalato (Vorasubin et al, 2013). Sordità completa, trattati con un impianto cocleare, può verificarsi in persone dipendenti da questi farmaci. Questo quadro clinico è talvolta confusa con la malattia autoimmune dell’orecchio interno .
Fiorinal contiene l’aspirina, che è ben conosciuto per essere un ototossica ed in grado di provocare una perdita uditiva neurosensoriale ed acufene(Brien 1993).
Salicilati
Acido acetilsalicilico, comunemente noto come aspirina, è ampiamente utilizzato per le sue proprietà antinfiammatorie, antipiretiche e analgesiche. L’aspirina è un inibitore dell’aggregazione piastrinica e viene utilizzato per il trattamento di pazienti con una storia di attacchi ischemici transitori, ictus, angina instabile o infarto del miocardio . L’acido acetilsalicilico viene assorbito rapidamente dopo somministrazione orale e viene idrolizzata nel fegato nella sua forma attiva, acido salicilico. Livelli terapeutici variano 25-50 mcg / mL per analgesici ed antipiretici a 150-300 mcg / ml per il trattamento della febbre reumatica acuta. Tuttavia, tinnito può verificarsi a livelli sierici a partire da 200 mcg / mL.
Fisiopatologia
L’acido salicilico entra rapidamente la coclea, e livelli di perilymph livelli sierici paralleli. Livelli crescenti producono acufene e, in generale, una perdita uditiva neurosensoriale piatta reversibile. Il meccanismo è multifattoriale, ma sembra causare metabolica piuttosto che alterazioni morfologiche all’interno della coclea.
Epidemiologia
Incidenza di ototossicità è alto come 1% ed è più comunemente osservata nei pazienti anziani, anche a basse dosi.
Fattori di rischio
I fattori di rischio associati alla ototossicità salicilato comprendono alte dosi, età avanzata, e la disidratazione.
Segni e sintomi
L’acufene è l’effetto avverso più comune di tossicità salicilato. Altri effetti collaterali includono perdita dell’udito, nausea, vomito, mal di testa, confusione, tachicardia, tachipnea e. La perdita dell’udito è generalmente da lieve a moderata e simmetria bilaterale. Il recupero di solito si verifica 24-72 ore dopo la cessazione del farmaco.
L’insorgenza di acufeni è stata utilizzata in passato come un segno precoce di ototossicità. Studi successivi hanno trovato che l’insorgenza di tinnito non deve essere usato come predittore del livello salicilato siero perché gli effetti ototossici possono essere presenti a bassi livelli ematici. [15]
Trattamento
Tossicità salicilato è trattato monitoraggio degli elettroliti e la somministrazione di liquidi, con l’aggiunta della diuresi alcalina, se necessario. La somministrazione di ossigeno e la ventilazione meccanica possono essere necessari in casi gravi.
Prevenzione – monitoraggio della funzione vestibolare o acustica
Non ci sono in corso protocolli di monitoraggio dell’orecchio interno che sono di uso comune e che possono impedire attendibile della tossicità, e sembra improbabile che essi sono ancora possibili. La difficoltà è che la tossicità è ritardata – che non causi sintomi clinici per una settimana dopo l’assunzione, ed il danno può progredire dopo che il farmaco è stato sospeso .
Fausti e colleghi (1994) hanno utilizzato l’audiometria ad alta frequenza, nel tentativo di individuare l’ototossicità. Solo il 37% di orecchi testati in questo modo hanno mostrato una significativa riduzione, dopo il trattamento con diversi aminoglicosidi per una durata media di 11,4 giorni .
Può l’audiometria ad alta frequenza evidenziare la ototossicità? Questo studio non affronta questo punto come i farmaci monitorati varia nella loro propensione a causare la perdita dell’udito e inoltre non c’era alcun tentativo di correlare la vestibolotossicità con i risultati audiometrici. Un altro problema è che le persone anziane perdono generalmente le alte frequenze in ogni caso, senza lasciare nulla di misurare.
Otoemissioni acustiche , in particolare quelle ottenute a frequenze estremamente alte, hanno un potenziale per rilevare l’ototossicità. (Orts et al, 2000) Non si è trovata la loro utilità nella pratica per il fatto, che gli anziani in genere non hanno OAE, le persone ancora più giovani spesso non hanno OAE ad alta frequenza e praticamente le OAE non sembrano siano molto sensibili alla tobramicina. In realtà, Katbamna et al (1999) hanno riferito che le ampiezze dei DPOAE non erano significativamente differenti nei pazienti trattati.
Nelle figure di cui sopra, le OAE sono conservate alle frequenze più basse, mentre la funzione vestibolare è perduta. In altre parole, anche se ad altissima frequenza le DPOAE possono essere sensibili alla ototossicità, finora, non ci sono dati per essere sicuri. Katbamna et al (1998) suggeriscono che una maggiore soppressione controlaterale può essere il primo segno di sviluppo di ototossicità .
ANTIMALARICI

DERIVATI chinino
|
FARMACI |
Vestibolotossicità |
Cocleotossici |
Commento |
|
Quinidex |
No |
Sì |
Acufene |
|
Atabrine |
No |
Sì |
|
|
Plaquenil |
No |
Sì |
|
|
Chinina solfato |
No |
Sì |
|
|
meflochina (Lariam) |
Probabile |
Sì |
Acufeni e vertigini |
|
Idrossiclorochina |
Improbabile |
Raro |
La perdita dell’udito |
|
Clorochina (Malaquin) |
Nessun rapporto |
Sì |
Acufene |
Commento: Mentre l’ingestione di chinino può causare sindrome che comprendono tinnitus, sordità neurosensoriale e vertigini (Obasikene et al, 2012), i farmaci derivati dal chinino raramente sono di per sé una fonte di sofferenza dell’udito. Alcuni derivati del chinino, come la eflochina (Larium) impiegata per la prevenzione della malaria raramente causano acufeni significativi e duraturi. C’è anche qualche sospetto di vestibolotossicità e tossicità del CNS (Dow et al, 2006). Studi recenti suggeriscono che la chinina altera la motilità delle cellule ciliate esterne (Jarboe e Hallworth, abstract ARO, 1999, N ° 237).
Clorochina
Livello d’azione e caratteristiche del danno: in animali da esperimento esposti a clorochina sono stati osservati danni alle cellule ciliate interne ed esterne per dosi superiori a 40 mg/Kg (Sykes et al.. 1984).
Chinino
Derivato da albero corteccia di china, il chinino è stato storicamente usato per trattare la malaria e per le sue qualità antifebbrili. Usa oggi è limitata dalla disponibilità di alternative meno tossiche. Il chinino è talvolta usato per trattare crampi notturni e in aggiunta alla terapia antimalarica. Il chinino subisce principalmente metabolismo epatico. Livello d’azione e caratteristiche del danno: come per i salicilati l’ototossicità del chinino è multifattoriale. Sono stati evidenziati danni diretti alle cellule ciliate, ma viene considerato quale fattore patogenetico anche la vasocostrizione e la conseguente riduzione del flusso ematico cocleare (Jung et al., 1993). In uno studio condotto su pazienti trattati con chinino (massima concentrazione plasmatica di 2 rng/L) è stata osservata l’insorgenza di ipoacusia neurosensoriale per le alte frequenze (20 dB a 14 kHz) dopo circa un anno di esposizione, reversibile al termine del trattamento. E stato quindi ipotizzato che l’ototossicità del chinino alle dosi terapeutiche per la malaria, sia un effetto collaterale comunque reversibile (Tange et al, 1997).
Segni e sintomi
Tossicità chinino può produrre tinnito, perdita, vertigini, mal di testa, nausea e perdita della vista dell’udito. La perdita dell’udito è di solito neurosensoriale e reversibile. Una caratteristica tacca neurosensoriale è spesso presente a 4000 Hz. Perdita irreversibile dell’udito raramente è stata riportata con l’uso chinino.
Trattamento
Trattamento per il chinino ototossicità consiste principalmente di interruzione della terapia; amplificazione può essere utilizzato in rari casi di sordità irreversibile.
Meflochina
Caratteristiche del danno: sono stati descritti casi di ipoacusia neurosensoriale insorta in pazienti sottoposti a profilassi antimalarica con meflochina (Fusetti et al., 1999).
Idroclorochina
In letteratura sono stati segnalati alcuni casi di ipoacusia neurosensoriale in- sorta in soggetti esposti per alcuni anni alle dosi terapeutiche di idroclorochina (Johansen et al.. 1998; Seckin et al.. 2000).
References
References
American Speech-Language Hearing Association. (1994). Audiologoc Managment of Individuals Recieving Cochleotoxic Drug Therapy [Guidelines]. Available at www.asha.org/policy.
Barlow DW, Duckert LG, Kreig CS, et al. Ototoxicity of topical otomicrobial agents. Acta Otolaryngol. Mar 1995;115(2):231-5. [Medline].
Bhansali SA, Stockwell CW, Bojrab DI. Oscillopsia in patients with loss of vestibular function. Otolaryngol Head Neck Surg. Jul 1993;109(1):120-5. [Medline].
Campbell KC, Durrant J. Audiologic monitoring for ototoxicity. Otolaryngol Clin North Am. Oct 1993;26(5):903-14. [Medline].
Cohen-Kerem R, Kisilevsky V, Einarson TR, et al. Intratympanic gentamicin for Menière’s disease: a meta-analysis. Laryngoscope. Dec 2004;114(12):2085-91. [Medline].
Dayal VS, Chait GE, Fenton SS. Gentamicin vestibulotoxicity. Long term disability. Ann Otol Rhinol Laryngol. Jan-Feb 1979;88(1 Pt 1):36-9. [Medline].
Edson RS, Terrell CL. The aminoglycosides. Mayo Clin Proc. May 1999;74(5):519-28. [Medline].
Fausti SA, Henry JA, Helt WJ, et al. An individualized, sensitive frequency range for early detection of ototoxicity. Ear Hear. Dec 1999;20(6):497-505. [Medline].
Fischel-Ghodsian N. Genetic factors in aminoglycoside toxicity. Ann N Y Acad Sci. Nov 28 1999;884:99-109. [Medline].
Govaerts PJ, Claes J, van de Heyning PH, et al. Aminoglycoside-induced ototoxicity. Toxicol Lett. Aug 1990;52(3):227-51. [Medline].
Henley CM, Rybak LP. Developmental ototoxicity. Otolaryngol Clin North Am. Oct 1993;26(5):857-71.[Medline].
Hiel H, Schamel A, Erre JP, Hayashida T, Dulon D, Aran JM. Cellular and subcellular localization of tritiated gentamicin in the guinea pig cochlea following combined treatment with ethacrynic acid. Hear Res. Jan 1992;57(2):157-65. [Medline].
Hirvonen TP, Minor LB, Hullar TE, Carey JP. Effects of intratympanic gentamicin on vestibular afferents and hair cells in the chinchilla. J Neurophysiol. Feb 2005;93(2):643-55. [Medline].
Huizing EH, de Groot JC. Human cochlear pathology in aminoglycoside ototoxicity–a review. Acta Otolaryngol Suppl. 1987;436:117-25. [Medline].
Ikeda K, Oshima T, Hidaka H, et al. Molecular and clinical implications of loop diuretic ototoxicity. Hear Res. May 1997;107(1-2):1-8. [Medline].
Ishiyama G, Ishiyama A, Kerber K, Baloh RW. Gentamicin ototoxicity: clinical features and the effect on the human vestibulo-ocular reflex. Acta Otolaryngol. Oct 2006;126(10):1057-61. [Medline].
Jonathan B Clark, MD, MPH. Evaluation of Visual Vestibular Interaction With the Dynamic Visual Acuity Test. micromedical.com. Available
at http://www.micromedical.com/Newsletter/MMNewsletter20.pdf. Accessed 4/25/2010.
Jung TT, Rhee CK, Lee CS, et al. Ototoxicity of salicylate, nonsteroidal antiinflammatory drugs, and quinine. Otolaryngol Clin North Am. Oct 1993;26(5):791-810. [Medline].
Kahlmeter G, Dahlager JI. Aminoglycoside toxicity – a review of clinical studies published between 1975 and 1982. J Antimicrob Chemother. Jan 1984;13 Suppl A:9-22. [Medline].
Kaplan DM, Hehar SS, Bance ML, et al. Intentional ablation of vestibular function using commercially available topical gentamicin-betamethasone eardrops in patients with Meniere’s disease: further evidence for topical eardrop ototoxicity. Laryngoscope. Apr 2002;112(4):689-95. [Medline].
Knight KR, Kraemer DF, Neuwelt EA. Ototoxicity in children receiving platinum chemotherapy: underestimating a commonly occurring toxicity that may influence academic and social development. J Clin Oncol. Dec 1 2005;23(34):8588-96. [Medline].
Lai P, Coulson C, Pothier DD, Rutka J. Chlorhexidine ototoxicity in ear surgery, part 1: review of the literature. J Otolaryngol Head Neck Surg. Dec 2011;40(6):437-40. [Medline].
Lee KJ, ed. Essential Otolaryngology Head and Neck Surgery. 995-998. 8th. McGraw-Hill: 2003:104-105.
Leitner MG, Halaszovich CR, Oliver D. Aminoglycosides inhibit KCNQ4 channels in cochlear outer hair cells via depletion of phosphatidylinositol(4,5)bisphosphate. Mol Pharmacol. Jan 2011;79(1):51-60.[Medline].
Levine DP. Vancomycin: a history. Clin Infect Dis. Jan 1 2006;42 Suppl 1:S5-12. [Medline].
MacDougall HG, Weber KP, McGarvie LA, Halmagyi GM, Curthoys IS. The video head impulse test: diagnostic accuracy in peripheral vestibulopathy. Neurology. Oct 6 2009;73(14):1134-41. [Medline].
Monsell EM, Cass SP, Rybak LP. Therapeutic use of aminoglycosides in Ménière’s disease. Otolaryngol Clin North Am. Oct 1993;26(5):737-46. [Medline].
Nielsen-Abbring FW, Perenboom RM, van der Hulst RJ. Quinine-induced hearing loss. ORL J Otorhinolaryngol Relat Spec. 1990;52(1):65-8. [Medline].
Powell SH, Thompson WL, Luthe MA, et al. Once-daily vs. continuous aminoglycoside dosing: efficacy and toxicity in animal and clinical studies of gentamicin, netilmicin, and tobramycin. J Infect Dis. May 1983;147(5):918-32. [Medline].
Rademaker-Lakhai JM, Crul M, Zuur L, et al. Relationship between cisplatin administration and the development of ototoxicity. J Clin Oncol. Feb 20 2006;24(6):918-24. [Medline].
Roland PS. New developments in our understanding of ototoxicity. Ear Nose Throat J. Sep 2004;83(9 Suppl 4):15-6; discussion 16-7. [Medline].
Roland PS. Summary of the findings of a joint consensus panel on the use of potentially ototoxic ototopicals. Ear Nose Throat J. Sep 2004;83(9 Suppl 4):13-4. [Medline].
Rybak LP, Whitworth C, Scott V. Comparative acute ototoxicity of loop diuretic compounds. Eur Arch Otorhinolaryngol. 1991;248(6):353-7. [Medline].
Rybak LP. Ototoxicity of loop diuretics. Otolaryngol Clin North Am. Oct 1993;26(5):829-44. [Medline].
Rybak LP, Kelly T. Ototoxicity: bioprotective mechanisms. Curr Opin Otolaryngol Head Neck Surg. Oct 2003;11(5):328-33. [Medline].
Rybak LP, Whitworth CA. Ototoxicity: therapeutic opportunities. Drug Discov Today. Oct 1 2005;10(19):1313-21. [Medline].
Schacht J, Weiner N. Aminoglycoside-induced hearing loss: a molecular hypothesis. ORL J Otorhinolaryngol Relat Spec. 1986;48(2):116-23. [Medline].
Selimoglu E. Aminoglycoside-induced ototoxicity. Curr Pharm Des. 2007;13(1):119-26. [Medline].
Matz GJ. Aminoglycoside cochlear ototoxicity. Otolaryngol Clin North Am. Oct 1993;26(5):705-12.[Medline].
Talbert RL, Ludden TM, West RE. Rapid establishment of therapeutic serum concentrations of salicylates.J Clin Pharmacol. Feb-Mar 1979;19(2-3):108-12. [Medline].
Temple AR. Acute and chronic effects of aspirin toxicity and their treatment. Arch Intern Med. Feb 23 1981;141(3 Spec No):364-9. [Medline].
Uzun C, Koten M, Adali MK, et al. Reversible ototoxic effect of azithromycin and clarithromycin on transiently evoked otoacoustic emissions in guinea pigs. J Laryngol Otol. Aug 2001;115(8):622-8.[Medline].
Vasquez EM, Maddux MS, Sanchez J, et al. Clinically significant hearing loss in renal allograft recipients treated with intravenous erythromycin. Arch Intern Med. Apr 12 1993;153(7):879-82. [Medline].



