Parole chiave : Anchilosi stapedovestibolare, Sordità di trasmissione, Timpano normale, Platinotomia calibrata, Ausilio uditivo
 L’Otosclerosi è la più comune causa di perdita uditiva nella razza caucasica. Con questo termine, introdotto da Politzer nel 1894, si indica una malattia della capsula otica caratterizzata da fasi alternate di riassorbimento e formazione di tessuto osseo compatto L’otosclerosi è una malattia eredo-familiare sicuramente presente in alcuni degli ascendenti e che potrà quindi essere trasmessa a qualcuno dei discendent.E’ generalmente bilaterale e colpisce in genere soggetti giovani con maggior frequenza di sesso femminile (il sesso femminile è colpito con frequenza doppia di quello maschile).
L’Otosclerosi è la più comune causa di perdita uditiva nella razza caucasica. Con questo termine, introdotto da Politzer nel 1894, si indica una malattia della capsula otica caratterizzata da fasi alternate di riassorbimento e formazione di tessuto osseo compatto L’otosclerosi è una malattia eredo-familiare sicuramente presente in alcuni degli ascendenti e che potrà quindi essere trasmessa a qualcuno dei discendent.E’ generalmente bilaterale e colpisce in genere soggetti giovani con maggior frequenza di sesso femminile (il sesso femminile è colpito con frequenza doppia di quello maschile).
A causa di questo processo osteodistrofico si verifica un “blocco” (anchilosi) del movimento della staffa nella sua sede: la finestra ovale.
§ Quali sono le cause dell’Otosclerosi?
Benché non siano ancora disponibili ancora dati certi sulla eziopatogenesi della otosclerosi, sono state poste diverse ipotesi:
· Ipotesi genetica:[3]in molti soggetti con osteosclerosi (50%) è possibile riconoscere una forma familiare.La malattia si trasmette con un meccanismo di tipo ereditario, malattia autosomica dominante Trasmissione con penetranza variabile collegamento Tanzariello Categoria: Sordità Genetiche Trasmissione autosomica dominante, prevalentemente legato al cromosoma sessuale X collegamento Tanzariello Categoria: Sordità Genetich Trasmissione “X-Iinked”e ciò spiegherebbe la maggior incidenza della malattia nelle donne.
· Ipotesi virale: nelle cellule della capsula otica è presente il recettore glicoproteico per i paramyxovirus, rendendo le strutture dell’orecchio interno particolarmente sensibili alle infezioni sostenute da questi virus. In accordo con tale ipotesi, nei soggetti con otosclerosi è stata inoltre riscontrata la presenza di materiale genetico e proteico del virus del morbillo. In una recente ipotesi è che l’otosclerosi richiede una combinazione di un gene specifico con esposizione ad un virus specifico (ad esempio morbillo) per essere espressa e perchè si verifichi la perdita uditiva (McGuirt et al , 1998).
· Ipotesiautoimmune: in alcuni soggetti con otosclerosi è possibile riscontrare la presenza diautoanticorpidiretti verso ilcollagene
embrionaledi tipo II, tessuto presente nell’adulto soltanto a livello della capsula labirintica.
· Ipotesidisendocrina: frequente nel sesso femminile, associata allapubertà, all’allattamentoe allagravidanza.[2] L’otosclerosi insorge spesso nella pubertà, si aggrava con la gravidanza e soprattutto con l’allattamento, per cui ogni donna affetta dalla malattia deve essere informata che la gravidanza e l’allattamento dovrebbero essere, per quanto è possibile, accuratamente evitati. Un’altra ipotesi riguarda la funzioneparatiroidea, in quanto un disparatiroidismo potrebbe innescare l’osteodistrofia tipica di questa patologia.
· Ipotesivascolare: l’alterazione della struttura vascolare dell’orecchio interno può esitare verso un inadeguato apporto ematico alle strutture capsulari, con conseguente distrofia.
- ^ Albera e Rossi, Otorinolaringoiatria – II edizione, Torino, Edizioni Minerva Medica, 2008, p. 63, ISBN 978-88-7711-583-6.
- ^ De Souza, Christopher. Otosclerosis and Stapedectomy. New York: Thieme Medical Publishers, 2004.
- ^ Schrauwen I, Ealy M, Huentelman MJ, Thys M, Homer N, Vanderstraeten K, Fransen E, Corneveaux JJ, Craig DW, Claustres M, Cremers CW, Dhooge I, Van de Heyning P, Vincent R, Offeciers E, Smith RJ, Van Camp G, A Genome-wide Analysis Identifies Genetic Variants in the RELN Gene Associated with Otosclerosis, in Am. J. Hum. Genet., vol. 84, febbraio 2009, p. 328, DOI:10.1016/j.ajhg.2009.01.023, PMID 19230858.
§ Epidemiologia dell’ Otosclerosi
L’incidenza del riscontro di focolai otosclerotici nelle ossa temporali è variabile a seconda della razza: 10% nei caucasici. 5% negli asiatici. 1% negli afro-americani, 0% nei nativi americani. La manifestazione clinica è però 10 volte meno frequente di quella istologica: tra lo 0.21% nei caucasici. Mentre nella forma istologica non c’è differenza tra maschi e femmine, nella forma clinica il rapporto donna/uomo è circa 2:1. La sua forma asintomatica è spesso reperibile occasionalmente in circa un soggetto su 10; la forma sintomatica compare invece in un soggetto su 250.
[1] ^ Albera e Rossi, Otorinolaringoiatria – II edizione, Torino, Edizioni Minerva Medica, 2008, p. 63, ISBN978-88-7711-583-6.
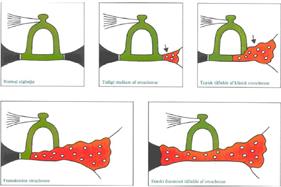
L’otosclerosi è caratterizzata da un decorso a stadi solitamente molto lento, ad eccezione di alcune forme giovanili caratterizzate da un rapido peggioramento. Il sistema endocrino svolge un importante ruolo nella progressione della malattia che sembra rapidamente aggravarsi in seguito ad un incremento dell’attività endocrina ed in particolare ad un aumento della produzione di estrogeni; ciò si manifesta durante la pubertà, la gravidanza, l’allattamento e con l’uso di contraccettivi orali.Clinicamente il sintomo principale è la riduzione dell’udito (ipoacusia) Fig.2.
 Generalmente esordisce come unilaterale per poi interessare successivamente entrambi i lati (nella maggior parte dei casi). La perdita uditiva è inizialmente di tipo trasmissivo, ovvero è esclusivamente dovuta ad un’alterata conduzione meccanica
Generalmente esordisce come unilaterale per poi interessare successivamente entrambi i lati (nella maggior parte dei casi). La perdita uditiva è inizialmente di tipo trasmissivo, ovvero è esclusivamente dovuta ad un’alterata conduzione meccanica
dell’onda sonora. E’ solitamente una
perdita che evolve lentamente nell’arco di mesi od anni, spesso con periodi di stabilizzazione. Quando la fissazione della staffa è
completa, clinicamente si evidenzia una perdita di 60 dB, la massima perdita trasmissiva possibile.
Nella maggior parte dei pazienti otosclerotici (70%) si manifestano gli acufeni Fig.3 (rumore nell’orecchio) unilaterali o bilaterali e la loro importanza cresce in relazione allo stadio della malattia. In alcuni casi (10-25%) si manifestano anche sintomi vestibolari rappresentati da:attacchi ricorrenti di vertigine Fig.4 oggettiva; sensazioni vertiginose  fugaci di carattere posizionale od instabilità.I focolai otospongiotici provocano ipoacusia (perdita di udito) con caratteristiche molto particolari: dapprima di tipo trasmissivo, si trasforma successivamente in una forma di tipo misto e poi percettivo a causa della progressiva sofferenza delle strutture nervose cocleari deputate alla percezione dei suoni (organo del Corti).La malattia porta inevitabilmente ad una perdita uditiva di notevole grado la cui evoluzione può essere talvolta rallentata da idonee terapie mediche.
fugaci di carattere posizionale od instabilità.I focolai otospongiotici provocano ipoacusia (perdita di udito) con caratteristiche molto particolari: dapprima di tipo trasmissivo, si trasforma successivamente in una forma di tipo misto e poi percettivo a causa della progressiva sofferenza delle strutture nervose cocleari deputate alla percezione dei suoni (organo del Corti).La malattia porta inevitabilmente ad una perdita uditiva di notevole grado la cui evoluzione può essere talvolta rallentata da idonee terapie mediche.
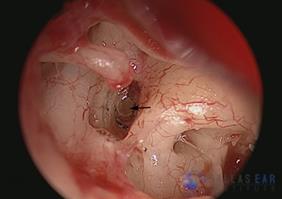
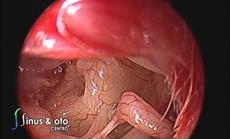
L’esame otoscopico solitamente evidenzia una membrana timpanica normale(Fig.5).
Fig.5a
|
|
|
Fig.5b segno di Schwartze orecchio destro Fig.5c orecchio sinistro
La valutazione strumentale include l’esame audiometrico tonale, l’esame audiometrico vocale e l’esame impedenzometrico con la valutazione dei riflessi stapediali.

La diagnosi si formula in base ai dati anamnestici e soprattutto ai risultati degli esami audiologici (audiometria, impedenzometria).
Fig. 6
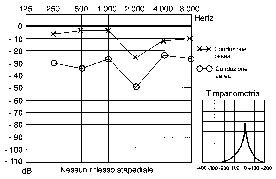
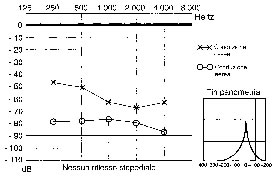
Timpanometria: Tanzariello sezione di audiologia adulti Esame Impedenzometrico : il timpanogramma è solitamente normale (tipo A). solitamente con un picco ridotto (As).
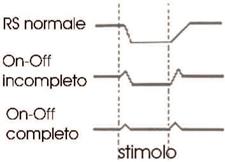
RCS: i riflessi cocleo-stapediali sono tipicamente assenti: Tanzariello sezione di audiologia adulti Esame Impedenzometrico sia per stimolo contro laterale sia ipsilaterale nella fase conclamata. nella fase iniziale, il RCS può essere presente all’inizio e alla fine dello stimolo (effetto ON-OF) (Fig. 6) e questo può dipendere dai vari gradi di fissità della staffa a livello della finestra ovale (Fig. 7).
Stadiazione Otosclerosi
|
|
|
|
|
|
Audiometria tonale Tanzariello sezione di audiologia adulti Audiometria tonale liminare : Permette la valutazione della trasmissione del suono per via aerea (da 250Hz a 8000Hz) e per via ossea (da 250HZ a 4000Hz). La soglia di trasmissione per via aerea indica il grado di perdita e determina se la perdita è grande abbastanza da giustificare una terapia chirurgica. La soglia di trasmissione per via ossea indica la funzione neurosensoriale e il grado di miglioramento uditivo ottenibile con la chirurgia, ovvero più è evidente il coinvolgimento dell’apparato neurosensoriale (ridotta trasmissione per via ossea) peggiore sarà la possibilità di recupero uditivo con l’intervento chirurgico. Inoltre, l’esame audiometrico tonale ci permette di monitorare l’evoluzione della malattia che ipoteticamente ha un andamento a stadi. l’ipoacusia è di tipo trasmissivo, nella fase iniziale con maggior interessamento delle frequenze sotto i 1000 Hz (I°stadio-fase 1) Fig. 8.
|
Stadio 1 |
ipoacusia trasmissiva tipicamente a carico delle basse frequenze (250-500-1000Hz): si parla di curva audiometrica ascendente
|
per diventare poi pantonale (II°stadio-fase 2):
Successivamente il coinvolgimento delle strutture cocleari produce un interessamento della via ossea (Fig. 9).
|
Stadio 2 |
ipoacusia trasmissiva progressivamente interessante anche le frequenze acute (2000-4000-8000Hz): curva audiometrica piatta. In questa fase si evidenzia la “Tacca di Carhart” , ovvero un innalzamento della soglia per via ossea a 2000Hz dovuta ad un cambio di impedenza nell’orecchio medio.
|
l progressivo peggioramento della funzione uditiva coinvolge sia la via aerea sia la via ossea e può portare ad una ipoacusia di tipo misto grave (fase III e IV) o profonda (fase terminale). Nella fase II si osserva un peggioramento in particolare per la frequenza 2000 Hz (tacca di Carhart). che scompare dopo l’intervento chirurgico,che sembra dovuto ad un fenomeno di riduzione della risonanza ossiculare e ridotta mobilità della perilinfa, più che ad un danno sensoriale vero e proprio (Fig. 9).
|
Stadio 3 |
l’ipoacusia progredisce ed inizia ad evidenziarsi un iniziale iinnalzamento della soglia per via ossea per le frequenze aacute, indice di un iniziale coinvolgimento dell’apparato nneurosensoriale (Fig. 10).
|
||
|
Stadio 4 |
la componente neurosensoriale dell’ipoacusia diventa sempre più importante fino a diventare predominante (Fig. 11).
|
Oltre alla ipoacusia i pazienti affetti da otosclerosi accusano gravi e persistenti acufeni e, saltuariamente, vertigini.
Talvolta l’evoluzione della patologia è molto lenta, in altri casi il paziente va ben presto incontro alla perdita totale dell’udito (detta anacusia se monolaterale; detta cofosi se bilaterale).
§ Come viene trattata Otosclerosi?
Ci sono quattro opzioni di trattamento:
Non fare nulla (approccio conservativo)
Otosclerosi non deve essere trattato. Di solito è consigliabile avere un test dell’udito ripetuto una volta all’anno (o prima se l’udito peggiora).
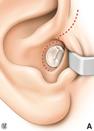
Amplificazione
 Gli apparecchi acustici sono di solito efficaci per la perdita uditiva. Fig. 11a
Gli apparecchi acustici sono di solito efficaci per la perdita uditiva. Fig. 11a
Terapia medica
La terapia medica si basa sulla somministrazione a cicli ripetuti di composti a base di fluoruro di calcio che sembra avere una certa azione nel rallentare l’evoluzione del processo di osteogenesi otosclerotico. Si usa nei casi inziali quando non è ancora indicata la chirurgia.
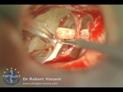
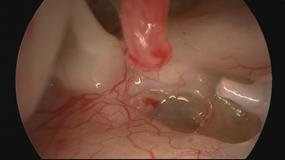
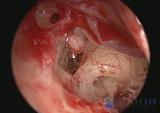
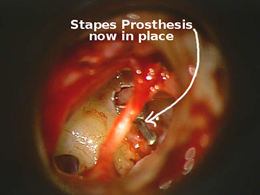
Terapia chirurgica Fig. 12
 La terapia è esclusivamente chirurgica e si basa sulla riabilitazione del movimento tra staffa e finestra ovale (intervento di stapedotomia con interposizione di protesi a pistone).Una valida alternativa all’intervento di microchirurgia tradizionale è rappresentata dalla tecnica laser con laser CO2
La terapia è esclusivamente chirurgica e si basa sulla riabilitazione del movimento tra staffa e finestra ovale (intervento di stapedotomia con interposizione di protesi a pistone).Una valida alternativa all’intervento di microchirurgia tradizionale è rappresentata dalla tecnica laser con laser CO2
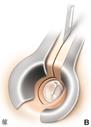
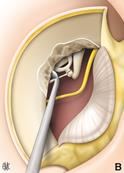
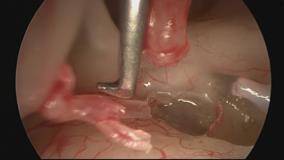
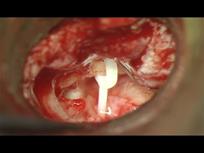
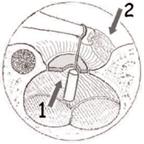
La terapia chirurgica, anche quando condotta da un chirurgo esperto, comporta una quota di rischio di danno irreversibile della funzione cocleare; è pertanto importante attenersi, nel porre l’indicazione all’operazione, a criteri precisi: una differenza tra soglia per via ossea e soglia per via aereea di 30-40 dB, nei casi in cui siano presenti acufeni o turbe dell’equilibrio, in forme caratterizzate da una sordità grave bilaterale con possibilità di recupero che consenta almeno l’uso della protesi. Il ricorso alla soluzione chirurgica è assolutamente sconsigliabile quando l’orecchio in causa è l’unico orecchio udente. L’intervento per l’otosclerosi si definisce “stapedectomia” (asportazione totale della staffa compresa la platina). Fig. 13 o “stapedotomia” (asportazione della sovrastruttura della staffa lasciando in sede la platina).

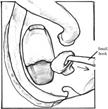
Fig. 13- Stapedectomia. f = nervo facciale, i = incudine, s = staffa (sovrastruttura e crura), o = focolaio di otosclerosi, p = platina della staffa. La tecnica di stapedectomia con stapedioplastica prevede la rimozione completa della staffa (2) in unico o più frammenti e l’utilizzazione di un pistone o di altra protesi sostitutiva della staffa (3). La finestra ovale, sede della staffa, viene solitamente protetta con un frammento di vena o altro tessuto connettivo prelevato al paziente durante l’intervento. In alcuni casi può essere utilizzata vena bovina conservata. La tecnica di stapedectomia è oggi sostituita da metodiche meno traumatizzanti e viene usata solo in casi molto particolari.
|
|
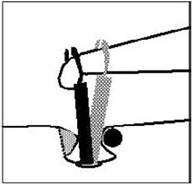
Fig. 14 – Stapedotomia. f = nervo facciale, i = incudine, s = staffa (sovrastruttura e crura), o = focolaio di otosclerosi, p = platina della staffa. Durante la stapedotomia , trovando situazioni anatomiche favorevoli, il chirurgo non rispetterà esattamente le fasi dell’intervento qui rappresentate e potrà, ad esempio, inserire il pistone prima di rimuovere la sovrastruttura della staffa, rendendo così le manovre di posizionamento ancora più sicure. |
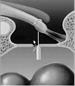
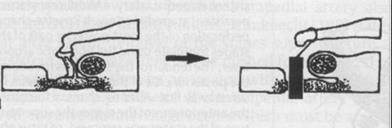
La stapedotomia Fig. 14 è oggi la tecnica operatoria più diffusa e consiste nell’asportare la sovrastruttura della staffa (capitello, crura anteriore e posteriore) lasciando in sede la platina sulla quale si pratica un piccolo foro dove verrà applicata la parte terminale della protesi. In tale modo la protesi mantiene la continuità tra la catena ossiculare (con l’estremità superiore è agganciata all’incudine) e il labirinto (l’estremità inferiore penetra nel foro praticato sulla platina) permettendo la trasmissione dell’onda sonora.
E’ importante ricordare che l’intervento di stapedectomia o stapedotomia deve essere fatto solo per migliorare la sordità e non per risolvere il problema degli acufeni.
COMPLICANZE E CAUSE DI INSUCCESSO DELL’INTERVENTO
Complicanze intraoperatorie
|
|
Fig.15.a — lacerazione della membrana timpanica: Tanzariello eccezionale per il cofochirurgo esperto, che sa anche come ripararla; (Vedi Sotto pag 147). |
|
|
Fig.15.b— persistenza dell‘arteria stapediale che occupa la finestra ovale e può costringere a sospendere l’intervento. (Vedi Sotto pag 160).
|
|
|
Fig.15.c — lesione della corda del timpano, che attraversa il campo operatorio (può essere spostata allungandola con la fresatura del canalino osseo in cui decorre: Pivotti G. e Sala T.). (Vedi Sotto).
|
|
|
Fig.15.d — lesione del nervo faciale: il nervo circonda la finestra ovale e pertanto confina spesso con il focolaio otosclerotico; si trova non di rado scoperto (deiscente) e talora anche uscito dal canale osseo (erniato). (Vedi Sotto 159). |
Una possibile lesione per manovra intraoperatoria va dichiarata al paziente, anche se rappresenta un’ eventualità assolutamente eccezionale.
E conosciuta la paralisi del 6° giorno per processi reattivi postoperatori del perinervio, che regredisce entro un limite di tempo non definibile (cura con cortisonici. diuretici ecc.) e va monitorizzata nel tempo con l’elettromiografia, se ha un lungo decorso.
E’ un motivo di più per adottare il metodo della interposizione; se si riscontra il nervo faciale deiscente. lo si copre unitamente alla finestra ovale ed alla regione platinare (vena senza avventizia, o pericondrio o fascia del muscolo temporale). è un evento molto raro, 0,4%, associata a stapedectomia. 1
Complicanze postoperatorie immediate
La labirintite postoperatoria è la complicanza più frequente, importante ed imprevedibile. Si manifesta nei giorni successivi all’intervento con:
— vertigini (spontanee o nei movimenti del capo), comparsa di ronzio od aumento se presente;
— oggettivamente si riscontrano: piccole scosse di nistagmo spontaneo oculare verso il lato operato; lateralizzazione della prova di Weber, per alcune frequenze, verso il lato non operato.
Tale reazione. a parità di difficoltà operatoria e di operatore, varia da paziente a paziente; si invocano le reazioni vasomotorie provocate dalle manovre sulla platina. la discesa di anche minime quantità di sangue dopo aver creato l’apertura nella platina della staffa. le nuove condizioni idrodinamiche dell’orecchio interno che comunica con l’orecchio medio (motivo di più di fare l’interposizione). il versamento sieroso postoperatorio dell’orecchio medio (che può agire nell’orecchio interno tramite la membrana della finestra rotonda). la presenza seppur rara di una flogosi otitica vera e propria per la presenza di germi resistenti agli antibiotici somministrati, la possibilità che le manovre sul focolaio otosclerotico abbiano indotto una reazione autoimmune.
È noto che 1’ idrope endolinfatico rappresenta la prima e più frequente reazione del labirinto membranoso ad ogni situazione di emergenza dell’orecchio interno; i sintomi di “irritazione” labirintica postoperatoria possono essere spiegati anche con tale eventualità (cessano con l’impiego di diuretici).
Per prevenire la labirintite postoperatoria abbiamo sempre instaurato subito dopo l’intervento una terapia come se fosse già in atto questa temibile complicanza.
Se i sintomi da reazione labirintica pur attenuati durano a lungo, anche senza evidente danno uditivo alle strutture dell’orecchio interno, occorre tener presenti:
|
|
Fig.16.a — il reparative granuloma di Schucknecht consiste nella formazione in eccesso di tessuto di granulazione nella regione della fresatura dell’anulus tilnpanicus, che scende nella cassa sino a penetrare nella finestra ovale, con fenomeni tossici a carico dell’orecchio interno; secondo Harris e Weiss si riscontra nell’ 1-5% degli operati; (Vedi Sotto 169).
|
|
|
Fig.16.b — la lunghezza eccessiva della protesi (calcolata al quarto di millimetro, in modo perfetto se vi vuole ottenere la chiusura completa del gap; (Vedi Sotto 150)
|
|
|
Fig.16.c — la stenosi tubarica, che spinge il timpano e la protesi verso l’orecchio interno (un altro motivo di usare l’interposizione), risolvibile con la manovra di Valsalva o le insufflazioni tubariche (e sistemando la situazione delle fosse nasali!);
|
|
|
Fig.16.d — l’abnorme mobilità del frammento di platina lasciata in sito nella platinotomia; (Vedi Sotto 151-2).
|
|
|
Fig.16.e — la formazione di una fistola labirintica intorno alla protesi (che non esiste con l’interposizione); (Vedi Sotto 153)
|
È stata descritta eccezionalmente una sofferenza otolitica del tipo della “cupololitiasi” (Schucknecht).
Se l’intervento ha raggiunto il sito scopo, il paziente, quando viene stamponato il condotto uditivo esterno al 3-5° giorno, riferisce di sentire “rimbombare” la voce dell‘esaminatore.
Complicanze postoperatorie tardive
— Reparative granuloma: ricorre frequentemente nella letteratura americana, come causa di una perdita uditiva neurosensoriale che può insorgere dalla prima alla sesta settimana dopo l’intervento, anche se in precedenza l’udito è migliorato: si può giungere a gravi perdite irreversibili; il reintervento, nel dubbio, si impone e con urgenza.
— L’insufficienza vertebra-basilare: comune dopo i 40 anni, viene segnalata più volte da Causse J.. come causa di deficiente irrorazione e sofferenza dell’orecchio interno anche nel periodo postoperatorio immediato.
— La funzione tubarica non perfetta: generalmente a seguito di flogosi recidivanti delle fosse nasali (infettive e/o allergiche) è la causa più comune del riformarsi dell’intervallo (gap) tra via aerea ed ossea. perché la diminuita pressione nell’orecchio medio porta alla retrazione timpanica con infossamento della protesi nella finestra ovale ed irrigidimento del neosistema trasmissivo: si consiglia. come manovra di sollievo immediato. l’insufflazione tubarica o la manovra di Valsalva.
Per tale motivo conviene sempre sistemare con cure mediche e/o chirurgiche la situazione rinosinusale prima di procedere all’intervento per otosclerosi (continuando intanto il suo trattamento medico).
Norme da seguire dagli operati
— Evitare rumori intensi nell’attività lavorativa o per diporto (discoteca!).
— Non assumere i farmaci ototossici: aminoglicosidi, il chinino e derivati, l’acido salicilico e derivati cioè l’aspirina (permessa saltuariamente in piccola quantità), alcuni diuretici come la furosemide e l’acido etacrinico; permessa la “minipillola”.
— Evitare al massimo le flogosi rinosinusali (raffreddori) per le modificazioni che inducono nella funzione tubarica e nella pressione dell’orecchio medio.
— Dopo il primo anno sono permessi viaggi in aereo e discesa rapida dalla montagna, meglio se ricorrendo ad antistarninici e a polverizzazioni endonasali di vasocostrittori per favorire l’equilibrio pressorio nelle due superfici della membrana timpanica, tramite la tuba.
Problema del secondo orecchio
L’otosclerosi non di rado è bilaterale.
Ogni anno, è obbligatorio fare controllo dell’udito (audiogramma e Riflesso Cocleo Stapediale).
Il secondo orecchio “può” essere operato su richiesta del paziente un anno dopo il primo intervento ben riuscito:
— se la soglia per via aerea sta uscendo o è uscita dai limiti dell’udito sociale;
— anche se non mostra alcun segno di peggioramento, cioè è stabile da più anni, su richiesta del paziente.
L’ascolto biauricolare permette la pienezza dell’udito in tutte le circostanze della vita.
Il secondo orecchio “deve” essere operato (sempre a distanza di un anno dall’intervento ben riuscito sul primo orecchio) se:
— l’udito peggiora, anche con terapia medica adeguata;
— l’otosclerosi si “labirintizza” (innalzamento della soglia per via ossea, oltre che aerea):
— una giovane paziente desidera una gravidanza.
Il paziente deve sempre avere con sé ad ogni contro/lo, ovunque sia fatto, tutti gli esami dell’udito ed il referto “dettagliato” dell‘intervento o degli interventi cui è stato sottoposto.
OTOSCLEROSI E GRAVIDANZA
Otosclerosi monolaterale
— fare un controllo dell’ udito ed una cura medica personalizzata prima della gravidanza:
— farsi operare prima della gravidanza se l’udito è peggiorato negli ultimi anni e Con aumento del ronzio (nonostante cure mediche adeguate):
— evitare l’allattamento al seno;
— fare sempre un controllo dell’udito alla fine della gravidanza e riprendere una terapia medica personalizzata.
Otosclerosi bilaterale
— fare sempre una cura medica personalizzata prima e dopo la gravidanza;
— se la perdita uditiva è importante, è peggiorata negli ultimi anni, si accompagna ad acufeni (ronzii) in particolare prima e durante il periodo mestruale (indice di malattia in attività) è necessario prima della gravidanza sistemare la situazione operando entrambi gli orecchi, a distanza di un anno.
Problema dei figli
L’ otosclerosi, come si è già scritto, è una malattia autosomica con penetranza genetica del 40% (Causse I. e J.B.); questo vuol dire che non è obbligatoriamente ereditaria, e tende generalmente a saltare anche più generazioni (se non esiste un’eredità ignorata nell’ altro coniuge).
Se vi è il sospetto che un figlio, o meglio una figlia (la malattia predilige il sesso fermninile) non sente perfettamente, a partire dall’età di 10-12 anni è bene fare un audiogramma tonale (e vocale) e la ricerca del riflesso cocleo-stapediale; si potrà così scoprire la malattia sin dall’inizio e trattarla con cure mediche, secondo lo schema di Shambaugh e di Causse J., bloccando così la sua progressione e proteggendo le strutture dell’ orecchio interno.
Cenni storici
 L’otosclerosi è una patologia nota agli otologi da due secoli. Essa ha tuttavia suscitato numerose controversie e resta ancora, ad oggi, un soggetto di studio fisiopatologico e di ricerca terapeutica. La prima descrizione di un blocco stapedio a livello della finestra ovale è dovuta all’anatomista italiano Valsalva [4] che descrisse per la prima volta nel 1704 l’anchilosi della staffa nella finestra del vestibolo (ovale). Toynbee [5] collegò nel 1841 questa scoperta anatomica e la presenza di una sordità, è il primo a ipotizzare la relazione tra sordità e anchilosi stapedovestibolare nel 1849. Questo anatomopatologo inglese
L’otosclerosi è una patologia nota agli otologi da due secoli. Essa ha tuttavia suscitato numerose controversie e resta ancora, ad oggi, un soggetto di studio fisiopatologico e di ricerca terapeutica. La prima descrizione di un blocco stapedio a livello della finestra ovale è dovuta all’anatomista italiano Valsalva [4] che descrisse per la prima volta nel 1704 l’anchilosi della staffa nella finestra del vestibolo (ovale). Toynbee [5] collegò nel 1841 questa scoperta anatomica e la presenza di una sordità, è il primo a ipotizzare la relazione tra sordità e anchilosi stapedovestibolare nel 1849. Questo anatomopatologo inglese
 pubblicò, nel 1853, i risultati dello studio di 1 659 rocche temporali su cui rilevava 39 anchilosi. Nel 1881 il tedesco von Troeltsch spiega la fissazione della staffa con una sclerosi che interessa la mucosa della cassa del timpano e propone, così, il termine di «otosclerosi» . Nel 1893 Politzer respinge l’ipotesi fisiopatologica di un catarro secco, allora in voga, e pone l’origine della malattia a livello della capsula otica. Nel 1912 Siebenmann descrisse alterazioni ossee tipo osso areolare e propose la denominazione otospongiosi Mudry A. Adam Politzer (1835-1920) 2006 ; È in effetti nel 1914 che viene descritta la forma classica della malattia: l’otosclerosi di Lermoyez .Essa colpisce di preferenza il genere femminile nel corso del terzo e del quarto decennio e provoca ipoacusia e acufeni con un’evoluzione progressiva segnata da puntate per- e post partum. La nozione di precedenti familiari è attuale e già nota. . Il trattamento chirurgico dell’otosclerosi ha conosciuto anch’esso una storia tumultuosa. La prima tecnica, la mobilizzazione stapedia, è stata proposta da Ménière nel 1842 per la cofochirurgia ; Kessel è stato il primo ad attuarla nel 1876 I primi tentativi di chirurgia sulla base (platina) della staffa sono stati realizzati nel 1878 da Kessel. La base è mobilizzata attraverso una via d’accesso antroatticale [6], Egli migliorò incidentalmente l’udito di un paziente mobilizzando una staffa anchilotica durante una chirurgia per otite cronica. Egli è anche un precursore della seconda tecnica chirurgica della sindrome otosclerotica: la fenestrazione del canale semicircolare laterale. Così, egli constatò, in occasione di uno studio autoptico, una frattura della rocca che attraversava il canale semicircolare laterale. Si tratta di un paziente seguito per otosclerosi vittima di un trauma cranico mortale che aveva in parte recuperato l’udito nell’intervallo. Kessel tenta, allora di riprodurre questa fistola con l’aiuto di un martello e di una sgorbia. In Francia, Camille Miot fu un pioniere della mobilizzazione stapedia e rilevò già il carattere transitorio del miglioramento uditivo con questa procedura Miot C,: Adrien Delahaye; 1884-1888. La fine del XIXsecolo è marcata dall’apporto delle tecniche americane. Alderton propone una stapedectomia semplice quando una mobilizzazione è fallita. Blake realizza, dal canto suo, una stapedectomia associata a una ricopertura della finestra vestibolare mediante la membrana timpanica [1 House H.P. 1993 Tuttavia, davanti al numero importante di insuccessi e di casi di meningiti letali, la chirurgia dell’otosclerosi venne momentaneamente abbandonata, condannata in particolare da Siebenmann e Politzer.; quindi, fin dalla fine del XIX secolo, i tentativi si sono moltiplicati in Francia (Boucheron, Miot, Moure), negli Stati Uniti (Burnett) e in Germania (Passow, Schwartze) [7]. La via d’accesso comportava una miringectomia posteriore (per evitare che la breccia timpanica si richiudesse immediatamente per poter mobilizzare nuovamente la staffa nei giorni successivi) e una mobilizzazione della staffa accompagnata dalla rimozione facoltativa di alcuni ossicini quali il martello e l’incudine. Tuttavia, la frequenza degli insuccessi e delle complicanze ha portato a condannare questa chirurgia in occasione del Congresso internazionale di
pubblicò, nel 1853, i risultati dello studio di 1 659 rocche temporali su cui rilevava 39 anchilosi. Nel 1881 il tedesco von Troeltsch spiega la fissazione della staffa con una sclerosi che interessa la mucosa della cassa del timpano e propone, così, il termine di «otosclerosi» . Nel 1893 Politzer respinge l’ipotesi fisiopatologica di un catarro secco, allora in voga, e pone l’origine della malattia a livello della capsula otica. Nel 1912 Siebenmann descrisse alterazioni ossee tipo osso areolare e propose la denominazione otospongiosi Mudry A. Adam Politzer (1835-1920) 2006 ; È in effetti nel 1914 che viene descritta la forma classica della malattia: l’otosclerosi di Lermoyez .Essa colpisce di preferenza il genere femminile nel corso del terzo e del quarto decennio e provoca ipoacusia e acufeni con un’evoluzione progressiva segnata da puntate per- e post partum. La nozione di precedenti familiari è attuale e già nota. . Il trattamento chirurgico dell’otosclerosi ha conosciuto anch’esso una storia tumultuosa. La prima tecnica, la mobilizzazione stapedia, è stata proposta da Ménière nel 1842 per la cofochirurgia ; Kessel è stato il primo ad attuarla nel 1876 I primi tentativi di chirurgia sulla base (platina) della staffa sono stati realizzati nel 1878 da Kessel. La base è mobilizzata attraverso una via d’accesso antroatticale [6], Egli migliorò incidentalmente l’udito di un paziente mobilizzando una staffa anchilotica durante una chirurgia per otite cronica. Egli è anche un precursore della seconda tecnica chirurgica della sindrome otosclerotica: la fenestrazione del canale semicircolare laterale. Così, egli constatò, in occasione di uno studio autoptico, una frattura della rocca che attraversava il canale semicircolare laterale. Si tratta di un paziente seguito per otosclerosi vittima di un trauma cranico mortale che aveva in parte recuperato l’udito nell’intervallo. Kessel tenta, allora di riprodurre questa fistola con l’aiuto di un martello e di una sgorbia. In Francia, Camille Miot fu un pioniere della mobilizzazione stapedia e rilevò già il carattere transitorio del miglioramento uditivo con questa procedura Miot C,: Adrien Delahaye; 1884-1888. La fine del XIXsecolo è marcata dall’apporto delle tecniche americane. Alderton propone una stapedectomia semplice quando una mobilizzazione è fallita. Blake realizza, dal canto suo, una stapedectomia associata a una ricopertura della finestra vestibolare mediante la membrana timpanica [1 House H.P. 1993 Tuttavia, davanti al numero importante di insuccessi e di casi di meningiti letali, la chirurgia dell’otosclerosi venne momentaneamente abbandonata, condannata in particolare da Siebenmann e Politzer.; quindi, fin dalla fine del XIX secolo, i tentativi si sono moltiplicati in Francia (Boucheron, Miot, Moure), negli Stati Uniti (Burnett) e in Germania (Passow, Schwartze) [7]. La via d’accesso comportava una miringectomia posteriore (per evitare che la breccia timpanica si richiudesse immediatamente per poter mobilizzare nuovamente la staffa nei giorni successivi) e una mobilizzazione della staffa accompagnata dalla rimozione facoltativa di alcuni ossicini quali il martello e l’incudine. Tuttavia, la frequenza degli insuccessi e delle complicanze ha portato a condannare questa chirurgia in occasione del Congresso internazionale di  medicina di Parigi nel 1900: «Tutti i tentativi di mobilizzazione della staffa sono non solo inutili ma, per giunta, spesso pericolosi». Denker conclude: «Non vi è alcun avvenire nella chirurgia della sordità» [8]. La denominazione di otosclerosi venne data da Politzer nel 1889. Tuttavia, il termine di otospongiosi venne conservato in Francia dopo i lavori di Siebenmann (1912).
medicina di Parigi nel 1900: «Tutti i tentativi di mobilizzazione della staffa sono non solo inutili ma, per giunta, spesso pericolosi». Denker conclude: «Non vi è alcun avvenire nella chirurgia della sordità» [8]. La denominazione di otosclerosi venne data da Politzer nel 1889. Tuttavia, il termine di otospongiosi venne conservato in Francia dopo i lavori di Siebenmann (1912).
Si deve attendere il 1910 perché Jenkins rilanci la fenestrazione del dotto semicircolare laterale. Il suo allievo svedese Holmgren proseguì lo sviluppo di questo gesto chirurgico e formò, in questo senso , il francese Sourdille Quest’ultimo migliorò la tecnica ricoprendo la fistola creata mediante un lembo cutaneo dal condotto uditivo esterno, mettendo in contatto la breccia con l’ambiente esterno e ristabilendo, così, una migliore trasmissione. Egli riferì in questa occasione un 64% di risultati favorevoli su 109 pazienti operati. Questa timpanolabirintotomia si esegue in tre fasi: dopo una mastoidectomia egli confezionava un lembo cutaneo a partire dal condotto uditivo esterno. Questo lembo ricopre la fistola del canale semicircolare laterale. Fu nel 1930 che Sourdille pubblicò i primi risultati di una «nuova tecnica chirurgica per il trattamento delle sordità di conduzione» [9]. L’intervento, descritto in numerosi congressi in tutto il mondo, viene eseguito in tre tempi e comprende una resezione della testa del martello, una trapanazione del canale semicircolare laterale e la chiusura di questa fistola con un lembo timpanomeatale. Molti autori ripresero e svilupparono la tecnica di Sourdille modificando la tecnica di realizzazione del lembo timpanomeatale, la via d’accesso, la resezione ossiculare e la modalità di copertura della fistola. Malgrado ciò, la tecnica rimaneva relativamente complessa e rischiosa nonostante la comparsa degli antibiotici [7]. Negli Stati Uniti Lempert, di origine polacca, semplificò il metodo di Sourdille, realizzando l’intervento in un solo tempo [1 House 1993 ; Egli fu il maestro di House e Shambaugh che perpetuarono l’uso di questa tecnica fino agli anni Sessanta. Questa fenestrazione non permette però una chiusura completa del Rinne audiometrico ed è gravata dal 10% di recidiva per chiusura della fistola e da un 2% di labirintizzazione con sordità neurosensoriale [1 House H.P. The evolution of otosclerosis surgery Otolaryngol. Clin. North Am. 1993 ; 26 : 323-333
 L’era moderna della chirurgia dell’otospongiosi inizia, in effetti, nel 1953 con Samuel Rosen, che[9] scoprì casualmente, mobilizzando accidentalmente la staffa, che si produceva un miglioramento dell’udito. Egli continuò allora per questa via e, per la prima volta, vennero constatate delle chiusure totali del Rinne audiometrico, benché transitorie. Venne descritta la tecnica di mobilizzazione della staffa; essa fu utilizzata progressivamente negli Stati Uniti e in Europa, sostituendo la tecnica della fenestrazione di Sourdille. Il carattere transitorio dei risultati funzionali portò i chirurghi ad agire più drasticamente sulla base della staffa. Guillon, Michel Portmann, Fowler e quindi Shea proseguirono i lavori fino alla pubblicazione della stapedectomia con interposizione [10]. La prima stapedectomia ebbe
L’era moderna della chirurgia dell’otospongiosi inizia, in effetti, nel 1953 con Samuel Rosen, che[9] scoprì casualmente, mobilizzando accidentalmente la staffa, che si produceva un miglioramento dell’udito. Egli continuò allora per questa via e, per la prima volta, vennero constatate delle chiusure totali del Rinne audiometrico, benché transitorie. Venne descritta la tecnica di mobilizzazione della staffa; essa fu utilizzata progressivamente negli Stati Uniti e in Europa, sostituendo la tecnica della fenestrazione di Sourdille. Il carattere transitorio dei risultati funzionali portò i chirurghi ad agire più drasticamente sulla base della staffa. Guillon, Michel Portmann, Fowler e quindi Shea proseguirono i lavori fino alla pubblicazione della stapedectomia con interposizione [10]. La prima stapedectomia ebbe  luogo nel 1956 e Shea, nel 1960, realizzò la trapanazione della base della staffa con l’inserimento di uno stantuffo in Teflon®. Schuknecht usò, dal canto suo, una protesi in filo di metallo che provocava una minore lisi dell’incudine e una minore protrusione vestibolare. Tuttavia, in realtà è Myers che inventa nel 1970 la chirurgia attuale dell’otosclerosi, procedendo a una stapedectomia attraverso cui posiziona un pistone transplatinare. In seguito, i miglioramenti sono stati soprattutto tecnici, con l’apporto di microfrese taglianti e poi diamantate e, a partire dal 1979, del laser (CO2 , argon, potassio-titanyl-fosfato [KTP]). Si deve a Perkins e quindi a McGee il ruolo del laser nella strategia chirurgica. I suoi vantaggi sono una riduzione del rischio di frattura platinaria e l’innocuità per l’orecchio interno con il controllo termico all’estremità della fibra (sistema Fibertom™). Le ultime innovazioni sono rappresentate dai laser diodi e YAG (thulium ed erbium).
luogo nel 1956 e Shea, nel 1960, realizzò la trapanazione della base della staffa con l’inserimento di uno stantuffo in Teflon®. Schuknecht usò, dal canto suo, una protesi in filo di metallo che provocava una minore lisi dell’incudine e una minore protrusione vestibolare. Tuttavia, in realtà è Myers che inventa nel 1970 la chirurgia attuale dell’otosclerosi, procedendo a una stapedectomia attraverso cui posiziona un pistone transplatinare. In seguito, i miglioramenti sono stati soprattutto tecnici, con l’apporto di microfrese taglianti e poi diamantate e, a partire dal 1979, del laser (CO2 , argon, potassio-titanyl-fosfato [KTP]). Si deve a Perkins e quindi a McGee il ruolo del laser nella strategia chirurgica. I suoi vantaggi sono una riduzione del rischio di frattura platinaria e l’innocuità per l’orecchio interno con il controllo termico all’estremità della fibra (sistema Fibertom™). Le ultime innovazioni sono rappresentate dai laser diodi e YAG (thulium ed erbium).
Basi anatomiche EMC (Bonfils P., Chevallier J.M. 11)
La fossetta della finestra del vestibolo (o finestra ovale) appartiene alla parete mediale della cassa del timpano (Figura 17).
|
Figura 17. Anatomia della regione della finestra del vestibolo. 1. Epitimpano; 2. canale facciale; 3. fossetta della finestra del vestibolo; 4. eminenza piramidale; 5. promontorio; 6. fossetta della finestra della coclea; 7. ipotimpano; 8. prominenza del canale del muscolo tensore del timpano; 9. nervo timpanico. |
Essa è delimitata:
• superiormente dalla prominenza del canale facciale contenente il nervo facciale che forma un arco al di sopra della finestra del vestibolo;
• anteriormente e inferiormente dal promontorio. All’estremità anteriore della finestra del vestibolo si trova la fissula ante fenestram;
• posteriormente dalla parete posteriore della cavità timpanica che determina l’eminenza piramidale;
• all’interno dalla rampa vestibolare dell’organo spirale.
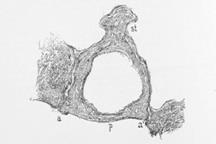
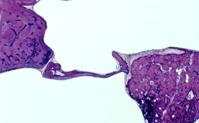
La finestra del vestibolo è un orifizio scavato nella parete mediale della cavità timpanica; ha una forma ellittica, lunga 3 mm e alta 1,5 mm.
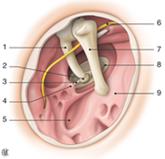
I rapporti laterali della fossetta della finestra del vestibolo sono gli ossicini situati nella cassa del timpano (Figura 18).
|
Figura 18. Anatomia degli ossicini. 1. Legamenti sospensori; 2. testa del martello; 3. corpo dell’incudine; 4. ramo lungo dell’incudine; 5. muscolo stapedio; 6. base della staffa; 7. ramo della staffa; 8. processo lenticolare dell’incudine.
|
|
|
|
Figura 19. Anatomia della staffa. 1. Processo lenticolare dell’incudine; 2. finestra del vestibolo; 3. tendine del muscolo stapedio; 4. muscolo stapedio; 5. base della staffa; 6. legamento anulare.
|
Il martello è l’ossicino più laterale, la cui testa, a forma di maglio, è situata nell’attico. Esso si articola con l’incudine il cui ramo lungo, che termina con un rigonfiamento (il processo lenticolare), si dirige in basso e passa sulla verticale della fossetta della finestra del vestibolo. Essa maschera la finestra del vestibolo nella via d’accesso utilizzata durante la chirurgia dell’otosclerosi. La staffa è il solo ossicino situato interamente nell’atrio della cassa del timpano, a livello della fossetta della finestra del vestibolo. Essa ha la forma di staffa di equitazione, con una testa che si articola con il processo lenticolare dell’incudine, due rami che formano un’arcata ossea e una base, la platina, che occlude la finestra del vestibolo. La platina è separata dai margini della finestra del vestibolo dal legamento anulare la cui flessibilità permette alla base della staffa di muoversi entro la finestra e di trasmettere, così, le variazioni di pressione ai liquidi endolabirintici. Il muscolo stapedio, innervato dal nervo del muscolo stapedio, ramo della terza porzione del nervo facciale intrapetroso, nasce dall’eminenza piramidale e termina sulla testa della staffa (Figura 19). La vascolarizzazione della staffa avviene principalmente mediante un ramo dell’arteria stilomastoidea che accompagna il tendine del muscolo stapedio. Bisogna sottolineare la precarietà della vascolarizzazione dell’apofisi lenticolare dell’incudine, che dipende da questa vascolarizzazione stapedia e dalla rete superficiale sottomucosa della cassa del timpano. Questa vascolarizzazione precaria spiega la possibilità, dopo una sezione del tendine del muscolo stapedio e la rimozione della staffa, eseguite durante la chirurgia dell’otosclerosi, di vedere comparire una necrosi dell’estremità inferiore del ramo lungo dell’incudine, provocando una caduta del pistone che le era agganciato.
La corda del timpano è un ramo della terza porzione intrapetrosa del nervo facciale. Essa passa nel canale posteriore della corda del timpano scavato nella parete posteriore della cassa del timpano, da cui fuoriesce attraverso l’ostium introïtus. Essa si dirige, allora, in avanti e in alto, per passare all’esterno del ramo lungo dell’incudine e poi all’interno del manico del martello. È in questa parte che viene aggredita nella via di accesso della chirurgia dell’otosclerosi. L’ostium introïtus è situato presso il solco timpanico nel quale si inserisce l’anello timpanico. Esso è a contatto con il solco e può quindi essere leso durante la disinserzione dell’anello timpanico (Figura 20).
|
Figura 20 Anatomia della corda del timpano. 1. Incudine; 2. processo lenticolare dell’incudine; 3. tendine del muscolo stapedio; 4. eminenza piramidale; 5. fossetta della finestra della coclea; 6. corda del timpano; 7. martello; 8. base della staffa; 9. promontorio.
|
TECNICHE CHIRURGICHE
Lo sviluppo delle tecniche utilizzate nel trattamento dell’otosclerosi è interessante. Sono poche le patologie che hanno suscitato tanto interesse. Nel 1704, Valsalva è stato il primo a descrivere un blocco stapediale sul cadavere di un sordo. Nel 1857, Toynbee ha riscontrato questa anchilosi in un numero non trascurabile di rocche, concludendo, quindi, che «l’anchilosi della staffa nella finestra ovale è una causa frequente di sordità».
I primi studi chirurgici iniziarono con Kessel, verso la metà del XIX secolo. Egli mise in evidenza una frattura del canale semicircolare orizzontale sulla rocca di un paziente sordo che aveva recuperato l’udito e poi era morto dopo la caduta da un vagone. I tentativi terapeutici con frattura del canale semicircolare orizzontale utilizzando il martello e la sgorbia si rivelarono un insuccesso. Nello stesso periodo, Ménière descrisse il primo movimento stapedico. Questa descrizione coincide con lo sviluppo della fisiologia, la scoperta dei batteri e dell’asepsia, così come l’allestimento di una strumentazione appropriata destinata all’otorinolaringoiatria, come lo specchio frontale e il diapason. . I primi tentativi di chirurgia sulla base (platina) della staffa sono stati realizzati nel 1878 da Kessel. La base è mobilizzata attraverso una via d’accesso antroatticale [6], quindi, fin dalla fine del XIX secolo, i tentativi si sono moltiplicati in Francia (Boucheron, Miot, Moure), negli Stati Uniti (Burnett) e in Germania (Passow, Schwartze) [7]. La via d’accesso comportava una miringectomia posteriore (per evitare che la breccia timpanica si richiudesse immediatamente per poter mobilizzare nuovamente la staffa nei giorni successivi) e una mobilizzazione della staffa accompagnata dalla rimozione facoltativa di alcuni ossicini quali il martello e l’incudine.
Nel 1894, Politzer dimostrò che questa patologia non era dovuta, come si pensava, alla presenza di secrezioni nell’orecchio medio, bensì a una patologia della capsula otica.
Negli Stati Uniti, i pionieri della chirurgia della staffa sono stati Jack , Burnett , Blake e Alderton . Blake, in particolare, ha descritto molte tecniche, tra le quali, un’esposizione della cassa con exeresi dell’incudine o del martello, al fine di migliorare la mobilità della staffa. Egli tentò anche delle stapedectomie complete con chiusura della finestra mediante il timpano. L’Autore notò all’epoca che questa tecnica non determinava cofosi. Parallelamente, in Francia, furono praticate delle mobilizzazioni della staffa. Gli insuccessi di questa tecnica furono dovuti alle recidive dell’ipoacusia per chiusura della fenestrazione e ad alcuni casi di meningiti mortali. Tuttavia, la frequenza degli insuccessi e delle complicanze ha portato a condannare questa chirurgia in occasione del Congresso internazionale di medicina di Parigi nel 1900: «Tutti i tentativi di mobilizzazione della staffa sono non solo inutili ma, per giunta, spesso pericolosi». Denker conclude: «Non vi è alcun avvenire nella chirurgia della sordità» [8]. La denominazione di otosclerosi venne data da Politzer nel 1889. Tuttavia, il termine di otospongiosi venne conservato in Francia dopo i lavori di Siebenmann (1912). Dopo forti critiche gli studi terapeutici si bloccarono per alcuni anni. Il primo caso di fenestrazione fu praticato nel 1917 da Holmgren. La tecnica consiste nella fenestrazione del canale semicircolare superiore ricoperto dalla dura madre. Nel 1930, Sourdille ricoprì la fenestrazione del canale semicircolare esterno con un lembo cutaneo del condotto uditivo esterno. La breccia del canale semicircolare era così a contatto con l’ambiente esterno, consentendo una migliore trasmissione. Questa tecnica caratterizzata da tre momenti chirurgici è alla base delle differenti tecniche di fenestrazione che seguirono. Essa è stata perfezionata (un solo tempo chirurgico) e divulgata negli Stati Uniti nel corso degli anni Quaranta. La percentuale di sordità postoperatoria era del 2% e la prova di Rinne non si arrestava mai completamente. Nel 1953 Rosen [9] scoprì casualmente, mobilizzando accidentalmente la staffa, che si produceva un miglioramento dell’udito. Nel 1955, Rosen ottiene delle stabilizzazioni complete del Rinne grazie a una mobilizzazione della staffa, ma i risultati sono stati per lo più transitori. La polemica tra i sostenitori della fenestrazione o della mobilizzazione fu molto accesa. Parallelamente sono stati fatti dei tentativi di platinotomia . Nel 1958, Shea fu stato il primo a descrivere la tecnica che consisteva nella rimozione della staffa, nella ricopertura della finestra ovale con un innesto venoso e nell’apposizione di una protesi in Nylon® (polietilene) fra l’incudine e la finestra. Nel corso degli anni è stato migliorato il materiale utilizzato per la realizzazione delle protesi. Nel 1970, Myers ha introdotto una nuova tecnica: la platinotomia, con posizionamento di un pistone transplatinario il cui diametro è aumentato nel corso degli anni (0,2 mm dopo i primi studi). I successivi tentativi di miglioramento si sono in seguito concentrati sulla strumentazione utilizzata nella chirurgia della platina, con l’introduzione dei microtrapani e del laser.
EPIDEMIOLOGIA
Incidenza nelle diverse popolazioni
Esiste una predisposizione razziale all’otosclerosi, essendo, infatti, molto più frequente nella razza bianca.
Incidenza nella razza bianca
È in questa razza che la malattia ha la più alta incidenza e, di conseguenza, è studiata maggiormente (popolazione bianca dell’Europa e degli Stati Uniti).
Bisogna fare una distinzione tra l’otosclerosi clinicamente evidente e l’otosclerosi istologica. L’otosclerosi clinica ha un’incidenza dello 0,1-2%. Queste differenze si spiegano con le differenze delle popolazioni testate e la modalità di screening (sistematica o consultazioni specialistiche). Ecco alcuni esempi di studi:
• 0,1% in Lituania nel 1974
• 0,3% in Norvegia nel 1974
• 1% nel Regno Unito nel 1961
• 2% a Londra nel 1967
Sembrano esistere delle differenze all’interno della stessa razza caucasica in relazione ad alcuni tratti fenotipici. Anche Cawthorne ha segnalato che l’incidenza dell’otosclerosi è due volte e mezzo più elevata nei soggetti con i capelli chiari rispetto a quelli con i capelli scuri. In genere la lesione è bilaterale. Per Cawthorne il 90% dei pazienti visitati per una malattia otospongiosa presenta una lesione bilaterale.
L’otosclerosi istologica è almeno dieci volte più frequente. Secondo Hueb in uno studio condotto su 644 pazienti di razza bianca la sua incidenza è del 12,7% . Secondo Guild, l’incidenza della forma istologica è del 18,5% in una popolazione di donne bianche e del 9,7% in una popolazione di adulti bianchi. Gli studi istologici sistematici permettono di evitare un errato reclutamento delle visite per segni funzionali e permettere quindi di valutare meglio la frequenza dell’interessamento mono- o bilaterale. Secondo Hueb , la lesione è bilaterale nel 65% delle rocche umane (con un blocco platinario nel 45% dei casi e i focolai di otosclerosi sono presenti solo nel 65% dei casi). Essa è bilaterale nell’89% delle rocche femminili (frequenze delle lesioni identiche a quelle maschili).
Modificazioni interrazziali
Classicamente l’otosclerosi è una malattia frequente nella razza bianca, rara nella razza nera, molto rara nella razza asiatica e assente negli Indiani d’America. L’otosclerosi sembra dieci volte meno frequente nella razza nera rispetto a quella bianca. In uno studio condotto su 650 casi di ipoacusia nel Ghana, Brobby ha riscontrato solo due casi di otosclerosi. Guild ha riscontrato delle lesioni istologiche di otosclerosi solo nell’1% delle rocche provenienti da soggetti di razza nera. L’incidenza è bassa nella razza asiatica, probabilmente dello 0,25% ma senza dubbio non è così rara come si pensa. Uno studio condotto nelle Hawaii su due popolazioni ha riscontrato un’incidenza della malattia due volte più elevata nella popolazione caucasica rispetto a quella giapponese. La prima conferma istologica in un giapponese si è avuta solo nel 1968. L’incidenza nella popolazione degli indiani dell’Asia sembra essere identica a quella della popolazione bianca. L’otosclerosi è una malattia virtualmente inesistente nella popolazione degli indiani d’America. In uno studio della durata di cinque anni condotto nel sud-ovest degli Stati Uniti, in diverse tribù indiane , sono stati riscontrati solo tre casi di otosclerosi. Uno studio multicentrico molto importante ha messo in evidenza l’assenza di questa patologia nelle popolazioni indiane dell’America latina. La parte boliviana dello studio (1987) ha riscontrato il gruppo Rh positivo in tutti gli indiani geneticamente puri. Nessuno di essi era affetto da otosclerosi. Tutti i pazienti operati di otosclerosi negli ultimi 23 anni avevano un antenato di razza caucasica. Un indiano affetto da otosclerosi, le cui caratteristiche fisiche sembravano indicare che fosse geneticamente puro, si è rivelato essere di gruppo Rh negativo. L’anamnesi familiare ha evidenziato un antenato di razza caucasica. Questi risultati confermano la presenza di una componente genetica nella trasmissione della malattia. Anche un’altra popolazione fa sospettare una partecipazione genetica. Kapu e Patt hanno riportato il caso di Todas, una regione dell’India, dove l’incidenza della malattia è del 17%. Gli Autori hanno riscontrato che la frequenza della malattia è molto elevata nei matrimoni tra consanguinei (dal 34 al 45%).
Influenza del sesso
Bisogna differenziare l’otosclerosi clinica da quella istologica. È stata osservata nella forma clinicamente evidente una predominanza nel sesso femminile. con un rapporto donna/uomo di circa 2/1 (dal 67 al 71%). Invece, non esistono differenze tra i sessi per l’otosclerosi istologica. Per spiegare questa predominanza della forma clinica nel sesso femminile sono stati chiamati in causa fattori ormonali . Ma questa spiegazione non soddisfa completamente. Hueb et al hanno riscontrato, in uno studio istologico su 752 pazienti, 144 rocche con otosclerosi. Settantasei (56%) erano uomini e 68 (44%) donne. La presenza di lesioni cliniche (blocco platinario) o di sole lesioni istologiche era identica nei due sessi, senza alcuna predominanza nel sesso femminile. Al contrario, la lesione era bilaterale nell’89% delle rocche femminili e solo nel 65% di quelle maschili. Gli Autori hanno proposto, quindi, l’ipotesi di un’incidenza più elevata di otosclerosi bilaterale nella popolazione femminile, che a differenza di quella maschile è meno restia alle visite, al manifestarsi della sintomatologia e, quindi, una differenza di ratio nell’otosclerosi clinica. Essi tuttavia non spiegano il perché della frequenza più elevata dell’interessamento nella popolazione femminile.
Influenza dell’età
L’età di comparsa di questa malattia è difficile da stabilire poiché è determinata da un concetto clinico: sordità di trasmissione da blocco platinario. Le lesioni istologiche che provocano questo blocco si instaurano progressivamente. Anche se le cifre esatte divergono, gli Autori sono d’accordo nell’affermare che l’otosclerosi interessa tipicamente una popolazione costituita da donne giovani. Per Hueb et al, l’età media dei primi segni clinici è di 33,5 anni, con estremi che vanno dai 10 ai 48 anni. Per Dejuan, l’età d’esordio della malattia è tra 18 e 21 anni nel 28% dei casi, tra 21 e 30 anni nel 40% dei casi e tra 31 e 40 anni nel 22% dei casi. Ma in nessun caso questa rappresenta l’età in cui i pazienti vengono realmente trattati, poiché trascorrono diversi anni tra i primi sintomi e l’intervento chirurgico. Eccezionalmente, la malattia si manifesta precocemente. Su 161 rocche di bambini di età inferiore ai 5 anni, Guild ritrova solamente un caso di otosclerosi istologica.
ANATOMIA PATOLOGICA
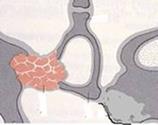
L’OTS è una malattia della capsula otica la quale è formata da tre strati: endostale interno, encondrale intermedio (con focolai di cartilagine residui) e periostale esterno. La patologia interessa inizialmente lo strato intermedio encondrale e successivamente quello periostale. I focolai cartilaginei possono essere sede di ossificazione patologica esuberante e possono localizzarsi in tutta la rocca ma la sede più frequente è il polo anteriore della finestra ovale (nel 80-90% dei casi). Le lesioni sono in genere bilaterali. Esiste una classificazione di Portmann in cinque tipi di OTS:
· platina fissa di aspetto normale
· A-B:focolaio invade il polo anteriore Fig.21.A, il polo posterioreB Fig.21B
· C:invasione diffusa di tutta la platina con residua regione centrale indenne Fig.21C
· D:invasione totale della platina ma bordi visibili Fig.21D
· E:forma obliterante. Fig.21E

Fig.21 A-B,C,D,E
La capsula otica è costituita da tre strati ossei. Lo strato interno o endostale, è molto sottile e mantiene la stessa struttura nel corso del tempo. Lo strato medio, o encondrale, contiene i focolai cartilaginei residui. Gli osteoblasti depositando del tessuto osseo in queste lacune, formano i «globuli ossei», osservati durante tutto l’arco della vita. Lo strato esterno, o periostale, è composto da osso membranoso e permette la crescita della capsula durante l’embriogenesi.forma obliterante
Localizzazione dei focolai di otosclerosi
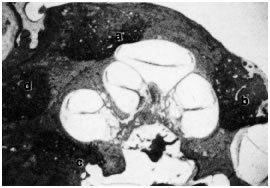
I focolai di otosclerosi sono stati ritrovati in tutte le parti della rocca, ma vi sono alcune regioni colpite con maggiore frequenza. La lesione più frequente è quella della parte anteriore della finestra ovale Fig.22 a.
|
|
|
Fig.22a: Fissula ante fenestram dall’80 al 95% |
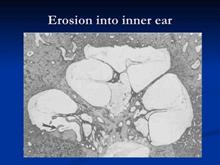
La frequenza di questo interessamento varia a seconda degli Autori dall’80 al 95% . La finestra rotonda è la seconda localizzazione in ordine di frequenza. Questo interessamento si riscontra nel 30-50% dei casi. Non è rara l’obliterazione completa della nicchia della finestra rotonda, dal momento che la sua frequenza è di circa il 6% nello studio di Hueb. Ma possono essere colpite altre sedi, in ordine decrescente:
|
Fig.22.b Parte Anteriore della Finestra Ovale |
|
|
Fig.22.c Parte Posteriore della Finestra Ovale |
|
|
Fig.22 .d Legamento Anulare
|
|
|
Fig.22.e Fissazione della Platina
|
|
|
Fig.22.f .A Otosclerosi Stapediale Platina A Biscotto |
|
|
Fig.22.f.B |
Fig.22.F-C |
|
Fig.22 g A Finestra Rotonda 30-50% dei casi |
|
|
Fig.22 g B Otosclerosi della Finestra Rotonda
|
|
|
Otosclerosi con Obliterazione dellla Finestra Rotonda, circa il 6% |
|
|
|
|
|
Fig.22. h-A Condotto Uditivo Interno (A) CT dimostra otosclerosis con cavità pericochlear, uno dei quali comunica con il condotto uditivo interno vicino al fondo (freccia). (B) Sezione istologica di destra dell’osso temporale di un altro paziente con malattia paragonabile mostra cavità otosclerosi (Cav) in continuità (*) con il canale uditivo interno (IAC) comunicante con lo spazio fluido spinale cerebrale. H & E × 8. |
|
|
Fig.22.h-B Condotto Uditivo Interno |
|
|
Fig.22.i: Otosclerosi Stapediale Interessamento della Platina; |
|
|
Fig.22.l: Otosclerosis Obliterative |
|
|
Fig.22 m: Canali Semicircolari: obliterazione ossea dello spazio perilinfatico e del canale semicircolare posteriore |
|
|
Fig.22 n: SC: Canali Semicircolari RWM: roud window membrane |
|
|
Fig.22 o: l’ Acquedotto Cocleare |
|
|
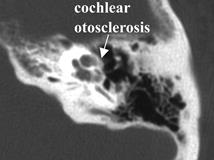
Fig.22.pA: Otoslerosi Cocleare: Grandi lesioni otosclerotiche circondano la coclea , ma risparmiano la zona finestra ovale e la staffa . Questo paziente aveva sordità neurosensoriale |
|
|
Fig.22.p-B-C-D: Otoslerosi cocleare
|
|
|
Fig.22.p-E: |
|
Il canale carotideo, gli ossicini (martello e incudine), il canale facciale, restano delle sedi di lesione molto rare (meno del 3% dei casi). Bisogna ricordare che la lesione in genere è bilaterale. La frequenza dell’interessamento bilaterale varia a seconda degli Autori, dal 96,5% al 76% . Fig.23
 Fig.23
Fig.23
Descrizione delle lesioni
Esame macroscopico
Si possono individuare due stadi. Il primo è lo stadio «attivo» della malattia. Il focolaio contiene tessuto morbido, spongioso, immaturo. Esso è friabile e sanguina facilmente. contrariamente a quanto avviene nel secondo stadio «inattivo». Il focolaio contiene tessuto sclerotico, duro al tatto e poco emorragico.
|
|
|
|
Fig.24a:I° Stadio Attivo |
Fig.24b: II° Stadio Inattivo |
Microscopia ottica
Anche alla microscopia ottica viene conservata la classificazione in due stadi. Essa permette di schematizzare lo studio istologico di questa malattia, ma è un po’ riduttiva. In effetti l’evoluzione istologica non avviene per tappe, ma in modo molto progressivo. Inoltre, In uno stesso focolaio si possono osservare contemporaneamente i diversi stadi. Le modificazioni osservate interessano numerosi elementi: cellule ossee (osteoclasti e osteoblasti), vasi sanguigni e spazi perivascolari, sostanza di sostegno (sostanza fondamentale e collagene) (Fig.25).
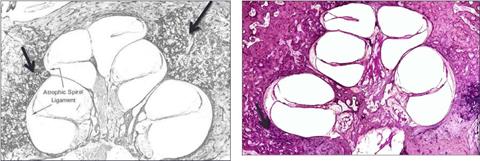
Il primo stadio è caratterizzato dalla scomparsa dell’osso normale, sostituito da tessuto osseo spugnoso, meno denso e molto vascolarizzato. Le prime lesioni corrispondono a un allargamento degli spazi perivascolari, da iperattività degli osteoclasti. Questi spazi sono successivamente riempiti con tessuto connettivo fibroso riccamente vascolarizzato. Sviluppandosi in strutture preesistenti, l’aspetto al microscopio ottico è quello di lacune vascolari, circondate da osso scarsamente vascolarizzato (Fig.26). I vasi dilatati possono localizzarsi a livello del promontorio ed essere responsabili della classica (ma molto incostante) «macchia di Shwartze». Gli osteociti si differenziano in osteoblasti producendo un osso immaturo povero di collagene e ricco di sostanza fondamentale amorfa (glicoproteine e glicosaminoglicani). Quest’osso fortemente basofilo si colora in blu con l’ematossilina-eosina, formando il classico aspetto di blue mantles di Manassé.
La seconda fase è caratterizzata da una diminuzione generalizzata dell’attività cellulare, con trasformazione degli osteociti in osteoblasti. Gli osteoblasti producono un osso che riempie gli spazi perivascolari. La quantità di sostanza fondamentale prodotta diminuisce, mentre aumenta la concentrazione di quella fibrillare. Essendo acidofilo, quest’osso si colora di rosso con l’ematossilina-eosina. Questo nuovo osso ha una struttura lamellare, è denso e ricco di minerali (Fig.27).
La morfologia dei blue mantles non è specifica dell’otosclerosi. Questo aspetto si può riscontrare anche in altre patologie otologiche, come nelle mastoiditi croniche . Secondo Hueb et al , le blue mantles sono presenti in più della metà delle rocche affette da otosclerosi e soltanto nel 20% delle rocche dei pazienti sani esaminati. Il loro significato rimane sconosciuto.
|
|
Fig 25 : Focolai di otosclerosi che invadono l’apice cocleare (a), la zona di giunzione tra il giro mediano e la finestra ovale (b), il condotto uditivo interno (c), l’osso tra carotide e coclea (d). (Ingrandimento × 12).
|
|
|
Fig 26 : Focolaio otosclerotico (a) che si estende lungo un vaso (b), circondato da osso normale (c). (Ingrandimento × 160).
|
|
|
Fig 27 : Osso spugnoso (A), sostituito da tessuto connettivo (B). (Ingrandimento × 10,5). |
Microscopia elettronica
La lesione iniziale principale sembra essere, secondo Lim, una demineralizzazione della sostanza fondamentale e del collagene. La lesione progredisce con fusione dei microfocolai (inferiori a 10 μm). Si assiste a una disorganizzazione delle fibre collagene, che provoca la scomparsa del classico aspetto striato. La marcata mineralizzazione che caratterizza il secondo stadio, visualizzata con il microscopio ottico, non è confermata dalla microscopia elettronica. Il microscopio elettronico ha permesso di ipotizzare l’importante ruolo svolto da alcuni enzimi in questa patologia. Già nel 1969, Chevance et al avevano visualizzato dei lisosomi nei focolai «attivi». Sull’intensa attività enzimatica si basa l’ipotesi eziopatogenica più interessante.
Anatomia Patologica
L’OTS è una malattia della capsula otica la quale è formata da tre strati: endostale interno, encondrale intermedio (con focolai di cartilagine residui) e periostale esterno. La patologia interessa inizialmente lo strato intermedio encondrale e successivamente quello periostale. I focolai cartilaginei possono essere sede di ossificazione patologica esuberante e possono localizzarsi in tutta la rocca ma la sede più frequente è il polo anteriore della finestra ovale (nel 80-90% dei casi). Le lesioni sono in genere bilaterali. Esiste una classificazione di Portmann in cinque tipi di OTS:
• platina fissa di aspetto normale
• A/B: focolaio invade il polo anteriore
• C: invasione diffusa di tutta la platina con residua regione centrale indenne
• D: invasione totale della platina ma bordi visibili
• E: forma obliterante

Fig 28 1-2 AB
Fig 28 3C
Fig 28 4D
Fig 28 5E
In caso di otosclerosi è possibile identificare 3 fasi progressive caratterizzate da precipue alterazioni anatomo-patologiche:
1. Fase della congestione osteoide: i canali Haversiani si dilatano consensualmente alla tumefazione delle strutture perivascolari subcapsulari.
2. Fase della spongiosi: un’intensa attivazione osteoclastica innesca il riassorbimento della strutture ossee determinando un aspetto a spugna.
3. Fase della sclerosi: in seguito al riassorbimento osteoclastico, l’attività osteoblastica provoca la deposizione di nuovo materiale osteo-fibrillare disorganizzato e non regolare.
Se tale trasformazione ossea avviene lungo i bordi ossei della finestra ovale, il processo può estendersi lungo il legamento della finestra, con progressivo irrigidimento della platina della staffa. Nel caso in cui i focolai otosclerotici si presentino in altre parti della capsula labirintica, la malattia può risultare asintomatica o determinare sofferenza cocleare con ipoacusia neurosensoriale.
Eziologia
Benché non siano ancora disponibili ancora dati certi sulla eziopatogenesi della otosclerosi, sono state poste diverse ipotesi:
· 1)Ipotesi genetica:[3]in molti soggetti con osteosclerosi (50%) è possibile riconoscere una forma familiare. La trasmissione avviene con modalità autosomico dominante a bassa penetranza.
· 2)Ipotesi disendocrina: frequente nel sesso femminile, associata alla pubertà, all’allattamento e alla gravidanza.[2] Un’altra ipotesi riguarda la funzione paratiroidea, in quanto un disparatiroidismo potrebbe innescare l’osteodistrofia tipica di questa patologia.
· 3)Ipotesi virale: nelle cellule della capsula otica è presente il recettore glicoproteico per i paramyxovirus, rendendo le strutture dell’orecchio interno particolarmente sensibili alle infezioni sostenute da questi virus. In accordo con tale ipotesi, nei soggetti con otosclerosi è stata inoltre riscontrata la presenza di materiale genetico e proteico del virus virus del morbillo.
· 4)ipotesi autoimmune: in alcuni soggetti con otosclerosi è possibile riscontrare la presenza di autoanticorpi diretti verso il collagene embrionale di tipo II, tessuto presente nell’adulto soltanto a livello della capsula labirintica.
· 5)Ipotesi vascolare: l’alterazione della struttura vascolare dell’orecchio interno può esitare verso un inadeguato apporto ematico alle strutture capsulari, con conseguente distrofia.
1) Ipotesi genetica
Fattori genetici
L’otosclerosi si trasmette, generalmente, con modalità autosomica dominante a penetranza incompleta e a espressività variabile. Il carattere familiare di questa malattia è conosciuto da quando Toynbee lo ipotizzò già nel 1860[94 ]. Già nel 1861 Toynbe descrisse una famiglia con elevata prevalenza di ipoacusia otosclerotica. Quindici anni piìi tardi Magnus documentò un’altra famiglia con otosclerosi (Thys & Van Camp, 2009). In una casistica di 2.100 pazienti operati, Schambaugh[88] ha riscontrato una familiarità per ipoacusia progressiva nel 54, 5% dei casi. Sono state descritte forme clinicamente evidenti in due gemelli omozigoti [1, 87],, così come nelle fratrie di gemelli omozigoti in cui uno solo era affetto[31].
La trasmissione genetica autosomica dominante della malattia fu ipotizzata per la prima volta da Albrecht nel 1922 e tale meccanismo sembra oggi quello piti accreditato, caratterizzato inoltre da penetranza incompleta ed espressività variabile. La penetranza incompleta definisce quel fenomeno per il quale un certo numero cli soggetti con genotipo associato alla malattia non sviluppa la malattia stessa. L’espressività variabile invece si verifica quando i soggetti affetti presentano quadri di malattia con differente gravità. Il grado di penetranza dell’otosclerosi sembra variare dal 25 al 40% (Larsson, 1960; Morrison & Bundv, 1967). Tuttavia sono state descritte anche modalità di trasmissione ereditaria differenti come quella autosomica recessi- va (Bauer & Stein, 1925).
Questi studi si sono basati solamente su una valutazione clinica, senza una conferma anatomopatologica.
Bisogna tuttavia considerare che nel 40-50% dei casi non risulta possibile documeritare il meccanismo ereditario della malattia. Queste forme, definite sporadiche, sono interpretate in maniera non univoca. Esse possono rappresentare l’espressione di una nuova mutazione, di una trasmissione autosomica recessiva (Morrison & Bundv, 1970) o di forme di ereditarietà complessa (Gordon, 1989),
Secondo Thys & Vari Camp (2009) la maggior parte dei casi sporadici di otosclerosi sono sostenuti dall’ereditarietà complessa, situazione in cui interagiscono fattori genetici ed ambientali.
La penetranza di una malattia è la frequenza con la quale un gene patologico manifesta i suoi effetti. Quella dell’otosclerosi non è perfettamente nota. Questa, misurata su valutazioni cliniche (e non istologiche), è del:
• 40% secondo Causse[13], , Morrison [62] e Gordon[37], ,
• 25-45% per Larsson [51] e Rüedi [78].
L’espressività di una malattia è la capacità di un gene a manifestarsi con delle modalità quantitativamente variabili. L’espressività dell’otosclerosi è molto variabile: la tendenza evolutiva e l’entità dei sintomi sono molto diversi da un paziente all’altro.
La maggior parte degli Autori concorda su questa modalità di trasmissione, ma sono state formulate anche altre ipotesi. Per Mendlowitz e Hirschorn[59], potrebbe essere una trasmissione di tipo poligenico multifattoriale. Per Ben Arab[6] , esiste un gene autosomico dominante molto raro (presente solo nel 13% dei pazienti affetti) associato a un’alta componente poligenica. Questa importante componente poligenica spiegherebbe la variabilità della malattia. Lo studio multicentrico di Marcos ha riscontrato dei casi di otosclerosi in popolazioni in cui solitamente non è presente questa malattia, solo se c’era stata una contaminazione razziale. Nella popolazione panamense studiata, l’otosclerosi era frequente nei bianchi, rara nei neri e assente negli indiani. Delle 103 stapedectomie dello studio, il 29% riguardava i bianchi-indiani, il 10% i bianchi-negri e il 3% i neri-indiani.
Forme monogeniche di Otosclerosi
Sono stati isolati 7 loci cromosomici e geni associati con lotosclerosi (OTSC 1- 5, 7 e 8). Essi sono riassunti nella tabella I con le relative voci bibliografiche (ad eccezione del locus OTSC6 non pubblicato ma descritto dal “Human Genome Organisation Nomenclature Committee”).
Tabella I: Loci cromosomici associati ad otosclerosi (modificata da Markou & Goudakos, 2009)
|
Studio ed anno di pubblicazione |
Nazionalità della famiglia |
locus cromosomico
|
|
Tomek et al. 1998
|
India |
OTSC1 15q25-q26 |
|
Van De Bogaert et al. 2001 |
Belgio |
OTSC2 7q34-q36
|
|
Chen et al, 2002 |
Cipro |
OTSC3 6p2l3-p223
|
|
Brownstein ci al, 2006 |
Israele |
OTSC4 l6q21q23.2
|
|
Van De Bogaert et al. 2004 |
Danimarca |
OTSC5 3q22-q24 OTSC6
|
|
Thys et al., 2007 |
Grecia |
OTSCT 6ql3q16 1
|
|
Bel Hadj Ali ci al, 2007 |
Tunisia |
OTSC8 9pl3 L9q21ll
|
locus riportato dal Human Genomc’ Organisarion Nomenclatura Committee” (dato non pubblicato)
Il primo gene, OTSC1, è stato isolato in una famiglia del sud dell’india, in cui l’otosclerosi veniva trasmessa con modalità autosomica dominante (Tornek et al, 1998). Il gene mappato al locus 15q25-q26 produce la componente “noncollagene” della matrice extracellulare della cartilagine. Si ritiene che questo gene svolga un ruolo chiave nella patogenesi dell’otosclerosi per i seguenti motivi: a) codifica una proteina complessa per la quale esistono diversi alleli, b) il labirinto osseo si sviluppa cia un precursore cartilagineo in cui è presente questa proteina, c) la mutazione di questo gene nelle cavie determina ipoacu-. sia, d) questa proteina si aggrega ai glicosamminoglicani.
Il gene OTSC2 è stato scoperto daVan den Bogaert et al (2001) in una famiglia belga con otosclerosi autosomica dominante. Lanalisi del genoma ha individuato il locus 7q34-q36.
Il terzo locus cromosomiale OTSC3 (6p2L3-p22.3) è stato identificato da Chen et al (2002) in una famiglia cipriota. Il gene suddetto si trova nella regione che codifica per il sistema I-ILA (human leucocyte antigen), supportando l’ipotesi di una associazione tra otosclerosi ed antigeni HL\-A ed HLA-B.
Il quarto locus cromosomico è stato isolato in Israele da Broxvnstein et al (2006); il locus OTSC4 comprende geni coinvolti nel sistema immune e nell’omeostasi ossea.
Il locus OTSC5 è stato inclividuato in Danimarca daVan den Bogaert et al (2004). Il sesto locus. OTSC6, è riportato dal “Human Genome Organisation Nomenclature Committee”, ma a tutt’oggi non è stato ancora pubblicato.
Nel 2007 in una famiglia greca è stato trovato il settimo locus, OTSC7, sul cr0- mosoma 6q13-q16.l. Lo stesso gene è stato isolato in 13 famiglie belghe e tedesche (Thvs et al, 2DD7).13
In ultimo, Bel Hadj Ali e collaboratori (2007) hanno studiato il genoma di una famiglia tunisina con forma autosomica dominante di otosclerosi: il gene responsabile, OTSC8, è stato localizzato sul cromosoma 9p13.1-9q21.11.
Non esiste alcuna correlazione significativa con i marker genetici del gruppo sanguigno ABO, Rh o MN [62]. Gli studi eseguiti per cercare una relazione con gli antigeni HLA (human leucocite antigen) hanno fornito conclusioni discordanti. Secondo Wayoff e Chobaut [98] o Dahlqvist [24] non esiste una relazione significativa. Per Gregoriadis [39], esiste un aumento significativo degli antigeni HLA A11, Bw35 e B14 nei pazienti con familiarità per otosclerosi. Questo aumento invece, non è significativo se non ci sono precedenti familiari. Attualmente si sta studiando la proteina GC (group-specific component). Essa è implicata nel trasporto della vitamina D [25]. Il suo studio nell’otosclerosi ha portato a risultati contrastanti. Dahlqvist et al [25] hanno riscontrato una significativa associazione tra otosclerosi e i fenotipi e gli alleli della GC, Questa associazione non è stata riscontrata nello studio condotto da Kjeldsen et al [50]. È stato condotto uno studio [56] sull’espressione del RNA messaggero (mRNA) dei tre fattori che intervengono nel metabolismo del tessuto connettivo (procollagenasi, prostromelisina e inibitore delle metalloproteasi). Sono stati riscontrati valori di mRNA nei pazienti affetti (e in alcuni dei loro parenti) diversi dalla popolazione di controllo sana. Gli Autori hanno concluso che alcuni mRNA potrebbero essere dei marcatori genetici della malattia. Questo studio, però, è stato effettuato su pochissimi casi (quattro pazienti con otosclerosi, otto familiari e nove pazienti controllo) sarà, quindi, sicuramente necessario un approfondimento.
Forme complesse di Otosclerosi
Nell’otosclerosi sporadica come si è detto i pazienti non presentano familiarità per la malattia o questa non si trasmette secondo i classici meccanismi dell’ereditarietà mendeliana. In questi casi secondo Thys & Van Camp (2009) si deve ipotizzare una forma “complessa” in cui concorrono fattori ambientali e genetici.
Alcuni esempi di forme genetiche complesse associate ad otosclerosi vengono riportate di seguito.
Human Leukocyte Antigen: il sistema HLA rappresenta il principale sistema di istocompatibilità nell’uomo ed è codificato da un segmento di DNA del cromosoma 6 caratterizzato da organizzazione geneticamente complessa. Questa regione codifica alcune proteine-antigene della membrana cellulare. Il sistema HLA si associa a malattie con componente immunologica. Il locus OTSC3 si trova nello stesso tratto cromosomico che codifica il sistema HLA. Tuttavia l’analisi completa delle mutazioni risulta problematica poiché si tratta di una regione geneticamente complessa.
Transforming Growth Factor-1: Il TGFB1 gioca un ruolo chiave nello sviluppo embriologico dell’orecchio, nel turnover osseo e nel processo di rimodellamento della capsula otica. Questo fattore viene espresso anche nei pazienti otosclerotici. In effetti la concentrazione di glicosamminoglicani, fibronectina e collagene della matrice extracellulare del tessuto osseo nei soggetti normali e negli otosclerotici differisce in maniera significativa. Queste differenze possono essere correlate al TGFB1. Thys et al (2007) hanno studiato l’associazione tra fenotipo otosclerotico e varianti di TGFB 1. La variante T2631 riduce, secondo gli Autori, la suscettibilità all’otosclerosi attraverso l’inibizione della differenziazione e l’attivazione degli osteoclasti nella prima fase otospongiotica della malattia
Sistema Renina-Angiotensina-Aldosterone: lmauchi et al (2008) hanno descritto un’associazione tra otosclerosi e sistema renina-angiotensina-aldosterone (RAA) La malattia infatti è piti frequente nel sesso femminile durante la gravidanza,
ciuando si verifica una stimolazione del sistema RAA. Gli Autori hanno trovato una significativa associazione tra otosclerosi e due polimorfismi: angiotensinogen(AGT) M235T (rs699) ed angiotensina I converting enzyme (ACE), L’ipotesi non è stata supportata tuttavia in un successivo studio (Schrauwen et al, 2009).
Altri fattori
Questi fattori ipotetici non sono direttamente coinvolti nella genesi della malattia, ma possono influenzare le modalità di espressione. In realtà l’otosclerosi sembra essere una malattia multifattoriale, con una predisposizione familiare e uno o più fattori eziologici.
2) Ipotesi Disendocrina
Fattori Endocrini
Sono stati chiamati in causa in numerosi studi. Questo fattore permette di spiegare la predominanza nel sesso femminile dell’otosclerosi clinicamente evidente, così come gli episodi d’aggravamento correlati alla vita sessuale ed endocrina (pubertà e gravidanza). Secondo Cawthorne [18], il 63% delle donne (in un gruppo di 419 donne) ha notato la comparsa o l’aggravamento della malattia durante la gravidanza. Altri studi [35, 61] hanno riscontrato dei valori simili. Questa nozione è dunque classica, ma controversa per alcuni. Walsh [97] non ha trovato alcuna relazione significativa tra gravidanza e aggravamento dell’ipoacusia. Generalmente l’età d’esordio della malattia coincide con l’acme del periodo fertile. Esiste forse una distorsione di reclutamento negli studi che mostrano una relazione. D’altra parte, tutti questi studi sono stati esclusivamente clinici, confrontando il decorso della malattia con la presenza di una gravidanza. Partendo da queste osservazioni, è stato ipotizzato un fattore ormonale scatenante, ma non ci sono stati studi specifici che hanno cercato di scoprire il fattore esatto o la sua struttura. Uno studio di Wayoff [98] ha rivelato, peraltro, che non c’è alcuna relazione tra la gravità del decorso della malattia e il numero di gravidanze. Sembra, quindi, che tutte le precauzioni a cui sono state sottoposte le donne affette da otosclerosi (controindicazione alle gravidanze e contraccezione con estroprogestinici), siano un po’ eccessive.
In questo modo, la differenza di incidenza dell’otosclerosi nei due sessi maschile e femminile non è spiegata con gli episodi di forte impregnazione estrogenica rappresentati dalla gravidanza e dall’allattamento. Un’ipotesi chiarisce, malgrado ciò, il legame tra estrogeni e otosclerosi: l’iperprolattinemia indotta dagli estrogeni potrebbe inibire la protezione ossea dovuta all’osteoprotegerina riducendo il suo livello di espressione [24 Horner K.C. The effect of sex hormones on bone metabolism of the otic capsule – an overview Hear. Res. 2009 ; 252 : 56-60 [cross-ref] Sono state proposte teorie riguardanti dei disturbi della risposta cellulare all’ormone paratiroideo, per spiegare delle anomalie dell’osteosintesi a livello della capsula otica. A livello delle cellule otosclerotiche, si avrebbe un’anomalia del recettore per il paratormone, portando a una desensibilizzazione e a un’attenuazione del segnale [12 Ayache D., El Kohen A. Otospongiose Traité d’ORL Paris: Médecine Sciences Flammarion (2008). 59-65
In definitiva, i dati attuali della letteratura non permettono di controindicare una gravidanza o un trattamento estrogenico in una paziente affetta da otosclerosi. Ormone paratiroideo
3) Ipotesi Virale Da due decenni è sospettato il ruolo del virus del Morbillo nella patogenesi dell’otosclerosi. Nel 1987 Arnold e Friedmann [25 Arnold W., Friedmann I. Detection of measles and rubella-specific antigens in the endochondral ossification zone in otosclerosis Laryngol. Rhinol. Otol. (Stuttg.) 1987 ; 66 : 167-171 [cross-ref] ricercarono un’eziologia virale all’otosclerosi, analogamente al paramyxovirus nella malattia di Paget. Essi proposero, allora, i virus del morbillo e della rosolia come possibili patogeni. McKenna [26 McKenna M.J., Kristiansen A.G., Haines J. Polymerase chain reaction amplification of a measles virus sequence from human temporal bone sections with active otosclerosis Am. J. Otol. 1996 ; 17 : 827-830 proseguì in questa via e ritrovò, nel 1996, dell’acido ribonucleico (RNA) del virus del morbillo in otto ossa temporali sui 11 campioni di rocche su cui l’otosclerosi era provata istologicamente, mentre nove campioni di controllo erano negativi quanto alla ricerca del genoma del morbillo. Il virus del morbillo potrebbe anche spiegare in parte l’interessamento più frequente delle donne. In effetti, il tasso di letalità del morbillo è più alto nelle donne [27 Niedermeyer H.P., Arnold W., Neubert W.J., Sedlmeier R. Persistent measles virus infection as a possible cause of otosclerosis: state of the art Ear Nose Throat J. 2000 ; 79 : 552-558 ], il che suggerisce una suscettibilità femminile più importante nei confronti dell’infezione da morbillo. L’impatto della vaccinazione contro il virus del morbillo apporta un argomento supplementare per la causalità del rapporto tra morbillo e otosclerosi. Effettivamente, negli Stati Uniti [28 Vrabec J.T., Coker N.J. Stapes surgery in the United States Otol. Neurotol. 2004 ; 25 : 465-469 [cross-ref] e in Germania [29 Arnold W., Busch R., Arnold A., Ritscher B., Neiss A., Niedermeyer H.P. The influence of measles vaccination on the incidence of otosclerosis in Germany Eur. Arch. Otorhinolaryngol. 2007 ; 264 : 741-748 [cross-ref] si nota una diminuzione del numero di chirurgie della platina e un aumento dell’età media nella diagnosi dopo la diffusione a livello generale della vaccinazione antimorbillosa. Il russo Lolov [30 Lolov S., Edrev G., Kyurkchiev S. Antimeasles immunoglobulin G and virus-neutralizing activity in sera of patients with otosclerosis Adv. Otorhinolaryngol. 2007 ; 65 : 107-113 [cross-ref] ] ha evidenziato una differenza che rafforza il rapporto morbillo-otosclerosi. I pazienti colpiti presentano anche un’attività sierica delle immunoglobuline contro il virus del morbillo significativamente più bassa rispetto ai soggetti indenni da otosclerosi. Questa constatazione non permette peraltro di sapere se questa minore risposta umorale sia la causa o la conseguenza di un’infezione da morbillo localizzata alla capsula otica. Per misurare l’importanza eziologica del virus del morbillo è interessante esaminare i lavori del polacco Marosi, che riscontra, su una casistica di più di 200 platine otosclerotiche, circa due terzi dei prelievi contenenti RNA del virus del morbillo mediante Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR) [18 Karosi T., Jókay I., Kónya J., Petkó M., Szabó L.Z., Pytel J. , e al. Activated osteoclasts with CD51/61 expression in otosclerosis Laryngoscope 2006 ; 116 : 1478-1484 [cross-ref] ]. Da un punto di vista fisiopatologico, il virus del morbillo indurrebbe sempre, secondo lo stesso autore, un aumento dell’espressione del proprio recettore cellulare (CD46) a livello dei focolai otosclerotici [31 Karosi T., Szalmás A., Csomor P., Kónya J., Petkó M., Sziklai I. Disease-associated novel CD46 splicing variants and pathologic bone remodeling in otosclerosis Laryngoscope 2008 ; 118 : 1669-1676 [cross-ref] ], cronicizzando in questo modo l’infezione virale locale. Se l’associazione tra otosclerosi e virus del morbillo sembra molto reale, rimane da determinare attraverso quale meccanismo il virus indurrebbe delle lesioni otosclerotiche. Ne potrebbero essere responsabili un’infiammazione locale e un’attivazione di osteoclasti.
Fattori otologici flogistici
In passato l’otosclerosi è stata associata alle patologie infiammatorie dell’orecchio medio. Studi recenti indicano che si tratta in effetti di fattori concomitanti, senza alcuna correlazione statistica valida e senza alcun legame eziopatogenico[68].
Fattori infettivi
Quaranta et al [74] hanno riscontrato, in uno studio istopatologico sistematico sulle staffe di sei pazienti operati, una lesione da candidosi (Fungus hyphae). Ma non si tratterebbe di un fattore eziologico scatenante, bensì di un’infezione coesistente favorita dai ripetuti trattamenti antibiotici e corticosteroidei. Il virus del morbillo è forse un cofattore. Nel 1897 era stata descritta la presenza di un antigene virale [3]. Gli stessi Autori [67] hanno trovato delle sequenze di nucleotidi del virus del morbillo nelle staffe dei pazienti con otosclerosi. Questo virus potrebbe essere all’origine dei processi infiammatori che provocano la malattia.
Virale più genetica
Anche questo è possibile anche la prova di influenze virali in otosclerosi, una recente ipotesi è che otosclerosi richiede una combinazione di un gene specifico con esposizione ad un virus specifico (ad esempio morbillo) per essere espressa e perdita dell’udito a verificarsi (McGuirt et al, 1998; Karosi, Konya et al 2004).. inclusioni nucleari simili a nucleocapsidi paramyxoviral sono stati osservati in osteoclasti otosclerosi (McKenna et al, 1986; Chole e McKenna, 2001). RNA virus del morbillo è stato trovato in staffa di persone otosclerotic (Potocka-Baklazek et al, 2014).
|
|
Fig. 29: Sclera Blu-grigia (vale a dire “bianco” dell’occhio) nei singoli sia con osteogenesi imperfetta e otosclerosi |
Il gene che predispone ad otosclerosi può essere simile al gene che causa l’osteogenesi imperfetta – una malattia ossea generalizzata (McKenna et al, 2002), che viene generalmente trasmessa in modo autosomico dominante. Le persone con osteogenesi imperfetta spesso sviluppano ipoacusia trasmissiva, e sono trattati allo stesso modo come sono i pazienti con otosclerosi (van der Rijt e Cremers, 2003). I loro occhi a volte hanno una dominante blu-grigio, chiamato “sclera blu”. Questo non è un brillante blu – vedi sopra. I geni che conferiscono suscettibilità di otosclerosi possono anche fornire una certa protezione contro l’otite media (Manolidis et al, 2003).
Alcuni ritengono che l’infezione cronica da morbillo nell’osso predisponga i pazienti ad otosclerosi, materiali virali possono essere trovati in osteoblasti nelle lesioni otosclerotic (Nadol, 1998) e nella platina della staffa pedane delle persone con otosclerosi (Karosi, Konya et al 2004;. Karosi, Konya et al 2005).. D’altra parte, circa il 40% dei pazienti con otosclerosi nella platina sono negativi per il morbillo (Karosi et al, 2007), ed è anche chiaro perché il morbillo dovrebbero influenzare l’osso temporale, ma non influenza altre ossa del corpo.
I casi che sono virus positivo sono anche positivi per il TNF-alfa, suggerendo un possibile collegamento con la malattia autoimmune dell’orecchio interno . (Karosi, Konya et al. 2005). A nostra conoscenza, nessuno ha ancora tentato di applicare questa scoperta con farmaci anti-TNF, come entanercept.
Patogenesi
L L’ipotesi attualmente studiata con maggiore attenzione è quella di una o più alterazioni enzimatiche. Il ruolo di alcuni enzimi lisosomiali (tripsina, stromelisina, fosfatasi…) sembra rilevante nella prima fase della malattia (fase di depolimerizzazione). Differenti studi hanno dimostrato un aumento dell’attività di questi enzimi nell’osso colpito da otosclerosi o nei liquidi perilinfatici dei pazienti. Secondo Causse [17], l’α-1-antitripsina e l’α-2-macroglobulina svolgono un ruolo protettivo nei confronti dell’orecchio interno. Invece, la tripsina avrebbe un ruolo nefasto. L’α-1-antitripsina inibirebbe la frazione di tripsina libera, essendo la maggior parte fissata dall’α-2-microglobulina. Ribari ha riscontrato un aumento dell’attività di due enzimi, le catepsine B e D, [75, 76]. Questi enzimi sono di origine osteoblastica. Gli osteoblasti sono implicati non solo nel processo di formazione ossea, ma anche nel processo di riassorbimento. Secondo Mac Phee [56] esiste un deficit di espressione dell’enzima procollagenasi, della prostromelisina e dell’inibitore delle metalloproteasi. Questo deficit convalida l’ipotesi di un disturbo del metabolismo della matrice del tessuto connettivo.
Esisterebbe anche un’anomalia dei siti recettoriali della calcitonina, che possono spiegare alcune anomalie dell’assorbimento del calcio [58]. Secondo Sterkers [93], l’otosclerosi sarebbe dovuta a complessi meccanismi, con anomalie dell’integrazione del calcio e disturbi nella sintesi della matrice del tessuto connettivo. La malattia potrebbe essere legata alla suscettibilità familiare verso infezioni virali, provocando una reazione immunitaria locale.
l’’ipotesi attualmente studiata con maggiore attenzione è quella di una o più alterazioni
4) Ipotesi Autoimmune Questa pista eziologica è stata ipotizzata in seguito all’evidenziazione, in alcuni individui otosclerotici, di anticorpi anticollagene tipo II [32 Niedermeyer H.P., Arnold W. Etiopathogenesis of otosclerosis ORL J. Otorhinolaryngol. Relat. Spec. 2002 ; 64 : 114-119 [cross-ref] ]. Tuttavia, questi autoanticorpi non sarebbero l’elemento iniziatore della malattia, ma piuttosto un fattore di mantenimento dell’infiammazione Un’ipotesi collega, peraltro, autoimmunità e infezione virale attraverso una somiglianza antigenica tra la capsula otica e il virus del morbillo, all’origine di un’autoimmunizzazione, senza che attualmente vi sia alcuna prova di ciò.
5) Ipotesi vascolare:l’alterazione della struttura vascolare dell’orecchio interno può esitare verso un inadeguato apporto ematico alle strutture capsulari, con conseguente distrofia.
FISIOPATOLOGIA
Sordità di trasmissione
Essa è dovuta alla fissazione della platina della staffa nella finestra ovale per un focolaio d’otosclerosi Fig. 30.a . Questo focolaio origina il più delle volte a livello della fissula ante fenestram e poi si estende progressivamente per via mucoperiostale. Negli stadi inziali, il focolaio può alterare i movimenti ampi della staffa senza alterarne le vibrazioni. Ciò spiega la scomparsa del riflesso stapediale senza ipoacusia di trasmissione osservato in alcuni pazienti. Successivamente il focolaio determina un blocco completo della staffa, impedendo la trasmissione delle vibrazioni sonore e provocando una dispersione di queste vibrazioni (fenomeno di «ponte sonoro») ipoacusia di trasmissione Fig. 30.b. In casi estremi, il focolaio può ricoprire interamente la platina, visibile solo come un focolaio di otosclerosi.
|
|
Fig. 30.b. |
Effetto Carhart
Non è dovuto a una lesione cocleare, bensì a un’«alterazione delle soglie di conduzione ossea legata alla riduzione della partecipazione dell’orecchio medio e dell’orecchio esterno nella trasmissione ossea delle vibrazioni sonore». Quando la vibrazione di un suono viene trasmessa per via ossea, una parte di questo suono giunge fino al condotto uditivo esterno poi alla metà esterna e può, quindi, attraverso l’orecchio medio, ristimolare la coclea. La scomparsa dei movimenti d’inerzia della catena degli ossicini annulla questa stimolazione complementare e impedisce anche il normale funzionamento della conduzione ossea. Questa riduzione della conduzione ossea è massima tra i 750 e i 2.000 [5]Hz ma può ritornare a frequenze più elevate.
Sordità di percezione
Questa sordità è di origine cocleare. Il suo meccanismo non è chiaro. Reudi ha ipotizzato un’eziologia «vascolare» [78]. Esistono degli shunt venosi tra i focolai d’otosclerosi e i vasi cocleari. Questi shunt provocherebbero una stasi venosa e conseguente ipossia cocleare. Siebenmann «ha avanzato l’ipotesi» di un’eziopatogenesi tossica [91], secondo la quale verrebbero liberati dei metaboliti tossici nei liquidi cocleari. La presenza di enzimi proteolitici nella perilinfa e nella platina della staffa in effetti è stata dimostrata da Chevance [20]. Linthicum [54] ha ipotizzato che i focolai d’otosclerosi possano danneggiare la membrana basilare e interferire anche con il micromeccanismo cocleare.
Anche il rapporto tra il numero di focolai e il danno cocleare non è ben chiaro e ancora oggetto di numerose controversie. Linthicum [53] ha riscontrato una correlazione tra il grado di interessamento cocleare e la lesione istologica, con la ialinizzazione del legamento spirale. Al contrario, altri Autori non hanno trovato alcuna relazione tra la gravità dell’interessamento istologico e la gravità della sordità di percezione. Anche Elonka e Applebaum [28] hanno evidenziato una lesione cocleare soltanto nei soggetti con più di due focolai d’otosclerosi. Schuknecht e Barber [83] non hanno trovato alcuna correlazione tra questi due elementi.
Alcuni Autori hanno tentato di quantificare l’ipoacusia in funzione del danno istologico. Secondo Goycoolea [38], la perdita media della conduzione ossea è di 28, 26 dB nei pazienti senza interessamento endostale, 33, 75 dB nei pazienti con un focolaio endostale e 62 dB in quei pazienti con più di due
Otosclerosi cocleare pura vedi fig. 31a/b
|
|
||
|
fig. 31a |
fig. 31b |
|
Si tratta di un’otospongiosi i cui i focolai non raggiungono la platina e che determina quindi solo un difetto isolato di sordità di percezione, senza alcuna alterazione della trasmissione. Questo quadro nosologico è, secondo la maggior parte degli Autori, raro. Secondo Schuknecht [84] «un focolaio di otosclerosi sufficientemente importante da provocare una sordità neurosensoriale determina immancabilmente anche la fissazione della staffa». In uno studio su 144 rocche con focolai d’otosclerosi, Hueb [45] ha riscontrato questa lesione solo otto volte. Di fronte a una sordità di conduzione a evoluzione progressiva, la diagnosi di otosclerosi cocleare si basa in gran parte su criteri radiologici (ipodensità pericocleare alla TC che forma un alone [cfr. figura 4 del paragrafo «Diagnostica per immagini», aspetto di pseudo-quarto giro della coclea alla RM] [43
|
fig. 31c |
fig. 31d
|
Tringali S., Bertholon P., Pouget J.F., Timoshenko A.P., Faye M., Veyret C. , e al. Otospongiose cochléaire et pseudo-quatrième tour de cochlée Ann. Otolaryngol. Chir. Cervicofac. 2004 ; 121 : 373-376 [inter-ref]
A favore della diagnosi si ricercano precedenti familiari di otosclerosi e si eliminano le altre cause di sordità neurosensoriale. Così, il deficit uditivo neurosensoriale osservato deve essere superiore alla semplice sordità dovuta a una presbiacusia.
Il trattamento di questa forma di otosclerosi si basa, in particolare, sulla supplementazione in fluoro per rallentare l’evoluzione della malattia, sull’apparecchio acustico convenzionale e, a volte, sull’impianto cocleare.
Otosclerosi molto avanzata o far-advanced otosclerosis
È l’evoluzione finale di un’otosclerosi estesa a una gran parte della capsula otica. La lesione obliterante della finestra vestibolare è riscontrata più frequentemente.
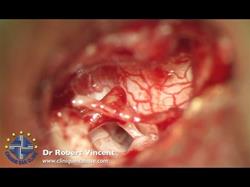 Questa forma clinica è stata descritta inizialmente da House e Sheehy negli anni Sessanta [46 Sheehy J.L. Far-advanced otosclerosis, diagnostic criteria and results of treatment: report of 67 cases Arch. Otolaryngol. 1964 ; 80 : 244-249 fig. 32
Questa forma clinica è stata descritta inizialmente da House e Sheehy negli anni Sessanta [46 Sheehy J.L. Far-advanced otosclerosis, diagnostic criteria and results of treatment: report of 67 cases Arch. Otolaryngol. 1964 ; 80 : 244-249 fig. 32
] con una definizione puramente audiometrica: otosclerosi con perdita uditiva superiore a 85 dB in conduzione aerea e soglie in conduzione ossea non misurabili (con l’evoluzione tecnologica degli audiometri si ammette che una perdita uditiva in conduzione ossea superiore a 60 dB rientri nei criteri di definizione della far-advanced otosclerosis ).
L’otosclerosi molto avanzata si presenta sotto forma di una sordità profonda, che ha l’aspetto di una sordità neurosensoriale sull’audiogramma, con soglie audiometriche evidenziabili in conduzione aerea (assenza di Rinne). A volte, la sordità è totale e l’audiogramma è bianco. L’imputabilità del deficit uditivo all’otosclerosi si basa su criteri anamnestici (precedenti familiari di otosclerosi e otosclerosi nota, addirittura già operata) e sulla diagnostica per immagini (ipodensità periclocleari alla TC delle rocche).
Il corredo terapeutico di questa forma particolare comporta la chirurgia stapedia classica associata alle protesi uditive, ma anche l’impianto cocleare.
In letteratura non sembra emergere alcun atteggiamento consensuale. In effetti, alcuni consigliano di realizzare prima una platinotomia al fine di rendere efficiente un ausilio uditivo protesico [47 Calmels M.N., Viana C., Wanna G., Marx M., James C., Deguine O. , e al. Very far-advanced otosclerosis: stapedotomy or cochlear implantation Acta Otolaryngol. 2007 ; 127 : 574-578 [cross-ref] I sostenitori di questa strategia propongono l’impianto cocleare, relativamente oneroso, solo in caso di insuccesso della procedura sulla platina. Altri sono, al contrario, a favore dell’impianto cocleare, che ottiene, in questa indicazione, buoni risultati, simili a quelli delle altre ipoacusie neurosensoriali sottoposte a impianto [48 Rama-Lopez J., Cervera-Paz F.J., Manrique M. Cochlear implantation of patients with far-advanced otosclerosis Otol. Neurotol. 2006 ; 27 : 153-158 e 49 Marshall A.H., Fanning N., Symons S., Shipp D., Chen J.M., Nedzelski J.M. Cochlear implantation in cochlear otosclerosis Laryngoscope 2005 ; 115 : 1728-1733 [cross-ref]
 Otosclerosi ed interessamento vestibolare fig. 33
Otosclerosi ed interessamento vestibolare fig. 33
La coesistenza di otosclerosi-lesioni vestibolari è stata riportata da numerosi Autori. La presenza di disturbi di tipo vestibolare clinicamente evidenti nei pazienti con otosclerosi varia dal 24 [18] al 35% [61]. Sul piano istologico, Heub [45] ha riscontrato un interessamento dell’endostio vestibolare nel 63% di 144 rocche di pazienti con focolai di otosclerosi cocleare. L’associazione dei disturbi dell’equilibrio-otosclerosi è stata classificata con il termine di otosclerotic inner ear sindrome da Mc Cabe [55]. In ogni caso, il rapporto causa-effetto rimane tutt’ora poco chiaro per numerosi Autori. Schuknecht [82] considera questa associazione una rarità e probabilmente una coincidenza.
Clinica
La diagnosi di otosclerosi molto spesso è semplice, va subito sospettata già dalla prima visita se c’è una sordità di trasmissione, accompagnata a volte da acufeni, con un timpano normale. Se c’è familiarità per la malattia la diagnosi è quasi certa, ma nella maggior parte dei casi l’audiometria e la timpanometria ne danno la conferma. Esistono comunque casi più complessi, rappresentati essenzialmente dalle forme iniziali, dalle forme puramente cocleari, sulla cui esistenza si discute ancora, o quelle associate a precedenti episodi infettivi che determinano la modifica dell’aspetto del timpano. La TC potrebbe, nei casi dubbi, confermare o escludere la diagnosi. Non deve essere utilizzata di routine e il suo uso indiscriminato può essere professionalmente criticato. L’esame della cassa costituisce, infine, l’ultima valutazione a cui si ricorre nei casi più difficili, facendo una triplice valutazione sistematica che riguarda la mobilità del martello, dell’incudine e della staffa.
SEGNI FUNZIONALI
Sordità fig. 34
 È la motivazione principale della visita. Essa è generalmente progressiva e si manifesta, il più delle volte, tra i 20 e i 40 anni, dopo un lungo periodo di evoluzione che coincide con un’ipoacusia socialmente preoccupante. Le forme unilaterali o molto asimmetriche possono essere riconosciute più rapidamente, infatti l’orecchio controlaterale viene utilizzato dal paziente per una misura soggettiva della differenza di udito.
È la motivazione principale della visita. Essa è generalmente progressiva e si manifesta, il più delle volte, tra i 20 e i 40 anni, dopo un lungo periodo di evoluzione che coincide con un’ipoacusia socialmente preoccupante. Le forme unilaterali o molto asimmetriche possono essere riconosciute più rapidamente, infatti l’orecchio controlaterale viene utilizzato dal paziente per una misura soggettiva della differenza di udito.
Solitamente viene menzionato il paradossale e apparente miglioramento dell’udito in ambienti rumorosi definito come paracusia di Willis, in cui tutti sono concordi nel riconoscere che questo fenomeno sia dovuto, in realtà, ad un innalzamento del tono della voce degli interlocutori, anch’essi disturbati dal rumore esterno, che ha nell’otosclerosi un effetto di mascheramento meno importante per i suoni gravi. Questo fenomeno non è appannaggio della malattia, ma si riscontra più frequentemente, se si effettua un’anamnesi mirata. Bisogna ricercare anche i sintomi rivelatori della presa di coscienza della sordità, il suo carattere progressivo ed evolutivo, la sua mono- o bilateralità ed eventualmente, nelle donne, l’incidenza delle gravidanze. È frequente, infatti, il riscontro della sordità o del suo peggioramento nel post partum.
Acufeni
Gli acufeni sono frequenti e possono costituire il motivo per cui il paziente si sottopone alla visita. Possono essere di vario tipo e ricondotti alla loro causa con la valutazione audiometrica. Se si dovesse proporre un intervento chirurgico, bisogna avvertire il paziente che dovrebbero scomparire, ma che nessuno può dargli la garanzia assoluta. Generalmente si ottiene un risultato positivo nel 50% dei casi, senza alcun elemento predittivo. A volte, invece, possono aggravarsi. Possono anche comparire dopo l’intervento. Sono spesso variabili e possono scomparire spontaneamente.
Nonostante l’assenza di garanzia sul risultato, essi costituiscono un’importante motivazione che porta i pazienti a optare per la scelta chirurgica da cui nasce la necessità di un’informazione molto accurata.
Vertigini
Le vertigini si manifestano raramente. Il più delle volte sono brevi e posturali e possono essere dovute ad altre patologie. Tuttavia alcuni Autori [29, 98] hanno sottolineato la frequente comparsa di alterazioni nei tracciati nistagmografici, che, però, vanno eseguiti solo all’interno di un programma di ricerca. Bisogna, al contrario, informare il paziente della possibilità della comparsa di vertigini postoperatorie, senza enfatizzarne l’incidenza e la portata.
Esame obiettivo
Otoscopia
Indipendentemente dalla malattia, il timpano è normale. Un segno classico è la macchia rosea di Schwartz, una zona iperemica situata posterosuperiormente al promontorio. Spesso si associa a un’evoluzione particolare.
|
|
|
Fig.35a segno di Schwartze orecchio destro Fig.35b orecchio sinistro
Audiometria o esame con il diapason Tanzariello
Questo esame deve essere effettuato con molta cura dal momento che, nella maggior parte dei casi, permette di indirizzarsi con certezza verso la diagnosi prima di ogni altro esame complementare, se il timpano è normale. Sono tre i segni essenziali:
• il Rinne è negativo; il diapason è percepito meglio sulla mastoide che davanti all’orecchio: si tratta di una sordità di trasmissione;
• il Weber è lateralizzato nell’orecchio affetto o in quello più sordo;
• il Lewis Federici è negativo; la percezione di un suono in conduzione ossea è migliore della percezione in conduzione cartilaginea, applicando il piede del diapason in maniera energica sul trago.
Questo segno è indice di una grave sordità di trasmissione, rappresenta un elemento sufficientemente valido per proporre al paziente l’intervento chirurgico.
Le prove audiometriche classiche (test di Bonnier, di Schwabach, di Bing ecc.) non hanno un reale interesse se i sintomi suggeriscono un esame audiometrico.
Al termine dell’esame clinico, la diagnosi è fortemente sospetta; bisognerà informare il paziente sulle alternative chirurgiche, sui rischi e conoscere il lavoro che svolge perché rappresenta un elemento importante nella decisione operatoria, tanto da metterla in discussione. Ma la diagnosi di certezza potrà essere fatta solo dopo aver ottenuto i risultati degli esami audiometrici che vanno sempre eseguiti.
LA DIAGNOSI AUDIOLOGICA DI OTOSCLEROSI
Esami complementari
Sono l’audiometria, l’audiogramma tonale e vocale e l’impedenzometria. Gli esami radiologici (TC) non sono utili nelle forme classiche e pertanto non devono essere richiesti di routine.
Audiometria tonale liminare Collegamento a Tanzariello ESAMI Categoria: SEZIONE DI AUDIOLOGIA ADULTIFig. 36a-b-c
 Conferma l’ipoacusia di trasmissione o mista e ne precisa l’entità e le componenti stabilendo la gravità della lesione cocleare e l’ampiezza del Rinne audiometrico che condiziona soprattutto le aspettative postoperatorie. È il grado di sordità che giustifica la valutazione di un trattamento terapeutico protesico o chirurgico e, specie in quest’ultimo caso, permette di spiegare al paziente i vantaggi dell’intervento, i suoi limiti e i suoi rischi.
Conferma l’ipoacusia di trasmissione o mista e ne precisa l’entità e le componenti stabilendo la gravità della lesione cocleare e l’ampiezza del Rinne audiometrico che condiziona soprattutto le aspettative postoperatorie. È il grado di sordità che giustifica la valutazione di un trattamento terapeutico protesico o chirurgico e, specie in quest’ultimo caso, permette di spiegare al paziente i vantaggi dell’intervento, i suoi limiti e i suoi rischi.
La curva ossea può essere normale ( Fig. 36b). In molti casi, si riscontra una deflessione intorno ai 2.000 Hz o ai 1.000 Hz chiamato «effetto Carhart» (Fig. 36c ). Si tratta di un vero scotoma che può interessare anche la frequenza dei 4.000 Hz e che rappresenta un elemento complementare nella diagnosi. L’effetto Carhart è stato definito come «un’alterazione della soglia di conduzione ossea legata alla riduzione della partecipazione dell’orecchio medio e dell’orecchio esterno nella trasmissione ossea delle vibrazioni sonore». Non rappresenta quindi una lesione sensitiva propriamente detta, questo spiega perché possa essere corretto con l’intervento chirurgico.
|
|
Fig 36b : Otosclerosi allo stadio iniziale. Nessuna alterazione della curva ossea. Rinne predominante sui toni gravi.
|
|
|
Fig.36c : Otosclerosi allo stadio iniziale, con effetto Carhart intorno ai 2.000 Hz.
|
Audiometria vocale per via aerea Tanzariello Sezione Di Audiologia Adulti
Audiometria vocale per via aerea Viene generalmente correlata all’audiometria tonale. Essa valuta il disturbo sociale e costituisce un argomento a favore del trattamento terapeutico. Fig.36d
 Fig.36d
Fig.36d
Esame Impedenzometrico Tanzariello Sezione Di Audiologia Adulti Esame Impedenzometrico
Il timpanogramma è quasi sempre normale, se ben eseguito, con una compliance bassa in un certo numero di casi. Il riflesso stapediale è assente e questa assenza costituisce un elemento essenziale per la diagnosi.

Fig.37 Il tipo As, (Fig. 8)(A “shallow” o “ridotto”) suggerisce un sistema irrigidito dell’orecchio centrale ,indica un aumento di rigidità del s.t.o. (esempio glue ear,timpano ispessito/ timpano sclerosi ,otosclerosi) e differisce dal tipo A per una riduzione del picco di circa il 50%e la compliance è meno di 0,2 mmhos.; può riscontrarsi in occasione di otosclerosi o nel caso di disfunzione tubarica. Il tipo Ad(Fig. 9)(A “deep” o “profondo”),i timpanogrammi a picchi altissimi, indicano una eccessiva motilità del s.t.o. come ad esempio nella discontinuità della catena ossiculare o nel caso di una abnorme flaccidità della membrana timpanicae la compliance è più di 2,5 mmhos.
Nelle forme iniziali, si può mettere in evidenza un effetto on-off caratterizzato da una doppia deflessione negativa che si manifesta all’inizio e alla fine della stimolazione sonora ed è in grado di generare un riflesso di aspetto normale. Va considerata come patologica la sola deflessione negativa finale. Questo effetto on-off è spiegato:
-
- dal movimento della cerniera della platina all’inizio della fissazione;
-
- da un «blocco» improvviso della platina seguito da un effetto ritardo;
- da uno spostamento transitorio della frequenza di risonanza dell’orecchio medio.
Alcuni Autori insistono sull’interesse:
-
- dell’audiometria ad alte frequenze, non solo per l’importanza prognostica, ma anche come elemento di controllo postoperatorio;
- dell’audiometria vocale in ambienti rumorosi che permette di formulare delle riserve sui risultati operatori attesi nei soggetti che distinguono male i diversi suoni in ambienti rumorosi.
APPROFONDIMENTO AUDIOLOGICO
LA DIAGNOSI AUDIOLOGICA DI OTOSCLEROSI
L. Bruschini, F. Forli, S. Passetti, S. Berrettini
La diagnosi di Otosclerosi si basa classicamente sui dati della anamnesi personale e familiare, dell’esame otomicroscopico e sui risultati di alcuni test audiologici di routine. Grazie alla timpanometria ed all’esame del riflesso stapediale si ottiene in genere la diagnosi di certezza. Esistono tuttavia casi nei quali la diagnosi audiologica è difficile e richiede l’impiego di test non routinari.
Classificazioni audiometriche.
L’otosclerosi determina notoriamente una sordità progressiva, che nello stadio iniziale è esclusivamente trasmissiva per la fissità ossiculare, mentre negli stadi più avanzati ha una componente neurosensoriale sempre più rilevante, per l’interessamento cocleare, fino alla sordità profonda. La progressione della sordità otosclerotica è classicamente rappresentata nei 4 stadi audiometrici indicati da Shambaugh:
· 1°stadio: VO normale o con “tacca di Carhart” a 2 kHZ. VA < 50 dB, con curva di soglia in salita dai toni gravi agli acuti. Sordità di tipo trasmissivo di entità lieve-media.
· 2°stadio: VO in discesa sui toni acuti (> 20-30 dB a 2 e 4 kHz). VA < 60 dB, con curva di soglia lineare od in discesa sui toni acuti. Sordità di tipo misto di entità media.
· 3°stadio: VO in discesa sui toni acuti con soglia dei 1-2 e 4 kHz < 40dB. VA in discesa sui toni acuti. Sordità di tipo misto di entità medio-grave
· 4°stadio: VO in discesa sui toni acuti con soglia > 40 dB. Sordità di tipo misto di entità grave-profonda.
Il 4°stadio è stato ulteriormente suddiviso, indicando la sordità otosclerotica più grave caratterizzata dai livelli della VA > 85 dB e dalla VO non misurabile. Questa sordità è propria della forma otosclerotica più avanzata definita “Far Advanced Otosclerosis” (FAO) (House et al. 1961).Nelle sordità otosclerotiche ancora più gravi non sono misurabili né la VO né la VA. Queste forme sono state classificate come “Very Far Advanced Otosclerosis” (VFAO) (Iurato et al. 1992)
Una ulteriore variante audiometrica della sordità otosclerotica è la curva “a corda molle” (“cookie-bite”, morso di biscotto), che indica una sordità essenzialmente neurosensoriale o mista (fig 38). Questa sordità è generalmente associata all’otosclerosi cocleare (Sellari-Franceschini et al. 1998).
|
|
Fig.38: Sordità otosclerotica di tipo misto con curva di soglia “a corda molle”. |
Audiometria tonale liminare e sopraliminare. Tanzariello Sezione Di Audiologia Adulti 1)Audiometria tonale liminare e 2) Audiometria tonale sopraliminare
La sordità otosclerotica non pone alcun problema di determinazione delle soglie dei toni puri per via aerea (VA) o per via ossea (VO), se l’orecchio interno (la coclea) non è interessato o se è interessato in modo identico nei due orecchi. Quando tra i due orecchi c’è una differenza sensibile di interessamento cocleare o quando addirittura un solo orecchio ha un danno neurosensoriale, la misura della VO, in questo orecchio, può comportare errori di determinazione. Un caso paradigmatico è costituito dalla presenza di otosclerosi stapediale in un orecchio e di una sordità neurosensoriale nell’orecchio controlaterale.
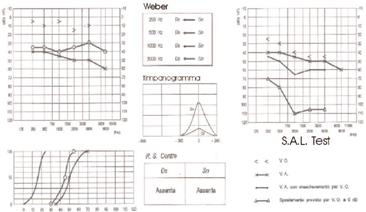
Fig.39: Il SAL test di Jerger per la determinazione della VO dell’orecchio Sn in un caso di otosclerosi Dx e sordità neurosensoriale a Sn.
Nel caso riportato nella figura 39 il test di Weber indica la netta lateralizzazione della VO nell’orecchio destro (Dx) otosclerotico. Per determinare la VO dell’orecchio sinistro (Sn) è necessario mascherare l’orecchio Dx.Il mascheramento per VA è impossibile, per l’insufficiente intensità del rumore di mascheramento, data la presenza della sordità di trasmissione a Dx. Ne consegue la necessità di impiegare test di mascheramento per VO. Il SAL test di Jerger è il più accurato in questi casi (Del Bo et al. 1995).
Il SAL test si esegue, come noto, mascherando ambedue gli orecchi contemporaneamente, con un rumore a banda stretta di 110 dB, inviato per VO mediante un vibratore posto sulla fronte. Per l’effetto del mascheramento, la VA dell’orecchio Sn peggiora. Confrontando le due VA dell’orecchio Sn, con e senza mascheramento, in base a valori tabellari standard di riferimento, si ottengono valori della VO attendibili (Jerger 1960).
Nel caso riportato la VO di Sn coincide con la VA, indicando la presenza di una sordità neurosensoriale. Gli altri test audiologici eseguiti non sono in grado di dirimere la diagnosi della sordità a Sn. In particolare le due soglie di discriminazione vocale Dx e Sn non hanno differenze apprezzabili nei due orecchi. La timpanometria segnala curve di “tipo A” ed il riflesso stapediale (per stimolazione acustica controlaterale) è “assente” in ambedue gli orecchi, per l’anchilosi stapediale a Dx e per l’insufficiente intensità dello stimolo acustico necessario per evocare il riflesso a Sn (intensità dello stimolo acustico (dB) = dB soglia uditiva a Dx + dB soglia del riflesso stapediale) (Fig.39).
Audiometria vocale e stadi audiometrici. Tanzariello Sezione Di Audiologia Adulti Audiometria vocale per via aerea
L’audiometria vocale indica il livello di comprensione delle parole, fornendo informazioni sulla funzione dell’orecchio interno e delle vie acustiche centrali. Nell’otosclerosi è comunemente utilizzata a) per valutare la “riserva cocleare” dei due orecchi prima dell’intervento, b) per scegliere il 1° orecchio da operare, c) per verificare il reale guadagno uditivo sociale postoperatorio e d) per la valutazione delle indicazioni alla protesizzazione .
La curva di soglia di intelligibilità vocale ha un andamento diverso in relazione al grado di interessamento cocleare. Negli stadi 1° e 2° (Shambaugh) segue la configurazione della curva di intelligibilità normale, mentre negli stadi 3° e 4° ha una configurazione diversa, inclinata sulla soglia di intellezione od “a campana”, tipica delle sordità con componente neurosensoriale rilevante.
Nella figura 40 è indicata l’audiometria vocale in un caso di otosclerosi con audiogramma tonale di stadio 1°(Shambaugh).

Fig.40. Correlazione tra audiometria tonale e vocale (1°stadio audiometrico di Shambaugh)
Le due soglie tonali per VO, Dx e Sn, sono normali e pressoché coincidenti. Anche le due soglie per VA, Dx e Sn, coincidono ed hanno l’andamento “in salita” sui toni acuti, tipico della curva di rigidità. Il timpanogramma è di tipo As nei due orecchi ed il RS è assente. Le due curve di intelligibilità Dx e Sn coincidono e seguono la configurazione della curva normale. Il Weber tonale è indifferente. Anche il test di Weber vocale, eseguito inviando il materiale vocale (parole bisillabiche) per VO mediante il vibratore posto al centro della fronte(Causse 1974), non indica una lateralizzazione dello stimolo. (Fig.33). Nessun test indica una lateralizzazione Dx o Sn dello stimolo sonoro. La scelta del 1° orecchio da operare in questo caso è affidata alle indicazioni del paziente.
Nella figura 41 è indicata l’audiometria vocale in un caso di otosclerosi con audiogramma tonale di stadio 2°(Shambaugh).

Fig.41. Correlazione tra audiometria tonale e vocale (2°stadio audiometrico di Shambaugh)
Come nel caso precedente le soglie tonali per VO e VA dei due orecchi sono quasi coincidenti. Anche le due curve di intelligibilità dell’orecchio Dx e Sn sono quasi coincidenti ed hanno una inclinazione maggiore della curva normale sulla soglia di intellezione, indicando un iniziale danno cocleare. Il timpanogramma è di tipo As ed il RS è “assente. Nè Weber tonale, nè il Weber vocale indicano una lateralizzazione all’orecchio Dx od al Sn della VO. Anche in questo caso nessun test audiometrico è in grado di dare indicazioni utili per scegliere il primo orecchio da operare (Fig.34).
Nella figura 42 è indicata l’audiometria vocale in un caso di otosclerosi con audiogramma tonale di stadio 3°(Shambaugh).
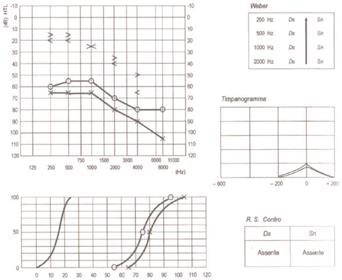
Fig,42. Correlazione tra audiometria tonale e vocale (3°stadio audiometrico di Shambaugh)
L’audiometria tonale indica una sordità di tipo misto di grado medio-grave peggiore a Sn. Il test di Weber è indifferente. Le due curve di intelligibilità raggiungono la soglia di intellezione a 95 e105dB nei due orecchi, indicando la presenza di una buona riserva cocleare sia a Dx che a Sn. Viene così confermata l’indicazione ad operare l’orecchio Sn (orecchio peggiore), con una buona prognosi riguardo all’esito funzionale. (Fig.35).
Nella figura 43 è indicata l’audiometria vocale in un caso di otosclerosi con audiogramma tonale di stadio 4°(Shambaugh).
L’audiometria tonale indica che la VO dei due orecchi ha una soglia in discesa sui toni acuti > 40 dB. La sordità è di tipo misto bilaterale, di entità grave-profonda, peggiore a Dx. Le due curve di intelligibilità vocale Dx e Sn non raggiungono la soglia di intellezione, la curva di intelligibilità dell’orecchio Sn raggiunge l’80% delle parole ripetute correttamente alla massima intensità di stimolazione dell’audiometro, mentre quella dell’orecchio Dx è una curva a”campana” con un massimo di 50% delle parole correttamente ripetute a 110 dB.

Fig.43: Correlazione tra audiometria tonale e vocale (4°stadio audiometrico di Shambaugh)
Nella figura 44 è riportato un caso di otosclerosi con audiogramma tonale di stadio 4°. L’audiometria vocale indica una riduzione “estrema” della comprensione delle parole a destra. La curva di intelligibilità raggiunge soltanto il 20% delle parole correttamente ripetute alla massima intensità di stimolazione(120dB).
In questo caso l’indicazione all’intervento nell’orecchio Dx (orecchio peggiore) può essere posta in discussione.
Nella figura 45 è riportato il risultato funzionale ad un anno dall’intervento di stapedotomia Dx. L’audiometria tonale indica un sensibile miglioramento sia della soglia della VA dell’orecchio Dx operato. Anche la curva di intelligibilità vocale è sensibilmente migliorata raggiungendo il 70% delle parole correttamente ripetute a 100 dB. Si conferma quindi l’indicazione all’intervento anche nei casi con riduzione “estrema” della soglia di intellezione. L’intervento determina il miglioramento della soglia, consentendo una migliore utilizzazione della protesi acustica.

Fig,44:
otosclerosi bilaterale con audiogramma tonale di stadio 4°. Audiometria vocale indicante una riduzione “estrema” della comprensione delle parole a destra.
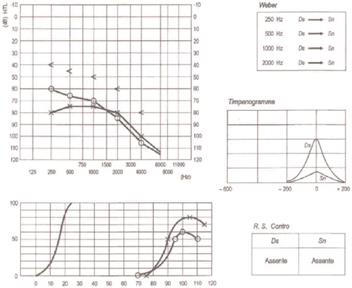
Fig.45 Il caso precedente a distanza di un anno dall’intervento di stapedotomia Dx.
Evidente miglioramento delle soglie udiometriche tonale e vocale dell’orecchio Dx operato.
L’esame del Riflesso Stapediale (RS). Tanzariello Categoria: SEZIONE DI AUDIOLOGIA ADULTI Esame Impedenzometrico
Il RS può essere normalmente presente nell’otosclerosi conclamata, se nessun focolaio interessa la finestra ovale (FO), mentre è tipicamente “assente” nell’otosclerosi stapedo-ovalare. Se la lesione otosclerotica stapedo-ovalare è iniziale ed interessa il solo polo anteriore della FO e/o il legamento anulare, l’evocazione del RS può dare una risposta anomala detta “effetto ON-OFF”. In 3 casistiche di otosclerotici il RS è indicato come normalmente presente, assente, o nell’effetto ON-OFF in percentuali diverse (Tab.II)
Tab.II: Il riflesso stapediale (RS) nell’otosclerosi.
|
RS |
Jerger et al. (1974) |
Causse JR e |
Prefazio e Montaguti |
|
|
|
Causse JB (1980) |
(1983) |
|
Normale |
10% |
53,9% |
5,8% |
|
Assente |
80% |
38% |
90,6% |
|
Effetto ON-OFF |
18% |
8% |
3,6% |
Mentre il RS normale è rappresentato graficamente da una deflessione negativa che indica una diminuzione della compliance del sistema timpano ossiculare che dura tutto il tempo della stimolazione, la risposta ON-OFF è caratterizzata da due deflessioni positive che indicano due fasi rapide di aumento della compliance all’inizio ed alla fine dello stimolo acustico, separate da una fase centrale in cui la compliance ritorna ai valori normali (Fig.46b).

Fig. 46.a-Effetto on-off nell’otosclerosi iniziale.
Infatti nei deficit otosclerotici modesti o nelle menomazioni monolaterali con orecchio opposto apparentemente normoacusico si ha una particolare modalità di produzione del RS che mostra questi caratteri di atipia.
1) Presenza di una duplice deflessione (doppio spike) all’inizio e alla fine della stimolazione.
2) Senso positivo di questi spike, di segno opposto alla direzione normale, indice di un duplice transitorio aumento della compliance.
3) Ritorno all’isoelettrica tra i due spike iniziale e finale durante tutta la fase di stimolazione.
L’interpretazione di questo fenomeno è complessa: forse è dovuta ad una prevalenza del muscolo tensore, forse a particolari modalità dinamiche della staffa. Infatti sembra che esso compaia solo nelle forme otospongiosiche a focolaio anteriore, mentre mancherebbe nelle altre forme platinari.
|
|
Fig.46.b: Morfologia del riflesso stapediale (RS) |

In alcuni casi è possibile osservare un effetto ON-OFF “incompleto” o “parziale” caratterizzato dalla comparsa, tra le due deflessioni positive, di una deflessione negativa più o meno ampia, che simula il RS normale: Questo tipo di risposta è una forma di passaggio tra il RS normale e l’effetto ON-OFF “completo”ed è strettamente correlata con l’evoluzione del focolaio otosclerotico stapedo ovalare. La progressione verso l’anchilosi stapediale completa è indicata in sequenza prima dall’effetto ON-OFF incompleto, poi dall’effetto ON-OFF ed infine dal RS assente (Bruschini et al. 1987).
Il passaggio dall’effetto ON-OFF al RS assente è ben rilevabile se si esamina una otosclerosi iniziale nel tempo.
Nella figura 10 è indicata l’audiometria il test di Weber, il timpanogramma ed il RS di un caso di otosclerosi iniziale. La morfologia del RS indica l’effetto ONOFF bilaterale.
Gli stessi test audiologici eseguiti dopo due anni indicano un modesto peggioramento della soglia audiometrica e l’assenza del RS all’orecchio Dx, mentre a Sn si rileva ancora un RS con effetto ON-OFF. (Fig.47) La presenza di un RS con effetto ON-OFF, indicando una otosclerosi stapedo ovalare “iniziale” è una indicazione a dilazionare l’intervento chirurgico.

Fig.47:Otosclerosi iniziale. Audiogramma di stadio 1°
(Shambaugh)e RS con “effetto ONOFF” bilaterale.

Fig.48: Il solito caso di otosclerosi a distanza di 2 anni.
Modesto peggioramento della soglia audiometrica destra, RS “assente” a Dx. Audiometria e RS con effetto ON-OFF invariati a Sn.
La diagnosi differenziale con la timpanosclerosi e l’otite media secretiva.
Queste diagnosi si basano fondamentalmente sull’esame otomicroscopico e sulla timpanometria.
La gran parte degli orecchi otosclerotici hanno un timpanogramma di tipo A (Jerger 1970), come gli orecchi normali. Meno frequentemente il timpanogramma è di tipo As (riduzione del gradiente del picco) per la rigidità del sistema timpano ossiculare dovuta alla anchilosi stapediale.
Nella timpanosclerosi il timpanogramma è generalmente di tipo B (timpanogramma “piatto”), per l’aumento di rigidità della membrana e/o della catena ossiculare (Fig.49), o di tipo difasico, per la coesistenza di aree di ispessimento fibroso e/o calcifico e di atrofia della membrana timpanica. Nella timpanosclerosi limitata agli ossicini e/o alla FO e/o all MT si possono rilevare curve timpano metriche di tipo Ad (aumento abnorme del gradiente del picco), per l’atrofia parziale o totale della MT e l’interruzione della catena ossiculare per l’erosione della lunga apofisi dell’incudine (Fig.50), od anche di tipo C od As, con otomicroscopia normale. In questo ultimo caso la diagnosi differenziale con l’otosclerosi è intraoperatoria (timpanotomia esplorativa).

Fig.49: Timpanosclerosi Dx :Audiometria e timpanogramma di tipo B.

Fig.50 Timpanosclerosi Dx (atrofia della MT ed erosione della lunga apofisi dell’incudine): Audiometria e timpanogramma di tipo As
L’otite media secretiva può complicare l’otosclerosi. L’associazione di otite secretiva ed otosclerosi pone difficoltà di diagnosi differenziale, che si risolvono, di solito, soltanto all’atto della guarigione della otite secretiva.
Nel caso riportato nella figura 51 la prima diagnosi di “otite secretiva” era posta in base alla sordità trasmissiva bilaterale, al timpanogramma di tipo B ed al rilievo otomicroscopico del liquido siero-mucoso nella cassa timpanica. Il drenaggio trastimpanico e la sistemazione di tubi di ventilazione nei due orecchi non ha prodotto alcun miglioramento dell’udito. Dopo la rimozione dei tubi di ventilazione e la risoluzione stabile dell’otite secretiva, l’orecchio sinistro è stato operato di stapedotomia con un buon risultato funzionale (Fig.52)

Fig.51: Caso di otosclerosi complicato da otite secretiva: Audiometria e timpanogramma
Fig.52: Caso di otosclerosi complicato da otite secretiva: Audiometria dopo il drenaggio trastimpanico (a) e dopo intervento di stapedoplastica a Sn (b).
Diagnosi differenziale con l’interruzione della catena ossiculare a timpano integro.
L’interruzione della catena ossiculare con timpano normale si ritrova nelle malformazioni minori dell’orecchio medio o negli esiti traumatici. In questi ultimi, la catena ossiculare è interrotta per la dislocazione ed il distacco traumatico dell’incudine dal martello o per la frattura delle crura della staffa. La diagnosi differenziale audiologica con l’otosclerosi si basa esclusivamente sulla timpanometria indicante un timpanogramma di tipo Ad (abnorme cedevolezza del sistema timpano ossiculare). Nella dislocazione dell’incudine il RS è “assente” perché l’interruzione della catena ossiculare è situata a monte della sede di inserzione del muscolo stapedio (Fig.53). Se l’interruzione è a valle, come nella frattura traumatica delle crura della staffa, il RS è normalmente presente (Fig.54).
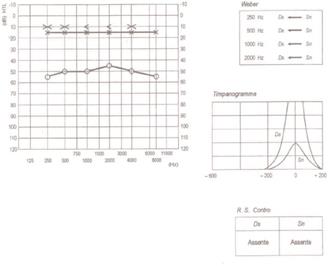
Fig.53: Dislocazione traumatica dell’incudine a timpano integro a Dx. Sordità di trasmissione, timpanogramma di tipo Ad, RS assente.
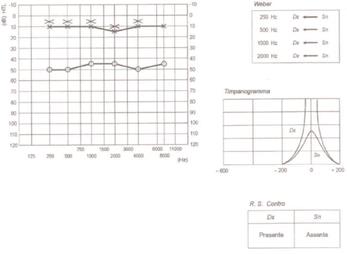
Fig: 54: Frattura dell’arco stapediale a Dx: Sordità di trasmissione, timpanogramma di tipo Ad, RS presente a Dx.
Imaging
«Chirurgia della sordità»
Esami nella chirurgia della sordità: «Non è necessario effettuare una tomografia se si sospetta un’otosclerosi, tranne che come supporto alla diagnosi in caso di fallimento chirurgico o in occasione di un’eventuale rara forma endococleare». In ogni caso, bisogna conoscere le anomalie radiologiche.
Tecnica
· Il piano principale di studio è quello orizzontale, parallelo al piano nasion-trago.
· Lo spessore delle sezioni non deve superare 1 mm, usando i filtri ossei.
· Le sezioni devono essere sovrapposte di 0,5 mm in modo da ottenere tre o quattro immagini sulla platina.
· Il piano frontale non è utile per studiare la finestra ovale. Le ricostruzioni in modalità 2D permettono di studiare la posizione della seconda porzione del VII rispetto alla platina e di prevedere le difficoltà chirurgiche.
Risultati e semeiologia tomografica
Ipodensità
La lesione otospongiosa è radiograficamente ipodensa e presenta contorni sfumati [96]. Queste ipodensità si localizzano principalmente a livello della fissula ante fenestram. Possono interessare la regione della finestra rotonda, il meato acustico interno anteriormente alla sua parete anteriore. Veillon li ha riscontrati in sede precocleare, intorno ai canali semicircolari, a contatto con l’acquedotto della coclea e nella parete mediale del vestibolo [96]. Partendo da ciò, ha proposto una classificazione tomografica:
Tabella III
|
classificazione di Veillon |
|
|
tipo 0 |
assenza di anomalie; |
|
tipo 1A: |
interessamento isolato della platina (ispessimento) senza ipodensità prestapediale associata;
|
|
tipo 1B: |
ipodensità prestapediale inferiore o uguale a 1 mm di spessore; |
|
tipo 2: |
ipodensità prestapediale superiore a 1 mm di spessore senza contatto periferico con il lume cocleare;
|
|
tipo 3: |
ipodensità stapediale superiore a 1 mm di spessore a contatto con la periferia del lume cocleare;
|
|
tipo 4A: |
ipodensità situata in avanti, al di sotto o all’interno del lume cocleare;
|
|
tipo 4B: |
ipodensità labirintica posteriore situata intorno ai canali semicircolari o a contatto della parte mediale del vestibolo.
|
Attualmente, la classificazione di Veillon(10) ( Tabella III ) è ancora utilizzata, ma tale classificazione non presenta alcun correlazioni cliniche.
Ispessimento platinario
La platina normale ha uno spessore di 0,15-0,20 mm. Se si tiene conto dell’ingrandimento tomografico, si può considerare [96] patologica una platina di 0,7 mm.
Immagini di sommazione
Sono rare e sono da ricercare tra la parete mediale della cavità timpanica e gli ossicini.
Il sistema di classificazione proposto da Symons / Fanning nel 2005 è illustrato nella Figura 55 .

Fig.55 immagini assiali CT della rocca petrosa in pazienti affetti da otosclerosi. Grado 0: normale. Grado 1: piccola Lucent lesione al fenestram fissula ante. Grado 2A: la sclerosi e restringimento del turno basale (ha anche la malattia Fenestral spongiotica). Grado 2B: lesione Lucent si estende dal fenestram fissula ante alla svolta mezzo della coclea. Grado 2C: lucency chiazze intorno alla parte laterale della base, medio, e giri apicale della coclea, la mediale della coclea appare risparmiata. Grado 3: grave, confluente lucency intorno alla coclea.
Evoluzione
L’otosclerosi ha un’evoluzione generalmente progressiva, caratterizzata da un peggioramento della sordità nella quale bisogna distinguere, con un follow-up audiometrico regolare, la componente relativa all’alterazione della trasmissione da quella relativa alla lesione neurosensoriale. Alcune forme evolvono per tappe, nelle donne apparentemente scatenate dai momenti della vita sessuale e principalmente dalle gravidanze, anche se ciò può essere messo in discussione. È abbastanza frequente riscontrare inizialmente un’apertura progressiva del Rinne con una conduzione ossea conservata (come conseguenza dell’effetto Carhart già menzionato), quindi, nella maggior parte dei casi, le frequenze acute si alterano con una riduzione tra i 4.000 e gli 8.000 Hz così che la curva ossea, sia spesso alterata a partire dai 2.000 Hz, seguendo una pendenza regolare (Fig.56). Nelle fasi terminali essi decrescono a 1.000, a 500 o addirittura a 250 Hz in modo progressivo (Fig.57), fino alla sordità profonda con scomparsa, spesso, del Rinne e con una lesione molto importante della comprensione (Fig.58). È raro tuttavia arrivare a condizioni in cui sia impossibile utilizzare una protesi, ma, a volte, alcune forme molto labirintizzate creano enormi problemi che portano talvolta al trattamento chirurgico «per poter applicare un apparecchio protesico», dal momento che persistono anche con una parziale apertura del Rinne.
È stata proposta una classificazione audiologica in quattro stadi:
· stadio I: sordità di trasmissione pura con eventuale effetto Carhart;
· stadio II: la conduzione ossea (CO) non si riscontra più dopo i 2.000 Hz;
· stadio III: la CO fa comparire un deficit superiore ai 30 dB con frequenze di 1.000-2.000 Hz. In modalità vocale raggiunge un plateau;
· stadio IV: il deficit della CO è superiore ai 40 dB sopra i 1.000 Hz, le frequenze acute sono amputate a partire dai 4.000 Hz. La curva vocale raggiunge il massimo livello al 60%.
Il decorso è in ogni modo molto variabile da un paziente all’altro; la malattia può essere diagnosticata in uno stadio avanzato, con grosse alterazioni labirintiche in alcuni pazienti ancora giovani (forme giovanili). In altri, al contrario, si ha una lunga stabilizzazione della malattia, con una CO a lungo normale o quasi normale. Il monitoraggio audiometrico regolare permette, se non si opta subito per l’intervento, di valutare al meglio il rischio di evoluzione e di consigliare il paziente circa i criteri obiettivi di evoluzione; che porteranno, molto spesso, alla decisione di intervenire chirurgicamente sebbene le condizioni siano soddisfacenti, cioè, con una buona tenuta neurosensoriale (questo non significa che le forme labirintizzate non possano beneficiare dell’intervento in determinate condizioni).
|
|
Fig 55 : Otosclerosi con un inizio di labirintizzazione che provoca un’alterazione della conduzione ossea per i suoni acuti.
|
|
|
Fig 57 : Alterazione della curva ossea effettuata su tutte le frequenze. Questa alterazione resta relativamente modesta.
|
|
|
Fig 58 a : Otosclerosi con importanti sintomi labirintici.
|
Forme cliniche
Forme evolutive
Alcune otospongiosi evolvono molto rapidamente verso la labirintizzazione. Sono spesso delle forme a esordio precoce che rientrano nel quadro delle cosiddette forme giovanili. Costituiscono per alcuni una controindicazione al trattamento chirurgico; sebbene nulla dimostra che quest’ultimo possa accelerare la malattia. Si tratta in realtà di una forma di cautela, comprensibile da parte del chirurgo senza che l’intervento possa essere basato pienamente sull’osservazione clinica. Ma è indispensabile formulare delle riserve legittime e ottenere un consenso informato.
Forme in base all’età
Forme giovanili
La loro frequenza è valutata differentemente, dall’1 all’8, 5%. Questa differenza è giustificata dall’interpretazione del termine giovanile. Alcuni Autori considerano solo le forme prepuberali, altri parlano di forme giovanili al di sotto dei 20 anni. Si sono accordati tuttavia nel riconoscere il loro carattere evolutivo che li rende più prudenti nei confronti della chirurgia.
Indicazioni nel giovane
• Risultati sovrapponibili a quelli dell’adulto.
• Millman et al (1996)31 casi (40 int), età media 16 annibuoni risultati nel 90 % di casirisultati stabili in 25 anni di follow up
• Versamenti endotimpanici, infezioni del tratto respiratoriosuperiore, attività sportive potenzialmente traumatiche.
• Necessità di TC per difetti platinari o della catena ossiculare(Lescane 2008).
• Risultati peggiori nella fissazione congenita della staffa associata ad anomalie dell’incudine e del martello
• De la Cruz et al (1999)81 casi (95 int.)< 18 anni82 % successi vs 44% nelle forme confissazione congenita della staffa5 anni di follow up
Forme tardive
Generalmente considerate poco evolutive, pongono anche il problema della motivazione dell’intervento.
Indicazioni nell’anziano
• Uguali percentuali di successo rispetto all’etàadulta (Lippy 1996; 90,9%, 70-92 anni)
• La chirurgia di revisione ha percentuali disuccesso sovrapponibili in età adulta edavanzata (Lippy 2002, 67.6% vs 70.8%)
Forme unilaterali Fig 59
Esse sono frequenti nelle fasi iniziali, ma spesso non fanno che precedere una bilateralizzazione a cui il paziente deve essere preparato. In alcuni casi comunque, si tratta di autentiche forme unilaterali e Guild [40] ha stimato che circa il 30% dei casi di otosclerosi istologica è monolaterale. Ma, in pratica, la frequenza clinica sembra essere minore, anche se i valori di 3,5% preannunciati da Cawthorne [18] e Nager [65] sono probabilmente troppo bassi.

Fig 59 otosclerosi unilaterale sinistra
Forme cocleari pure fig. 60.a
 Ipotizzate molto tempo fa, sono state negate da alcuni Autori e si manifestano molto raramente e, probabilmente, molto spesso precedute da una sordità di percezione, anche se sono state osservate con maggiore frequenza nei pazienti con precedenti familiari di otosclerosi. Ma devono manifestarsi alcuni aspetti che orientino verso la diagnosi come la comparsa precoce di questa sordità di percezione e perfino l’evoluzione associata a eventi endocrini. Schuknecht [83], Cawthorne [19] e più di recente Fraysse e Fayad [32] basandosi su importanti studi post mortem, hanno affermato che, in pratica non esistono casi di forme cocleari senza anchilosi stapedovestibolare.
Ipotizzate molto tempo fa, sono state negate da alcuni Autori e si manifestano molto raramente e, probabilmente, molto spesso precedute da una sordità di percezione, anche se sono state osservate con maggiore frequenza nei pazienti con precedenti familiari di otosclerosi. Ma devono manifestarsi alcuni aspetti che orientino verso la diagnosi come la comparsa precoce di questa sordità di percezione e perfino l’evoluzione associata a eventi endocrini. Schuknecht [83], Cawthorne [19] e più di recente Fraysse e Fayad [32] basandosi su importanti studi post mortem, hanno affermato che, in pratica non esistono casi di forme cocleari senza anchilosi stapedovestibolare.
Viceversa, Guild [40] dopo l’autopsia di 80 pazienti con otosclerosi ha riscontrato in 15 casi un focolaio cocleare senza focolaio platinario. Himojosa e Marion [43] hanno studiato 127 rocche affette da otosclerosi. Sei di esse avevano una sordità di percezione pura senza fissazione della staffa, con lesioni degenerative sensoriali e neurali simili a quelle della presbiacusia.
Bisogna anche riconoscere che in alcuni casi, la prova tardiva per la diagnosi è fornita dalla comparsa di un effetto on-off, L’apertura del Rinne seguita dalla scomparsa del riflesso stapediale, in una sordità inizialmente di percezione. Pertanto la questione merita di essere così inquadrata, dal momento che provoca una sordità di percezione da un lato e una sordità di trasmissione tipica dall’altro. Questi casi sono infatti rarissimi.
L’esame radiografico, cioè, la TC, permette, in questi casi precisi, un’alta probabilità diagnostica o addirittura la diagnosi di certezza, ma questo esame non dovrebbe più essere richiesto frequentemente nel caso di una sordità di percezione.

Fig 61 b-c Immagini assiali HRCT dell’osso temporale destro (a) e di sinistra ( b) in un paziente adulto con grave SNHL bilaterale . Il ‘ doppio anello ‘ ( freccia) ipodensa pericocleare bilaterale è in linea con una otosclerosi cocleare bilaterale
Otosclerosi e gravidanza
L’influenza della gravidanza sull’evoluzione dell’otosclerosi è unanimamente riconosciuta. Molte forme di otosclerosi si manifestano o si diagnosticano con la prima gravidanza e, in pratica, è molto frequente che una donna con più figli segnali spontaneamente le esacerbazioni riscontrate in seguito alla gravidanza stessa. L’ipervascolarizzazione causata dalla ritenzione estrogena dovuta alla gravidanza potrebbe provocare, a livello dei focolai di otosclerosi, una liberazione di sostanze litiche e uno squilibrio enzimatico che accelerano il processo autoimmunitario [15]. Morrison [63] ha evidenziato questa influenza nel 40-55% dei casi. Gapany [35], in uno studio condotto su 338 donne, ha riscontrato:
comparsa di malattia con la gravidanza nel 21,6%;
peggioramento con la prima gravidanza nell’11,30%;
peggioramento alla seconda gravidanza nel 4,7%;
peggioramento a ogni gravidanza nel 5,6%.
Non sembra, tuttavia, esistere un rapporto significativo tra la gravità dell’evoluzione della patologia e il numero delle gravidanze [98]. È utile intervenire nei tempi che precedono la prima gravidanza a condizione che la sordità giustifichi l’intervento. In caso contrario, è sufficiente un semplice monitoraggio audiometrico dopo il parto. Secondo alcuni, l’allattamento al seno è controindicato, se la gravidanza ha determinato un peggioramento della sordità.
controindicato, se la gravidanza ha determinato un peggioramento della sordità.
Otosclerosi e trattamenti ormonali
Contraccezione
Si è discusso a lungo sulla legittimità della contraccezione orale con estrogeni nelle donne affette da otospongiosi. A riguardo non esistono studi randomizzati. Causse [12] ha notato in donne già operate e trattate con dosi di estrogeni superiori a 30 μg/die, una maggiore frequenza di riduzione dell’udito per le frequenze medie (24% versus 10%). Vanno consigliati, quindi, dosaggi più bassi ma sembra eccessivo impedirne l’uso. In assenza di studi più approfonditi, è consigliabile, nei limiti del possibile, un altro mezzo di contraccezione. I contraccettivi orali non devono essere controindicati, ma è preferibile prescrivere quelli a dosaggi inferiori, dell’ordine di 20 μg, e soprattutto sottolineare l’importanza di controlli audiometrici regolari [22]. Alcuni hanno proposto la somministrazione, 3 settimane su 4, di un progestinico puro, a dosaggi normali, come il clormadinone da 10 mg/die. Questo tipo di trattamento è ben tollerato ed è privo di effetti collaterali di tipo metabolico. I microprogestinici, somministrati in modo continuo, sono poco indicati perché possono indurre un iperestrogenismo endogeno.
Trattamento sostitutivo perimenopausale
Il discorso cambia se si utilizza un ormone naturale, come l’estradiolo 17-beta, somministrato in compresse micronizzate o in gel percutaneo, alle dosi corrispondenti alle concentrazioni fisiologiche dell’ormone. Questo farmaco non dovrebbe creare problemi, ma ciò non esclude un monitoraggio audiometrico regolare.
DIAGNOSI DIFFERENZIALE
Diagnosi positiva
Nelle forme comuni, di gran lunga le più frequenti, la diagnosi di otosclerosi è praticamente evidente in presenza di una sordità di trasmissione evolutiva con timpano e timpanogramma normali, effetto Carhart e abolizione del riflesso stapediale. Non sempre si riscontra una familiarità. Quest’ultima non è necessaria per la diagnosi. È diverso, invece, nella forma cocleare pura già menzionata o in presenza di un’otosclerosi associata a un’altra patologia come l’otite cronica, un’otite sieromucosa, un’otite fibroadesiva, fino alle sequele di otiti infantili che abbiano determinato la rottura della catena degli ossicini o soprattutto una timpanosclerosi. Queste ultime due affezioni rappresentano più frequentemente un elemento diagnostico differenziale piuttosto che un’associazione, anche se nulla impedisce di associarsi a un’otosclerosi pura. Perlomeno, la diagnosi resterà probabilmente dubbia, anche in sede intraoperatoria.
Il colesteatoma congenito nella forma iniziale a timpano integro può simulare l’audiometria e la timpanometria dell’otosclerosi: audiogramma di tipo 1° o 2° di Shambaugh, timpanogramma di tipo A od Ad e RS “assente” (per l’interruzione della catena ossiculare), L’ otomicroscopia può indicare la presenza del colesteatoma nella cassa timpanica, in trasparenza, se la “perla” si avvicina alla MT. La diagnosi differenziale può essere fatta solo con una HR-TC della rocca petrosa. In alcuni casi il colesteatoma congenito è uno spiacevole reperto intraoperatorio di una timpanotomia esplorativa.
Nelle malformazioni congenite minori dell’orecchio medio e degli ossicini con orecchio esterno normale (fissità, ipoplasia od assenza di uno o più ossicini), i reperti otomicroscopici ed audiologici possono essere analoghi a quelli dell’oto‑ sclerosi. I dati anamnestici (precoce inizio della sordità, assenza di familiarità) possono indirizzare la diagnosi. L’esecuzione di una HR-TC della rocca petrosa dirime la diagnosi e consente di valutare possibili anomalie associate dell’orecchio interno e del vestibolo.
L’anchilosi del martello e/o dell’incudine. La fissità della catena ossiculare non otoclerotica è dovuta alla calcificazione della testa del martello e più di rado del solo corpo dell’incudine nell’epitimpano. L’otosclerosi stapediale può associarsi alla fissità parziale o completa del martello per l’ossificazione del legamento timpano malleolare anteriore. Nessun test audiologico è in grado di dirimere la diagnosi differenziale con l’anchilosi stapedio-ovalare otosclerotica isolata. Neanche la HR-TC è di aiuto in questi casi. La diagnosi è intra-operatoria con l’ispezione e la manipolazione degli ossicini. La fissità incudo malleolare associata alla anchilosi stapediale è tra le più frequenti cause di insuccesso chirurgico.
Alcuni tumori benigni dell’orecchio medio come i neurinomi della seconda porzione del nervo faciale, gli adenomi ceruminosi, i meningiomi del tegmen timpani ed i tumori glomici nella fase iniziale del loro accrescimento, possono simulare il quadro clinico ed audiologico dell’otosclerosi. La diagnosi differenziale viene eseguita con la HR-TC della rocca petrosa, completata in alcuni casi (neurinoma del faciale) con la RM con mdc (Sellari-Franceschini et al. 1994).
La deiescenza del canale semicircolare superiore (sindrome di Minor). Tanzariello Essa è dovuta a una deiscenza di un canale semicircolare, il più delle volte quello superiore oppure il posteriore, che determina la creazione di una terza finestra labirintica. Ciò provoca una dispersione di energia acustica alla base di una sordità di trasmissione o mista. L’impedenz
iometria rileva un riflesso stapedio normale; l’audiogramma è simile a quello di un’otosclerosi, tuttavia con una conservazione relativa delle soglie in frequenza grave. Inoltre, le soglie di conduzione ossea sono conservate in audiometria tonale, a volte anche con dei valori negativi («conduzione ossea troppo buona»). La diagnosi si basa su criteri clinici, associazione a vertigini indotte da variazioni pressorie (segno della fistola, Valsalva) e stimoli sonori di alta intensità (fenomeno di Tullio), e su criteri radiologici: TC delle rocche ad alta risoluzione, sezioni sagittali e coronali inframillimetriche e un abbassamento delle soglie di comparsa dei potenziali evocati otolitici (inferiori a 90 dB). Quest’ultimo criterio è essenziale per differenziare la sindrome di Minor e un falso positivo radiologico.Sono descritti casi di ipoacusia trasmissiva ed assenza del RS, sottoposti a stapedioplastica ed anche a successivi interventi di revisione, senza alcun miglioramento acustico. Questi soggetti avevano sia prima che dopo l’intervento instabilità e nistagmo indotto da suoni intensi o variazione di pressione all’orecchio esterno (fenomeno di Tullio). In questi pazienti la normale evocazione dei VEMP escludeva, una patologia dell’orecchio medio ed una HR-TC della rocca petrosa metteva in evidenza una deiescenza del canale semicircolare superiore (Halmagyi et al. 2003).

Figura. 62. La tomografia computerizzata e la ricerca intraoperatoria in un paziente con deiscenza del canale superiore. Tomografia computerizzata ad alta risoluzione dell’osso temporale sinistro preoperatorie, che dimostrano la sindrome di deiscenza del canale superiore. L’immagine riformattata nel piano del canale semicircolare superiore (SSC) chiaramente dimostra una deiscenza ossea del canale superiore. A deiscenza (freccia bianca) è vista sovrastante la SSC sinistra (A). Fotografia intraoperatoria dell’osso temporale sinistro del paziente. Una deiscenza definito di osso sovrastante la SSC è visto (freccia nera) (B). ant: anteriore, posta: posteriori, lat: laterali, med: mediale.
Coreano J Otorhinolaryngol-Head Neck Surg. 2016 Jan; 59 (1): 68-72.
http://dx.doi.org/10.3342/kjorl-hns.2016.59.1.68
La sindrome dell’acquedotto vestibolare largo (SAVL). La sindrome dell’acquedotto vestibolare largo (SAVL) è caratterizzata dalla presenza di un acquedotto vestibolare abnormemente dilatato, associato ad ipoacusia. E’ considerata la causa malformativa più frequente di ipoacusia nell’infanzia, anche se la sua presenza è talora misconosciuta. Spesso la presenza di un acquedotto vestibolare dilatato si associa ad altre malformazioni dell’orecchio interno, tra cui le più comuni sono la dilatazione del vestibolo, dei canali semicircolari, o una ipoplasia della coclea. La SAVL può essere associata sia ad ipoacusia non sindromica che sindromica. E’ presente nella sindrome di Pendred, nella sindrome branchiooto-renale ed è stata descritta in associazione con l’acidosi renale tubulare distale (Berrettini et al. 2002). Viene trasmessa come carattere autosomico recessivo e mutazioni del gene pds, sul cromosoma 7q31, sono state messe in relazione sia alla SAVL non sindromica, che associata a sindrome di Pendred.
La SAVL è bilaterale nel 55-94% dei casi. Le caratteristiche audiologiche della SAVL sono estremamente variabili. L’ipoacusia è di entità variabile, da lieve a profonda, ma sono stati descritti anche casi normoacusici. Spesso ha esordio improvviso ed andamento fluttuante e progressivo (11-65% dei casi); in circa la metà dei casi l’esordio e la progressione, talora a steps, è conseguente a traumi cranici anche di lieve entità, manovra di Valsalva, brusche variazioni di pressione atmosferica, sforzi fisici. Quando è bilaterale, l’ipoacusia è spesso asimmetrica. Nel 17-38% dei casi è presente un gap trasmissivo di entità variabile, legato ad una ridotta mobilità della staffa, conseguente ad un aumento pressorio dei liquidi labirintici. L’esame impedenzometrico evidenzia un timpanogramma nella norma, con riflesso stapediale presente o meno, in relazione all’entità dell’ipoacusia. L’età di esordio dell’ipoacusia è variabile, generalmente dalla nascita all’adolescenza, anche se nella maggior parte dei casi l’ipoacusia esordisce durante l’infanzia.
Una sintomatologia vestibolare è riferita da meno di 1/3 dei pazienti, anche se la presenza di un deficit labirintico sembra essere di più frequente riscontro. Altri sintomi audiologici talora associati sono acufeni e sensazione di “aural fullness”. La diagnosi di SAVL è radiologica. La TC delle rocche petrose con scansioni assiali di 1,5 mm permette di evidenziare tutto il decorso dell’acquedotto vestibolare, dal vestibolo alla superficie posteriore della rocca petrosa. La diagnosi di acquedotto vestibolare largo viene posta se il diametro dell’acquedotto, misurato nel punto di mezzo tra la crus commune e l’apertura dell’acquedotto è superiore a 1,5 mm. La risonanza magnetica dell’orecchio interno, con ricostruzioni tridimensionali, permette invece una accurata visualizzazione e valutazione morfologica del labirinto membranoso; ed è l’unica metodica che consente di visualizzare la porzione extra-ossea del sacco endolinfatico (Berrettini et al. 2001).

Fig,.63 Imaging mostra un acquedotto vestibolare allargata bilateralmente (EVA) staffa normale nel orecchio sinistro.; protesi staffa destra si sta proiettando 2 mm nel vestibolo. Una diagnosi errata di otosclerosi in un paziente con sindrome vestibolare acquedotto allargata: un caso clinico
Dayse Távora-Vieira autore Corrispondente 1, 2 e Stuart Miller 2
La Stapes Gusher Sindrome-X linked. Collegamento a Tanzariello Disordini uditivi centrali Categoria: Sordita Non-Sindromiche Gene POU3F4, (DFN3)
La DFN3 o “Stapes Gusher Sindrome” è la forma più frequente di ipoacusia genetica X-linked ed è caratterizzata dalla presenza di ipoacusia mista (percettiva con componente trasmissiva), bilaterale, generalmente simmetrica e progressiva spontaneamente o nel corso di traumi.. L’esordio dell’ipoacusia generalmente è nella prima decade di vita e la gravità della sintomatologia è variabile da famiglia a famiglia. La componente trasmissiva è generalmente più marcata per le frequenze gravi e sembra essere legata alla fissità della staffa, anche se questa ipotesi è in contrasto con il fatto che alcuni individui affetti hanno il riflesso stapediale presente. La TC delle rocche petrose rivela la presenza di un condotto uditivo interno dilatato, con una coclea piccola e con partizione incompleta. Essa è dovuta a una malformazione dell’orecchio interno con segni di fistola perilinfatica alla TC delle rocche: il meato uditivo interno è allargato e comunica con il giro basale della coclea attraverso un acquedotto cocleare dilatato. L’ipoacusia è dovuta all’iperpressione labirintica. Ciò spiega la comparsa di un geyser labirintico in caso di platinotomia, con un rischio elevato di cofosi e un rischio minore di fuoriuscita di liquor cefalorachidiano e di meningite, imponendo l’esecuzione di una TC prima di ogni atto chirurgico di apertura dell’orecchio interno. Questa sindrome ha una trasmissione recessiva legata al cromosoma X: colpisce quindi solo i maschi la cui madre è eterozigote. Il gene responsabile è localizzato in Xq 21.1 e codifica il fattore di trascrizione POU3F4.Mutazioni puntiformi e microdelezioni del gene POU3F4, in posizione Xq21 sono state associate a questa forma genetica di ipoacusia.
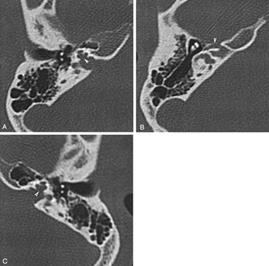
Fig 64.a-b-c sordità congenita X-linked. A, sezione assiale CT (1 mm di spessore) dell’osso temporale destro mostra una vasta IAC. C’è assenza di osso (freccia) alla base della coclea consente di comunicare con la IAC. La coclea è displastica ed il modiolus non ben visto. B, Sullo stesso lato, la parte labirintica (punta di freccia) del nervo facciale è ampia. C, sezione assiale TC dell’osso temporale sinistro mostra anche una vasta IAC comunicanti (punta di freccia) con il giro basale della coclea. La coclea è displastica, e le modiolus non ben visto. I risultati CT in un paziente: X-Linked Stapes GusherGaurav Kumar una , Mauricio Castillo un e Craig A. Buchman un
Diagnosi differenziale con le altre sordità di trasmissione
Essa è condizionata dai precedenti anamnestici (infettivi, traumatici), dal carattere evolutivo o non evolutivo (aplasia minore), dai dati dell’otoscopia (otite fibroadesiva, timpanosclerosi, colesteatoma a timpano chiuso, o addirittura tumore dell’orecchio), ma anche con malattie generali come la malattia di Paget o il morbo di Lobstein. In alcuni casi, infine, la sola esplorazione della cassa permetterà di distinguere un’anchilosi ossiculare non platinaria (sindrome di House, di Guilford, di Goodhill). La diagnosi differenziale si pone con le altre sordità di trasmissione a timpano chiuso nel corso di un iter diagnostico per gradi, che comprendono l’esame clinico, le indagini funzionali e, se necessario, lo studio radiologico. L’otoscopia è sufficiente per escludere alcune eziologie. Lo studio audiometrico può rilevare degli indizi a favore di altre cause. Infine, la TC trova qui un ruolo di elezione ed esclude la maggior parte delle patologie che possono simulare l’otosclerosi. Altri esami possono rivelarsi adeguati caso per caso, come la RM o la videonistagmografia.
Rottura della catena degli ossicini
Può essere di origine infettiva con lisi della crura discendente dell’incudine o solamente dell’apofisi lenticolare con eventuale scomparsa delle crura della staffa; si potrà riscontrare un colesteatoma a timpano chiuso sospettato all’otoscopio. Può essere di origine traumatica secondaria a un trauma esterno con o meno frattura della rocca o a una lussazione dell’incudine come, per esempio, in occasione di una mastoidectomia. In entrambi i casi, la diagnosi sarà dedotta dai precedenti anamnestici e dalle informazioni del timpanogramma che mostrano un aumento della compliance. Inizialmente potrà essere formulata con la TC e in qualsiasi caso riconosciuta durante l’intervento chirurgico, se si decide di optare per quest’ultimo.
|
|
|
Fig.65A-B-C-individuazione intraoperatoria del primo paziente . La Staffa è affondata completamente nel vestibolo , viene mostrata solo la testa di staffa (freccia ) . perdite di fluido perilinfatici fuori vestibolo ( A ) . La finestra ovale (freccia ) viene aperto dopo stapedectomia ( B ) . La finestra ovale è chiuso con fascia temporale muscolare ( freccia) ( C ) . |
Otite sieromucosa
Essa è facilmente identificata al momento dell’esame clinico, poiché il timpano non è mai normale. La diagnosi è confermata dal timpanogramma piatto e l’evoluzione è favorevole in poche settimane.
Postumi di otiti croniche
Essi possono generare una sintomatologia simile all’otospongiosi per lisi o anchilosi della catena ossiculare. L’anamnesi rileva precedenti di otite; l’otoscopia visualizza dei rimaneggiamenti della membrana timpanica; in caso di lisi ossiculare si riscontra un picco ampio all’impedenziometria; infine, la TC conferma la lisi ossiculare o la timpanosclerosi localizzata o all’epitimpano o alla fossetta vestibolare.
Anchilosi ossiculare Fig.65.D
Il martello e/o l’incudine sono a volte anchilosati; la diagnosi è posta o con la TC o in fase intraoperatoria al momento del test di mobilità del martello e dell’incudine. L’anchilosi malleolare è, in genere, in rapporto con una calcificazione del legamento malleolare anteriore. L’anchilosi della testa del martello può essere isolata o associata a un’anchilosi stapedia; la mobilità malleolare viene quindi sistematicamente verificata in fase intraoperatoria durante un intervento per otosclerosi
|
|
Fig.65.D Anchilosi congenita isolate della staffa |
Lesione ossiculare traumatica
Si deve anche ricercare un trauma della catena ossiculare. Che si tratti di una frattura o di una lussazione, l’anamnesi è evocatrice e l’impedenzometria mostra un sistema timpano-ossiculare a compliance elevata. La TC conferma il trauma ossiculare.
Aplasia minore(vedi sotto)
È essenziale ricercare le aplasie minori dell’orecchio in un paziente giovane di fronte a un’ipoacusia di trasmissione stabile e antica. È, in effetti, la diagnosi differenziale della forma giovanile dell’otosclerosi. A favore dell’aplasia minore depongono, sul piano clinico, delle anomalie morfologiche facciali e dell’orecchio esterno e, alla TC, delle malformazioni ossiculari o dell’orecchio interno. Il follow-up audiometrico mostra una sordità di trasmissione stabile e non evolutiva in conduzione ossea.
Tumori dell’orecchio medio
Tutti i tipi di tumori possono generare una sordità di trasmissione per blocco della catena ossiculare. La maggior parte delle volte l’otoscopia permette di ipotizzare la diagnosi. La diagnostica per immagini, se è indicata, è allora realizzata per valutare l’estensione e per tentare di determinare la natura della lesione. Molto spesso, la risposta è trovata solo dopo l’esplorazione chirurgica della cavità timpanica.
Tra le cause più frequenti si possono ricordare i colesteatomi primitivi, Fig.65.E collegamento tanzariello Categoria: Forme Flogistiche dell’orecchio medio Otite media cronica colesteatomatosa il paraganglioma timpanico Fig.65.F collegamento tanzariello orecchio medio Categoria: Forme Neoplastiche Tumori glomici o Paraganglioma timpanogiuguIare (o chemodectoma) e le granulomatosi (istiocitosi X, tubercolosi).
Altri tumori possono essere riscontrati più raramente, come un adenoma, uno schwannoma del VII, un meningioma o, più eccezionalmente, un tumore carcinoide dell’orecchio medio.
|
|
|
|
|
Fig. 65.E Colesteatoma congenito. Orecchio destro. Tutto l’orecchio medio è riempito da una voluminosa massa biancastra aderente al timpano. |
|
|
Fig. 65.F Paraganglioma Timpanico Immagine otoscopica Classe A2 gruppootologico |
Malformazione congenita minore
La diagnosi si baserà sul fatto che la sordità è precedente e non è evolutiva. Tuttavia, questo concetto teoricamente semplice non è sempre facile da stabilire nei pazienti che scoprono il loro deficit uditivo tardivamente. Nel dubbio, bisogna necessariamente eseguire uno studio tomografico alla ricerca dell’associazione di un’eventuale malformazione dell’orecchio interno[32].
|
|
|
|
Fig. 65.G: Sezione assiale CT dell’orecchio destro che mostra displasia LSC-vestibolo (Tipo B-1 malformazioni). |
Fig. 65.H: Sezione assiale CT dell’orecchio destro che mostra canale del nervo vestibolare superiore allargata. |
Otosclerosi associata con tipo B-1 malformazioni dell’orecchio interno
A De Stefano ,2 F Dispenza , N Aggarwal , e A Russo
Tabella III Classificazione delle malformazioni congenite minori secondo toTeunissen e Cremers.
|
Classe |
Malformazioni |
% |
|
1 |
Anchilosi o isolati fissazione congenita della staffa |
30,6% |
|
• fissaggio pedana |
||
|
• fissazione sovrastruttura |
||
|
2 |
Staffa anchilosi associata ad altre malformazioni della catena degli ossicini |
38,1% |
|
• deformità del incudine e / o di martello, o aplasia della lunga apofisi dell’incudine |
||
|
• fissaggio osseo del martello e / o incudine |
||
|
3 |
Anomalie congenite della catena degli ossicini con mobili pedana staffa |
21,6% |
|
• la disintegrazione della catena degli ossicini |
||
|
• fissazione Epitympanic |
||
|
• fissazione timpanica |
||
|
4 |
aplasia congenita o grave displasia delle finestre ovale e rotonda |
9,7% |
|
• Aplasia |
||
|
• displasia |
||
|
• Prolasso del nervo facciale |
||
|
• persistenza dell’arteria stapediale |
Otite fibroadesiva Fig.66.
 In assenza di patologie concomitanti, la diagnosi differenziale va fatta in presenza di un timpano normale o anormale, dal momento che quest’ultimo quadro è molto raro in questa malattia. La timpanometria permette la diagnosi nelle fasi iniziali. L’unica difficoltà diagnostica, in caso di otite adesiva, consiste nella valutazione dall’entità del processo atelettasico e nella distinzione tra otite adesiva e otite fibroadesiva. Affronteremo ora le anchilosi fibrotiche limitate alla platina, sequele di otiti o perfino di traumi e che Goodhill ha descritto con il termine di artrite degenerativa del legamento ossiculare. Si tratta di casi eccezionali che non influiscono molto sulla decisione operatoria e la cui incidenza è trascurabile.
In assenza di patologie concomitanti, la diagnosi differenziale va fatta in presenza di un timpano normale o anormale, dal momento che quest’ultimo quadro è molto raro in questa malattia. La timpanometria permette la diagnosi nelle fasi iniziali. L’unica difficoltà diagnostica, in caso di otite adesiva, consiste nella valutazione dall’entità del processo atelettasico e nella distinzione tra otite adesiva e otite fibroadesiva. Affronteremo ora le anchilosi fibrotiche limitate alla platina, sequele di otiti o perfino di traumi e che Goodhill ha descritto con il termine di artrite degenerativa del legamento ossiculare. Si tratta di casi eccezionali che non influiscono molto sulla decisione operatoria e la cui incidenza è trascurabile.
Timpanosclerosi Collegamento Tanzariello ORECCHIO MEDIO Categoria: Reliquati delle OtitiFig.67.
 Sequela di ripetute otiti nel bambino, la timpanosclerosi può provocare quello che abbiamo chiamato la «pietrificazione» degli ossicini. Il quadro iniziale è caratterizzato dalla sua natura ialina, pseudocartilaginea – fatta di lamelle a «buccia di cipolla». Più tardi, Questo tessuto diventa calcareo fino ad assumere forme pseudo-ossee che possono invadere totalmente l’epitimpano. In altri casi, il processo si limita al blocco del martello o dell’incudine, ma può anche localizzarsi esclusivamente o preferenzialmente nella regione delle finestre. È del tutto eccezionale che l’otoscopia non permetta la diagnosi differenziale per la presenza di una grave miringosclerosi, spesso circolare, anulare, ben diversa per noi dalle comuni placche calcaree che si riscontrano frequentemente nei soggetti con precedenti otiti infantili e che abbiano subito delle paracentesi. Affrontiamo ora le calcificazioni timpaniche a volte visibili dopo il posizionamento di drenaggi transtimpanici che favoriscono la timpanosclerosi, in una confusione deplorevole della terminologia.
Sequela di ripetute otiti nel bambino, la timpanosclerosi può provocare quello che abbiamo chiamato la «pietrificazione» degli ossicini. Il quadro iniziale è caratterizzato dalla sua natura ialina, pseudocartilaginea – fatta di lamelle a «buccia di cipolla». Più tardi, Questo tessuto diventa calcareo fino ad assumere forme pseudo-ossee che possono invadere totalmente l’epitimpano. In altri casi, il processo si limita al blocco del martello o dell’incudine, ma può anche localizzarsi esclusivamente o preferenzialmente nella regione delle finestre. È del tutto eccezionale che l’otoscopia non permetta la diagnosi differenziale per la presenza di una grave miringosclerosi, spesso circolare, anulare, ben diversa per noi dalle comuni placche calcaree che si riscontrano frequentemente nei soggetti con precedenti otiti infantili e che abbiano subito delle paracentesi. Affrontiamo ora le calcificazioni timpaniche a volte visibili dopo il posizionamento di drenaggi transtimpanici che favoriscono la timpanosclerosi, in una confusione deplorevole della terminologia.
Osteopatie
Certe patologie ossee possono avere una ripercussione sull’udito. La sordità si integra allora il più delle volte, in un corteo di sintomi più generali. Tuttavia, la lesione dell’orecchio può talvolta essere rivelatrice. Si ricorda a questo titolo:
1)il morbo di Lobstein (od osteogenesi imperfetta), la cui lesione petrosa si manifesta con delle ipodensità periplatinari e pericocleari; i sintomi principali della malattia sono deformità e fratture ossee;
2)la malattia di Paget: le lesioni interessano l’osso temporale e il cranio e provocano l’ispessimento degli ossicini;
3)la sifilide terziaria, la cui diagnosi può essere sospettata in presenza di alcune forme di otosclerosi cocleare alla TC.
4) Osteopetrosi – malattia di Albers-Schönberg,l’Osteopetrosi è una malattia ossea che rende le ossa anormalmente dense e incline alla rottura (frattura Analogie tra osteoporosi e otosclerosi sono stati notati, tra cui una simile associazione con il gene COL1A1.
5)Displasia Fibrosa La displasia fibrosa dell’osso è una malattia scheletrica benigna non ereditaria congenita, nella quale l’osso viene sostituito da un tessuto simil-fibroso con osteogenesi precoce. La prevalenza non è facilmente definibile, in quanto spesso la malattia causa lesioni asintomatiche.
 1)Malattia di Lobstein o osteogenesi imperfetta(s di von der Hoeve) Collegamento Tanzariello Categoria: Orecchio Interno Ed Alterazione Ossee
1)Malattia di Lobstein o osteogenesi imperfetta(s di von der Hoeve) Collegamento Tanzariello Categoria: Orecchio Interno Ed Alterazione Ossee
Fig. 68
Malattia ereditaria a trasmissione autosomica dominante, caratterizzata da una fragilità ossea («malattia delle ossa di vetro»), sclere blu e iperlassità dei legamenti. L’associazione con un’anchilosi stapedovestibolare è tipica della sindrome di Van der Hoeve: Clerc e Chevance hanno insistito sulle differenze istologiche tra l’otosclerosi propriamente detta e questa malattia. In alcuni casi si nota un importante coinvolgimento labirintico e un ispessimento platinario considerevole, fino al riempimento osseo della fossa ovale. L’intervento, inizialmemte, dà risultati equivalenti a quelli dell’otosclerosi (a parte il caso dove la fossa ovale è ostruita). La platina appare sottile e fissata in periferia, a volte, con una staffa sottile e atrofizzata. Il rischio di una platina galleggiante è più elevato.
E’ una patologia congenita ereditaria, caratterizzata da anomalie del tessuto collagene. Clinicamente si presenta con fragilità ossea, iperelasticità dei legamenti articolari e sclere di colore blu. Questa patologia può determinare una anchilosi stapedio-ovalare del tutto simile all’otosclerosi. La malattia è caratterizzata da focolai multipli di riassorbimento e neoapposizione ossea al livello della platina e del labirinto, come nelle forme evolutive di otosclerosi. L’ipoacusia dell’osteogenesi imperfecta compare per lo più nella seconda-terza decade di vita. L’ipoacusia può essere trasmissiva, mista o neurosensoriale. L’ipoacusia neurosensoriale dipende da microfratture, emorragie e presenza di tessuto vascolare e fibroso di riparazione all’interno ed intorno alla coclea. Dal punto di vista radiologico l’osteogenesi imperfecta dell’osso temporale e l’otosclerosi sono molto simili (Berrettini et al. 2001). I reperti dell’osteogenesi sono la presenza di osso demineralizzato ed ispessito che coinvolge la capsula otica, lo spessore dell’osso neoformato sembra essere maggiore rispetto all’otosclerosi, inoltre l’interessamento del labirinto osseo sembra essere più diffuso nell’osteogenesi, è caratteristico un coinvolgimento della capsula otica al di sopra del canale semicircolare superiore. L’anchilosi stapedio-ovalare della osteogenesi imperfetta ha indicazioni chirurgiche, per quanto i risultati sono in genere mediocri. Inoltre la chirurgia della sordità nell’osteogenesi imperfetta offre difficoltà tecniche perché la platina è friabile e rivestita da mocoperiostio spesso e molto vascolarizzato. 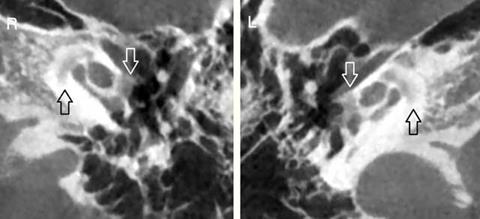
Fig 69.A:Una tomografia computerizzata a fascio conico ( CBCT ) è stato eseguito e rivelato una capsula otica demineralizzazione a livello della fissula antefenestral ( frecce bianche ) e l’area pericochlear ( frecce nere ) su entrambi i lati , suggestiva dell’otosclerosi bilaterale ( Figura A ) . Altri punti di riferimento anatomici dell’orecchio esterno, medio ed interno erano normali . Questi risultati sono in linea con una osteogenesi imperfetta(OI) tipo I che coinvolge nell’osso temporale .
|
|
|
Fig 69 B.Osteogenesi Imperfetta Congenita : Orecchio medio
2)Malattia di Paget Fig. 70 Collegamento Tanzariello Categoria: Orecchio Interno Ed Alterazione Ossee
Si può accompagnare ad anchilosi stapedovestibolare per modificazioni fibrotiche e ossee del legamento ossiculare. Può provocare anche una fissazione del martello e dell’incudine nell’epitimpano con delle spicole ossee. In genere, la lesione temporale non è mai isolata e la diagnosi è rapidamente sospettata dalle suggestive immagini radiografiche. Tuttavia, l’anchilosi può essere isolata, rendendo difficile il riconoscimento della malattia. In questa forma, bisognerà porre attenzione, sulla possibilità di una sordità mista con interessamento del labirinto, restringimento e stiramento del condotto uditivo interno.

 4)Osteopetrosi – malattia di Albers-Schönberg Collegamento Tanzariello Categoria: Orecchio Interno Ed Alterazione Ossee Fig. 71.a.b
4)Osteopetrosi – malattia di Albers-Schönberg Collegamento Tanzariello Categoria: Orecchio Interno Ed Alterazione Ossee Fig. 71.a.b
|
|
|
Osteopetrosi è una malattia ereditaria caratterizzata dalla sclerosi ossea. Una delle caratteristiche più predominante della malattia nell’osso temporale è la perdita dell’udito conduttivo a causa della formazione ossea anomala nell’orecchio medio e di otite media.
5)Displasia Fibrosa
|
|
|
Fig.72.a.b:Displasia fibrosa, rocca petrosa destra. Tomografia computerizzata (TC) viste assiali (A, B). Formazione ossea a «vetro smerigliato», sviluppata a partire dalla pars squamosa dell’osso temporale, che riempie l’epitimpano e l’antro responsabile di un’anchilosi dell’incudine a livello della fossa dell’incudine.
La displasia fibrosa è caratterizzata da un rimontaggio progressivo degli elementi normali dell’osso dal tessuto fibroso. È veduto nelle due prime decadi di vita ed ugualmente si distribuisce rispetto al sesso dei pazienti. L’osso temporale è coinvolto in 18% dei casi. La displasia fibrosa dell’osso temporale è manifestata più conunemente nel canale uditivo esterno (80%) e l’orecchio interno e medio può anche essere implicato. Le alterazioni Sarcomatous sono rare. La diagnosi è basata sulle immagini radiologiche. La stenosi del condotto uditivo esterno è una sequela frequente della displasia fibrosa dell’osso temporale e si associa spesso a un colesteatoma del condotto. È anche classica un’estensione alla catena degli ossicini con fissazione. Una sordità di trasmissione è dunque una manifestazione comune in questi pazienti. Una sordità di percezione, più rara, può essere secondaria a un’estensione delle lesioni all’osso labirintico con possibilità di fistole, soprattutto nelle forme cistiche, o a una stenosi del condotto uditivo interno.
Anchilosi ossiculare non platinaria
Si tratta di una scoperta operatoria al di fuori di uno studio tomografico che, come abbiamo detto, non può essere eseguita sistematicamente. Guilford [41] ha descritto la fissazione isolata della testa del martello o associata a otosclerosi. Goodhill [36] ha descritto, anche, la fissazione della testa del martello associata a quella del corpo dell’incudine. La presenza di queste patologie deve sottolineare la necessità di un esame accurato di tutti i movimenti della catena ossiculare in sede intraoperatoria con particolare attenzione alla fissazione della platina, ma anche della mobilità incudomalleare. La mobilizzazione chirurgica della testa del martello può essere seguita da una nuova anchilosi che annulla il risultato uditivo soddisfacente, a testimonianza del grado evolutivo del processo patologico.fig.73a-b
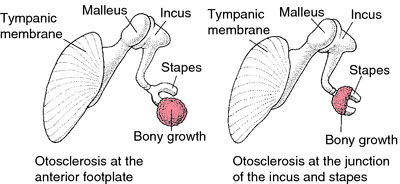
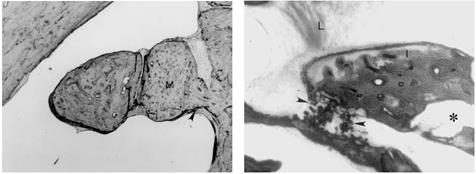
|
Fig.73a: L’anchilosi anteriore della testa dell’incudine può essere congenita |
Fig.73-b: La fissazione del processo corto dell’incudine(i)può esseredalla calcificazione del suo ligamento). *cellule aeree nell’incudine L ligamento normale |
TRATTAMENTO
Le modalità terapeutiche sono di tre tipi: trattamento medico, trattamento chirurgico e dispositivi protesici.
Trattamento medico
Fluoruro di sodio
Il NaF (fluoruro di sodio) è utilizzato nel trattamento dell’otosclerosi da più di 30 anni. Gli studi eseguiti per comprendere i suoi effetti sul metabolismo osseo sono numerosi. Da una parte, il NaF determinerebbe, nel ratto, una ricalcificazione dell’osso, per aumento dell’assorbimento intestinale di calcio e una riduzione di quello osseo da parte degli osteoclasti [69]. Il cristallo di fluoroapatite formato sarebbe più resistente all’assorbimento osteoclastico rispetto a quello di idrossiapatite. Dall’altra parte, il NaF avrebbe un effetto antienzimatico [16], il cui ruolo nella patogenesi di questa malattia è stato stabilito precedentemente. Ma attualmente è difficile confermare l’efficacia di tale trattamento. La stessa patogenesi della malattia è poco conosciuta e le conseguenze degli effetti del NaF su alcuni meccanismi enzimatici sono difficili da valutare. Gli studi clinici sono poco numerosi e i follow-up a breve termine. Le dosi del farmaco attualmente suggerite sono molto variabili e vanno da 2 a 40 mg/die. Questo tipo di trattamento è spesso utilizzato da alcuni, mai da altri, e in modo sistematico da altri ancora. Anche Wayoff [98] ha riconosciuto il possibile ruolo di questo trattamento quando non viene praticato quello chirurgico, o nelle forme di otosclerosi molto attiva prima o dopo il trattamento chirurgico. Per Forquer [30] le forme di otosclerosi in fase attiva, con interessamento cocleare, acufeni e macchia di Schwartze rispondono meglio a questo trattamento.
Difosfonati Fig.74
 Questi farmaci sono utilizzati da molto tempo nel trattamento della malattia di Paget. Le analogie fisiopatologiche tra queste due affezioni hanno spinto a utilizzarli nell’otosclerosi. I difosfonati bloccano la trasformazione dei precursori degli osteoclasti e hanno anche un’attività antiinfiammatoria [34]. Questo trattamento è, però, controverso. Nei pazienti in trattamento con difosfonati sono stati descritti dei casi di sordità improvvise profonde (addirittura cofosi) e irreversibili [8].
Questi farmaci sono utilizzati da molto tempo nel trattamento della malattia di Paget. Le analogie fisiopatologiche tra queste due affezioni hanno spinto a utilizzarli nell’otosclerosi. I difosfonati bloccano la trasformazione dei precursori degli osteoclasti e hanno anche un’attività antiinfiammatoria [34]. Questo trattamento è, però, controverso. Nei pazienti in trattamento con difosfonati sono stati descritti dei casi di sordità improvvise profonde (addirittura cofosi) e irreversibili [8].
Calcitonina
Uno studio spagnolo [58 Lacosta Nicolás J.L., Sánchez del Hoyo A., García Cano J. Possible benefits of calcitonin in the treatment of otosclerosis Acta Otorrinolaringol. Esp. 2003 ; 54 : 169-172 ] recente ha affermato un possibile beneficio della calcitonina somministrata per via intranasale in aerosol. In effetti, la calcitonina inibisce il riassorbimento osseo dovuto agli osteoclasti e favorisce la ricostruzione di un osso normale da parte degli osteoblasti. Un miglioramento uditivo era constatato in circa il 20% dei pazienti, mentre il 25% segnalava una diminuzione o una scomparsa degli acufeni. Infine, quasi il 10% dei soggetti riferiva cefalee iatrogene. Ancora una volta, questi risultati devono essere ponderati di fronte alla rarità degli studi su questo soggetto e al modesto numero di pazienti inclusi.
Altri trattamenti
Sono stati descritti altri trattamenti: vasodilatatori, ecc. La loro efficacia è molto controversa. Si spera che una migliore conoscenza dei meccanismi fisiopatologici implicati nell’otosclerosi porti un giorno a un trattamento medico efficace e universalmente riconosciuto.
Trattamento chirurgico
Trattamento chirurgico dell’otosclerosi
L’approccio chirurgico rappresenta indiscutibilmente quello di scelta nel trattamento dell’otosclerosi, ma bisogna rispettare dei principi basilari.
Motivazioni dell’intervento
Si basano sull’handicap sociale tollerato dal paziente e sulla speranza di un sostanziale miglioramento postchirurgico.
In pratica, l’intervento deve essere preso in considerazione solo per le sordità uguali o superiori ai 30 dB e con un Rinne di quest’ordine, sempre che esista la possibilità di un recupero della conduzione ossea (effetto Carhart). La presenza di un Lewis negativo è un elemento prognostico favorevole all’intervento.
Un’importante labirintizzazione non costituisce una controindicazione formale. Molti Autori hanno insistito sulla possibilità di miglioramenti straordinari dell’udito, in questi casi, [32], e soprattutto sul miglioramento ottenuto rispetto agli apparecchi complementari.
Possibilità d’intervento
• Sono da escludere totalmente gli interventi chirurgici in pazienti con un solo orecchio funzionale. Per quanto minimo, il rischio di cofosi, in questo caso, non può essere accettabile, e non potrebbe essere giustificato da un punto di vista medico-legale. Ciò implica una grande precisione nell’esecuzione dell’audiogramma, eliminando ogni rischio di curve fantasma.
• In caso di insuccesso del primo intervento che porta al ripristino della trasmissione, sembra logico, quando è necessario o possibile, intervenire prima sull’orecchio non operato e non tentare un nuovo intervento se non dopo essersi assicurati del successo duraturo ottenuto sull’orecchio controlaterale. I reinterventi soggetti a maggiori rischi e a insuccesso assoluto (cofosi o importante diminuzione della conduzione ossea, che non può essere protesizzata) non permetterebbero più di intervenire sull’altro orecchio.
• Al di là delle condizioni audiometriche, bisogna sempre prendere in considerazione le controindicazioni generali (età avanzata del paziente, disturbi della coagulazione, malattie concomitanti). Bisogna considerare l’impossibilità a instaurare un’ipotensione controllata, tanto per le indicazioni, quanto per la scelta dell’anestesia. In questi casi va preferita un’anestesia locale, se le condizioni lo permettono (condizioni psicologiche).
Autorizzazione all’intervento
 Consiste nell’ottenere il consenso informato dal paziente, di cui parleremo più avanti. Il paziente deve essere perfettamente informato delle conseguenze e dei rischi dell’intervento, ma anche dei vantaggi e dei risultati positivi solitamente ottenuti. Non ha senso preoccuparlo inutilmente, soprattutto se si ha un’esperienza personale sufficiente che non lo giustifichi. Esporre i rischi, sottolinearne la gravità (cofosi), ma anche relativizzarne la frequenza, queste sono le regole da seguire. Il paziente deve decidere e scegliere tra intervento chirurgico e protesi acustica con cognizione di causa.
Consiste nell’ottenere il consenso informato dal paziente, di cui parleremo più avanti. Il paziente deve essere perfettamente informato delle conseguenze e dei rischi dell’intervento, ma anche dei vantaggi e dei risultati positivi solitamente ottenuti. Non ha senso preoccuparlo inutilmente, soprattutto se si ha un’esperienza personale sufficiente che non lo giustifichi. Esporre i rischi, sottolinearne la gravità (cofosi), ma anche relativizzarne la frequenza, queste sono le regole da seguire. Il paziente deve decidere e scegliere tra intervento chirurgico e protesi acustica con cognizione di causa.
Esame preoperatorio e anestesia Fig. 69
Alcuni Autori privilegiano l’anestesia locale da sola o potenziata e sottolineano i vantaggi di un intervento poco traumatico e con un ottimo controllo dell’emostasi. La cooperazione del paziente e la grande esperienza dell’operatore sono tuttavia delle condizioni essenziali per la riuscita dell’intervento stesso.
Molti, tuttavia, preferiscono ricorrere all’anestesia generale e utilizzano spesso tecniche di ipotensione controllata.
In ogni caso, è necessaria una valutazione preoperatoria per studiare la funzione cardiaca e renale (specialmente se bisogna praticare una ipotensione controllata) e l’emostasi (tempi di cefalina-caolino, valore di protrombina, tempo di sanguinamento).
Scelta della tecnica operatoria
Essa dipende essenzialmente dalle abitudini e dall’esperienza dell’operatore, Ma, nonostante ciò, ci sono alcuni punti universalmente accettati. La fenestrazione con i suoi risultati incompleti, gli svantaggi (cavità svuotata, vertigini, ecc.) non ha più alcun diritto di essere menzionata. La mobilizzazione semplice della staffa può essere applicata solo a qualche caso eccezionale, quando la platina si mobilizza spontaneamente prima di ogni azione sulla crura della staffa, durante la verifica iniziale indispensabile del blocco stapediale. Tuttavia, non deve essere dimenticata, anche se si sa che la staffa si rifisserà nuovamente. Essa ha il pregio di essere priva di rischi.
In realtà la discussione si pone su tre punti:
• la scelta della via di accesso,
• l’intervento sulla platina: platinectomia o platinotomia,
• la scelta del sistema di trasmissione.
Scelta della via di accesso
Si può scegliere tra la via del condotto o via transmeatale e la via endauricolare come via minima (via di Shambaugh).
La prima ha il vantaggio di adattarsi bene alle tecniche di anestesia locale, avere un basso rischio di sanguinamento, non lasciare alcuna cicatrice visibile. Gli svantaggi sono rappresentati dal fatto che si tratta di una via stretta attraverso uno speculum che limita l’uso contemporaneo dell’aspirazione e dei vari strumenti chirurgici e dalle difficoltà in caso di un condotto stretto, da complicanze maggiori, o dalle anomalie anatomiche.
La seconda tecnica permette un’esposizione più ampia del campo operatorio, con possibilità di estensione (in particolare in avanti in caso di spina timpanica sporgente); essa permette all’operatore di utilizzare liberamente le due mani. Tuttavia alcuni autori criticano il prolungamento del tempo chirurgico (che viene compensato se si utilizza un’interposizione aponeurotica; l’aponeurosi è prelevata nella parte alta dell’incisione), la maggiore difficoltà nell’emostasi e, in particolare, una minore adattabilità all’anestesia locale.
Dettagli intraoperatorie
Procedure primarie possono essere eseguite in anestesia generale o locale con sedazione. [12] L’approccio transcanalare è quasi sempre utilizzato.
Un lembo tympanomeatal viene sollevato lungo il canale uditivo esterno posteriore.Gli ossicini vengono immediatamente identificati e palpazione per verificare il movimento. La palpazione del martello dovrebbe suscitare il movimento fino al giunto incudostapedial. Palpazione del processo lenticolare dell’incudine indica fissaggio della sovrastruttura staffa. palpazione delicata impedisce una immobilizzazione involontario della staffa. Vedere le immagini qui sotto.
Tecnica operatoria EMC
Trattamento chirurgico dell’otosclerosi. Aspetti tecnici e medicolegali[46-050] – Doi : 10.1016/S1292-3036(10)58286-5
P. Bonfils
Posizionamento del paziente e del chirurgo
Il paziente è posizionato in decubito dorsale. Una leggera inclinazione proclive del lettino permette di ridurre la pressione venosa cefalica e, quindi, il sanguinamento nel campo operatorio. La testa è,a seconda dei chirurghi, o lasciata libera o posta su un poggiatesta per limitare la sua mobilità o immobilizzata con l’aiuto di un cerotto. Ogni cambiamento di posizione della testa richiede un basculamento del tavolo operatorio.
Il chirurgo deve essere posto sul lato dell’orecchio da operare, comodamente seduto su una sede di cui si possa facilmente regolare l’altezza con un pedale. Le ginocchia devono poter essere poste comodamente sotto il tavolo operatorio. Il braccio del microscopio è, al bisogno, spostato durante l’intervento al fine di avere sempre un’eccellente visione sulla zona di intervento. Un’aspirazione, la cui intensità può essere controllata da un pedale, può risultare utile. Questa chirurgia descritta qui con il termine «chirurgia dell’otosclerosi» è applicabile anche per il trattamento chirurgico di altre anchilosi stapedovestibolari non otosclerotiche. Il primo tempo chirurgico (la via d’accesso) è realizzato a piccolo ingrandimento.
Tecnica operatoria [7, 13, 20, 21]
Via di accesso
Incisione
Sono stati descritti due tipi di incisione: la via del meato, o via transmeatale, e la via endoaurale minima, o via di Shambaugh.
Via del meato (Fig. 75 ). Si esegue un’infiltrazione con una soluzione adrenalinata (tipo lidocaina adrelinata) nel quadrante posterosuperiore del meato acustico esterno, alla giunzione tra meato osseo e cartilagineo. Si esegue una sola puntura; l’infiltrazione (2-4 ml), molto lenta, permette lo scollamento, sotto il controllo della vista, dell’insieme della parete posterosuperiore del meato acustico fino al solco.
|
|
|
|
|
Il timpano è esposto attraverso uno speculum di grandezza adeguata al meato acustico esterno. Alcuni chirurghi utilizzano un porta-speculum autostatico che permette di avere entrambe le mani libere. L’incisione cutanea è eseguita con l’aiuto del bisturi curvo, tipo bisturi di Rosen, arrivando direttamente all’osso, a 7 mm circa dal solco, seguendo la curvatura del solco al fine di restare sempre alla stessa distanza da quest’ultimo. La distanza tra l’incisione e il solco non deve essere troppo breve, per poter ricoprire correttamente con il lembo la zona della resezione ossea effettuata successivamente. Questa incisione è eseguita da h 6 a h 12, realizzando un arco di circa 180°.
Il lembo è scollato fino all’anulus, iniziando con la porzione posterosuperiore, la cui cute è più spessa, evitando di aspirare sul lembo per non lacerarlo.
Il vantaggio di questa via è la sua semplicità. Essa è molto adatta all’anestesia locale; può essere limitata in caso di meato acustico esterno stretto.
Via endoaurale minima (Fig. 76 ). La via endoaurale minima di Shambaugh comporta due parti: una parte intrameatale simile alla via del meato e una controincisione extrameatale, interelico-trago, fino al bordo inferiore del muscolo auricolare anteriore.
|
|
|
|
Fig. 71 A-B-C :
Via endoaurale minima (A-C).
A. Tracciato delle incisioni;
B. Incisione cutanea;
C. Esposizione del condotto uditivo esterno.
|
|
Fig. 76 D. Viene sollevato il timpano per entrare nella cassa del timpano |
|
|
Fig. 76 E: Il timpano è stato sollevato con un’incisione nel canale auricolare . La cavità dell’orecchio medio viene visualizzato . Il Martello (punta di freccia nera ) , incudine ( freccia nera ) , e staffa ( freccia bianca ) si vedono chiaramente . Queste tre ossa compongono la catena dei 3ossicini dell’orecchio medio che permettono di condurre il suono nell’orecchio interno . Il nervo della corda del timpano , uno dei nervi del gusto , si vede al di sopra della incudine e appena sotto l’osso martello . |
Il vantaggio di questa via è di poter posizionare un divaricatore autostatico e di liberare le due mani dell’operatore, di prelevare un frammento di aponeurosi del muscolo atriale anteriore (al fine di chiudere l’apertura della platina) e di ottenere una visione più ampia del campo operatorio, in particolare in caso di spina timpanica anteriore troppo sporgente. In caso di condotto stretto, si ha l’interesse a iniziare l’intervento con il segmento verticale interelico-trago. In caso di stenosi congenita o acquisita del meato acustico esterno osseo è a volte necessario allargare in uno o due tempi questo meato prima di eseguire la chirurgia stapedia. Quando un frammento di aponeurosi del muscolo atriale anteriore è stato prelevato, esso viene liberato del suo grasso, assottigliato e asciugato. In assenza di via di accesso endoaurale minimale e se è necessario un innesto di chiusura della finestra del vestibolo, si deve prelevare all’inizio dell’intervento un frammento di vena del dorso della mano. L’endovena è posta in direzione della cassa del timpano.
Apertura della cassa del timpano ( Fig. 77)
Il lembo timpanomeatale è ribaltato in avanti dopo averlo disinserito dal solco. Si deve aver cura di non ledere la corda del timpano durante questo atto. Questo tempo beneficia di un ingrandimento operatorio più elevato (× 10). Lo scollamento del lembo deve permettere di visionare il collo del martello in avanti e la finestra della coclea.
La corda del timpano è scollata a sua volta. La sua liberazione può essere delicata, in particolare quando essa è incassata in un canale osseo più o meno completo. La sua mobilizzazione è eseguita dall’avanti all’indietro con cautela, al fine di non lederla.
|
|
|
Fig. 77.A-B :
Apertura della cassa del timpano (A, B).
A. Distacco della corda del timpano dopo l’apertura della cassa;
B. Incisura di Rosen.
È allora necessario realizzare un’incisura ossea (detta «incisura di Rosen») nella parte posteriore del muro della loggetta, tra il punto di emergenza della corda del timpano posteriormente e il collo del martello anteriormente. Questa incisura è eseguita con microcurette. Il movimento va dalla profondità verso la superficie, il che evita di traumatizzare la catena degli ossicini, altrimenti a rischio. Alcuni preferiscono eseguire questa incisura con fresa diamantata o con una sgorbia; un’attenzione tutta particolare è prestata agli ossicini sottostanti. In caso di timore di problema tubarico concomitante, si ricostruisce questa incisura alla fine
dell’intervento con un frammento cartilagineo. Negli altri casi l’incisura non è ricostruita. L’incisura è realizzata fino a esporre correttamente il canale facciale nella sua seconda parte superiormente e la piramide posteriormente. L’inclinazione della testa del soggetto in iperestensione e verso l’operatore permette di migliorare la visione sulla regione della finestra del vestibolo.
Una volta completamente esposta la regione della finestra del vestibolo, è a volte necessario liberare alcune fibre che mascherano la base della staffa con l’aiuto di una punta. La mobilità della catena è valutata delicatamente, per non traumatizzare l’orecchio interno e per non provocare una lussazione della catena ossiculare. Inoltre, questa esplorazione della mobilità della catena può sembrare, ad oggi, accessoria, poiché la realizzazione sistematica di un esame TC preoperatorio deve aver confermato l’esistenza di un focolaio otosclerotico. Il suo unico interesse è di poter individuare delle rare associazioni di un focolaio otosclerotico con una fissazione dell’incudine o del martello. La mobilizzazione del ramo lungo dell’incudine permette di constatare la fissità della staffa.
Preparazione della staffa
È possibile misurare la distanza che separa l’apofisi lunga dell’incudine e la base della staffa con l’aiuto di un misuratore. L’altezza usuale del fusto del pistone è di 4,5 mm. Esso può così essere posto contro la base della staffa e poi essere accorciato, se necessario, in funzione dei rilievi intraoperatori.
Al fine di limitare il sanguinamento intorno alla regione della finestra del vestibolo, alcuni chirurghi realizzano un’elettrocoagulazione con punta coagulante della mucosa sulla metà inferiore della periferia della fossa della finestra del vestibolo. L’intensità della coagulazione deve essere bassa e provata precedentemente su una regione meno vulnerabile (come sulla cute del meato). Si può anche realizzare un’emostasi per compressione con un frammento di garza inzuppato di adrenalina a 1/1 000o.
L’accesso alla regione della finestra del vestibolo può essere limitato da una procidenza del canale facciale oppure, in alcuni casi dove il canale facciale è assente, da un’ernia del nervo facciale nella sua seconda porzione. In caso di procidenza molto marcata si deve, a volte, interrompere l’intervento.
Procedura sulla staffa
Le procedure eseguite sulla staffa possono essere di due tipi: o la realizzazione di una platinectomia, parziale o totale, o la realizzazione di una platinotomia. I vantaggi e gli svantaggi della platinectomia e della platinotomia calibrata sono stati affermati, spesso con vigore, dai sostenitori di ciascuna tecnica. La platinectomia è, a volte, la sola tecnica possibile in presenza di una base della staffa ancora sottile, che si fratturerebbe a stella durante la realizzazione della platinotomia. La platinotomia calibrata è, a volte, la sola tecnica possibile in presenza di una base della staffa molto spessa. La tecnica migliore è probabilmente quella che l’operatore «padroneggia» meglio, potendosi adattare alle particolarità di ciascun caso.
Platinectomia (Fig. 73)
Prima di ogni procedura sulla platina, è opportuno realizzare un foro nella base della staffa, detto «foro di sicurezza», per poter agganciare i frammenti della platina se la base della staffa diviene flottante. Il foro (o platinofissura) è realizzato con una punta, un laser o una fresa diamantata di piccolo diametro. La sezione del tendine del muscolo stapedio è eseguita con le microforbici rette, a volte, in caso di accesso difficile, con microuncino o con laser. Alcuni autori preferiscono conservare il tendine per preservare la vascolarizzazione dell’incudine. Questo atteggiamento impone di rispettare la testa della staffa. Il rispetto di questo tendine allo scopo di conservare il riflesso stapedio per proteggere l’orecchio interno dai traumi sonori non è documentato.
|
|
|
|
|
|
|
|
|
|
|
|
Figura Fig. 78 : Platinectomia (A-G). Fig. 78 A. Foro di sicurezza al centro della platina; Fig. 78 B. Sezione del tendine del muscolo stapedio; Fig. 78 C. Disarticolazione incudostapedia; Fig. 78 D. Platinectomia posteriore; Fig. 78 E. Rimozione del frammento anteriore; Fig. 78 F, G. Posizionamento dell’innesto.
|
||
|
|
Fig. 78 H, Una volta evidenziata la fissità della staffa si procede a sezione del tendine stapediale e disgiunzione incudostapediale |
||
|
|
Fig. 78 I. Una volta evidenziata la fissità della staffa si procede a sezione del tendine stapediale e disgiunzione incudostapediale CHIRURGIA TRSDIZIONALE |
||
|
|
Fig. 78.L Il tendine dello stapedio , che è collegato alla staffa , viene vaporizzato con il laser CO2 ( freccia nera ) . |
||
|
|
78.L foro nell’orecchio interno ( stapedectomia ) attraverso la platina della staffa che è pronto per essere coperto con tessuti molli. |
||
|
|
78.M Ecco che il tessuto molle ( fascia aerolare del muscolo retroauricolare ) viene posizionato in atto . |
||
La disarticolazione incudostapedia è eseguita delicatamente, con un uncino abbastanza lungo, evitando una mobilizzazione intempestiva dell’incudine per non provocare una disarticolazione incudomalleolare. Alcuni autori preferiscono sezionare i due rami della staffa con delle microforbici curve.
Prima dell’apertura del labirinto l’emostasi deve essere perfetta. Il trapianto deve essere pronto all’uso. Se si esegue una platinectomia totale, la staffa è lentamente inclinata, con un movimento di «va e vieni», dall’alto in basso e dal basso in alto, al fine di dissociare la platina dalla finestra del vestibolo. La platinectomia, parziale o totale, è eseguita con un microuncino, evitando di introdurre lo strumento nel labirinto. L’exeresi è dolce e prudente. È opportuno non aspirare nella finestra del vestibolo, né sul suo contorno, al fine di evitare ogni traumatismo endolabirintico. Quando è realizzata una platinectomia parziale, viene rimossa la metà posteriore della platina. È indispensabile un’interposizione.
Una volta rimosse la platina e la staffa, la finestra è chiusa con il tessuto scelto dall’operatore: vena prelevata al dorso della mano, frammento di aponeurosi muscolare e frammento del pericondrio. Il ribaltamento dell’innesto permette di verificare che esso sia indenne da ogni detrito osseo. L’innesto deve coprire tutta la finestra, appoggiarsi sul canale facciale e debordare dalla finestra in modo non eccessivo. Esso è applicato con una punta. Un innesto troppo grande fa alcune pieghe, facilitando la persistenza di una fistola labirintica.
Platinotomia ( Fig. 74)
La platinotomia è eseguita o con l’aiuto di microperforatori di diametro crescente (da 0,3 a 0,6 mm di diametro) o con laser o alla fresa diamantata, a basse velocità, al fine di evitare un trauma sonoro. Il diametro della platinotomia deve essere leggermente superiore al diametro del pistone. Per un pistone del diametro di 0,5 mm, la platinotomia deve avere un diametro di 0,6 mm.
|
|
Fig. 79 : Platinotomia |
|
|
|
Fig. 79 B La finestra ovale con la platina della staffa è magnificata endoscopicamente |
|
|
|
Fig. 79 C Mediante una microfresa viene praticato un foro (platinotomia) sulla platina della staffa |
|
|
|
Platinotomia manuale. Un set di quattro perforatrici manuali (0,3, 0,4, 0,5 e 0,6 mm di diametro. Fig. 79 D viene utilizzato per creare l’apertura per la stapedotomia. I perforatori vengono ruotate avanti e indietro tra il pollice e l’indice. La, punta di ogni perforatore è solo parzialmente introdotto nel vestibolo. La corretta dimensione dell’apertura (0,5 mm) è confermata con un calibratore di 0,4 millimetri pinza . La protesi staffa viene prelevato dal blocco di taglio utilizzando grandi pinze a coccodrillo dritte e liscie (Fig. 79 E). Il pistone è subito spostata sopra la platina della staffa e allineato con il processo lungo dell’incudine. La lunghezza del protesi è corretto se l’anello del pistone supera la superficie laterale te dell’incudine di 0,5 mm (Fig. 79 F).
|
|
|
|
|
Fig. 79 E Ugo Fish |
Fig. 79 F |
Fig. 79 G |
Se la protesi è di lunghezza corretta, viene spostato sopra l’apertura della stapedotomia con un gancio di 1,0 mm e di 45° e fatto penetrare delicatamente nel vestibolo (Fig. 49 F). Il ciclo viene poi crimpato sul incudine con un piccolo alligatore a pinze diritte e lisce (Fig. 49 G).
La platinotomia calibrata è, talvolta, associata al posizionamento di un’interposizione, che limita il rischio di fistola labirintica postoperatoria. Il calibro della platinotomia deve essere superiore a quello previsto in assenza di un’interposizione. L’innesto aponeurotico deve essere molto sottile.
I gesti di disarticolazione, di sezione del tendine del muscolo stapedio e di resezione della sovrastruttura sono identici a quelli praticati durante la realizzazione di una platinectomia.
Particolarità del laser
L’utilizzo del laser nella chirurgia dell’otosclerosi si è sviluppato da una decina di anni. Il suo uso non è più discusso, ma il suo costo non è trascurabile. Il laser può essere utilizzato per la sezione del tendine del muscolo stapedio, la sezione dei rami della staffa e la realizzazione della platinotomia. Il laser CO2 può essere utilizzato su un labirinto aperto a condizione che quest’ultimo sia riempito di liquido perilinfatico. In effetti, l’energia del laser è immediatamente assorbita dal liquido perilinfatico [13].
Si possono utilizzare dei laser montati sul microscopio e il cui tiro è diretto con un micromanipolatore come il laser CO2 e il laser Erbium. Si possono anche utilizzare dei laser facilmente veicolati da una fibra ottica come il laser Argon (blu verde) e il laser KTP (verde).
Ricostruzione dell’effetto columellare (Fig. 80)
La maggior parte degli autori utilizza una protesi per ristabilire l’effetto columellare. È stato descritto l’utilizzo dei rami della staffa per ristabilire l’effetto columellare.
|
|
|
|
|
|
|
|
Fig. 80 :
Ricostruzione dell’effetto columellare (A-F).
Quando si utilizza un pistone in Teflon® o titanio è opportuno dilatare delicatamente l’anello con una punta e, quindi, posizionare il pistone nel campo operatorio con una micropinza. L’estremità del fusto è posta nella finestra del vestibolo o nella platinotomia, mentre l’anello aperto è chiuso sul ramo discendente dell’incudine. Non è utile chiuderlo sull’incudine, poiché l’elasticità del teflon permette spontaneamente la chiusura dell’anello. Esistono dei pistoni di vario diametro, da 0,4 a 0,8 mm di diametro, e da 3,5 a 6 mm di lunghezza. La lunghezza standard è di 4,5 mm (platinectomia) o di 5 mm (platinotomia).
|
|
Fig. 80 G una protesi viene inserita attraverso la comunicazione creata e agganciata all’incudine |
Fig. 75 G. Posizionamento di un pistone in Teflon® standard;
|
|
Fig. 80.H. Il pistone è predisposta per l’inserimento nell’apertura della platina staffa orecchio interno . Questo pistone ha una lunghezza 4,25 mm ( meno della metà di centimetro ! ) e una larghezza di 0,5 mm . |
|
|
Fig. 80.I. . Un apertura è stato creato nell’orecchio interno ( freccia nera ) per consentire il posizionamento della protesi . Il fluido dell’orecchio interno è chiaramente visualizzato attraverso l’apertura . |
|
|
Fig. 80.L. Il gancio del pistone è posizionato sopra l’ incudine ed alla base dell’ orecchio interno , ricreando il meccanismo uditivo . Il gancio sarà crimpato sopra l’osso incudine . Ora , quandi il timpano si muove con il suono , il pistone si muove effettivamente e leggermente dentro e fuori alll’orecchio interno e permette all’individuo di ascoltare . |
Fig. 75 H, I, L. Posizionamento di un pistone in Titanio;
Quando si utilizza un pistone cup, esso va posizionato delicatamente nella finestra del vestibolo. La cupola è posta sotto l’estremità inferiore del ramo discendente dell’incudine e l’anello è portato al di sopra di questo ramo. Il vantaggio del pistone cup è di non doversi appoggiare sull’incudine per posizionare la protesi. Il pistone standard misura 4,5 mm di lunghezza e 0,8 mm di diametro.
Se la protesi cade nell’ipotimpano, essa è recuperata, se questa manovra può essere effettuata facilmente e in modo atraumatico. In caso contrario, la protesi è abbandonata nella cassa del timpano.
Non è utile verificare il buon funzionamento del montaggio poggiando sul pistone e ricercando un movimento della finestra della coclea. Questa manovra può essere traumatizzante e la sua positività è incostante.
Fig. 75 M,N. Posizionamento di un piston cup.
|
|
Fig. 80 M. Questa immagine illustra la piccola dimensione di una protesi piston cup per lastaffa . |
|
|
Fig. 80 N. Il piston cup è ora posizionato .
|
Quando si utilizza un pistone cup, esso va posizionato delicatamente nella finestra del vestibolo. La cupola è posta sotto l’estremità inferiore del ramo discendente dell’incudine e l’anello è portato al di sopra di questo ramo. Il vantaggio del pistone cup è di non doversi appoggiare sull’incudine per posizionare la protesi. Il pistone standard misura 4,5 mm di lunghezza e 0,8 mm di diametro.
Se la protesi cade nell’ipotimpano, essa è recuperata, se questa manovra può essere effettuata facilmente e in modo atraumatico. In caso contrario, la protesi è abbandonata nella cassa del timpano.
Non è utile verificare il buon funzionamento del montaggio poggiando sul pistone e ricercando un movimento della finestra della coclea. Questa manovra può essere traumatizzante e la sua positività è incostante.
Chiusura, medicazione e cure postoperatorie (Fig. 81)
Il lembo timpanomeatale è riposizionato in sede. Si deve verificare l’assenza di una perforazione della membrana timpanica. Un tampone otologico è posto nel meato acustico esterno al fine di mantenere a contatto il lembo cutaneo. Si deve evitare di porre sulla medicazione un antibiotico ototossico. La terapia antibiotica postoperatoria non è sistematica; essa è discussa in letteratura.
|
|
|
Fig. 81.. Dopo che la membrana timpanica viene riposizionata al suo posto nel condotto uditivo si sigilla con il sangue e crema antibiotica ,non ototossica, che protegge il condotto uditivo dalle infezioni.
In assenza di vertigini, il paziente può essere dimesso il giorno dopo l’intervento. L’intervento è realizzato da alcuni in chirurgia ambulatoriale. La rimozione del tampone è generalmente effettuata al termine della prima settimana. L’audiogramma di controllo non è, generalmente, realizzato prima di 1 mese. È prudente consigliare al paziente di evitare di starnutire o di soffiarsi con forza il naso.
Per saperne di più
http://www.orl-france.org/portail_orl/college/otospongi ose.htm.
Uno studio condotto da Vincent et al ha indicato che stapedotomia può essere sicuro ed efficace eseguita nei bambini con otosclerosi giovanile. Lo studio ha incluso 34 pazienti pediatrici con otosclerosi (41 stapedotomies primaria totale), con la chiusura del gap aria osso postoperatorio essere 10 dB o meno nel 93% dei pazienti ed entro 20 dB nel 98% dei pazienti. [13]
STAPEDOTOMIA TRADIZIONALE
|
|
Fig.82. A. Viene sollevato il timpano per entrare nella cassa del timpano |
|
|
Fig. 82. B. La staffa viene identificata endoscopicamente e valutata |
|
|
Fig. 82.C. Una volta evidenziata la fissità della staffa si procede a sezione del tendine stapediale e disgiunzione incudostapediale |
|
|
Fig.82 D. la sovrastruttura della staffa si rimuove evidenziando la finestra ovale |
|
|
Fig. 82 E La finestra ovale con la platina della staffa è magnificata endoscopicamente |
|
|
Fig. 82 F Mediante una microfresa viene praticato un foro (platinotomia) sulla platina della staffa |
|
|
Fig. 82 G Una protesi viene inserita attraverso la comunicazione creata e agganciata all’incudine
|
STAPEDOTOMIA CON LASER CO2
|
|
|
Fig.83. Il timpano è stato sollevato con un’incisione nel canale auricolare . La cavità dell’orecchio medio viene visualizzato . Il Martello (punta di freccia nera ) , incudine ( freccia nera ) , e staffa ( freccia bianca ) si vedono chiaramente . Queste tre ossa compongono la catena dei 3ossicini dell’orecchio medio che permettono di condurre il suono nell’orecchio interno . Il nervo della corda del timpano , uno dei nervi del gusto , si vede al di sopra della incudine e appena sotto l’osso martello .
|
|
|
|
Fig.84. Il tendine dello stapedio , che è collegato allastaffa , viene vaporizzato con il laser CO2 ( freccia nera ) . |
|
|
|
Fig. 85. l pistone è predisposta per l’inserimento nell’apertura della platina staffa orecchio interno . Questo pistone ha una lunghezza 4,25 mm ( meno della metà di centimetro ! ) e una larghezza di 0,5 mm .
|
|
|
|
Fig. 86. La Strutturadella staffa ( staffa) è stata rimossa con il laser CO2 . La platina della staffa è ora facilmente visibile ( freccia nera ) . La platina della staffa è la parte piatta dell’osso della staffa che è inserta nella finestra ovale dell’orecchio interno . Questa platina separa l’ orecchio interno dall’orecchio medio .
|
|
|
|
Fig. 87. . Un apertura è stato creato nell’orecchio interno ( freccia nera ) per consentire il posizionamento della protesi . Il fluido dell’orecchio interno è chiaramente visualizzato attraverso l’apertura . |
|
|
|
Fig. 88. Il gancio del pistone è posizionato sopra l’ incudine ed alla base dell’ orecchio interno , ricreando il meccanismo uditivo . Il gancio sarà crimpato sopra l’osso incudine . Ora , quandi il timpano si muove con il suono , il pistone si muove effettivamente e leggermente dentro e fuori alll’orecchio interno e permette all’individuo di ascoltare . |
Scelta della tecnica platinaria
Rappresenta l’elemento più controverso dell’intervento tra i sostenitori della platinectomia totale o parziale e quelli della platinotomia, cioè, la realizzazione di un foro platinario la cui importanza è argomento di discussione, come la sua realizzazione. Questo aspetto è di difficile risoluzione. In effetti, e tutto ciò sottolinea ancora il ruolo svolto dall’esperienza e dalle abitudini, non esiste alcuno studio comparativo, randomizzato, che confronti i risultati delle due tecniche praticate dallo stesso operatore, allo stesso livello di esperienza, anche se alcuni chirurghi possono assumere posizioni diverse durante la loro attività. Allo stesso modo, non si potrebbero paragonare i risultati dell’una o dell’altra tecnica quando, per esempio, un operatore utilizza la platinotomia con platine particolarmente spesse, o invece realizza una platinectomia quando la platina «scoppia» e si frammenta. Quindi, non ci sembra giustificato sviluppare gli argomenti presentati nei diversi articoli, e in questa sede ci limiteremo ad alcune osservazioni:
• è indispensabile verificare, per prima cosa, il blocco della staffa, ma anche la mobilità dell’incudine e del martello;
• è prudente, se non indispensabile, praticare un foro di sicurezza al centro della platina prima di rimuovere le crura, in modo tale da avere la possibilità di «recuperare» la platina nel caso in cui quest’ultima si mobilizzasse al momento della frattura delle crura della staffa;
• in caso di platinectomia con interposizione, il «lembo» deve essere disponibile e «preparato» prima della sezione delle crura della staffa, tenendo conto del rischio di stapedectomia in blocco involontaria. L’uso del laser KTP, proposto da alcuni, per la sezione delle crura elimina senza dubbio questo rischio la cui importanza, tuttavia, non deve essere esasperata, se vengono prese tutte le precauzioni;
• al di fuori del foro di sicurezza, qualsiasi manovra sulla platina deve essere preceduta dalla sezione del tendine della staffa e dalla disarticolazione incudostapediale. Allo stesso modo, va effettuata un’emostasi molto accurata;
• la platinectomia deve essere completa o parziale. Nel primo caso, è sempre necessaria un’interposizione venosa, aponeurotica o pericondrale. La rigidità dell’aponeurosi preventivamente seccata o del pericondrio ne facilita notevolmente il posizionamento. Tuttavia molti utilizzano ancora un lembo venoso. In ogni caso, l’innesto deve ricoprire perfettamente la fossa ovale e deve essere tagliato e applicato con molta cura. Nella platinectomia molto limitata si può evitare di posizionare il lembo e utilizzare per la ricopertura il gel-foam, un coagulo o del grasso. Questo è però il caso di una platinotomia non calcolata. Nella maggior parte dei casi, è preferibile realizzare un’interposizione;
• con la platinotomia si deve realizzare un orifizio preciso a livello della platina e perfettamente adattato al diametro del pistone. L’orifizio può essere realizzato con piccole frese a mano, con le microfrese o con il laser KTP 532. Causse ha proposto una platinotomia di 0, 8 mm, con interposizione di un lembo venoso e un pistone di 0, 4 mm.
La scelta della tecnica chirurgica è controversa, e le alternative chirurgiche attualmente sonosono:
o platinotomia calibratacon microperforatore
o platinotomia calibrata con laser a CO2
o platinotomia calibrata con laser a Argon
o platinotomia calibrata con laser a diodi
o platinotomia con interposizione di lembo di vena
o platinotomia con interposizione di pericondrio tragale
o emiplatinectomia posteriore con o senza interposizione
Attualmente la preferenza iniziale della maggior parte degli otochirurghi ricade sulla platinotomia calibrata. L’intervento può essere eseguito in anestesia locale o generale; la nostra preferenza è per la anestesia generale. Infatti l’esigenza fondamentale è quella di avere a disposizione un campo operatorio possibilmente esangue, in grado di consentire un risultato funzionale ottimale in assenza di disconfort per il paziente.
I nostri risultati ottenuti hanno dimostrato come l’anestesia generale utilizzando farmaci di ultima generazione tipo il Remifentanil® con infusione in pompa possa essere l’elemento condizionante la realizzazione dell’intervento chirurgico. In particolare la possibilità di ottenere un’attenta e mirata ipotensione con preciso controllo del sanguinamentoha favorito nella nostra esperienza sempre la perfetta esecuzione della tecnica chirurgica soprattutto in quelle fasi dell’intervento di capitale importanza.
Inoltre è sempre stato ottenuto uno score di dimissibilità entro le 24 ore e non si sono rilevati aumenti dei tempi operatori essendo questi dipendenti dall’allestimento del campo operatorio e solo minimamente legati all’induzione, all’intubazione ed al risveglio. Il vantaggio della anestesia locale riportato da alcuni AA riguardo la possibilità di valutare intraoperatoriamente il risultato funzionale non ci è parso determinante perché in tutti i casi in cui si è ottenuta una precisa tecnica chirurgica il risultato funzionale è stato sempre ottimale mentre l’acumetria intraoperatoria ci sembra un test sommario e poco attendibile considerando che si pretende di avere una risposta precisa da un paziente sedato e sicuramente non in ambiente silente; a proposito della possibilità di saggiare intraoperatoriamente la funzionalità del nervo facciale essa è richiesta solo raramente e comunque non è pregiudicata dall’utilizzo dei farmaci di ultima generazione ad elevatissimo metabolismo (5 minuti).
Sulla base della nostra esperienza riteniamo quindi che l’anestesia generale rappresenti l’elemento che può in modo sensibile essere determinante nel raggiungimento di un buon risultato stabile nel tempo, con evidente vantaggio tra l’altro per il confort del paziente.
Scelta del sistema di trasmissione
Un buon effetto columellare può essere ottenuto con la conservazione della crura posteriore della staffa. Questa tecnica è difficile e non è quasi più utilizzata.
Ugualmente il tubo di Shea, tubo in polietilene tagliato a becco di clarino alla sua estremità distale e rotto alla sua estremità prossimale per adattarlo all’apofisi lenticolare è poco utilizzato. Gli viene rimproverata la mancanza di stabilità.
Il filo di acciaio proposto inizialmente da Schuknecht e che è possibile confezionare estemporaneamente permette una fissazione solida a livello della branca discendente dell’incudine, ma è considerato da alcuni Autori come un fattore di rischio ischemico. Per ricoprire la finestra ovale si può utilizzare un frammento di grasso posizionato nell’ansa inferiore. Questa tecnica conserva un certo numero di adepti e il suo costo è contenuto, ha una fabbricazione artigianale, ed è utilizzata soprattutto nei Paesi in via di sviluppo.
I pistoni rappresentano, oggi, le modalità di trasmissione citate più spesso. Si differenziano per forma, diametro e materiale. I pistoni in Teflon® sono di gran lunga i più utilizzati. I pistoni troppo sottili (0,3 mm) sembrano dare cattivi risultati nella trasmissione delle basse frequenze.
Sebbene siano stati descritti numerosi pistoni, la scelta può limitarsi a due tipi principali:
• il pistone classico in Teflon®, spesso chiamato pistone semplice, disponibile da 0,4 e 0,3 mm di diametro e da 3,5 a 6 mm di lunghezza, è quello più frequentemente utilizzato;
• il pistone-cup in Teflon® che unisce i vantaggi del pistone (per il suo arco di sospensione) e il tubo per la cupola che viene adattata all’apofisi lenticolare. L’applicazione è particolarmente agevole. Misura 4,5 mm di lunghezza e 0,8 di diametro.
Incidenti e complicanze
Durante l’intervento
Si può verificare un certo numero di incidenti:
• lacerazione del lembo timpanomeatale (non grave),
Collegamento Tanzariello Traumi a carico della membrana timpanica ORECCHIO MEDIO lacerazione timpanica (alla fine dell’intervento va sovrapposto un lembo sulla faccia interna del timpano);
• lo stiramento o la sezione della corda del timpano possono provocare una disgeusia, relativamente frequente se si ricerca sistematicamente (20%), ma generalmente transitoria. Una sezione bilaterale crea maggiori problemi ed è quindi importante segnalarla nella descrizione dell’intervento, soprattutto nel caso fosse necessario un secondo intervento;
• una lussazione o addirittura una frattura della branca discendente dell’incudine è una grave complicanza che può avvenire durante la realizzazione dell’incisura ossea d’ingresso (clessidra di Rosen);
• più gravi ancora sono gli incidenti platinari: platina galleggiante non recuperabile o perdita di frammenti di platina.
Bisogna sempre evitare i traumatismi del labirinto, anche se bisogna rinunciare a recuperare la platina o i suoi frammenti.
La perdita di liquido labirintico sotto pressione, è poco prevedibile. La breccia deve essere «chiusa» con l’interposizione e il blocco del pistone.
Le emorragie massive vanno prevenute con un’accurata emostasi. Se, nonostante tutto, si verificano, va evitata ogni aspirazione tempestiva nel labirinto.
Le lesioni del facciale sono rare e sono una conseguenza dell’esposizione della seconda porzione del nervo, che può erniare nella fossa ovale.
APPROFONDIMENTO: COMPLICANZE INTRAOPERATORIE DELLA CHIRURGIA DELL’OTOSCLEROSI
1)Perforazione della Membrana Timpanica(non grave),
Collegamento Tanzariello Traumi a carico della membrana timpanica ORECCHIO MEDIO
Una ferita della membrana timpanica compare generalmente al momento dello scollamento del lembo timpano-meatale. La sua frequenza è stata stimata all’1,9% dei casi. Un innesto di aponeurosi temporale o di pericondrio, eseguito alla fine dell’intervento, permette, il più delle volte, di occludere la lacerazione con successo [60].
2) stiramento o la sezione della corda del timpano
lo stiramento o la sezione della corda del timpano possono provocare una disgeusia, relativamente frequente se si ricerca sistematicamente (20%), ma generalmente transitoria. Una sezione bilaterale crea maggiori problemi ed è quindi importante segnalarla nella descrizione dell’intervento, soprattutto nel caso fosse necessario un secondo intervento;
|
|
Figura fig. 90.a : La breve punta cru dell’incudine è un indicatore utile che indica il nervo della corda del timpano che rimane in parte nella parete ossea (circa dello spessore di 1 mm) . |
3)Lussazione o la frattura dell’apofisi lunga dell’incudine
La lussazione dell’incudine compare, il più delle volte, al momento della disarticolazione incudo-stapedia, oppure al momento dell’introduzione del pistone. Questa complicanza è osservata in meno dello 0,2% dei casi [26, 27]. Il trattamento è, a volte, difficile, quando è stata realizzata una platinectomia [28]. E’ insieme con le due precedenti, una delle cause più frequenti di malfunzionamento della protesi, legata al trauma indotto sull’incudine dal gancio della protesi e favorita da diversi fattori, spesso associati, quali:
– apofisi lunghe, sottili e ipotrofiche;
– manovre chirurgiche che causano lesioni della mucosa dell’apofisi e della sua vascolarizzazione;
– protesi troppo strette, decubiti sulla porzione più vulnerabile dell’ossicino, situata al passaggio tra processo lungo e processo lenticolare;
– continue sollecitazioni legate ai movimenti dell’incudine in presenza di una protesi dislocata sui bordi della finestra ovale e quindi fissa (fig. 90.b-c);
– sollecitazioni legate ad ampie escursioni del complesso timpano-ossiculare e a rapide variazioni della pressione nella cassa (brusche variazioni di quota, immersioni, violente manovre di Valsalva, ecc.).
|
|
|
|
Fig.90.b: La protesi dislocata sul bordo della FO, causa l’erosione dell’incudine
|
Fig.90.c |
L’erosione si verifica solitamente a distanza di diversi anni dal primo intervento; la frattura completa è solitamente avvertita come un peggioramento dell’udito improvviso o rapidamente progressivo, a volte ben collegabile con un definito momento scatenante (traumi, brusche variazioni di pressione nell’orecchio medio). In alcuni casi l’ipoacusia subisce variazioni legate ai movimenti del capo, alla deglutizione o a manovre di Valsalva.
La frattura può essere evidenziata preoperatoriamente con l’ “imaging”; in ogni caso in sede di intervento la diagnosi non comporta solitamente difficoltà ed è pressoché immediata.
Le soluzioni chirurgiche attuabili sono essenzialmente dipendenti dalla lunghezza dell’apofisi residua.
Se questa presenta una porzione integra sufficientemente lunga possono essere applicati differenti tipi di pistoni di lunghezza e morfologia adeguata; nel caso in cui il residuo dell’apofisi non sia utilizzabile è necessaria una malleo-stapedoplastica . Alcuni Autori hanno descritto l’impiego di cementi per incrementare lo spessore e la lunghezza di un’apofisi lunga molto erosa, così da permettere l’aggancio di un normale pistone7,12,16,41.
|
|
|
|
Fig.91.a L’osso dell’incudine scolpito è stato ricollocato tra il martello e la platina della staffa . |
Fig. 91.b Operazione di revisione Otosclerosi Erosione totale incudine pistone di teflon collegato al martello Dr Robert Vincent |
|
|
|
|
Fig.91.c Revisione Transcanale di otosclerosi anchilosi del manico dell’ Incudine in una stapedotomia Robert Vincent |
Fig.91.d Otosclerosi revisione – manico dell’incudine dislocata ed VII deiscente in unastapedotomia -Robert Vincent |
|
|
|
|
Fig.91.e• riparazione primaria sempre favorito quando possibile • IS protesi articolare ( Applebaum , K – Helix , personalizzato modificato , altri ) • cemento HA • chiusura completa o quasi completa di ABG possibile |
|
4)La presenza di una protesi troppo corta senza dislocazione può essere causa di insuccesso trasmissivo, spesso associato a una sensazione di vibrazione avvertita dal paziente; il disturbo spesso compare diversi mesi dopo l’intervento, dopo che si è completata la stabilizzazione della protesi e la risoluzione dell’edema postoperatorio; anche in questo caso la protesi andrà sostituita con un elemento di lunghezza maggiore.
|
|
Fig.92.a. vista intraoperatoria di una revisione destro orecchio che mostra lo spostamento laterale del pistone . Il pistone è in contatto con il lungo processo di incus , lateralizzata nell’asse del canale uditivo esterno , con un ciclo ancora chiuso che è spostato in su verso la membrana tympanica . In questo caso , una lisi parziale del lungo processo di incus è visto . |
|
|
Fig.92.b. IMPARARE DA un errore : fallimento personale a causa di una protesi corta Dr Robert Vincent |
5)Una protesi troppo lunga può essere causa di malfunzionamento, associato a volte anche a disturbi dell’equilibrio, e favorire la comparsa di una fistola perilinfatica; anche in questo caso è necessaria la sua sostituzione con una protesi di lunghezza adeguata. Una protesi troppo lunga va comunque manipolata con estrema cautela e ben liberata da tutte le aderenze cicatriziali prima di essere rimossa, per evitare di danneggiare le strutture labirintiche sottostanti.
|
|
|
Fig.93.a-b.Dopo stapedectomia Protesi in Polietilene ,che pesca nel vestibolo
|
|
|
Fig.93.c-d.Dopo stapedectomia Protesi in Polietilene Troppo Lunga
· In alcuni casi retrazioni cicatriziali e medializzazioni della catena ossiculare possono letteralmente “affondare” il pistone nella finestra ovale; in questi casi la rimozione della protesi può essere sconsigliabile per l’elevato rischio di labirintizzazione.
· Può accadere che in sede di revisione la protesi non venga reperita; in alcuni casi la protesi può trovarsi in via di estrusione attraverso la membrana timpanica o nel condotto uditivo esterno.
· Il semplice allentamento del gancio della protesi sul processo lungo è di solito facilmente risolvibile stringendolo adeguatamente
6) La staffa si mobilizza in toto (in genere non si tratta di vere otosclerosi, ma di calcificazioni del legamento anulare).
Attenzione in questi casi ad evitare l’effetto “tappo” asportando con cautela la staffa integra solo dopo aver sezionato la mucosa dai bordi della finestra ovale per non strappare ampi lembi della stessa dalla finestra ovale. Si applica un lembo di vena assotigliato, come da noi preferito e praticato dal 1974 al 1990 o un frammento di pericondrio tragale, fissato con due frustoli di gelfoam ai poli e quindi si inserisce la protesi.
7) Distacco parziale della platina.
Nel fratturare le crura o nell’asportare la sovrastruttura può staccarsi anche metà platina o la quasi totalità. In tale circostanza occorre, come sopra, preparare un lembo di vena di 5×7 mm e chiudere la parte assente della platina e appli¬carvi al di sopra la protesi.
8) Platina Fratturata o Lussata
La frattura della platina della staffa è un rischio chirurgico. È, allora, preferibile eseguire una platinectomia totale se i frammenti sono mobili. I tentativi di recupero dei frammenti nell’orecchio interno sono limitati, a causa del rischio di lesione endococleare.
9) Platina Fluttuante Fig.94a

La platina della staffa non è più fissata nella finestra del vestibolo e «fluttua» sui liquidi del labirinto. L’uso di micro uncini ad angolo molto ottuso può essere utile per recuperare la platina flottante. Questa complicanza compare, il più delle volte, durante la rimozione dei rami della staffa. È osservata in meno dell’1% dei casi [29]. È abituale prevenire una tale complicanza o realizzando, prima di ogni mobilizzazione della staffa, una platinotomia a minima [30] o utilizzando un laser per eseguire la platinotomia [31] o realizzando la platinotomia e il posizionamento della protesi prima di effettuare la disarticolazione incudostapedia [32].

Fig.94.b-c L’atteggiamento di fronte a una platina flottante varia in letteratura. Viene raccomandato o di realizzare una perforazione nella platina per poterla  fratturare e recuperare così i frammenti o di fresare la parte postero-inferiore del promontorio per sollevare la platina o di occludere la platina con un frammento di aponeurosi e interrompere l’intervento o di ristabilire un effetto columellare dopo aver posizionato un trapianto aponevrotico o di realizzare una platinotomia con laser e proseguire l’intervento [33, 34]. In caso di caduta di un frammento di platina nel Fig.94.d labirinto, è preferibile abbandonare ogni idea di recupero.
fratturare e recuperare così i frammenti o di fresare la parte postero-inferiore del promontorio per sollevare la platina o di occludere la platina con un frammento di aponeurosi e interrompere l’intervento o di ristabilire un effetto columellare dopo aver posizionato un trapianto aponevrotico o di realizzare una platinotomia con laser e proseguire l’intervento [33, 34]. In caso di caduta di un frammento di platina nel Fig.94.d labirinto, è preferibile abbandonare ogni idea di recupero.
10) Fistola perilinfarica Collegamento Tanzariello Categoria: Orecchio Interno E Traumi Fistola Labirintica
La presenza di una fistola perilinfatica della FO è rilevata nel 5-7% delle RS (Tab. 1). Nella stapedectomia la causa principale della fistola, che si forma a distanza di tempo dall’intervento, è la retrazione cicatriziale della neomembrana di chiusura della FO e la migrazione della protesi al bordo della FO. In questa sede la continua vibrazione della protesi determina la lacerazione della neomembrana e quindi la fistola perilinfatica. La migrazione della protesi e la creazione della fistola sono facilitate dalla presenza di una neomembrana “corta” (Fisch e Ruedi 1968, Glasscock 1973, Althaus 1981) (Fig.95)
|
|
Fig.95.a: Nella stapedectomia subtotale la vibrazione della protesi, migrata sul bordo della FO, lacera la neomembrana “corta”, determinando la fistola perilinfatica (1). |
![]() Nella stapedotomia il meccanismo di formazione della fistola è diverso. La protesi può essere spinta all’interno del vestibolo labirintico dallo spostamento mediale dell’incudine, attratto da aderenze cicatriziali al promontorio. La perilinfa esce dal foro platinare parzialmente aperto (Keck e Coll. 2002, Lesinsky 2003). (Fig.90.b)
Nella stapedotomia il meccanismo di formazione della fistola è diverso. La protesi può essere spinta all’interno del vestibolo labirintico dallo spostamento mediale dell’incudine, attratto da aderenze cicatriziali al promontorio. La perilinfa esce dal foro platinare parzialmente aperto (Keck e Coll. 2002, Lesinsky 2003). (Fig.90.b)
|
Fig.95.b: Nella stapedotomia la rotazione mediale dell’incudine per le aderenze cicatriziali con il promontorio (2), spingono il pistone dentro il vestibolo determinando la fistola perilinfatica attraverso il foro platinare (1). |
|
|
|
|
11) Perdita di liquor Cefalorachidiano e «Geyser/Guscher »
Si tratta di una complicanza molto rara grave della chirurgia dell’otosclerosi,incidenza dello o.o3%. Consiste nella profusa fuoriuscita di un un flusso di liquido perilinfatico sotto pressione improvviso all’apertura del labirinto con la platinotomia,di ed è una delle evenienze più gravi in cui si possa incorrere in questo intervento. Mette infatti a repentaglio il risultato funzionale, può essere difficile da arrestare, può favorire l’instaurarsi di meningite. La quantità del liquido eccede quella della semplice perilinfa, quindi esso deve essere costituito da liquido cefalorachidiano (Wiet 1993). La sorgente di questo potrebbe essere costituita da una abnorme pervietà dell’acquedotto della chiocciola o da un difetto nel fondo del condotto uditivo interno. Causse (1983) descrive che questo reperto si può prevedere in presenza di un aspetto “avascolare” della cassa timpanica ed una inserzione abnormemente anteriore della crus posteriore della staffa.
Viene identificata una “X-linked recessive progressive mixed hearing loss with perilymphatic gusher during stapes surgery” (Cremers, 1999) che trova in una deiscenza del fondo del condotto uditivo interno il suo riscontro morfologico (Phelps, 1991) e può simulare l’otosclerosi.
Il trattamento del gusher consiste nel riconoscerlo precocemente ed a questo scopo vale il “foro di sicurezza” creato nella platina nelle prime fasi dell’intervento. Successivamente si dovrà creare un foro di misura su cui sovrapporre un ampio lembo di vena prima di interporre una protesi; si dovrà tenere la testa del paziente sollevata ed aspettare 20-30 minuti , potrà trovare indicazione un drenaggio spinale lombare per diminuire per quanto possibile la pressione del liquido cefalorachidiano L’analisi dell’esame TC preoperatorio può, talvolta, permettere di ipotizzare questo tipo di complicanza. Il «geyser» è legato a una comunicazione anomala tra gli spazi subaracnoidei e il liquido perilinfatico. È dovuto a una malformazione dell’acquedotto cocleare o vestibolare. La posizione proclive può aiutare a ridurre la perdita. Una vaccinazione antipneumococcica postoperatoria è sistematica [29]. Di fronte a una tale complicanza,occorre alzare la testa, si deve limitare l’apertura del labirinto, colmare la breccia della platina con del tessuto connettivo e mantenere questo materiale di riempimento con un pistone. Sono state descritte diverse tecniche per limitare la pressione dei liquidi del labirinto: posizione proclive del paziente, iperossigenazione e puntura lombare di svuotamento ,la maggior parte di questi gusher portano ad una perdita di udito[13]. Fig. 96.a-b-c
|
|
|
|
|
Fig. 96.c Gusher perilinfatico durante la chirurgia della staffa – |
12) Labirinto “secco”.
Sempre conseguenza di aspirazione, può comportare grave pregiudizio alla riuscita funzionale e deve essere evitato utilizzando microaspiratori a bassa potenza di aspirazione, interponendo sempre quando si aspira nella finestra ovale un batuffolo di gelfoam ed aspirando per brevissimi periodi attraverso di questo. Nel caso in cui la perilinfa risulti in parte aspirata occorre fermarsi ed attendere che il livello della perilinfa risalga a filo della finestra ovale.
13) Sanguinamento intraoperatorio
Il sanguinamento intraoperatorio è un fattore importante che complica l’atto chirurgico. Shea [35] ha dimostrato che un sanguinamento intraoperatorio è associato a un rischio aumentato di comparsa di una sordità neurosensoriale. Il sanguinamento può provenire dal lembo timpanomeatale o dalla cassa del timpano. È eccezionalmente legato alla persistenza di un’arteria stapedia, la cui coagulazione permette di proseguire l’intervento. Esso è legato soprattutto alla dissezione della mucosa della parete interna della cassa, in particolare quando il paziente ha avuto una recente infezione delle vie aeree superiori o presenta una pressione arteriosa troppo elevata durante l’intervento. In questo caso possono essere utile lavaggi con soluzione fisiologica tiepida e l’uso di batuffoli di gelfoam imbevuto di adrenalina. Importante è anche l’intervento dell’anestesista nel mantenere il paziete ipoteso. Bisogna comunque evitare l’uso dell’aspiratore a livello del labirinto. L’entrata di sangue nel labirinto potrebbe essere causa di dete¬rioramento della soglia uditiva postoperatoria, ma ancora più gravi potrebbero essere i danni provocati nelle manovre per asportarlo. In caso di sanguinamento troppo importante è, talvolta, necessario soprassedere alla procedura sulla platina.
14) Difficoltà Legate a Decorso Anomalo del Nervo Facciale Scoperto o Canale Facciale Procidente
La procidenza del nervo facciale può complicare l’atto operatorio riducendo l’accessibilità alla finestra del vestibolo. E’ di riscontro frequente la deiscenza del canale di Falloppio nel secondo tratto, ma ciò non comporta solitamente ptosi del nervo. Si verifica ~ 9% delle procedure staffa. Alcune anomalie anatomiche del nervo facciale possono portare a rinunciare a proseguire l’intervento. Un decorso basso è riferibile ad un anomalo sviluppo embrionale della carti¬lagine di Reichert. Durcan (1967) ha descritto tre possibili anomalie del nervo facciale in rapporto alla finestra ovale: un nervo ptosico, un nervo bifido, un nervo che decorre sul promontorio. Queste si possono variamente associare ad anomalie od assenza della sovrastruttura della staffa od anche della finestra ovale. Welling (1992) sostiene che le anomalie di decorso del nervo facciale non si manifestano sole ma sono parte di anomalie più complesse. In caso di nervo facciale procidente sarà necessario praticare una fresatura del bordo inferiore della finestra ovale e posizionare la protesi in modo da evitare il decubito sul nervo stesso (Fig.92. a-b).
|
|
|
|
Fig. 97 c-d
|
|
|
|
|
Fig. 98.a-b : vista endoscopica delle strutture dell’orecchio medio seguenti elevazione del lembo tympanomeatal ( I- incudine , OW- finestra ovale , Fn nervo facciale , rw- nicchia della finestra rotonda ) |
Queste anomalie possono, talvolta, essere ricercate durante l’analisi dell’esame TC preoperatorio.si possono verificare tre variazioni anatomiche
A)NERVO NEL SUO CANALE OSSEO Si esegue il foro platinare e quindi si introduce il pistone previa curvatura forzata dell’anello
B)IL NERVO PUÒ ESSERE DEISCENTE In tale evenienza con l’aiuto dell’aspiratore si posiziona la protesi,che poi va spostata per evitare traumatismi al nervo stesso
C)IL NERVO OCCUPA LA FINESTRA OVALE IN TOTO ed in questo caso occorre spostarsi in basso e praticare il foro nel promontorio
De Souza e Glasscock (2004) consigliano, in caso di anomalia complessa, di interrompere l’intervento, anche se in letteratura (Horn 1998) sono offerte le pos¬sibilità della decompressione con “gentle displacement” del nervo, della sua trasposizione, della fenestrazione del canale semicircolare orizzontale, della cocleostomia postero-inferiormente al processo cocleariforme. In un solo paziente è stato impossibile praticare la stapedoplastica poiché il facciale ricopriva totalmente la finestra ovale e si associava a malformazione dell’incudine e della staffa.
15) Paresi Facciale.
Una paresi del nervo facciale è possibile, più facilmente se il canale del nervo è deiscente. Se il chirurgo ritiene fiduciosamente di non aver danneggiato il nervo, è probabile che la paresi receda in un tempo variabile. Occasionalmente può essere causata dagli anestetici locali, nel qual caso regredisce in 24 ore. Nella nostra casistica non si è mai verificato alcun caso di paresi postoperatoria.

FIG. 99 a-b: Otto giorni seguenti a stapedotomia , si osserva sul lato destro paralisi facciale di II grado (House – Brackmann): che in (a) mostra i denti e in ( b) spostamento del labbro.
16) Arteria Stapediale Persistente (PSA):Una arteria stapediale persistente è una malformazione vascolare rara. La vera prevalenza non è nota, ma è di circa 1: 5000. Il tasso di rilevamento in vivo di questa variante può aumentare con una comprensione più approfondita della sua comparsa su studi TC. La diagnosi di PSA può essere fatto con l’uso di TC ad alta risoluzione dell’osso temporale o angiografia.La diagnosi può essere suggerita dalla mancanza del spinoso forame alla TC o radiografie; Tuttavia, questo risultato è aspecifica e può essere visto anche nei casi in cui l’arteria meningea media trae origine dalla arteria oftalmica. Non sono stati segnalati La rilevabilità e l’aspetto di un PSA su immagini RM o angiografia MR. Le piccole dimensioni della tipica PSA sarebbe molto probabilmente fare il rilevamento da RM o RM angiografia difficile. individuazione Imaging di questa variante può ovviare inutili interventi chirurgici e può aiutare a pianificare gli interventi chirurgici o endovascolari.E’ una struttura primitiva che normalmente si atrofizza nel terzo mese di vita fetale. L’arteria stapediale è transitoriamente presente nel normale sviluppo del feto, che collega i rami del futuro carotide esterna (ECA) alla carotide interna (ICA). la persistenza postembrionale dell’arteria stapediale è rara. Questa arteria origina dalla carotide interna, penetra nella cassa timpanica antero-inferiormente, passa sul promontorio eventualmen¬te contenuta nel canale osseo di Jacobson, procede attraverso il forame otturato-rio della staffa quindi piega anteriormente nella porzione orizzontale del canale del nervo facciale, penetra nella fossa cranica media e termina nell’arteria meningea media. L’arteria stapediale ha due rami: il dorsale sopraorbitario ed il ventrale maxillo-mandibolare.
Può essere associata con anomalie dell’arteria carotide interna (Roll 2003, Yilmaz 2003) e dell’orecchio medio, specialmente della staffa e del nervo fac¬ciale (Tien 2001). L’incidenza riportata di tale reperto durante la chirurgia della staffa varia tra 0.02% (Steffen 1968) e 0.05% (David 1967). L’arteria stapediale può presentare come una massa dell’orecchio medio pulsatile o può essere trovato tra l’altro durante l’intervento chirurgico dell’orecchio medio. La presenza di un’arteria stapediale persistente (PSA) può essere riconosciuto con radiografia, TAC, o angiografia. Questa diagnosi è basata su TAC e risultati intraoperatori, se mediana, può essere coagulata o evitata facendo il foro platinare nella porzione più posteriore della platina. Fig. 95.A-B-C-D-E;

Fig. 100.A-B-C-D-E;
Rappresentazione schematica delle fasi di sviluppo dell’arteria stapediale A, L’arteria ioide nasce dalla ICA. L’arteria stapediale nasce dalla arteria ioide vicino alla sua origine. I rami dell’arteria stapediali in divisioni superiore e inferiore dopo aver attraversato la staffa. Le arterie faringei ventrali sono i precursori della definitiva ECA. L’arteria stapediale è l’unico fornitura alle divisioni superiori ed inferiori.
B, forme anastomosi tra l’arteria faringea ventrale e rami di divisione inferiore.
C, L’arteria stapediale diminuisce dimensioni.
D, anatomia adulto normale con involuzione dell’arteria stapediale.
E, la configurazione anatomica della tipica PSA.
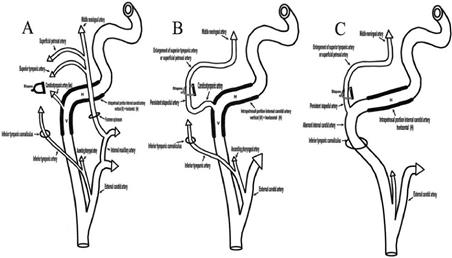
Fig. 101. A, Rappresentazione schematica della normale anatomia dell’ACI e parte del plesso arteriosa timpanica.
Fig. 101. B, Rappresentazione schematica di un’arteria stapediale persistente non associata ad un ICA aberrante. Ci è l’allargamento della arteria caroticotimpanica, come nel nostro caso riportato. In alternativa, l’arteria timpanica inferiore può formare il segmento inferiore del PSA. Nell’ultimo caso, è previsto allargamento canaliculus timpanica inferiore. Non c’è spinoso foramen in entrambe le situazioni. Fig. 101. C, Rappresentazione schematica di un PSA associato con ICA aberrante. C’è assenza della porzione verticale del ICA. L’arteria timpanica linferiore e canaliculus sono ingrandite. In questa teoria, vi è inversione
|
|
Fig. 102. a |
|
|
Fig. 102. b |
|
|
|
Fig. 102. c |
|
|
|
|
Fig. 102.d Vista Otoendoscopica della cavità timpanica destra.The PSA passa tra le crura della staffa . (Crus Anteriore Stapediale [ freccia ] Crus Posteriore Stapediale [ PSC ] ; tendine stapediale [ST ] ; articolazione incudostapediale comune [ ISJ ] Ristampato con il permesso di : Bhattacharyya N , Poe DS Otoendoscopic view of a persistent stapedial artery. Otolaryngol Head Neck Surg 1999;120:923 |
|
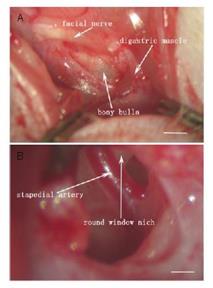
Fig. 102.e.f
|
Fig. 103.a.b |
|
|
Fig. 104.a.b
Sintomatologia. E’ possibile che un’arteria stapediale persistente causi acufene pulsante, eventualmente anche obiettivo (Roll 2003) e, limitando il movimento della staffa, ipoacusia trasmissiva. Frequentemente diagnosticata in età infantile, può dare l’immagine di una massa congesta e pulsante al di dietro della membrana timpanica, facendo sospettare un glomo timpanico, un’arteria carotide aberrante od un bulbo della giugulare deiscente.
Trattamento. L’importanza clinica della persistenza dell’arteria stapediale in occasione di intervento sulla staffa consiste in primo luogo nella possibilità di profuso sanguinamento e nella possibilità di un’arteria carotide interna aberrante. Horn e Coll.(1998) ritengono che la PSA non costituisca di per sé una controindicazione ad una chirurgia della staffa con buon risultato funzionale; riportano casi della letteratura in cui l’arteria era stata sezionata senza problemi; suggeriscono l’uso di Laser e microfresa ed una fenestrazione in cui applicare una protesi in teflon che non traumatizzi l’arteria. Nella nostra casistica due soli casi. In un caso è stata cauterizzata e sezionata, in un secondo caso è stato possibile forare la metà posteriore della platina ed applicare la protesi di dietro all’arteria.
17) Otosclerosi Obliterativa della finestra ovale
L’Otosclerosi che oblitera la finestra ovale non può essere facilmente gestito o rimosso con il laser . Tuttavia , il laser è utile nel cauterizzare le mucosa circostante per evitare il sanguinamento . Obliterazione della finestra ovale con otosclerosi richiede la rimozione dell’osso obliterante prima seguito dalla fenestrazione ( Fig . 106 a) . Questa operazione viene eseguita con tappe incrementali, utilizzando prima una fresa diamantata di 1 mm o una fresa a taglio con graduale ripetuti trapanazioni fino a chè l’osso è stato assottigliato e visualizzata la tonalità blu del vestibolo. A questo punto la fenestrazione viene rifinita con la fresa diamantata di 07 mm , che dovrebbe essere epicentrata nella cavità da aprire . In questi casi, la cosa migliore da fare è misurare la distanza tra l’ incudine e vestibolo prima della finestratura , in quanto è spesso difficile valutare la profondità con il misuratore una volta che la fenestra è stato creata
|
|
|
Fig. 105.a.b
|
|
|
Fig. 106.a.b:Incidenza intorno al 5% fino al 20%
|
|
Fig. 106.c: L’immagine qui di lato mostra una finestra ovale molto ristretta |
Piu spesso negli adolescenti e giovani adulti
Clinica ed audiometria non utili per la diagnosi ,che di solito è intraoperatoria
Nel postoperatorio
• Vertigini importanti e durature sono da considerarsi delle complicanze che possono portare alla programmmazione di un nuovo intervento alla ricerca di una fistola labirintica o di un pistone troppo lungo.
• L’infezione è rara, ma può esse all’origine di una meningite otogena, che inizia con una labirintite che, generalmente, porta alla cofosi. Questo rischio giustifica tutte le precauzioni che garantiscano la massima asepsia. La prescrizione sistematica di antibiotici non protegge da questo rischio ed è molto controversa.
• Gli acufeni postoperatori (che vanno distinti dalla persistenza di quelli preoperatori) non necessitano di trattamenti terapeutici, ma devono far temere un’evoluzione sfavorevole dell’udito.
• Le sordità postoperatorie costituiscono in realtà il rischio più temuto, soprattutto nelle forme maggiori di sordità di percezione. Saranno affrontate secondo i protocolli abituali di trattamento delle sordità improvvise, con risultati variabili. Non bisogna scartare la possibilità di una fistola labirintica che giustifichi una seconda esplorazione.
COMPLICANZE MECCANICHE POSTOPERATORIE TARDIVE
L’assenza di chiusura del Rinne postoperatorio è una complicanza postoperatoria la cui spiegazione può essere varia. La sua frequenza è stimata al 5,8% da Vincent et al. [39] su una casistica di 2527 pazienti (146/2 527). Le ragioni della persistenza di una sordità di percezione sono state attribuite a una lisi dell’apofisi lunga dell’incudine (34% dei casi), a una lussazione della protesi (25%), a una protesi o troppo corta (14,3%) o troppo lunga (3,4%, 56 pazienti) per alcuni [39] o a uno spostamento della protesi (81% dei casi), a una rifissazione della base della staffa (14%), a una fissazione del martello (4%), a una lussazione (4%) o a una fissazione (2%) dell’incudine (279 pazienti) per altri [63]. Battista et al. hanno valutato che il 10-20% dei pazienti operati per un’otosclerosi sarà sottoposto a una revisione chirurgica nei venti anni successivi all’intervento iniziale [64].
Oltre a questi problemi meccanici incentrati sulla catena ossiculare, la ricomparsa di una sordità di trasmissione può essere legata a una nuova obliterazione della finestra del vestibolo secondaria a una nuova proliferazione otosclerotica. Così, su una serie di 22 casi, Nadol ha evidenziato, in uno studio anatomopatologico, che tale proliferazione otosclerotica rappresentava il 23% dei casi [65]. Questa proliferazione può anche interessare la finestra della coclea nello 0,1% dei casi rioperati [64].
Granuloma infiammatorio postoperatorio
Un granuloma di natura infiammatoria si può sviluppare a contatto con la finestra del vestibolo. Sarebbe legato dalla deposizione di microframmenti di cotone o teleria ,dalla presenza di medicazioni gelatinose posizionate al momento dell’intervento a contatto con le finestre [61] per sigillare il foro pla¬tinare. La sua prevalenza è stimata tra l’1,3% e il 5% [62]. Il timpano appare leggermente infiammato. Una degradazione progressiva dell’udito, comprendente un coinvolgimento endococleare ed eventualmente anche da disturbi statocinetici, compare durante i primi 15 gg postoperatori [30]. l’otoscopia può evidenziare una massa rossastra retrotimpanica; alla TC il granuloma si presenta come una massa della densità dei tessuti molli di dimensioni variabili in corrispondenza della finestra ovale.Un reintervento precoce, durante i primi 15 gg postoperatori, limiterebbe la degradazione uditiva [61]. esso consiste nella delicata rimozione del tessuto infiammatorio e nella sostituzione della protesi. Il reintervento consente di stabilizzare o migliorare il risultato funzionale, ma è gravato da una consistente incidenza di coclearizzazione (circa 1/3 dei casi) 37 Seichsnaydre MA, Sismanis A, Hughes GB. Update of reparative granuloma: survey of the American Otological Society and the American Neurotology Society. Am J Otol 1994;15(2):155-160.
|
Figure 107. (A-B). |
|

Figure 108. (A-B). campioni istopatologici del granuloma riparativo dalla finestra ovale che mostra a) cellule infiammatorie e b) fibroblasti .
|
|
|
Figure 109. (A-B).granuloma post-operatorio
|
|
Figura 110. Fotografia del tessuto rimosso dal paziente B.J. Le frecce segnano l’interfaccia tra il gelfoam ( G ) e il granuloma ( GR ) |
Colesteatoma postoperatorio
I colesteatomi sono eccezionali e sono descritti, il più delle volte, in casi clinici isolati [66]. Essi si manifestano spesso diversi anni dopo l’intervento iniziale. Potrebbero essere secondari all’inclusione intraoperatoria di cellule epidermiche nella cassa del timpano, o con uno strumento o con l’innesto [67].
Altre complicanze
Lesione della corda del timpano (vedi sopra) Figura 111
Le lesioni della corda sono dovute o a uno stiramento o a una sezione della corda durante la realizzazione della via di accesso alla finestra del vestibolo. La loro prevalenza è stimata pari al 30% dei casi [30]. La disgeusia sembra più frequente quando la corda è sezionata piuttosto che stirata [68]. Il recupero del gusto è più lungo in caso di sezione (6,7 mesi, deviazione standard = 4,9) che in caso di stiramento (3,4 mesi, deviazione standard = 3,7). La scomparsa della disgeusia sembra più rapida quando la corda è stata sezionata [69].
|
|
Figura 111 : La breve punta cru dell’incudine è un indicatore utile che indica il nervo della corda del timpano che rimane in parte nella parete ossea (circa dello spessore di 1 mm) . |
Meningite postoperatoria
Si tratta di una complicanza eccezionale, favorita da una malformazione dell’orecchio interno oppure legata a una labirintite postoperatoria [70, 71, 72].
Paralisi facciale postoperatoria (vedi sopra)
Una paralisi facciale periferica postoperatoria può comparire immediatamente o secondariamente all’atto operatorio. Quando essa è constatata al risveglio del paziente, può essere in rapporto con l’anestesia locale o essere legata a un trauma del nervo facciale, in particolare quando il canale facciale è deiscente o presenta un decorso atipico. L’atteggiamento è identico a quello tenuto nel caso di una paralisi facciale post-traumatica [73]. Le paralisi facciali secondarie non sembrano legate a un trauma intraoperatorio del canale facciale. In qualche caso, il trauma sarebbe legato a un riscaldamento del canale facciale legato all’uso del laser [74, 75]. La loro prevalenza è stimata allo 0,5% [76, 77]. Le paralisi compaiono alcuni giorni (media 5,5 gg) dopo l’intervento [77]. Il trattamento si basa sulla terapia steroidea. Sono di prognosi favorevole e il loro recupero avviene in media nei due mesi successivi all’intervento [76].
Dispositivi acustici
Le apparecchiature protesiche sono utilizzate in molte situazioni:
• quando la chirurgia è controindicata: orecchio unico, patologie infettive otologiche ripetute, gravi complicanze postoperatorie pregresse sull’orecchio controlaterale, precedenti di sordità improvvisa, patologia medica o psichiatrica che controindica un intervento;
• quando la chirurgia non è indicata: ipoacusia troppo poco rilevante da giustificare un intervento chirurgico (ma in questo caso è, in genere, il paziente a non richiedere la correzione);
• quando il paziente rifiuta il trattamento chirurgico: il medico deve presentare la protesi come un’alternativa alla chirurgia e spiegare chiaramente tutti i rischi;
• associati alla chirurgia, quando quest’ultima non ha dato risultati positivi (protesizzazione dell’orecchio operato o di quello controlaterale), dopo una labirintizzazione secondaria, o come aggiunta di un guadagno insufficiente scontato.
I migliori risultati protesici si ottengono nei pazienti con una sordità di trasmissione pura. Non esiste infatti il fenomeno del reclutamento, né quello di distorsione. Il guadagno ottenuto con l’apparecchio corrisponde alla media del Rinne misurato. Questo tipo di sordità, generalmente, non supera i 60 dB. Si possono scegliere diversi apparecchi come quelli che circondano l’orecchio, quelli intraconici o quelli intra-auricolari. Molto usate attualmente, le protesi intra-auricolari hanno fatto enormi progressi e possono essere munite di telecomandi.
Le protesi dei pazienti con una sordità mista creano molti più problemi. In alcuni casi, nonostante un’amplificazione massima, la soglia di percezione rimane bassa a causa della distorsione che altera la comprensione e di un reclutamento che abbassa la soglia del dolore. In questo caso, la cooperazione con l’audioprotesista è di fondamentale importanza. Il paziente va sufficientemente informato su tutte le fini regolazioni affinché non si scoraggi rapidamente davanti a un risultato che può tardare a comparire. La complessità delle regolazioni necessarie (protesi a compressione) fa sì che le protesi più adeguate spesso sono quelle che contornano l’orecchio e non quelle intra-auricolari. L’efficacia della protesi va valutata continuamente, con un’anamnesi precisa e un’audiometria tonale e vocale.
Approfondimento Complicanze postoperatorie della chirurgia dell’otosclerosi
Complicanze relative al sistema cocleovestibolare
Due tipi di complicanze uditive possono comparire dopo la chirurgia dell’otosclerosi: un peggioramento o l’assenza di un miglioramento uditivo e la comparsa o l’aggravamento degli acufeni.
Diversi studi in letteratura mostrano che i risultati uditivi e i rischi operatori nella chirurgia dell’otosclerosi sono strettamente legati all’esperienza del chirurgo [36, 37]. Recentemente, Yung et al. (2006) [38] hanno analizzato i tassi di insuccesso nelle prime cento stapedectomie realizzate da due chirurghi. Le sordità di percezione postoperatorie sono comparse in occasione dei primi venti casi. L’analisi dei risultati e delle complicanze di questa chirurgia permette a questi autori di ipotizzare una padronanza dell’atto operatorio dopo 60-80 interventi. Un allenamento regolare sembra loro essere un fattore importante di successo. Beninteso, questo concetto pone il delicato problema dell’apprendimento della chirurgia dell’otosclerosi.
Sordità di percezione endococleare postoperatoria
La complicanza più temuta della chirurgia dell’otosclerosi è la comparsa o l’aggravamento di una sordità endococleare. Su una grande casistica di 2 527 pazienti, Vincent et al. [39] hanno riferito un tasso del 5,15% di sordità neurosensoriale postoperatoria grave. Questa sordità è spiegata dalla presenza di una fistola perilinfatica postoperatoria solo in otto casi. Mann et al., su una casistica di 1 229 casi, riferiscono 20 sordità gravi (1,62%) di cui 12 sono progredite verso la cofosi (1%) [40]. Questo rischio di sordità endococleare aumenta quando si tratta di una chirurgia di prima intenzione (1,3% dei casi), di una prima revisione (11,3%) o di una seconda revisione chirurgica (16,6%) [41]. I fattori prognostici di una tale complicanza non compaiono chiaramente in letteratura. Mann raccomanda la prescrizione di una profilassi antibiotica sistematica per ridurre il rischio di labirintite infettiva postoperatoria, ma questo approccio non è unanimemente ammesso in letteratura. Per alcuni autori, la profilassi antibiotica postoperatoria non deve essere sistematica e deve essere adattata al contesto clinico e alle condizioni operatorie [14]. Un esame TC postoperatorio permette, a volte, di sospettare una causa possibile di questa sordità endococleare (granuloma, penetrazione della protesi nell’orecchio interno, fistola perilinfatica con pneumolabirinto) [42]. Malgrado ciò, si deve essere prudenti durante l’interpretazione delle immagini TC, in particolare a causa dell’assenza di parallelismo tra lo stato uditivo del paziente e il grado di penetrazione del pistone nel vestibolo. La presenza di uno pneumolabirinto in fase postoperatoria non è rara, anche quando l’intervento e le cure successive sono stati molto semplici. Il recupero uditivo dopo un reintervento chirurgico è raro [43].
Diversi studi hanno valutato l’evoluzione degli acufeni dopo un intervento chirurgico per otosclerosi. Il miglioramento degli acufeni è stimato in letteratura tra il 35% [44] e il 95% dei casi [45, 46]. Il miglioramento della percezione degli acufeni sembra proporzionale al miglioramento uditivo [47].
Le vertigini postoperatorie sono frequenti. Sono stimate al 15% [48]. Esse sono tipicamente descritte come delle vertigini di breve durata, associate a una sensazione di instabilità in occasione di variazioni improvvise di posizione. Scompaiono spontaneamente entro alcuni giorni e sarebbero legate a una fistola perilinfatica transitoria. La presenza di intense vertigini, con un nistagmo che batte verso l’orecchio sano, di acufeni e di un aggravamento delle soglie uditive in conduzione ossea deve far temere una labirintite [49]. È necessaria la prescrizione di una terapia antibiotica o anche corticosteroidea [14].
La persistenza di vertigini postoperatorie tardive deve indurre a ricercare la presenza di una fistola perilinfatica [2]. Le fistole perilinfatiche dopo la chirurgia dell’otosclerosi rappresentano il 9-10% degli insuccessi chirurgici riportati in letteratura [50, 51]. La semeiotica di queste fistole è spesso ingannevole, potendo simulare una malattia di Ménière, e associa una sordità di percezione spesso fluttuante, degli acufeni, delle vertigini o un’instabilità. I sintomi possono comparire alle variazioni di posizione e al momento di soffiarsi il naso o di starnutire. È stata segnalata la possibilità di una sordità di trasmissione [52]. Queste fistole possono essere legate a una carenza di tenuta stagna a livello della finestra del vestibolo durante l’atto operatorio o essere secondarie, manifestandosi, talvolta, anni dopo l’intervento. L’interposizione di un innesto di aponeurosi dopo la realizzazione di una platinectomia totale o parziale permette di limitare il rischio di fistola. La tecnica di platinotomia calibrata, con o senza interposizione, sembra più raramente complicata da una fistola [53, 54]. Lo studio clinico di un paziente nel quale si sospetta la presenza di una fistola è difficile. Il segno della fistola, ricercato con uno speculum pneumatico, è incostante. La ricerca di questo segno in occasione di un esame elettronistagmografico sembra essere più attendibile, ma senza poter essere un test di certezza [55, 56]. L’esame TC dell’orecchio medio e dell’orecchio interno è un esame utile quando evidenzia un pistone troppo lungo affondato nel vestibolo, un frammento di platina nel vestibolo, un pneumolabirinto oppure un granuloma della finestra del vestibolo [57, 58].
Il trattamento delle fistole perilinfatiche dopo una stapedectomia si basa su un reintervento chirurgico. La fistola è localizzata a livello della finestra del vestibolo. L’innesto vecchio è abitualmente asportato e, quindi, sostituito con un nuovo innesto di aponeurosi, e il pistone è, quindi, ricollocato [51, 59].
|
[1] |
Legent F., Avenard M., Andrieu-Guitrancourt J., Bordure P., Marie J.P. Place de la chirurgie dans le traitement de l’otospongiose Bull. Acad. Natl. Med. 2006 ; 190 : 915-926 |
|
[2] |
Shea J.J. Stapedectomy: long-term report Ann Otol Rhinol Laryngol 1982 ; 91 : 516-520 |
|
[3] |
Lescanne E., Robier A., Soin C., Manceau A., Benlyazid A., Beutter P. Chirurgie de l’otospongiose. À propos de 227 cas, introduction de la platinotomie laser CO2 Ann. Otolaryngol. Chir. Cervicofac. 1999 ; 116 : 28-36 [inter-ref] |
|
[4] |
Valvalsa A.M. De Aura Humana Tractatus : Bologna (1704). |
|
[5] |
Toynbee J. Pathological and surgical observations on the disease of the ear Medico-Churg 1841 ; 24 : 190 |
|
[6] |
Kessel D. Uber das Mobilisieren der Steigbügels durch ausschneiden des Trommelfelles, Hammers und AmboB bei Undurchgängigkeit der Tuba Arch F Ohrenh 1878 ; 13 : 69 |
|
[7] |
Martin H., Martin C., Roulleau P. L’otospongiose, otosclérose. Historique Paris: Arnette (1994). |
|
[8] |
Sourdille M. Nouvelle technique chirurgicale pour le traitement des surdités de conduction : Ann Otolaryngol (1930). 417-418 |
|
[9] |
Rosen S. Mobilization of the stapes to restore hearing in otosclerosis N Y St J Med 1953 ; 53 : 2650-2653 |
|
[10] |
Shea J.J. Fenestration of the oval window Ann Otol St Louis 1958 ; 67 : 932-951 |
|
[11] |
Bonfils P., Chevallier J.M. Anatomie du système auditif Anatomie. Tome III. Anatomie ORL Paris: Flammarion Médecine-Sciences (2005). 294-335 |
|
[12] |
Bonfils P., Avan P. Évaluation du système auditif Précis d’audiophonologie et de déglutition. Tome I. L’oreille et les voies de l’audition Marseille: Solal (2005). 149-163 |
|
[13] |
Bordure P., Robier A., Malard O. Chirurgie de la platine du stapes Chirurgie otologique et oto-neurologique Paris: Masson (2005). 119-136 |
|
[14] |
Bordure P., Deguine O. Chirurgie de l’otospongiose : risques et complications Les risques chirurgicaux en oto-rhino-laryngologie : information, prise en charge et prévention : Société Française d’oto-rhino-laryngologie et de chirurgie de la face et du cou (2008). 177-193 |
|
[15] |
Cormack R.S., Lehane J. Difficult tracheal intubation in obstetrics Anesthesia 1984 ; 39 : 1105-1111 [cross-ref] |
|
[16] |
Bertrand-Deligné J. Anesthésie en ORL Traité d’ORL Paris: Flammarion (2008). 763-767 |
|
[17] |
Kaygusuz K., Yildirim A., Ozdemir Kl I., Gursoy S., Mimaroglu C. Hypotensive anaesthesia with remifentanil combined with desflurane or isoflurane in tympanoplasty or endoscopic sinus surgery: a randomised, controlled trial J. Laryngol. Otol. 2008 ; 122 : 691-695 |
|
[18] |
Degoute C., Ray M.J., Manchon M., Dubreuil C., Bansillon V. Remifentanil and controlled hypotension: comparison with nitroprusside or esmolol during tympanoplasty Can J Anesth 2001 ; 48 : 20-27 [cross-ref] |
|
[19] |
Pilli G., Güzeldemir M.E., Bayan N. Esmolol for hypotensive anesthesia in middle ear surgery Acta Anaesth Belg 1996 ; 47 : 85-91 |
|
[20] |
Fleury P., Legent F., Lefebvre C. Atlas des techniques chirurgicales de l’oreille Paris: Masson (1974). 21-69 |
|
[21] |
Glasscock M.E., Shambaugh G.E. Surgery of the ear Philadelphia: WB Saunders (1990). 389-418 |
|
[22] |
Somers T., Govaerts P., Marquet T., Offeciers E. Statistical analysis of otosclerosis surgery performed by Jean Marquet Ann Otol Rhinol Laryngol 1994 ; 103 : 945-951 |
|
[23] |
Sedwick J.D., Louden C.L., Shelton C. Stapedectomy versus stapedotomy. Do you really need a laser? Arch. Otolaryngol. Head Neck Surg. 1997 ; 123 : 177-180 |
|
[24] |
Siddiq M.A. Otosclerosis: a review of aetiology, management and outcomes Br J Hosp Med 2006 ; 67 (470) : 472-476 |
|
[25] |
Poe D.S. Laser-assisted endoscopic stapedectomy: a prospective study Laryngoscope 2000 ; 110 : 1-37 |
|
[26] |
Sheehy J.L. Stapedectomy: incus bypass procedures. A report of 203 operations Laryngoscope 1982 ; 92 : 258-262 |
|
[27] |
Causse J., Causse J.B. Eighteen-year report on stapedectomy. I. Problems of stapedial fixation Clin Otolaryngol Allied Sci 1980 ; 5 : 49-59 [cross-ref] |
|
[28] |
de Souza C, Glasscock ME. Otosclerosis and stapedectomy: diagnosis, management and complications. Stuttgart: Thieme; 2004. 212p. |
|
[29] |
Wiet R.J., Harvey S.A., Bauer G.P. Complications in stapes surgery. Options for prevention and management Otolaryngol. Clin. North Am. 1993 ; 26 : 471-490 |
|
[30] |
Lippy W.H., Schuring A.G. Treatment of the inadvertently mobilized foot plate Arch. Otolaryngol. 1973 ; 98 : 80-81 |
|
[31] |
Nissen R.L. Argon laser in difficult stapedotomy cases Laryngoscope 1998 ; 108 : 1669-1673 [cross-ref] |
|
[32] |
Szymanski M., Golabek W., Morshed K., Siwiec H. The influence of the sequence of surgical steps on complications rate in stapedotomy Otol. Neurotol. 2007 ; 28 : 152-156 |
|
[33] |
Lippy W.H., Schuring A.G. Solving ossicular problems in stapedectomy Laryngoscope 1983 ; 93 : 1147-1150 |
|
[34] |
Saunders N.C., Fagan P.A. Promontory drilling in stapedectomy: an anatomical study Otol. Neurotol. 2006 ; 27 : 776-780 [cross-ref] |
|
[35] |
Shea J.J. Jr. Complications of the Stapedectomy Operation Ann Otol Rhinol Laryngol 1963 ; 72 : 1108-1123 |
|
[36] |
Hough J.V., Dyer R.K. Jr. Stapedectomy. Causes of failure and revision surgery in otosclerosis Otolaryngol. Clin. North Am. 1993 ; 26 : 453-470 |
|
[37] |
Rombout J., Van Zanten B., Fokkens W.J., Pauw B.K. Clinical consequences of feedback on ear surgery: the continuous recording of adverse events and complications with regard to reducing the number of surgeons who perform otosclerosis surgery Eur. Arch. Otorhinolaryngol. 2002 ; 259 : 351-361 |
|
[38] |
Yung M.W., Oates J., Vowler S.L. The learning curve in stapes surgery and its implication to training Laryngoscope 2006 ; 116 : 67-71 [cross-ref] |
|
[39] |
Vincent R., Sperling N.M., Oates J., Jindal M. Surgical findings and long-term hearing results in 3,050 stapedotomies for primary otosclerosis: a prospective study with the otology-neurotology database Otol. Neurotol. 2006 ; 27 (8suppl2) : S25-S47 |
|
[40] |
Mann W.J., Amedee R.G., Fuerst G., Tabb H.G. Hearing loss as a complication of stapes surgery Otolaryngol. Head Neck Surg. 1996 ; 115 : 324-328 [cross-ref] |
|
[41] |
Bhardwaj B.K., Kacker S.K. Revision stapes surgery J. Laryngol. Otol. 1988 ; 102 : 20-24 |
|
[42] |
Rangheard A.S., Marsot-Dupuch K., Mark A.S., Meyer B., Tubiana J.M. Postoperative complications in otospongiosis: usefulness of MR imaging AJNR Am. J. Neuroradiol.2001 ; 22 : 1171-1178 |
|
[43] |
Lippy W.H., Schuring A.G. Stapedectomy revision following sensorineural hearing loss Otolaryngol. Head Neck Surg. 1984 ; 92 : 580-582 |
|
[44] |
Oliveira C.A. How does stapes surgery influence severe disabling tinnitus in otosclerosis patients? Adv. Otorhinolaryngol. 2007 ; 65 : 343-347 [cross-ref] |
|
[45] |
Sobrinho P.G., Oliveira C.A., Venosa A.R. Long-term follow-up of tinnitus in patients with otosclerosis after stapes surgery Int. Tinnitus J. 2004 ; 10 : 197-201 |
|
[46] |
Lima Ada S., Sanchez T.G., Marcondes R., Bento R.F. The effect of stapedotomy on tinnitus in patients with otospongiosis Ear Nose Throat J. 2005 ; 84 : 412-414 |
|
[47] |
Sparano A., Leonetti J.P., Marzo S., Kim H. Effects of stapedectomy on tinnitus in patients with otosclerosis Int. Tinnitus J. 2004 ; 10 : 73-77 |
|
[48] |
Lesinski S.G., Newrock R. Carbon dioxide lasers for otosclerosis Otolaryngol. Clin. North Am. 1993 ; 26 : 417-441 |
|
[49] |
Ayache D., El Kihel M., Betsch C., Bou Malhab F., Elbaz P. Les réinterventions dans la chirurgie de l’otospongiose : à propos de 26 cas Ann. Otolaryngol. Chir. Cervicofac. 2000 ; 117 : 281-290 [inter-ref] |
|
[50] |
Althaus S.R. Perilymph fistulas Laryngoscope 1981 ; 91 : 538-562 [cross-ref] |
|
[51] |
Derlacki E.L. Revision stapes surgery: problems with some solutions Laryngoscope 1985 ; 95 : 1047-1053 |
|
[52] |
Goodhill V. The conductive loss phenomenon in post-stapedectomy perilymphatic fistulas Laryngoscope 1967 ; 77 : 1179-1190 [cross-ref] |
|
[53] |
Wiet R.J., Kubek D.C., Lemberg P., Byskosh A.T. A meta-analysis review of revision stapes surgery with argon laser: effectiveness and safety Am. J. Otol. 1997 ; 18 : 166-171 |
|
[54] |
Lescanne E., Moriniere S., Gohler C., Manceau A., Beutter P., Robier A. Retrospective case study of carbon dioxide laser stapedotomy with lens-based and mirror-based micromanipulators J. Laryngol. Otol. 2003 ; 117 : 256-260 |
|
[55] |
Shepard N.T., Telian S.A., Niparko J.K., Kemink J.L., Fujita S. Platform pressure test in identification of perilymphatic fistula Am. J. Otol. 1992 ; 13 : 49-54 |
|
[56] |
Black F.O., Lilly D.J., Nashner L.M., Peterka R.J., Pesznecker S.C. Quantitative diagnostic test for perilymph fistulas Otolaryngol. Head Neck Surg. 1987 ; 96 : 125-134 |
|
[57] |
Bordure P., Legent F., Calais C., Loheac D., Beauvillain C. Pneumolabyrinthe et fistule périlymphatique après stapédectomie Ann. Otolaryngol. Chir. Cervicofac. 1990 ; 107 : 359-362 |
|
[58] |
Ayache D., Lejeune D., Williams M.T. Imaging of postoperative sensorineural complications of stapes surgery Adv. Otorhinolaryngol. 2007 ; 65 : 308-313 [cross-ref] |
|
[59] |
Sheehy J.L., Nelson R.A., House H.P. Revision stapedectomy: a review of 258 cases Laryngoscope 1981 ; 91 : 43-51 |
|
[60] |
Causse J., Causse J.B. Eighteen-year report on stapedectomy. I. Problems of stapedial fixation Clin Otolaryngol Allied Sci 1980 ; 5 : 49-59 [cross-ref] |
|
[61] |
Gacek R.R. The diagnosis and treatment of poststapedectomy granuloma Ann Otol Rhinol Laryngol 1970 ; 79 : 970-975 |
|
[62] |
Harris I., Weiss L. Granulomatous complications of oval window fat grafts Laryngoscope 1962 ; 72 : 870-885 |
|
[63] |
Lesinski S.G. Causes of conductive hearing loss after stapedectomy or stapedotomy: a prospective study of 279 consecutive surgical revisions Otol. Neurotol. 2002 ; 23 : 281-288 [cross-ref] |
|
[64] |
Battista R.A., Wiet R.J., Joy J. Revision stapedectomy Otolaryngol. Clin. North Am. 2006 ; 39 : 677-697 [cross-ref] |
|
[65] |
Nadol J.B. Jr. Histopathology of residual and recurrent conductive hearing loss after stapedectomy Otol. Neurotol. 2001 ; 22 : 162-169 [cross-ref] |
|
[66] |
Von Haacke N.P., Wilson J.A., Murray J.A., Duvall E. Cholesteatoma following stapedectomy J. Laryngol. Otol. 1987 ; 101 : 708-710 |
|
[67] |
Ferguson B.J., Gillespie C.A., Kenan P.D., Farmer J.C. Jr. Mechanisms of cholesteatoma formation following stapedectomy Am. J. Otol. 1986 ; 7 : 420-424 |
|
[68] |
Mahendran S., Hogg R., Robinson J.M. To divide or manipulate the chorda tympani in stapedotomy Eur. Arch. Otorhinolaryngol. 2005 ; 262 : 482-487 [cross-ref] |
|
[69] |
Clark M.P., O’Malley S. Chorda tympani nerve function after middle ear surgery Otol. Neurotol. 2007 ; 28 : 335-340 [cross-ref] |
|
[70] |
Nielsen T.R., Thomsen J. Meningitis following stapedotomy: a rare and early complication J. Laryngol. Otol. 2000 ; 114 : 781-783 |
|
[71] |
Stevenson D.S., Proops D.W., Phelps P.D. Severe cochlear dysplasia causing recurrent meningitis: a surgical lesson J. Laryngol. Otol. 1993 ; 107 : 726-729 |
|
[72] |
Snyder B.D., Boies L.R. Jr., Ulvestad R.F., McGuiness P.A. Delayed meningitis following stapes surgery Arch. Neurol. 1979 ; 36 : 174-175 |
|
[73] |
Senechaut J.P., Hazan A., Henrion P., Vacher S., Peytral C. Complications iatrogéniques sévères dans la chirurgie de l’oreille moyenne et leurs aspects médico-légaux Ann. Otolaryngol. Chir. Cervicofac. 1988 ; 105 : 377-382 |
|
[74] |
Ng M., Maceri D.R. Delayed facial paralysis after stapedotomy using KTP laser Am. J. Otol. 1999 ; 20 : 421-424 |
|
[75] |
Mills R., Szymanski M., Abel E. Delayed facial palsy following laser stapedectomy: in vitro study of facial nerve temperature Clin Otolaryngol Allied Sci 2003 ; 28 : 211-214 [cross-ref] |
|
[76] |
Smith M.C., Simon P., Ramalingam K.K. Delayed facial palsy following uncomplicated stapedectomy J. Laryngol. Otol. 1990 ; 104 : 611-612 |
|
[77] |
Shea J.J. Jr., Ge X. Delayed facial palsy after stapedectomy Otol. Neurotol. 2001 ; 22 : 465-470 [cross-ref] IL CONSENSO INFORMATO DEL PAZIENTE Il paziente deve essere a conoscenza del rischio che incontra nell’ intervento per otosclerosi. D’altra parte, dato i andamento progressivo della malattia, l’intervento quasi sempre costituisce uno stato di necessità tanto più se si tratta di giovani pazienti e con forme bilaterali (che possono peggiorare con la gravidanza). Se la malattia è bilaterale, si opera per primo l’orecchio che ha la soglia (per via aerea) peggiore o, a parità di soglia, che ha avuto una caduta più rapida. A parità di tutti questi fattori, sarà il paziente stesso, al quale va spiegato il problema, a scegliere l’orecchio da operare (uso del telefono; posizione nell’ambiente di lavoro ecc.). La possibilità che l’intervento sia seguito (nel periodo immediatamente successivo od entro il primo mese) da una perdita uditiva di variabile entità (per una sofferenza delle strutture nervose dell’orecchio interno e pertanto non reversibile) viene indicata nelle più importanti statistiche italiane ed estere ti a l’l% e il 5%, con una frequenza nella maggior parte dei cofochirurghi che oscilla tra il 2% ed il3%. Invece la perdita grave e irreversibile dell’udito nelle più significative statistiche italiane ed estere viene data con una percentuale non inferiore all’ 1%; e viene spiegata con la labirintite postoperatoria, con la rottura della membrana di Reissner (Causse), con l’azione tossica del reparative granuloma (Schucknecht), Se non si chiude il gap aerea-ossea o se si riforma, si può fare un reintervento, a condizione che non vi sia una caduta della via tonale ossea; si possono riscontrare processi adesivo-cicatriziali nella cassa e tra gli ossicini, la lisi del processo lungo dell’Incudine (per la protesi con gancio metallico!), uno spostamento della protesi nella finestra ovale (molto raro con il metodo dell’interposizione), o la presenza di una fistola attorno alla protesi (evenienza possibile se non viene usato il metodo dell’interposizione). La percentuale di successo parziale o di insuccesso, e la quota di rischio, è ovviamente più alta nei reinterventi. Gli acufeni. che molto spesso accompagnano la malattia, scompaiono o si riducono soltanto in un terzo dei pazienti; però l’intervento ben riuscito fa entrare una massa ormai sconosciuta di messaggi sonori per cui vengono meno notati dal paziente anche se persistono invariati. Le migliorate condizioni idrodinamiche dell’orecchio interno e le cure mediche sistematiche attuate nei primi anni dopo l’intervento aiutano a ridurne l’intensità. I fattori che innalzano la quota di rischio, da tener sempre presenti nel bilancio preoperatorio. vanno identificati in: gravità del focolaio osteosclerotico(forma obliterativa): — interessamento dell’ orecchio interno o per cause meccaniche (focolai endococleari con aumento della pressione dei liquidi) o per cause tossiche (enzimi lisosomiali prodotti dal focolaio: Causse J. e J.B.) (otosclerosi lobirintizzata): — presenza di flogosi recidivanti delle prime vie; — una funzione tubarica non perfetta (allergia delle vie aeree); — diabete, ipertensione; — lavoro pregresso in ambiente rumoroso; — uso prolungato della pillola e/o assunzione di farmaci ototossici; l’età del paziente ha meno importanza (Pirodda A.). |
- Che cosa è l’Otosclerosi?
- Quali sono le cause dell’Otosclerosi?
- Epidemiologia dell’ Otosclerosi
- Sintomi Dell’ Otosclerosi
- Diagnosi dell’ Otosclerosi
- Stadiazione Otosclerosi
- Come viene trattata Otosclerosi?
- Amplificazione
- Terapia medica
- Terapia chirurgica
- ANATOMIA PATOLOGICA
- Localizzazione dei focolai di otosclerosi
- Descrizione delle lesioni
- Esame macroscopico
- Microscopia ottica
- Microscopia elettronica
- Anatomia Patologica Approfondimento?’
- Eziologia?
- Ipotesi genetica
- Ipotesi Disendocrina
- Ipotesi Virale
- Fattori otologici flogistici
- Fattori infettivi
- Virale più genetica
- Patogenesi?
- Ipotesi Autoimmune
- Ipotesi vascolare
- APPROFONDIMENTO AUDIOLOGICO
- Imaging
- Risultati e semeiologia tomografica
- Ipodensità
- Evoluzione
- Forme cliniche
- Forme evolutive
- Forme in base all’età
- Forme giovanili
- Forme tardive
- Forme unilaterali
- Forme cocleari pure
- Otosclerosi e gravidanza
- Otosclerosi e trattamenti ormonali Contraccezione
- Trattamento sostitutivo perimenopausale
- DIAGNOSI DIFFERENZIALI
- Il colesteatoma congenito
- Malformazioni congenite minori dell’orecchio medio e degli ossicini
- Alcuni tumori benigni dell’orecchio medio
- La deiescenza del canale semicircolare superiore
- La sindrome dell’acquedotto vestibolare largo (SAVL)
- La Stapes Gusher Sindrome-X linked
- Diagnosi differenziale con le altre sordità di trasmissione
- Rottura della catena degli ossicini
- Otite sieromucosa
- Anchilosi ossiculare (vedi sotto)
- Lesione ossiculare traumatica
- Aplasia minore(vedi sotto)
- Tumori dell’orecchio medio
- Malformazione congenita minore
- Otite fibroadesiva
- Timpanosclerosi
- TRATTAMENTO
- Trattamento medico
- Trattamento chirurgico
- Trattamento chirurgico dell’otosclerosi
- Motivazioni dell’intervento
- Possibilità d’intervento
- Autorizzazione all’intervento
- Esame preoperatorio e anestesia
- Scelta della tecnica operatoria
- Scelta della via di accesso
- Dettagli intraoperatorie
- Tecnica operatoria
- TRATTAMENTO
- Posizionamento del paziente e del chirurgo
- Via del meato
- Via endoaurale minima
- Apertura della cassa del timpano
- Preparazione della staffa
- Procedura sulla staffa
- Platinectomia
- Platinotomia
- Ricostruzione dell’effetto columellare
- Chiusura, medicazione e cure postoperatorie
- Scelta della tecnica platinaria
- Scelta del sistema di trasmissione
- Incidenti e complicanze
- Durante l’intervento
- COMPLICANZE INTRAOPERATORIE
- Perforazione della Membrana Timpanica
- stiramento o la sezione della corda del timpano
- Lussazione o la frattura dell’apofisi lunga dell’incudine
- La presenza di una protesi troppo corta
- protesi troppo lunga
- La staffa si mobilizza in toto
- Distacco parziale della platina
- Platina Fratturata o Lussata
- Platina Fluttuante
- Fistola perilinfarica
- Perdita di liquor Cefalorachidiano e «Geyser/Guscher »
- Labirinto “secco”
- Sanguinamento intraoperatorio
- Difficoltà Decorso Anomalo
- Paresi Facciale
- Arteria Stapediale Persistente (PSA):
- Otosclerosi Obliterativa della finestra ovale
- Complicanze meccaniche postoperatorie tardive
- Granuloma infiammatorio postoperatorio
- Colesteatoma postoperatorio
- Altre complicanze
- Lesione della corda del timpano
- Meningite postoperatoria
- Paralisi facciale postoperatoria
- Dispositivi acustici
- Complicanze postoperatorie
- Complicanze relative al sistema cocleovestibolare
- Sordità di percezione endococleare postoperatoria
- Acufeni postoperatori
- Vertigini postoperatorie