La spirometria (letteralmente “misurazione del respiro”) DERIVA dal latino spiro, “respirare” e dal greco metron, “misura”è il più comune e diffuso esame della funzione respiratoria, è un esame molto semplice e non invasivo che consente di misurare il volume e la velocità del flusso d’aria in entrata nei polmoni. Questa metodica si avvale dell’ausilio di uno strumento, lo spirometro, che riesce a trasformare i segnali ricevuti in numeri e grafici che verranno poi successivamente interpretati dal medico.
La spirometria è forse uno dei principali metodi diagnostici che gli specialisti hanno a disposizione per rilevare anomalie nel respiro che possono nascondere una serie di patologie per le quali questo esame è di fondamentale importanza come l’ansa, la fibrosi cistica, la BPCO (broncopneumopatia cronica ostruttiva), la fibrosi polmonare.
In questo articolo parliamo di:
- A cosa serve l’esame?
- Test spirometrico
- Che differenza c’è tra spirometria semplice e spirometria globale?
- Quali valori si possono misurare con la spirometria?
- Spirogramma normale
- Curva flusso-volume
- Patologie ostruttive
- Patologie restrittive
- Patologie miste
- Fattori che influenzano l’esame
- Ulteriori approfondimenti: altre prove respiratorie
- Perché è importante?
- Come si esegue?
- Cosa sapere prima dell’esame?
- E dopo l’esame?
- Ci sono rischi: fa male?
A cosa serve l’esame?
L’esecuzione di una spirometria è indicata nei seguenti casi:
- Diagnosi e trattamento dell’asma. American (Academy of Allergy/expert panel, Bateman E.D.et Al,)
- Identificazione di malattie respiratorie in pazienti che presentano sintomi di difficoltà respiratoria, nonché per distinguere un problema cardiaco da una malattia respiratoria come causa di base. Pierce R
- Misurare la risposta bronchiale in soggetti che si sospetta possano soffrire di asma Pierce R.
- Diagnosticare e differenziare tra malattie ostruttive polmonari e malattie di tipo restrittivo. Pierce R
- Seguire l’andamento e la storia naturale di una malattia nelle condizioni respiratorie Pierce R.
- Verificare il grado di insufficienza in corso di asma occupazionale Pierce R.
- Identificare coloro che sono a rischio di barotrauma durante le immersion[ Pierce R
- Eseguire una valutazione del rischio pre-operatorio prima dell’esecuzione dell’anestesia e di interventi chirurgici di chirurgia cardio-toracica. Pierce R
- Misurare la risposta al trattamento di condizioni identificabili e misurabili tramite una spirometria. Pierce R
Test spirometrico


Che differenza c’è tra spirometria semplice e spirometria globale?
La spirometria semplice permette di misurare i gas “mobilizzabili”, cioè quanta aria è possibile inspirare ed espirare attraverso uno sforzo, e la velocità con cui questo avviene; questa valutazione è il primo passo della valutazione funzionale respiratoria.
Questo esame può essere eseguito rapidamente con strumenti professionali di analisi
La spirometria globale è una tecnica diagnostica che si differenzia dalla spirometria semplice per il fatto che consente di misurare la quantità totale di gas (in questo caso l’aria) che è contenuta nella gabbia toracica. Il paziente viene collocato in una speciale cabina (detta pletismografica) e deve respirare all’interno di un boccaglio ed un flussimetro.
Questa tecnica si basa sulla legge di Boyle, una legge fisica che stabilisce che pressione e volume sono inversamente proporzionali. Nel caso specifico della spirometria globale, il circuito paziente-boccaglio-flussimetro viene interrotto impedendo all’aria inspirata di fuoriuscire dai polmoni dopo che il paziente ha respirato regolarmente per qualche minuto. Questa interruzione causa un’inevitabile difficoltà respiratoria nel paziente e la compressione e decompressione del gas all’interno dei suoi polmoni viene rivelata dallo strumento che ci fornisce un valore del volume di aria presente all’interno dei polmoni partendo dalla pressione rivelata all’interno della cabina.
L’esame è in grado di fornirci i seguenti dati:
- il volume di aria contenuta all’interno del torace a fine espirazione;
- il volume di aria presente nel torace nel punto di massima inspirazione (capacità polmonare totale);
- l’aria che rimane nei polmoni a fine espirazione.
La spirometria globale è di fondamentale importanza per la diagnosi di patologie che causano una riduzione della ventilazione polmonare, ovvero una ridotta capacità da parte del paziente di inspirare efficacemente. L’esame non è pericoloso, né invasivo e né doloroso ed ha una durata complessiva di 5 minuti.In caso di riscontro di anomalie può essere richiesta la spirometria globale, un esame che richiede dispositivi aggiuntivi permettendo così di valutare in aggiunta che la quantità di aria che rimane nei polmoni dopo un’espirazione forzata (volume residuo), utile per esempio nella diagnosi di enfisema
Quali valori si possono misurare con la spirometria?
I parametri più comuni che vengono misurati sono:
- La Capacità Vitale (VC);
- CVF (capacità vitale forzata): massima quantità di aria che il paziente può espirare forzatamente dopo un’inspirazione massimale
- PEF: picco di flusso espiratorio, indica la massima velocità raggiunta durante l’espirazione, che di solito si ottiene dopo 1/10 di secondo
- il Volume Espiratorio Forzato (FEV) misurato all’intervallo di 0.5, 1, 2 e 3 secondi
- FEV1 o VEMS: volume di aria espirata nel primo secondo.
- Indice di Tiffaneau: rapporto tra FEV1 e FVC.
- FEF 25, 50, 75: velocità dell’aria espirata, espressa in litri al secondo e misurata al 25%, 50% e 75% della FVC.
- FEF 25-75: è il valore posto sulla porzione intermedia di una linea ideale che unisce FEF 25 e FEF 75, è diverso dal FEF 50 ed è utilizzato per esprimere con un unico valore il comportamento dei flussi parziali
- Picco di flusso espiratorio: massima velocità del flusso d’aria quando il paziente espira
Tra tutti questi parametri, il più importante è il volume espiratorio massimo al primo secondo (abbreviato dalla sigla VEMS o FEV1) che viene espresso in litri oppure in percentuale in rapporto al valore di un soggetto con respirazione normale.
Questo parametro indica, sostanzialmente, la quantità di aria(espressa in volume) che viene eliminata nell’arco del primo secondo di un’espirazione forzata.
Il FEV1 è il parametro di flusso più riproducibile ed è particolarmente utile nella diagnosi e nel monitoraggio dei pazienti affetti da patologie polmonari ostruttive (p. es., asma, bronco pneumopatia cronica ostruttiva ).
Il FEV1 e CVF aiutano a differenziare i disturbi polmonari ostruttivi da quelli restrittivi. Il riscontro di un FEV1 normale rende improbabile la diagnosi di malattia polmonare ostruttiva irreversibile, così come il riscontro di una CVF normale rende improbabile la diagnosi di malattia restrittiva.
PEF: picco di flusso espiratorio, indica la massima velocità raggiunta durante l’espirazione, che di solito si ottiene dopo 1/10 di secondo.
Questa variabile è utilizzata principalmente per il monitoraggio domiciliare dei pazienti asmatici e per determinare le variazioni diurne del flusso d’aria.
L’interpretazione di queste misurazioni dipende dalla corretta esecuzione del test da parte del paziente, che spesso migliora se assistito e istruito durante la manovra vera e propria. Dimostrano spirografi accettabili
- Buona iniziazione al test (p. es., un inizio rapido ed energico di espirazione)
- Niente tosse
- Curve lisce
- Assenza di una precoce interruzione dell’espirazione (p. es., tempo espiratorio minimo di 6 secondi senza variazioni di volume nell’ultimo secondo)
I tentativi di ripetere il test presentano variazioni inferiori al 5% o ai 100 mL. Risultati difformi da questi criteri minimi di accettabilità devono essere interpretati con cautela.
Criteri di accettabilità
- morfologia della curva (assenza di artefatti come: tosse, inizio ritardato dell’espirazione forzata, sforzo espiratorio insufficiente, interruzione precoce dell’espiro)
- durata dello sforzo superiore a 3 secondi
- tre prove sovrapponibili con variazione inferiore al 10%
La curva da prendere in considerazione è quella tra le tre accettabili che presenta il maggior valore della sommatra FVC e FEV1.
Nella scelta dello spirometro sceglierne sempre uno che consenta di visualizzare la curva flusso-volume durante la sua esecuzione.
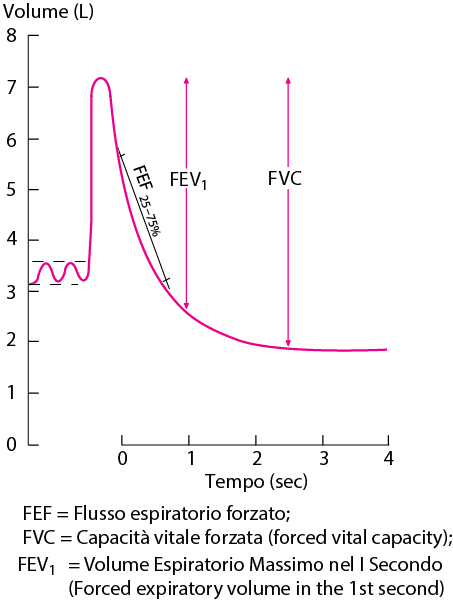
Spirogramma normale
FEF25–75%= è il flusso espiratorio forzato durante l’espirazione del 25-75% della CVF; FEV1= volume espiratorio forzato in 1 sec; CVF = capacità vitale forzata (la massima quantità di aria espirata forzatamente dopo la massima inspirazione).
Volume polmonare
I volumi polmonari (Volumi polmonari normali) sono misurati determinando la capacità funzionale residua (CFR). La CFR è la quantità di aria residua nei polmoni dopo espirazione normale. La capacità polmonare totale è il volume di gas contenuto nei polmoni alla fine dell’inspirazione massimale.
Volumi polmonari normali
VRE = volume di riserva espiratoria; CFR = capacità funzionale residua; CI = capacità inspiratoria; VRI = volume di riserva inspiratorio;
VR = volume residuo; CPT = capacità polmonare totale; CV = capacità vitale; VT= volume corrente.
CFR = VR + VRE; CI = VT + VRI; CV = VT+ VRI + VRE.
La capacità funzionale residua viene misurata utilizzando tecniche di diluizione dei gas o un pletismografo (che è più accurato in quei pazienti che hanno limitazioni del flusso aereo e presenza di gas intrappolato).
Curve volume-tempo e flusso-volume
La rappresentazione grafica della spirometria è espressa da una curva volume/tempo, nella quale, sull’asse delle ascisse, è riportato il valore del tempo, sulle ordinate quello della quantità di aria espirata (volume). Tale curva non è usata in fase diagnostica, ma soprattutto per valutare la corretta durata dello sforzo espiratorio
Curva flusso-volume
Contrariamente allo spirogramma, che mostra il flusso (in L) rispetto al tempo (in secondi), la curva flusso-volume (Curve flusso-volume) mostra il flusso (in L/secondo) in relazione al volume polmonare (in L), dall’inspirazione massimale all’espirazione completa (volume residuo) e durante la massima espirazione a partire dall’inspirazione completa (capacità polmonare totale). Il vantaggio principale della curva flusso-volume è che essa è in grado di mostrare se il flusso d’aria è appropriato per un particolare volume polmonare. Per esempio, il flusso d’aria è normalmente più lento a volumi polmonari bassi perché il ritorno elastico è minore a volumi polmonari più bassi. I pazienti affetti da fibrosi polmonare hanno bassi volumi polmonari, e il loro flusso d’aria appare ridotto, se misurato indipendentemente. Tuttavia, quando il flusso d’aria è presentato come una funzione del volume polmonare, risulta evidente che il flusso è in realtà più elevato del normale come risultato dell’aumentato ritorno elastico caratteristico dei polmoni fibrotici.
Molto più importante è la curva flusso-volume.
La morfologia di una curva flusso-volume normale è riportata nella Figura 1. (Boccaccino)
Sull’asse orizzontale è posto il volume di aria espirata o inspirata espresso in litri.
Sull’asse verticale la velocità con la quale l’aria fuoriesce dai polmoni (flusso) espressa in litri al secondo.
Nella Figura 1, la linea orizzontale di colore nero (larghezza della curva) indica la capacità vitale forzata (FVC),la linea arancio indica il FEV1.
Il FEV1 varia nel bambino normale tra l’85% e il 90% della FVC.
La curva espiratoria (grigia) indica il flusso espiratorio, cioè la velocità con la quale l’aria esce dai polmoni durante tutto l’atto espiratorio.
Come si può notare vi è una prima fase di rapida ascesa della velocità, legata all’inizio della manovra espiratoria forzata, durante la quale si invita il paziente a effettuare un atto espiratorio “esplosivo”, in modo da esaurire tutta l’azione legata alla muscolatura volontaria (parete addominale).
La quantità di aria espirata prima del picco di flusso deve essere inferiore al 5% della FVC ed è definita “sforzodipendente”, essendo determinata oltre che dal ritorno elastico anche dalla partecipazione volontaria dei muscoli espiratori.
Dopo tale fase, che dura un decimo di secondo e il cui apice ci dà il valore del picco di flusso espiratorio (PEF), vi è una rapida discesa della velocità: tale fenomeno è legato alla compressione dinamica delle vie aeree.
La porzione della curva espiratoria flusso-volume è definita, nella sua parte discendente, come “sforzo-indipendente” ed è strettamente correlata alle resistenze respiratorie, essendo determinata solo dal ritorno elastico del polmone e della gabbia toracica.
Interpretazione
Con la spirometria non è possibile fare una diagnosi specifica, ma solo collocare il quadro clinico in esame tra:sindromi ostruttive, sindromi restrittive e normalità.
I valori ottenuti possono essere confrontati con i valori previsti (predetti) (Fig. 2 Boccacino) o con valori precedenti dello stesso paziente (valutazione longitudinale).
La valutazione dei predetti non deve far commettere l’errore di sottostimare un valore apparentemente normale che, se confrontato con valori precedenti, denota invece un peggioramento della funzionalità respiratoria.
Naturalmente se non si dispone di misurazioni pregresse diviene estremamente importante eseguire almeno un test di broncodilatazione (BD). Infatti se il test di BD è positivo si avrà un’indicazione importante su quale sia il best-FEV1 per il paziente in esame, quindi il FEV1 post BD diventa il valore normale di riferimento per quel paziente.
L’indice di Tiffaneau (I.T.) è un valore importate nell’ambito della diagnostica differenziale, può essere anche più sensibile del solo FEV1 nel definire la gravità del quadro asmatico.
Infatti se vogliamo graduare la gravità dell’asma è preferibile utilizzare invece che il FEV1, l’I.T., le cui variazioni sembrano maggiormente correlate alle variazioni cliniche.
Il FEV1 è un indice importante e altamente riproducibile della spirometria, ma proprio perché non è selettivo per quella porzione della curva influenzata maggiormente dall’elasticità polmonare (sforzo-indipendente), può capitare che in alcuni casi non sia di grande aiuto nel monitoraggio della malattia asmatica.
I flussi parziali, soprattutto il FEF 50 e il FEF 25-75 rappresentano un ausilio importante in alcuni casi di asma.
Questi indici sono molto sensibili, possono indicarci un’alterazione iniziale della malattia e sono maggiormente correlati all’iperreattività bronchiale, ma per la loro alta variabilità hanno alcune limitazioni:
- possono essere presi in considerazione solo nei pazienti con FVC normale (in caso di asma grave vi è un aumento del volume residuo e un fenomeno di air trapping che rende falsamente normali i flussi parziali e determina una riduzione della FVC);
- il limite normale è posto al di sopra del 70% del predetto;
- nel test di BD è considerata variazione significativa un aumento del loro valore “post BD” superiore al 45%.
Compressione dinamica delle vie aeree
Le vie aeree prive di sostegno cartilagineo, quindi facilmente collassabili, si trovano tutte circondate da tessuto polmonare, per cui risentono dell’aumentata pressione esercitata al loro esterno durante l’espirazione forzata (compressione) e tendono a collassare, creando una riduzione progressiva del flusso.
Il punto delle vie aeree nel quale, durante l’espirazione forzata, la pressione interna equivale a quella pleurica è detto equal pressure point (EPP) e si sposta durante questa fase espiratoria dalle vie aeree centrali a quelleperiferiche (compressione dinamica).
Le vie aeree che tendono a ostruirsi in seguito alla compressione sono quelle a monte dell’EPP, cioè dove la pressione è inferiore a quella pleurica (Fig. 5.Boccaccino)
Ecco perché i flussi parziali, cioè le velocità relative al 75%, 50% e 25% della capacità vitale forzata, rappresentano, a mano a mano che ci si sposta verso la parte finale dell’espirazione (FEF 75), la limitazione al flusso delle vie aeree più distali (piccole vie aeree).
La spirometria risente in modo indiretto dell’alterata elasticità polmonare che sfocia in una riduzione del flusso espiratorio, soprattutto nella zona sforzo-indipendente.
Proprio su questo caratteristico comportamento della limitazione al flusso è basata la diagnostica spirometrica dell’asma, sia per la riduzione del FEV1, che comprende però anche la parte sforzo-dipendente, sia per la riduzione dei flussi parziali (sforzo-indipendenti).
Ostruzione respiratoria
L’ostruzione respiratoria può avvenire a diversi livelli: laringe, trachea, grossi e medi bronchi, piccole vie aeree.
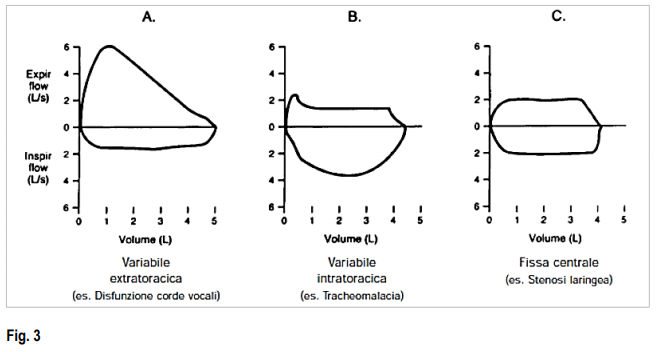
La morfologia della curva FV avrà un aspetto differente a seconda dei vari tipi di ostruzione (Fig.3.Boccaccino).
Nel caso dell’asma (Fig. 4.Boccaccino) il grado di ostruzione varia e così il tipo di reperto, che può essere rappresentato dalla sola riduzione dei flussi parziali con FEV1 e FVC normali (ostruzione delle piccole vie aeree) o dalla riduzione anche del FEV1 con FVC normale e riduzione dell’I.T. al di sotto dell’85%.
Nei gradi severi, con aumento del volume residuo vi sarà una riduzione della FVC, determinata da una collassabilità estremamente facile delle vie aeree che non consentono il normale svuotamento dei polmoni (airtrapping).
Il FEV1 è l’indice respiratorio più strettamente correlato a una valutazione prognostica dell’asma. Un aumento della sensibilità prognostica potrebbe essere ottenuto, come suggerito da alcuni autori, usando il rapporto FEF 25-75/FVC.
Curve flusso-volume
(A) Normale. La parte inspiratoria della curva è simmetrica e convessa. La parte espiratoria è lineare. Il flusso d’aria a metà della capacità inspiratoria e il flusso d’aria a metà della capacità espiratoria sono spesso misurati e comparati. Il flusso d’aria inspiratorio massimo al 50% della capacità vitale forzata (MIF 50% CVF) è maggiore rispetto al flusso d’aria espiratorio massimo al 50% della CVF (capacità vitale forzata) (MEF 50% CVF) poiché durante l’espirazione si verifica una compressione dinamica delle vie aeree.
(B) Disturbi ostruttivi (p. es., enfisema, asma). Sebbene tutte le velocità di flusso d’aria siano diminuite, il prolungamento dell’espirazione predomina e il MEF < MIF. A volte, il picco di flusso espiratorio è utilizzato per valutare il grado di ostruzione delle vie aeree ma è condizionato dallo sforzo del paziente.
(C) Malattia restrittiva (p. es., malattia polmonare interstiziale, cifoscoliosi). Il gap è ridotto a causa della diminuzione dei volumi polmonari. I flussi d’aria sono maggiori del normale a parità di volume polmonare, poiché l’aumentato ritorno elastico dei polmoni mantiene le vie aeree aperte.
(D) Ostruzione fissa delle vie aeree superiori (p. es., stenosi tracheale, gozzo). La parte alta e bassa delle curve sono appiattite cosicché la conformazione ricorda quella di un rettangolo. L’ostruzione fissa limita i flussi sia durante l’inspirazione che durante l’espirazione e il MEF = MIF.
(E) Ostruzione extratoracica variabile (p. es., paralisi monolaterale delle corde vocali, disfunzione delle corde vocali). Quando una sola corda vocale è paralizzata, si muove passivamente con il gradiente di pressione attraverso la glottide. Durante l’inspirazione forzata, è tirata all’interno, causando un plateau di flusso inspiratorio diminuito. Durante l’espirazione forzata, viene passivamente spinta di lato e il flusso espiratorio è alterato. Perciò, MIF 50% CVF (capacità vitale forzata) < MEF 50% CVF (capacità vitale forzata).
(F) Ostruzione intratoracica variabile (p. es., tracheomalacia). Durante un’inspirazione forzata, una pressione pleurica negativa mantiene la trachea mobile aperta. Con l’espirazione forzata, la perdita del supporto strutturale provoca il restringimento tracheale e un plateau della diminuzione di flusso. Il flusso d’aria viene mantenuto brevemente prima che si verifichi la compressione delle vie aeree.
La curva flusso-volume richiede la misura dei volumi polmonari assoluti. Sfortunatamente, molti laboratori costruiscono il grafico del flusso d’aria rispetto alla CVF (capacità vitale forzata); la curva flusso-CVF non ha un tratto inspiratorio e perciò non fornisce molte informazioni.
Quadri patologici
Sulla base delle velocità di flusso e dei volumi polmonari, è possibile classificare come ostruttive o restrittive la maggior parte delle patologie respiratorie ( Cambiamenti fisiologici caratteristici associati a disturbi polmonari ).
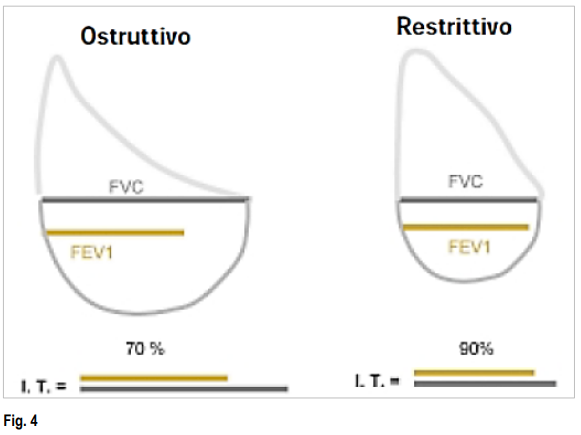
Patologie ostruttive
Le patologie ostruttive sono caratterizzate dalla riduzione del flusso d’aria, in modo particolare del FEV1 e del FEV1 espresso come percentuale della CVF (FEV1/CVF). Il grado di riduzione del FEV1 comparato con i valori previsti determina il grado del difetto ostruttivo (Gravità dei disturbi polmonari ostruttivi e restrittivi*, †). I difetti ostruttivi sono causati da
- Maggiore resistenza al flusso d’aria a causa di anomalie interne del lume delle vie aeree (p. es., neoplasie, secrezioni, ispessimento della mucosa)
- Alterazioni della parete delle vie aeree (p. es., contrazioni dei muscoli lisci, edema)
- Riduzione del ritorno elastico (p. es., la distruzione parenchimale che si verifica nell’enfisema).
Con la velocità ridotta del flusso d’aria, i tempi espiratori sono più lunghi del normale e l’aria può rimanere intrappolata all’interno dei polmoni a causa dello svuotamento incompleto e dell’aumento dei volumi polmonari (p. es., capacità polmonare totale, volume residuo).
Il miglioramento del FEV1 o del FEV1/CVF ≥ 12% o di 200 mL in seguito alla somministrazione di un broncodilatatore conferma la diagnosi di asma o di ipersensibilità delle vie aeree. Tuttavia, alcuni pazienti affetti da asma possono avere una funzionalità respiratoria e parametri spirometrici normali tra una crisi e l’altra. Qualora il sospetto di asma rimanga elevato nonostante normali risultati della spirometria, è indicato il test di provocazione con la metacolina, analogo sintetico dell’acetilcolina che si comporta come un irritante bronchiale aspecifico, al fine di riconoscere o escludere la broncocostrizione. Nel test di provocazione alla metacolina, i parametri spirometrici vengono misurati in condizioni basali e dopo inalazione di concentrazioni crescenti di metacolina. La concentrazione di metacolina che causa un calo del 20% FEV1 è chiamata PC20. I laboratori hanno diverse definizioni di reattività delle vie aeree, ma in generale i pazienti, quando mostrano almeno una riduzione del FEV1 del 20% rispetto al valore di base (PC20), quando la concentrazione di metacolina inalata è < 1 mg/mL, è considerata diagnostica di un aumento della reattività bronchiale, mentre una PC20 > 16 mg/mL esclude la diagnosi. Valori di PC20 compresi tra 1 e 16 mg/mL sono dubbi.
Il test da sforzo può essere utilizzato per identificare la broncocostrizione indotta dallo sforzo ma è meno sensibile del test di provocazione con metacolina nell’individuare un’ipersensibilità generalizzata delle vie aeree. Il paziente viene sottoposto a un livello costante di lavoro sul tapis roulant o sul ciclo-ergometro per 6-8 minuti a un’intensità tale da determinare una frequenza cardiaca pari all’80% della frequenza massima prevista. Il FEV1 e la CVF (capacità vitale forzata) vengono misurati prima e dopo 5, 15 e 30 minuti di esercizio. Il broncospasmo indotto dallo sforzo, dopo l’esercizio, comporta un FEV1 o una CVF ≥ 15%.
L’iperventilazione volontaria eucapnica può anche essere utilizzata per indurre e diagnosticare la broncocostrizione indotta dall’esercizio fisico, ed è il metodo accettato dal Comitato Olimpico Internazionale. L’iperventilazione volontaria eucapnica comporta l’iperventilazione con una miscela di gas di 5% di diossido di carbonio e di 21% di ossigeno all’85% della massima ventilazione volontaria per 6 min. Il FEV1 viene poi misurato a intervalli specifici dopo il test. Come per altri test di provocazione bronchiale, il calo di FEV1 che è diagnostico nel broncospasmo indotto varia nei diversi laboratori.
Patologie restrittive
Un disturbo restrittivo è caratterizzato da una riduzione del volume polmonare, specificamente, una CPT (capacità polmonare totale) < 80% del valore predetto. Tuttavia, nella malattia restrittiva precoce, la capacità polmonare totale può essere normale (come risultato di un forte sforzo inspiratorio) e l’unica anomalia potrebbe essere una riduzione del volume residuo. La riduzione della CPT (capacità polmonare totale) determina la gravità della restrizione ( Gravità dei disturbi polmonari ostruttivi e restrittivi*, † ). La riduzione dei volumi polmonari provoca una riduzione delle velocità di flusso (FEV1 ridotto, Curve flusso-volume B). Tuttavia, il flusso d’aria rispetto al volume polmonare risulta aumentato, per cui il FEV1/CVF è normale o aumentato.
I difetti restrittivi sono determinati dalle seguenti cause:
- Perdita di volume polmonare (p. es., lobectomia)
- Anomalie delle strutture che circondano il polmone (p. es., patologie pleuriche, cifosi, obesità)
- Debolezza dei muscoli inspiratori (p. es., disturbi neuromuscolari)
- Anomalie del parenchima polmonare (p. es., fibrosi polmonare )
La caratteristica comune a tutti i casi è una riduzione della compliance dei polmoni, della parete toracica o di entrambi.
Gravità dei disturbi polmonari ostruttivi e restrittivi*, †
|
Gravità |
Ostruttivo | Restrittivo | |
| FEV1/CVF (% del predetto) | FEV1 (% del predetto) | CPT (capacità polmonare totale) (% del predetto) | |
| Normale | ≥ 70 | ≥ 80 | ≥ 80 |
| Lieve | < 70 | ≥ 80 | 70-79 |
| Moderato | < 70 | 50 ≤ FEV1 < 80 | 50-69 |
| Grave | < 70 | 30 ≤ FEV1 < 50 | < 50 |
| Molto grave | < 70 | < 30 oppure< 50 con insufficienza respiratoria cronica | — |
| *La gravità si basa principalmente su FEV1/CVF e FEV1 per i disturbi ostruttivi e CPT per i disturbi restrittivi. | |||
| †I criteri variano a seconda delle linee guida. | |||
| FEV1 = volume espiratorio forzato in 1 secondo; CVF = capacità vitale forzata; CPT = capacità polmonare totale. | |||
Patologie miste
Vi sono alterazioni a livello polmonare sia di tipo restrittivo che ostruttivo. L’indice di Tiffenau è < 70% e la capacità vitale totale è < 80%, rispetto ai valori di riferimento.
Nell’asma bronchiale, la patologia si manifesta ad accessi, si alternano periodi di benessere con attacchi asmatici transitori più o meno frequenti. Di conseguenza, è possibile che durante la visita clinica e l’esame spirometrico tutti i parametri siano perfettamente normali, tuttavia i soggetti asmatici hanno una maggiore reattività bronchiale (i loro bronchi si “chiudono” più facilmente rispetto al normale in seguito a stimoli broncocostrittori). Attraverso uno specifico test (test di provocazione alla metacolina) si può slatentizzare questa iper-reattività bronchiale e diagnosticare un’asma bronchiale, nonostante una spirometria basale nella norma. Si somministra al paziente la metacolina, una molecola che stimola i recettori muscarinici del sistema nervoso parasimpatico delle cellule muscolari bronchiali determinando broncocostrizione. Per diagnosticare una iper-reattività bronchiale la FEV1 deve risultare < 20% rispetto al valore basale misurato con la spirometria precedente al test.
Vie aeree centrali
La morfologia della curva FV può indicarci se l’ostruzione è a livello delle alte vie aeree o se siamo di fronte a un’ostruzione delle vie aeree centrali (Fig. 3).
La porzione inspiratoria della curva non risente dell’effetto di compressione dinamica, poiché le vie aeree si trovano in una situazione di pressione maggiore rispetto a quella pleurica, quindi non ha valore diagnostico nell’asma.
Nelle forme di ostruzione glottica, tracheale o da compressione neoplastica della trachea tale porzione inspiratoria tende ad appiattirsi.
La curva espiratoria risulta appiattita nelle ostruzioni fisse delle vie aeree superiori.
Fattori che influenzano l’esame
L’esame non può essere prescritto in caso di:
- emottisi (fuoriuscita di sangue dal cavo orale proveniente da un’emorragia dell’apparato respiratorio),
- pneumotorace (accumulo di aria anomalo all’interno dello spazio che separa il polmone dalla parete toracica),
- recente intervento chirurgico addominale o toracico,
- trauma toracico,
- infarto del miocardio nei tre mesi precedenti l’esame o angina instabile,
- aneurisma toracico o aneurisma aorticonei tre mesi precedenti l’esame,
- recenti interventi chirurgici agli occhi o distacco di retina,
- chirurgia cardiaca a cielo aperto,
- infezioni respiratorie in atto,
- ictus.
Possono alterare il risultato del test per la scarsa collaborazione del paziente le seguenti condizioni:
- incontinenza urinaria,
- dolore toracicoo addominale,
- demenza e in generale un’alterazione dello stato mentale,
- nausea.
Ulteriori approfondimenti: altre prove respiratorie
Oltre alla spirometria che resta una delle tecniche diagnostiche più valide per la rivelazione di anomalie respiratorie, esistono altri esami che possono affiancarla per giungere ad una diagnosi più certa.
- Pletismografia. Si tratta di una particolare tecnica che consente di misurare il grado di capacità dei polmoni di distendersi in seguito all’entrata dell’aria. E’ importante per diagnosticare un’enfisema polmonare oppure l’asma bronchiale nei pazienti a rischio;
- Test di diffusione del monossido di carbonio (DLCO). Si tratta di un esame specifico che consente di valutare l’efficienza degli scambi gassosi tra gli alveoli polmonari e il sangue. In parole più semplici consente di capire se esistono ostacoli o meno al passaggio dei gas (ossigeno ed anidride carbonica) a livello della membrana che riveste i capillari che circondano gli alveoli. L’esame si esegue in apnea ed è necessario che il fiato venga trattenuto per circa 10 secondi. La ridotta capacità respiratoria del paziente rappresenta un limite all’esecuzione di questo test;
- Test di broncodilatazione o Test di reversibilità
È semplice da eseguire e fornisce utili indicazioni sulla componente broncostrittiva del paziente in esame.Può essere utile oltre che nel bambino con anomalie spirometriche anche nel bambino con valori basali solo apparentemente normali.
Dopo aver praticato una spirometria basale si somministra salbutamolo per aerosol e si esegue una nuova spirometria dopo 20 minuti.
La dose di salbutamolo può essere somministrata anche sotto forma di spray predosato in dose terapeutica o
in dose maggiore al fine di ottenere il massimo dell’effetto broncodilatante (noi preferiamo somministrare 400 mcg spray con distanziatore).
L’indice più importante da valutare è il FEV1, che indica un test positivo se si innalza del 12% rispetto al valore basale.
Il FEF 25-75, essendo un indice molto variabile, va preso in considerazione solo se aumenta oltre il 45% e mai da solo, ma considerando sempre la storia clinica del soggetto, valutandolo nel tempo con altre spirometrie e con altri test di funzionalità respiratoria e assicurandosi che i valori della FVC siano normali.
La positività del test di BD è altamente indicativa per una diagnosi di asma, soprattutto se abbinata alla presenza di sintomatologia specifica.
La negatività del test di BD può dipendere sia dal fatto che i disturbi respiratori del soggetto non sono di origine asmatica, sia dalla necessità, per presenza di ipersecrezione, di una terapia antinfiammatoria prolungata, prima di ottenere un test di BD positivo.
Nei pazienti con asma grave potrebbe ottenersi una broncodilatazione quantitativamente meno intensa che in quelli con asma di media entità.
Ciò è dovuto all’edema dei tessuti, per cui è necessaria una terapia cortisonica prima di valutare un buon effetto del broncodilatante.
Un effetto paradosso (peggioramento dopo salbutamolo del FEV1) è spesso dovuto a una variazione nell’esecuzione dello sforzo eseguito o a un fenomeno di compressione dell’aria intratoracica.
Per le ragioni suddette il test di BD può dare falsi negativi, soprattutto se il paziente asmatico ha una spirometria basale perfettamente normale o ha un’asma grave.
- Test di provocazione aspecifici
Servono a misurare la reattività bronchiale del paziente in seguito alla somministrazione di stimoli broncocostrittori aspecifici quali: metacolina, aria fredda, nebbia ultrasonica.
Il test più diffuso è quello con metacolina, molto utile nell’escludere la diagnosi di asma in caso di negatività. Il suo potere predittivo negativo è superiore a quello positivo, essendo positivo anche in altre patologie respiratorie e in situazioni di iperreattività transitoria (infezione, rinite).
Trova la sua maggiore utilità allorquando vi è un sospetto di asma su base clinica con una spirometria normale e un test di broncodilatazione negativo.
Perché è importante?
La spirometria è un esame specialistico di fondamentale importanza per la diagnosi precoce di patologie a carico delle vie respiratorie in soggetti a rischio come i fumatori oppure essere funzionale alla valutazione della capacità respiratoria di chi pratica sport a livello agonistico e non.
L’esecuzione di questo esame è richiesta anche per effettuare valutazioni postoperatorie in pazienti che sono stati operati al cuore o ai polmoni e consente, inoltre, un monitoraggio molto attento dell’evoluzione delle patologie cronico ostruttive sia nel tempo che nella risposta farmacologica ai farmaci broncodilatatori.
Infine, la spirometria trova applicazione nella medicina legale per il controllo nel tempo dei lavoratori che per motivi lavorativi si trovano costantemente a contatto con polveri, vapori e fumi che possono compromettere la loro capacità respiratoria e, nella peggiore delle ipotesi, andare incontro ad una invalidità polmonare.
Come si esegue?
Affinché l’esame si svolga in modo corretto, è necessario seguire scrupolosamente le indicazioni fornite dall’operatore prima di procedere alla spirometria vera e propria. Prima di iniziare l’esame vi verrà chiuso il naso con uno stringinaso (molto simile a quello che si usa in piscina per evitare l’ingresso dell’acqua all’interno del naso) che consentirà all’aria di fuoriuscire esclusivamente dalla bocca evitando dispersioni. Il paziente dovrà respirare all’interno dello spirometro servendosi di un opportuno boccaglio munito di filtro antibatterico monouso che eviterà l’ingresso di batteri e piccole particelle all’interno dello strumento.
Advertisement

In un primo momento il paziente dovrà respirare normalmente per alcuni secondi in modo da ambientare lo spirometro per poi inspirare profondamente al segnale dell’operatore e svuotarli completamente, effettuando l’operazione anche più di una volta.
La durata dell’esame è di circa 15 minuti e può capitare di ripetere l’esame dopo 20 minuti dopo che il paziente ha inalato un farmaco broncodilatatore in spray.
Se la spirometria viene eseguita dopo che sia stato somministrato il farmaco in questione si parla di prova di reversibilità e consente di effettuare una diagnosi differenziale tra asma e BPCO.
Cosa sapere prima dell’esame?
Prima di sottoporsi alla spirometria c’è una preparazione specifica da seguire in modo tale da non alterare i risultati dell’esame. Se si stanno utilizzando farmaci antistaminici o broncodilatatori per inalazione è necessario sospenderli per almeno 8-12 ore prima di sottoporsi all’esame. Prima di procedere, l’operatore raccoglie una serie di informazioni di carattere generale sul paziente al fine di individuare eventuali controindicazioni all’esame come traumi all’addome o al torace, interventi di cataratta, malattie cardiovascolari in fase di assestamento, aneurismi, embolia polmonare, angina pectoris, nausea e vomito.
L’operatore, inoltre, raccoglierà dati sulla composizione fisica come il calcolo dell’indice di massa corporea per età, peso, altezza e sesso del paziente.
E dopo l’esame?
Advertisement
La spirometria non richiede particolari precauzioni successive e si possono riprendere senza problemi le normali attività quotidiane. Il referto e i risultati dell’esame sono in genere disponibili alla conclusione della procedura: giusto il tempo di consentire al medico di elaborare i risultati appena registrati. Le casistiche possibili (che possono essere di grado lieve, moderato, grave e severo) sono:
- respiro nella norma;
- presenza di patologia ostruttiva;
- presenza di patologia restrittiva;
- compresenza di patologia ostruttiva e restrittiva.
In base ai risultati ottenuti, il medico potrà decidere o meno di indagare più a fondo la questione consigliando al paziente di eseguire ulteriori analisi che riportiamo alla fine della guida.
Ci sono rischi: fa male?
La spirometria non è né rischiosa e né dolorosa. Si tratta di un esame non invasivo, sicuro e ben tollerato dal paziente dato che non prevede alcun contatto con le strutture interne del paziente. Tuttavia, può accadere che gli stimoli frequenti di tosse o dolori al torace rendano difficile l’esecuzione dell’esame con risultati che talvolta si discostano da quelli che poi rappresentano la realtà effettiva dello stato di salute.
BIBLIOGRAFIA ESSENZIALE
^ American Academy of Allergy, Asthma, and Immunology, Five Things Physicians and Patients Should Question – Choosing Wisely: an initiative of the ABIM Foundation (PDF), su choosingwisely.org, American Academy of Allergy, Asthma, and Immunology. URL consultato il 4 giugno 2014.
^ Bateman E.D., Hurd S.S.; Barnes P.J.; Bousquet J.; Drazen J.M.; Fitzgerald M.; Gibson P.; Ohta K.; O’Byrne P.; Pedersen S.E.; Pizzichini E.; Sullivan S.D.; Wenzel S.E.; Zar H.J., Global strategy for asthma management and prevention: GINA executive summary, in European Respiratory Journal, vol. 31, n. 1, 2008, pp. 143–178, DOI:10.1183/09031936.00138707, PMID 18166595.
^ Berglund E, Birath G; Bjure J; Grimby G; Kjellmer I; Sandqvist L, Soderholm B, Spirometric studies in normal subjects. I. Forced expirograms in subjects between 7 and 70 years of age, in Acta Med Scand, vol. 173, febbraio 1963, pp. 185–92, PMID 13970718.
^ Cherniack RM, Raber MB, Normal standards for ventilatory function using an automated wedge spirometer, in Am. Rev. Respir. Dis., vol. 106, n. 1, Lug 1972, pp. 38–46, PMID 5036832.
^ Ciprandi Giorgio, Cirillo Ignazio, Forced expiratory flow between 25% and 75% of vital capacity may be a marker of bronchial impairment in allergic rhinitis, in Journal of Allergy and Clinical Immunology, vol. 127, n. 2, febbraio 2011, pp. 549–549, DOI:10.1016/j.jaci.2010.10.053
^ Crapo RO, Morris AH, Standardized single breath normal values for carbon monoxide diffusing capacity, in Am. Rev. Respir. Dis., vol. 123, n. 2, febbraio 1981, pp. 185–9, PMID 7235357.
^ Crapo RO, Morris AH, Gardner RM, Reference spirometric values using techniques and equipment that meet ATS recommendations, in Am. Rev. Respir. Dis., vol. 123, n. 6, Giu 1981, pp. 659–64, PMID 7271065.
^ Crapo RO, Morris AH, Clayton PD, Nixon CR, Lung volumes in healthy nonsmoking adults, in Bull Eur Physiopathol Respir, vol. 18, n. 3, 1982, pp. 419–25, PMID 7074238.
^ Expert Panel Report 3: Guidelines for the Diagnosis and Management of Asthma (PDF), National Institutes of Health edizione= NIH Publication Number 08-5846, 2007. URL consultato il 4 maggio 2019 (archiviato dall’url originaleil 2 luglio 2014).
^ Hankinson JL, Odencrantz JR, Fedan KB, Spirometric reference values from a sample of the general U.S. population, in Am. J. Respir. Crit. Care Med., vol. 159, n. 1, gennaio 1999, pp. 179–87, DOI:10.1164/ajrccm.159.1.9712108, PMID 9872837.
^ Hedenström H, Malmberg P, Agarwal K, Reference values for lung function tests in females. Regression equations with smoking variables, in Bull Eur Physiopathol Respir, vol. 21, n. 6, 1985, pp. 551–7, PMID 4074961.
^ Hedenström H, Malmberg P, Fridriksson HV, Reference values for lung function tests in men: regression equations with smoking variables, in Ups. J. Med. Sci., vol. 91, n. 3, 1986, pp. 299–310, PMID 3811032.
^ Knudson RJ, Lebowitz MD, Holberg CJ, Burrows B, Changes in the normal maximal expiratory flow-volume curve with growth and aging, in Am. Rev. Respir. Dis., vol. 127, n. 6, Giu 1983, pp. 725–34, PMID 6859656.
^ Langhammer A, Johnsen R, Gulsvik A, Holmen TL, Bjermer L, Forced spirometry reference values for Norwegian adults: the Bronchial Obstruction in Nord-Trøndelag Study, in Eur. Respir. J., vol. 18, n. 5, novembre 2001, pp. 770–9, PMID 11757626.
^ Lausted C., Johnson A.; Scott W.; Johnson M.; Coyne K.; Coursey D., Maximum static inspiratory and expiratory pressures with different lung volumes, in Biomedical engineering online, vol. 5, n. 1, 2006, p. 29, DOI:10.1186/1475-925X-5-29, PMC 1501025, PMID 16677384.
Lombardi A, Boccaccino A. Prove di funzionalità respiratoria. Pneumologia Pediatrica. Vol 16, n° 62, 2016
^ Lungfunktion — Practice compendium for semester 6. Department of Medical Sciences, Clinical Physiology, Academic Hospital, Uppsala, Sweden.
^ Pérez Luis Liu, Office spirometry, in Osteopathic Family Physician, vol. 5, n. 2, marzo 2013, pp. 65-69, DOI:10.1016/j.osfp.2012.09.003.
^ Salta a:a b c d e f g h Pierce R, Spirometry: an essential clinical measurement, in Aust Fam Physician, vol. 34, n. 7, Lug 2005, pp. 535–9, PMID 15999163. URL consultato il 4 giugno 2014.
Respirazione; Baumann R, Kurtz A; Fisiologia, III edizione; a cura di Klinke R, Pape H-C, Kurtz A, Silbernagl S; EdiSES, Napoli, 2012.
^ Roca J, Sanchis J, Agusti-Vidal A, Segarra F, Navajas D, Rodriguez-Roisin R, Casan P, Sans S, Spirometric reference values from a Mediterranean population, in Bull Eur Physiopathol Respir, vol. 22, n. 3, 1986, pp. 217–24, PMID 3730638.
^ Ronald B.George, Chest medicine: essentials of pulmonary and critical care medicine, Lippincott Williams & Wilkins, 2005, p. 96, ISBN 978-0-7817-5273-2.
^ Rossi A, Gottfried SB, Zocchi L, Higgs BD, Lennox S, Calverley PM, Begin P, Grassino A, Milic-Emili J, Measurement of static compliance of the total respiratory system in patients with acute respiratory failure during mechanical ventilation. The effect of intrinsic positive end-expiratory pressure, in Am. Rev. Respir. Dis., vol. 131, n. 5, Mag 1985, pp. 672–7, PMID 4003913.
^ Shah S, Sharma G, Current clinical diagnostic tests for asthma, in Adv. Exp. Med. Biol., vol. 795, 2014, pp. 75–80, DOI:10.1007/978-1-4614-8603-9_5, PMID 24162903.
^ Silvestri IC, Pereira CA, Rodrigues SC, Comparison of spirometric changes in the response to bronchodilators of patients with asthma or chronic obstructive pulmonary disease, in J Bras Pneumol, vol. 34, n. 9, settembre 2008, pp. 675–82, PMID 18982204. URL consultato il 4 giugno 2014.
^ Simon Michael R., Chinchilli Vernon M.; Phillips Brenda R.; Sorkness Christine A.; Lemanske Jr.Robert F.; Szefler Stanley J.; Taussig, Lynn; Bacharier Leonard B.; Morgan Wayne, Forced expiratory flow between 25% and 75% of vital capacity and FEV1/forced vital capacity ratio in relation to clinical and physiological parameters in asthmatic children with normal FEV1 values, in Journal of Allergy and Clinical Immunology, vol. 126, n. 3, Set 2010, pp. 527–534.e8, DOI:10.1016/j.jaci.2010.05.016.
Spirometry: an essential clinical measurement; Pierce R; Australian family phisician; The Royal Australian College of General Practitioners; Victoria, Jul 2005.
Spirometry, Don’t Blow It!; Lange NE, Mulholland M, Kreider ME; Chest; American College of Chest Physicians; Elsevier, Aug 2009.
Spirometry and Bronchodilator Test; Sim YS, Lee JH, Lee WY, Suh DI; Tubercolosis and respiratory disease; The Korean Academy of Tuberculosis and Respiratory Diseases; Apr 2017.
^ Stanojevic S, Wade A, Stocks J, Hankinson J, Coates AL, Pan H, Rosenthal M, Corey M, Lebecque P, Cole TJ, Reference ranges for spirometry across all ages: a new approach, in Am. J. Respir. Crit. Care Med., vol. 177, n. 3, febbraio 2008, pp. 253–60, DOI:10.1164/rccm.200708-1248OC, PMC 2643211, PMID 18006882.
^ Sud A, Gupta D, Wanchu A, Jindal SK, Bambery P, Static lung compliance as an index of early pulmonary disease in systemic sclerosis, in Clin. Rheumatol., vol. 20, n. 3, 2001, pp. 177–80, PMID 11434468.
^ Salta a:a b Tan RA, Spector SL, Provocation studies in the diagnosis of occupational asthma, in Immunol Allergy Clin North Am, vol. 23, n. 2, Mag 2003, pp. 251–67, PMID 12803362.