OTOTOSSICITÀ: ANTIBIOTICI AMINOGLICOSIDICI
Parole chiave : antibiotici aminoglicosidici, diuretici dell’ansa, farmaci antineoplastici, derivati salicilati, eritromicina, minociclina
|
· OTOTOSSICI EXTRAPROFESSIONALI Farmaci · Antibiotici con buone prove per Ototossicità · Antibiotici per il quale esiste qualche sospetto di Ototossicità
|
|
· Aspirina e farmaci correlati
· OTOTOSSICI PROFESSIONALI
· Statistiche sulla Ototossicità
· Fattori di rischio per l’Ototossicità
· Progressione di Ototossicità
· Esame clinico dell’Ototossicità
· Come viene diagnosticata l’Ototossicità?
· Come viene trattata l’Ototossicità ?
· Approfondimento Farmaci
Che cosa è l’Ototossicità
l’Ototossicità è, molto semplicemente, l’avvelenamento dell’orecchio (oto = orecchio, tossicità = avvelenamento), che deriva dalla esposizione a farmaci o sostanze chimiche che danneggiano l’orecchio interno o il nervo cocleovestibolare . Poiché nell’orecchio interno c’è sia l’organo uditivo ,che dell’equilibrio, l’ototossicità può provocare disturbi di uno o entrambi questi sensi. Tali danni possono portare a perdita uditiva temporanea o permanente, e / o a perdita dell’equilibrio. Le sostanze ototossiche includono diversi farmaci (ad esempio antibiotici aminoglicosidi , alcuni agenti anti-cancro , ciclo diuretici , farmaci anti-malarici e l’aspirina ), ed altre sostanze ambientali (ad esempio mercurio, piombo e arsenico). La tabella elenca alcuni dei farmaci ototossici più comunemente usati e le sostanze.
|
|
|
|
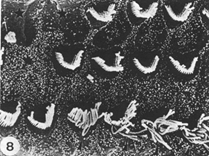
Normale organizzazione organo di corti |
Stereociglia danneggiate dalla somministrazione di amminoglicosidi |
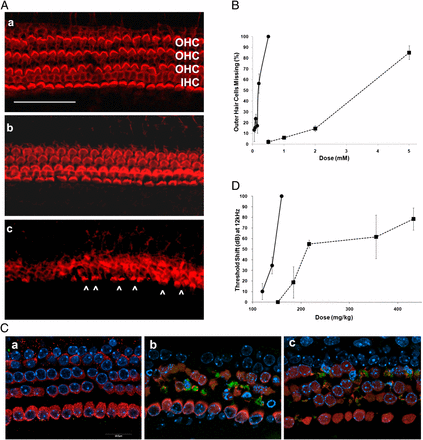
Tabella 1. Comuni sostanze note per essere associate con ototossicità 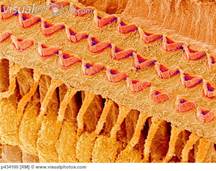
|
Tipo / gruppo |
Denominazione della sostanza ototossiche |
|
Antibiotici aminoglicosidici |
Gentamicina, streptomicina, tobramicina, neomicina, netilmicina, kanamicina, amikacina, diidrostreptomicina, ribostamicina |
|
Antibiotici non aminoglicosidi |
Vancomicina, eritromicina |
|
Diuretici dell’ansa |
Furosemide, acido etacrinico, bumetanide, torsemide |
|
Agenti chemioterapici |
Cisplatino, carboplatino, mostarda azotata |
|
Salicilati |
Aspirina |
|
I farmaci anti-malarici |
Chinina, clorochina |
|
Sostanze chimiche ambientali e altre sostanze |
Piombo, mercurio, ossido di carbonio, arsenico, disolfuro di carbonio, stagno, esano, toluene, alcool |
OTOTOSSICI EXTRAPROFESSIONALI
Farmaci
ANTIBIOTICI
Penicilline di nuova generazione
ANTIBIOTICI CON BUONA PROVA PER ototossicità
|
Farmaci |
Vestibolotossici |
Otossici |
Livello di Tossicità |
|
Amikacina |
non tossico |
13,9% |
|
|
Azitromicina |
non nota |
occasionale |
richiesta una dose molto alta |
|
Capreomicina |
sì |
||
|
Cloramfenicolo |
sì |
solo in rapporti sporadici |
|
|
Claritromicina |
occasionale |
||
|
Dibekacina |
sì |
sì |
|
|
Diidrostreptomicina |
minore tossicità |
molto tossico |
|
|
Eritromicina |
sì |
Dosi elevate IV solo |
|
|
8,6% |
minore |
|
|
|
Metronidizolo |
tossica (raramente) |
sconosciuto |
|
|
Neomicina |
minore |
molto tossico |
Sotto forma di gocce topiche per le orecchie |
|
Netilmicina |
Sì |
2,4% |
|
|
Polimixina B |
Sotto forma di gocce per le orecchie |
||
|
Streptomicina |
molto tossico |
minore |
|
|
Tobramicina |
Sì |
minore 6% |
Meno tossico della Gentamicina |
|
tossico o raramente tossici |
nessuno a moderata |
Sinergia con la gentamicina |
Aminoglicosidi
Fin dalla loro introduzione nel 1944, molteplici preparazioni aminoglicosidi sono resi disponibili, tra cui la streptomicina, diidrostreptomicina, kanamicina, gentamicina, neomicina, tobramicina, netilmicina, e amikacina. Gli aminoglicosidi sono antibiotici battericidi che si legano al ribosoma 30S e inibiscono la sintesi proteica batterica. Sono attivi solo contro i bacilli aerobi gram-negativi e cocchi.
Anche se gli effetti ototossici di aminoglicosidi sono ben documentati, questa classe di farmaci è ancora ampiamente usato oggi. Aminoglicosidi possono essere utilizzati in combinazione con penicillina in stafilococco, streptococco, e, soprattutto, endocardite enterococchi. Un aminoglicoside è spesso aggiunto ad un antibiotico beta-lattamici, quando gravi Pseudomonas aeruginosa infezioni sono trattate. Aminoglicosidi possono essere efficaci nel trattamento della tubercolosi. Gruppi particolari di pazienti, compresi quelli con fibrosi cistica , disfunzione immunitaria, e certa malattia infettiva cronica, hanno maggiori probabilità di essere trattati con questa classe di antibiotici.
Di tutti i farmaci ototossici, gli aminoglicosidi sono i più vestibulotoxic, anche se variano notevolmente nei loro effetti differenziali sul vestibolare e sistemi cocleari. [2] kanamicina, amikacina, neomicina, e diidrostreptomicina sono preferenzialmente cochleotoxic. Gentamicina colpisce sia cocleare e sistemi vestibolari; Tuttavia, la maggior parte autori includono gentamicina principalmente come vestibulotoxic. Streptomicina, tobramicina e netilmicina sono principalmente vestibulotoxic.
Fisiopatologia
Tossicità degli aminoglicosidi rivolge principalmente renale e sistemi cocleovestibolari; Tuttavia, non esiste una chiara correlazione tra grado di nefrotossicità e ototossicità. Tossicità cocleare che si traduce in perdita di udito di solito inizia nelle alte frequenze ed è secondaria alla distruzione irreversibile delle cellule ciliate esterne in organo del Corti, prevalentemente a cavallo basale della coclea. Nell’apparato vestibolare, cellule cigliate di tipo I sono più sensibili delle cellule cigliate di tipo II. [3]
Gli aminoglicosidi sono liquidati più lentamente dai liquidi dell’orecchio interno che dal siero e quindi una latenza esiste al ototossica effetti di aminoglicosidi. Questa latenza può determinare la progressione della perdita o insorgenza di perdita dell’udito dopo l’interruzione del trattamento aminoglicosidi dell’udito. Continuando a monitorare il paziente per gli effetti cochleotoxic e vestibulotoxic fino a 6 mesi dopo l’interruzione del trattamento con aminoglicosidi è importante.
I meccanismi esatti di aminoglicosidi ototossicità rimangono sconosciute. Molti processi cellulari sono stati implicati, e questo continua ad essere un’area attiva di ricerca. E sembra che gli agenti aminoglicosidi devono entrare nelle cellule dei capelli per indurre la morte delle cellule. [4] Dopo l’entrata in cellule ciliate, molti meccanismi e dei processi cellulari possono essere coinvolti. Turbativa della sintesi proteica mitocondriale, formazione di radicali liberi dell’ossigeno, l’attivazione di c-Jun chinasi N-terminale (JNK), e l’attivazione delle caspasi e nucleasi possono derivarne. Aminoglicosidi hanno anche dimostrato di avere effetti diretti sui potenziali di membrana cellulare attraverso le interazioni con i canali del potassio. [5] Inoltre, l’interazione aminoglicoside con metalli di transizione come il ferro e il rame potenziare la formazione dei radicali liberi e ulteriori danni alle cellule.
In definitiva, una certa interazione di questi molti processi porta alla perdita permanente di cellule ciliate sensoriali sia nella coclea e apparato vestibolare, con conseguente perdita dell’udito permanente o di equilibrio erettile. [6, 7]
Aminoglicosidi ototossicità è probabilmente multifattoriale, e un’ulteriore indagine continua. Alcuni studi stanno indagando chelanti del ferro e antiossidanti come possibili agenti per prevenire la perdita dell’udito durante la terapia, mentre altri studi stanno esplorando forme di terapia genica come future opzioni di trattamento. Attualmente, nessun trattamento è disponibile a parte l’amplificazione e l’impianto cocleare ; Pertanto, la prevenzione è fondamentale.
Epidemiologia
In alcuni paesi, gli antibiotici sono prescritti liberamente o sono disponibili senza prescrizione medica. In queste aree, aminoglicosidi causa ben il 66% dei casi di mutismo sordi. A seconda di agente e dosaggio, fino al 33% dei pazienti adulti possono avere cambiamenti audiometrici con trattamento di aminoglicosidi. Tossicità vestibolare è anche ben documentata; si verifica in circa il 4% dei pazienti adulti. L’incidenza di pazienti che soffrono di tossicità dovuta agli aminoglicosidi possono essere in diminuzione a causa dei miglioramenti nel monitoraggio e consapevolezza.
Gli studi indicano che la tossicità cocleare da aminoglicosidi è meno comune nei neonati e nei bambini che negli adulti. L’incidenza di aminoglicosidi indotto tossicità cocleare nei neonati è stato stimato intorno al 2%. [8]
Fattori di rischio
Alcuni fattori possono mettere i pazienti ad aumentato rischio di ototossicità. Aminoglicosidi ototossicità è più probabilità di verificarsi con dosi maggiori, livelli ematici più elevati, o durata della terapia. Altri pazienti ad alto rischio sono i pazienti anziani, quelli con insufficienza renale, quelli con problemi di udito preesistenti, quelli con una storia familiare di ototossicità, e quelli che percepiscono diuretici o altri farmaci ototossici o nefrotossici.
Una predisposizione genetica esiste in RNA mitocondriale mutazione 1555A> G, che è stato trovato per essere associato con perdita di udito non sindromica e aminoglicosidi indotta. [9] Il difetto crea un’alterazione nella sintesi delle proteine mitocondriali. Pazienti cinesi con questo difetto hanno effetti più rapidi e gravi di aminoglicosidi ototossicità. Un’attenta valutazione della storia familiare è importante e può prevenire molti casi. Inoltre, alcuni hanno suggerito che le popolazioni ad alto rischio (ad esempio, pazienti con fibrosi cistica, una storia di famiglia, e disfunzione immunitaria) dovrebbero essere sottoposti a screening per questa mutazione. [10, 7]
Segni e sintomi
Clinicamente, il danno cocleare acuta può presentarsi come tinnito. Sordità precoce può non essere riconosciuti dal paziente e inizialmente manifesta come un aumento della soglia di frequenze più alte (> 4000 Hz). Con la progressione, frequenze vocali inferiori sono colpiti e il paziente può diventare sordi se il farmaco viene proseguita. Se il farmaco viene interrotto precocemente nel corso di danno, ulteriore perdita può essere impedito, e parziale recupero di soglie uditive può essere possibile. Tuttavia, la perdita è di solito permanente.
I sintomi di tossicità vestibolare includono tipicamente squilibrio e sintomi visivi. Lo squilibrio è peggiore al buio o in situazioni in cui basamento è incerto. Spinning vertigine è insolito. I sintomi visivi, chiamati oscillopsia, si verificano solo quando la testa è in movimento. Movimenti rapidi della testa sono associati con transitorio offuscamento della vista. Ciò può causare difficoltà di vedere i segni durante la guida o riconoscere i volti delle persone mentre si cammina. Clinicamente, nistagmo può essere presente come un segno precoce.
Prevenzione
Prevenzione della aminoglicosidi ototossicità comporta un attento monitoraggio dei livelli sierici di droga e la funzione renale, così come l’udito valutazioni prima, durante e dopo la terapia. Misurare basale funzione audiometrico prima della terapia; tuttavia, questo non è sempre possibile in situazioni acute. Somministrazione giornaliera riduce incidenza di ototossicità e dovrebbe essere considerata quando possibile. Coscienziosamente identificare i pazienti ad alto rischio e seleziona antibiotici alternativi per loro. Infine, perché aminoglicosidi rimangono nella coclea lungo dopo la terapia è terminata, istruire i pazienti ad evitare ambienti rumorosi per 6 mesi dopo il completamento della terapia in quanto rimangono più sensibili al rumore indotto danno cocleare.
Recenti studi sugli animali hanno coinvolto la somministrazione di spazzini dei radicali liberi, chelanti del ferro, e inibitori di vie di morte cellulare come possibili meccanismi di prevenzione ototossicità. Diversi agenti promettenti, compresa la vitamina E, acido alfa lipoico, Ebselen, e ginkgo biloba, sono stati trovati per essere otoprotective ed efficace in alcuni studi sugli animali. Ulteriori studi clinici sono necessari per determinare se i meccanismi protettivi dimostrato in studi su animali possono essere replicate in pazienti mantenendo effetti terapeutici degli aminoglicosidi. [11, 6]
Aminoglicosidi specifici
Streptomicina: Streptomicina stato il primo aminoglicosidi applicata clinicamente ed è stato usato con successo contro batteri gram-negativi in passato. Streptomicina colpisce preferenzialmente il sistema vestibolare piuttosto che il sistema uditivo. Danno vestibolare dovuti alla streptomicina è comune con l’uso prolungato e in pazienti con funzione renale compromessa. A causa della sua tossicità, ed a causa della resistenza diffusa, questo agente è usato raramente oggi. Tuttavia, l’uso streptomicina è aumentato per il trattamento della tubercolosi.
Gentamicina: Come con streptomicina, gentamicina ha una predilezione per il sistema vestibolare. Terapeutiche livelli sierici di picco di 10-12 mcg / ml sono generalmente considerati sicuri, ma possono ancora essere tossica in alcuni pazienti. Regolare accuratamente il dosaggio nei pazienti con malattia renale.
Neomicina: Questo agente è uno degli aminoglicosidi più cochleotoxic quando somministrato per via orale e in dosi elevate; Pertanto, l’uso sistemico di solito non è raccomandato. Neomycin è tra i più lenti aminoglicosidi per cancellare dalla perilymph; di conseguenza, la tossicità ritardata (1-2 sett) può derivarne dopo la sospensione della terapia. Neomicina è usato principalmente come un efficace agente otic e ototopical. Anche se neomicina è generalmente considerato sicuro se usato per via topica nel canale uditivo o su piccole lesioni cutanee, alternative altrettanto efficaci sono disponibili.
Kanamicina: Anche se meno tossico neomicina, kanamicina è abbastanza ototossico. Kanamicina ha una propensione a causare profonda danni alle cellule ciliate cocleari, marcata perdita di udito ad alta frequenza, e completa sordità. L’effetto dannoso è principalmente alla coclea, mentre il sistema vestibolare è solitamente risparmiato lesioni. Kanamicina ha limitato l’uso clinico di oggi. Come con neomicina, la somministrazione parenterale non è generalmente raccomandato.
Amikacin: amikacina è un derivato di kanamicina e ha molto poco di tossicità vestibolare. I suoi effetti negativi riguardano principalmente il sistema uditivo; tuttavia, è considerata meno ototossico di gentamicina. Nel trattamento di infezioni gravi, amikacina è indicato principalmente sulla base dei risultati di test di sensibilità e la risposta del paziente.
Tobramicina: Ototossicità di tobramicina è simile a quello di amikacina; ad alta frequenza risultati di perdita di udito. Come con kanamicina, la tossicità vestibolare è meno comune. La tobramicina è spesso utilizzato nelle preparazioni otic e di attualità. Uso topico, anche se non senza polemiche, è generalmente considerato sicuro.
Vancomicina
Anche per vancomicina sono stati descritti effetti ototossici (Tanaka et al.. 2001).
Aminoglicosidi
È documentata da tempo l’ototossicità degli aminoglicosidi (Leone et al., 2000), ed è inoltre noto che, mentre molti degli effetti collaterali degli antimicrobici sono prontamente reversibili dopo la sospensione della terapia. gli effetti ototossici mediati dagli aminoglicosidi sono irreversibili (Cunha. 2001).
Recentemente è stata descritta l’efficacia dell’iniezione intratimpanica degli aminoglicosidi nel trattamento delle vertigini in pazienti con sindrome di Ménière. In questi pazienti è stata osservata una diversa entità di danno uditivo conseguente alla somministrazione di dosi diverse del farmaco in sedi diverse. Lo studio ha dimostrato che l’ototossicità dei vari aminoglicosidi è diversa, poiché alcuni di questi sono principalmente vestibolotossici, altri ototossici. Al momento attuale, però, non sono noti i meccanismi attraverso i quali si esplica l’ototossicità o la vestibolotossicità dei diversi aminoglicosidi (Nakashima et al., 2000).
Gentamicina
L’ototossicità della gentamicina, così come per altri aminoglicosidi (neomicina solfato. tobramicina), è stata da tempo dimostrata in studi condotti su animali. Gli studi condotti sull’uomo sono minori, anche se sono stati segnalati casi di ipoacusia neurosensoriale insorta dopo applicazione topica di questo antibiotico (Morpeth et al., 2001).
Livello d’azione: in uno studio condotto su cavie sono stati osservati effetti inibitori della gentamicina sui canali del calcio delle cellule ciliate esterne apicali e basali. Si è osservato che l’ingresso di calcio è maggiormente impedito a livello basale. È stato inoltre documentato che la acidificazione extracellulare può aumentare l’effetto ototossico acuto degli aminoglicosidi sul trasporto di calcio a livello delle cellule ciliate e di ciò si deve tener conto nell’utilizzo di preparazioni otologiche (Tan et al.. 2001).
|
|
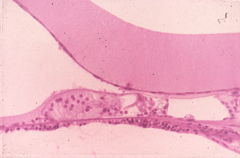
GENTAMICIN ototossicità (COCHLEAR RICOSTRUZIONE) (orecchio sinistro) Questa ricostruzione grafica della coclea mostra una perdita totale di cellule cigliate nel giro basso (basale della coclea), ed una perdita della prima fila di cellule esterne ad 8 a 10 mm (giro basale superiore). In una piccola area del piano basale (11,5 mm) c’è stata una perdita di tutte le cellule ciliate esterne. C’era anche una perdita delle cellule gangliari a spirale nella parte bassa del giro basale. (grandi cerchi indicano la presenza di cellule acustiche, i punti la mancanza .) |
|
|
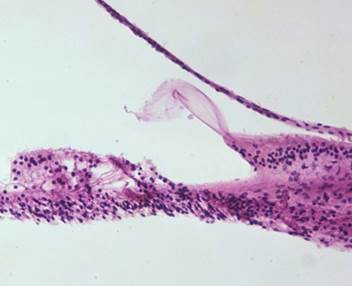
GENTAMICIN ototossicità (sezione dell’osso temporale umana) Descrizione: C’è un leggero sollevamento da artefatto della membrana tectoria; Tuttavia, l’organo del Corti è ben conservato. , mancano le cellule ciliate esterne della prima e seconda di fila. H & E 156x. |
Neomicina
Neomicina, un altro antibiotico aminoglicosido, che è stato isolato nel 1949. Ora è utilizzato principalmente per via topica a causa della tossicità renale e dell’ototossicità (per l’udito). La neomicina è scarsamente assorbita dal tratto gastrointestinale normale – circa il 97% viene escreto nelle feci. La neomicina è quasi totalmente assorbita rapidamente dalle superfici del corpo (tranne dalla vescica urinaria) dopo l’applicazione locale e quando applicato topicamente in associazione con procedure chirurgiche. Con dosi ripetute, avviene un progressivo accumulo nell’orecchio interno. Si è vista che viene rilasciato lentamente, nell’arco di alcune settimane, dopo che la somministrazione è stata interrotta. L’ototossicità con interessamento uditivo da assorbimento orale di neomicina e ‘stato segnalato (Rappaport et al, 1986) e ci può essere anche un effetto ototossico da gocce auricolari nei pazienti con perforazione del timpano. Questo problema è ancora dibbattuto (come del 12/1/98). La tossicità da neomicina ha spesso una insorgenza ritardata, che non si può rilevare anche molto tempo dopo che la neomicina è stata interrotta (Informazioni date dalla letteratura dei produttori, Teva Pharmaceuticals, 11/1999).
|
|
titolo: R-200 Neomicina Capitolo: Intossicazioni sezione Capitolo: Aminoglicosidi Ototossicità, neomicina TB numero del caso: 751 Sesso: Femmina Età (yrs.): 54 Otologic Dx: 1. Ototossicità neomicina, cocleare 2.Emorragia subaracnoidea, estensione del sangue nella coclea |
Kanamicina
Kanamicina, è anche un aminoglicoside, che è stato prodotto nel 1957, ed è stato successivamente sostituito da nuove aminoglicosidi come gentamicina, tobramicina, netilmicina, e amikacina In uno studio condotto su pulcini cui è stata iniettata kanamicina per 8 giorni consecutivi è stata osservata una distruzione completa delle cellule ciliate nell’area compresa tra 04 e 0.8 mm dalla parte finale della papilla basale (Xiang et aL. 2001).
Altri antibiotici
Macrolidi
Eritromicina è stato introdotto nel 1952 e ha visto l’uso diffuso nella medicina clinica. In generale, eritromicina è considerato un farmaco sicuro. Eritromicina è stato considerato il sostituto di scelta nel gruppo A le infezioni da streptococco e pneumococco per le persone sensibili alla penicillina. Eritromicina resta l’antibiotico di scelta per Legionella polmonite e altre polmoniti atipiche. Le prime segnalazioni di ototossicità non sono stati rilevati fino al 1973. Da allora, sono stati segnalati solo casi sporadici di ototossicità, e sono stati generalmente reversibili. Questi pazienti tendevano ad avere altri fattori di rischio, tra cui insufficienza renale, insufficienza epatica, le dosi di oltre 4 g / d, e la somministrazione per via endovenosa. Clinicamente significativa perdita dell’udito è stata anche riportata in destinatari di rene-trapiantati che sono stati trattati con eritromicina per via endovenosa. L’esordio è in genere entro 3 giorni dall’inizio del trattamento. Frequenze vocali possono essere colpite, piuttosto che le frequenze più alte. Gli effetti sono generalmente reversibili.
Azitromicina e claritromicina sono nuovi antibiotici macrolidi. Questi antibiotici hanno visto diffuso uso clinico perché hanno meno effetti collaterali GI e uno spettro antimicrobico più ampio rispetto eritromicina. Tuttavia, recentemente, alcuni rapporti sono apparse riguardo ai possibili effetti ototossici. [12] I rapporti sono attualmente sporadici e sono necessari ulteriori indagini.
Vancomicina
Vancomicina è un antibiotico glicopeptide che è stato introdotto nel 1950. E ‘un farmaco comunemente usato nella luce della sua efficacia in infezioni da stafilococco meticillina-resistenti . Diverse segnalazioni di ototossicità, di solito si manifesta come tinnito, sono stati presentati nei pazienti con concentrazioni sieriche elevate attribuiti ad insufficienza renale o nei pazienti sottoposti a terapia concomitante con aminoglicosidi. [13] I dati sono chiari, ma suggeriscono che ototossicità è reversibile, almeno in alcuni individui . Non esistono studi dimostrano prova conclusiva di ototossicità con vancomicina amministrazione da solo e in dosi terapeutiche. Non raccomandazioni sono state fatte per quanto riguarda il suo utilizzo; Tuttavia, gli autori suggeriscono cautela con la somministrazione concomitante di vancomicina e di altri agenti ototossici, e la documentazione dei livelli sierici vancomicina.
Tobramicina
La tobramicina è solo raramente associata a ototossicità (circa 1/150 di secondo Neu et al, 1986), ma non vi è una chiara prova che può produrre una sindrome vestibolare simile alla gentamicina (Barrsma, 1979; Lehmann, 1976). La maggior parte dei casi di tossicità da tobramicina si sono verificati in persone con insufficienza renale. Si è riscontrata poca ototossicità visto nei pazienti con somministrazioni ripetute (Pedersen et al, 1987; Thomesen et al, 1979), che suggerisce che possa essere gestita in modo diverso per l’orecchio. Si sospetta che la tobramicina è ototossica per i neonati, ma non ci sono prove che lo dimostrino (de Hoog et al, 2002; 2003). Negli animali, la tobramicina è molto meno ototossico della gentamicina (Bamonte et al, 1986; Kitasato, 1990; McCormick et al, 1985; Petorossi et al, 1986).
Azitromicina e claritromicina
Livello del danno: in uno studio condotto esponendo cavie in modo ripetuto ad azitromicina, claritromicina ed eritromicina, è stato osservato un danno diretto alle cellule ciliate negli animali esposti ad aminoglicosidi e non in quelli esposti a macrolidi (Uzun et al, 2001).
La somministrazione di azitromicina può indurre lo sviluppo di ipoacusia neurosensoriale irreversibile (Mamikoglu et al., 2000).
References concerning specific antibiotics:
Related to tobramycin
- Baarsma, EA and E. Rijntjes (1979). “Vestibulo-toxicity of tobramycin.” J Laryngol Otol 93 (7): 725-7.
- Bamonte, F., A. Monopoli, E. Ongini, et al. (1986). “Comparative actions of four aminoglycoside antibiotics on the vestibular function in guinea-pigs.” Arch Int Pharmacodyn Ther 282 (1): 161-76.
- de Hoog, M., BA van Zanten, WC Hop, et al. (2003). “Newborn hearing screening: tobramycin and vancomycin are not risk factors for hearing loss.” J Pediatr 142 (1): 41-6.
- Kitasato, I., M. Yokota, S. Inouye, et al. (1990). “Comparative ototoxicity of ribostamycin, dactimicin, dibekacin, kanamycin, amikacin, tobramycin, gentamicin, sisomicin and netilmicin in the inner ear of guinea pigs.” Chemotherapy 36 (2): 155-68.
- Lehmann, W., R. Hausler and FA Waldvogel (1976). “A clinical study on the ototoxic effects of tobramycin.” Arch Otorhinolaryngol 212 (3): 203-11.
- McCormick, GC, E. Weinberg, RJ Szot, et al. (1985). “Comparative ototoxicity of netilmicin, gentamicin, and tobramycin in cats.” Toxicol Appl Pharmacol 77 (3): 479-89.
- Neu, HC and CL Bendush (1976). “Ototoxicity of tobramycin: a clinical overview.” J Infect Dis 134 Suppl : S206-18.
- Pedersen, SS, T. Jensen, D. Osterhammel, et al. (1987). “Cumulative and acute toxicity of repeated high-dose tobramycin treatment in cystic fibrosis.” Antimicrob Agents Chemother 31 (4): 594-9.
- Pettorossi, VE, F. Bamonte, P. Errico, et al. (1986). “Vestibulo-ocular reflex (VOR) in guinea pigs. Impairment induced by aminoglycoside antibiotics.” Acta Otolaryngol 101 (5-6): 378-88.
- Thomsen, J. and B. Friis (1979). “High dosage tobramycin treatment of children with cystic fibrosis. Bacteriological effect and clinical ototoxicity.” Int J Pediatr Otorhinolaryngol 1 (1): 33-40.
Gli antibiotici generalmente considerati sicuri
|
Gli antibiotici generalmente considerati sicuri |
|
Aztreonam |
|
Penicilline |
|
Cefalosporine |
|
Macrolidi (es. Azitromicina ed eritromicina), tranne in dosi molto elevate. |
Macrolidi e altri antibiotici che sono solo leggermente ototossico:
Azitromicina, è un macrolide – e non nella stessa famiglia come Gentamicina. Tuttavia, ci sono rapporti occasionali di ototossicità, quando ci sono stati prolungati e alti livelli. Gli alti livelli in genere richiedono la somministrazione per via endovenosa.
Clindamicina non è stato segnalato per causare ototossicità, di per sé, ed è probabilmente sicuro.
Il cloramfenicolo è stata sporadicamente segnalata per essere sistemica ototossica.
L’ eritromicina, anche se non è un aminoglicoside come la gentamicina, è ototossico ad alte dosi per via endovenosa. (McGhan et al. 2003). McGhan e Merchant riportano un edema striale patologico in tutti i giri cocleari (in un caso singolo). Questo potrebbe spiegare la perdita di soglia relativamente piatto con una buona discriminazione vocale che è il segno distintivo dell’ ototossicità da eritromicina. Ciò potrebbe anche spiegare UNa perdita dell’udito un po’ reversibile.
In diverse occasioni è stato segnalato che il metronidizole (Flagyl) è ototossico (Blake and Butt 1984; Hibberd, Nicoll et al 1984;. Hibberd, Nicoll et al 1984;. Lawford e Sorrell 1994; Iqbal, Murthy et al 1999;. Riggs et al, 1990). fortunatamente sembra che la tossicità del Metronidizole sia rara e documentata solo da segnalazioni di casi sporadici.
Riferimenti re Metronidizole:
- Blake, P. e WE Butt (1984). “Ototossicità di metronidazolo.” NZ Med J 97 (753): 241.
- Hibberd, AD, RJ Nicoll, et al. (1984). “La sordità è una reazione avversa per l’uso profilattico di metronidazolo.” NZ Med J 97 (750): 128.
- Hibberd, AD, RJ Nicoll, et al. (1984). “Ototossicità di metronidazolo.” NZ Med J 97 (754): 275.
- Iqbal, SM, JG Murthy, et al. (1999). “Metronidazolo ototossicità – rapporto di due casi.” J Laryngol OTOL 113 (4): 355-7.
- Lawford, R. e TC Sorrell (1994). “Ascesso amebica della milza complicato da metronidazolo indotto neurotossicità:. Caso clinico” Clin Infect Dis 19 (2): 346-8.
References re macrolides:
• Bizjak, ED, MT Haug, 3rd, RJ Schilz, et al. (1999). “Intravenous azithromycin-induced ototoxicity.” Pharmacotherapy 19 (2): 245-8.
• McGhan LJ and Merchant SN (2003). “Erythromycin ototoxicity.” Otol Neurotol 24(4): 701-2.
• Mamikoglu, B. and O. Mamikoglu (2001). “Irreversible sensorineural hearing loss as a result of azithromycin ototoxicity. A case report.” Ann Otol Rhinol Laryngol 110 (1): 102.
• Ress, BD and EM Gross (2000). “Irreversible sensorineural hearing loss as a result of azithromycin ototoxicity. A case report.” Ann Otol Rhinol Laryngol 109 (4): 435-7.
• Tseng, AL, L. Dolovich and IE Salit (1997). “Azithromycin-related ototoxicity in patients infected with human immunodeficiency virus.” Clin Infect Dis 24 (1): 76-7.
• Uzun, C., M. Koten, MK Adali, et al. (2001). “Reversible ototoxic effect of azithromycin and clarithromycin on transiently evoked otoacoustic emissions in guinea pigs.” J Laryngol Otol 115 (8): 622-8.
• Uzun, C. (2003). “Tinnitus due to clarithromycin.” J Laryngol Otol 117(12): 1006-1007.
• Wallace, MR, LK Miller, MT Nguyen, et al. (1994). “Ototoxicity with azithromycin.” Lancet 343 (8891): 241.
Preparazioni Otici topici
Alcuni farmaci potenzialmente ototossici topici che vengono comunemente utilizzati nell’orecchio per il trattamento dell’otite media acuta (OMA) e otite media cronica suppurativa (CSOM) sono stati recentemente valutati e una posizione di consenso è stata presentata dalla AAO-HNS. Il farmaco ototopical più comunemente usato è una combinazione di neomicina-polimixina. Più recenti, disponibili farmaci ototopical sono dei fluorochinoloni classe, tra cui ciprofloxacina e desametasone (Ciprodex) e ofloxacina preparazioni otic.
Le seguenti raccomandazioni sono state fatte dal pannello consenso antibiotico ototopical (aggiornato 2004) [10] :
Quando possibile, preparati antibiotici topici gratuitamente potenziale ototossicità dovrebbero essere utilizzati in preferenza a preparazioni ototopical che hanno il potenziale di lesioni otologica se l’orecchio medio o mastoide è aperto. (-Aminoglicosidi contenente gocce di attualità non sono approvati dalla FDA per l’uso nell’orecchio medio).
Se usato, la preparazione di antibiotici potenzialmente ototossici deve essere utilizzato solo nelle orecchie infetti. L’uso deve essere interrotto dopo l’infezione si è risolta. Finestra rotonda permeabilità contribuisce agli effetti ototossici. I dati sugli animali suggeriscono che i ispessita, edematosa mucosa dell’orecchio medio presenti in un orecchio infetto può fornire una protezione da ototossicità.
Se potenzialmente ototossici gocce antibiotici sono prescritti per l’uso nell’orecchio medio o mastoide, il paziente / genitore dovrebbe essere avvertito del rischio di ototossicità. E dovrebbe essere incaricato di chiamare il medico deve capogiri, vertigini, perdita dell’udito o tinnito accadere. Il pannello di consenso non si sentiva uditivo di routine o di controllo vestibolare era giustificato.
Se l’orecchio medio e mastoide siano integri e chiusi, quindi l’uso di preparati potenzialmente ototossici non presentano rischi di lesioni ototossico.
Nel complesso, anche se esistono prove che il pregiudizio otologica da aminoglicosidi preparati ototopical è infrequente, l’evidenza suggerisce anche che essi offrono alcun vantaggio rispetto agenti tossici. Pertanto, questo autore scoraggia l’uso di routine di preparati ototopical neomicina per AOE e CSOM e raccomanda preparazioni fluorochinolonici, come ofloxacina gocce otic e Ciprodex gocce, soprattutto in persone con tubi aperto spazio dell’orecchio medio o dell’orecchio ventilazione.
Altri farmaci, compresi antisettici come Vosol e genziana violetta, sono stati implicati nel causare ototossicità. In preparazione per interventi chirurgici, povidone-iodio ha dimostrato di essere sicuro per interventi chirurgici dell’orecchio medio; tuttavia, clorexidina è tossico se raggiunge l’orecchio interno e non deve essere usato. [20]Altre informazioni utili sulle gocce ototossiche
Le gocce auricolari possono contenere antibiotici, alcuni dei quali possono essere ototossici se somministrato a persone con timpani perforati. La soluzione di gocce otologiche di Cortisporina sembra sia la più ototossica per la coclea delle cavie, molta meno tossiche le gocce di gentamicina. Le gocce auricolari di Ofloxacina hanno una tossicità trascurabile (Barlow et al, 1995). E’ stato segnalato che le gocce auricolari contenenti Neomicina possano contribuire alla perdita (Podoshin et al, 1989) uditiva ,ma di grado lieve , ma una valutazione definitiva del rischio non è ancora stata fatta. Non sono stati riportati casi di ototossicità con le gocce di tobramicina . La maggior parte di vestibolotossicità da gocce auricolari non è finora stata studiata, sebbene casi clinici suggeriscono che le gocce contenenti gentamicina sono tossici se somministrati per lunghi periodi di tempo.
Ci sono diverse note interazioni tra le famiglie di farmaci ototossici. Diuretici dell’ansa (vedi in seguito) potenziano la tossicità degli aminoglicosidi. La Vancomicina è sinergica con la gentamicina, in quanto è più probabile che causare tossicità, come il rumore. La Vancomicina, di per sé in dosi appropriate, non è particolarmente ototossico (Gendeh et al, 1998).
L’ototossicità ritardata , cioè la tossicità che continua per diversi mesi dopo che il farmaco è stato sospeso , è stata ben documentata perché gli aminoglicosidi sono trattenuti all’interno dell’orecchio interno molto più a lungo rispetto al sangue. E’ stato riportato che la Gentamicina persista per più di 6 mesi negli animali. E’ anche noto che la Neomicina, streptomicina e kanamicina sono eliminate lentamente dall’ orecchio interno (Thomas et al, 1992)
References regarding ototoxicity of antibiotics:
- Barlow DW, Duckert LG, Kreig CS, Gates GA. Ototoxicity of topical otomicrobial agents. Acta Otolaryngol (Stockh) 1995 Mar;115(2):231-235
- Bates RD, Nahata MC, Jones JW, McCoy K, Yong G, Cox S, Barson WJ. Pharmacokinetics and safety of tobramycin after once-daily administration in patients with cystic fibrosis. Chest 112(5):1208-13, 1997. This paper notes no ototoxicity in 18 patients for once/day administration.
- Conlon BJ, McSwain SD, Smith DW. Topical gentamicin and ethacryinic acid: effects on cochlear function. Laryngoscope 108(7):1087-9, 1998.
- de Hoog M, van Zanten GA, Hoeve LJ, Blom AM, van den Anker JN. A pilot case control follow-up study on hearing in children treated with tobramycin in the newborn period. Int J Pediatr Otorhinolaryngol 2002; 65: 225-32.
- Edson RS, Terrell CL. The Aminoglycosides. Mayo Clin Proc 1991 Nov;66(11):1158-1164.
- Gendeh B, Gibb AG, Aziz N, Kong N, Zahir Z. Vancomycin administration in continuous ambulatory peritoneal dialysis: the risk of ototoxicity. Otol HNS 1998:118:551-8.
- Israel KS, Welles JS, Black HR. Aspects of the pharmacology and toxicology of tobramycin in animals and humans. J Infect Dis 1976 Aug;134 Suppl:S97-S103.
- Masur H, Whelton PK, Whelton A. Neomycin toxicity revisited. Arch Surg 1976 Jul;111(7):822-825.
- Matz GJ. Aminoglycoside cochlear ototoxicity. Otolaryngol Clin North Am 1993 Oct;26(5):705-712.
- Medical Letter. Hypoglycemia and hyperglycemia with fluoroquinolones. Vol 45 (issue 1162) Aug 14, 2003
- Nikolaidis P, Vas S, Lawson V, Kennedy-Vosu L, Bernard A, Abraham G, Izatt S, Khanna S, Bargman JM, Oreopoulos DG. Is intraperitoneal tobramycin ototoxic in CAPD patients? Perit Dial Int 1991;11(2):156-161.
- Rappaport BZ, Fausti SA, Schechter MA, et al. A prospective study of high-frequency auditory function in patients receiving oral neomycin. Scand Audiol 15:67-7, 1986
- Riggs LC, Shofner WP, Shah AR, Young MR, Hain TC, Matz GJ. Ototoxicity resulting from combined administration of metronidizazole and gentamicin. Am J Otol 20, 4, 1990, 430-
- Sacristin JA, Soto JA, de Cos MA. Erythromycin-induced hypoacusis: 11 new cases and literature review. Annals of Pharmacotherapy 27(7-8), 950-5, 1993.
- Swanson DJ, Sung RJ, Fine MJ, Orloff JJ, Chu SY, Yu VL. Erythromycin ototoxicity: prospective assessment with serum concentrations and audiograms in a study of patients with pneumonia. Am J Med 1992 Jan;92(1):61-68.
- Tange RA, Dreschler WA, Prins JM, Buller HR, Kuijper EJ, Speelman P. Ototoxicity and nephrotoxicity of gentamicin vs netilmicin in patients with serious infections. A randomized clinical trial. Clin Otolaryngol 1995 Apr;20(2):118-123.
- Thomas J, Marion MS, Hinojosa R. Neomycin ototoxicity. Am J Otolaryngol, 13, 1992, 54-55
- Vasquez R, Mattucci K. A proposed protocol for monitoring ototoxicity in patients who take cochleo- or vestibulotoxic drugs. ENT J. 82:3, 181-184
- Wilhelm MP. Vancomycin. Mayo Clin Proc 1991 Nov;66(11):1165-1170
Tossicità terapeutico
Negli ultimi dieci anni, gentamicina intratympanic è diventata una delle principali modalità di trattamento per la malattia di Ménière intrattabile. Anche se presto ablazione vestibolare usato la streptomicina, gentamicina è ora la preparazione preferita perché è più vestibulotoxic di cochleotoxic e quindi può asportare funzione vestibolare preservando l’udito. L’idea è che la perdita vestibolare unilaterale permette di risarcimento da parte del sistema vestibolare controlaterale, consentendo così una migliore funzione generale.
La terapia Gentamicina viene indotta con 30-40 mg alla settimana fino a segni di perdita vestibolare unilaterale sono visti. . Kaplan et al hanno dimostrato che con questo regime la maggior parte dei pazienti sperimentano ototossicità per giorno 12 [21] In una meta-analisi di cui 15 prove e 627 pazienti, 74,7% dei pazienti hanno dimostrato di ottenere il controllo completo di vertigini con il trattamento gentamicina intratympanic; controllo completo o sostanziale è stata ottenuta nel 92,7% dei pazienti. [22, 7]
References
- Kahlmeter G, Dahlager JI. Aminoglycoside toxicity – a review of clinical studies published between 1975 and 1982. J Antimicrob Chemother. Jan 1984;13 Suppl A:9-22. [Medline].
- Monsell EM, Cass SP, Rybak LP. Therapeutic use of aminoglycosides in Ménière’s disease. Otolaryngol Clin North Am. Oct 1993;26(5):737-46. [Medline].
- Hirvonen TP, Minor LB, Hullar TE, Carey JP. Effects of intratympanic gentamicin on vestibular afferents and hair cells in the chinchilla. J Neurophysiol. Feb 2005;93(2):643-55. [Medline].
- Hiel H, Schamel A, Erre JP, Hayashida T, Dulon D, Aran JM. Cellular and subcellular localization of tritiated gentamicin in the guinea pig cochlea following combined treatment with ethacrynic acid. Hear Res. Jan 1992;57(2):157-65. [Medline].
- Leitner MG, Halaszovich CR, Oliver D. Aminoglycosides inhibit KCNQ4 channels in cochlear outer hair cells via depletion of phosphatidylinositol(4,5)bisphosphate. Mol Pharmacol. Jan 2011;79(1):51-60.[Medline].
- Rybak LP, Whitworth CA. Ototoxicity: therapeutic opportunities. Drug Discov Today. Oct 1 2005;10(19):1313-21. [Medline].
- Selimoglu E. Aminoglycoside-induced ototoxicity. Curr Pharm Des. 2007;13(1):119-26. [Medline].
- Matz GJ. Aminoglycoside cochlear ototoxicity. Otolaryngol Clin North Am. Oct 1993;26(5):705-12.[Medline].
- Fischel-Ghodsian N. Genetic factors in aminoglycoside toxicity. Ann N Y Acad Sci. Nov 28 1999;884:99-109. [Medline].
- Roland PS. New developments in our understanding of ototoxicity. Ear Nose Throat J. Sep 2004;83(9 Suppl 4):15-6; discussion 16-7. [Medline].
- Rybak LP, Kelly T. Ototoxicity: bioprotective mechanisms. Curr Opin Otolaryngol Head Neck Surg. Oct 2003;11(5):328-33. [Medline].
- Uzun C, Koten M, Adali MK, et al. Reversible ototoxic effect of azithromycin and clarithromycin on transiently evoked otoacoustic emissions in guinea pigs. J Laryngol Otol. Aug 2001;115(8):622-8.[Medline].
- Levine DP. Vancomycin: a history. Clin Infect Dis. Jan 1 2006;42 Suppl 1:S5-12. [Medline].
- Knight KR, Kraemer DF, Neuwelt EA. Ototoxicity in children receiving platinum chemotherapy: underestimating a commonly occurring toxicity that may influence academic and social development. J Clin Oncol. Dec 1 2005;23(34):8588-96. [Medline].
- Jung TT, Rhee CK, Lee CS, et al. Ototoxicity of salicylate, nonsteroidal antiinflammatory drugs, and quinine. Otolaryngol Clin North Am. Oct 1993;26(5):791-810. [Medline].
- Bhansali SA, Stockwell CW, Bojrab DI. Oscillopsia in patients with loss of vestibular function. Otolaryngol Head Neck Surg. Jul 1993;109(1):120-5. [Medline].
- MacDougall HG, Weber KP, McGarvie LA, Halmagyi GM, Curthoys IS. The video head impulse test: diagnostic accuracy in peripheral vestibulopathy. Neurology. Oct 6 2009;73(14):1134-41. [Medline].
- Jonathan B Clark, MD, MPH. Evaluation of Visual Vestibular Interaction With the Dynamic Visual Acuity Test. micromedical.com. Available at http://www.micromedical.com/Newsletter/MMNewsletter20.pdf. Accessed 4/25/2010.
- Ishiyama G, Ishiyama A, Kerber K, Baloh RW. Gentamicin ototoxicity: clinical features and the effect on the human vestibulo-ocular reflex. Acta Otolaryngol. Oct 2006;126(10):1057-61. [Medline].
- Lai P, Coulson C, Pothier DD, Rutka J. Chlorhexidine ototoxicity in ear surgery, part 1: review of the literature. J Otolaryngol Head Neck Surg. Dec 2011;40(6):437-40. [Medline].
- Kaplan DM, Hehar SS, Bance ML, et al. Intentional ablation of vestibular function using commercially available topical gentamicin-betamethasone eardrops in patients with Meniere’s disease: further evidence for topical eardrop ototoxicity. Laryngoscope. Apr 2002;112(4):689-95. [Medline].
- Cohen-Kerem R, Kisilevsky V, Einarson TR, et al. Intratympanic gentamicin for Menière’s disease: a meta-analysis. Laryngoscope. Dec 2004;114(12):2085-91. [Medline].
- American Speech-Language Hearing Association. (1994). Audiologoc Managment of Individuals Recieving Cochleotoxic Drug Therapy [Guidelines]. Available at www.asha.org/policy.
- Barlow DW, Duckert LG, Kreig CS, et al. Ototoxicity of topical otomicrobial agents. Acta Otolaryngol. Mar 1995;115(2):231-5. [Medline].
- Campbell KC, Durrant J. Audiologic monitoring for ototoxicity. Otolaryngol Clin North Am. Oct 1993;26(5):903-14. [Medline].
- Dayal VS, Chait GE, Fenton SS. Gentamicin vestibulotoxicity. Long term disability. Ann Otol Rhinol Laryngol. Jan-Feb 1979;88(1 Pt 1):36-9. [Medline].
- Edson RS, Terrell CL. The aminoglycosides. Mayo Clin Proc. May 1999;74(5):519-28. [Medline].
- Fausti SA, Henry JA, Helt WJ, et al. An individualized, sensitive frequency range for early detection of ototoxicity. Ear Hear. Dec 1999;20(6):497-505. [Medline].
- Govaerts PJ, Claes J, van de Heyning PH, et al. Aminoglycoside-induced ototoxicity. Toxicol Lett. Aug 1990;52(3):227-51. [Medline].
- Henley CM, Rybak LP. Developmental ototoxicity. Otolaryngol Clin North Am. Oct 1993;26(5):857-71.[Medline].
- Huizing EH, de Groot JC. Human cochlear pathology in aminoglycoside ototoxicity–a review. Acta Otolaryngol Suppl. 1987;436:117-25. [Medline].
- Ikeda K, Oshima T, Hidaka H, et al. Molecular and clinical implications of loop diuretic ototoxicity. Hear Res. May 1997;107(1-2):1-8. [Medline].
- Knight KR, Kraemer DF, Neuwelt EA. Ototoxicity in children receiving platinum chemotherapy: underestimating a commonly occurring toxicity that may influence academic and social development. J Clin Oncol. Dec 1 2005;23(34):8588-96. [Medline].
- Lee KJ, ed. Essential Otolaryngology Head and Neck Surgery. 995-998. 8th. McGraw-Hill: 2003:104-105.
- Nielsen-Abbring FW, Perenboom RM, van der Hulst RJ. Quinine-induced hearing loss. ORL J Otorhinolaryngol Relat Spec. 1990;52(1):65-8. [Medline].
- Powell SH, Thompson WL, Luthe MA, et al. Once-daily vs. continuous aminoglycoside dosing: efficacy and toxicity in animal and clinical studies of gentamicin, netilmicin, and tobramycin. J Infect Dis. May 1983;147(5):918-32. [Medline].
- Rademaker-Lakhai JM, Crul M, Zuur L, et al. Relationship between cisplatin administration and the development of ototoxicity. J Clin Oncol. Feb 20 2006;24(6):918-24. [Medline].
- Roland PS. Summary of the findings of a joint consensus panel on the use of potentially ototoxic ototopicals. Ear Nose Throat J. Sep 2004;83(9 Suppl 4):13-4. [Medline].
- Rybak LP. Ototoxicity of loop diuretics. Otolaryngol Clin North Am. Oct 1993;26(5):829-44. [Medline].
- Rybak LP, Whitworth C, Scott V. Comparative acute ototoxicity of loop diuretic compounds. Eur Arch Otorhinolaryngol. 1991;248(6):353-7. [Medline].
- Schacht J, Weiner N. Aminoglycoside-induced hearing loss: a molecular hypothesis. ORL J Otorhinolaryngol Relat Spec. 1986;48(2):116-23. [Medline].
- Talbert RL, Ludden TM, West RE. Rapid establishment of therapeutic serum concentrations of salicylates.J Clin Pharmacol. Feb-Mar 1979;19(2-3):108-12. [Medline].
- Temple AR. Acute and chronic effects of aspirin toxicity and their treatment. Arch Intern Med. Feb 23 1981;141(3 Spec No):364-9. [Medline].
- Vasquez EM, Maddux MS, Sanchez J, et al. Clinically significant hearing loss in renal allograft recipients treated with intravenous erythromycin. Arch Intern Med. Apr 12 1993;153(7):879-82. [Medline].