Categorie DFN
Le sordità genetiche nella maggioranza dei casi sono malattie “mono-geniche”:
l’alterazione di un solo gene è responsabile di ciascuna forma di sordità, e la sordità è per lo più causata da un disordine dell’orecchio interno. Le diverse forme di sordità non sindromica sono state caratterizzate per mezzo di un analisi di legame genetico (“linkage”) eseguita su famiglie numerose che permettono di definire un “locus” su uno dei cromosomi, cioè una regione genomica contenente il gene responsabile della sordità. Spesso il gene viene isolato in un secondo tempo, ed in qualche caso un singolo locus può contenere due geni della sordità.
Una convenzione internazionale ha stabilito di denominare i loci della sordità non sindromica con le sigle DFNA (deafness, autosomica dominante loci 1-41), DFNB (deafness, autosomica recessiva loci 1-33), e DFN (deafness, X-linked loci 1-8) Tali sigle sono seguite da un numero, che definisce l’ordine di tempo nel quale ogni forma è stata definita. Ad oggi esistono 60 forme (24 con geni donati), 80 forme DFNB (39 con geni donati), e 5 forme DFN, Oltre a queste, nella classificazione sono state inserite 2 forme DFNM, (M modificante) caratterizzate dalla presenza di un gene “modificante”, cioè in grado di cambiare l’espressività di una determinata mutazione genetica. Le relazioni fra geni, fenotipo, e modalità di trasmissione del carattere sono complesse secondo il tipo di mutazione: così uno stesso gene può determinare una DFNA e/o una DFNB, e/o una sordità sindromica.
Nel 50% dei casi di sordità asindromica autosomica recessiva la causa è rappresentata da mutazioni presenti nella regione genomica (locus) DFNB1 presente sul braccio lungo del cromosoma 13. Il locus DFNB1 contiene il gene GJB2 (Gap Junction-2; OMIM 121011) che codifica per la proteina Connessina 26, ed il gene GJB6 (OMIM 604418) che codifica per la proteina Connessina 30. Ad oggi sono state individuate circa 100 mutazioni a carico del gene GJB2 (http://davinci.crg.es/deafness) e 2 delezioni che coinvolgono il gene GJB6 (D13S1830 e D13S1854) e che sono la causa della sordità non sindromica legata al locus DFNB1.
Fino ad oggi si sono identificati circa 150 “loci” cromosomici associati a forme genetiche di sordità. Si stima che questo numero rappresenti solamente la metà delle alterazioni genetiche che potrebbero causare una sordità. Esistono database che aggiornano puntualmente la classificazione delle sordità genetiche (per es.: hffp://hereditaryhearinglossorg).
La maggior parte delle forme di sordità non sindromica sono associati con perdita di udito permanente causata da danni alle strutture nell’orecchio interno. L’orecchio interno è costituito da tre parti: una struttura a forma di chiocciola chiamata coclea che aiuta suono processo, nervi che inviano informazioni dalla coclea al cervello, e strutture coinvolte con equilibrio. La perdita dell’udito causata da cambiamenti dell’orecchio interno è chiamato sordità neurosensoriale. La perdita dell’udito che deriva da variazioni nel dell’orecchio medio è chiamato ipoacusia trasmissiva. L’orecchio medio contiene tre piccole ossa che aiutano il suono trasferimento dal timpano all’orecchio interno. Alcune forme di sordità non sindromiche comportano cambiamenti sia l’orecchio interno e l’orecchio medio; questa combinazione viene chiamata ipoacusia mista.
La gravità della perdita dell’udito varia e può cambiare nel tempo. Può interessare un orecchio (unilaterale) o entrambe le orecchie (bilaterali). Gradi di gamma perdita dell’udito da lieve (difficoltà a comprendere il linguaggio morbido) a profonda (incapacità di sentire anche rumori molto forti). La perdita può essere stabile, o può progredire come una persona invecchia. Particolari tipi di sordità sindromica spesso mostrano modelli distintivi di perdita dell’udito. Ad esempio, la perdita può essere più pronunciato ad alta, media o bassa tonalità.
Epidemiologia
Circa 1 su 1000 bambini negli Stati Uniti nasce con sordità profonda. In 9 anni, circa 3 su 1.000 bambini hanno perdita che colpisce le attività della vita quotidiana dell’udito. Più della metà di questi casi sono causati da fattori genetici. La maggior parte dei casi di sordità genetica (70% al 80%) sono non sindromiche; restanti casi sono causati da sindromi genetiche specifiche. Negli adulti, la possibilità di sviluppare perdita dell’udito aumenta con l’età; perdita dell’udito colpisce la metà di tutte le persone di età superiore ai 80 anni.
Geni legati alla sordità non sindromica
Mutazioni in the ACTG1 , CDH23 , CLDN14 , COCH , COL11A2 , DFNA5 , ESPN , EYA4 , GJB2 , GJB6 , KCNQ4 , MYO15A , MYO6 ,MYO7A , OTOF , PCDH15 ,
POU3F4 , SLC26A4 , STRC , TECTA , TMC1 , TMIE , TMPRSS3 , USH1C , e WFS1
geni causano sordità non sindromica, con prove più deboli attualmente implicando genes
CCDC50 , DIAPH1 , DSPP , ESRRB , GJB3 , GRHL2 , GRXCR1 , HGF ,LHFPL5 , LOXHD1 , LRTOMT , MARVELD2 , MIR96 , MYH14 , MYH9 ,
MYO1A ,MYO3A , OTOA , PJVK , POU4F3 , PRPS1 ,PTPRQ ,RDX , SERPINB6 , SIX1 , SLC17A8 , TPRN , TRIOBP , e whrn.
Le cause di sordità non sindromiche possono essere complesse. I ricercatori hanno identificato più di 30 geni che, se mutati, possono provocare la sordità non sindromica; Tuttavia, alcuni di questi geni non sono state pienamente caratterizzato. Molti geni legati alla sordità sono coinvolti nello sviluppo e la funzione dell’orecchio interno. Mutazioni genetiche interferiscono con passaggi critici nel suono di trasformazione, con conseguente perdita dell’udito. Diverse mutazioni nello stesso gene possono causare vari tipi di perdita dell’udito, e alcuni geni sono associati con la sordità sia sindromica e non sindromica. In molte famiglie, il gene (s) coinvolti devono ancora essere identificati.
La sordità può anche derivare da fattori ambientali o una combinazione di genetica e ambientali fattori, tra cui alcuni farmaci, infezioni peri-natale (infezioni che si verificano prima o dopo la nascita), e l’esposizione a rumori forti per un periodo prolungato.
Tipi comprendono:
|
Gene |
Tipo |
|
|
DFNA1 |
||
|
DFNA2A |
||
|
DFNA2B |
||
|
DFNA3A |
||
|
DFNA3B |
||
|
DFNA4 |
||
|
DFNA5 |
||
|
DFNA8 / 12 |
||
|
DFNA9 |
||
|
DFNA10 |
||
|
DFNA11, neurosensoriale |
||
|
DFNA13 |
||
|
DFNA15 |
||
|
DFNA17 |
||
|
DFNA20 / 26 |
||
|
DFNA22 |
||
|
DFNA23 |
||
|
DFNA25 |
||
|
DFNA28 |
||
|
DFNA36 |
||
|
DFNA36, con dentinogenesi |
||
|
DFNA44 |
||
|
DFNA48 |
||
|
DFNA50 |
||
|
DFNB1A |
||
|
DFNB1B |
||
|
DFNB2, neurosensoriale (vedi anche sindrome di Usher) |
||
|
DFNB3 |
||
|
DFNB6 |
||
|
DFNB7 |
||
|
DFNB8, esordio infantile |
||
|
DFNB9 |
||
|
DFNB10, congenita |
||
|
DFNB12 |
||
|
DFNB16 |
||
|
DFNB18 |
||
|
DFNB21 |
||
|
DFNB22 |
||
|
DFNB23 |
||
|
DFNB24 |
||
|
DFNB25 |
||
|
DFNB28 |
||
|
DFNB30 |
||
|
DFNB31 |
||
|
DFNB35 |
||
|
DFNB36 |
||
|
DFNB37 |
||
|
DFNB39 |
||
|
DFNB49 |
||
|
DFNB53 |
||
|
DFNB59 |
||
|
DFNB63 |
||
|
DFNB67 |
||
|
DFNB77 |
||
|
DFNB79 |
||
|
DFNB84 |
||
|
DFNB91 |
||
|
DFNX1 |
||
|
DFNX2 |
Genetica
Sordità sindromica può avere diversi modelli di ereditarietà. Tra il 75% e il 80% dei casi sono ereditate in un modello autosomico recessivo, il che significa che due copie del gene in ogni cellula sono alterati. Di solito, ciascun genitore di un individuo con autosomica recessiva sordità è portatrice di una copia del gene alterato. Questi vettori non hanno la perdita dell’udito.
Un altro 20% al 25% dei casi di sordità non sindromica è autosomica dominante, il che significa che una sola copia del gene alterato in ogni cella è sufficiente a causare la perdita dell’udito. Le persone con autosomica dominante sordità spesso ereditano una copia alterata del gene da un genitore che ha la perdita dell’udito.
Tra l’1% e il 2% dei casi mostrano un modello X-linked di eredità, che significa che il gene mutato responsabile per la condizione si trova sul cromosoma X. I maschi con collegata a X sordità sindromica tendono a sviluppare sordità più grave in precedenza in vita rispetto alle femmine che ereditano una copia della stessa mutazione del gene. Padri non passeranno tratti X-linked ai propri figli, poiché non passano sul cromosoma X alla prole maschile.
Sordità non sindromica Mitocondriale, che risulta dalle modifiche al DNA nei mitocondri, si verifica in meno di 1% dei casi negli Stati Uniti. Il DNA mitocondriale alterato viene passato da una madre ai suoi figli e figlie. Questo tipo di sordità non è ereditata dai padri.
sordità progressiva ad esordio tardivo è la disabilità neurologica più comune degli anziani. Anche se la perdita di decibel superiore a 25 è presente solo l’1% dei giovani adulti di età compresa tra 18-24 anni di età tra, questo aumenta al 10% nelle persone tra i 55-64 anni di età e circa il 50% negli ottantenni.
Il contributo relativo dell’ereditarietà di deficit uditivo legata all’età non è nota, tuttavia la maggior parte di sordità ereditaria ad esordio tardivo è autosomica dominante e non sindromica (Van Camp et al., 1997). Oltre quaranta geni associati con autosomica perdita di udito non sindromica dominante sono stati localizzati e di questi quindici sono stati clonati.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Perdita dell’udito Neurosensoriale Ereditaria Non Sindromica
Iris Schrijver
the journal of molecular diagnostics
November 2004Volume 6, Issue 4, Pages 275–284
Schema dell’articolo
I. Genetica
II. Connessine
III. Connexin Funzione
IV. Altri geni
B. COCH (DFNA9)
C. Mitocondriale perdita dell’udito
E. WFS1 (DFNA6, DFNA14, DFNA38)
V. Universale Newborn Hearing Screening
VI. La valutazione medica di perdita dell’udito
VII. Test genetici
VIII. Considerazioni etiche
IX. Trattamento
X. Conclusioni
XI. Riferimenti
Enormi progressi sono stati compiuti nella comprensione delle basi molecolari dell’udito e perdita dell’udito.Attraverso i recenti progressi, abbiamo cominciato a capire l’affascinante biologia del sistema uditivo e svelato nuovi meccanismi molecolari di danni all’udito. Cambiamenti nella impatto diagnostico dei test genetici sono verificati, nonché interessanti sviluppi in opzioni terapeutiche. Diagnosi molecolare, che è già una realtà per diversi geni acustici associati, sarà indubbiamente continuerà ad aumentare nel prossimo futuro, sia in termini di numero di mutazioni testate e lo spettro di geni. L’analisi genetica per la perdita dell’udito è usato soprattutto per la diagnosi e il trattamento, e relativamente di rado per le decisioni riproduttive, a differenza di altre malattie ereditarie. Ereditato perdita dell’udito, invece, è caratterizzata da notevole eterogeneità genetica. L’abbondanza di geni portano un gran numero di mutazioni, ma le mutazioni specifiche in un singolo gene può causare la perdita dell’udito sindromica o non sindromica.Alcune mutazioni predominano in singoli gruppi etnici. Per diagnostici clinici e di laboratorio, è difficile tenere il passo con le scoperte che si svolgevano. Questa recensione ha lo scopo di fornire il quadro pertinente per diagnostici e un approccio pratico per l’analisi di mutazione in non udenti.
La perdita dell’udito è comune a tutte le età. Si tratta di un grave problema di salute pubblica perché colpisce 6-8% della popolazione nei paesi sviluppati in cui tutte le cause sono combinati ed è il difetto congenito più comune. 1 In seguito all’attuazione dello screening uditivo neonatale universale (UNHS) è stato trovato l’incidenza per essere ancora più alto di quanto si pensasse. Circa uno su 1000 neonati sono sordi, uno in 300 bambini sono colpiti con ipoacusia congenita di grado minore, e uno supplementare nel 1000 diventano profondamente udenti prima dell’età adulta. 2, 3 Prima della realizzazione di programmi di rilevamento e di intervento precoce dell’udito, l’età media alla diagnosi era di 1,5 a 3 anni, che è ben oltre l’inizio dell’intervallo critica per la voce e l’acquisizione del linguaggio. 4 perdita di udito non diagnosticate e ritardo diagnostico hanno un profondo impatto sulla competenza linguistico-comunicativa, oltre che cognitivo e psicosociale sviluppo. 5 riconoscimento ritardata può portare all’isolamento più tardi nella vita. 6
La perdita dell’udito può essere dovuto a fattori ambientali, difetti genetici, o una loro combinazione.Presbiacusia (perdita di udito legata all’età) è generalmente considerato essere multi-fattoriale. Al contrario, circa il 25% dell’infanzia udito deterioramento negli Stati Uniti è causato da fattori ambientali come la prematurità, le infezioni, l’esposizione ai farmaci ototossici, e traumi. Si stima che almeno il 50% di perdita di udito prelinguale è causato da cambiamenti genetici, considerando l’eziologia rimane oscuro nel restante 25%. La maggior parte di questi casi, tuttavia, si presume essere di origine genetica. Così, cause genetiche rappresentano la parte più consistente di tutti i casi di perdita dell’udito prelinguale. 7
La perdita dell’udito può essere classificato ulteriormente diversi criteri, tra cui la gravità (lieve o da 20 a 39 dB, moderata o 40-69 dB, grave o 70-89 dB, e profonda o> 90 dB), 1 età dell’insorgenza (prelinguale o post-linguale), e l’eziologia fisiologica. Ipoacusia trasmissiva è caratterizzata da anomalie dell’orecchio esterno o anomalie degli ossicini dell’orecchio medio, ipoacusia neurosensoriale è causa di un malfunzionamento dell’orecchio interno, e la perdita dell’udito centrale è causata da difetti del nervo VIII, il tronco cerebrale, o la corteccia cerebrale . La perdita dell’udito può essere miscelato.
Ipoacusia genetica ha diverse eziologie e si stima che circa l’1% di tutti i geni umani sono coinvolti nel processo di audizione. 8 Lasciando i modelli di eredità da parte, i conti perdita dell’udito non sindromici per oltre il 70% di tutta la perdita dell’udito ereditaria. 9 sordità non sindromica o isolato non è associato con un chiaro modello di altri difetti fisici. Al contrario, la sordità sindromica è caratterizzata da manifestazioni aggiuntive, come la retinite pigmentosa (ad esempio, la sindrome di Usher), gozzo eutiroideo e malformazioni dell’orecchio interno (sindrome Pendred), dismorfismo cranio-facciale (sindrome di Treacher-Collins), marfanoide habitus corpo (sindrome di Stickler), anomalie renali (sindrome di Alport), o la presenza di lunghi intervalli QT (Jervell e sindrome Lange-Nielsen). Sono state descritte diverse centinaia di sindromi che coinvolgono la perdita dell’udito. 1 Sebbene utile quando caratteristiche sindromiche si possono riconoscere, questa suddivisione pone un dilemma quando le manifestazioni cliniche non sono completamente sviluppati.Ciò è particolarmente comune durante l’infanzia, ma può anche essere causato da l’espressione genica variabile. Ad esempio, il gozzo in autosomica recessiva sindrome di Pendred può svilupparsi solo in età adulta, se non del tutto. In assenza di altri sintomi evidenti all’esame obiettivo, la diagnosi di sindrome di Pendred rischia di perdere.
Genetica
La perdita dell’udito può seguire un modello di autosomica recessiva, autosomica dominante, X-linked, e l’ereditarietà mitocondriale. La base genetica è molto complessa. Mutazioni alleliche in alcuni geni possono causare la perdita recessiva e dominante l’udito, le mutazioni nello stesso gene può causare sindromico o perdita di udito non sindromica, e perdita di udito recessiva può essere causato da una combinazione di due mutazioni in geni diversi dallo stesso gruppo funzionale.
Del minimo stimato del 50% dei casi con perdita uditiva ereditaria, ~70% sono non sindromica e ~ 80% di questi sono autosomica recessiva (10, Figura1). Perdita di udito non sindromica è molto spesso neurosensoriale. Può essere diviso in DFNA (autosomica dominante sordità, ~15 al 20%), DFNB (autosomica recessiva sordità, ~ 80%), DFN (sordità legata al cromosoma X, ~ 1%), e sordità mitocondriale (almeno l’1%) .10, 11 autosomica dominante sordità neurosensoriale (SNHL) spesso è post-linguale e progressiva, mentre SNHL recessiva è prelinguale come una regola.
Figura 1
Una suddivisione di ipoacusia da causa (colonna 1), presenza o assenza di funzioni associate nei casi ad eziologia genetica (colonna 2), e modalità di trasmissione nel gruppo non sindromica (colonna 3). Lescatole più piccole in colonna 3 rappresentano la perdita di udito legata al cromosoma X, che rappresenta il ~ 1% di perdita di udito non sindromica, e perdita di udito mitocondriale, che rappresenta almeno l’1%.DC, autosomica dominante; AR, autosomica recessiva.
Immagine di grandi dimensioni | Visualizza Hi-Res Immagine | Scarica PowerPoint Slide
A causa della eterogeneità genetica enorme, l’identificazione di geni e difetti del gene che influiscono sul processo di udienza è stato impegnativo. Considerando la complessità del sistema uditivo, che richiede l’interazione di una diversità di proteine compresi canali ionici, matrice extracellulare, proteine citoscheletriche, e fattori di trascrizione, questo non è sorprendente. Tuttavia, ostacola l’identificazione di geni con metodi genetici tradizionali, come il raggruppamento di più famiglie per analisi di linkage. Le analisi di linkage è anche complicata dal fatto che più di una causa di perdita dell’udito può separare in una famiglia dopo l’accoppiamento assortative, che è relativamente comune tra gli individui sordi.
Studi genetici di perdita dell’udito hanno avuto successo in popolazioni isolate e famiglie consanguinee.Anche dopo che il gene è stato localizzato in una regione su un cromosoma, tuttavia, il processo di clonazione posizionale tramite una mappa fisica seguita dall’identificazione trascrizione può essere arduo. 12 Alcuni loci identificati, compresi DFNB1, DFNA2 e DFNA3, sono stati trovati per porto geni multipli. D’altra parte, alcuni geni hanno più assegnazioni locus causa denominazioni iniziali errati. 13 identificazione Gene è stato facilitato notevolmente dai recenti progressi nella genomica, la libreria cocleare feto umano, e dalla ricerca in organismi modello come il mouse. 12, 13
Nel campo della perdita di udito non sindromica, 21 geni associati con ereditarietà autosomica recessiva, 20 associati con trasmissione autosomica dominante, e uno con trasmissione recessiva legata al cromosoma X sono stati identificati e caratterizzati (http://dnalab-www.uia.ac.be / dnalab / HHH/).
Connessine
Autosomica perdita di udito non sindromica recessiva nel locus sul cromosoma 13q11-12 DFNB1 è caratterizzata da congenita, di solito non progressiva, da lieve a insufficienza uditiva profonda. Il locus contiene due geni, GJB2 e GJB6. GJB2 codifica connexin 26, una proteina gap giunzione del gruppo beta con un peso molecolare di 26 kD. Le connessine umani sono classificati per la loro massa molecolare (riflessa dal numero nel nome connessina), e dalla portata di identità di sequenza, che è indicato nei simboli gene per GJA, B, e C sottotipi. I connexine sono molto simili e contengono loro regione codificante in un singolo esone, separato dal 5′-UTR da un introne. Identificazione della GJB2 gene è stato un punto di riferimento nella genetica di perdita dell’udito, perché ha sottolineato il ruolo centrale dei canali ionici gap junction cocleari. 14La sequenza codifica di GJB2 è circondata interamente da esone 2 e si compone di 681 bp, che si traducono in una proteina con 226 aminoacidi e comprendono il codone di stop. Esone 1 è contenuta nel 5′-UTR. Le mutazioni in questo gene rappresentano la causa più comune di perdita sporadica e autosomica recessiva non sindromica neurosensoriale dell’udito (SNHL). Essi sono responsabili per circa la metà dei casi negli Stati Uniti, Europa, Australia e Israele, e sono stati segnalati in altre popolazioni pure. 15
La mutazione più comune è una delezione di una singola guanina da una stringa di sei (35delG). Spiega questa mutazione per più di due terzi delle mutazioni e dei risultati identificate in un frame-shift con premature terminazione della proteina. Rimane ancora da determinare perché questa mutazione ha una frequenza relativamente alta, ma è stato suggerito che 35delG si trova in una regione hypermutable. 16 Sia un consenso motivo Chi locale e una sequenza TGGGG, che sono stati collegati a beta-globina mutazioni e la ricombinazione dei geni immunogobulin, potrebbero svolgere un ruolo. Se slittamento e mispairing dei fili durante la sintesi del DNA determinano l’elevata incidenza di questa mutazione, tuttavia, etnica dovrebbe non poco contribuire variazione nella frequenza. Tuttavia, la prevalenza di 35delG sembra variare notevolmente tra le popolazioni. Un’alternativa alla mutazione punto caldo ipotesi viene proposta da Van Laer et al, 17 il quale propone che l’alta frequenza di questa variante risultati da un comune fondatore. Perché la mutazione è pensato per essere evolutivamente antico, aplotipo sharing è osservata solo in una piccola regione cromosomica. Anche se queste ipotesi sembrano essere contraddittorie, entrambi i fenomeni possano aver contribuito alla elevata frequenza di alleli di questo singola mutazione. 17 La frequenza complessiva portante della 35delG negli Stati Uniti raggiunge il 2,5% in alcuni studi, ma sembra variare in base alla popolazione.17, 18, 19
. La mutazione 167delT è la mutazione più comunemente identificato nella popolazione ebraica ashkenazita, dove ha una frequenza portante di circa il 4% 20 nel sud-est asiatici, 235delC è la più diffusa con una frequenza portante di ~ 1: 100. 21 un elenco di tutte le mutazioni pubblicati così come polimorfismi comuni inGJB2, è disponibile per la correlazione clinica e l’interpretazione alla home page di connessina-sordità(http://www.crg.es/deafness/). Circa 110 i singoli non sindromici GJB2 sono state descritte varianti del gene: otto sono dominanti, 89 sono recessive, e 11 sono di significato sconosciuto. Mutazioni riportate sono sciocchezze, missense, tranciati, e le mutazioni frame-shift così come in-frame delezioni(http://www.crg.es/deafness/).
Anche se fino a metà degli individui con autosomica recessiva SNHL avere GJB2 mutazioni, ~ 10 al 50% portare solo uno. 15 Un ruolo per GJB6, il gene adiacente a GJB2 sul cromosoma 13, è stata suggerita nel 1999, quando una mutazione dominante ( T5M) è stata descritta. 22 La mutazione più comune in GJB6, però, è una delezione> 300 kb che causa SNHL non sindromica quando omozigote, o se è presente sulla allele opposto di un GJB2 mutazione. 23 GJB2 e GJB6 sono solo ~ 35 kb a parte. GJB2 si trova sul lato centromerico(Figura2). GJB6 è molto simile a GJB2, ma non interrotto da introni. 22 Entrambi i geni sono espressi nella coclea dove possono combinarsi per formare hemichannels più unità nella cella membrana, e la funzione come parte integrante del regolamento di potassio nell’orecchio interno. Un modello di topo con connessina 30 carenza dimostra profonda perdita dell’udito congenito. Un meccanismo DIGENICA di eredità, di conseguenza, è plausibile. In alternativa, la grande eliminazione potrebbe influenzare un elemento normativo monte da scoprire di GJB2. 24
Figura 2
Rappresentazione schematica del braccio lungo del cromosoma 13, 12 bande (non in scala). I GJB2 eGJB6 geni, che codificano connessina 26 e connessina 30, rispettivamente, sono adiacenti. Δ, un 309-kb 15delezione, che elimina una parte del GJB6 gene ed è associata con perdita di udito in forma omozigote recessivo, o in stato eterozigote, in combinazione con una mutazione nel GJB2. Questa delezione era precedentemente pensato per estendersi 342 kb.
Immagine di grandi dimensioni | Visualizza Hi-Res Immagine | Scarica PowerPoint Slide
Come si è visto con la mutazione 35delG nel gene connessina 26, la prevalenza della delezione del gene connessina 30 sembra variare notevolmente a seconda etnia. La frequenza delezione in materie di studio con uno o zero GJB2 mutazioni è più alta in Israele (71,4%), mentre il GJB6 mutazione avviene in circa il 20% della popolazione degli Stati Uniti con problemi di udito. 15 Il GJB6 eliminazione può spiegare ~ 10% di tutto DFNB1 alleli con una gamma estremamente ampia basata sull’origine etnica. Finora, l’informazione è stime molto limitate e affidabili preclusi da un piccolo numero di campioni in alcuni paesi. Anche all’interno degli Stati Uniti, ulteriori studi saranno necessari come la frequenza complessiva può variare notevolmente da stato a stato.Tuttavia, connessina 30 contribuisce in modo significativo la base molecolare di perdita dell’udito. Oltre ad un effetto diretto, è possibile che il GJB6 delezione modifica il fenotipo in individui che portano due recessiveGJB2 mutazioni. Non ci può essere notevole variabilità intra-familiare con perdite che vanno da lievi a profonde udito. Finora, tuttavia, ciò non è stato esplorato. 25
Non sindromica sordità dominante associata a GJB2 mutazioni è insorgenza precoce, da moderata a grave, e (a differenza di autosomica recessiva GJB2 sordità legati) tipicamente progressive. Dominanti GJB2 mutazioni, però, spesso hanno effetti pleiotropici. Disturbi dell’udito è stata riportata in associazione con disturbi della pelle tra palmoplantar keratorderma (PPK, la sindrome di Vohwinkel), cheratite-ittiosi-sordità, e sindromi ittiosi sordità hystrix-like. 26 GJB6 è stata anche associata con la sindrome di Clouston (hydrotic displasia ectodermica), che è autosomica dominante e può verificarsi con la sordità. 27, 28
Connexin Funzione
Più di 20 proteine connessina ampiamente espresse sono state identificate finora(http://www.ncbi.nlm.nih.gov/). Attraverso la formazione di giunzioni, consentono la comunicazione tra cellule adiacenti e sono coinvolti in numerose funzioni cellulari tra cui la crescita cellulare, la differenziazione, la reazione a segnali, la sincronizzazione di attività in tessuti eccitabili, e omeostasi. 29 I livelli di espressione differenti connexin isotipi sono interconnesse, come è stato dimostrato in un mouse connessina 32 knock-out, che ha avuto la riduzione simultanea di connessina 26 espressione in epatociti. 30 connessine 26, 30, 31, 32, e 43 sono espressi nell’orecchio interno se soddisfano un importante ruolo nella udito normale.
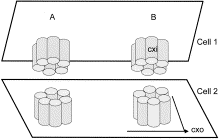
Nella coclea, la endolinfa ricco di potassio, si mette in moto ondoso dalla vibrazione meccanica del suono.Questo devia microvilli sugli apici cellulari e sposta l’stereocilia-actina contenenti associato. Potassio fluisce poi nelle cellule cigliate e depolarizza la membrana risultante in un potenziale d’azione, che attiva il nervo acustico. Per mantenere il gradiente di potassio elettrochimica tra le cellule dei capelli e la endolinfa, però, gli ioni potassio devono essere riciclati dalle cellule dei capelli di nuovo al endolinfa. 31 Anche se la loro esatta funzione e il ruolo nella perdita di udito rimangono sconosciute allo stato attuale, è stato messo in avanti che giunzioni connexin, attraverso la comunicazione intercellulare, influenzano l’ambiente ionico delle cellule epiteliali cocleari e potassio ricircolo. 32 trova nella membrana cellulare, sei connessine dello stesso tipo o differenti tipi formare una connessone, che crea un poro nella membrana e canale di comunicazione intercellulare quando allineato con una seconda connessone in una cella adiacente 33(Figura 3). Riduzione di valore delle normali risultati di funzione dei canali ionici a morte delle cellule dei capelli e la sordità permanente. 32, 34, 35
Figura 3
Sei proteine connessine (cxi) gruppo per formare un hemichannel nella membrana cellulare. Questo canale è chiamato connessone (CXO). Connexons possono essere fatte di sei connessine identici (omomerici) o di tipo diverso (eteromerico). Due connexons vicini, che creano un canale di comunicazione funzionale, possono essere identici (omotipica, come mostrato sotto A) o di diversa composizione (eterotipica, come mostrato sotto B).
Immagine di grandi dimensioni | Visualizza Hi-Res Immagine | Scarica PowerPoint Slide
Gli studi sugli animali e in vitro di ricerca dei singoli connessine umani hanno illuminato le diverse, selettivi, e complessi compiti nei singoli tessuti. La molteplicità di funzioni cellulari è facilitata dalla espressione di una varietà di connessine in ogni tipo di cellula. Attraverso combinazione di diversi connessine come elementi costitutivi dei singoli connexons, e attraverso la formazione di diverse coppie di connessone, questi canali ionici dimostrano grande varietà nelle loro funzioni. D’altro canto, la struttura connessone può limitare alcune interazioni cellula-cellula per incompatibilità selettiva. 29
Connessine Mutant espressi in coppie di Xenopus ovociti, con quantificazione dell’attività canale tra le due cellule mediante la tecnica del doppio morsetto di tensione hanno dimostrato una riduzione o completa mancanza di funzione connessone. Considerando che la perdita di funzione è il principale meccanismo patogenetico per mutazioni recessive connessine, mutazioni dominanti esercitano un effetto dominante negativo sulla proteina wild-type. L’inibizione negativamente dominante è molto probabilmente il risultato della interazione diretta di connessine normali e difettosi sulla membrana cellulare. 22 Non solo si verifica per effetto di un connexin difettoso su un intatto uno dello stesso tipo, ma può anche essere tra- dominante, come è stato dimostrato per la connessina 26 e 43, che può co-localizzare. 36
Connessine 26 e 30 sono co-espressi nell’orecchio interno. Connessina 30 knock-out così come i modelli di topo in cui connessina 26 è stata selettivamente ablato nell’orecchio interno (un approccio scelto perché connessina 26 – / – mice non sono vitali) hanno grave ipoacusia, suggerendo che queste due connessine sono in grado di si completano a vicenda nella parte interna dell’orecchio. 37 Una singola mutazione recessiva in ogni gene può anche portare a SNHL non sindromica attraverso un meccanismo apparentemente DIGENICA.Il deficit uditivo potrebbe essere dovuto ad un effetto di dosaggio, ma si può prevedere che la allele wild-type di ogni gene sarebbe in grado di compensare. Considerando che ci sono sei connessine in ogni connessone, tuttavia, è probabile che le proteine anomale sono incorporati nella maggioranza dei connexons heteromeric e omomerici. Questo si traduce poi in connexons difettosi che non possono ricircolare efficace di potassio, sono privi di potenziale elettrico, e non riescono a fornire un ambiente in cui le cellule ciliate sopravvivere. Finora, tuttavia, la base funzionale dell’osservazione DIGENICA non è chiarita.
Altri geni
Diverse centinaia di geni sono coinvolti nella complessa biologia dell’udito. Piuttosto che alla lista tutti i geni completamente caratterizzati, la seguente sezione si propone di rivedere i geni diversi GJB2 e GJB6 coinvolti nella perdita di udito non sindromica per i quali le prove di laboratorio clinico è attualmente disponibile(http://www.genetests.org/servlet/access ) (Tabella1).
|
Tabella 1geni coinvolti nella non sindromica perdita di udito, per il quale laboratorio clinico Test è attualmente disponibile (http://www.genetests.org/servlet/access) |
||||||
|
Chrom.posizione |
Locus / mutazione |
Simbolo Gene |
In lei. |
Proteina |
Funzione |
Rif. |
|
13q11-12 |
DFNB1 / A3 |
GJB2 |
AR / AD |
Connexin 26 |
Gap giunzione |
|
|
13q12 |
GJB6 |
AR / AD |
Connexin 30 |
Gap giunzione |
||
|
7q31 |
DFNB4 |
SLC26A4 |
AR |
Pendrin |
Trasportatore anionico |
|
|
14q12-13 |
DFNA9 |
COCH |
ANNO DOMINI |
Cochlin |
Proteina della matrice extracellulare |
|
|
Mitoch. |
1555A> G |
MTRNR1 |
Mito. |
12SrRNA |
||
|
7445A> G |
MTTS1 |
tRNA Serina |
||||
|
7472insC |
||||||
|
7511T> C altro |
||||||
|
Xq21.1 |
DFN3 |
POU3F4 |
XL |
Pou Classe dominio 3 |
Fattore di trascrizione |
|
|
4p16.1 |
DFNA6 / 14/38 |
WFS1 |
ANNO DOMINI |
Wolframin |
Non è chiaro: ER proteina transmembrana |
|
Chrom, cromosomica; Inher, eredità.; Mitoch, mitocondriale.; Ref., Riferimenti.
SLC26A4 (DFNB4)
Le mutazioni in SLC26A4 sono associati con autosomica recessiva SNHL e con la sindrome di Pendred. 38, 39Questa è una delle forme più comuni di sordità sindromica, ma ha riconosciuto sotto-probabile. Si è associato con una coclea dismorfico che contiene 1,5 invece di 2,5 giri (Mondini displasia) e con l’allargamento l’acquedotto vestibolare, che può essere esaminato da tomografia computerizzata. Il deficit uditivo è in genere grave e spesso stabile, anche se può essere progressiva. Il SLC26A4 gene codifica Pendrin, cloruro / trasportatore di ioduro. Ulteriori manifestazioni della sindrome di Pendred includono gozzo eutiroideo, che deriva dalla limitata capacità della tiroide di iodio durante la organify ormone tiroideo biosintesi, ma questa caratteristica non è né specifica né sensibile. Gozzo può essere un sintomo clinico di altri disturbi, e non è sempre presente nella sindrome di Pendred causa di penetranza incompleta. Anche quando espresso, spesso non si manifesta fino all’età adulta. Un test di laboratorio che può essere utile è il test di scarico perclorato, che valuta la organificazione di ioduro. Test molecolare è prezioso e fattibile in questo disturbo, come quattro ricorrenti mutazioni spiegano ~75% dei cromosomi colpiti. Le mutazioni possono tuttavia essere trovati in tutto il gene. 40
COCH (DFNA9)
Il COCH gene codifica Cochlin, una proteina abbondantemente espressa nella matrice extracellulare dell’orecchio interno. La perdita dell’udito associati a difetti in questo gene è in genere autosomica dominante, non sindromica, post-linguale con un esordio in età adulta, e progressiva. Gli individui affetti hanno l’unico osso temporale scoperta istopatologica di deposizioni mucopolisaccaridi, che sembrano soffocare le fibre dendritiche. Sintomi vestibolari quali squilibrio possono essere presenti. Questa malattia ha somiglianze cliniche per la malattia di Meniere, ma, al contrario, mostra la perdita dell’udito ad alta frequenza. 41
Mitocondriale perdita dell’udito
SNHL è presente nel 42-70% dei soggetti con disturbi mitocondriali e può essere non sindromica o sindromica. Mutazioni del DNA mitocondriale sono state identificate in> 3% dei pazienti con SNHL. Questa cifra è destinata ad aumentare a causa di un previsto aumento dei test genetici e la consapevolezza. 42mitocondriali le mutazioni di perdita dell’udito sono trasmesse esclusivamente attraverso la linea materna, e dimostrano completa o quasi completa omoplasmia, il che significa che la mutazione è presente in (quasi) tutto dei genomi mitocondriali all’interno di un individuo. 43
Fino al 25% dei pazienti che ricevono aminoglicosidi esperienza SNHL, anche quando somministrato a livelli terapeutici e per un periodo di tempo breve. Il cinquanta per cento delle persone colpite portano i 12S ribosomiale RNA mutazione 1555A> G nel MTRNR1. SNHL potrebbe essere evitato in molti pazienti se l’analisi del mtDNA verrebbe eseguita di routine e un alto indice di sospetto erano presenti prima della somministrazione aminoglicosidi. 42 Questa mutazione è anche una causa indipendente di non sindromica, e generalmente più mite, la perdita dell’udito in molteplici etnie.
La mutazione 7445A> G nel gene che codifica la serina tRNA provoca perdita dell’udito, ma penetranza dipende sul aplotipo mitocondriale in singole popolazioni. Ciò ha portato ad ipotizzare che sia modificatori genetici accessori o fattori ambientali giocano un ruolo nell’espressione di perdita dell’udito. Alcune mutazioni, come un inserimento citosina in posizione 7472 nel gene tRNASer, sono associate a sordità neurosensoriale progressiva combinata con manifestazioni neurologiche. La mutazione 7511T> C in tRNASer non è associato con manifestazioni neurologiche, ma porta alla perdita progressiva dell’udito con l’età variabile di esordio. 44più mutazioni sono state identificate in pazienti con SNHL non sindromica, ma questi sono ancora in corso di valutazione per patogenicità, 43(http://dnalab-www.uia.ac.be/dnalab/hhh/).
Mitocondriale SNHL può essere sindromica e può essere associata a mutazioni puntiformi (compresi quelli in tRNALys e tRNASer), delezioni, duplicazioni e (http://dnalab-www.uia.ac.be/dnalab/hhh/). Sindromi associate con perdita uditiva mitocondriale includono quelli causati dalla 3243A> G mutazione puntiforme nel MTTL1, il gene che codifica per la leucina tRNA. In questi casi, la perdita dell’udito esiste in concomitanza con la sindrome di Kearns-Sayre, encefalopatia mitocondriale con acidosi lattica e episodi di simil-ictus (MELAS), diabete ereditarietà materna e la sordità, o oftalmoplegia esterna progressiva cronica.
La patogenesi della perdita uditiva mitocondriale è dovuta all’elevata adenosina trifosfato (ATP) requisito nelle cellule ciliate cocleari. Una riduzione di ATP disponibile, causata da una disfunzione della fosforilazione ossidativa mitocondriale causa di mutazioni, provoca disturbi del gradiente ionico nell’orecchio interno. Così, mutazioni mitocondriali possono contribuire alla perdita progressiva dell’udito di invecchiamento, presbiacusia. 42
POU3F4 (DFN3)
POU3F4 codifica per un fattore di trascrizione (POE è l’abbreviazione di Pit, ottobre, e il DNA Unc domini di legame). 45 mutazioni sono state trovate disperse attraverso il gene, con il clustering nei domini POU. Sono causale nella X-linked, non sindromica, progressiva e profonda ipoacusia neurosensoriale (DFN3), che possono dare prova di una componente conduttivo a causa della fissazione staffa. I staffa è un osso a forma di staffa nell’orecchio medio. POU3F4 correlate perdita dell’udito è un altro disturbo per il quale l’imaging studi di TC possono essere utili, come un allargamento del canale acustico interno, e una dilatazione al confine tra la acustico interno canale e l’orecchio interno può essere visto. Come risultato, la pressione è aumentata e perilinfatica perilinfa dall’orecchio interno può trasmettere durante la rimozione chirurgica della staffa.
WFS1 (DFNA6, DFNA14, DFNA38)
WFS1 è stato descritto nel 1998 da Strom ed altri 46 e più di 90 sono state identificate mutazioni nel WFS1gene da allora. WFS1 codifica l’wolframin glicoproteina ed è associata con autosomica recessiva sindrome di Wolfram in presenza di mutazioni inattivanti. Esso è legato anche a un aumento della suscettibilità al suicidio e malattia mentale, così come il diabete. Non mutazioni inattivanti, con un effetto dominante negativo presunto, sono una causa comune di autosomica dominante SNHL bassa frequenza (DFNA6 / 14/38). 47 La maggior parte di queste mutazioni si trovano nel dominio della proteina carbossi-terminale. La perdita dell’udito mostra tipicamente esordio nell’infanzia ed è progressiva, ma non si avanza alla sordità profonda. La maggior parte dei pazienti non hanno alcuna significativa compromissione dell’udito nelle frequenze importanti per il discorso. Così, la maggior parte non richiedono apparecchi acustici. 48
Universale Newborn Hearing Screening
In passato, un approccio di screening con l’inserimento di soli bambini ad alto rischio non è riuscito a identificare almeno il 50% dei bambini con perdita di udito, e molti neonati senza fattori di rischio è rimasta non diagnosticata solo dopo 18 mesi di età. Se la diagnosi e l’intervento si svolgono prima dei 6 mesi di età, tuttavia, un livello quasi adeguato all’età delle competenze linguistiche può essere realizzato. Nel 2000, il Comitato misto per l’Audizione Infant ha riconosciuto universale Newborn Hearing Screening (UNHS). 49 Lo scopo è quello di fornire lo screening a tutti i neonati sentire prima dell’età di 1 mese, con la conferma della perdita di udito nei bambini che non superano il primo , o una proiezione successiva, attraverso una valutazione audiologica dall’età di 3 mesi. Trattamento completo può quindi essere iniziata prima dell’età di 6 mesi. 6 La maggior parte dei bambini identificati attraverso questo programma hanno genitori con udito normale.
La perdita dell’udito può essere identificato da diversi metodi complementari diversi. Seguendo le linee guida dal National Institutes of Health, tutti gli stati degli USA hanno adottato UNHS, ma algoritmi e di collaudo di variare. I due metodi principali utilizzati per il controllo neonatale sono emissioni otoacustiche e uditivi del tronco encefalico risposta automatica. 2
Una limitazione di UNHS è che non tutti i casi di perdita dell’udito dell’infanzia verranno rilevati. Lo screening neonatale dell’udito potrebbe non riuscire a identificare i bambini con perdita progressiva dell’udito, che rappresenta circa il 15% dei bambini in età prescolare con SNHL. 11 La progressione è stata anche descritta nella perdita dell’udito prelinguale solitamente stabile associata a mutazioni GJB2. In due bambini con mutazioni omozigote 35delG, la perdita dell’udito sembra essere stata prelinguale ma non congenito. Entrambi i bambini superato test dell’udito neonato di risposta uditivi del tronco encefalico e di un campo audiogramma gratuito, rispettivamente. Ciò implica che un bambino può passare i UNHS ma potrebbe ancora diventare gravemente colpiti primi anni di vita. 50
Il test UNHS è solo il primo passo di un programma di successo e conveniente. L’obiettivo principale è la diagnosi precoce e la gestione, lo sviluppo del linguaggio normale, e il successo a lungo termine dopo l’intervento. Gestione dei dati e il monitoraggio dei bambini per il follow-up sono attualmente in fase di sviluppo. Finora, tuttavia, non vi è alcun protocollo universale per la gestione medica dei bambini non udenti.
La valutazione medica di perdita dell’udito
La valutazione medica deve iniziare non appena la perdita dell’udito è sospettato di un prenatale, medico, e la storia completa della famiglia. I fattori di rischio quali bassi punteggi di Apgar, basso peso alla nascita, sofferenza respiratoria, ventilazione meccanica, l’ammissione in terapia intensiva neonatale, iperbilirubinemia, displasia retrolental, anomalie cranio-facciali e anomalie cromosomiche dovrebbero essere valutate in questo momento. 6
L’esame clinico e genetico sono necessari per escludere le caratteristiche spesso sottili compatibili con una eziologia infettiva sindromico o congenite. Inoltre, un esame oftalmologico devono essere effettuati esclusivamente a causa anomalie oculari sono presenti in più della metà dei bambini con grave di sordità profonda. 51 Ogni paziente con perdita di udito inspiegabile dovrebbe anche avere una ecografia renale e neuro-imaging dell’osso temporale. Studi di imaging possono includere risoluzione elevata TAC per valutare la presenza di una malformazione Mondini, o una risonanza magnetica per visualizzare il nervo acustico, escludere aplasia, e di escludere infettiva distruzione dell’orecchio interno. Una risonanza magnetica è particolarmente importante prima di un intervento chirurgico di impianto cocleare.
Gli esami di laboratorio deve essere personalizzata e diretta verso il sospetto diagnostico. I test possono includere un anticorpo test IgM nei primi anni di vita per valutare la possibilità di infezione intrauterina, test per emoglobinopatie come questi possono essere associati a SNHL, analisi delle urine e test di funzionalità renale nei bambini con possibile sindrome di Alport, test della tiroide di governare fuori una carenza, TSH e un test di scarica perclorato in sospetta sindrome Pendred, e una valutazione di disturbi metabolici come le malattie da accumulo lisosomiale. 11 un ECG per valutare l’intervallo QT devono essere effettuate se Jervell e Lange-Nielsen o sindrome di Romano-Ward sono sospetto. Qualsiasi valutazione della perdita di udito richiede un approccio multidisciplinare, che dovrebbe includere la consulenza e il supporto per i genitori. Un recente sondaggio ha rivelato che l’identificazione della causa della perdita dell’udito è la priorità più alta di genitori che imparano che il loro bambino è non udenti. 6
Test genetici
GJB2 (connessina 26) L’analisi dovrebbe essere il primo passo nella analisi di mutazione per non sindromica sordità neurosensoriale, in quanto è la causa più comune nella sua categoria. I campioni utilizzati per le prove possono includere sangue e nei tessuti periferici, ma anche i campioni meno invasive come le cellule buccali ottenute con un tampone, o parte delle macchie di sangue raccolti per lo screening neonatale. Entrambe le modalità di raccolta di DNA ad alleviare l’obbligo di eseguire la venipuntura su bambini molto piccoli. GJB2mutazioni possono essere identificati con una varietà di test allele-specifici, tra cui PCR seguiti da restrizione digestione, PCR con allele-specifico ibridazione, primer extension, o in tempo reale PCR. Tali metodi sono rapidi, economico e altamente sensibile e specifico ma limitando perché il numero di mutazioni puntiformi indagato è tipicamente bassa. Come osservato in numerose altre condizioni, origine etnica svolge un ruolo importante nella prevalenza e frequenze di mutazioni come illustrato dalle mutazioni più comunemente osservati negli ebrei Ashkenazi (167delT), asiatici (235delC) e caucasici (35delG). La mutazione 35delG è nettamente raro negli afro-americani, ma la prevalenza di SNHL non lo è. Molto probabilmente, altri GJB2 alleli quali R143W giocano un ruolo. Questa mutazione è stata rilevata nella maggior parte dei soggetti dello studio non udenti in Ghana. 52 Così, origine etnica dovrebbe essere un fattore nel decidere quale tipo di test è la più appropriata per un paziente.
Metodi di scansione Mutazione quali DGGE, TTGE, SSCP, DHPLC e hanno bisogno di essere completamente ottimizzato per creare risultati riproducibili. A seconda della tecnica, condizioni, e livello di ottimizzazione, alcuni di questi metodi sono uno schermo generale mutazione con cui alcune mutazioni possono perdere. Il sequenziamento è il metodo più completo e definitivo, come quasi tutte le mutazioni puntiformi, nonché piccole delezioni e inserzioni possono essere rilevati. Le dimensioni relativamente ridotte della GJB2 gene rende adatto per questo approccio. Quasi tutte le mutazioni sono stati rilevati nella regione codificante, che è interamente comprendeva dalla seconda esone. Tuttavia, poiché la maggior parte dei laboratori si concentrano solo su questo settore, non è completamente risolto se l’inclusione dell’esone uno sarebbe vantaggioso. 52 Inconvenienti di sequenziamento del DNA diretta sono l’incapacità di rilevare delezioni di interi esoni o geni e l’interpretazione alta intensità di lavoro, anche se la sequenza software confronto facilita questo compito. Analisi di sequenza in presenza di una mutazione frame-shift può essere difficile perché altre mutazioni sottostanti possono essere presenti. Se viene rilevata una mutazione frame-shift, primers dovrebbero essere utilizzate per interrogare la sequenza in entrambe le direzioni. 53 Grandi delezioni e inserzioni possono essere studiate con un lungo approccio PCR, accoppiato con l’analisi a base di gel per il dimensionamento.
Il GJB6 eliminazione dovrebbe essere esaminato in una seconda fase in individui in cui nessuno, o solo un singolo, GJB2 stata rilevata mutazione. 54 Ciò può, per esempio, essere ottenuto mediante l’uso di primer che fiancheggiano il grande delezione, in quanto questo è un ricorrente cancellazione con gli stessi punti di interruzione. Solo individui con delezione dimostrerebbero presenza del prodotto, mentre un prodotto di controllo esterno della soppressione potrebbe essere utilizzato per la verifica di amplificazione. 23 L’GJB2 e sei prodotti possono essere anche mirata simultaneamente da una PCR multiplex per valutare la presenza di eliminazione dal gel di agarosio elettroforesi, seguita da sequenziamento del DNA diretto della griglia di lettura aperta nel GJB2 gene. 53
Oltre a UNHS e un controllo medico generale, potenti argomenti possono essere fatte per i test genetici in pazienti con perdita di udito. 1) Nella maggior parte degli individui con ipoacusia genetica, una eziologia non è possibile altra via, perché gli studi di imaging sono negativi, caratteristiche extra-uditiva non sono evidenti, e il fenotipo perdita di udito non consente la categorizzazione. La notevole e continuo progresso nella nostra comprensione della patologia molecolare di ipoacusia, al contrario, consente sempre l’individuazione di un difetto genetico specifico. 2) Poiché l’analisi molecolare è essenzialmente non-invasive, sedazione o anestesia generale di neonati e bambini possono essere evitabili e la necessità di una più ampia, e costoso, le prove possono essere ridotti. 3) L’analisi molecolare può risultare in una diagnosi accurata e precoce, che facilita lo sviluppo cognitivo ottimale. 4) L’analisi molecolare può essere utile per la diagnosi di sordità sindromica prima funzionalità aggiuntive emergere (ad esempio, nella sindrome di Pendred o Jervell e Lange-Nielsen sindrome), e in grado di distinguere gli individui con mutazioni mitocondriali che sono a rischio per la perdita dell’udito iatrogena se trattati con aminoglicosidi. I rapporti pubblicati sono, in generale, esclusi i casi con evidenti fattori di rischio ambientali o sindromiche pazienti di perdita dell’udito da GJB2 analisi. Dal momento che molti individui con questi fattori di rischio e la perdita dell’udito hanno dimostrato di portare GJB2mutazioni dopo tutto, però, i test genetici può essere opportuno in questi casi. 5) GJB2 varianti possono influenzare l’espressione di perdita dell’udito sindromica, ambientale, progressivo, e all’età. Perché GJB2vettori hanno ridotto la funzione delle cellule dei capelli, le mutazioni eterozigoti possono contribuire a manifestazioni più gravi o precedenti. 52, 55 6) Altri benefici includono la conoscenza associata del modello di eredità e di consulenza genetica più accurata.
Come saranno disponibili ulteriori dati, correlazioni genotipo-fenotipo possono essere fatte e il significato clinico delle singole mutazioni, o loro combinazioni, può essere valutata più affidabile. La domanda per i test molecolari è già in aumento con la scoperta dei difetti molecolari alla base varie perdita dell’udito. Lo spettro di test molecolari disponibili clinicamente o su una base di ricerca è in crescita e può essere seguito sul sito web GeneTests (http://www.genetests.org/servlet/access). E c’è da aspettarsi che i test genetici diventerà parte integrante di ascoltare le valutazioni di perdita a tutte le età, e che UNHS saranno accoppiati con le linee guida per il follow-up. Anche se una mutazione non può essere identificato al momento, ri-contattare e test genetici di follow-up può essere giustificata quando vengono sviluppati saggi molecolari supplementari.
Risultati diagnostici molecolari dovrebbero sempre essere interpretati con cautela, in quanto la nostra conoscenza delle basi molecolari di perdita dell’udito è ancora in evoluzione. Questo pone una sfida per gli operatori sanitari, come pochi sono specializzati in questo settore. Una errata percezione comune è che una mutazione screen negativo esclude la sordità genetica. I nostri rapporti e interpretazioni deve essere personalizzata, dettagliate, e riflettono incertezze attuali conoscenze al momento opportuno. Patogenicità non è ancora stato determinato per tutte le mutazioni descritte (vedi la homepage connessina-sordità per i dati connessina attuali, http://www.crg.es/deafness/) e nuove mutazioni sono scoperti da approcci globali come il sequenziamento del gene.In tali casi, la patogenicità può dedurre dalla conservazione amminoacidica tra le specie, luogo della mutazione ad un residuo corrispondente a mutazioni patogene in geni correlati, impatto di una mutazione in carica e la polarità, coesistenza con altre mutazioni nello stesso gene o in un altro, tipo di perdita dell’udito identificato, studi familiari, e l’assenza della nuova mutazione in un grande gruppo di soggetti di controllo con lo stesso sfondo etnico. Anche così, la patogenicità può essere risolto solo con espressione e studi funzionali. 53 Cautela deve essere praticata anche in termini di eredità, come autosomica dominante e perdita di udito recessivo può essere causata da mutazioni nello stesso gene. Correlazioni genotipo-fenotipo stanno solo ora emergendo e sono oggetto di studio su scala più ampia per determinare l’effetto di composti set mutazione eterozigoti. Anche con mutazioni ben noti, come la mutazione 35delG nel GJB2 gene, tuttavia, la variabilità intra-familiare da lieve a sordità profonda può essere osservato e la prognosi accurata non è attualmente possibile. Ci possono essere mutazioni missense specifiche che esercitano un’influenza nello stato eterozigote. Mutazioni eterozigoti possono anche influenzare la suscettibilità alla presbiacusia o menomazione dell’udito causata dal rumore attraverso un effetto semi-dominante. 20
Considerazioni etiche
I test genetici per la perdita di udito e la sordità non sono collettivamente percepito come vantaggiosa.Soprattutto nella comunità dei non udenti in generale, la sordità è né considerato negativo, né limitando.Questa comunità ha una propria cultura linguistica (linguaggio dei segni), i valori e l’identità di cui la sordità è parte integrante. Non è percepita come una condizione medica. Di conseguenza, i progressi nella ricerca di perdita dell’udito e test genetici potrebbero essere percepite come dannose. Servizi genetici possono essere considerati, tuttavia, perché alcuni individui preferiscono avere bambini sordi. Servizi di consulenza genetica per le famiglie con sordità possono essere solo efficace e appropriato se si prendono i valori sociali della comunità dei non udenti in considerazione. 56
Per sentire i genitori, d’altra parte, avere un figlio non udente o sordo solleva tipicamente molte domande e preoccupazioni per il futuro. La possibilità di determinare l’eziologia della perdita uditiva del loro bambino attraverso metodi non invasivi, la prospettiva di un trattamento mirato e cura completa primi anni di vita, insieme con una comprensione della modalità di trasmissione e del caso di recidiva, sono generalmente accolti e portare ad una maggiore l’accettazione nella comunità udienza. Non a caso, la diagnosi prenatale sarebbe considerato ascoltando individui più di due volte più spesso di quanto da persone sorde (49% contro il 21%), con l’audizione con problemi di caduta tra (39%). All’interno di tutti questi gruppi, l’interruzione della gravidanza sarebbe considerato solo da una piccola minoranza. 57
Atteggiamenti generali del più ampio dell’udienza, sordo, e la comunità con problemi di udito verso i test genetici sono stati recentemente esaminati in collaborazione con l’applicazione generalizzata dello screening uditivo neonatale. Ottantacinque percentuale di udito, e il 62% dei sordi o con problemi di udito individui consentirebbe analisi genetica per il loro bambino, che punta ad aumentare l’accettazione dei test genetici per la perdita dell’udito. 58
Trattamento
La sordità è il solo difetto sensoriale che può essere trattata con successo anche se sordità è completo. Un recente studio impianto cocleare in bambini di 8 a 9 anni di età che hanno ricevuto i loro impianti, prima dei cinque anni, ha dimostrato che tutti i bambini hanno beneficiato di impianto cocleare nei settori della produzione del linguaggio, la percezione del parlato e la lingua. C’era una differenza positiva significativa nella performance cognitiva e la lettura nei bambini con identificati GJB2 mutazioni che causano un insulto isolato alla coclea senza danni al nervo VIII o il sistema uditivo centrale. Anche se la perdita di udito in altri bambini può essere non sindromica e isolato in apparenza, le eziologie sottostanti sono suscettibili di includere asintomatica citomegalovirus congenito (CMV) e la meningite non diagnosticata. Così, questi bambini rischiano di affrontare SNHL con lievi minorazioni aggiuntive a causa di effetti centrali. 59
Chirurgia impianto cocleare è stata eseguita anche in pazienti con MELAS, ereditarietà materna diabete e sordità, sindrome di Kearns-Sayre, e oftalmoplegia esterna progressiva cronica. Anche se una varietà di mutazioni può causare la perdita dell’udito mitocondriale e, anche se la gravità variabile così come progressione dopo l’esordio iniziale sono caratteristiche, la chirurgia impianto cocleare è stato molto utile.Questo suggerisce fortemente che i cambiamenti patologici derivanti dalle mutazioni del mtDNA colpiscono soprattutto la coclea. 42
Conclusioni
Il campo di perdita dell’udito e della sordità ha fatto grandi passi avanti nei settori della ricerca, screening neonatale, diagnosi molecolare e trattamento. La perdita dell’udito è ora identificato presto in tutti i 50 stati, e dei primi risultati di conferma della possibilità di utilizzo più inclusivo del linguaggio e della parola. Attraverso un maggiore indice di sospetto, cause sindromiche possono essere diagnosticati o esclusi con una attenta valutazione, e la base molecolare della sordità può essere determinato in modo più affidabile che mai. Nei casi di SNHL non sindromica, GJB2 analisi della mutazione deve sempre essere offerto, preferibilmente in combinazione graduale con GJB6 test. Eredità e test mitocondriale devono essere considerati in ogni famiglia con più persone affette, tranne quando la perdita di udito è stato chiaramente trasmessa attraverso un maschio. Quando più saggi diventano disponibili, test molecolari potrebbe diventare il primo passo verso la determinazione causale durante il test più invasivi potrebbe essere evitato. Una volta stabilita la causa, il trattamento come ad esempio l’impianto cocleare può migliorare notevolmente la comunicazione e la qualità della vita di molti pazienti. Allo stesso tempo, ogni scoperta nella biologia del sistema uditivo ci porta un passo più vicini a trasformare il silenzio al suono.
References
- Petit, C, Levilliers, J, Marlin, S, and Hardelin, J-P. Hereditary hearing loss. in: CR Scriver, AL Beaudet, WS Sly, D Valle (Eds.) The Metabolic and Molecular Bases of Inherited Disease. 4. ed 8. McGraw-Hill,New York; 2001: 6281–6328
- Mason, JA and Herrmann, KR. Universal infant hearing screening by automated auditory brainstem response measurement. Pediatrics. 1998; 101: 221–228
-
- | PubMed
- Parving, A. The need for universal neonatal hearing screening: some aspects of epidemiology and identification. Acta Paediatr Suppl. 1999; 88: 69–72
-
- | PubMed
- Centers for Disease Control and Prevention (CDC). Infants tested for hearing loss: United States, 1999–2001. MMWR. 2003; 52: 981–984
- Yoshinaga-Itano, C, Sedey, AL, Coulter, DK, and Mehl, AL. Language of early- and later-identified children with hearing loss. Pediatrics. 1998; 102: 1161–1171
-
- | PubMed
- Baroch, KA. Universal newborn hearing screening: fine-tuning the process. Curr Opin Otolaryngol Head Neck Surg. 2003; 11: 424–427
-
- | PubMed
- Marres, HA. Congenital abnormalities of the inner ear. in: H Ludman, T Wright, Bath (Eds.) Diseases of the Ear. Arnold & Oxford University Press, ; 1998: 288–296
- Friedman, TB and Griffith, AJ. Human nonsyndromic sensorineural deafness. Annu Rev Genomics Hum Genet. 2003; 4: 341–402
-
- | PubMed
- Van Camp, G, Willems, PJ, and Smith, RJ. Nonsyndromic hearing impairment: unparalleled heterogeneity. Am J Hum Genet. 1997; 60: 758–764
- ACMG. Genetics evaluation guidelines for the etiologic diagnosis of congenital hearing loss. Genetic Evaluation of Congenital Hearing Loss Expert Panel: ACMG statement. Genet Med. 2002; 4:162–171
-
- | PubMed
- Hone, SW and Smith, RJ. Medical evaluation of pediatric hearing loss: laboratory, radiographic, and genetic testing. Otolaryngol Clin North Am. 2002; 35: 751–764
-
- | PubMed
- Li, XC and Friedman, RA. Nonsyndromic hereditary hearing loss. Otolaryngol Clin North Am. 2002;35: 275–285
-
- | PubMed
- Van Laer, L, Cryns, K, Smith, RJ, and Van Camp, G. Nonsyndromic hearing loss. Ear Hear. 2003; 24:275–288
-
- | PubMed
- Kelsell, DP, Dunlop, J, Stevens, HP, Lench, NJ, Liang, JN, Parry, G, Mueller, RF, and Leigh, IM.Connexin 26 mutations in hereditary non-syndromic sensorineural deafness. Nature. 1997; 387: 80–83
-
- | PubMed
- Del Castillo, I, Moreno-Pelayo, MA, Del Castillo, FJ, Brownstein, Z, Marlin, S, Adina, Q, Cockburn, DJ, Pandya, A, Siemering, KR, Chamberlin, GP, Ballana, E, Wuyts, W, Maciel-Guerra, AT, Alvarez, A, Villamar, M, Shohat, M, Abeliovich, D, Dahl, HH, Estivill, X, Gasparini, P, Hutchin, T, Nance, WE, Sartorato, EL, Smith, RJ, Van Camp, G, Avraham, KB, Petit, C, and Moreno, F. Prevalence and evolutionary origins of the del(GJB6–D13S1830) mutation in the DFNB1 locus in hearing-impaired subjects: a multi-center study. Am J Hum Genet. 2003; 73: 1452–1458
-
- | PubMed
- Denoyelle, F, Weil, D, Maw, MA, Wilcox, SA, Lench, NJ, Allen-Powell, DR, Osborn, AH, Dahl, HH, Middleton, A, Houseman, MJ, Dode, C, Marlin, S, Boulila-ElGaied, A, Grati, M, Ayadi, H, BenArab, S, Bitoun, P, Lina-Granade, G, Godet, J, Mustapha, M, Loiselet, J, El-Zir, E, Aubois, A, Joannard, A, Levilliers, J, Garabedian, E, Mueller, RF, Gardner, RJM, and Petit, C. Prelingual deafness: high prevalence of a 30delG mutation in the connexin 26 gene. Hum Mol Genet. 1997; 6: 2173–2177
-
- | PubMed
- Van Laer, L, Coucke, P, Mueller, RF, Caethoven, G, Flothmann, K, Prasad, SD, Chamberlin, GP, Houseman, M, Taylor, GR, Van de Heyning, CM, Fransen, E, Rowland, J, Cucci, RA, Smith, RJ, and Van Camp, G. A common founder for the 35delG GJB2 gene mutation in connexin 26 hearing impairment. J Med Genet. 2001; 38: 515–518
-
- | PubMed
- Green, GE, Scott, DA, McDonald, JM, Woodworth, GG, Sheffield, VC, and Smith, RJ. Carrier rates in the midwestern United States for GJB2 mutations causing inherited deafness. JAMA. 1999; 281:2211–2216
-
- | PubMed
- Fitzgerald, T, Duva, S, Ostrer, H, Pass, K, Oddoux, C, Ruben, R, and Caggana, M. The frequency of GJB2 and GJB6 mutations in the New York State newborn population: feasibility of genetic screening for hearing defects. Clin Genet. 2004; 65: 338–342
-
- | PubMed
- Cohn, ES and Kelley, PM. Clinical phenotype and mutations in connexin 26 (DFNB1/GJB2), the most common cause of childhood hearing loss. Am J Med Genet. 1999; 89: 130–136
-
- | PubMed
- Yan, D, Park, HJ, Ouyang, XM, Pandya, A, Doi, K, Erdenetungalag, R, Du, LL, Matsushiro, N, Nance, WE, Griffith, AJ, and Liu, XZ. Evidence of a founder effect for the 235delC mutation of GJB2 (connexin 26) in east Asians. Hum Genet. 2003; 114: 44–50
-
- | PubMed
- Grifa, A, Wagner, CA, D’Ambrosio, L, Melchionda, S, Bernardi, F, Lopez-Bigas, N, Rabionet, R, Arbones, M, Monica, MD, Estivill, X, Zelante, L, Lang, F, and Gasparini, P. Mutations in GJB6 cause nonsyndromic autosomal dominant deafness at DFNA3 locus. Nat Genet. 1999; 23: 16–18
-
- | PubMed
- Del Castillo, I, Villamar, M, Moreno-Pelayo, MA, del Castillo, FJ, Alvarez, A, Telleria, D, Menendez, I, and Moreno, F. A deletion involving the connexin 30 gene in nonsyndromic hearing impairment. N Engl J Med. 2002; 346: 243–249
-
- | PubMed
- Wu, BL, Kenna, M, Lip, V, Irons, M, and Platt, O. Use of a multiplex PCR/sequencing strategy to detect both connexin 30 (GJB6) 342 kb deletion and connexin 26 (GJB2) mutations in cases of childhood deafness. Am J Med Genet. 2003; 121A: 102–108
-
- | PubMed
- Stevenson, VA, Ito, M, and Milunsky, JM. Connexin-30 deletion analysis in connexin-26 heterozygotes. Genet Test. 2003; 7: 151–154
-
- | PubMed
- Brown, CW, Levy, ML, Flaitz, CM, Reid, BS, Manolidis, S, Hebert, AA, Bender, MM, Heilstedt, HA, Plunkett, KS, Fang, P, Roa, BB, Chung, P, Tang, HY, Richard, G, and Alford, RL. A novel GJB2 (connexin 26) mutation, F142L, in a patient with unusual mucocutaneous findings and deafness. J Invest Dermatol. 2003; 121: 1221–1223
-
- | PubMed
- Lamartine, J, Munhoz Essenfelder, G, Kibar, Z, Lanneluc, I, Callouet, E, Laoudj, D, Lemaitre, G, Hand, C, Hayflick, SJ, Zonana, J, Antonarakis, S, Radhakrishna, U, Kelsell, DP, Christianson, AL, Pitaval, A, Der Kaloustian, V, Fraser, C, Blanchet-Bardon, C, Rouleau, GA, and Waksman, G. Mutations in GJB6 cause hidrotic ectodermal dysplasia. Nat Genet. 2000; 26: 142–144
-
- | PubMed
- Smith, FJ, Morley, SM, and McLean, WH. A novel connexin 30 mutation in Clouston syndrome. J Invest Dermatol. 2002; 118: 530–532
-
- | PubMed
- Richard, G. Connexin gene pathology. Clin Exp Dermatol. 2003; 28: 397–409
-
- | PubMed
- Simon, AM and Goodenough, DA. Diverse functions of vertebrate gap junctions. Trends Cell Biol.1998; 8: 477–483
-
- | PubMed
- Battey, JF Jr. Using genetics to understand auditory function and improve diagnosis. Ear Hear.2003; 24: 266–269
-
- | PubMed
- Saez, JC, Berthoud, VM, Branes, MC, Martinez, AD, and Beyer, EC. Plasma membrane channels formed by connexins: their regulation and functions. Physiol Rev. 2003; 83: 1359–3400
-
- | PubMed
- Goodenough, DA, Goliger, JA, and Paul, DL. Connexins, connexons, and intercellular communication. Annu Rev Biochem. 1996; 65: 475–502
-
- | PubMed
- Rabionet, R, Gasparini, P, and Estivill, X. Molecular genetics of hearing impairment due to mutations in gap junction genes encoding beta connexins. Hum Mutat. 2000; 16: 190–202
-
- | PubMed
- Teubner, B, Michel, V, Pesch, J, Lautermann, J, Cohen-Salmon, M, Sohl, G, Jahnke, K, Winterhager, E, Herberhold, C, Hardelin, JP, Petit, C, and Willecke, K. Connexin30 (Gjb6)-deficiency causes severe hearing impairment and lack of endocochlear potential. Hum Mol Genet. 2003; 12: 13–21
-
- | PubMed
- Rouan, F, White, TW, Brown, N, Taylor, AM, Lucke, TW, Paul, DL, Munro, CS, Uitto, J, Hodgins, MB, and Richard, G. Trans-dominant inhibition of connexin-43 by mutant connexin-26: implications for dominant connexin disorders affecting epidermal differentiation. J Cell Sci. 2001; 114: 2105–2113
- Marziano, NK, Casalotti, SO, Portelli, AE, Becker, DL, and Forge, A. Mutations in the gene for connexin 26 (GJB2) that cause hearing loss have a dominant-negative effect on connexin 30. Hum Mol Genet. 2003; 12: 805–812
-
- | PubMed
- Everett, LA, Glaser, B, Beck, JC, Idol, JR, Buchs, A, Heyman, M, Adawi, F, Hazani, E, Nassir, E, Baxevanis, AD, Sheffield, VC, and Green, ED. Pendred syndrome is caused by mutations in a putative sulphate transporter gene (PDS). Nat Genet. 1997; 17: 411–422
-
- | PubMed
- Li, XC, Everett, LA, Lalwani, AK, Desmukh, D, Friedman, TB, Green, ED, and Wilcox, ER. A mutation in PDS causes non-syndromic recessive deafness. Nat Genet. 1998; 18: 215–217
-
- | PubMed
- Reardon, W, Coffey, R, Phelps, PD, Luxon, LM, Stephens, D, Kendall-Taylor, P, Britton, KE, Grossman, A, and Trembath, R. Pendred syndrome: 100 years of under-ascertainment?. Q J Med. 1997; 90: 443–447
- Robertson, NG, Lu, L, Heller, S, Merchant, SN, Eavey, RD, McKenna, M, Nadol, JB Jr, Miyamoto, RT, Linthicum, FH Jr, Lubianca Neto, JF, Hudspeth, AJ, Seidman, CE, Morton, CC, and Seidman, JG.Mutations in a novel cochlear gene cause DFNA9, a human nonsyndromic deafness with vestibular dysfunction. Nat Genet. 1998; 20: 299–303
-
- | PubMed
- Sinnathuray, AR, Raut, V, Awa, A, Magee, A, and Toner, JG. A review of cochlear implantation in mitochondrial sensorineural hearing loss. Otol Neurotol. 2003; 24: 418–426
-
- | PubMed
- Fischel-Ghodsian, N. Mitochondrial deafness. Ear Hear. 2003; 24: 303–313
-
- | PubMed
- Sue, CM, Tanji, K, Hadjigeorgiou, G, Andreu, AL, Nishino, I, Krishna, S, Bruno, C, Hirano, M, Shanske, S, Bonilla, E, Fischel-Ghodsian, N, DiMauro, S, and Friedman, R. Maternally inherited hearing loss in a large kindred with a novel T7511C mutation in the mitochondrial DNA tRNA(Ser(UCN)) gene.Neurology. 1999; 52: 1905–1908
-
- | PubMed
- Bitner-Glindzicz, M, Turnpenny, P, Hoglund, P, Kaariainen, H, Sankila, EM, van der Maarel, SM, de Kok, YJ, Ropers, HH, Cremers, FP, Pembrey, M, and Malcolm, S. Further mutations in Brain 4 (POU3F4) clarify the phenotype in the X-linked deafness, DFN3. Hum Mol Genet. 1995; 4: 1467–1469
-
- | PubMed
- Strom, TM, Hortnagel, K, Hofmann, S, Gekeler, F, Scharfe, C, Rabl, W, Gerbitz, KD, and Meitinger, T.Diabetes insipidus, diabetes mellitus, optic atrophy, and deafness (DIDMOAD) caused by mutations in a novel gene (wolframin) coding for a predicted transmembrane protein. Hum Mol Genet. 1998; 7:2021–2028
-
- | PubMed
- Bespalova, IN, Van Camp, G, Bom, SJ, Brown, DJ, Cryns, K, DeWan, AT, Erson, AE, Flothmann, K, Kunst, HP, Kurnool, P, Sivakumaran, TA, Cremers, CW, Leal, SM, Burmeister, M, and Lesperance, MM.Mutations in the Wolfram syndrome 1 gene (WFS1) are a common cause of low frequency sensorineural hearing loss. Hum Mol Genet. 2001; 10: 2501–2508
-
- | PubMed
- Cryns, K, Sivakumaran, TA, Van den Ouweland, JM, Pennings, RJ, Cremers, CW, Flothmann, K, Young, TL, Smith, RJ, Lesperance, MM, and Van Camp, G. Mutational spectrum of the WFS1 gene in Wolfram syndrome, nonsyndromic hearing impairment, diabetes mellitus, and psychiatric disease.Hum Mutat. 2003; 22: 275–287
-
- | PubMed
- Guilford, P, Ben Arab, S, Blanchard, S, Levilliers, J, Weissenbach, J, and Belkahia, A. Joint Committee on Infant Hearing; American Academy of Audiology; American Academy of Pediatrics; American Speech-Language-Hearing Association; Directors of Speech and Hearing Programs in State Health and Welfare Agencies. Year 2000 position statement: principles and guidelines for early hearing detection and intervention programs. Pediatrics. 2000; 106: 798–817
-
- | PubMed
- Green, GE, Smith, RJ, Bent, JP, and Cohn, ES. Genetic testing to identify deaf newborns. JAMA.2000; 284: 1245
-
- | PubMed
- Armitage, IM, Burke, JP, and Buffin, JT. Visual impairment in severe and profound sensorineural deafness. Arch Dis Child. 1995; 73: 53–56
-
- | PubMed
- Kenneson, A, Van Naarden Braun, K, and Boyle, C. GJB2 (connexin 26) variants and nonsyndromic sensorineural hearing loss: a HuGE review. Genet Med. 2002; 4: 258–274
-
- | PubMed
- Wu, BL, Lindeman, N, Lip, V, Adams, A, Amato, RS, Cox, G, Irons, M, Kenna, M, Korf, B, Raisen, J, and Platt, O. Effectiveness of sequencing connexin 26 (GJB2) in cases of familial or sporadic childhood deafness referred for molecular diagnostic testing. Genet Med. 2002; 4: 279–288
-
- | PubMed
- Pandya, A, Arnos, KS, Xia, XJ, Welch, KO, Blanton, SH, Friedman, TB, Garcia Sanchez, G, Liu, MDXZ, Morell, R, and Nance, WE. Frequency and distribution of GJB2 (connexin 26) and GJB6 (connexin 30) mutations in a large North American repository of deaf probands. Genet Med. 2003; 5: 295–303
-
- | PubMed
- Steel, KP. A new era in the genetics of deafness. N Engl J Med. 1998; 339: 1545–1547
-
- | PubMed
- Middleton, A, Hewison, J, and Mueller, RF. Attitudes of deaf adults toward genetic testing for hereditary deafness. Am J Hum Genet. 1998; 63: 1175–1180
-
- | PubMed
- Middleton, A, Hewison, J, and Mueller, R. Prenatal diagnosis for inherited deafness: what is the potential demand?. J Genet Couns. 2001; 10: 121–131
-
- | PubMed
- Martinez, A, Linden, J, Schimmenti, LA, and Palmer, CG. Attitudes of the broader hearing, deaf, and hard-of-hearing community toward genetic testing for deafness. Genet Med. 2003; 5: 106–112
-
- | PubMed
- Bauer, PW, Geers, AE, Brenner, C, Moog, JS, and Smith, RJ. The effect of GJB2 allele variants on performance after cochlear implantation. Laryngoscope. 2003; 113: 2135–2140
-
- | PubMed