OTOTOSSICITÀ: AGENTI CHEMIOTERAPICI
Parole chiave : antibiotici
aminoglicosidici, diuretici dell’ansa, farmaci antineoplastici, derivati
salicilati, eritromicina, minociclina
|
·
|
|
Che cosa è l’Ototossicità
l’Ototossicità
è, molto semplicemente, l’avvelenamento dell’orecchio (oto = orecchio,
tossicità = avvelenamento), che deriva dalla esposizione a farmaci o sostanze
chimiche che danneggiano l’orecchio interno o il nervo cocleovestibolare . Poiché
nell’orecchio interno c’è sia l’organo uditivo ,che dell’equilibrio,
l’ototossicità può provocare disturbi di uno o entrambi questi sensi. Tali
danni possono portare a perdita uditiva temporanea o permanente, e / o a
perdita dell’equilibrio. Le sostanze ototossiche includono diversi
farmaci (ad esempio antibiotici
aminoglicosidi , alcuni agenti anti-cancro , ciclo diuretici , farmaci
anti-malarici
e l’aspirina ),
ed altre sostanze ambientali (ad esempio mercurio, piombo e arsenico). La
tabella elenca alcuni dei farmaci ototossici più comunemente usati e le
sostanze.
|
|
|
|
Normale |
Stereociglia |
Tabella 1. sostanze
comuni note per essere associate con ototossicità
|
Tipo / gruppo |
Denominazione della |
|
Antibiotici |
Gentamicina, streptomicina, |
|
Antibiotici non |
Vancomicina, eritromicina |
|
Diuretici dell’ansa |
Furosemide, acido |
|
Agenti chemioterapici |
Cisplatino, carboplatino, |
|
Salicilati |
Aspirina |
|
I farmaci anti-malarici |
Chinina, clorochina |
|
Sostanze chimiche |
Piombo, mercurio, ossido di |

OTOTOSSICI
EXTRAPROFESSIONALI
Farmaci
ANTITUMORALI
|
farmaci |
Vestibolotossici |
Cocleotossici |
Livello di Tossicità |
|
Carboplatino |
|
1-10%
|
|
|
Cisplatino |
Minore |
69% |
dose totale> 200 mg / mq metro |
|
Mostarda azotata |
sì |
sì |
|
|
Vincristina |
sì |
sì
|
|
Agenti antineoplastici
Agenti antineoplastici più comunemente associati con
ototossicità sono il cisplatino composti a base di platino e, in misura minore,
carboplatino. Questi agenti sono ampiamente utilizzati in ginecologica, polmone
, sistema nervoso centrale, testa e collo , e tumori testicolari .
Antineoplastici sono ciclo cellulare agenti alchilanti non specifici che inseriscono
nel elica del DNA, interrompendo la replicazione.
Il cisplatino è ampiamente distribuito, ma le concentrazioni più
elevate si trovano nei reni, fegato e prostata. Cisplatino si lega in maniera
irreversibile alle proteine plasmatiche e può essere rilevato
fino a 6 mesi dopo il completamento della terapia. Carboplatino non è legato
alle proteine plasmatiche e viene più facilmente eliminato dai
reni. Dose e l’efficacia di cisplatino e carboplatino sono limitati in gran
parte dagli effetti avversi. In particolare, questi agenti producono
nefrotossicità e ototossicità con l’aumentare della dose.
Fisiopatologia
Il meccanismo di ototossicità platino è mediata dalla produzione
di radicali liberi e la morte cellulare. Composti del platino danneggiano il vascularis
stria nei media Scala e causano la morte delle cellule ciliate esterne a
partire dalla giro basale della coclea. Specie di radicali liberi sono prodotti
dalla NADPH ossidasi nelle cellule ciliate interne a seguito di esposizione
cisplatino. NADPH ossidasi è l’enzima che catalizza la formazione di radicali
superossido. Una forma particolare di NADPH ossidasi, NOX3, è fortemente e
selettivamente prodotta nell’orecchio interno ed è un’importante fonte di
generazione di radicali liberi nella coclea, che potrebbe contribuire alla
perdita dell’udito. [6] I radicali liberi generati da questo meccanismo, allora
conducono ai mitocondri-mediata e la morte cellulare per apoptosi
caspasi-mediata, e la perdita dell’udito permanente definitiva.
Epidemiologia
L’incidenza e la gravità di ototossicità dipendono dalla dose,
velocità di infusione, e il numero di cicli, lo stato renale e
co-somministrazione di altri agenti ototossici. L’incidenza e la gravità è
anche maggiore nella popolazione pediatrica e nei pazienti sottoposti a
radioterapia alla testa e al collo. Alcuni studi descrivono una perdita uditiva
del 61% dei bambini trattati con chemioterapia a base di platino. [14] Questo è
paragonabile con gli studi precedenti.
Fattori di rischio
I seguenti fattori di rischio sono stati identificati per lo
sviluppo e potenziamento di platino ototossicità indotta: (1) ad alta dose e il
numero di cicli, (2) irradiazione cranica concomitante o passato, (3) età
estreme, (4) disidratazione, (5 ) co-somministrazione di altri agenti
ototossici, e (6) insufficienza renale.
Segni e sintomi
I pazienti con ototossicità platino indotta possono segnalare
acufene e l’esperienza soggettiva perdita dell’udito. La perdita dell’udito
associati a tossicità cisplatino è solitamente bilaterale, neurosensoriale,
irreversibile e progressiva. Udito ad alta frequenza è tipicamente influenzata
in primo luogo, ma la perdita non può essere visualizzato fino a diversi giorni
o mesi dopo l’ultima dose. Al contrario, ipoacusia grave può verificarsi dopo
una singola dose.
Prevenzione
Ottenere audiogrammi iniziali e periodici audiogrammi follow-up
durante la terapia per tutti i pazienti trattati con questi farmaci. Eseguire
questi studi immediatamente prima cicli successivi droga così l’effetto massimo
del ciclo precedente può essere determinato. Infine, i pazienti devono
continuare a sottoporsi a test audiometrico a causa di una significativa
ritenzione farmaco a lungo dopo il completamento della terapia. Anche
consigliare ai pazienti di evitare l’esposizione al rumore per un massimo di 6
mesi.
Recenti studi hanno esplorato agenti come l’a-tocoferolo (un
derivato della vitamina E), D-metionina (un amminoacido), salicilati, chelanti
del ferro, N-acetil-cisteina (un antiossidante), caspasi o inibitori calpaina,
e anche la terapia genica come preventivi se usato in combinazione con agenti
chemioterapici a base di platino. Questi studi hanno dimostrato un
significativo beneficio in modelli animali, ma devono essere replicato in
modelli umani preservando gli effetti antineoplastici di agenti come il
cisplatino. [11]
Cisplatino
Il cisplatino attualmente è il farmaco antitumorale più
utilizzato nei pazienti affetti da umori solidi pediatrici selezionati .Nelle
neoplasie trattati con cisplatino è stato osservato un severo effetto
ototossico mediato dal chemioterapico (Riwelski et al.. 2001) che può danneggiare le cellule di sostegno (Ramirez-Camacho et al,
2004).. Alcuni studi condotti su pazienti trattati con protocolli
chemioterapici allestiti con ci-splatino hanno evidenziato una severa ma
reversibile ototossicità (Shellens et al., 2001). La tossicità inizia nelle
cellule ciliate esterne (Reavis et al, 2011) e per questo motivo è stato
suggerito che le DPOAE ‘ s ( Prodotti di Distorsione delle Otoemissioni
Acustiche )rappresentino un metodo valido per rilevare la ototossicità. La
tossicità del cisplatino è sinergica con gentamicina e è stato segnalato che
alte dosi di cisplatino possano causare sordità totale. Rispetto al
cisplatino, l’oxaliplatino è caratterizzato da una minore tossicità documentata
nell’uomo (Haller et al, 2000; Su et al, 2000).
Livello d’azione/caratteristiche del danno: il danno ototossico
mediato dal cisplatino si esplica a livello dell’organo del Corti. Le cellule
ciliate esterne, specie quelle del giro basale, sono elettivamente coinvolte
(Dehne et al.. 2001; Feghali et al.. 2001). Un possibile meccanismo ipotizzato
per spiegarne l’ototossicità è l’alterazione dei sistemi antiossidanti con
conseguente aumento dei radicali liberi mediato dal farmaco.
|
|
|
|
Fig. 1a mostra le soglie medie per tutti i gruppi (controllo e |
L’ampiezza media del DP-grammi in funzione della frequenza f2 |
|
|
|
Carboplatino
Livello d’azione e caratteristiche del danno: in pazienti
sottoposti a chemioterapia per neoplasie sono stati osservati effetti
ototossici negli esposti ad alte dosi di carboplatino.
In studi compiuti su topi esposti al chemioterapico è stato
documentato che il carboplatino induce stress ossidativo nella coclea
dell’animale generando radicali liberi e determinando inattivazione dei sistemi
antiossidanti (Husain et al., 2001).
Test di base deve essere ottenuta prima dell’inizio di agenti
chemioterapici, soprattutto cisplatino e carboplatino. In quei pazienti che
assumono aminoglicosidi, test di base deve essere ottenuto entro 72 ore
dall’inizio del trattamento. Selezione dei pazienti, complicando fattori
medici, livello di coscienza, e l’età gioca un ruolo nella selezione dei metodi
per la diagnosi precoce.
METODI DI MONITORAGGIO AUDIOLOGICO
Audiometria tonale di base, quando possibile, dovrebbe essere effettuata
. Come minimo le soglie ai tono puri- bilateralmente per via aerea per le
frequenze audiometriche standard di 0,25-8 kHz. Se l’apparecchiatura permette
frequenze di soglia di circa 8 kHz dovrebbero anche essere misurate. Ulteriori
test dovrebbe includere la storia familiare, l’esame otoscopico, impedenzometria
,via ossea ed audiometria vocale.
Per i pazienti non sono in grado di cooperare effettuare test
oggettivo con le emissioni otoacustiche (OAE), EchochG, e / o la risposta
uditivi del tronco encefalico (ABR) test dovrebbe essere ottenuto per la
documentazione e il monitoraggio. Test OAE è specificamente sensibili allo
stato delle cellule ciliate esterne della coclea ed è un test obiettivo
relativamente efficiente per valutare la cocleotossicità,l’.EChochG è un test
transtimpanico più invasivo e richiede tempo che valuta risposte cocleari e
neurali. ABR è anche un test che richiede tempo ed è inoltre limitata agli
stimoli risposte a frequenze comprese tra 1 e 4 kHz.
Il monitoraggio deve continuare durante la terapia a intervalli
regolari. Con qualsiasi segno di ototossicità, si dovrebbero adottare misure
per ridurre la tossicità possibile. Per antibiotici aminoglicosidici,
settimanale al test bi-settimanale è stato suggerito. Per i farmaci
chemioterapici, si consiglia il test settimanale. L’intervallo per il test
dovrebbe diminuire con il primo segno di cambiamento ototossico. Il
monitoraggio dovrebbe continuare per almeno 3-6 mesi dopo la sospensione del farmaco
potenzialmente ototossici o fino a quando l’udienza si stabilizza.
Definizione e gradi di ototossicità
La definizione e criteri per la ototossicità è stato stabilito
dalla American Speech-Language-Hearing Association (ASHA), il National Cancer
Institute Criteri Comuni di Terminologia per gli Eventi Avversi (CTCAE), e
Brock.
ASHA definisce ototossicità come: (a) 20db o maggiore
diminuzione del puro-tono soglia a una frequenza, (b) 10dB o superiore
diminuito a 2 frequenze adiacenti, o (c) perdita di risposta a 3 frequenze di
prova consecutivi in cui le risposte erano precedentemente ottenuto, quando
viene utilizzato OAE o ABR.
Il CTCAE e Brock hanno determinato gradi per definire
ulteriormente ototossicità come segue:
CTCAE gradi ototossicità 1-4
Grado 1 – spostamento Soglia o perdita di 15-25 dB rispetto al
basale, una media di due o più frequenze contigui in almeno un orecchio.
Grado 2 – spostamento Soglia o perdita di> 25-90 dB, una
media di due frequenze di prova contigui in almeno un orecchio
Grado 3 – La perdita dell’udito sufficiente indicare intervento
terapeutico, compresi apparecchi acustici (ad esempio,> 20 dB HL bilaterale
nelle frequenze del parlato;> 30 dB HL unilaterale, e che richiedono servizi
aggiuntivi del linguaggio correlati)
Grado 4 – Indicazioni per impianto cocleare e che richiedono
ulteriori servizi connessi discorso-linguaggio
Gradi di Brock perdita dell’udito
Grado 0 – Audizione soglie inferiore a 40 dB HL a tutte le
frequenze
Grado 1 – Soglie 40 dB o superiore a 8.000 Hz
Grade 2 – Soglie 40 dB o superiore a 4.000-8.000 Hz
Grado 3 – Soglie 40 dB o superiore a 2,000-8,000 Hz
Grado 4 – Soglie a 40 dB o superiore a 1,000-8,000 Hz
Cavaliere et al suggeriscono che la tradizionale CTCAE ha
sotto-riportata ototossicità e minimizzato il significato della perdita
dell’udito nei bambini trattati con agenti chemioterapici a base di platino.
[14]
Vestibolotossicità
Criteri Vestibolotossici non sono stati ben stabiliti. Batteria
standard di test vestibolare, compreso il test calorico, VEMP, e VNG, sono
utili per documentare vestibulopathy. Inoltre, data oscillopsia come il sintomo
principale, l’aggiunta di test rotazionale , soprattutto alle alte frequenze, è
raccomandato. La presenza della funzione di rotazione può non essere evidente
dopo il test calorico e può indicare le risposte intatti in altre aree di
sensibilità vestibolare che potrebbero altrimenti perdere. Intatto funzione può
separare il paziente che beneficeranno di riabilitazione vestibolare dal
paziente che non lo faranno.
I pazienti con vestibolotossicità hanno deficit bilaterali e non
presenteranno con nistagmo o denunce di vertigine. Test clinici come dinamica
test dell’acuità visiva, testa comodino spinta test, [16] occhio di test
grafico, e la testa impulso di prova orizzontale [17] sono stati utilizzati per
esaminare il deficit del riflesso vestibolo-oculare (VOR) in pazienti con
vestibulopathy bilaterale causata da farmaci vestibolotossicità . Purtroppo, le
relazioni soggettive dei pazienti non correlano bene con parametri di prova.
[16]
Un test capezzale per l’acuità visiva dinamica è la prova
grafico occhio. In questo esame, l’esaminatore detiene una versione in
miniatura di un grafico occhio sui 18 pollici di fronte al soggetto da testare.
La persona legge la riga più piccolo possibile. Questo rappresenta la migliore
visione normale della persona. Poi l’esaminatore ruota la testa in avanti e
indietro circa una volta al secondo e chiede alla persona di leggere la riga
più piccolo possibile. Una persona con un sistema vestibolare intatto e VOR
dovrebbe essere in grado di leggere la stessa linea. Una persona con
oscillopsia, tuttavia, può solo leggere le righe con molto più grande di
stampa. Il numero di linee “lost” è indicativo del grado di oscillopsia.
[18]
Un altro test capezzale utilizzato per valutare la VOR è la
spinta testa. Il test head-spinta viene eseguita afferrando la testa del
paziente e applicando breve piccola ampiezza, elevate spinte testa
accelerazione, prima da un lato e poi dall’altro. Il paziente viene chiesto di
fissare sul naso dell’esaminatore e l’esaminatore orologi per ‘saccades
catch-up, “un segno di diminuzione del guadagno VOR orizzontale sul lato
ipsilaterale a cui la testa era stata trasformata. [19]
Gestione
La preoccupazione principale è mantenere la capacità di
comunicazione del paziente durante quello che è generalmente una grave
malattia. Consultare un medico specializzato in anticipo per la valutazione
basale. Inoltre, è essenziale per consigliare i pazienti e genitori per quanto
riguarda i rischi di farmaci ototossici e sottolineare l’importanza della
tempestiva segnalazione di sintomi quali tinnito, perdita, oscillopsia, e
dysequilibrium dell’udito.
-Suoni ad alta frequenza fornire importanti contributi alla
intelligibilità del parlato e può pertanto avere effetti significativi sulla
comunicazione e le abilità di ascolto. Quando si verifica la perdita
dell’udito, riferendosi pazienti adeguatamente per ascoltare l’amplificazione
per impedire la comunicazione, sociale, istruzione e battute d’arresto è
essenziale.
Il sistema vestibolare è in grado di compensare la perdita
unilaterale. vestibolare riabilitazione è raccomandato per aiutare un individuo
nel facilitare compensazione. In perdita bilaterale, la riabilitazione sarà aiutare
il paziente utilizzando altri meccanismi per migliorare l’equilibrio e la
funzione.
References
1.
Kahlmeter G, Dahlager JI.
Aminoglycoside toxicity – a review of clinical studies published between 1975
and 1982. J Antimicrob Chemother.
Jan 1984;13 Suppl A:9-22. [Medline].
2.
Monsell EM, Cass SP, Rybak LP.
Therapeutic use of aminoglycosides in Ménière’s disease. Otolaryngol
Clin North Am. Oct 1993;26(5):737-46. [Medline].
3.
Hirvonen TP, Minor LB, Hullar TE,
Carey JP. Effects of intratympanic gentamicin on vestibular afferents and hair
cells in the chinchilla. J Neurophysiol.
Feb 2005;93(2):643-55. [Medline].
4.
Hiel H, Schamel A, Erre JP,
Hayashida T, Dulon D, Aran JM. Cellular and subcellular localization of
tritiated gentamicin in the guinea pig cochlea following combined treatment
with ethacrynic acid. Hear Res.
Jan 1992;57(2):157-65. [Medline].
5.
Leitner MG, Halaszovich CR, Oliver
D. Aminoglycosides inhibit KCNQ4 channels in cochlear outer hair cells via
depletion of phosphatidylinositol(4,5)bisphosphate. Mol
Pharmacol. Jan 2011;79(1):51-60.[Medline].
6.
Rybak LP, Whitworth CA. Ototoxicity:
therapeutic opportunities. Drug Discov Today. Oct 1
2005;10(19):1313-21. [Medline].
7.
Selimoglu E. Aminoglycoside-induced
ototoxicity. Curr Pharm Des. 2007;13(1):119-26. [Medline].
8.
Matz GJ. Aminoglycoside cochlear
ototoxicity. Otolaryngol Clin North Am. Oct
1993;26(5):705-12.[Medline].
9.
Fischel-Ghodsian N. Genetic factors
in aminoglycoside toxicity. Ann N Y Acad Sci. Nov
28 1999;884:99-109. [Medline].
10.
Roland PS. New developments in our
understanding of ototoxicity. Ear Nose Throat J.
Sep 2004;83(9 Suppl 4):15-6; discussion 16-7. [Medline].
11.
Rybak LP, Kelly T. Ototoxicity:
bioprotective mechanisms. Curr Opin Otolaryngol Head Neck Surg. Oct
2003;11(5):328-33. [Medline].
12.
Uzun C, Koten M, Adali MK, et al. Reversible
ototoxic effect of azithromycin and clarithromycin on transiently evoked
otoacoustic emissions in guinea pigs. J Laryngol
Otol. Aug 2001;115(8):622-8.[Medline].
13.
Levine DP. Vancomycin: a
history. Clin Infect Dis. Jan 1 2006;42 Suppl 1:S5-12. [Medline].
14.
Knight KR, Kraemer DF, Neuwelt EA.
Ototoxicity in children receiving platinum chemotherapy: underestimating a
commonly occurring toxicity that may influence academic and social
development. J Clin Oncol.
Dec 1 2005;23(34):8588-96. [Medline].
15.
Jung TT, Rhee CK, Lee CS, et al.
Ototoxicity of salicylate, nonsteroidal antiinflammatory drugs, and
quinine. Otolaryngol Clin North Am.
Oct 1993;26(5):791-810. [Medline].
16.
Bhansali SA, Stockwell CW, Bojrab DI. Oscillopsia
in patients with loss of vestibular function. Otolaryngol
Head Neck Surg. Jul 1993;109(1):120-5. [Medline].
17.
MacDougall HG, Weber KP, McGarvie
LA, Halmagyi GM, Curthoys IS. The video head impulse test: diagnostic accuracy
in peripheral vestibulopathy. Neurology.
Oct 6 2009;73(14):1134-41. [Medline].
18.
Jonathan B Clark, MD, MPH.
Evaluation of Visual Vestibular Interaction With the Dynamic Visual Acuity
Test. micromedical.com. Available at http://www.micromedical.com/Newsletter/MMNewsletter20.pdf. Accessed 4/25/2010.
19.
Ishiyama G, Ishiyama A, Kerber K,
Baloh RW. Gentamicin ototoxicity: clinical features and the effect on the human
vestibulo-ocular reflex. Acta Otolaryngol.
Oct 2006;126(10):1057-61. [Medline].
20.
Lai P, Coulson C, Pothier DD, Rutka
J. Chlorhexidine ototoxicity in ear surgery, part 1: review of the
literature. J Otolaryngol Head Neck Surg.
Dec 2011;40(6):437-40. [Medline].
21.
Kaplan DM, Hehar SS, Bance ML, et
al. Intentional ablation of vestibular function using commercially available
topical gentamicin-betamethasone eardrops in patients with Meniere’s disease:
further evidence for topical eardrop ototoxicity. Laryngoscope.
Apr 2002;112(4):689-95. [Medline].
22.
Cohen-Kerem R, Kisilevsky V,
Einarson TR, et al. Intratympanic gentamicin for Menière’s disease: a
meta-analysis. Laryngoscope.
Dec 2004;114(12):2085-91. [Medline].
23.
American Speech-Language Hearing
Association. (1994). Audiologoc Managment of Individuals Recieving Cochleotoxic
Drug Therapy [Guidelines]. Available at www.asha.org/policy.
24.
Barlow DW, Duckert LG, Kreig CS, et
al. Ototoxicity of topical otomicrobial agents. Acta
Otolaryngol. Mar 1995;115(2):231-5. [Medline].
25.
Campbell KC, Durrant J. Audiologic
monitoring for ototoxicity. Otolaryngol Clin North Am. Oct
1993;26(5):903-14. [Medline].
26.
Dayal VS, Chait GE, Fenton SS.
Gentamicin vestibulotoxicity. Long term disability. Ann
Otol Rhinol Laryngol. Jan-Feb 1979;88(1 Pt
1):36-9. [Medline].
27. Edson RS, Terrell CL. The aminoglycosides. Mayo Clin
Proc. May 1999;74(5):519-28. [Medline].
28.
Fausti SA, Henry JA, Helt WJ, et al.
An individualized, sensitive frequency range for early detection of
ototoxicity. Ear Hear.
Dec 1999;20(6):497-505. [Medline].
29.
Govaerts PJ, Claes J, van de Heyning
PH, et al. Aminoglycoside-induced ototoxicity. Toxicol Lett. Aug
1990;52(3):227-51. [Medline].
30.
Henley CM, Rybak LP. Developmental
ototoxicity. Otolaryngol Clin North Am. Oct 1993;26(5):857-71.[Medline].
31.
Huizing EH, de Groot JC. Human
cochlear pathology in aminoglycoside ototoxicity–a review. Acta
Otolaryngol Suppl. 1987;436:117-25. [Medline].
32.
Ikeda K, Oshima T, Hidaka H, et al.
Molecular and clinical implications of loop diuretic ototoxicity. Hear
Res. May 1997;107(1-2):1-8. [Medline].
33.
Knight KR, Kraemer DF, Neuwelt EA.
Ototoxicity in children receiving platinum chemotherapy: underestimating a
commonly occurring toxicity that may influence academic and social
development. J Clin Oncol.
Dec 1 2005;23(34):8588-96. [Medline].
34.
Lee KJ, ed. Essential
Otolaryngology Head and Neck Surgery. 995-998. 8th.
McGraw-Hill: 2003:104-105.
35.
Nielsen-Abbring FW, Perenboom RM,
van der Hulst RJ. Quinine-induced hearing loss. ORL J Otorhinolaryngol
Relat Spec. 1990;52(1):65-8. [Medline].
36.
Powell SH, Thompson WL, Luthe MA, et
al. Once-daily vs. continuous aminoglycoside dosing: efficacy and toxicity in
animal and clinical studies of gentamicin, netilmicin, and tobramycin. J
Infect Dis. May 1983;147(5):918-32. [Medline].
37.
Rademaker-Lakhai JM, Crul M, Zuur L,
et al. Relationship between cisplatin administration and the development of
ototoxicity. J Clin Oncol.
Feb 20 2006;24(6):918-24. [Medline].
38.
Roland PS. Summary of the findings
of a joint consensus panel on the use of potentially ototoxic
ototopicals. Ear Nose Throat J.
Sep 2004;83(9 Suppl 4):13-4. [Medline].
39.
Rybak LP. Ototoxicity of loop
diuretics. Otolaryngol Clin North Am. Oct 1993;26(5):829-44. [Medline].
40.
Rybak LP, Whitworth C, Scott V.
Comparative acute ototoxicity of loop diuretic compounds. Eur
Arch Otorhinolaryngol. 1991;248(6):353-7. [Medline].
41.
Schacht J, Weiner N.
Aminoglycoside-induced hearing loss: a molecular hypothesis. ORL
J Otorhinolaryngol Relat Spec.
1986;48(2):116-23. [Medline].
42.
Talbert RL, Ludden TM, West RE.
Rapid establishment of therapeutic serum concentrations of salicylates.J
Clin Pharmacol. Feb-Mar 1979;19(2-3):108-12. [Medline].
43.
Temple AR. Acute and chronic effects
of aspirin toxicity and their treatment. Arch Intern
Med. Feb 23 1981;141(3 Spec No):364-9. [Medline].
44.
Vasquez EM, Maddux MS, Sanchez J, et
al. Clinically significant hearing loss in renal allograft recipients treated
with intravenous erythromycin. Arch Intern Med.
Apr 12 1993;153(7):879-82. [Medline].
Chemotherapy
ototoxicity references
• Freilich
RJ, Kraus DH, Budnick AS, Bayer LA, Finlay JL. Hearing loss in children with
brain tumors treated with cisplatin and carboplatin based high-dosed
chemotherapy with autologous bone marrow rescue. Med
Pediatr Oncol 1996 Feb;26(2):95-100.
• RAMIREZ-CAMACHO
R, Garcia-Berrocal JR, Bujan J, Martin-Marero A, et al. Supporting cells as a target of cisplatin-induced inner ear
damage: therapeutic implications. Laryngoscope 2004;114:533-7.
• Reavis KM
and many others. Distortion-Product Otoacoustic Emission Test Performance for
Ototoxicity Monitoring Ear&Hearing2011;32;61–74
• Rubin JS,
Wadler S, Beitler JJ, Haynes H, Rozenblit A, McGill F, Goldberg G, Runowicz C.
Audiological findings in a Phase I protocol investigating the effect of WR 2721,
high-dose cisplatin and radiation therapy in patients with locally advanced
cervical carcinoma. J Laryngol Otol 1995 Aug;109(8):744-747.
• Rybak LP,
Husain K, Morris C, Whitworth C, Somani S. Effect of protective agents against
cisplatin ototoxicity. Am J Otol 21:513-520, 2000
• KALKANIS
JG, Whitworth C, Rybak LP. Vitamin E reduces cisplatin ototoxicity.
Laryngoscope 2004;114:538-42.
• Salvinelli
F, Casale M, Vincenzi B, Santini D, Di Peco V, Firrisi L, Onori N, Greco F,
Tonini G.Bilateral irreversible hearing loss associated with the combination of
carboplatin and paclitaxel chemotherapy: a unusual side effect. J
Exp Clin Cancer Res 2003 Mar;22(1):155-8
Prodotto Distortion otoemissioni acustiche: una tecnica oggettiva
per lo screening di perdita dell’udito nei bambini trattati con i derivati Platin.
|
|
Ingeborg Dhooge, Catharina Dhooge *, Sven Geukens, Bieke De Univ.-HNO-Klinik Pubblicato |
1. INTRODUZIONE
Gli agenti chemioterapici
contenenti platino svolgono un ruolo chiave nel trattamento di tumori solidi
pediatrici selezionati. La somministrazione di cisplatino è complicata da
sequele a lungo termine, come ad alta frequenza (HF) sordità neurosensoriale
(SNHL).Carboplatino, un analogo del cisplatino, ha anche dimostrato attività
antitumorale, ma è meno nefrotossici e ototossici meno di cisplatino ( Stern e
Bunin 2002 ).
ototossicità monitoraggio durante la terapia viene di solito eseguita per mezzo
di ripetute audiometria tonale. Vari gradi (grado 0-4) di perdita
dell’udito può essere scoredusing il sistema di classificazione Brock ( Brock et al
1991 ). Tuttavia, questa tecnica ha tre grossi
inconvenienti:
1.) effetti ototossici spesso mostrano il loro primo impatto nelle regioni
frequenze al di sopra di 8000 Hz
. 2) Nei bambini audiometria tonale è spesso problematico
3) La scala Brock assume un udito normale al basale che possono non essere
sempre così.
Questo studio retrospettivo è stato progettato per esaminare l’efficacia di
DPOAEs come alternativa obiettivo di HF audiometria tonale nella rilevazione di
SNHL ototossici causa di un trattamento con dosi standard di derivati Platin in
una popolazione adulta pediatrica e giovani.
2. Materiali e Metodi
Trentaquattro
bambini e giovani adulti trattati per tumore alla Divisione
Pediatrica di Ematologia e Oncologia presso l’Ospedale Universitario di Gand
sono stati inclusi.
Sedici pazienti sono stati precedentemente trattati con dosi standard di
cisplatino (sei pazienti) o carboplatino (otto pazienti) o entrambi (due
pazienti). Indicazioni per la chemioterapia erano neuroblastoma (NB, tre
pazienti), epatoblastoma (un paziente), teratocarcinoma (un paziente),
rabdomiosarcoma (RMS, tre pazienti), PNET-CNS (4 pazienti), osteosarcoma (un
paziente) e nefroblastoma (tre pazienti ).
Oltre cisplatino o
carboplatino e, orari di chemioterapia consisteva di alte dosi di methotrexate,
ifosfamide, cyclofosfamide, vincristina, etoposide, adriamicina, bleomicina,
actinomycin e epirubicina a seconda del tipo di cancro.
Diciotto pazienti che non hanno ricevuto i derivati Platin,
serviti come controlli. Entrambi i gruppi hanno ricevuto schemi di
trattamento antibiotico simili e gli stessi orari per neutropenia
febbrile.
nefrotossicità è stata misurata mediante la velocità di filtrazione glomerulare
della creatinina (GFR CREA) utilizzando la formula di Schwartz. Le
caratteristiche dei pazienti sono elencate nella Tabella 1.
|
|
Gruppo |
Controlli |
|
Numero |
16 nessuna 2226 |
18 nessuna – |
*
P: ns (ANOVA)
**
TM: timpanica membrana
Parametri
otoscopia e Immittance normali sono stati considerati obbligatori per
l’inclusione nel protocollo di prova. Standard conduzione aerea e ossea
tono puro soglia audiometria è stata effettuata in una cabina trattato suono
utilizzando un audiometro Interacoustics AC40 clinica (calibrazione: ISO389,
1975). La tecnica Hughson-Westlake modificato è stato applicato. Ad
alta frequenza di conduzione dell’aria audiometria è stato testato con la
stessa audiometro con Koss HV / Pro cuffie ad alta frequenza
digitali. Toni puri pulsati sono stati presentati in 8000, 10000, 12500 e
16000 Hz. Riflessi condizionati strumentali (ICR) sono stati utilizzati in
bambini di età inferiore ai 3 anni. Sei frequenze (250, 1000, 4000, 10000,
12500 e 16000 Hz) sono stati testati in questo gruppo per approssimare il grado
di perdita dell’udito. DPOAEs sono stati registrati utilizzando il
Otodynamics Analyzer (versione Research ILO-96), con un rapporto di frequenza
di 1,22 e due livelli di stimolo di 75-70 e di 65-55 dB SPL, ottenendo il
2F1-f2 DP-GRAM. Il DPOAE variava da frequenze f2 comprese tra 1001 e 6165
Hz, con un otto punti per la risoluzione di ottava. Il criterio per una
risposta valida DPOAE era un livello 2F1-f2 di 3 dB sopra rumore.
3. RISULTATI
Fig. 1 mostra
le soglie medie per tutti i gruppi (controllo e le tre sottogruppi di
trattamento). L’ampiezza media del DP-grammi in funzione della frequenza
f2 è mostrato in Fig. 2 . C’era una differenza significativa
tra il gruppo cisplatino e ogni altro gruppo, per le soglie audiometriche medi,
nonché per i livelli di risposta per tutti f2 frequenze di 3088 Hz e superiori.


Ulteriori
analisi dei dati audiometrici del gruppo cisplatino è stata effettuata
utilizzando la classificazione di Brock et al (1991). Il rischio per lo
sviluppo di ototossicità, cioè grado di perdita dell’udito HF, aumenta con la
dose cumulativa di cisplatino (significativa correlazione di Spearman-rank di
0,74, p <0,05). L’importanza della dose cumulativa spiega l’assenza di
una sostanziale perdita dell’udito HF nel sottogruppo carboplatino / cisplatino
in cui la dose cumulativa cisplatino non superava 560 mg/m2.
grado
di tossicità e cisplatino cumulativa percepita sono mostrati in Tabella 3. Un
significativo correlazione di .83 (Spearman-rank correlazione, p <0.05), è
stata trovata tra il livello di risposta 2F1-F2 e dose cumulativa
cisplatino. I pazienti che avevano ricevuto una dose bassa o media
(<600 mg/m2) era significativamente migliore DP-grammi (p <0,0001)
rispetto ai pazienti che avevano ricevuto 600 mg/m2 o più.
Infine, un
Pearson analisi di correlazione di tali dati ha mostrato una correlazione
altamente significativa di 0,82 (p <0.01) tra i dati audiometrici e DPOAE
ampiezza.
Tabella 2 : classificazione di perdita dell’udito ad alta frequenza
bilaterale indotta da cisplatino secondo Brock et al. (1991) , il
grado di tossicità e la dose accumulata cisplatino ricevuti.
|
|
Grado |
Designazione |
Numero di |
Dose cumulativa |
|
<40 dB |
0 |
Nessuno |
1 |
400 |
|
≥ |
1 |
Mite |
1 |
550 |
|
≥ |
2 |
Moderato |
2 |
650 |
|
≥ |
3 |
Segnato |
2 |
710 |
|
≥ |
4 |
Grave |
|
|
4. DISCUSSIONE
Monitoraggio per ototossicità è essenziale nella gestione dei
pazienti con tumore trattati con possibili agenti ototossici. La diagnosi
precoce è importante per regolare il trattamento. Se ulteriori danni è
inevitabile, possono essere adottate misure riabilitative precoci. Un’associazione
tra la dose di cisplatino cumulativa e l’incidenza di ipoacusia è stata
confermata nel nostro gruppo di pazienti. HF audiometria è più
sensibile ai danni ototossico rispetto ai tradizionali audiometria
tonale. Per il gruppo carboplatino trovato senza apprezzabili perdite
uditive tono puro, né per i pazienti trattati con una combinazione di
cisplatino e
carboplatino. Le
dosi cumulative moderate dato per carboplatino nel nostro gruppo di pazienti,
la variabilità fra suscettibilità alla ototossicità e il fatto che l’ dose di
carboplatino per corso era basso, può spiegare l’assenza di ototossicità in
questi pazienti. ( Freilich et al 1996; Parsons et al 1998;
Watanabe et al 2002 ). Diversi argomento autori l’uso di DPOEAs nella
valutazione della funzione cocleare dopo chemioterapia con cisplatino ( Zorowka et
al 1993; Littman et al 1998; Ress et al 1999; Stavroulaki et al 2001) . Le
nostre osservazioni confermano i risultati di questi studi, dal fatto che DPOAEs
correla molto bene con i dati audiometrici. E ‘comunque importante
sottolineare che, anche se i loro livelli di risposta sembrano superiori
rispetto ai controlli, le risposte OAE ottenuti dai pazienti carboplatino e
pazienti carboplatino cisplatino sono entro i valori normali e non differiscono
in modo significativo l’uno
dall’altro. Una riduzione
significativa è stata osservata solo nel gruppo cisplatino. Ototossicità
Monitoraggio con l’uso di DPOAEs è particolarmente utile nel follow-up di bambini
ed infanti perché è un metodo non invasivo, abbastanza rapido da gestire e
facile da usare. Otoemissioni acustiche non sono influenzate da
interpretazioni soggettive, rendendo questa tecnica altamente riproducibile e
più preciso di audiometria.
RIFERIMENTI
Brock PR, Bellman SC, Yeomans CE; Pinkerton CR & Pritchard
J. 1991 ototossicità Cisplatino nei bambini:.. un sistema di
classificazione pratico Med Pediatr Oncol ., 19, 295-300 Freilich
RJ, Kraus DH, Budnick AS, Bayer LA & Finlay JL 1996 . perdita
dell’udito nei bambini con cervello tumori trattati con cisplatino e
carboplatino-a base di chemioterapia ad alte dosi con trapianto autologo di
midollo osseo. Med Pediatr Oncol , 26, 95 -. 100 Littman
TA, Magruder A. & Strother DR 1998 . Monitoraggio e previsione
danni ototossico utilizzando la distorsione di prodotti otoemissioni acustiche
: studio di caso pediatrico. J Am Acad Audiol ,. 9,
257-262. Parsons SK, Neault MW, Lehmann LE, Brennan LL, Eickhoff CE, et
al. 1998 . ototossicità grave in seguito-carboplatino contenente
regime di condizionamento per trapianto di midollo autologo per il
neuroblastoma. Trapianto di Midollo Osseo, 22, 669 -.
674 Ress BD, Sridhar KS, Balkany TJ, Waxman GM, Stagner BB &
Lonsbury-Martin BL 1999 . Effetti di chemioterapia cis-platino su
otoemissioni acustiche: Lo sviluppo di un protocollo di screening
oggettivo. . Terzo Scienze Cliniche posto-Resident Award 1998 Otolaryngol
Testa Collo Surg ., 21, 693-701 Stavroulaki P., Apostolopoulos
N., Segas J., Tsakanikos M. & G. Adamopoulos 2001 . otoemissioni
acustiche evocati – un approccio per il monitoraggio cisplatino indotto
ototossicità nei bambini. Int J Pediatr Otorhinolaryngol , 59,
47 – 57. Stern JW & Bunin N. 2002 . Studio prospettico di
chemioterapia a base di carboplatino-per i tumori a cellule germinali
pediatrici . Med Pediatr Oncol , 39, 163 -. 167 Watanabe
KC, Jinnouchi K., A. Hess, Michel O., Baba S. & T. Yagi 2002 .
Carboplatino induce apoptosi meno nella coclea di cavie di cisplatino. Chemioterapia, 48
, 82 -. 87 Zorowka PG, Schmitt HJ & Gutjahr P. 1993 .
otoemissioni acustiche evocata e puri audiometria soglia di tono in pazienti
sottoposti a terapia con cisplatino. Int J Pediatr Otorhinolaryngol ,
25, 73-80.
L’uso di
ilicifolia Maytenus per prevenire ototossicità indotta da cisplatino
Cristiane
Akemi Kasse I ; Oswaldo Cruz LM II ; Luis
CN Iha III ;Henrique O Costa IV ; Elaine
C Lopes V ; Flávia Coelho VI
I Master e Dottorato, Universidade Federal de São Paulo,
Unifesp-EPM.Professore di ricerca, Universidade Bandeirantes, Uniban II Livre
docente (abilitazione) professore, Universidade de São Paulo,
USP. Professore affiliato, Otorinolaringoiatria disciplina, Universidade
Federal de São Paulo, Unifesp III Master, Universidade
Federal de São Paulo, Unifesp. Studente di dottorato, Universidade Federal
de São Paulo, Unifesp IV Dottorato di laurea, Santa Casa
de Misericordia de São Paulo. Professore, Santa Casa de Misericordia de
São Paulo V Medico in farmacologia, Universidade Federal
de São Paulo, Unifesp. Ricercatore, Instituto de Ciencias Avançadas em
otorrinolaringología, ICAO VI Veterinario, Santa Casa de
Misericordia de São Paulo e l’ospedale Sirio Libanes. Ricercatore,
Instituto de Ciencias Avançadas em otorrinolaringología, ICAO. Dipartimento
di disturbi della comunicazione umana, Otorinolaringoiatria disciplina,
Universidade Federal de São Paulo (Unifesp)
Indirizzo
per la corrispondenza
SINTESI
Maytenus ilicifolia è una pianta originaria del
Sud America, con diverse proprietà medicinali, tra cui effetti
antiossidanti. AIM: utilizzando un cisplatino indotto modello
ototossicità originale, abbiamo valutato un possibile otoprotection causato da
Maytenus estratto ilicifolia. MATERIALI E METODI: disegno
dello studio clinico e sperimentale con la femmina cavie albine divisi in gruppi
come segue: 9 animali trattati con cisplatino solo (tre dosi di 7.5mg/kg/day),
4 animali che ricevevano l’estratto della pianta solo 10 animali trattati con
il protocollo di cisplatino e 1g/kg/day di estratto di 8 giorni, 5 animali con
cisplatino e 3g/kg/day di estratto per 8 giorni, e 5 animali che ricevono
estratto per 3 settimane e cisplatino nell’ultima settimana. Le prove sono
state emissioni di prodotti distorsione otoacustiche, tronco encefalico
risposta uditiva, prima e dopo il farmaco e microscopia elettronica a
scansione. RISULTATI: . animali trattati con cisplatino più
l’estratto vegetale, avevano alterazioni in tutte le prove, che presentano
lesioni alla regione cocleare basale in microscopia elettronica CONCLUSIONI
:Nonostante effetto antiossidante del estratto della pianta, non è stato
sufficiente a proteggere la coclea contro cisplatino ototossicità.
Parole
chiave: Maytenus, i radicali liberi, tossicità da farmaci.
INTRODUZIONE
Una sfida
importante per Otology in questo secolo è stato il trattamento di dysacusis
sensoriale; questa condizione è diventata più frequente causa di
esposizione al rumore, l’invecchiamento e l’uso di farmaci, tra le altre
cause. Recenti studi di piante medicinali 1-3 hanno
attirato l’attenzione del nostro gruppo nella ricerca di immobili otoprotecting
per attenuare o evitare lesioni cocleare.
Maytenus
ilicifolia è una pianta nativa in molte regioni del Sud America, tra sud-est
del Brasile. Questa pianta ha diverse azioni possibili, tra cui medicinali
analgesici, anti-infiammatori, 1 antitumorale,
antiulcera 2 e gli effetti antioxidanting3. Abbiamo
scelto ilicifolia Maytenus per indagare i possibili effetti otoprotective
perché ha antioxydating proprietà (presenza di flavonoidi e alcaloidi), 4,5 pochi
effetti collaterali negli esseri umani, e minimizza l’azione tossica di una
varietà di agenti. 6-8
Abbiamo
scelto cisplatino per la produzione di lesioni cocleari. Questo farmaco è
un agente chemioterapico importante per il trattamento di tumori solidi in
adulti e bambini; può causare (spesso irreversibili) lesioni uditive ed è
nefrotossici, 9 causando anche gastrointestinali
significativi e gli effetti collaterali neurologici. 10,11 Cisplatino
ferisce varie strutture cocleari, tra cui cellule ciliate, cellule di supporto,
le strie vascolari e il nervo uditivo. 12,13Cisplatino produce
radicali liberi che agiscono sul sistema antiossidante delle cellule, che porta
alla morte cellulare.14 Il grado di lesione dipende dal
percorso e somministrazione delle dosi. dodici Abbiamo
testato alcuni protocolli ototossicità in cavie, 15-17 ,
ma non abbiamo incontrato il livello di pregiudizio descritto in alcuni di
questi protocolli, 17 o c’era un alto tasso di mortalità
con dosi ototossici. 16 Per questo motivo abbiamo
sviluppato un protocollo originale che ha prodotto lesioni in tre
circonvoluzioni cocleare, ratificata da prove di emissione dei prodotti
distorsione otoacustiche (OAEDP), il tronco encefalico uditivo evocato potenziale
(BAEP) e microscopia elettronica a scansione (EM); questo protocollo ha
avuto un tasso di mortalità più basso. La dose ideale è 22,5 mg / kg
somministrati per via intraperitoneale, divisa in tre dosi, Distanziati cinque
giornate tra la prima e la seconda dose e un giorno tra le ultime dosi. 18
Lo scopo
di questo studio era di verificare con funzione verifica ogni possibile azione
otoprotective fornito dalla estratto acquoso di ilicifolia Maytenus in cavie
trattati con cisplatino.
METODO
Il
Comitato Etico di ricerca della nostra Università ha approvato questo studio
clinico e sperimentale (numero 1461-1404). Gli animali sono stati 3 to 4
mesi albini femminile cavie di peso da 350 a 450g. La scelta del sesso,
peso e mancanza di pigmentazione è basata sull’osservazione clinica e dati in
letteratura 19 sulla sensibilità, cisplatino ototossicità,
e aumento della sopravvivenza degli animali e uniformità risposta del
test. Tutti gli animali erano sani e avevano otoscopies normali.
Ottenere
la acquosa estratto del Maytenus ilicifolia
Il Centro
de indagini Químicas, Biológicas e Agrícolas disponibile l’estratto ilicifolia
Maytenus. La specie è coltivato in questo centro da parte dei medici Pedro
Magalhães Mellilo e Ilio Montanari Júnior sotto la fertilità del suolo,
umidità, luce solare, temperatura e erbivori e di inquinamento del suolo
condizioni agricole controllate.
La foglia
ilicifolia polvere Maytenus stato estratto da infusione (5%, 50 g / l) in acqua
per 30 minuti a 73 ° C. Il liquido risultante è stato filtrato,
concentrato a 150 ml in un evaporatore sotto vuoto a 50 ° C e liofilizzata per
produrre l’estratto acquoso di Maytenus ilicifolia.
Valutazione
della funzione uditiva
Tutti gli
animali sono stati sottoposti BAEP e test OAEDP per misurare le soglie uditive
e l’integrità delle cellule ciliate esterne (OHC). Il dispositivo di prova
è stato un Bio-logica, Navigator-Pro e il modello Audix. Le cavie sono
stati sedati con xilazina (10 mg / kg) e ketamina cloridrato (40 mg / kg).
L’ambiente
di prova era acusticamente adeguata e gli elettrodi sono stati collocati sulla
regione mastoide di ciascun orecchio e il vertice della testa; auricolari
sono stati collocati sulle corrispondenti orecchie.
Uno
stimolo monocanale click è stato utilizzato per BAEP test (da 0,1 a 1,5 il
filtro kHz, 10.66ms finestra, 100ms durata click, 13.3 volte al secondo tasso
di stimolo, 50.000 guadagno medio, visualizzato su un oscilloscopio).Frequenze
analizzati sono da 1 a 3 kHz. La soglia è definita come l’intensità minima
che riprodotta onda tracciati deflessione. Le risposte sono state date in
SPL (livello di pressione sonora).
Abbiamo
usato il OAEDP quanto è un test altamente sensibile per cisplatino-provocato
lesioni OHC. 15,16 Le risposte sono state analizzate
rispettivamente a 500, 1, 2, 3, 4 e 8 kHz, con L1 e L2 65-55 SPL intensità, e
un rapporto di 1,2 F1/F2. Una sonda per emettere suoni (f1 e f2) è stato
posto sopra l’orecchio in fase di verifica fino ad ottenere una
risposta. Abbiamo confrontato il rumore di fondo parametri (NF) e la
risposta (DP), e analizzato la differenza (DP-NF) prima e dopo il trattamento.
Le cavie
che avevano le prove, prima alterati sono stati esclusi dallo studio.
Scanning
Electron Microscopy Investigation
Microscopia
elettronica a scansione è stato fatto sugli animali per dimostrare le lesioni
OHC indotta da cisplatino, in particolare nel giro basale 16 e
per osservare possibili cambiamenti morfologici negli animali trattati con
l’estratto acquoso.
Alla fine
del trattamento gli animali sono stati sacrificati con una iniezione letale di
anestetico (ketamina), poi decapitati per dissezione microchirurgica cocleare.
Il
cocleare era fissato con la tecnica di perfusione con una soluzione di
glutaraldeide al 2,5%, e tamponata a pH 7,4 con acetato durante 24
ore; una quantità sufficiente è stato iniettato nella finestra rotonda
fino perilymph esce l’apice. Il materiale è stato quindi posto in un
cacodilate sodio tamponata 0.1 M, pH 7.2 soluzione per 12 ore. Etanolo
disidratazione stato fatto aumentando la sua concentrazione dal 50% al 100%, in
incrementi di 30 minuti. Il punto critico è stato fatto durante 60 minuti,
e un bagno di oro è stato fatto durante un’ora. I campioni sono stati
collocati in supporti e fissata con smalto per la visualizzazione in un
dispositivo JEOL modello 5300 EM, a 1500 ingrandimenti e 2000x. Abbiamo
osservato i tre strati OHC e uno strato di cellule ciliate interne in gyri tre
e mezzo; abbiamo scelto quelle zone con meno artefatti e meno perdita di
tessuto. Gyri fosse incollato separatamente e le aree che erano difficili
da visualizzare sono stati scartati.
Trattamento
I gruppi
sono stati così suddivisi:
Gruppo 1:
10 cavie (20 orecchie) hanno ricevuto 3 dosi di cisplatino (7,5 mg / kg / d) al
1 °, 5 ° e 6 giorni.
Gruppo 2:
10 cavie (20 orecchie) hanno dato solo l’estratto acquoso (3 g / kg / d) al
giorno per 7 giorni.
Gruppo 3:
10 cavie (20 orecchie) hanno avuto l’estratto acquoso (1 g / kg / d) al giorno
per 7 giorni e 3 dosi di cisplatino.
Gruppo 4:
5 cavie (10 orecchie) hanno avuto l’estratto acquoso (3 g / kg / d) al giorno
per 7 giorni e 3 dosi di cisplatino.
Gruppo 5:
5 cavie (10 orecchie) hanno avuto l’estratto acquoso (1g/kg/d) per 3 settimane
e 3 le dosi di cisplatino la scorsa settimana.
Le cavie
sono stati sacrificati 24 ore dopo l’ultima dose di cisplatino. L’estratto
orale è stato somministrato per os dopo un periodo di digiuno di 4 ore, una
volta al giorno, iniziando il giorno prima della prima dose di cisplatino.
BAEP e
test OAEDP sono state fatte prima di iniziare il farmaco e 24 ore dopo l’ultima
dose. È stato registrato anche l’aumento di peso e la perdita. Pre-e
risultati post-trattamento sono state confrontate.
Metodo
statistico
I dati
per ogni orecchio di ogni cavia sono stati analizzati separatamente come un
unico dato, dopo che i dati sono stati raggruppati; La ragione di questo è
che ciascun orecchio aveva risposte diverse nella prova e non vi era variazione
inter-individuale entro i limiti normali, in particolare con test OAEDP.
Il test
ANOVA è stato utilizzato per analizzare i risultati dei test BAEP; il
livello di significatività del 5%. Il test del chi-quadrato è stato
utilizzato per analizzare i risultati dei test OAEDP; il livello di significatività
era 5%.
RISULTATI
OAEDP
Tabella 1 mostra
i mezzi di differenze DP prima e dopo il trattamento, compresi i risultati dei
test statistici. Il gruppo trattato solo con l’estratto acquoso (gruppo 2)
ha mostrato differenze statisticamente significative in tutti i valori di
frequenza (p <0,001) rispetto al gruppo trattato con solo cisplatino (gruppo
1). Abbiamo scoperto che ci sono state differenze statisticamente significative
tra i gruppi trattati con l’estratto acquoso e cisplatino solo i valori delle
medie geometriche di 7206, 5434 e 2730 (gruppi 3,4 e 5) rispetto al gruppo 1
(solo cisplatino); queste differenze non sono stati trovati in altre
cinque frequenze.
BAEP
La tabella
2 mostra i risultati pre-test e post-farmaco. Sono
mostrate la media (M) e la deviazione standard (SD).

Gruppo 1
ha mostrato un aumento statisticamente significativo soglia (p <0.001) i
seguenti farmaci rispetto al gruppo che è stato dato solo l’estratto acquoso
(gruppo 2). Non c’erano differenze statisticamente significative tra le
risposte dei gruppi 3,4 e 5 (gruppi indicati cisplatino e l’estratto acquoso) e
quella del gruppo 1 (solo cisplatino) (p = 0,31).
Microscopia
elettronica a scansione
L’indagine
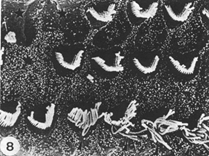
morfologica ha dimostrato che esiste un pregiudizio grave (perdita di oltre il
70% di OHC) e completa (100%), perdita di OHC osservati da microscopia
elettronica a scansione in alcune cavie in mezzo (e soprattutto) il
circonvoluzioni basale delle cavie trattate solo con cisplatino ( Figura 1 ). Le
cavie trattate con l’estratto acquoso, indipendentemente dalla dose, mostravano
lesioni gravi, ma con la conservazione di alcuni OHC.

La figura
1 mostra un’immagine di un EM guinea pig gruppo 1 in cui un
esteso danno OHC è visto nel giro basali.Figura 2 mostra
un’immagine EM di OHC dal gruppo 2 cavie in cui le strutture anatomiche sono
conservati.

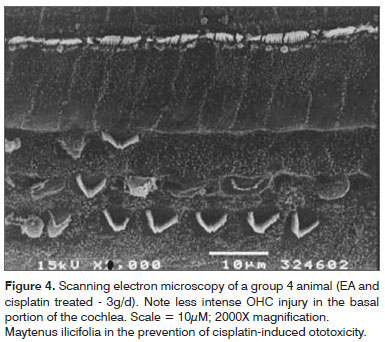
Figure 3 , 4 e 5 sono
le immagini di OHC gyri basali dei gruppi 3, 4 e 5 cavie, mostrando grandi aree
in cui le cellule ciliate sono assenti e la conservazione di alcune cellule e
strutture anatomiche.


Stato
clinica e peso
La
pelliccia di cavie trattate congiuntamente con l’estratto acquoso non è stato
irto, la loro assunzione di cibo e acqua non è diminuita, erano più attivi e
l’aspetto fisico era buono. Le eccezioni erano cavie trattate per tre
settimane ( Tabella 3 ).
La
mortalità del cisplatino unico gruppo (gruppo 1) è stata del 50%; non
c’era la mortalità nei gruppi 2, 4 e 5. Nel gruppo 3, il 20% degli animali non
è sopravvissuto più di 5 giorni.
DISCUSSIONE
Si stima
che la flora brasiliana è composta da tra 40.000 e 60.000 specie di
piante; è dunque un paese con un grande potenziale per la produzione di
farmaci. Maytenus ilicifolia è stato ampiamente studi, ed i suoi effetti
medicinali sono stati ben dimostrata. 20-24
Mattei e
Carlini11 scoperto che l’estratto di Maytenus ilicifolia ha un significativo
effetto antiossidante in vitro;inibisce il processo di lipoperossidazione nel
cervello dei topi con la produzione di specie reattive (agenti antiossidanti).
Oliveira
et al. 22 hanno studiato i globuli rossi e proteine plasmatiche
con tecnezio radioattivo e ha scoperto che ci sembrava essere agenti
antiossidanti nell’estratto di questa pianta.
Melo et
al. 23 indotta la produzione di radicali liberi in E. Coli
tipo di batteri precedentemente trattati con SnCl2 e confrontato le proprietà
antiossidanti di Maytenus ilicifolia, Cymbopogon citratus e genistelloides
Baccharis.Maytenus ha avuto l’effetto migliore dei tre impianti.
Nel
nostro studio, l’estratto acquoso di Maytenus ilicifloia è stato dato nel 1g /
d dosi per 8 giorni e 3g / d per 8 giorni, 24 ore prima e in collaborazione con
cisplatino, per verificare una possibile azione otoprotective di questa pianta
a causa del meccanismo antiossidante .
L’estratto
acquoso di Maytenus ilicifloia non bloccare indotta da cisplatino lesioni OHC,
indipendentemente dalla dose, come confermato da test uditivo. Sebbene i
risultati dei test hanno mostrato OAEDP statisticamente significative risposte
ad alcune frequenze rispetto al gruppo cisplatino, c’erano scarsa risposta alla
maggior parte delle frequenze. Ciò può essere spiegato osservando la EM
scansione di alcune cavie in cui la maggior parte delle OHC sono stati feriti,
ma alcune righe di queste cellule erano ancora conservati o ha avuto
cambiamenti strutturali senza perdita delle ciglia, suggerendo che ci possono
essere risposte favorevoli ad una certa frequenze OAEDP.
L’estratto
acquoso anche conservato lo stato fisico degli animali; questi animali
avevano meno di perdita di peso e bassa letalità. L’estratto acquoso come
un farmaco antiossidante che producono usato prima di cisplatino per
otoprotection non era efficace per preservare l’audizione delle cavie (gruppo
5).
Ci sono
alcune ipotesi per spiegare i nostri risultati. L’estratto acquoso di
Maytenus ilicifolia sembra preservare lo status clinico delle cavie esposte al
cisplatino, possibilmente da un’azione antiossidante su altri organi, come la
perdita di peso e la mortalità era chiaramente differente tra i gruppi. Il
metabolismo in questi organi, tuttavia, è diverso da quello in
uditivo; l’estratto acquoso di Maytenus ilicifolia è stato in grado di
bloccare completamente l’azione di ototossico di cisplatino negli organi
uditivi in particolare. Una seconda ipotesi è che
l’estratto acquoso di Maytenus ilicifolia non attraversa la barriera
emato-encefalica, e quindi non ha raggiunto la coclea; questo spiegherebbe
il suo effetto solo in alcuni organi. Una terza ipotesi è che il
meccanismo di blocco radicali liberi dal estratto acquoso di Maytenus
ilicifolia non era sufficiente per evitare lesioni cisplatino dell’organo Corti
alle dosi utilizzate in questo studio.
CONCLUSIONE
L’estratto
acquoso di Maytenus ilicifolia non ha avuto un effetto otoprotective
sufficiente contro cisplatino in questo studio; il suo utilizzo fa
affidamento migliorate condizioni fisiche negli animali e diminuisce la
letalità di cisplatino.
.
REFERERENCES
1.
Pereira MAS, Januário AH, Queiroz MEC, Carvalho D, França SC. Maytenus
aquifolia e Maytenus ilicifolia: polimorfismo e perfil químico. XV
Simposio de Plantas Medicinais do Brasil, anais, res. 06,011, 1998 Águas
de Lindóia, SP. [ Link ]
2.
Macaubas CIP, Oliveira de MGM, Formigoni MLO, Silveira Filho da NG, Carlini
EA. Estudo DA eventuali Ação antiúlcera gastrica fare Balsamo (Sedum sp)
Folha de Fortuna (Bryophyllum calycinum) COUVE (Brassica oleraceae) e de
Espinheira-Santa (Maytenus ilicifolia) em ratos. Central de Medicamentos
(Brasil). Estudo de ação antiúlcera gastrica de plantas Brasileiras
(Maytenus ilicifolia “Espinheira-santa” e Outras). Brasília,
Central de Medicamentos 1988; p.5-20. [ Link ]
STELLFELD
CA 3.. A Espinheira-Santa: contribuição AO Estudo
farmacognóstico. Boletim da Associação Brasileira de Farmácia 1934;
15:551-70. [ Link ]
4. Ahmed
MS, Fong HHS, Soejarto DD, Dobberstein RH, Waller DP. Separazione
cromatografo liquido ad alte prestazioni e la quantificazione di maytansinoids
in Maytenus ilicifolia. J Cromatography 1981;
213:340-4. [ Link ]
5. Xavier
HS & D’Angelo LCA. Perfil cromatográfico dos componentes polifenóicos
de Maytenus ilicifolia (Celastraceae). XII Simposio de Plantas Medicinais
do Brasil 1992, Curitiba, PR. [ Link ]
Pereira
MV 6.. Contribuição ao Estudo do Principio ativo e outros constituintes
básicos fare Maytenus ilicifolia. Rev Bras Quim 1962, 54 (322)
:416-7. [ Link ]
7. Ohsaki
A, Imai Y, Naruse M, Ayabe SI, Komiyama K, Takashima J. Quattro nuovi
triterpenoidi da Maytenus ilicifolia. J Nat Prod 2004; 67 (3)
:469-71. [ Link ]
8. Mattei
R & Carlini EA. PROPRIEDADES antioxidantes (lipoperoxidação) da
Pfaffia paniculata, Heteropteris aphrodisiaca e Maytenus ilicifolia: Estudo in
vitro. XV Simposio de Plantas Medicinais do Brasil 1998 Águas de Lindóia,
SP. [ Link ]
Ekborn A.
Lindberg A. Laurell G. Wallin I. Eksborg S. Ehrsson H. Ototossicità.
9. nefrotossicità e la farmacocinetica di cisplatino e il suo complesso
monoidrato nella cavia. Cancro Chemother Pharmacol 2003; 51 (1)
:36-42. [ Link ]
10.
Schell MJ, McHaney VA, Verde AA. La perdita dell’udito nei bambini
trattati con cisplatino con o wothout prima irradiazione cranica. J Clin
Oncol 1989; 7:754-60. [ Link ]
11.
Faustini SA, Schechter MA, Rapport BZ, Frey MF, Mass RE. Cisplatino
ototossicità: caso selezionato relazioni.Cancer 1984;
53:224-31. [ Link ]
12.
Laurell G & Bagger-Sjoback D. degenerazione dell’organo del Corti a seguito
admininstration endovenosa di cisplatino. Acta Otolaryngol (Archivio)
1991; 111:891-8. [ Link ]
13.
Hinoja R. Riggs LC, Strauss M et al. Temporal istopatologia osso di
cisplatino ototossicità. Am J OTOL 1995;
16:731-41. [ Link ]
14.
Ravi R, Somani SM, Rybak LP. Meccanismo di cisplatino
ototossicità: sistema antiossidante. Pharmacol Toxicol 1995;
76:386-94. [ Link ]
15.
Hyppolito MA. Oliveira JA. Rossato M. Holanda F. Ototoxicidade da
cisplatina e otoproteção pelo extrato de ginkgo biloba às Células ciliadas
externas: Estudo Anatomico e eletrofisiológico. Rev Bras Otorrinolaringol
2003; 69 (4) :504-11. [ Link ]
Hyppolito
MA 16.. Oliveira JA. Lessa RM. Rossato M. Otoproteção da
Amifostina aos Efeitos ototóxicos da cisplatina: Estudo Albinas em cobaias por
emissões otoacústicas produtos de distorção e microscopia eletrônica de
varredura. Rev Bras Otorrinolaringol 2005; 71 (3)
:268-73. [ Link ]
17. Saito
T, Aran JM. Ototossicità comparato di cisplatino durante il trattamento
acuto e cronico. ORL 1994; 56:320-5. [ Link ]
18. Iha
L, Kasse C, Neto OM, Almeida CR, Cruz OLMC. Ototoxicidade induzida pela
cisplatina em cobaias: efeito funcional dose-dependente-avaliação. Acta
ORL 2007; 25:112-8. [ Link ]
Schweitzer
VG 19.. Indotta da cisplatino ototossicità: l’effetto di pigmentazione e
agenti inibitori. Laringoscopio 1993; 103:1-52. [ Link ]
20. Lima
OG, Coelho JSB, Weigert E, D’Albuquerque IL, Souza MAM. Substâncias
antimicrobianas de Plantas Superiores. Rev Inst Antibiot 1971;
11:35-8. [ Link ]
21.
Souza-Formigoni ML, Oliveira MG, MG Monteiro, da Silveira-Filho NG, Carlini
EA. Effetto Antiulcerogenic ot due specie Maytenus negli animali da
laboratorio. J Ethnopharmacol 1991; 34:21-7. [ Link ]
22.
Oliveira JF, Braga ACS, Oliveira MBN, Ávila AS, de Araújo AC, Cardoso VN,
Bezerra RJAC, Bernardo-Filho M. La valutazione degli effetti di Maytenus
ilicifolia (Espinheira Santa) estrarre sull’etichettatura dei globuli rossi e
plasma proteine con tecnezio-99m. J Ethnopharmacol 2000;
72:179-84. [ Link ]
23. Melo
SF, Soares SF, Costa RF, Silva CR, Oliveira MBN, Bezerra RJAC, de Araújo AC,
Cardoso VN, Bernardo-Filho M. Effetto del citratus Cymbopogon, Maytenus
ilicifolia e Baccharis genistelloides estratti contro i danni cloruro stannoso
ossidativo in Escherichia coli. Mutat Res 2001;
496:33-8. [ Link ]
24. Mossi
AJ, Cansian RL, Carvalho AZ, Dariva C, Vladimir GU, Mazutti M, IN Filho,
Echeverrigaray S. Estrazione e caratterizzazione di composti volatili in
Maytenus ilicifolia, utilizzando ad alta pressione di CO 2 . Fitoterapia
2004; 75 (2) :168-78. [ Link ]