Sindrome di Stickler/Sindrome di Marshall. Si tratta di condizioni eterogenee con interessamento del tessuto connettivo collagene, caratterizzate da grave miopia, anomalie oro facciali ed ipoacusia La Sindrome di Stickler è AD; il tipo I causato da mutazioni del gene COL2A1, la tipo Il da mutazioni del gene COL11A2 e la tipo III da mutazioni del gene COL11A2 L’ipoacusia è di tipo misto o neurosensoriale, è più grave nella Sindrome di Marshall e nei tipi II e III,
Sindrome di Stickler/ sindrome di Marshall ,artro-oftalmopatia progressiva ereditaria , displasia di Stickler
distrofia ereditaria artro-oftalmologica
– trasmissione autosomica dominante
– espressività variabile
– sordità neurosensoriale-mista
– palatoschisi
– insufficienza muscolatura faringo-laringea
– miopia
|
Sindrome di Stickler
|
Modalità di trasmissione |
Tipo di deficit uditivo |
Anomalie associate |
|
|
A.D. Gene COL2A1(cr. 12) tipo I, COL11A1 (cr. 1) tipo II, COL11A2 (A.D. e A. R.) |
Ipoacusia neurosensoriale bilaterale piú marcata sulle frequenze acute |
Anomalie ossificazione (epifisi,diafisi), anomalie articolari, ipoplasia facciale, grave miopia (insorgenza primo anno di vita) e frequente distacco di retina, palatoschisi (occasionale). |
- CHE COSA È LA SINDROME DI STICKLER??
- TIPI
- STORIA, PERCHÉ SINDROME DI STICKLER?
- CAUSE GENETICHE
- QUALI GENI SONO LEGATI ALLA SINDROME DI STICKLER?
- EPIDEMIOLOGIA
- CAUSE
- SINTOMI
- LA DIAGNOSI DIFFERENZIALE
- APPROFONDIMENTI
CHE COSA È LA SINDROME DI STICKLER?
La Sindrome di Stickler (artro-oftalmopatia ereditaria progressiva) è un gruppo di malattie genetiche che interessano il tessuto connettivo , in particolare il collagene . La sindrome di Stickler è un sottotipo di collagenopatia, tipo II e XI Due geni sono stati individuati come responsabili di questa sindrome (COL2A1, COL11 A2), entrambi implicati nella costituzione di certi tipi di collagene. La sindrome può rivelarsi alla nascita con una palatoschisi. micrognatismo, ptosi linguale e soprattutto incompetenza della muscolatura faringo-laringea (turbe della deglutizione ed ostruzione respiratoria) Nelle due varianti cliniche della sindrome, (I e III) è anche presente una forte miopia Durante l’accrescimento diventano evidenti anomalie scheletriche e cartilaginee a carico degli arti. La sordità è neurosensoriale o mista, talvolta complicata da esiti di fiogosi timpaniche croniche.. La sindrome Stickler è caratterizzata da peculiari anomalie facciali, problemi oculari, perdita dell’udito e problemi articolari. E ‘stata studiato per prima e caratterizzato da Gunnar B. Stickler nel 1965.
TIPI
Cambiamenti genetici sono legate ai seguenti tipi di sindrome di Stickler (Annunen S, ed Al 1999; Liberfarb RM ed Al,2003)
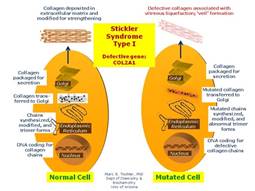
Sindrome di Stickler, COL2A1 (75% dei casi Stickler) Fig.1
Sindrome di Stickler, COL11A1
Sindrome di Stickler, COL11A2 (non-oculare)
Sindrome di Stickler, COL9A1 (variante recessiva)
Se ci sono due o tre tipi di sindrome di Stickler è controversa. Ogni tipo è qui presentati per il gene coinvolto. La classificazione di queste condizioni sta cambiando i ricercatori a saperne di più circa le cause genetiche.
|
|
Fig.1 sindrome di Stickler tipo 1 |
I ricercatori hanno descritto diversi tipi di sindrome di Stickler, che si distinguono per la loro causa genetica e loro segni e sintomi caratteristici. In particolare, le anomalie oculari e gravità della perdita uditiva differiscono tra i tipi. Il tipo I ha il più alto rischio di distacco di retina. Il tipo II include anche anomalie oculari, ma IL tipo III non ha interessamenti oculari (ed è spesso chiamato sindrome di Stickler non-oculare). Tipi II e III sono più probabili di tipo I per aver perdita dell’udito. I tipi IV e V sono molto rari e sono stati diagnosticati solo in alcuni individui.
Una condizione simile chiamata sindrome di Marshall è caratterizzata da un aspetto caratteristico del viso, anomalie oculari, perdita dell’udito e artrosi precoce. La Sindrome di Marshall può includere anche bassa statura, che tipicamente non si riscontra nei pazienti con sindrome di Stickler. Se la sindrome di Marshall rappresenta una variante della sindrome di Stickler o una patologia separata è controversa.
Perché sindrome di Stickler?
Stickler sindrome prende il nome dal dottor Gunnar B Stickler. Nel 1960 un ragazzo di dodici anni è stato esaminato presso la Fondazione Mayo nel Minnesota, USA. Il ragazzo aveva ingrandimenti ossee diverse articolazioni ed è stato estremamente miope. Sua madre era totalmente cieco. Dr Stickler ha scoperto che c’erano altri membri della famiglia con sintomi simili, il primo membro della famiglia essendo stati visti dal dottor Charles Mayo nel 1887. Questo ha spinto il dottor Stickler per studiare la famiglia. Con colleghi ha lavorato per definire la condizione, i risultati in corso di pubblicazione nel giugno 1965. Dr Stickler provvisoriamente chiamato la condizione ereditaria PROGRESSIVE ARTRO-OFTALMOPATIA conosciuta in tutto il mondo, come la sindrome di Stickler.
CAUSE GENETICHE
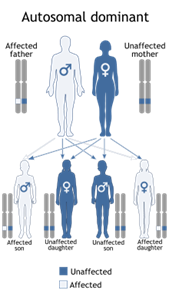
La sindrome deriva da una mutazione di diversi geni del collagene durante lo sviluppo fetale. Si tratta di un sindrome , indipendente dal sesso, autosomica dominante Fig.2, il che significa che un paziente con la sindrome ha una probabilità del 50% di passare la malattia ad ogni figlio. Ci sono tre varianti di Stickler sindrome identificati, ciascuno associato ad un gene di biosintesi del collagene. Un difetto metabolico riguardante l’acido ialuronico e il collagene di tipo 2-d si presuma sia la causa di questa sindrome.
|
Fig.2 La sindrome di Stickler è ereditata come modello autosomico dominante |
QUALI GENI SONO LEGATI ALLA SINDROME DI STICKLER?
Le mutazioni nei geni COL11A1, COL11A2 e COL2A1 COL9A1, COL9A2 e geni causano tipi di sindrome di Stickler da I a V, rispettivamente. La sindrome di Marshall, che può essere una variante di Stickler sindrome, risulta da mutazioni nel gene COL11A1. Perché ci siano due o tre tipi di sindrome è controverso. Ciascun tipo è qui presentato secondo il gene in causa. La classificazione di tali condizioni cambierà quando i ricercatori apprenderanno di più circa le cause genetiche. Tali geni sono coinvolti nella produzione del collagene tipo II tipo IX e tipo XI. I collageni sono molecole complesse che provvedono alla struttura e alla resistenza del tessuto connettivo che sostengono le articolazioni del corpo e degli organi. Il collagene di tipo II, tipo IX e XI tipo sono componenti del vitreo, cartilagine e altri tessuti connettivi.. Una mutazione in uno di questi geni interrompe la produzione, l’elaborazione o la formazione del collagene tipo II o XI. Le molecole difettose di collagene o la ridotta quantità di collagene influisce sullo sviluppo di ossa e altri tessuti connettivali, portando al caratteristico quadro della Stickler.
Altri geni, sebbene sconosciuti, possono causare la sindrome perché non tutti i soggetti colpiti hanno mutazioni in uno dei tre geni già identificati. La sindrome di Stickler tipo 1 è dovuta alle mutazioni del gene COL2A1 (12q13.11-q13.2), quella tipo 2 alle mutazioni dei geni COL11A1 (1p21) e COL11A2 (6p21.3). Inoltre, in una famiglia del Marocco, è stata osservata una forma autosomica recessiva associata alle mutazioni del gene COL9A1 (6q12-q14). Le mutazioni che si verificano nel primo gruppo di geni sono a carattere trasmissivo autosomico dominante mentre quelle a carico del secondo gruppo sono a carattere autosomico recessivo e, in entrambi i casi, le conseguenze fenotipiche che comportano sono molte.
EPIDEMIOLOGIA
Complessivamente la prevalenza stimata di sindrome Stickler è circa 1 su 10.000. Colpisce 1 neonato su 7.500-9.000. Alcuni medici credono che ben 3 in 10.000 persone sono colpite, ma ulteriori ricerche sono necessarie per confermare questo. Come una malattia ereditaria, la sindrome di Stickler è normalmente passata di padre in figlio. C’è una probabilità del 50% dei bambini essere colpiti in questo modo anche se ci sono alcuni casi registrati dove si è verificato per la prima volta in un bambino.
CAUSE
La sindrome è ereditaria con schema autosomico dominante. Si suppone che insorga da una mutazione di diversi geni del collagene durante lo sviluppo fetale. È indipendente dal sesso, cioè i soggetti affetti dalla sindrome hanno la probabilità del 50% di passarla a ciascun figlio.
SINTOMI
Gli individui con sindrome di Stickler hanno una serie di segni e sintomi. Alcune non hanno segni e sintomi; altri hanno alcune o tutte le funzioni descritte di seguito. Inoltre, ogni caratteristica di questa sindrome può variare da una forma lieve ad una grave.
Fu studiata e catalogata per la prima volta dal dr. G.B. Stickler nel 1965. È caratterizzata dal
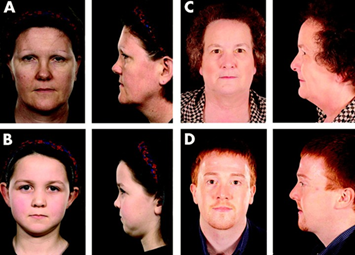
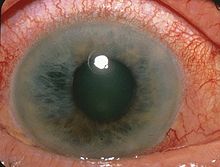
1) tipico aspetto facciale appiattito, Fig. 3
2) patologie oculari,
3) perdita dell’udito,
4)disturbi alle articolazioni.
1)tipico aspetto facciale appiattito: Fig. 3A-B-C-D-E questo è causato da ossa sottosviluppate del centro del viso, compresi gli zigomi e il ponte del naso. Un gruppo particolare di caratteristiche fisiche, chiamata sequenza di Pierre Robin, è comune anche in persone con sindrome di Stickler. La sequenza Robin include un’apertura nel tetto della bocca (palatoschisi), una lingua piccola , che è posto più indietro rispetto al normale (glossoptosi), e una piccola mandibola (micrognazia). Questa combinazione di caratteristiche può portare a problemi di alimentazione e difficoltà di respirazione.. Si può rivelare alla nascita tramite una schisi velopalatina, completa o sottomucosa, integrantesi talvolta in una sequenza di Pierre Robin: triade schisi palatina/microretrognazia/glossoptosi e, soprattutto, incompetenza dell’incrocio faringolaringeo, fonte di disturbi della deglutizione e di ostruzione respiratoria che possono richiedere una tracheotomia transitoria (la sindrome di Stickler è una causa ormai ben nota della sequenza di Pierre Robin). Il dismorfismo faciale è costante (ipoplasia del piano medio del volto), ma spesso difficile da valutare nel lattante.
|
|
||||
|
Fig. 3A-B-C-D-E |
||||
|
||||
|
2)patologie oculari,
Miopia
Alto rischio di distacchi di retina, che possono influenzare entrambi gli occhi.
Cataratta
Glaucoma
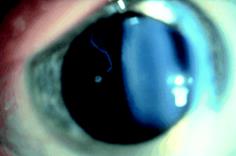
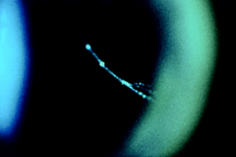
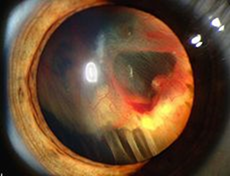
La sindrome di Stickler è una vitreo-retinopatia. Anomalie di formazione vitreo e dell’architettura gel sono patognomonico della sindrome di Stickler e, a nostro avviso un prerequisito per la diagnosi. 6 Due distinti fenotipi possono essere riconosciute. 7-9La maggior parte dei pazienti hanno una caratteristica anomalia congenita del vitreo (il tipo 1 fenotipo, Fig 4 A ) e questo correla con difetti di di procollagene di tipo II.78 Un gel vitreale apparentemente rudimentale occupa lo spazio immediato retrolentale ed è delimitato da una membrana distinta piegata. In una minoranza di pedigree c’è un fenotipo diverso con fasci radi e irregolarmente ispessite di fibre in tutta la cavità vitrea (tipo 2 fenotipo, Fig. 4B).
|
|
|
|
Fig4 A : fenotipo tipo 1, |
Fig. 4B :fenotipo, tipo 2 |
In particolare, le anomalie oculari e gravità della perdita uditiva differiscono tra i tipi. Il tipo I ha il più alto rischio di distacco di retina. Il tipo II include anche anomalie oculari, ma il tipo III non ha interessamenti oculari (ed è spesso chiamato sindrome di Stickler non-oculare). Molte persone con sindrome di Stickler sono molto miopi (descritto ed aventi elevata miopia ) a causa della forma dell’occhio. Anomalie dello sviluppo dell’angolo di drenaggio camera anteriore predispongono i pazienti a glaucoma, 10Fig. 7 (b), ma la complicanza più grave oftalmica riferisce l’elevato rischio di distacco di retina, di solito come conseguenza di gigante formazione di rottura retinica Può Anche presente come complicazione la cataratta associata alla sindrome di Stickler. La sostanza gelatinosa all’interno dell’occhio (il vitreo ) ha un aspetto distintivo dei tipi di sindrome di Stickler associati ai geni COL2A1 e COL11A1. Come risultato si consiglia appuntamenti fissi ad un oculista specialista. Il tipo di sindrome di Stickler associata al gene COL11A2 non influenza l’occhio. [2]
|
|
|
Tutti i pazienti hanno mostrato il fenotipo vitreo “perline” (Fig. 4 C-D-E) ed hanno confermato le mutazioni nella catena α1 di tipo XI collagene ( COL11A1 ) |
|
|
|
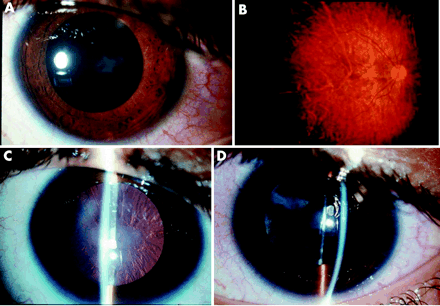
Fig. 5 A-B-C Caratteristica cataratta corticale |
|
|
|
Fig. 6 (A) lieve opacità della capsula posteriore del cristallino dell’occhio destro osservata inizialmente all’età di 7 anni. (B) Aspetto del fondo dimostrare la retina alterazioni della pigmentazione della periferia e alterazioni degenerative della retina all’interno del polo posteriore. (C) opacizzazione marcata e la fusione delle capsule lente nell’occhio di destra osservato a 9 anni di età. (D) Lievi opacità della capsula si osservano ancora due anni più tardi, a 11 anni di età. L’errore di rifrazione in questa fase è +1.25 e l’acuità visiva per una distanza di 6/12 (20/40). |
3)perdita dell’udito. La sordità di percezione, trasmissione o mista è incostante, e spesso mascherata o aggravata dai problemi di otite cronica che sono associati all’incompetenza faringea. Essa è spesso evolutiva. Sono descritti tre tipi di sindrome di Stickler: nei tipi 1 e 3, agli altri elementi della sindrome è associata una miopia molto forte con rischio di degenerazione vitro-retinica. L’esame oftalmologico di ogni bambino sordo e di ogni lattante con incompetenza faringolaringea deve permettere d’individuare questa sindrome e correggere precocemente la miopia. La maggior parte delle persone con sindrome di Stickler hanno anomalie scheletriche che colpiscono le articolazioni. Le articolazioni dei bambini affetti e giovani adulti possono essere allentati e molto flessibile (ipermobile), anche se le articolazioni diventano meno flessibile con l’età. Artrite appare spesso presto nella vita e può causare dolore articolare o rigidità. Possono verificarsi anche problemi con le ossa della colonna vertebrale (vertebre), tra cui curvatura anomala della colonna vertebrale (scoliosi o cifosi) e appiattito vertebre (platispondilia). Queste anomalie della colonna vertebrale possono causare mal di schiena.
4)disturbi alle Ossa e Articolazioni
Caratterizzata dall’associazione tra segni oculari, correlati alle forme più o meno complete della sequenza di Pierre Robin (si veda questo termine), alterazioni scheletriche e sordità neurosensoriale (10% dei casi) .Questi segni e sintomi variano ampiamente tra gli individui affetti. Questa sindrome è dovuta a una alterazione delle catene ![]() di alcuni collageni. Sono anche presenti delle anomalie scheletriche e cartilaginee, che possono portare a una piccola statura o, al contrario, a una grande statura. Le articolazioni dei bambini affetti e giovani adulti possono essere allentati e molto flessibile (ipermobile), anche se le articolazioni diventano meno flessibile con l’età. Artrite appare spesso presto nella vita e può causare dolore articolare di tipo artrosico o rigidità. Possono verificarsi anche problemi con le ossa della colonna vertebrale (vertebre), tra cui curvatura anomala della colonna vertebrale (scoliosi o cifosi) e appiattito vertebre (platispondilia). Queste anomalie della colonna vertebrale possono causare mal di schiena.
di alcuni collageni. Sono anche presenti delle anomalie scheletriche e cartilaginee, che possono portare a una piccola statura o, al contrario, a una grande statura. Le articolazioni dei bambini affetti e giovani adulti possono essere allentati e molto flessibile (ipermobile), anche se le articolazioni diventano meno flessibile con l’età. Artrite appare spesso presto nella vita e può causare dolore articolare di tipo artrosico o rigidità. Possono verificarsi anche problemi con le ossa della colonna vertebrale (vertebre), tra cui curvatura anomala della colonna vertebrale (scoliosi o cifosi) e appiattito vertebre (platispondilia). Queste anomalie della colonna vertebrale possono causare mal di schiena.
I ricercatori hanno descritto diversi tipi di sindrome di Stickler, che si distinguono per la loro causa genetica e loro segni e sintomi caratteristici. In particolare, le anomalie oculari e gravità della perdita uditiva differiscono tra i tipi. Il tipo I ha il più alto rischio di distacco di retina. Il tipo II include anche anomalie oculari, ma il tipo III non ha interessamenti oculari (ed è spesso chiamato sindrome di Stickler non-oculare). Nei tipi II e III la perdita dell’udito è più probabili rispetto al tipo I . I tipi di IV e V sono molto rari e sono stati diagnosticati solo in alcuni individui.
Una simile condizione chiamata sindrome di Marshall è caratterizzata da un aspetto caratteristico del viso, anomalie oculari, perdita dell’udito e artrosi precoce. Sindrome di Marshall può includere anche bassa statura, che tipicamente non si riscontra nei pazienti con sindrome di Stickler. E’ controverso se la sindrome di Marshall rappresenti una variante della sindrome di Stickler o piuttosto n’entità a se.
|
|
|
|
|
Fig. 7 (A) Miopia. |
Fig. 7 (b) Foto che mostra vasi congiuntivali dilatati a bordo corneale (flush ciliare, filo circumcorneale) e cornea nebbiosa caratteristica di glaucoma acuto ad angolo chiuso |
|
|
|
|
|
Le persone con sindrome di Stickler accusano una serie di segni e sintomi, dalla paucità alla grave espressione fenotipica.
Una tipica caratteristica della sindrome è l’aspetto della faccia, come appiattito. Ciò è causato dalle ossa poco sviluppate nel centro della faccia, comprese le mascelle e il setto del naso.
Molti pazienti con la sindrome di Stickler soffrono di la cataratta giovanile, miopia grave Fig. 7 (A) , a causa della forma dell’occhio. Gli individui con gli occhi colpiti dalla patologia sono soggetti a pressione oculare aumentata (glaucoma) e a degenerazione vitreo-retinica o corio-retinica, a distacco della retina e l’uveite cronica.. La sostanza gelatinosa dentro l’occhio ha un aspetto caratteristico nella sindrome di tipo COL2A1 e COL11A1. Quella di tipo COL11A2 non colpisce l’occhio.
I soggetti con questa patologia hanno disturbi che colpiscono anche altri organi. Artrite, anormalità dell’estremità delle ossa lunghe, anomalia delle vertebre, curvatura della spina dorsale, gibbosità, dolore all’articolazioni,
ginocchio valgo sono tutti problemi che possono occorrere alle ossa e alle articolazioni. L’artrite spesso compare a giovane età e peggiora con la crescita).Le articolazioni dei bambini colpiti e dei giovani possono essere molto flessibili (ipermobili).. Difficoltà nell’apprendimento possono anche avvenire per la menomazione all’udito e alla vista.Tipico di soggetti con Stickler può includere guance piatte, setto nasale appiattito e mascella piccola, anomalie del palato.
Un altro segno della sindrome è la diminuzione dell’udito da lieve a grave che, per alcuni, può essere progressiva. La perdita di udito è stata riscontrata nel 62,9 per cento dei casi, in una forma lieve o moderata. Il deficit uditivo era principalmente neurosensoriale ovvero a carico della coclea o del nervo acustico (67,8 per cento).
Il deficit trasmissivo, danno a carico dell’orecchio esterno o medio, è risultato essere meno frequente (14,1 pe cento) cosi come quello misto (18,1 per cento). Le forme di ipoacusia trasmissiva e mista sono state riscontrate principalmente nei giovani pazienti o nei pazienti con un difetto al palato.
Complessivamente le mutazioni a carico di COL11A1 (82,5 per cento) e COL11A2 ( 94,1 per cento) risultano più frequentemente associate con la menomazione uditiva, rispetto alle mutazioni di COL2A1 ( 52,2 per cento Considerando questi dati si può sostenere che la menomazione uditiva nei pazienti affetti da sindrome di Stickler è comune e che, nonostante la forma di ipoacusia che predomini sia quella neurosensoriale, anche l’ipoacusia trasmissiva e mista possono verificarsi.
Le mutazioni dei diversi geni codificanti per il collagene sono associate a diversi tassi di prevalenza di ipoacusia ma esistono ancora un gran numero di variazioni fenotipiche che non sono state associate a specifiche caratteristiche genotipiche.
Vista la portata del problema il consiglio è di eseguire un regolare follow-up dell’udito nei pazienti affetti da sindrome di Stickler, valutazioni audiologiche ogni sei mesi fino all’età cinque anni, poi annualmente,
La diagnosi differenziale
Diversi disturbi simili alla sindrome di Stickler sono stati descritti e il loro status di entità distinte rimane controversa. Dati genetici molecolari stanno cominciando a informare questo dibattito ma resta incertezza. Questo sarà risolto solo quando più dati di genotipo diventano disponibili in combinazione con la descrizione dettagliata dei oculare associata e fenotipo non-oculare.
SINDROME DI WAGNER
Wagner29ha registrato una grande famiglia svizzera con un disordine autosomico dominante dell’occhio assomiglia sindrome di Stickler, ma senza il distacco di retina. Molte delle famiglie successivamente segnalato come sindrome di Wagner hanno avuto caratteristiche sistemiche in comune con la sindrome di Stickler e la distinzione tra le due condizioni è diventata sfocata. Infatti, alcuni autori hanno suggerito che essi sono la stessa malattia. 30La prova che le famiglie che mostrano solo le manifestazioni oculari della sindrome di Wagner hanno una condizione distinta dalla sindrome di Stickler è venuto dalla constatazione di linkage to 5q13-q14 nella famiglia di origine Wagner 31e esclusione di linkage to COL2A1 in un’altra famiglia.32Alla luce di questi risultati, il termine “sindrome di Wagner-Stickler” dovrebbe essere abbandonato. Korkko et al33ha riferito di un paziente con la sindrome di Wagner derivante da una sostituzione di ingombranti aspartato aminoacido glicina per nell’esone 10 di COL2A1 e postulato un possibile legame tra il tipo di mutazione e fenotipi Stickler o Wagner. Tuttavia, frequente distacco della retina e, in misura minore cataratta sono stati attribuiti alla sindrome di Wagner, mentre nel report originale 29nessun paziente ha subito un distacco della retina, “cataracta Complicata” è stata quasi universale, e la miopia era bassa in tutti i casi. Si potrebbe sostenere che nella famiglia riportata da Korkko et al 33fenotipo assomiglia più da vicino la sindrome di Stickler sindrome di Wagner.
EROSIVA VITREORETINICA
Brown et al 34 hanno descritto un disordine autosomico occhio dominante hanno chiamato vitreoretinica erosiva con un fenotipo simile sindrome di Wagner e privo di eventuali anomalie sistemiche. Questa condizione è stato mappato a 5q13-q14 suggerendo che potrebbe essere una variante allelica della sindrome di Wagner. 31
SINDROME DI MARSHALL
Marshall 35ha registrato una grande famiglia che mostra ereditarietà autosomica dominante della cataratta, miopia, vitreo anormale, ipoplasia mediofacciale e sordità congenita. Marshall ha pensato il fenotipo potrebbe rappresentare una forma incompleta di ereditaria anidrotica displasia ectodermica, ma ha riconosciuto che il pelo era normale e la prova di ipodonzia e ipoidrosi “non era fortemente convincente”. Shanske et al 36ha notato dalle foto pubblicate che uno dei pazienti di Marshall era colpito da ipertelorismo con ipertelorismo forse lieve in altri. C’è stato molto dibattito se la sindrome di Marshall è una entità distinta 37 e, in caso affermativo, se displasia ectodermica è una caratteristica della condizione. 36Ayme e Preus 38 effettuate cluster analysis sui rapporti pubblicati di Marshall e Stickler sindrome pazienti e ha concluso che erano diversi. Resta da vedere se questo problema può essere risolto con l’analisi genetica molecolare. Griffith et al 39hanno riportato una mutazione COL11A1 in una famiglia ha detto di avere la sindrome di Marshall. Shanske et al40hanno suggerito la famiglia aveva la sindrome di Stickler, ma gli autori hanno risposto che, come riportato da Marshall famiglia di origine, i loro pazienti avevano cataratta congenita e giovanile, vitreo fluido, perdita di udito, e simili aspetto cranio-facciale e la radiologia. 41,in quanto questi sono tutte le caratteristiche della sindrome di Stickler riconosciuto e non vi è alcuna informazione sul fenotipo vitreo, il problema rimane irrisolto.
SINDROME DI WEISSENBACHER-ZWEYMÜLLER E OSMED
Weissenbacher e Zweymuller 42hanno descritto un neonato con la sequenza di Pierre-Robin, naso camuso, prossimale accorciamento dell’arto, femori a forma di campana muta e omeri, e schisi vertebrali coronali. I genitori erano sani e non collegati. Giedion et al 43hanno seguito lo stesso paziente a 18 anni di età. Sordità neurosensoriale aveva sviluppato all’età di 5. By adulta accorciamento della vita arto era del tutto risolto e l’altezza e l’aspetto erano sostanzialmente normale. Non c’era alcuna anomalia occhio. Epifisi ingrossati erano una caratteristica radiologica di primo piano in adolescenza. Giedion et al 43hanno riferito di altri tre pazienti con lo stesso fenotipo e ha coniato il nome OtoSpondiloMegaEpifiseale Displasia (OSMED). Essi hanno concluso che la sindrome Weissenbacher-Zweymuller (WZS) e OSMED erano la stessa sindrome. Pihlajamaa et al 44,successivamente è emerso che il paziente WZS originale era eterozigoti per una mutazione in COL11A2. Sono state descritte altre famiglie mostrano autosomica dominante di un simile non-oculare Stickler sindrome fenotipo come risultato di mutazioni COL11A2. 45-47 Van Steensel et al 48riportano tre fratelli dei genitori consanguinei che erano omozigoti per una mutazione COL11A2 e aveva il OSMED fenotipo. Vikkula et al 46hanno riportato diversi membri di una famiglia consanguinea che erano omozigoti per una mutazione in COL11A2. Avevano una grave sordità neurosensoriale congenita, ipoplasia medio-facciale, a breve, naso all’insù, gli occhi prominenti, creste sopraorbitali prominenti, e insorgenza precoce adulta di grave artrosi delle anche, ginocchia, spalle e gomiti. Altezza adulta è stato leggermente ridotto con l’aumento della lordosi lombare. Le articolazioni interfalangee erano prominenti con brevi quinto metacarpo. Come in tutte le famiglie segnalate con mutazioni COL11A2, esame oftalmologico era normale.
ALTRI DISTURBI
Altre malattie con alcune caratteristiche in comune con la sindrome di Stickler includono displasia congenita spondiloepifiseale, 49 displasia di Kniest, 49-51 e la sindrome di Marfan. 52
References
1. ↵
Stickler GB, Belau PG, Farrell FJ, et al.(1965) Hereditary progressive arthro-ophthalmopathy. Mayo Clinic Proc 40:433–455.[Medline][Web of Science]Google Scholar
2. ↵
1. Stickler GB, Pugh DG(1967) Hereditary progressive arthro-ophthalmopathy. II. Additional observations on vertebral abnormalities, a hearing defect, and a report of a similar case. Mayo Clinic Proc 42:495–500.[Web of Science]Google Scholar
3. ↵
1. Temple IK(1989) Stickler’s syndrome. J Med Genet 26:119–126.[FREE Full text]
4. ↵
1. Scott JD(1989) Duke-Elder lecture. Prevention and perspective in retinal detachment. Eye 3:491–515.Google Scholar
5. ↵
1. Seery CM, Pruett RC, Liberfarb RM, Cohen BZ(1990) Distinctive cataract in the Stickler syndrome. Am J Ophthalmol 110:143–148.[Medline][Web of Science]Google Scholar
6. ↵
1. Maumenee IH(1979) Vitreoretinal degeneration as a sign of generalized connective tissue diseases. Am J Ophthalmol 88:432–449.[Medline][Web of Science]Google Scholar
7. ↵
1. Snead MP, Payne SJ, Barton DE, et al.(1994) Stickler syndrome: correlation between vitreoretinal phenotypes and linkage to COL 2A1. Eye 8:609–614.Google Scholar
8. ↵
1. Snead MP, Yates JR, Pope FM, Temple IK,Scott JD.(1996) Masked confirmation of linkage between type 1 congenital vitreous anomaly and COL 2A1 in Stickler syndrome. Graefes Arch Clin Exp Ophthalmol 234:720–721.[CrossRef][Medline][Web of Science]Google Scholar
9. ↵
1. Snead MP(1996) Hereditary vitreopathy. Eye 10:653–663.Google Scholar
10. ↵
1. Nielson CE.(1981) Stickler’s syndrome. Acta Ophthalmol 59:286–295.Google Scholar
11. ↵
1. Cho H,Yamada Y, Yoo TJ.(1991) Ultrastructural changes of cochlea in mice with hereditary chondrodysplasia (cho/cho). Ann N Y Acad Sci 630:259–261.[Medline][Web of Science]Google Scholar
12. ↵
1. Lucarini JW, Liberfarb RM,Eavey RD(1987) Otolaryngological manifestations of the Stickler syndrome. Int J Pediatr Otorhinolaryngol 14:215–222.[CrossRef][Medline][Web of Science]Google Scholar
13. ↵
1. Beighton P(1993) McKusick’s heritable disorders of connective tissue. (Mosby, St Louis), 5th ed..Google Scholar
14. ↵
1. Rai A, Wordsworth P, Coppock JS, Zaphiropoulos GC, Struthers GR.(1994) Hereditary arthro-ophthalmopathy (Stickler syndrome): a diagnosis to consider in familial premature osteoarthritis. Br J Rheumatol 33:1175–1180.[Abstract/FREE Full text]
15. ↵
1. Beals RK.(1977) Hereditary arthro-ophthalmopathy (the Stickler syndrome). Report of a kindred with protrusio acetabuli. Clin Orthop 125:32–35.Google Scholar
16. ↵
1. Liberfarb RM, Goldblatt A.(1986) Prevalence of mitral-valve prolapse in the Stickler syndrome. Am J Med Genet 24:387–392.[CrossRef][Medline][Web of Science]Google Scholar
17. ↵
1. Prockop DJ, Kivirikko KI, Tuderman L, Guzman NA.(1979) The biosynthesis of collagen and its disorders (second of two parts). N Engl J Med 301:77–85.[Medline][Web of Science]Google Scholar
18. ↵
1. Prockop DJ, Kivirikko KI, Tuderman L,Guzman NA.(1979) The biosynthesis of collagen and its disorders (first of two parts). N Engl J Med 301:13–23.[CrossRef][Medline][Web of Science]Google Scholar
19. ↵
1. Francomano CA.(1995) Key role for a minor collagen. Nat Genet 9:6–8.[CrossRef][Medline][Web of Science]Google Scholar
20. ↵
1. Pope FM.(1998) Molecular abnormalities of collagen and connective tissue. Maddison PJ, Isenberg DA, Woo P, Glass DN, editors. Oxford textbook of rheumatology. (Oxford University Press, Oxford), pp 353–404.Google Scholar
21. ↵
1. Prockop DJ, Kivirikko KI.(1995) Collagens: molecular biology, diseases and potentials for therapy. Annu Rev Biochem 64:403–434.[CrossRef][Medline][Web of Science]Google Scholar
22. ↵
1. Upholt WB, Strom CM, Sandell LJ.(1985) Structure of the type II collagen gene. Ann N Y Acad Sci 460:130–140.[CrossRef][Medline][Web of Science]Google Scholar
23. ↵
1. Ballo R, Beighton PH, Ramesar RS.(1998) Stickler-like syndrome due to a dominant negative mutation in the COL2A1 gene. Am J Med Genet 80:6–11.[CrossRef][Medline][Web of Science]Google Scholar
24. ↵
1. Horton WA.(1996) Progress in human chondrodysplasias: molecular genetics. Ann N Y Acad Sci 785:150–159.[Medline]Google Scholar
25. ↵
1. Richards AJ, Yates JR, Williams R, et al.(1996) A family with Stickler syndrome type 2 has a mutation in the COL11A1 gene resulting in the substitution of glycine 97 by valine in alpha 1 (XI) collagen. Hum Mol Genet 5:1339–1343.[Abstract/FREE Full text]
26. ↵
1. Martin S, Richards AJ,Yates JRW, Pope FM, Scott JD, Snead MP.(1998) Stickler syndrome types 1 and 2: confirmation of genetic heterogeneity and evidence for another locus. Presentation XXI Meeting Club Jules Gonin, p A34.Google Scholar
27. ↵
1. Mayne R, Brewton RG, Mayne PM, Baker JR.(1993) Isolation and characterization of the chains of type V/type XI collagen present in bovine vitreous. J Biol Chem 268:9381–9386.[Abstract/FREE Full text]
28. ↵
1. Wilkin DJ, Mortier GR, Johnson CL, et al.(1998) Correlation of linkage data with phenotype in eight families with Stickler syndrome. Am J Med Genet 80:121–127.[CrossRef][Medline][Web of Science]Google Scholar
29. ↵
1. Wagner H.(1938) Ein bisher unbekanntes Erbleiden des Auges (Degeneratio hyaloideo-retinalis hereditaria), beobachtet im Kanton Zurich. Klin Monatsbl Augenheilkd 100:840–857.Google Scholar
30. ↵
1. Liberfarb RM, Hirose T, Holmes LB.(1981) The Wagner-Stickler syndrome: a study of 22 families. J Pediatr 99:394–399. [CrossRef][Medline][Web of Science]Google Scholar
31. ↵
1. Brown DM, Graemiger RA, Hergersberg M, et al.(1995) Genetic linkage of Wagner disease and erosive vitreoretinopathy to chromosome 5q13-14. Arch Ophthalmol 113:671–675.[CrossRef][Medline][Web of Science]Google Scholar
32. ↵
1. Fryer AE, Upadhyaya M ,Littler M, et al.(1990) Exclusion of COL2A1 as a candidate gene in a family with Wagner-Stickler syndrome. J Med Genet 27:91–93.[Abstract/FREE Full text]
33. ↵
1. Korkko J, Ritvaniemi P, Haataja L, et al.(1993) Mutation in type II procollagen (COL2A1) that substitutes aspartate for glycine alpha 1-67 and that causes cataracts and retinal detachment: evidence for molecular heterogeneity in the Wagner syndrome and the Stickler syndrome (arthro-ophthalmopathy). Am J Hum Genet 53:55–61.[Medline]Google Scholar
34. ↵
1. Brown DM, Kimura AE, Weingeist TA, Stone EM.(1994) Erosive vitreoretinopathy. A new clinical entity. Ophthalmology 101:694–704.[Medline][Web of Science]Google Scholar
35. ↵
1. Marshall D.(1958) Ectodermal dysplasia. Report of a kindred with ocular deformities and hearing defect. Am J Ophthalmol 45:143–156.[Medline][Web of Science]Google Scholar
36. ↵
1. Shanske AL, Bogdanow A, Shprintzen RJ, Marion RW.(1997) The Marshall syndrome: report of a new family and review of the literature. Am J Med Genet 70:52–57.[CrossRef][Medline]Google Scholar
37. ↵
1. Cohen MM, Jr.(1974) The demise of the Marshall syndrome. J Pediatr 85:878.[Medline]Google Scholar
38. ↵
1. Ayme S, Preus M.(1984) The Marshall and Stickler syndromes: objective rejection of lumping. J Med Genet 21:34–38.[Abstract/FREE Full text]
39. ↵
1. Griffith AJ, Sprunger LK, Sirko-Osadsa DA, Tiller GE, Meisler MH,Warman ML.(1998) Marshall syndrome associated with a splicing defect at the COL11A1 locus. Am J Hum Genet 62:816–823.[CrossRef][Medline][Web of Science]Google Scholar
40. ↵
1. Shanske A, Bogdanow A, Shprintzen RJ, Marion RW.(1998) Marshall syndrome and a defect at the COL11A1 locus. Am J Hum Genet 63:1558–1561.[CrossRef][Medline][Web of Science]Google Scholar
41. ↵
1. Warman ML, Tiller GE, Griffith AJ.(1998) Reply to Shanske et al. Am J Hum Genet 63:1559–1561.[CrossRef][Medline][Web of Science]Google Scholar
42. ↵
1. Weissenbacher G, Zweymuller E.(1964) Coincidental occurrence of Pierre Robin and foetal chondrodysplasia. Monatsschr Kinderheilkd 112:315–317.[Medline]Google Scholar
43. ↵
1. Giedion A, Brandner M, Lecannellier J, et al.(1982) Oto-spondylo-megaepiphyseal dysplasia (OSMED). Helv Paediatr Acta 37:361–380.[Medline]Google Scholar
44. ↵
1. Pihlajamaa T, Prockop DJ, Faber J,et al.(1998) Heterozygous glycine substitution in the COL11A2 gene in the original patient with the Weissenbacher-Zweymuller syndrome demonstrates its identity with heterozygous OSMED (nonocular Stickler syndrome). Am J Med Genet 80:115–120.[CrossRef][Medline][Web of Science]Google Scholar
45. ↵
1. Brunner HG, van Beersum SE, Warman ML, Olsen BR, Ropers HH, Mariman EC(1994) A Stickler syndrome gene is linked to chromosome 6 near the COL11A2 gene. Hum Mol Genet 3:1561–1564.[Abstract/FREE Full text]
46. ↵
1. Vikkula M, Mariman EC, Lui VC, et al.(1995) Autosomal dominant and recessive osteochondrodysplasias associated with the COL11A2 locus. Cell 80:431–437.[CrossRef][Medline][Web of Science]Google Scholar
47. ↵
1. Sirko-Osadsa DA, Murray MA, Scott JA, Lavery MA, Warman ML, Robin NH.(1998) Stickler syndrome without eye involvement is caused by mutations in COL11A2, the gene encoding the alpha2(XI) chain of type XI collagen. J Pediatr 132:368–371.[CrossRef][Medline][Web of Science]Google Scholar
48. ↵
1. van Steensel MA, Buma P, de Waal Malefijt MC, van den Hoogen FH, Brunner HG.(1997) Oto-spondylo-megaepiphyseal dysplasia (OSMED): clinical description of three patients homozygous for a missense mutation in the COL11A2 gene. Am J Med Genet 70:315–323.[CrossRef][Medline][Web of Science]Google Scholar
49. ↵
1. Spranger J, Winterpacht A, Zabel B.(1994) The type II collagenopathies: a spectrum of chondrodysplasias. Eur J Pediatr 153:56–65.[Medline][Web of Science]Google Scholar
50. ↵
1. Kniest W.(1952) Zur abgrenzung der dysostosis enchondrallis von der chondrodystrophie. Z Kinderheilkd 70:633–640.[CrossRef][Medline]Google Scholar
51. ↵
1. Maumenee IH, Traboulsi EI.(1985) The ocular findings in Kniest dysplasia. Am J Ophthalmol 100:155–160.[Medline][Web of Science]Google Scholar
52. ↵
1. Gray JR, Davies SJ.(1996) Marfan syndrome. J Med Genet 33:403–408.[FREE Full text]
53. ↵
1. Brown DM, Vandenburgh K, Kimura AE, Weingeist TA, Sheffield VC, Stone EM.(1995) Novel frameshift mutations in the procollagen 2 gene (COL2A1) associated with Stickler syndrome (hereditary arthro-ophthalmopathy). Hum Mol Genet 4:141–142.[FREE Full text]
54. ↵
1. Ahmad NN, McDonald-McGinn DM, Zackai EH,et al.(1993) A second mutation in the type II procollagen gene (COL2AI) causing Stickler syndrome (arthro-ophthalmopathy) is also a premature termination codon. Am J Hum Genet 52:39–45.[Medline][Web of Science]Google Scholar
55. ↵
1. Williams CJ, Ganguly A, Considine E, et al.(1996) A-2→G transition at the 3′ acceptor splice site of IVS17 characterizes the COL2A1 gene mutation in the original Stickler syndrome kindred. Am J Med Genet 63:461–467.[CrossRef][Medline][Web of Science]Google Scholar
56. ↵
1. Ahmad NN, Ala-Kokko L, Knowlton RG, et al.(1991) Stop codon in the procollagen II gene (COL2A1) in a family with the Stickler syndrome (arthro-ophthalmopathy). Proc Natl Acad Sci USA 88:6624–6627.[Abstract/FREE Full text]
57. ↵
1. Brown DM, Nichols BE, Weingeist TA, Sheffield VC, Kimura AE,Stone EM.(1992) Procollagen II gene mutation in Stickler syndrome. Arch Ophthalmol 110:1589–1593.[CrossRef][Medline][Web of Science]Google Scholar
58. ↵
1. Ritvaniemi P, Hyland J, Ignatius J, Kivirikko KI, Prockop DJ, Ala-Kokko L.(1993) A fourth example suggests that premature termination codons in the COL2A1 gene are a common cause of the Stickler syndrome: analysis of the COL2A1 gene by denaturing gradient gel electrophoresis. Genomics 17:218–221.[CrossRef][Medline][Web of Science]Google Scholar
59. ↵
1. Ahmad NN, Dimascio J, Knowlton RG,Tasman WS.(1995) Stickler syndrome. A mutation in the nonhelical 3′ end of type II procollagen gene. Arch Ophthalmol 113:1454–1457.[CrossRef][Medline][Web of Science]Google Scholar
APPROFONDIMENTO
Storia Naturale
Stickler sindrome è una malattia multisistemica tessuto connettivo che può colpire l’occhio, cranio e faccia, orecchio interno, scheletro e articolazioni.
Risultati oculari comprendono miopia elevata (> -3 diottrie) che non è progressiva e rilevabile nel periodo neonatale [ Snead & Yates 1999 ] e le anomalie vitreo. Si osservano due tipi di anomalie vitreo:
- Tipo 1 (“membranosa”), che è molto più comune, è caratterizzata da una persistenza di gel vitreale vestigiale nello spazio retrolentale che è delimitato da una membrana piegata.
- Tipo 2 (“perline”), che è molto meno comune, è caratterizzata da radi fasci irregolarmente ispessite tutto il corpo vitreo.
Questi fenotipi oculari funzionano allineare all’interno delle famiglie [ Snead & Yates 1999 ].
Da Vu et al [2003] è stato descritto , una atrofia posteriore corioretinica in una famiglia con distrofia vitreoretinica, una nuova mutazione in COL2A1, e le caratteristiche sistemiche della sindrome di Stickler, suggerendo che gli individui con sindrome di Stickler possono avere cambiamenti corioretinici del polo posteriore in aggiunta alle alterazioni vitreali .
Nota: in precedenza, si è pensato che le famiglie con atrofia posteriore corioretinica avessero la malattia di Wagner.
LE ALTERAZIONI CRANIO-FACCIALI comprendono un profilo facciale piatto spesso definito come un faccia “scavata”. Questo profilo è causato da un sottosviluppo del mascellare superiore e del ponte nasale, che può causare telecanto ed epicanto. L’ipoplasia mediofacciale è più pronunciata nei neonati e nei bambini piccoli; gli individui più anziani possono avere un profilo facciale normale. Spesso la punta del naso è piccolo e all’insù, rendendo il philtrum apparire lungo.
La Micrognazia è comune e può essere associata a palatoschisi come parte della sequenza di Pierre Robin (micrognazia, palatoschisi, glossoptosi). Il grado di micrognazia può compromettere le vie aeree superiori, che necessitano di tracheostomia.
La palatoschisi può essere visto in assenza di micrognazia.
l’IPOACUSIA è comune. Il grado di ipoacusia è variabile e può essere progressiva.
Un certo grado di ipoacusia neurosensoriale si trova nel 40% degli individui – in genere per i toni acuti, spesso lieve [ Snead & Yates 1999 ]. Il meccanismo esatto non è chiaro, anche se è legato alla espressione del collagene nell’orecchio interno di tipo II e IX [ all’Admiraal et al 2000 ].L’Ipoacusia neurosensoriale globale nella sindrome di Stickler di I tipo è in genere lieve e non progressivo in modo significativo; è meno grave di quella riportata per la sindrome di Sticklerdi tipi II e III.
Perdita uditiva può anche essere visto. Questo può essere secondaria ad infezioni ricorrenti dell’orecchio che sono spesso associati con palatoschisi e / o può essere secondaria ad un difetto degli ossicini dell’orecchio medio.
MANIFESTAZIONI SCHELETRICHE: sono l’artrite precoce, bassa statura rispetto ai fratelli e reperti radiologici compatibili con lieve displasia spondilo-epifiseale. Alcuni individui hanno un corpo marfanoide, ma senza alta statura.
La lassità articolare, a volte riscontrata negli individui giovani, diventa meno evidente (o si risolve completamente) con l’età [ Snead & Yates 1999 ].
l’artrite precoce è comune e può essere grave, che porta alla necessità di di una sostituzione chirurgica articolare, anche già a partire dal terzo o quarto decennio. Più comunemente, l’artropatia è mite, e colpisce individui che spesso non si lamentano di dolori articolari a meno che non espressamente richiesto. Tuttavia, le denunce non specifici della rigidità articolare può essere provocato anche da bambini piccoli.
Anormalità spinali comunemente osservati nella sindrome di Stickler che provocano mal di schiena cronico sono scoliosi, anomalie endplate, cifosi, e platyspondylia [ Rose et al 2001 ].
PROLASSO DELLA VALVOLA MITRALE (MVP) è stata riportata in circa il 50% degli individui con sindrome di Stickler in una serie e non gli individui in un altro.
Diagnosi
Diagnosi clinica
Non sono stati definiti i criteri diagnostici clinici per la sindrome di Stickler. Il disturbo deve essere considerato in individui con risultati clinici in due o più delle seguenti categorie:
Oftalmologica
- Cataratta congenita o ad insorgenza precoce
- Anomalia congenita vitreo, distacco retinico
- La miopia maggiore di -3 diottrie
Nota: I neonati sono tipicamente ipermetrope (≥ 1 diottria); così il ritrovamento di qualsiasi grado di miopia in un neonato a rischio (ad esempio, un neonato che ha la sequenza di Pierre-Robin o un genitore affetto ) è suggestiva della diagnosi di sindrome di Stickler.
Craniofacciale
- Ipoplasia medio-facciale, depresso nasale, narici anteverse (facies caratteristica in genere più pronunciate durante l’infanzia)
- Ugola bifida, schisi del palato duro
- Micrognazia
- Sequenza di Robin (micrognazia, palatoschisi, glossoptosi)
Audiologica
- Ipoacusia neurosensoriale o conduttiva
- Sistemi dell’orecchio medio ipermobili (riportati nel 46% dei colpiti individui in una coorte [ Szymko-Bennett et al 2001 ])
Articolare
- Ipermobilità
- Lieve displasia spondiloepifiseale
- Artrosi precoce
Test Genetici Molecolari
Geni. Mutazioni in COL2A1, COL11A1, COL11A2, COL9A1, COL9A2 e sono stati associati con la sindrome di Stickler, denominata sindrome di Stickler tipo I, II, III, IV, e V, rispettivamente.
La diagnosi si basa sul quadro clinico e può essere confermata dalle analisi molecolari. È possibile la diagnosi prenatale per le famiglie nelle quali sia stata identificata la mutazione patogenetica. La presa in carico deve essere multidisciplinare e, data la variabilità dell’espressione clinica, il trattamento deve essere adattato a ogni paziente. La prognosi dipende dalla gravità dei segni presenti.
Indagini laboratorio anatomia patologica procedure diagnostiche:
- L’esame oculare alla nascita può evidenziare problemi già presenti, come la cataratta congenita o difetti del vitreo; una volta cresciuto il bambino si potrà valutare la presenza e l’entità di miopia
- Le alterazioni del massiccio facciale, del palato e della lingua vengono evidenziate al momento della visita alla nascita
- Il deficit uditivo viene studiato con l’audiogramma, che determina con esattezza, modificando intensità e frequenza dei suoni, il livello di percezione uditiva e la scala di suoni che il pazienti può ascoltare
- Nel corso della visita può essere evidenziata la presenza di un prolasso della mitrale, che determina un soffio da rigurgito sul focolaio di auscultazione mitralica
- Viene valutata l’estensione della flessibilità delle articolazioni.
- I tests genetici sono limitati ai casi dubbi; non è necessario il ricorso alla genetica per la diagnosi di un caso; può essere importante in fase di diagnosi prenatale.
Diagnosi differenziale
Un certo numero di disturbi hanno caratteristiche che si sovrappongono con quelli della sindrome di Stickler.
Per i disturbi alleliche vedere Disturbi geneticamente correlati .
Sindrome di Wagner (OMIM 143200 ). Descritto da Wagner [1938] , questa condizione è caratterizzata dalla presenza di manifestazioni oculari simili a quelle osservate in Stickler sindrome e la sindrome di Marshall ma senza altre manifestazioni cliniche. I risultati oculari, che progrediscono in gravità con l’età, comprendono miopia elevata, una cavità vitrea vuoto con fili avascolari, atrofia corioretinica, e la cataratta. Sono anche osservati distacco della retina e glaucoma. Anomalie con adattamento al buio sono evidenti su elettroretinografia. Il gene in cui mutazione è responsabile della sindrome di Wagner è VCAN. Meredith et al [2007] ulteriormente delineato le manifestazioni oculari della sindrome di Wagner come sineresi vitreo, ispessimento e la separazione incompleta della membrana hyaloid posteriore, modifiche corioretiniche accompagnate da risposte elettroretinografiche subnormali, un fovea ectopica, insorgenza precoce di cataratta, e nella loro famiglia, uveite anteriore senza formazione di sinechie.
Alto grado di miopia è un errore di rifrazione maggiore o uguale a -6 diottrie. Diversi loci per miopia sono state mappate ( Tabella 2 ).
Tabella 2. Loci Mappati per la miopia
|
Locus Nome |
Località |
OMIM |
|
MYP1 |
Xq28 |
|
|
MYP2 |
18p11.31 |
|
|
MYP3 |
12q |
|
|
MYP5 |
17q21-q22 |
|
|
MYP6 |
22q12 |
|
|
MYP7 |
11p13 |
|
|
MYP8 |
3q26 |
|
|
MYP9 |
4q12 |
|
|
MYP10 |
8p23 |
|
|
MYP11 |
4q22-q27 |
|
|
MYP12 |
2q37.1 |
|
|
MYP13 |
Xq23-q27.2 |
|
|
MYP14 |
||
|
MYP15 |
17q21-q22 |
|
|
MYP16 |
5p15.33-p15.2 |
|
|
MYP17 |
7p15 |
|
|
MYP18 |
14q22.1-q24.2 |
|
|
MYP19 |
5p15.1-p13.3 |
Non sindromica congenita PERSISTENTE IPERPLASTICO VITREO PRIMARIO, AUTOSOMICA RECESSIVA; PHPVAR attaccamento della retina (NcRNA) (OMIM 221900 ) comprende insensibilità congenita alla luce, massiccia massa retrolental, camera anteriore poco profonda, microftalmia, e nistagmo in individui altrimenti normali. NcRNA mapping a 10q21 [ Ghiasvand et al 2000 ].
Degenerazione Vitreoretinica Snowflake (OMIM 193230 ) è caratterizzata da cataratta, la degenerazione vitreoretinica assomiglia più da vicino a degenerazione dei fiocchi di neve, degenerazione fibrillare del vitreo e alterazioni retiniche periferiche, puntini giallo-bianco nella retina, depositi cristallini simili a fiocchi di neve. Gli individui mostrano un basso tasso di distacco di retina [ Lee et al 2003 ].
La Sindrome di Binder (displasia maxillonasale) (OMIM 155050 ). Questa condizione è caratterizzata da ipoplasia mediofacciale e assenza nelle radiografie della spina nasale anteriore,. Mentre sono state segnalate alcune famiglie con trasmissione verticale [ Roy-Doray et al 1997 ], la sindrome non è considerata una sindrome genetica, ma piuttosto un’anomalia aspecifica del complesso nasomascellare.
Sequenza di Robin. Circa la metà di tutti gli individui con sequenza Robin hanno una sindrome di fondo, di cui la sindrome di Stickler è la più comune. In uno studio, 34 su 100 individui con sequenza di Robin avevano la sindrome di Stickler. In uno studio retrospettivo su 74 pazienti con sequenza di Robin si è anche scoperto che oltre il 30% di questi individui aveva la sindrome di Stickler [ van den Elzen et al 2001 ]. In uno studio più recente su 115 individui con sequenza di Robin, il 18% aveva la sindrome di Stickler [ Evans et al 2006 ].
Nota per i medici: per un paziente-specifico ‘simultaneo consultare’ relative a questo disturbo, andare a ![]() , Un sistema diagnostico strumento interattivo decisione supporto software che fornisce diagnosi differenziali basate sui risultati dei pazienti (registrazione o accesso istituzionale necessario).
, Un sistema diagnostico strumento interattivo decisione supporto software che fornisce diagnosi differenziali basate sui risultati dei pazienti (registrazione o accesso istituzionale necessario).
Terapia
I medici specialisti che si occupano del trattamento della sindrome comprendono oftalmologi, audiologi e reumatologi. Non esiste un trattamento della sindrome in quanto tale, bensì dei segni e sintomi legati alla sindrome.
La correzione chirurgica della palatoschisi viene in genere effettuata tra il 9° ed il 12° mese di vita, e permette di risolvere i problemi di alimentazione e respirazione ad esso correlati.
La miopia viene corretta con applicazione di lenti, mentre il deficit uditivo con l’applicazione di protesi acustiche.
Per i dolori articolari si interviene con FANS (ibuprofene, naprossene ed aspirina) per alleviare il dolore e la tumefazione articolare; l’assunzione di questi farmaci prima o dopo l’esercizio fisico permette al bambino movimenti meno dolorosi.
Attenzione alla somministrazione di aspirina prima dei 14 anni di età, per il rischio di comparsa di sindrome di Reye.
Complicanze:
Comprendono:
- Glaucoma(oculare) l’aumento della pressione endooculare schiaccia il nervo ottico; se non trattato può evolvere alla cecità.
- Distacco di retina (oculare) si tratta di una grave complicanza oculare caratterizzata dal distacco della retina, strato di recettori monocellulare, dalla rete di vasi sanguigni responsabile del suo nutrimento, la coroide; se non trattato porta alla cecità. Si manifesta con improvvisa perdita di una parte del campo visivo, con movimento come di lembo di tenda ai margini del campo visivo, come improvvisa comparsa di “mosche volanti” macchie o filamenti che sembrano galleggiare nel vitreo.
- Sordità(uditiva) la perdita dell’udito aumenta con la crescita del bambino, e può evolvere alla sordità.
- Osteoartrite(articolare) la presenza di articolazioni gonfie e dolenti può indicare una precoce insorgenza di osteoartrite, con deterioramento della cartilagine articolare. Nei casi più gravi, è necessario il ricorso alla chirurgia, con sostituzione protesica dell’articolazione dell’anca o del ginocchio.
- Infezioni all’orecchio (uditiva) le anomalie del massiccio facciale espongono allo sviluppo di infezioni otologiche, più che nel bambino normale.
- Difficoltà nella respirazione o nell’alimentazione le anomalie del massiccio facciale possono comprendere la palatoschisi (apertura del palato duro), una lingua grande ed una piccola mascella (sindrome di Robin), malformazioni che comportano difficoltà nell’alimentazione e nella respirazione.
Icd-9-cm:
Circostanze da evitare
Individui affetti devono essere avvertiti di evitare attività come sport di contatto, che possono portare a traumatico distacco di retina.
Allo stato attuale, esistono terapie di profilassi per ridurre al minimo il danno articolare nei pazienti colpiti . Alcuni medici raccomandano di evitare attività fisiche che comportano un elevato impatto alle articolazioni i nel tentativo di ritardare l’insorgenza dell’ artropatia. Anche se questa raccomandazione sembra logica, non ci sono dati per sostenerla.
Valutazione dei parenti a rischio
A causa della espressione variabile della sindrome di Stickler [ Faber et al 2000 ], è opportuno identificare coloro che garantiscono la valutazione in itinere (vedi Surveillance ). La valutazione può essere realizzata in due modi:
- Documentando la storia medica e l’esecuzione di un esame fisico e oftalmologico, audiologico e le valutazioni radiografiche. L’esame delle fotografie dell’infanzia può essere utile nella valutazione dei risultati cranio degli adulti, dal momento che i risultati cranio-facciali caratteristici della sindrome di Stickler possono diventare un carattere meno distintivo con l’età.
- Con i test di genetica molecolare se la mutazione responsabile della malattia in famiglia è conosciuta
Si raccomanda che i parenti a rischio nei quali la diagnosi della sindrome di Stickler non si può escludere con certezza siano seguiti per le potenziali complicanze.
Vedere la consulenza genetica per le questioni relative alle prove di rischio nei parenti .
Prognosi
L’aspettativa di vita risulta essere pressoché normale, nonostante alcune condizioni associate alla sindrome (come l’artrite e la sordità) possono peggiorare la qualità della vita del malato.
Letteratura
- Admiraal RJ, Brunner HG, Dijkstra TL, Huygen PL, Cremers CW. Hearing loss in the nonocular Stickler syndrome caused by a COL11A2 mutation. Laryngoscope. 2000; 110 :457–61. [ PubMed]
- Ala-Kokko L, Baldwin CT, Moskowitz RW, Prockop DJ. Single base mutation in the type II procollagen gene (COL2A1) as a cause of primary osteoarthritis associated with a mild chondrodysplasia. Proc Natl Acad Sci US A. 1990; 87 :6565–8. [ PMC free article ] [ PubMed ]
- Annunen S, Korkko J, Czarny M, Warman ML, Brunner HG, Kaariainen H, Mulliken JB, Tranebjaerg L, Brooks DG, Cox GF, Cruysberg JR, Curtis MA, Davenport SL, Friedrich CA, Kaitila I, Krawczynski MR, Latos-Bielenska A, Mukai S, Olsen BR, Shinno N, Somer M, Vikkula M, Zlotogora J, Prockop DJ, Ala-Kokko L. Splicing mutations of 54-bp exons in the COL11A1 gene cause Marshall syndrome, but other mutations cause overlapping Marshall/Stickler phenotypes.Am J Hum Genet. 1999; 65 :974–83. [ PMC free article ] [ PubMed ]
- Baker S, Booth C, Fillman C, Shapiro M, Blair MP, Hyland JC, Ala-Kokko L. A loss of function mutation in the COL9A2 gene causes autosomal recessive Stickler syndrome. Am J Med Genet A.2011; 155A :1668–72. [ PubMed ]
- Donoso LA, Edwards AO, Frost AT, Ritter R, Ahmad N, Vrabec T, Rogers J, Meyer D, Parma S. Clinical variability of Stickler syndrome: role of exon 2 of the collagen COL2A1 gene. Surv Ophthalmol. 2003; 48 :191–203. [ PubMed ]
- Evans AK, Rahbar R, Rogers GF, Mulliken JB, Volk MS. Robin sequence: a retrospective review of 115 patients. Int J Pediatr Otorhinolaryngol. 2006; 70 :973–80. [ PubMed ]
- Faber J, Winterpacht A, Zabel B, Gnoinski W, Schinzel A, Steinmann B, Superti-Furga A. Clinical variability of Stickler syndrome with a COL2A1 haploinsufficiency mutation: implications for genetic counselling. J Med Genet. 2000; 37 :318–20. [ PMC free article ] [ PubMed ]
- Ghiasvand NM, Kanis AB, Helms C, Sheffield VC, Stone EM, Donis-Keller H. Nonsyndromic congenital retinal nonattachment gene maps to human chromosome band 10q21. Am J Med Genet.2000; 90 :165–8. [ PubMed ]
- Go SL, Maugeri A, Mulder JJ, van Driel MA, Cremers FP, Hoyng CB. Autosomal dominant rhegmatogenous retinal detachment associated with an Arg453Ter mutation in the COL2A1 gene.Invest Ophthalmol Vis Sci. 2003; 44 :4035–43. [ PubMed ]
- Griffith AJ, Sprunger LK, Sirko-Osadsa DA, Tiller GE, Meisler MH, Warman ML. Marshall syndrome associated with a splicing defect at the COL11A1 locus. Am J Hum Genet. 1998; 62:816–23. [ PMC free article ] [ PubMed ]
- Jackson GC, Marcus-Soekarman D, Stolte-Dijkstra I, Verrips A, Taylor JA, Briggs MD. Type IX collagen gene mutations can result in multiple epiphyseal dysplasia that is associated with osteochondritis dissecans and a mild myopathy. Am J Med Genet. 2010; 152A :863–9. [ PMC free article ] [ PubMed ]
- Lee MM, Ritter R, Hirose T, Vu CD, Edwards AO. Snowflake vitreoretinal degeneration: follow-up of the original family. Ophthalmology. 2003; 110 :2418–26. [ PubMed ]
- Liberfarb RM, Levy HP, Rose PS, Wilkin DJ, Davis J, Balog JZ, Griffith AJ, Szymko-Bennett YM, Johnston JJ, Francomano CA, Tsilou E, Rubin BI. The Stickler syndrome: genotype/phenotype correlation in 10 families with Stickler syndrome resulting from seven mutations in the type II collagen gene locus COL2A1. Genet Med. 2003; 5 :21–7. [ PubMed ]
- Liu YF, Chen WM, Lin YF, Yang RC, Lin MW, Li LH, Chang YH, Jou YS, Lin PY, Su JS, Huang SF, Hsaio KJ, Fann CSJ, Hwang HW, Chen YT, Tsai SF. Type II collagen variants and inherited osteonecrosis of the femoral head. New Eng J Med. 2005; 352 :2294–301. [ PubMed ]
- Majava M, Hoornaert KP, Bartholdi D, Bouma MC, Bouman K, Carrera M, Devriendt K, Hurst J, Kitsos G, Niedrist D, Petersen MB, Shears D, Stolte-Dijkstra I, Van Hagen JM, Ala-Kokko L, Männikkö M, Mortier G. A report on 10 new patients with heterozygous mutations in the COL11A1 gene and a review of genotype-phenotype correlations in type XI collagenopathies. Am J Med Genet A. 2007; 143 :258–64. [ PubMed ]
- Martin S, Richards AJ, Yates JR, Scott JD, Pope M, Snead MP. Stickler syndrome: further mutations in COL11A1 and evidence for additional locus heterogeneity. Eur J Hum Genet. 1999; 7:807–14. [ PubMed ]
- McGuirt WT, Prasad SD, Griffith AJ, Kunst HP, Green GE, Shpargel KB, Runge C, Huybrechts C, Mueller RF, Lynch E, King MC, Brunner HG, Cremers CW, Takanosu M, Li SW, Arita M, Mayne R, Prockop DJ, Van Camp G, Smith RJ. Mutations in COL11A2 cause non-syndromic hearing loss (DFNA13). Nat Genet. 1999; 23 :413–9. [ PubMed ]
- Melkoniemi M, Brunner HG, Manouvrier S, Hennekam R, Superti-Furga A, Kaariainen H, Pauli RM, van Essen T, Warman ML, Bonaventure J, Miny P, Ala-Kokko L. Autosomal recessive disorder otospondylomegaepiphyseal dysplasia is associated with loss-of-function mutations in the COL11A2 gene. Am J Hum Genet. 2000; 66 :368–77. [ PMC free article ] [ PubMed ]
- Meredith SP, Richards AJ, Flanagan DW, Scott JD, Poulson AV, Snead MP. Clinical characterisation and molecular analysis of Wagner syndrome. Br J Ophthalmol. 2007; 91 :655–9. [PMC free article ] [ PubMed ]
- Nikopoulos K, Schrauwen I, Simon M, Collin RW, Veckeneer M, Keymolen K, Van Camp G, Cremers FP, van den Born LI. Autosomal recessive Stickler syndrome in two families is caused by mutations in the COL9A1 gene. Invest Ophthalmol Vis Sci. 2011; 52 :4774–9. [ PubMed ]
- Parentin F, Sangalli A, Mottes M, Perissutti P. Stickler syndrome and vitreoretinal degeneration: correlation between locus mutation and vitreous phenotype. Apropos of a case. Graefes Arch Clin Exp Ophthalmol. 2001; 239 :316–9. [ PubMed ]
- Pihlajamaa T, Prockop DJ, Faber J, Winterpacht A, Zabel B, Giedion A, Wiesbauer P, Spranger J, Ala-Kokko L. Heterozygous glycine substitution in the COL11A2 gene in the original patient with the Weissenbacher-Zweymuller syndrome demonstrates its identity with heterozygous OSMED (nonocular Stickler syndrome). Am J Med Genet. 1998; 80 :115–20. [ PubMed ]
- Printzlau A, Andersen M. Pierre Robin sequence in Denmark: a retrospective population-based epidemiological study. Cleft Palate Craniofac J. 2004; 41 :47–52. [ PubMed ]
- Richards AJ, Baguley DM, Yates JR, Lane C, Nicol M, Harper PS, Scott JD, Snead MP. Variation in the vitreous phenotype of Stickler syndrome can be caused by different amino acid substitutions in the X position of the type II collagen Gly-XY triple helix. Am J Hum Genet. 2000; 67 :1083–94. [PMC free article ] [ PubMed ]
- Rose PS, Ahn NU, Levy HP, Ahn UM, Davis J, Liberfarb RM, Nallamshetty L, Sponseller PD, Francomano CA. Thoracolumbar spinal abnormalities in Stickler syndrome. Spine. 2001; 26 :403–9. [ PubMed ]
- Roy-Doray B, Geraudel A, Alembik Y, Stoll C. Binder syndrome in a mother and her son. Genet Couns. 1997; 8 :227–33. [ PubMed ]
- Shanske A, Bogdanow A, Shprintzen RJ, Marion RW. Marshall syndrome and a defect at the COL11A1 locus. Am J Hum Genet. 1998; 63 :1558–61. [ PMC free article ] [ PubMed ]
- Snead MP, Yates JR. Clinical and Molecular genetics of Stickler syndrome. J Med Genet. 1999; 36:353–9. [ PMC free article ] [ PubMed ]
- Stickler GB, Belau PG, Farrell FJ, Jones JD, Pugh DG, Steinberg AG, Ward LE. Hereditary progressive arthro-ophthalmopathy. Mayo Clin Proc. 1965; 40 :433–55. [ PubMed ]
- Szymko-Bennett YM, Mastroianni MA, Shotland LI, Davis J, Ondrey FG, Balog JZ, Rudy SF, McCullagh L, Levy HP, Liberfarb RM, Francomano CA, Griffith AJ. Auditory dysfunction in Stickler syndrome. Arch Otolaryngol Head Neck Surg. 2001; 127 :1061–8. [ PubMed ]
- Tiller GE, Polumbo PA, Weis MA, Bogaert R, Lachman RS, Cohn DH, Rimoin DL, Eyre DR. Dominant mutations in the type II collagen gene, COL2A1, produce spondyloepimetaphyseal dysplasia, Strudwick type. Nat Genet. 1995; 11 :87–9. [ PubMed ]
- Van Camp G, Snoeckx RL, Hilgert N, van den Ende J, Fukuoka H, Wagatsuma M, Suzuki H, Smets RM, Vanhoenacker F, Declau F, Van de Heyning P, Usami S. A new autosomal recessive form of Stickler syndrome is caused by a mutation in the COL9A1 gene. Am J Hum Genet. 2006;79 :449–57. [ PMC free article ] [ PubMed ]
- van den Elzen AP, Semmekrot BA, Bongers EM, Huygen PL, Marres HA. Diagnosis and treatment of the Pierre Robin sequence: results of a retrospective clinical study and review of the literature. Eur J Pediatr. 2001; 160 :47–53. [ PubMed ]
- Van Der Hout AH, Verlind E, Beemer FA, Buys CH, Hofstra RM, Scheffer H. Occurrence of deletion of a COL2A1 allele as the mutation in Stickler syndrome shows that a collagen type II dosage effect underlies this syndrome. Hum Mutat. 2002; 20 (3):236. [ PubMed ]
- van Steensel MA, Buma P, de Waal Malefijt MC, van den Hoogen FH, Brunner HG. Oto-spondylo-megaepiphyseal dysplasia (OSMED): clinical description of three patients homozygous for a missense mutation in the COL11A2 gene. Am J Med Genet. 1997; 70 :315–23. [ PubMed ]
- Vikkula M, Mariman EC, Lui VC, Zhidkova NI, Tiller GE, Goldring MB, van Beersum SE, de Waal Malefijt MC, van den Hoogen FH, Ropers HH. et al. Autosomal dominant and recessive osteochondrodysplasias associated with the COL11A2 locus. Cell. 1995; 80 :431–7. [ PubMed ]
- Vissing H, D’Alessio M, Lee B, Ramirez F, Godfrey M, Hollister DW. Glycine to serine substitution in the triple helical domain of pro-alpha 1 (II) collagen results in a lethal perinatal form of short-limbed dwarfism. J Biol Chem. 1989; 264 :18265–7. [ PubMed ]
- Vu CD, Brown J, Korkko J, Ritter R, Edwards AO. Posterior chorioretinal atrophy and vitreous phenotype in a family with Stickler syndrome from a mutation in the COL2A1 gene. Ophthalmology.2003; 110 :70–7. [ PubMed ]
- Wagner H. Ein bisher unbeknantes Erbleiden des Auges (degeneratiohyaloideo-retinalis hereditaria), beobachtet im Kanton, Zurich. Klin Mbl Augenheilk. 1938; 100 :840–57.
- Weissenbacher G, Zweymueller E. Simultaneous occurrance of the pierre robin syndrome and fetal chondrodysplasia. Monatsschr Kinderheilkd. 1964; 112 :315–7. [ PubMed ]
- Zabel B, Hilbert K, Stoss H, Superti-Furga A, Spranger J, Winterpacht A. A specific collagen type II gene (COL2A1) mutation presenting as spondyloperipheral dysplasia. Am J Med Genet. 1996;63 :123–8. [ PubMed ]
- Zankl A, Neumann L, Ignatius J, Nikkels P, Schrander-Stumpel C, Mortier G, Omran H, Wright M, Hilbert K, Bonafe L, Spranger J, Zabel B, Superti-Furga A. Dominant negative mutations in the C-propeptide of COL2A1 cause platyspondylic lethal skeletal dysplasia, Torrance type, and define a novel subfamily within the type 2 collagenopathies. Am J Med Genet. 2005; 133A :61–7. [PubMed ]