CRANIOSINOSTOSI CRANIOSTENOSI CRANIOSTOSI
La craniostenosi è una malformazione della struttura cranica che consiste nella fusione precoce di una o più suture craniche del neonato. Ciò determina uno sviluppo anomalo del cranio e del cervello e può causare, a seconda della stenosi e della sutura cranica coinvolta, deformità craniche, asimmetrie nello sviluppo facciale o ritardo mentale.
Cause
Le cause determinanti la craniostenosi sono la nascita prematura del neonato con gestazione inferiore alla trentasettesima settimana, il peso del neonato alla nascita inferiore a 2500 grammi, una gravidanza multipla o la nascita del feto postmaturo. Altre cause riscontrate possono essere l’ipertiroidismo, ilrachitismo, la mucopolisaccaridosi, la talassemia, l’anemia falciforme, o la microcefalia; inoltre, alcune sostanze possono determinare l’insorgere della malformazione, quali la idantoina od i retinoidi. Anche laiatrogenesi è considerata una causa della craniostenosi.[1] Alcune decine di alterazioni cromosomiche, che avvengono durante la gravidanza, causano l’insorgere della craniostenosi. Ulteriori alterazioni sono ritenute la causa delle cosiddette craniostenosi sindromiche. Nel 20% delle craniostenosi la causa è riscontrata nella mutazione di uno dei geni codificatori per uno dei tre fattori di crescita dei fibroblasti (FGFR1, FGFR2, FGFR3), mentre il gene TWIST è talvolta presente nei pazienti affetti dalla sindrome di Saethre-Chotzen.[2]
Tipologie di malformazione
La malformazione può coinvolgere una o più suture craniche, dando luogo a differenti patologie; quando la craniostenosi è a carico di più di una sutura cranica, il rischio dell’insorgere di ritardo mentale aumenta.[1]
Craniostenosi primarie
Le craniostenosi primarie (anche dette semplici) sono le più frequenti; comprendono deformazioni quali la scafocefalia, la plagiocefalia e la trigonocefalia, dette forme monosuturali, e la brachicefalia e la oxicefalia, dette forme plurisuturali(Dott. Luigi Sardo – Craniostenosi)
- La scafocefalia, frequente nei parti gemellari, consiste nella stenia della sutura sagittale. Ciò causa l’allungamento del cranio del neonato ed il restringimento della regione parietale”Il Cigno”
- La plagiocefalia consiste nella stenia della sutura coronale. Ciò causa un’assimetria cranio-facciale e l’appiattimento della fronte, talvolta associato ad una deviazione nasale”Il Cigno”
- La trigonocefalia consiste nella stenia della sutura metopica. Ciò causa un forte restringimento del viso associato ad ipertelorismo. È riconoscibile per via di alcuni segni clinici, quali sinofria, radice del naso larga, prominenza delle arcate orbitali”Il Cigno”
· La brachicefalia consiste nella stenia di entrambe le suture coronali(Dott. Luigi Sardo – Craniostenosi)
· La oxicefalia consiste nella stenia di più suture craniche(Dott. Luigi Sardo – Craniostenosi)
Craniostenosi sindromiche
Le craniostenosi sindromiche (anche dette complesse) comprendono la sindrome di Apert, la sindrome di Crouzon, la sindrome di Pfeiffer e la sindrome di Saethre-Chotzen.
Incidenza 1:2500 nati vivi, con un rapporto maschi/femmine di 3.1, circa 8% familiari Le craniostenosi sono associate a mutazioni dei geni della famiglia del FGFR (fibroblast growth factor receptor) (Cunningham et al 2007). Sono state descritte più di 100 sindromi con craniosinostosi, quelle più frequentemente associate con ipoacusia sono le Sindrome di Crouzon, Apert, Pfeiffer e Shaethtre-Chotzen La diagnosi precoce permette una corretta impostazione del piano riabilitativo chirurgico-ortodontico e protesico uditivo
Sindrome di Crouzon Prematura e progressiva craniosinostosi, ipoplasia della faccia con orbite poco profonde e proptosi oculare Ampia variabilità fenotipica, prevalenza 15 1 000000. Disordine AD dovuta a mutazioni del gene FGFR2 Ipoacusia trasmissiva in più del 50% dei casi per atresia del condotto uditivo esterno o malformazione della catena ossiculare, in circa 1/3 è presenta ipoacusia neurosensoriale.
Sindrome di Apert. Sinostosi bicoronale e della base cranica, appiattimento delle ossa occipitali, fronte prominente e moderato esoftalmo, associata a sindattilia delle mani/piedi e labio-palatoschisi in 1/3 dei casi Prevalenza 15:1000.000 Disordine AD dovuta a mutazioni del gene FGFR2 Ipoacusia trasmissiva spesso da otite media nel 50% dei casi
Sindrome di Pfeiffer. Acrocefala associata ad ingrossamento del po’lice della mano
e dita dei piedi con parziale sindattilia. Disordine AD dovuta a mutazioni del gene FGFR1 Ipoacusia trasmissiva o mista in più del 50% dei casi per stenosi/atresia del condotto uditivo esterno o malformazione della catena ossiculare. Più rare le malformazioni dell’orecchio interno.
Sindrome di Shaethtre-Chotzen. Craniosinostosi coronale uni- o bilaterale, ptosi ipertelorismo oculare, ipoplasia mascellare, padiglione piccolo e prominente, sindattilia. Disordine AD dovuta a mutazioni del gene TWIST 1 Ipoacusia trasmissiva o mista, da anchilosi stapediale e catena fissa, ma anche neurosensoriale profonda
Diagnosi
La presenza di asimmetrie nella struttura cranica sono spesso indicative di una craniostenosi. Talvolta la diagnosi può essere resa più difficoltosa a causa di tre diverse craniostenosi, ovvero quella della sutura sagittale, quella della sutura coronale e quella della sutura metopica. È importante per il pediatra essere a conoscenza di eventuali alterazioni craniche o sindromiche nella storia della famiglia del bambino e verificare che il bimbo non presenti malformazioni anche ad altri apparati od organi. Qualora si sospetti fortemente una craniostenosi è necessario eseguire una TAC associata ad un esame radiologico del cranio. Nei casi in cui siano riscontrati un posizionamento anomalo del capo ed una sinidattilia delle dita di mani e piedi è necessario optare per una diagnosi differenziale.[5]
Terapia
La terapia consiste in un intervento chirurgico atto a correggere e rimodellare la struttura cranica. È importante che l’intervento venga eseguito entro il primo anno di vita del bambino, fra i quattro e gli otto mesi, onde poter utilizzare la capacità plastica della crescita cerebrale e la rigenerazione ossea interna della dura madre; inoltre, l’intervento precoce consente di ridurre il rischio di traumi cranici.[1] Mentre nei casi di craniostenosi primaria è necessario un solo intervento, nelle craniostenosi sindromiche è necessaria una successione di più interventi chirurgici.[6]
L’intervento chirurgico consiste in un’osteotomia fronto-parieto-occipito-temporale bilaterale che consente l’asportazione della sutura chiusa. Ciò consente di ampliare gli spazi suturali, incrementando il diametro biparietale e normalizzando le curvature craniche. Laddove necessario, è anche possibile rimodellare la volta cranica e le regioni occipitali e frontali. I risultati sono ottimi sia sotto il profilo estetico che sotto quello funzionale, specialmente nei casi di craniostenosi sagittale.[1]
I rischi legati alla terapia sono, oltre a quelli comuni legati all’uso di anestetici, l’insorgere di emorragie, l’embolia polmonare, eventuali infezioni[3] e la perdita di liquido cefalorachidiano.[1]
Sindrome di Crouzon
Da Wikipedia, l’enciclopedia libera
|
Sindrome di Crouzon |
|
|
Risorse di classificazione ed esterne |
|
Paziente con sindrome di Crouzon (1912)
La sindrome di Crouzon è un autosomica dominante malattia genetica nota come arco branchiale sindrome. In particolare, questa sindrome colpisce il primo arco branchiale (o faringeo), che è il precursore della mascella e della mandibola . Dal momento che gli archi branchiali sono importanti elementi di sviluppo in una embrione in crescita , i disturbi nel loro sviluppo creano effetti diffusi e duraturi.
- Panoramica
- Cause
- Sintomi
- Diagnosi
- Incidenza
- Trattamento
- Importanza Dental
- Vedi anche
- Riferimenti
- Collegamenti esterni
§Panoramica]
Questa sindrome prende il nome da Octave Crouzon , [1][2] un fmedico francese che per primo descrisse questa sindrome . Egli ha osservato che i pazienti affetti erano una madre e sua figlia, il che implica una base genetica. Primo chiamata “disostosi cranio-facciale”, il disordine è stato caratterizzato da una serie di caratteristiche cliniche. Questa sindrome è causata da una mutazione del recettore del fattore di crescita dei fibroblasti II, localizzato sul cromosoma 10.
A dare iil nome, ” craniofacciale “si riferisce al cranio ed alla faccia , e ” disostosi “si riferisce alla malformazione delle ossa.
Ora conosciuto come sindrome di Crouzon, la malattia può essere descritto con i significati rudimentali del suo nome precedente. Ciò che avviene nella malattia è che le ossa del cranio e della faccia di un bambino, mentre è in fase di sviluppo, non sono in grado di espandersi. Così, può verificarsi che la crescita ossea non sia normale. La fusione di diversi punti delle suture porta a diversi modelli di crescita del cranio.
Gli esempi includono: trigonocefalia (fusione della sutura metopica ),
brachicefalia (fusione della sutura coronale),
dolicocefalia(fusione della sutura sagittale ),
plagiocefalia (chiusura prematura unilaterale lambdoidea e suture coronali )
oxycephaly (fusione dicoronali e della suture lambdoidea ),
Kleeblattschae del (chiusura prematura di tutti i punti di sutura).
§Cause
Associazioni con mutazioni nei geni del FGFR2[3] e FGFR3[4] sono stati identificati. [5][6]
§I sintomi
Come risultato delle modifiche dello sviluppo dell’embrione, i sintomi hanno caratteristiche molto marcate, soprattutto del viso. Le orecchie basse sono una caratteristica tipica, come in tutti i disordini che sono chiamati sindromi dell’arco branchiale. La ragione di questa anomalia è che le orecchie su un feto sono molto inferiori a quelli di un adulto. Durante lo sviluppo normale, le orecchie “viaggiano” verso l’alto nella testa; Tuttavia, nei pazienti Crouzon, questo modello di sviluppo è interrotto. Malformazioni dell condotto uditivo esterno sono estremamente comuni, in genere con conseguente perdita dell’ udito. In casi particolarmente gravi, può manifestarsi la malattia di Ménière .
La caratteristica più importante della sindrome Crouzon è la craniosinostosi , come sopra descritto; tuttavia si presenta solitamente come brachicefalia con conseguente comparsa di una testa corta e larga. esoftalmo (occhi sporgenti a causa delle orbite basse, dopo la fusione precoce delle ossa circostanti), ipertelorismo (maggiore di distanza normale tra gli occhi), e psittichorhina (naso a becco) (beak- come il naso) sono anche sintomi. Inoltre, lo strabismo esterno è un evento comune, che può essere pensato come opposto alla posizione dell’occhio trovato in sindrome di Down . Infine, un mascellare ipoplasico (l’insufficiente crescita della porzione media della faccia ) provoca un prognatismo mandibolare relativo (il mento sembra sporgere nonostante la normale crescita della mandibola) e dà l’effetto del paziente che ha una faccia concava. La sindrome di Crouzon è anche associato con dotto arterioso pervio (PDA) e coartazione aortica .
Per ragioni che non sono del tutto chiare, la maggior parte dei pazienti Crouzon hanno anche notevolmente ridotta le ossa dell’ omero e del femore rispetto al resto del loro corpo rispetto alla popolazione generale. Una piccola percentuale di pazienti Crouzon hanno anche quello che viene chiamato sindrome di Crouzon di “II tipo”, contraddistinto da parziale sindattilia .
§Diagnosi
La diagnosi di sindrome di Crouzon di solito può avvenire al momento della nascita, valutando i segni ed i sintomi del bambino. Ulteriori analisi, comprese le radiografie, le scansioni della risonanza magnetica (MRI),i test genetici, i raggi X e TAC possono essere utilizzati per confermare la diagnosi di sindrome di Crouzon.
§Incidenza
L’incidenza della sindrome di Crouzon è attualmente stimato in 1,6 su 100.000 persone. [7] Vi è una maggiore frequenza in famiglie con una storia della malattia, ma questo non significa che tutti in famiglia avranno la sindrome (di cui sopra).
§Trattamento
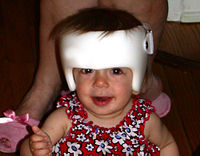
Un bambino con la sindrome di Crouzon indossa una fascia cranica correttiva.
La chirurgia è in genere utilizzata per impedire che la chiusura precoce delle suture del cranio danneggi lo sviluppo del cervello. Senza un intervento chirurgico, la cecità ed il ritardo mentale sono risultati tipici. La chirurgia craniofacciale è una disciplina sia della chirurgia plastica che della chirurgia orale e maxillo-facciale (OMS). Per spostare le orbite in avanti, i chirurghi cranio-facciali espongono il cranio e le orbite e rimodellano l’osso. Per trattare la carenza della porzione media della faccia, i chirurghi cranio-facciali possono muoversi nell’orbita e spostare in avanti ossa inferiori della porzione media della faccia. Per la chirurgia della mascella, sia i chirurghi plastici o i chirurghi orali e maxillofacciali (OMFS) possono eseguire queste operazioni. Pazienti Crouzon tendono ad avere più suture coinvolti, coronali più specificamente bilaterali craniosinostosi , e (se il bambino è sotto i 6 mesi) può essere eseguita chirurgia con la volta aperta o strip craniectomy. Nel post intervento , viene indossato un casco per diversi mesi .
Una volta trattati per i sintomi della volta cranica, i pazienti con la sindrome di Crouzon generalmente vivono una vita normale.
§significato Dentale
Per dentisti , questo disturbo è importante capire poiché molte delle anomalie fisiche sono presenti nella testa, e in particolare la cavità orale. Caratteristiche comuni sono un palato stretto / ogivale, crociato posteriore bilaterali, ipodonzia (mancano alcuni denti), e l’affollamento dei denti . A causa della ipoplasia mascellare, i pazienti con la sindrome di Crouzon hanno generalmente una notevole permanente underbite e successivamente possono non masticare con i loro incisivi. Per questo motivo, i pazienti con la sindrome di Crouzon,a volte mangiano il pollo fritto in maniera insolita con una forchetta, per esempio, o rompendo un panino a pezzi piuttosto che prenderlo a morsi con gli incisivi.
§Vedi anche
Sindrome di Collins TreacherReferences [ edit ]
1. ^synd/1383 at Who Named It?
2. ^ LEO Crouzon. Dysostose cranio-faciale héréditaire. Bulletin de la Société des Médecins des Hôpitaux de Paris, 1912, 33: 545-555.
3. ^ Reardon W, Winter RM, Rutland P, Pulleyn LJ, Jones BM, Malcolm S (September 1994). “Mutations in the fibroblast growth factor receptor 2 gene cause Crouzon syndrome”. Nat. Genet. 8 (1): 98–103. doi : 10.1038/ng0994-98 . PMID7987400 .
4. ^ Meyers GA, Orlow SJ, Munro IR, Przylepa KA, Jabs EW (December 1995). “Fibroblast growth factor receptor 3 (FGFR3) transmembrane mutation in Crouzon syndrome with acanthosis nigricans”. Nat. Genet. 11 (4): 462–4. doi : 10.1038/ng1295-462 . PMID7493034 .
5. ^ James, William; Berger, Timothy; Elston, Dirk (2005). Andrews’ Diseases of the Skin: Clinical Dermatology . (10th ed.). Saunders. ISBN 0-7216-2921-0 .
6. ^ Vajo Z, Francomano CA, Wilkin DJ. (February 2000). “The molecular and genetic basis of fibroblast growth factor receptor 3 disorders: the achondroplasia family of skeletal dysplasias, Muenke craniosynostosis, and Crouzon syndrome with acanthosis nigricans”. Endocrine Reviews21 (1): 23–39. doi : 10.1210/er.21.1.23 . PMID 10696568 .
7.
8. ^ Robin, NH; Falk, MJ; Haldeman-Englert, CR; Pagon, RA; Adam, MP; Ardinger, HH; Bird, TD; Dolan, CR; Fong, CT; Smith, RJH; Stephens, K (1993). ” FGFR -Related Craniosynostosis Syndromes”. PMID20301628 .
|
|
Wikimedia Commons has media related to Crouzon syndrome . |
· Crouzon syndrome on Genetics Home Reference from US National Library of Medicine & National Institutes of Health
· GeneReviews/NIH/NCBI/UW entry on FGFR-Related Craniosynostosis Syndromes
· Crouzon Syndrome – About.com
· Crouzon Syndrome – Seattle Children’s Hospital Craniofacial Center
· cleftAdvocate – Non-profit support organization for all craniofacial conditions; on-line and in-person family support, insurance and advocacy assistance, and more.
· General Information at hopkinsmedicine.org
Sindrome di Apert
Da Wikipedia, l’enciclopedia libera

Figure 1 of Hohoff A, Joos U, Meyer U, Ehmer U, Stamm T. The spectrum of Apert syndrome: phenotype, particularities in orthodontic treatment, and characteristics of orthognathic surgery. Head Face Med. 2007 Feb 8;3:10. PMID 17286873
· La Sindrome di Apert è una forma di acrocefalosindattilia , una malattia congenita caratterizzata da malformazioni del cranio, del viso, mani e piedi. E ‘classificato come una sindrome arco branchiale, che colpisce il primo arco branchiale (o faringeo) , il precursore del mascellare emandibolare . Disturbi nello sviluppo degli archi branchiali nello sviluppo fetale creano effetti duraturi e diffusi.
· Nel 1906, Eugène Apert , un medico francese, descrisse nove persone che condividono gli attributi e caratteristiche simili. [1] Linguisticamente, “acro” in greco significa “picco”, riferendosi al “picco” testa che è comune nella sindrome. “Cephalo”, anche dal greco, è una forma che unisce che significa “testa”. ” Sindattilia “si riferisce alla tessitura delle dita delle mani e dei piedi.
· In embriologia , le mani ei piedi hanno cellule selettive che muoiono, chiamato morte cellulare selettiva o apoptosi , provocando la separazione delle cifre. Nel caso di acrocefalosindattilia, morte cellulare selettiva non si verifica e la pelle, e raramente ossa, tra le dita e dei piedi fusibili.
Le ossa del cranio sono colpiti pure, simile alla sindrome di Crouzon e sindrome di Pfeiffer . Craniosinostosi si verifica quando il cranio del feto e il fusibile ossa facciali troppo presto in utero , interrompendo la crescita ossea normale. Fusione di diversi punti di sutura porta a differenti modelli di crescita sul cranio. Gli esempi includono: trigonocefalia (fusione della sutura metopica ), brachicefalia (fusione della sutura coronale e sutura lambdoidea bilateralmente), dolicocefalia (fusione della sutura sagittale ), plagiocefalia (fusione di coronali e suture lambdoidea unilateralmente), e oxycephaly o turricefalia ( fusione di suture coronali e lambdoid).
I risultati per l’incidenza della sindrome nella popolazione hanno variato, [2] con le stime a partire da 1 nascita di 200.000 previsto [3] e 160.000 dato come media da studi precedenti. [4][5] Uno studio condotto nel 1997 , tuttavia, dal Programma difetti di nascita Monitoraggio California, ha trovato un tasso di incidenza di 1 su 80.645 di quasi 2,5 milioni di nati vivi. [6] Un altro studio condotto nel 2002 dalla Craniofacial Center, North Texas Hospital for Children, ha trovato una maggiore incidenza di circa 1 su 65.000 nati vivi. [2]
- Segni e sintomi
- Craniosinostosi
- Sindattilia
- Altri segni
- Cause
- Trattamenti
- Craniosinostosi
- Sindattilia
- importanza Dental
- Vedi anche
- Riferimenti
- Collegamenti esterni
Segni e sintomi
Craniosinostosi
Le malformazioni del cranio sono gli effetti più evidenti di acrocefalosindattilia. Craniosinostosi si verifica, in cui le suture craniche chiudere troppo presto, anche se il cervello del bambino è ancora in crescita e in espansione. Brachicefalia è il modello comune di sviluppo, dove le suture coronali vicino prematuramente, impedendo la cranio dall’espansione frontward o indietro, e causando il cervello per espandere il cranio ai lati e verso l’alto. Ciò si traduce in un’altra caratteristica comune, un, fronte prominente alto con la schiena piatta del cranio. A causa della chiusura prematura delle suture coronali, aumento della pressione cranica può svilupparsi, portando a deficienza mentale. Una faccia piana o concava può svilupparsi come conseguenza della crescita carente nelle ossa facciali metà, portando ad un prognatismo conditir. Altre caratteristiche di acrocefalosindattilia possono includere orbite ossee superficiali e gli occhi ampiamente distanziati. Orecchie basse-set sono anche una caratteristica tipica di sindromi arco branchiale.
Sindattilia
Tutti Acrocefalosindattilia sindromi mostrano un certo livello di anomalie degli arti, in modo che possa essere difficile distinguerli. Tuttavia, le deformità tipiche della mano in pazienti con Sindrome di Apert distinguono dalle altre sindromi. [7] Le mani nei pazienti con sindrome di Apert mostrano sempre quattro caratteristiche comuni: [8]
1. una breve pollice con deviazione radiale
2. complesso sindattilia del dito indice, lungo e anello
4. semplice sindattilia del quarto spazio web
La deformazione dello spazio tra il dito indice e il pollice può essere variabile. Sulla base di questo primo spazio web, possiamo distinguere tre diversi tipi di handdeformation:
· Tipo I: Chiamato anche una “mano vanga”. Il tipo più comune e meno grave di deformazione. Il pollice mostra deviazione radiale e clinodattilia , ma è separato dal dito indice. L’indice, lungo e anulare si fondono insieme delle articolazioni distali e formano un palmo. Durante la fase embrionale, la fusione non ha alcun effetto sulla crescita longitudinale queste dita, in modo da avere una lunghezza normale. Nel quarto spazio web, vediamo sempre un semplice sindattilia, sia completa o incompleta.
· Tipo II: Chiamato anche un “cucchiaio” o mano “guanto”. Questa è un’anomalia più grave in quanto il pollice è fuso al dito indice per semplice sindattilia completa o incompleta. Solo la falange distale del pollice non è unito nell’unione ossea con il dito indice ed ha un chiodo separata. Poiché la fusione delle cifre è a livello delle articolazioni distali, una palma concava si forma. La maggior parte del tempo, vediamo completa sindattilia del quarto spazio web.
· Tipo III: Chiamata anche la “zoccolo” o mano “rosebud”. Questa è la forma più rara ma anche più grave di deformità mano nella sindrome di Apert. Vi è una solida fusione ossea o cartilaginea di tutte le cifre con una lunga, chiodo congiunti. Il pollice è rivolta verso l’interno ed è spesso impossibile dire le dita a parte. Solitamente corretta immagine della mano è molto difficile, a causa di sovrapposizione di ossa, ma l’esame fisico da solo non è sufficiente per misurare la gravità della deformazione
|
Tipo I (“vanga”) |
Tipo II (“guanto”) |
Tipo III (“bocciolo di rosa”) |
|
|
Prima spazio web |
Semplice Sindattilia |
Semplice Sindattilia |
Sindattilia complesso |
|
Middle tre dita |
Fusione da lato a lato con palmo |
Fusione di fingertops formare una palma concava |
Fusione Stretto di tutte le cifre con un chiodo congiunti |
|
Quarto spazio web |
Semplice e incompleta sindattilia |
Semplice e completa sindattilia |
Semplice e completa sindattilia |
Altri segni
Onfalocele è stata descritta in due pazienti con Apert sindrome da Herman TE et al. (USA, 2010) e da Ercoli G. et al.(Argentina, 2014). Un onfalocele è un difetto di nascita in cui un intestino o altri organi addominali sono al di fuori del corpo di un bambino a causa di un foro nella zona ombelico. Tuttavia, l’associazione tra la sindrome di Apert onfalocele e non è ancora confermato, così ulteriori studi sono necessari. [9][10]
Altri sintomi della sindrome di Apert derivano anche dalla crescita del cranio anormale:
Scarso sviluppo intellettuale (in alcuni bambini con la sindrome di Apert)
Apnea ostruttiva del sonno
RipetutE infezioni orecchio o dei seni paranasali
La perdita dell’udito Ipoacusia trasmissiva spesso da otite media nel 50% dei casi
Cause
Acrocefalosindattilia può essere un autosomica dominante disturbo. Maschi e femmine sono colpiti allo stesso modo;tuttavia la ricerca è ancora determinare una causa precisa. Tuttavia, quasi tutti i casi sono sporadici, a significare le mutazioni freschi o insulto ambientale al genoma . La prole di un genitore con la sindrome di Apert ha una probabilità del 50% di ereditare la malattia. Nel 1995, AOM Wilkie ha pubblicato una che mostra la prova di carta che acrocefalosindattilia è causata da un difetto del recettore del fattore di crescita dei fibroblasti 2gene , sul cromosoma 10 . [11]
Sindrome di Apert è una malattia autosomica dominante; circa due terzi dei casi sono dovuti ad un C a G mutazione alla posizione 755 nel FGFR2 . gene, che provoca un cambiamento di Ser Trp nella proteina [12] Questa è una mutazione hotspot maschio-specifica: in uno studio di 57 casi, la mutazione sempre avvenuto sulla allele paternamente derivato. [13] Sulla base della nascita prevalenza osservata della malattia (1 a 70.000), il tasso apparente di C a mutazioni G in questo sito è di circa 0,00,005 mila, che è 200- a 800 volte superiore al tasso usuale per le mutazioni a dinucleotidi CG. Inoltre, l’incidenza aumenta rapidamente con l’età del padre. Goriely et al. (2003) analizzarono la distribuzione allelica di mutazioni in campioni di sperma dagli uomini di diverse età e ha concluso che la spiegazione più semplice per i dati è che il C a G mutazione dà al cellulare un vantaggio nella linea germinale maschile. [12]
Non è ancora molto chiaro il motivo per cui le persone con sindrome di Apert hanno sia craniosinostosi e sindattilia. C’è stato uno studio che suggerisce che ha qualcosa a che fare con l’espressione di tre isoforme di FGFR2, il gene con le mutazioni puntiformi che causano la sindrome nel 98% dei pazienti. [14] KGFR, recettore del fattore di crescita dei cheratinociti, è un isoforma attivo nei metafisi articolazioni e interfalangee. FGFR1 è una isoforma attivo nella diafisi .FGFR2-Bek è attivo nella metafisi, nonché la diafisi, ma anche nella interdigitale mesenchima . La mutazione puntiforme aumenta l’attivazione ligando-dipendente di FGFR2, e quindi delle sue isoforme. Ciò significa che FGFR2 perde la sua specificità, causando vincolante FGFs che normalmente non si legano al recettore. [15] Da FGF sopprimel’apoptosi , il mesenchima interdigitale viene mantenuta. FGF aumenta anche la replicazione e la differenziazione diosteoblasti , pertanto fusione tempestiva di diversi suture del cranio. Questo potrebbe spiegare perché sia i sintomi sono sempre trovato nella sindrome di Apert.
Trattamenti
Craniosinostosi
La chirurgia è necessaria per impedire la chiusura delle suture coronali di danneggiare lo sviluppo del cervello. In particolare, interventi chirurgici per la LeFort III o monoblocco midface distrazione osteogenesi che stacca il midface o l’intera faccia superiore, rispettivamente, dal resto del cranio, vengono eseguite per riposizionarli nel piano corretto. Questi interventi sono eseguiti da entrambi (OMS) orale e maxillofacciale chirurghi di plastica e, spesso in collaborazione.
In generale, chirurgia per Apert sindrome avviene in tre fasi:
- Lo svincolo della fusione delle ossa del cranio (rilascio craniosinostosi). Un chirurgo separa le ossa del cranio anormalmente fuse e parzialmente riordina alcuni di loro. Questo intervento è di solito eseguita quando un bambino è di età compresa tra 6 e 8 mesi.
2. Avanzamento della porzione media della faccia . Come il bambino con la sindrome di Apert cresce, le ossa facciali di nuovo diventano disallineati. Un chirurgo taglia le ossa della mascella e le guance e li porta in avanti in una posizione più normale. Questo intervento può essere effettuato in qualsiasi momento tra i 4 ei 12. Altre chirurgia correttiva può essere necessaria, soprattutto quando l’ avanzamento della porzione media della faccia avviene in giovane età.
- Correzione di larghi-set occhi (correzione ipertelorismo). Un chirurgo rimuove un cuneo di osso nel cranio tra gli occhi . Il chirurgo fa le orbite più vicini, e può regolare anche la mascella,.
Altri trattamenti sindrome di Apert sono:
Collirio durante il giorno, con lubrificazione pomata occhio durante la notte; queste gocce possono impedire l’occhio essiccazione pericolosa che può verificarsi nella sindrome di Apert.
Pressione continua positiva delle vie aeree ( CPAP ); un bambino con la sindrome di Apert e apnea ostruttiva del sonno può indossare una maschera di notte, collegato a una piccola macchina. La macchina eroga pressione che mantiene le vie aeree del bambino aperto durante il sonno .
Antibiotici . I bambini con sindrome di Apert sono inclini a orecchio e del seno infezioni causate da batteri, che richiedono una terapia antibiotica.
Chirurgica tracheostomia , o il posizionamento di un tubo di respirazione nel collo; questo intervento può essere fatto per i bambini con grave apnea ostruttiva del sonno a causa di sindrome di Apert.
Posizionamento chirurgico di tubi per le orecchie (miringotomia), per i bambini con ripetute infezioni dell’orecchio a causa di sindrome di Apert
Sindattilia
Non esiste un trattamento standard per le malformazioni mano in Apert a causa delle differenze e la gravità in manifestazioni cliniche nei diversi pazienti. Ogni paziente deve quindi essere affrontata e trattata singolarmente, allo scopo di un adeguato equilibrio tra funzionalità ed estetica mano. Tuttavia, alcune linee guida possono essere forniti a seconda della gravità delle deformazioni. In generale è consigliabile rilasciare inizialmente primo e quarto spazi interdigitali, liberando così i raggi di confine. [16] Questo rende possibile per il bambino afferrare cose a mano, una funzione molto importante per lo sviluppo del bambino. Successivamente il secondo e terzo spazi interdigitali devono essere rilasciati. Perché ci sono tre handtypes in Apert, tutti con le loro deformità, hanno tutti bisogno di un approccio diverso per quanto riguarda il loro trattamento:
· Tipo I mano di solito ha bisogno solo la interdigitale rilascio spazio web. Prima versione web è raramente necessaria, ma spesso il suo approfondimento è necessario. Sarà necessaria pollice correzione clynodactyly.
· Nel II mani di tipo si consiglia di rilasciare i primi e quinto raggio in principio, poi la seconda e la terza spazi web interdigitali devono essere liberati. Il clynodactyly del pollice deve essere corretto pure. L’allungamento della falange pollice può essere necessaria, aumentando così il primo spazio web. In entrambi di tipo I e di tipo II, la sindattilia ricorrente del secondo spazio web si verifica a causa di un pseudoepiphysis alla base del metacarpo dell’indice.Questo dovrebbe essere corretto con successive revisioni.
· Mani di tipo III sono le più difficili da trattare a causa della loro complessità. Prima di tutto, si consiglia di rilasciare la prima e la quarta spazio web, convertendo così di tipo I mano. Il trattamento delle macerazioni e infezioni chiodo letto dovrebbe anche essere fatto all’inizio. Per aumentare del primo spazio web, allungamento del pollice può essere fatto. Si suggerisce che in casi gravi dovrebbe essere considerata una amputazione del dito indice. Tuttavia, prima di prendere questa decisione, è importante valutare il miglioramento potenziale da raggiungere contro i possibili problemi psicologici del bambino in seguito causa l’estetica della mano. Successivamente, il secondo e / o terzo spazio interdigitale dovrebbe essere rilasciato.
Con crescente di un bambino e, rispettivamente, le mani, le revisioni secondarie sono necessari per trattare le contratture e per migliorare l’estetica.
Apert Sindrome Prognosi
I bambini con sindrome di Apert di solito richiedono un intervento chirurgico per il rilascio delle ossa del cranio per consentire una possibilità per il cervello a svilupparsi normalmente. Il più vecchio un bambino è prima di effettuare questo intervento, minore è la possibilità di raggiungere normale capacità intellettuale. Anche con la chirurgia precoce, alcune cerebrali strutture possono rimanere poco sviluppato, però.
In generale, i bambini che vengono allevati dai genitori hanno una migliore possibilità di raggiungere normale capacità intellettuale. Circa quattro su 10 bambini affetti da sindrome di Apert che vengono allevati in un ambiente familiare sano raggiungono un normale quoziente di intelligenza (QI). Tra sindrome di Apert bambini che sono istituzionalizzati, solo uno su 18 raggiunge un QI normale. In uno studio, tre dei 136 bambini con sindrome di Apert infine frequentato l’università.
I bambini con sindrome di Apert e altre condizioni simili che hanno QI normali non sembrano avere un aumento del rischio di problemi comportamentali o emotivi. Tuttavia, essi possono richiedere un ulteriore sostegno sociale ed emotivo per far fronte con la loro condizione. I bambini con sindrome di Apert con QI più bassi si hanno spesso problemi comportamentali ed emotivi.
Non ci può essere un’ampia variabilità tra i bambini con la sindrome di Apert, con un po ‘gravemente colpite, e altri solo lievemente colpiti. Gli esperti sono sicuri perché la stessa mutazione genica può comportare tale variazione in un bambino la sindrome di Apert prognosi.
L’aspettativa di vita varia anche tra i bambini con sindrome di Apert. Quelli con la sindrome di Apert che sopravvivono passato l’infanzia e non hanno problemi di cuore probabilmente hanno una aspettativa di vita normale o quasi normale. L’aspettativa di vita è probabilmente migliorando grazie ai progressi delle tecniche chirurgiche e le cure di follow-up.
Significato Dentale
Caratteristiche rilevanti comuni di acrocefalosindattilia sono un palato ogivale, prognatismo pseudomandibular (che appare come prognatismo mandibolare ), un palato stretto, e l’affollamento dei denti.
Vedi anche
· La perdita dell’udito con sindromi cranio-facciali
Riferimenti
1. Saltate^ synd / 194 a che la chiamò?
2. ^ Salta a:un b Fearon, Jeffrey A. (luglio 2003). “Il trattamento delle mani e piedi in Sindrome di Apert: un’evoluzione nel Management”. chirurgia plastica e ricostruttiva (Dallas, Texas) 112 (1):. 1-12 doi : 10,1097 / 01.PRS.0000065908.60382.17 . ISSN 0032- 1052 .PMID 12.832.871 .
3. Saltate^ Foreman, Phil (2009). Formazione di studenti con una disabilità intellettiva: Research and Practice (PB) . IAP.p. 30. ISBN 978-1-60752-214-0 .
4. Saltate^ Carter, Charles H. (1965). Aspetti medici di ritardo mentale . Tommaso. p. 358. OCLC 174.056.103 .
5. Saltate^ Abe Bert Baker; Lowell H. Baker (1979). “Sindrome di Apert” . Neurologia clinica (Medical Dept., Harper & Row) 3 : 47. OCLC 11.620.265 .
6. Saltate^ Aitken, J. Kenneth (2010). Un AZ di fattori genetici in Autismo: un manuale per i professionisti . Jessica Kingsley. p. 133. ISBN 978-1-84310-976-1 .
7. Saltate^ Kaplan, LC (aprile 1991). “Valutazione clinica e gestione multispecialty di sindrome di Apert”. Cliniche in chirurgia plastica 18 (2):. 217-25 ISSN 0.094-1.298 . PMID2.065.483 .
8. Saltate^ Upton, J (aprile 1991). “Sindrome di Apert classificazione e l’anatomia patologica di anomalie degli arti.”. Cliniche in chirurgia plastica 18 (2):. 321-55 ISSN0.094-1.298 . PMID 2.065.493 .
9. Saltate^ Herman, TE; Siegel, MJ (ottobre 2010). “Sindrome di Apert con onfalocele”. J Perinatol. 30 (10): 695-697. doi :10.1038 / jp.2010.72 . PMID 20.877.364 .
10. Saltate^ Ercoli, G; Bidondo, MP; Senra, BC; Groisman, B (settembre 2014). “Sindrome di Apert con onfalocele: un caso”. Birth Defects Res Clin Mol Un Teratol. 100 (9):. 726-729 doi : 10.1002 / bdra.23270 . PMID25.045.033 .
11. Saltate^ Wilkie, AO; SF Slaney; M Oldridge; MD Poole; GJ Ashworth; AD Hockley; RD Hayward; DJ David; LJ Pulleyn; P Rutland (febbraio 1995). “sindrome di Apert risultati da mutazioni localizzate di FGFR2 ed è allelica alla sindrome di Crouzon”. Nature Genetics 9 (2):. 165-72doi : 10.1038 / ng0295-165 . PMID 7.719.344 .
12. ^ Salta a:un b Goriely, A .; McVean, GA; Röjmyr, M; Ingemarsson, B; Wilkie, AO (2003). “La prova per Advantage selettiva di patogeno FGFR2 mutazioni nel maschile Germ Line”.Science 301 (5633):. 643-6 doi : 10.1126 / science.1085710 . PMID 12.893.942 .
13. Saltate^ Moloney, DM; Slaney, SF; Oldridge, M; Muro, SA;Sahlin, P; Stenman, G; Wilkie, AO (1996). “Exclusive paterna origine di nuove mutazioni nella sindrome di Apert.” Nature Genetics 13 (1):. 48-53 doi : 10.1038 / ng0596-48 . PMID 8.673.103 .
14. Saltate^ Britto, JA; JCT Chan; RD Evans; RD Hayward; BM Jones (maggio 2001). “Espressione differenziale dei recettori del fattore di crescita dei fibroblasti in sviluppo digitale umana suggerisce patogenesi comune in acrosyndactyly complesso e craniosynostosis”. La chirurgia plastica e ricostruttiva 107 (6):. 1331-1338 doi : 10,1097 / 00006534-200105000-00001 . PMID 11.335.797 .
15. Saltate^ Hajihosseini MK, Duarte R, Pegrum J, Donjacour A, Lana-Elola E, Riso DP, Sharpe J, Dickson C (febbraio 2009). “La prova che FGF10 contribuisce alle difetti scheletrici e viscerali di un modello di sindrome di Apert del mouse.” Dev. Dyn. 238 (2): 376-85. doi : 10.1002 / dvdy.21648 . PMID 18.773.495 .
16. Saltate^ Zucker, RM (aprile 1991). “Correzione Sindattilia della mano nella sindrome di Apert”. Cliniche in chirurgia plastica 18 (2):. 357-64 ISSN 0094-1298 . PMID1.648.464 .
Collegamenti esterni [ modifica ]
· Informazioni da pagina di Teeter a www.apert.org
· Informazioni Sindrome di Apert da Ospedale craniofacciale Centro dei bambini di Seattle
· cleftAdvocate – organizzazione di supporto senza scopo di lucro per tutte le condizioni cranio-facciali; on-line e il sostegno della famiglia di persona, assicurazione e assistenza di advocacy, e altro ancora.
· Ingresso GeneReviews / NIH / NCBI / UW su FGFR-Related Craniosinostosi Sindromi
· Il Craniofacial Associazione Nazionale
Sindrome di Pfeiffer (TIPO I-III)

La sindrome di Pfeiffer e una condizione autosomica dominante caratterizzata da craniosinostosi coronale, ipoplasia della porzione mediale del volto, pollici larghi e deviati medialmente e dita dei piedi grandi (Robin-NH et al. Favorable prognosis for children with Pfeiffer syndrome types 2 and 3: implications for classification. Am-J-Med-Genet. 1998 Jan 23; 75(3): 240-4).
Rappresenta un’entità clinica variabile, divisa in tre gruppi secondo il fenotipo.
Segni e Sintomi
La sindrome di Pfeiffer è caratterizzata dall’associazione tra craniosinostosi(soprattutto delle suture coronali e a volte di quelle sagittali), ipertelorismo, ponte nasale depresso anche atresia delle coane e facies piana, pollici larghi e deviati, alluci grandi e parziale sindattilia delle mani e dei piedi. Ipoacusia trasmissiva o mista in più del 50% dei casi per stenosi/atresia del condotto uditivo esterno o malformazione della catena ossiculare. Più rare le malformazioni dell’orecchio interno. Occasionalmente si possono osservare idrocefalo, con proptosi oculare grave, anchilosi dei gomiti, difetti viscerali e ritardo dello sviluppo. In rapporto alla gravità del fenotipo, la sindrome viene suddivisa in tre sottotipi. La sindrome di Pfeiffer classica, tipo 1, riguarda i pazienti che presentano segni sfumati, compresa la brachicefalia, l’ipoplasia della parte media del viso e le anomalie delle dita delle mani e dei piedi. Questi pazienti hanno intelligenza normale e di solito hanno una buona prognosi.. Il tipo II, la forma più severa, e associato alla presenza di cranio a trifoglio, proptosi oculare severa, ipoplasia della porzione mediale del volto, pollici grandi deviati molto radialmente, dita grandi, e a volte ventricolomegalia. Il tipo III, la forma intermedia di malattia, e simile al tipo II ma non presenta il cranio a trifoglio (Benacerraf-BR et al. Using three-dimensional ultrasound to detect craniosynostosis in a fetus with Pfeiffer syndrome. Ultrasound in Obstetrics and Ginecology. Sep 2000; 16 (4) : 391-394).
La prognosi per i bambini affetti dalla sindrome di Pfeiffer di tipo II e severa, molti muoiono dopo la nascita a causa di problemi polmonari e cerebrali. Gli affetti dalla sindrome di tipo III tendono ad avere un ritardo mentale live-moderato ed handicap fisici, ma hanno una prognosi un po’ migliore dagli affetti del tipo II (Benacerraf-BR et al. Using three-dimensional ultrasound to detect craniosynostosis in a fetus with Pfeiffer syndrome. Ultrasound in Obstetrics and Ginecology. Sep 2000; 16 (4) : 391-394).
Il tipo I comprende i casi meno severi, mentre i tipi II e III i casi più gravi. I tipi II e III tendono ad avere un rischio maggiore di problemi di sviluppo neurologico e di spettanza di vita ridotta. (‘) Una gestione chirurgica e medica aggressiva può portare a risultati favorevoli in alcuni casi (Robin-NH et al. Favorable prognosis for children with Pfeiffer syndrome types 2 and 3: implications for classification. Am-J-Med-Genet. 1998 Jan 23; 75(3): 240-4).
La frequenza della sindrome di Pfeiffer e stata stimata in 1 ogni 200.000. La trasmissione e autosomica dominante, con penetranza completa ed espressione variabile. (‘) E’ eterogenea: sono state descritte due localizzazioni, sul cromosoma 8p11 e 10q26. Sono stati riportati una singola mutazione ricorrente del recettore 1 del fattore di crescita dei fibroblasti (FGFR1) e molte altre mutazioni coinvolgenti il recettore 2 (FGFR2) (D. Renier et al. Management of craniosynostoses. Child’s nerv Syst (2000) 16:645-658).
La presenza di asimmetrie nella struttura cranica sono spesso indicative di una craniostenosi. Talvolta la diagnosi può essere resa più difficoltosa a causa di tre diverse craniostenosi, ovvero quella della sutura sagittale, quella della sutura coronale e quella della sutura metopica. È importante per il pediatra essere a conoscenza di eventuali alterazioni craniche o sindromiche nella storia della famiglia del bambino e verificare che il bimbo non presenti malformazioni anche ad altri apparati od organi. Qualora si sospetti fortemente una craniostenosi è necessario eseguire una TAC associata ad un esame radiologico del cranio. Nei casi in cui siano riscontrati un posizionamento anomalo del capo ed una sindattilia delle dita di mani e piedi è necessario optare per una diagnosi differenziale.[il cigno]Durante il periodo prenatale, attraverso l’ecografia morfologica e possibile far diagnosi o avere il sospetto di sindrome di Pfeiffer. Il sospetto clinico può poi essere confermato dall’analisi molecolare: attraverso il sequenziamento del DNA e possibile identificare mutazioni specifiche della sindrome.
Diagnosi Prenatale e Prevenzione
La diagnosi prenatale di sindrome di Pfeiffer viene fatta occasionalmente attraverso l’ecografia, basandosi sulla forma anomala del cranio. Le anomalie delle forma della testa suggeriscono la presenza di craniosinostosi, anche se le linee di sutura sono viste difficilmente dall’ecografia standard a due dimensioni. Studi precedenti hanno dimostrato che le suture aperte possono essere viste molto più chiaramente usando l’ecografia tridimensionale piuttosto che bidimensionale (Benacerraf-BR et al. Using three-dimensional ultrasound to detect craniosynostosis in a fetus with Pfeiffer syndrome. Ultrasound in Obstetrics and Ginecology. Sep 2000; 16 (4) : 391-394).
Bibliografia
Associazione onlus “Il Cigno” – La diagnosi, 12-06-2010.
Benacerraf-BR; Spiro-R; Mitchell-AG Using three-dimensional ultrasound to detect craniosynostosis in a fetus with Pfeiffer syndrome;ULTRASOUND-IN-OBSTETRICS-AND-GYNECOLOGY. SEP 2000; 16 (4) : 391-394
Kress-W; Collmann-H; Busse-M; Halliger-Keller-B; Mueller-CR
Clustering of FGFR2 gene mutations in patients with Pfeiffer and Crouzon syndromes (FGFR2-associated craniosynostoses);CYTOGENETICS-AND-CELL-GENETICS. 2000; 91 (1-4) : 134-137
Katzen-JT; McCarthy-JG Syndromes involving craniosynostosis and midface hypoplasia.OTOLARYNGOLOGIC-CLINICS-OF-NORTH-AMERICA. DEC 2000; 33 (6) : 1257-1284,VI
Renier-D; Lajeunie-E; Arnaud-E; Marchac-D.Management of craniosynostoses
CHILDS-NERVOUS-SYSTEM. NOV 2000; 16 (10-11) : 645-658
Meling-TR; Tveten-S; Due-Tonnessen-BJ; Skjelbred-P; Helseth-E Monobloc and midface distraction osteogenesis in pediatric patients with severe syndromal craniosynostoses.PEDIATRIC-NEUROSURGERY. AUG 2000; 33 (2) : 89-94
Robson-CD; Mulliken-JB; Robertson-RL; Proctor-MR; Steinberger-D; Barnes-PD; McFarren-A; Muller-U; Zurakowski-Prominent basal emissary foramina in syndromic craniosynostosis: Correlation with phenotypic and molecular diagnoses.D.AMERICAN-JOURNAL-OF-NEURORADIOLOGY. OCT 2000; 21 (9) : 1707-1717
Johnson-D; Wilkie-AOM.Pfeiffer syndrome is not caused by haplo insufficient mutations of FGFR2.JOURNAL-OF-CRANIOFACIAL-GENETICS-AND-DEVELOPMENTAL-BIOLOGY. APR-JUN 2000; 20 (2) : 109-111
Tsukuno-M; Suzuki-H; Eno-Y.Reply to the critique: Pfeiffer syndrome is most likely caused by haploinsufficient mutation of FGFR2 in our cases.JOURNAL-OF-CRANIOFACIAL-GENETICS-AND-DEVELOPMENTAL-BIOLOGY. APR-JUN 2000; 20 (2) : 112
Johnson-D; Wall-SA; Mann-S; Wilkie-AOM.A novel mutation, Ala315Ser, in FGFR2: a gene-environment interaction leading to craniosynostosis? EUROPEAN-JOURNAL-OF-HUMAN-GENETICS. AUG 2000; 8 (8) : 571-577
Zhou-YX; Xu-XL; Chen-L; Li-CL; Brodie-SG; Deng-CX.A Pro250Arg substitution in mouse Fgfr1 causes increased expression of Cbfa1 and premature fusion of calvarial sutures.HUMAN-MOLECULAR-GENETICS. AUG 12 2000; 9 (13) : 2001-2008
Priolo-M; Lerone-M; Baffico-M; Baldi-M; Ravazzolo-R; Cama-A; Capra-V; Silengo-M
Pfeiffer syndrome type 2 associated with a single amino acid deletion in the FGFR2 gene.CLINICAL-GENETICS. JUL 2000; 58 (1) : 81-83
Glaser-RL; Jiang-W; Boyadjiev-SA; Tran-AK; Zachary-AA; Van-Maldergem-L; Paternal origin of FGFR2 mutations in sporadic cases of Crouzon syndrome and Pfeiffer syndrome
Johnson-M; Walsh-S; Oldridge-M; Wall-SA; Wilkie-AOM; Jabs-EW. Clinical findings in a patient with FGFR1 P252R mutation and comparison with the literature. AMERICAN-JOURNAL-OF-HUMAN-GENETICS. MAR 2000; 66 (3) : 768-777
Roscioli-T; Flanagan-S; Kumar-P; Masel-J; Gattas-M; Hyland-VJ; Glass-IA
Am-J-Med-Genet. 2000 Jul 3; 93(1): 22-8
Sindrome Saethre-Chotzen
Da Wikipedia, l’enciclopedia libera
|
Sindrome Saethre-Chotzen |
|
|
Risorse di classificazione ed esterne |
|
Sindrome Saethre-Chotzen (SCS), noto anche come Acrocefalosindattilia tipo III è una rara malattia congenita associata a craniosinostosi (chiusura prematura di uno o più dei punti di sutura tra le ossa del cranio ). Questo influisce sulla forma della testa e del viso, causando una testa a forma di cono ed una faccia asimmetrica. Gli individui con SCS hanno anche palpebre cadenti ( ptosi ), occhi distanziati ( ipertelorismo ) e difetti di nascita minori delle mani e dei piedi ( sindattilia ). [1] Inoltre, gli individui con i casi più gravi di SCS possono avere da lieve a moderata mentale ritardo o di apprendimento disabilità. A seconda del livello di gravità, alcuni individui con SCS possono richiedere una qualche forma di intervento medico o chirurgico. [2] La maggior parte delle persone con SCS vivere una vita abbastanza normale, indipendentemente dal fatto che è necessario un trattamento medico o no. [1]
- Cause
- Craniosinostosi
- Genetica
- Segni e sintomi
- Difetti cranici
- Difetti di mani e dei piedi
- difetti oculari
- orecchio, naso e difetti Bocca
- Difetti Meno comuni
- Diagnosi
- Diagnosi Prenatale
- Diagnosi clinica
- Molecolare / Diagnosi Genetica
- Diagnosi differenziale (condizioni comunemente scambiato)
- Trattamento e gestione
- Epidemiologia
- Storia
- Vedi anche
- Riferimenti
- Collegamenti esterni
§Cause
§Craniosinostosi
Suture craniche visti dalla parte superiore della testa
Il cranio è composto da tre sezioni principali, tra la base del cranio ( occipitale ), la faccia (osso frontale ), e la parte superiore ( ossa parietali ) e lati ( osso temporale ) della testa. La maggior parte delle ossa del cranio sono impostati in modo permanente in posizione prima della nascita. Tuttavia, le ossa temporali e parietali sono separate da suture , che restano aperti, permettendo la testa di cambiare un po ‘in forma durante il parto. Le suture craniche eventualmente chiudere entro il primo paio di anni dopo la nascita, dopo che il cervello ha terminato in crescita. [1]
In individui con SCS, la sutura coronale che separa le ossa frontali dalle ossa parietali, chiude prematuramente ( craniosinostosi ), a volte anche prima della nascita. Se la sutura coronale chiude asimmetricamente o unilaterale, allora il viso e la fronte formeranno irregolarmente, da lato a lato. Le persone con SCS hanno appuntito, testa torre simile perché il loro cervello sta crescendo più velocemente di loro cranio, con conseguente aumento della pressione intracranica (ICP) e causando la parte superiore della testa e / o sulla fronte a gonfiarsi fuori per consentire la crescita del cervello. Il viso appare irregolare, in particolare nei settori degli occhi e le guance e la fronte appare di larghezza e altezza. [1]
A causa della fronte anomala, c’è meno spazio per le normali caratteristiche facciali di sviluppare. Ciò si traduce in orbite basse e zigomi piatti. Le orbite basse rendono gli occhi più prominenti o sporgenti e causare gli occhi per essere più separato del normale (ipertelorismo ). Le prese sottosviluppati occhi, zigomi e mascella inferiore causano la faccia apparire piatta. Inoltre, la minore inclinazione verso il basso delle occhi con le palpebre cadenti ( ptosi ) aggiunge alle irregolarità complessiva del viso. [1]
§Genetics
SCS verifica quando vi è una mutazione sul cromosoma 7 nella regione 7p21
SCS è tipicamente ereditata come autosomica dominante tratto. Tuttavia, a volte, i bambini con unmicrodeletion di 7p21 (cromosoma contenente il locus responsabile SCS) sviluppare nuove anomalie e in genere mostrano significative anomalie neurologiche. Un aumento dell’età dei genitori può avere un ruolo nello sviluppo di nuove mutazioni e anomalie. [2]
Le analisi di linkage e riarrangiamento cromosomico rivelato la causa della SCS di essere mutazioni nel TWISTgene (torsione fattore di trascrizione genica) che si trova sul cromosoma 7p21. Il gene codifica per una TWISTelica-ansa-elica di base (b-HLH) fattore di trascrizione che controlla la testa mesenchima sviluppo come le forme del tubo craniche. Più di 35 diverse mutazioni TWIST coinvolgono il dominio b-HLH della proteina sono stati identificati nelle persone con SCS. Le mutazioni sono missense , nonsense , e frameshiftdelezione /inserzione mutazioni che o riducono o interrompono il dominio b-HLH. La maggior parte delle persone con SCS hanno un unico grande delezione nella regione 7p21, che contiene la regione che codifica per il gene TWIST. [3]
Nella ricerca per il gene responsabile della SCS, gli scienziati del Centro John sHopkins bambini hanno iniziato a studiare il gene TWIST perché i suoi effetti sui topi. Il gene TWIST nei topi, funzioni nello sviluppo del muscolo scheletrico e del viso, testa, mani e piedi. I topi che mancavano entrambe le copie del gene TWIST sono stati spontaneamente abortito prima della nascita, e aveva gravi malformazioni degli arti e della testa, tra cui difetti e fallimento della anormali tubo neurale alla stretta correttamente. Tuttavia, i topi con una sola copia del gene TWIST non-lavoro sopravvissero. Un ulteriore esame ha rivelato che questi topi avevano solo cranio minore, a mano, e difetti del piede simili a quelli osservati in SCS. Il topo gene TWIST è localizzato sul cromosoma 12 in topi, che corrisponde al braccio corto del cromosoma 7 nell’uomo. Con queste informazioni, gli scienziati hanno cominciato a isolare e mappare il gene TWIST umana sul braccio corto del cromosoma umano 7. Hanno rivelato che il gene TWIST umano era nella stessa regione che era assente nelle persone con SCS. Mentre cerca di diverse mutazioni nel gene TWIST umana, cinque diversi tipi di mutazioni sono state scoperte in individui con SCS. Dal momento che nessuna di queste mutazioni sono stati osservati in individui normali che non hanno avuto SCS, questo ha fornito prove sufficienti per concludere che il gene TWIST è l’agente eziologico della SCS1. I ricercatori hanno anche studiato il gene TWIST in Drosophila (mosca della frutta) al fine di determinare la sua funzione. Essi hanno scoperto che in presenza di due molecole proteiche TWIST combinate insieme, le funzioni geniche TWIST come fattore di trascrizione del DNA, cioè si lega al DNA a doppia elica in posizioni specifiche per controllare quali geni sono “accesi” o attivate. La maggior parte delle mutazioni identificate nel gene TWIST interferisce con come la proteina attribuisce al DNA, impedendo l’attivazione di altri geni che normalmente essere attivati durante lo sviluppo fetale.[1]
§Segni e sintomi
Gli individui con SCS sono tutti influenzati in modo diverso. Anche all’interno della stessa famiglia, gli individui affetti hanno caratteristiche diverse. La maggior parte degli individui con SCS sono moderatamente colpiti, con tratti del viso irregolari e una faccia relativamente piatta a causa di prese sottosviluppati occhi, zigomi e mascella inferiore. Oltre alle anomalie fisiche, le persone con SCS sperimentano anche ritardi di crescita, che si traduce in un tempo relativamente breve statura. Anche se, la maggior parte degli individui con SCS sono di intelligenza normale, alcuni individui possono avere da lieve a moderato ritardo mentale (QI 50-70). I casi più gravi di SCS, con più gravi deformità facciali, si verifica quando più suture craniche chiudere prematuramente. [1]
La mano di un bambino di 4 anni con sindattilia
La mano di un paziente con sindattilia di più cifre.
· Flat, testa asimmetrica e la faccia [2]
· La testa è tipicamente conica (acrocefalia) o piatta ( brachicefalia ), ma può anche essere lunghi e stretti ( dolicocefalia ) [4]
· Testa è breve da davanti a dietro [5]
· Faccia Lopsided [4]
· Low-set dei capelli causando fronte ad apparire altezza e [5]
§Difetti mani e dei piedi [ modifica]
· Tessitura ( sindattilia ) tra il secondo e il terzo dito e tra il secondo e il terzo dito [1]
· Dita corte e dei piedi ( brachidattilia ) [4]
· Pollice Broad e / o un ampio alluce (alluce) con una deformità in valgo (andata angolazione deldistale segmento di un osso / giunto) [3]
· Mani hanno una sola flessione piega palmer [2]
Ragazza con epicanto
Un diagramma che mostra un labbro leporino e palato completo
· Occhi irregolarmente posizionati che possono essere attraversati ( strabismo ) oppure a livello di set ( ipertelorismo ) [5]
· Problemi di vista a causa di anatomia del viso anomala, che causa disturbi meccanici dei muscoli estrinseci , con conseguente strabismo (incrociato gli occhi) [2]
· Strappare condottouna stenosi (restringimento del dotto lacrimale) [2]
· Palpebre cadenti ( ptosi ) [2]
· Rrime palpebralii basse oblique (separazione tra le palpebre superiori e inferiori) [2]
· Pieghe Epicantiche (pieghe della pelle della palpebra superiore che copre l’angolo interno dell’occhio) [3]
· Blefarofimosi (ptosi bilaterale con dimensioni ridotte della palpebra) [3]
· Errori di refrazione [3]
§orecchio, naso e difetti Bocca
· Orecchie piccole, basse, che possono essere ruotato un po’ indietro e ha una Pinnaimportante (sporgente) [4]
· Ipoacusia trasmissiva o mista, da anchilosi stapediale e catena fissa, ma anche neurosensoriale profonda
· Naso a becco (leggermente piegata verso il basso a punta), che è leggermente fuori centro e contiene un setto deviato[1]
· Malocclusione associata ad anomalie dentarie compresa ipoplasia dello smalto (smalto sottile a causa della formazione incompleta), Iperdontia (denti in più), e peg denti (piccoli denti di forma anomala) [3]
· Palatoschisi con arco alto [3]
§Difetti Meno comuni
· Bassa statura [6]
· Problemi cardiaci congeniti[3]
· Problemi di linguaggio [7]
· Atresia anale (malformed retto ) [2]
· Ritenuti testicoli ( criptorchidismo ) [4]
· Renali (rene) anomalie [4]
· I disturbi di personalità[3]
§Diagnosi
§Diagnosi Prenatale
La diagnosi prenatale della sindrome Saethre-Chotzen in gravidanze ad alto rischio è fattibile, ma molto raro e di rara esecuzione.Inoltre, questo è possibile solo se la mutazione che causa la malattia è già stata identificata all’interno della famiglia genoma . Ci sono un paio di tecniche diverse in cui il test prenatale può essere effettuata. La diagnosi prenatale è di solito eseguita intorno 15-18 settimane, con l’amniocentesi per estrarre il DNA dalle cellule del feto. La diagnosi prenatale può essere eseguita anche durante le settimane 10-12 con prelievo dei villi coriali (CVS) per estrarre il DNA del feto. [6] Recentemente, c’è stato un crescente interesse per l’utilizzo di ultrasuoni attrezzature al fine di rilevare anomalie del cranio del feto a causa di immaturo fusione delle suture craniche . [4]
§La diagnosi clinica
La diagnosi complessiva di SCS è basata principalmente sui risultati clinici e osservazioni basate sull’esame dismorfismi (valutare difetti strutturali) e valutazione radiografica ( raggi X , risonanza magnetica , e scansioni CT ). [3] La diagnosi clinica di SCS è generalmente basata sul presenza delle seguenti caratteristiche: [6]
· Più comunemente risulta dalla fusione prematura della sutura coronale , anche se uno qualsiasi degli altri suture potrebbe causare questo. [6]
· Craniosinostosi è tipicamente accompagnato da una forma strana teschio (per esempio, brachicefalia [breve e larga] e acrocefalia [a forma di cono]). [6]
· Nel determinare se un individuo ha SCS, il medico esaminerà cranio del paziente e sarà in grado di sapere se si è verificata fusione prematura in base alla forma del cranio. [6]
· Low-set attaccatura dei capelli, asimmetria facciale, ptosi (palpebre cadenti), e lo strabismo (incrociato / occhi pigri) [6]
· Piccole orecchie con marcata, gonfio pinna [6]
· Anomalie degli arti, tra cui borsiti (alluce valgo), brevi, dita parzialmente palmate, di forma triangolare epifisi della alluce (alluce), e duplicati falange distale dell’alluce [6]
§Molecolare / diagnosi genetica
Una diagnosi clinica di SCS può essere verificata con test al TWIST1 gene (solo gene , in cui le mutazioni sono noti per causare SCS) per mutazioni con l’analisi del DNA, come l’ analisi della sequenza , l’eliminazione / duplicazione di analisi, e citogenetica / FISH analisi.L’analisi di sequenza di esone 1 (TWIST1 regione codificante ) fornisce un buon metodo per rilevare la frequenza di mutazioni nel gene TWIST1. Queste mutazioni sono sciocchezze , missence , sito di splice mutazione , e intrageniche delezioni / inserzioni . Analisi cancellazione / duplicazione identifica mutazioni nel gene TWIST1 che non sono prontamente rilevato da analisi di sequenza. I metodi più comuni includono PCR , multiplex probe amplificazione legatura-dipendente (MLPA) , e cromosomica microarray (CMA) . Analisi citogenetica / FISH attribuisce etichette modo fluorescente marcatori del DNA di un denaturato cromosomi ed è quindi esaminata con illuminazione a fluorescenza, che rivela le mutazioni causate da traslocazioni o inversioni coinvolgono 7p21. Di tanto in tanto, gli individui con SCS avere una traslocazione cromosomica, inversione, o anello cromosoma 7 che coinvolge 7p21 conseguente risultati atipici, come ad esempio, una maggiore ritardo di sviluppo. [6] Gli individui con SCS, in genere hanno il normale funzionamento del cervello e raramente hanno disturbi mentali. Per questo motivo, se un individuo ha sia SCS e ritardo mentale , allora dovrebbero avere il loro gene TWIST1 proiettato con più attenzione, perché questo non è un normale tratto di SCS. [1]testing citogenetica esperimentazione diretta geni possono anche essere utilizzati per studiare gene / difetti cromosomici. Test citogenetica è lo studio dei cromosomi per rilevare utili o le perdite di cromosomi o segmenti cromosomici utilizzando ibridazione in situ fluorescente (FISH) e / o di ibridazione genomica comparativa (CGH) . Test genetici Diretta utilizza il sangue, capelli, pelle, liquido amniotico , o di altri tessuti, al fine di trovare malattie genetiche . Test genetici diretta può determinare se una persona ha SCS per testare il sangue di un individuo per mutazioni nel gene TWIST1. [6]
§Diagnosi differenziale (comunemente Condizioni Mistaken)
Fino a poco tempo fa, gli esperti spesso in disaccordo sul fatto che una paziente aveva SCS, la sindrome di Crouzon, isolato craniosinostosi, o qualche altra malattia, perché i sintomi sono così strettamente correlati, hanno letteralmente avevano modo di distinguere tra tutti loro. Tuttavia, ora abbiamo le prove gene diretta, che permette una diagnosi più definitiva perché permette loro di essere differenziati tra loro in base al quale gene è mutato in ogni condizione. [1] Di seguito è riportato un elenco di condizioni comunemente confuse / diagnosticate per SCS, alcuni dei loro sintomi, e che mutato gene ciascuno contiene:
|
Malattia / Condizioni |
Sintomi |
Mutato Gene |
|
SCS |
Occhi molto distanziati, Low-set capillari, occhi Cascante, interdigitali tessitura, orecchie deforme, occhi incrociati, e verso il basso pendenza rime palpebrali |
|
|
Sindrome Robinow-Sorauf |
Occhi molto distanziati, setto deviato, piatto posteriore del cranio, orecchie deforme, occhi incrociati, sporgente mandibola, e la duplicazione di falange distale |
|
|
Occhi molto distanziati, testa allargata, perdita dell’udito, le guance piatte, e le orecchie a basso impianto |
||
|
Occhi molto distanziati, testa Short-larga, la perdita dell’udito, occhi sporgenti, Beaked naso, orecchie a basso-set, strabismo , mento sporgente, e Short omero e il femore |
||
|
Occhi molto distanziati, mascella sottosviluppati, Beaked naso, perdita dell’udito, e occhi sporgenti |
||
|
Occhi molto distanziati, fronte prominente, piatto posteriore del cranio, occhi sporgenti, orecchie a basso impianto, faccia piana o concava, breve pollice e dita palmato |
||
|
Isolata unilaterale Coronal Sinostosi |
Solo malformazione è la fusione prematura delle suture; Se non trattata, può portare a viso asimmetria simile SCS |
FGFR (qualsiasi) |
|
Baller-Gerold Syndrome (BGS) |
Vasta testa corta, occhi sporgenti, fronte piatta, Poichilodermia , deformazione radiale con ridotto numero di cifre, pollice sottosviluppati o mancante e raggio, e ritardo della crescita |
Segmenti ossei che vengono rimossi in fronto-sovraorbitario avanzamento
Un bambino che indossa un casco remolding cranica dopo l’intervento chirurgico.
Le anomalie fisiche derivanti dalla SCS sono generalmente lievi e richiedono solo un piccolo intervento chirurgico o alcuna procedura a tutti. Uno dei sintomi più comuni della SCS è lo sviluppo di breve ( brachidattilia ), dita palmate e grandi dita ( sindattilia ). Queste caratteristiche non causano problemi alla funzione delle mani o dei piedi, e, quindi, nessuna procedura medica è necessario per correggere le anomalie, a meno che il paziente lo richiede. Tessitura delle dita può effettuare la base delle dita, con conseguente crescita mano ritardo durante l’infanzia, ma questo contribuisce non menomazioni funzionali. A volte, gli individui con SCS sviluppano ampi dita perché le ossa alle estremità delle dita dei piedi sono duplicando se stessi. Questo è particolarmente visibile nella alluce, ma richiede alcun intervento chirurgico perché non influisce negativamente sulla funzionalità complessiva del piede. Gli individui con queste anomalie punta camminare normalmente e può indossare calzature normali. [8]
Nei casi più gravi, interventi chirurgici frequenti e il monitoraggio clinico sono necessari durante lo sviluppo. Un bambino nato con asimmetrica coronale unilaterale sinostosi dovrebbe sottoporsicranioplastica nel suo primo anno di vita, al fine di evitare che un aumento della pressione intracranica e per prevenire progressiva asimmetria facciale . Cranioplastica è un intervento chirurgico per correggere ossa craniche prematuramente fuse. L’intervento agisce per ricostruire e riposizionare le ossa e suture per promuovere la crescita più normale. [3] cranioplastica è necessaria per continuare a crescere ed è importante per due motivi principali. Prima di tutto, ilcranio deve essere in grado di accogliere la crescita successivo parto cervello, che può non perché il cranio non cresce veloce come il cervello finché le suture rimangono fuse. Ciò si traduce in un aumento della pressione che circonda il cervello e inibisce il cervello di crescere, causando l’individuo a sperimentare problemi significativi, e se non trattata può portare alla morte. In secondo luogo, cranioplastica può essere richiesto a fini identificativi. [6] Questo è specialmente il caso in individui con asimmetrica sinostosi coronale unilaterale, che richiede chirurgia ricostruttiva del viso e del cranio. Se cranioplastica non viene eseguita, soprattutto in individui con unilaterale sinostosi coronale, quindi asimmetria facciale otterrà sempre peggio nel corso del tempo, che è il motivo per cranioplastica deve essere eseguita il più presto possibile. [8]
La chirurgia può essere necessaria anche in individui con problemi di vista. Disturbi visivi solito sorgono a causa della mancanza di spazio nell’orbita dell’occhio e del cranio causa della struttura ossea anormale del viso. Diminuzione spazio può anche portare ad anormali o mancanti condotti lacrimali e danni ai nervi. Chirurgia ricostruttiva è di solito necessario per aumentare lo spazio cranica, corretta condotto lacrimale stenosi e / o correggere ptosi delle palpebre per evitare l’ambliopia (occhio pigro). [1]
Chirurgia Midfacial può essere richiesto anche durante la prima infanzia per risolvere problemi respiratori, malocclusione dentale , e difficoltà di deglutizione.
Un palatoschisi è anche corretta con la chirurgia, e può comportare l’uso di tubi timpanostomia . Se necessario, un individuo subirà il trattamento ortognatica e / o trattamento ortodontico dopo lo sviluppo del viso è completa. [1] Poiché la perdita dell’udito è spesso associata a SCS, si raccomanda che lo screening audiologico persistono per tutta l’infanzia. [3]
Dopo chirurgia ricostruttiva cranio, un bambino può essere richiesto di indossare un Helmut stampaggio o qualche altra forma di protezione della testa fino a quando le ossa del cranio fissati in posizione. Questo richiede in genere circa tre mesi e dipende dall’età del bambino e la gravità della condizione. Dopo il recupero, gli individui con SCS apparire e agire del tutto normale, in modo che nessuno sarebbe nemmeno in grado di dire che essi hanno SCS. [9]
§Epidemiologia
SCS è il più comune craniosinostosi sindrome e colpisce 1 ogni 25.000 a 50.000 persone. [10] Essa si verifica in tutti i gruppi etnici e razziali, e colpisce maschi e femmine in ugual misura. [1] Se un genitore porta una copia della mutazione gene SCS , poi c’è una probabilità del 50% il loro bambino effettuerà anche una copia della mutazione del gene, in questo caso, il bambino può o non può mostrare segni di SCS. C’è anche una probabilità del 50% il loro bambino avrà due copie di lavoro del gene, e pertanto, non hanno SCS. Se entrambi i genitori sono portatori di una sola copia della mutazione gene SCS, poi c’è una probabilità del 25% il loro bambino avrà due copie della mutazione genica (così bambino sarebbe sviluppare una grave SCS), una probabilità del 25% il loro bambino dovrebbe avere due copie normali del gene (quindi sarebbe del tutto normale), e una probabilità del 50% il loro bambino avrebbe portato un gene mutazione copia e 1 copia normale (così bambino può o non può visualizzare SCS). [1] In rari casi, due genitori normali possono avere un bambino con SCS a causa di una de novomutazione . La causa esatta del de novo mutazione è sconosciuta, ma non sembra essere correlato a tutto ciò che i genitori hanno fatto o non hanno fatto durante la gravidanza. [11] SCS a causa di una de novo mutazione è così raro che la percentuale di casi passati è sconosciuta. [6]
§Storia
Nel 1931, Haakon Saethre, un norvegese psichiatra , ha descritto caratteristiche simili tra una madre e le sue due figlie. Tutti avevano le caratteristiche lunghe e irregolari del viso, linee sottili a basso-set, dita corte, e la tessitura tra il secondo e il terzo dito e tra il secondo, terzo, e quarto dito. Un anno dopo, nel 1932, F. Chotzen, un tedesco psichiatra , ha descritto un padre ei suoi due figli come aventi caratteristiche molto simili a quelle della madre e le sue figlie, oltre ad avere perdita di udito, bassa statura, e lieve ritardo mentale. Da qui, il nome Sindrome Saethre-Chotzen deriva da due scienziati, che avevano descritto separatamente la condizione senza alcuna conoscenza degli altri. [1]
· Acrocefalosindattilia tipo III
· Acrocefalia, Skull asimmetria, e sindattilia Mild
· ACS3
· ACS III
· Sindrome Chotzen
References[edit]
1. ^ Jump up to:abcdefghijklmnop Blanchford, Stacey L (2002). The Gale Encyclopedia of Genetic Disorders. Michigan: Gale Group. pp. 1019–1021.ISBN9780787656140.
2. ^ Jump up to:abcdefghi Allanson, Judith, Cassidy, Suzanne (2010). Management of Genetic Syndromes. New Jersey: John Wiley & Sons, Inc. pp. 230–235. ISBN9780470191415.
3. ^ Jump up to:abcdefghijklm Clauser L, Galie M. “Saethre-Chotzen Syndrome”. Orphanet. Retrieved Oct 28, 2012.
4. ^ Jump up to:abcdefgh Wynbrandt, James (2008). Genetic Disorders and Birth Defects. New York: Facts on File, Inc. p. 340. ISBN9780816063963.
5. ^ Jump up to:abc“Saethre-Chotzen Syndrome”. International Craniofacial Institute. Retrieved Oct 28, 2012.
6. ^ Jump up to:abcdefghijklmn Gallagher E, Ratisoontorn C, Cunningham M. “Saethre Chotzen Syndrome”. NCBI. Retrieved Oct 28, 2012.
7. Jump up^“Saethre-Chotzen Syndrome”. Children’s Hospital and Medical Center. Retrieved Oct 25, 2012.
8. ^ Jump up to:ab Anderson, Peter. “Headlines Craniofacial Support”. Retrieved November 27, 2012.
9. Jump up^“Surgical Options for Craniosynostosis”. Johns Hopkins Medicine. Retrieved November 28, 2012.
10. Jump up^“Saethre-Chotzen Syndrome”. Boston Children’s Hospital. Retrieved November 28, 2012.
11. Jump up^“Saethre-Chotzen Syndrome”. Seattle Children’s Hospital. Retrieved November 28, 2012.
12. Jump up^“Children’s Health: Saethre Chotzen Syndrome”. WebMD. Retrieved November 28, 2012.
· NIH. Multiple Congenital Anomaly/Mental Retardation (MCA/MR) Syndromes
· GeneReview/NCBI/NIH/UW entry on Saethre–Chotzen Syndrome
· ertelorismo
· SCS