· OTOTOSSICITÀ: AGENTI CHEMIOTERAPICI
Parole chiave : antibiotici aminoglicosidici, diuretici dell’ansa, farmaci antineoplastici, derivati salicilati, eritromicina, minociclina
|
· OTOTOSSICI EXTRAPROFESSIONALI Farmaci · Antibiotici con buone prove per Ototossicità · Antibiotici per il quale esiste qualche sospetto di Ototossicità
|
|
· Aspirina e farmaci correlati
· OTOTOSSICI PROFESSIONALI
· Statistiche sulla Ototossicità
· Fattori di rischio per l’Ototossicità
· Progressione dell’Ototossicità
· Esame clinico dell’Ototossicità
· Come viene diagnosticata l’Ototossicità?
· Come viene trattata l’Ototossicità ?
· Approfondimento Farmaci
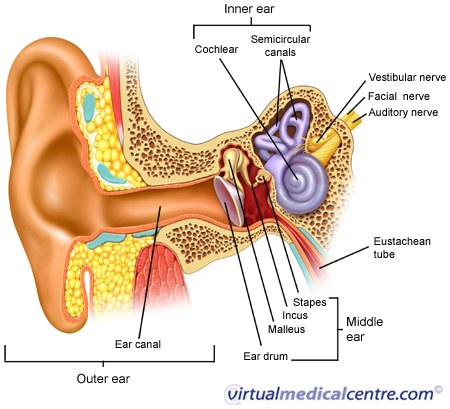
Che cosa è l’Ototossicità
l’Ototossicità è, molto semplicemente, l’avvelenamento dell’orecchio (oto = orecchio, tossicità = avvelenamento), che deriva dalla esposizione a farmaci o sostanze chimiche che danneggiano l’orecchio interno o il nervo cocleovestibolare . Poiché nell’orecchio interno c’è sia l’organo uditivo ,che dell’equilibrio, l’ototossicità può provocare disturbi di uno o entrambi questi sensi. Tali danni possono portare a perdita uditiva temporanea o permanente, e / o a perdita dell’equilibrio. Le sostanze ototossiche includono diversi farmaci (ad esempio antibiotici aminoglicosidi , alcuni agenti anti-cancro , ciclo diuretici , farmaci anti-malarici e l’aspirina ), ed altre sostanze ambientali (ad esempio mercurio, piombo e arsenico). La tabella elenca alcuni dei farmaci ototossici più comunemente usati e le sostanze.
|
|
|
|
Normale organizzazione organo di corti |
Stereociglia danneggiate dalla somministrazione di amminoglicosidi |

Tabella 1. Comuni sostanze note per essere associate con ototossicità 
|
Tipo / gruppo |
Denominazione della sostanza ototossiche |
|
Antibiotici aminoglicosidici |
Gentamicina, streptomicina, tobramicina, neomicina, netilmicina, kanamicina, amikacina, diidrostreptomicina, ribostamicina |
|
Antibiotici non aminoglicosidi |
Vancomicina, eritromicina |
|
Diuretici dell’ansa |
Furosemide, acido etacrinico, bumetanide, torsemide |
|
Agenti chemioterapici |
Cisplatino, carboplatino, mostarda azotata |
|
Salicilati |
Aspirina |
|
I farmaci anti-malarici |
Chinina, clorochina |
|
Sostanze chimiche ambientali e altre sostanze |
Piombo, mercurio, ossido di carbonio, arsenico, disolfuro di carbonio, stagno, esano, toluene, alcool |
OTOTOSSICI EXTRAPROFESSIONALI
Farmaci
ANTIBIOTICI
Penicilline di nuova generazione
ANTIBIOTICI CON BUONA PROVA PER ototossicità
|
Farmaci |
Vestibolotossici |
Otossici |
Livello di Tossicità |
|
Amikacina |
non tossico |
13,9% |
|
|
Azitromicina |
non nota |
occasionale |
richiesta una dose molto alta |
|
Capreomicina |
sì |
||
|
Cloramfenicolo |
sì |
solo in rapporti sporadici |
|
|
Claritromicina |
occasionale |
||
|
Dibekacina |
sì |
sì |
|
|
Diidrostreptomicina |
minore tossicità |
molto tossico |
|
|
Eritromicina |
sì |
Dosi elevate IV solo |
|
|
8,6% |
minore |
|
|
|
Metronidizolo |
tossica (raramente) |
sconosciuto |
|
|
Neomicina |
minore |
molto tossico |
Sotto forma di gocce topiche per le orecchie |
|
Netilmicina |
Sì |
2,4% |
|
|
Polimixina B |
Sotto forma di gocce per le orecchie |
||
|
Streptomicina |
molto tossico |
minore |
|
|
Tobramicina |
Sì |
minore 6% |
Meno tossico della Gentamicina |
|
tossico o raramente tossici |
nessuno a moderata |
Sinergia con la gentamicina |
Vancomicina
Anche per vancomicina sono stati descritti effetti ototossici (Tanaka et al.. 2001).
Aminoglicosidi
È documentata da tempo l’ototossicità degli aminoglicosidi (Leone et al., 2000), ed è inoltre noto che, mentre molti degli effetti collaterali degli antimicrobici sono prontamente reversibili dopo la sospensione della terapia. gli effetti ototossici mediati dagli aminoglicosidi sono irreversibili (Cunha. 2001).
Recentemente è stata descritta l’efficacia dell’iniezione intratimpanica degli aminoglicosidi nel trattamento delle vertigini in pazienti con sindrome di Ménière. In questi pazienti è stata osservata una diversa entità di danno uditivo conseguente alla somministrazione di dosi diverse del farmaco in sedi diverse. Lo studio ha dimostrato che l’ototossicità dei vari aminoglicosidi è diversa, poiché alcuni di questi sono principalmente vestibolotossici, altri ototossici. Al momento attuale, però, non sono noti i meccanismi attraverso i quali si esplica l’ototossicità o la vestibolotossicità dei diversi aminoglicosidi (Nakashima et al., 2000).
Gentamicina
L’ototossicità della gentamicina, così come per altri aminoglicosidi (neomicina solfato. tobramicina), è stata da tempo dimostrata in studi condotti su animali. Gli studi condotti sull’uomo sono minori, anche se sono stati segnalati casi di ipoacusia neurosensoriale insorta dopo applicazione topica di questo antibiotico (Morpeth et al., 2001).
Livello d’azione: in uno studio condotto su cavie sono stati osservati effetti inibitori della gentamicina sui canali del calcio delle cellule ciliate esterne apicali e basali. Si è osservato che l’ingresso di calcio è maggiormente impedito a livello basale. È stato inoltre documentato che la acidificazione extracellulare può aumentare l’effetto ototossico acuto degli aminoglicosidi sul trasporto di calcio a livello delle cellule ciliate e di ciò si deve tener conto nell’utilizzo di preparazioni otologiche (Tan et al.. 2001).
|
|
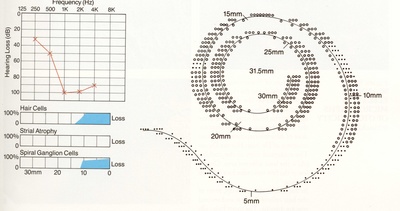
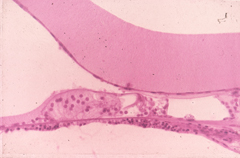
GENTAMICIN ototossicità (COCHLEAR RICOSTRUZIONE) (orecchio sinistro) Questa ricostruzione grafica della coclea mostra una perdita totale di cellule cigliate nel giro basso (basale della coclea), ed una perdita della prima fila di cellule esterne ad 8 a 10 mm (giro basale superiore). In una piccola area del piano basale (11,5 mm) c’è stata una perdita di tutte le cellule ciliate esterne. C’era anche una perdita delle cellule gangliari a spirale nella parte bassa del giro basale. (grandi cerchi indicano la presenza di cellule acustiche, i punti la mancanza .) |
|
|
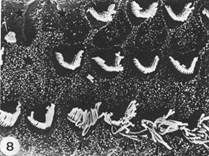
GENTAMICIN ototossicità (sezione dell’osso temporale umana) Descrizione: C’è un leggero sollevamento da artefatto della membrana tectoria; Tuttavia, l’organo del Corti è ben conservato. , mancano le cellule ciliate esterne della prima e seconda di fila. H & E 156x. |
Neomicina
Neomicina, un altro antibiotico aminoglicosido, che è stato isolato nel 1949. Ora è utilizzato principalmente per via topica a causa della tossicità renale e dell’ototossicità (per l’udito). La neomicina è scarsamente assorbita dal tratto gastrointestinale normale – circa il 97% viene escreto nelle feci. La neomicina è quasi totalmente assorbita rapidamente dalle superfici del corpo (tranne dalla vescica urinaria) dopo l’applicazione locale e quando applicato topicamente in associazione con procedure chirurgiche. Con dosi ripetute, avviene un progressivo accumulo nell’orecchio interno. Si è vista che viene rilasciato lentamente, nell’arco di alcune settimane, dopo che la somministrazione è stata interrotta. L’ototossicità con interessamento uditivo da assorbimento orale di neomicina e ‘stato segnalato (Rappaport et al, 1986) e ci può essere anche un effetto ototossico da gocce auricolari nei pazienti con perforazione del timpano. Questo problema è ancora dibbattuto (come del 12/1/98). La tossicità da neomicina ha spesso una insorgenza ritardata, che non si può rilevare anche molto tempo dopo che la neomicina è stata interrotta (Informazioni date dalla letteratura dei produttori, Teva Pharmaceuticals, 11/1999).
|
|
titolo: R-200 Neomicina Capitolo: Intossicazioni sezione Capitolo: Aminoglicosidi Ototossicità, neomicina TB numero del caso: 751 Sesso: Femmina Età (yrs.): 54 Otologic Dx: 1. Ototossicità neomicina, cocleare 2.Emorragia subaracnoidea, estensione del sangue nella coclea |
Kanamicina
Kanamicina, è anche un aminoglicoside, che è stato prodotto nel 1957, ed è stato successivamente sostituito da nuove aminoglicosidi come gentamicina, tobramicina, netilmicina, e amikacina In uno studio condotto su pulcini cui è stata iniettata kanamicina per 8 giorni consecutivi è stata osservata una distruzione completa delle cellule ciliate nell’area compresa tra 04 e 0.8 mm dalla parte finale della papilla basale (Xiang et aL. 2001).
Tobramicina
La tobramicina è solo raramente associata a ototossicità (circa 1/150 di secondo Neu et al, 1986), ma non vi è una chiara prova che può produrre una sindrome vestibolare simile alla gentamicina (Barrsma, 1979; Lehmann, 1976). La maggior parte dei casi di tossicità da tobramicina si sono verificati in persone con insufficienza renale. Si è riscontrata poca ototossicità visto nei pazienti con somministrazioni ripetute (Pedersen et al, 1987; Thomesen et al, 1979), che suggerisce che possa essere gestita in modo diverso per l’orecchio. Si sospetta che la tobramicina è ototossica per i neonati, ma non ci sono prove che lo dimostrino (de Hoog et al, 2002; 2003). Negli animali, la tobramicina è molto meno ototossico della gentamicina (Bamonte et al, 1986; Kitasato, 1990; McCormick et al, 1985; Petorossi et al, 1986).
Azitromicina e claritromicina
Livello del danno: in uno studio condotto esponendo cavie in modo ripetuto ad azitromicina, claritromicina ed eritromicina, è stato osservato un danno diretto alle cellule ciliate negli animali esposti ad aminoglicosidi e non in quelli esposti a macrolidi (Uzun et al, 2001).
La somministrazione di azitromicina può indurre lo sviluppo di ipoacusia neurosensoriale irreversibile (Mamikoglu et al., 2000).
References concerning specific antibiotics:
Related to tobramycin
- Baarsma, EA and E. Rijntjes (1979). “Vestibulo-toxicity of tobramycin.” J Laryngol Otol 93 (7): 725-7.
- Bamonte, F., A. Monopoli, E. Ongini, et al. (1986). “Comparative actions of four aminoglycoside antibiotics on the vestibular function in guinea-pigs.” Arch Int Pharmacodyn Ther 282 (1): 161-76.
- de Hoog, M., BA van Zanten, WC Hop, et al. (2003). “Newborn hearing screening: tobramycin and vancomycin are not risk factors for hearing loss.” J Pediatr 142 (1): 41-6.
- Kitasato, I., M. Yokota, S. Inouye, et al. (1990). “Comparative ototoxicity of ribostamycin, dactimicin, dibekacin, kanamycin, amikacin, tobramycin, gentamicin, sisomicin and netilmicin in the inner ear of guinea pigs.” Chemotherapy 36 (2): 155-68.
- Lehmann, W., R. Hausler and FA Waldvogel (1976). “A clinical study on the ototoxic effects of tobramycin.” Arch Otorhinolaryngol 212 (3): 203-11.
- McCormick, GC, E. Weinberg, RJ Szot, et al. (1985). “Comparative ototoxicity of netilmicin, gentamicin, and tobramycin in cats.” Toxicol Appl Pharmacol 77 (3): 479-89.
- Neu, HC and CL Bendush (1976). “Ototoxicity of tobramycin: a clinical overview.” J Infect Dis 134 Suppl : S206-18.
- Pedersen, SS, T. Jensen, D. Osterhammel, et al. (1987). “Cumulative and acute toxicity of repeated high-dose tobramycin treatment in cystic fibrosis.” Antimicrob Agents Chemother 31 (4): 594-9.
- Pettorossi, VE, F. Bamonte, P. Errico, et al. (1986). “Vestibulo-ocular reflex (VOR) in guinea pigs. Impairment induced by aminoglycoside antibiotics.” Acta Otolaryngol 101 (5-6): 378-88.
- Thomsen, J. and B. Friis (1979). “High dosage tobramycin treatment of children with cystic fibrosis. Bacteriological effect and clinical ototoxicity.” Int J Pediatr Otorhinolaryngol 1 (1): 33-40.
Gli antibiotici generalmente considerati sicuri
|
Gli antibiotici generalmente considerati sicuri |
|
Aztreonam |
|
Penicilline |
|
Cefalosporine |
|
Macrolidi (es. Azitromicina ed eritromicina), tranne in dosi molto elevate. |
Macrolidi e altri antibiotici che sono solo leggermente ototossico:
Azitromicina, è un macrolide – e non nella stessa famiglia come Gentamicina. Tuttavia, ci sono rapporti occasionali di ototossicità, quando ci sono stati prolungati e alti livelli. Gli alti livelli in genere richiedono la somministrazione per via endovenosa.
Clindamicina non è stato segnalato per causare ototossicità, di per sé, ed è probabilmente sicuro.
Il cloramfenicolo è stata sporadicamente segnalata per essere sistemica ototossica.
L’ eritromicina, anche se non è un aminoglicoside come la gentamicina, è ototossico ad alte dosi per via endovenosa. (McGhan et al. 2003). McGhan e Merchant riportano un edema striale patologico in tutti i giri cocleari (in un caso singolo). Questo potrebbe spiegare la perdita di soglia relativamente piatto con una buona discriminazione vocale che è il segno distintivo dell’ ototossicità da eritromicina. Ciò potrebbe anche spiegare UNa perdita dell’udito un po’ reversibile.
In diverse occasioni è stato segnalato che il metronidizole (Flagyl) è ototossico (Blake and Butt 1984; Hibberd, Nicoll et al 1984;. Hibberd, Nicoll et al 1984;. Lawford e Sorrell 1994; Iqbal, Murthy et al 1999;. Riggs et al, 1990). fortunatamente sembra che la tossicità del Metronidizole sia rara e documentata solo da segnalazioni di casi sporadici.
Riferimenti re Metronidizole:
- Blake, P. e WE Butt (1984). “Ototossicità di metronidazolo.” NZ Med J 97 (753): 241.
- Hibberd, AD, RJ Nicoll, et al. (1984). “La sordità è una reazione avversa per l’uso profilattico di metronidazolo.” NZ Med J 97 (750): 128.
- Hibberd, AD, RJ Nicoll, et al. (1984). “Ototossicità di metronidazolo.” NZ Med J 97 (754): 275.
- Iqbal, SM, JG Murthy, et al. (1999). “Metronidazolo ototossicità – rapporto di due casi.” J Laryngol OTOL 113 (4): 355-7.
- Lawford, R. e TC Sorrell (1994). “Ascesso amebica della milza complicato da metronidazolo indotto neurotossicità:. Caso clinico” Clin Infect Dis 19 (2): 346-8.
References re macrolides:
• Bizjak, ED, MT Haug, 3rd, RJ Schilz, et al. (1999). “Intravenous azithromycin-induced ototoxicity.” Pharmacotherapy 19 (2): 245-8.
• McGhan LJ and Merchant SN (2003). “Erythromycin ototoxicity.” Otol Neurotol 24(4): 701-2.
• Mamikoglu, B. and O. Mamikoglu (2001). “Irreversible sensorineural hearing loss as a result of azithromycin ototoxicity. A case report.” Ann Otol Rhinol Laryngol 110 (1): 102.
• Ress, BD and EM Gross (2000). “Irreversible sensorineural hearing loss as a result of azithromycin ototoxicity. A case report.” Ann Otol Rhinol Laryngol 109 (4): 435-7.
• Tseng, AL, L. Dolovich and IE Salit (1997). “Azithromycin-related ototoxicity in patients infected with human immunodeficiency virus.” Clin Infect Dis 24 (1): 76-7.
• Uzun, C., M. Koten, MK Adali, et al. (2001). “Reversible ototoxic effect of azithromycin and clarithromycin on transiently evoked otoacoustic emissions in guinea pigs.” J Laryngol Otol 115 (8): 622-8.
• Uzun, C. (2003). “Tinnitus due to clarithromycin.” J Laryngol Otol 117(12): 1006-1007.
• Wallace, MR, LK Miller, MT Nguyen, et al. (1994). “Ototoxicity with azithromycin.” Lancet 343 (8891): 241.
Altre informazioni utili sulle gocce ototossiche
Le gocce auricolari possono contenere antibiotici, alcuni dei quali possono essere ototossici se somministrato a persone con timpani perforati. La soluzione di gocce otologiche di Cortisporina sembra sia la più ototossica per la coclea delle cavie, molta meno tossiche le gocce di gentamicina. Le gocce auricolari di Ofloxacina hanno una tossicità trascurabile (Barlow et al, 1995). E’ stato segnalato che le gocce auricolari contenenti Neomicina possano contribuire alla perdita (Podoshin et al, 1989) uditiva ,ma di grado lieve , ma una valutazione definitiva del rischio non è ancora stata fatta. Non sono stati riportati casi di ototossicità con le gocce di tobramicina . La maggior parte di vestibolotossicità da gocce auricolari non è finora stata studiata, sebbene casi clinici suggeriscono che le gocce contenenti gentamicina sono tossici se somministrati per lunghi periodi di tempo.
Ci sono diverse note interazioni tra le famiglie di farmaci ototossici. Diuretici dell’ansa (vedi in seguito) potenziano la tossicità degli aminoglicosidi. La Vancomicina è sinergica con la gentamicina, in quanto è più probabile che causare tossicità, come il rumore. La Vancomicina, di per sé in dosi appropriate, non è particolarmente ototossico (Gendeh et al, 1998).
L’ototossicità ritardata , cioè la tossicità che continua per diversi mesi dopo che il farmaco è stato sospeso , è stata ben documentata perché gli aminoglicosidi sono trattenuti all’interno dell’orecchio interno molto più a lungo rispetto al sangue. E’ stato riportato che la Gentamicina persista per più di 6 mesi negli animali. E’ anche noto che la Neomicina, streptomicina e kanamicina sono eliminate lentamente dall’ orecchio interno (Thomas et al, 1992)
References regarding ototoxicity of antibiotics:
- Barlow DW, Duckert LG, Kreig CS, Gates GA. Ototoxicity of topical otomicrobial agents. Acta Otolaryngol (Stockh) 1995 Mar;115(2):231-235
- Bates RD, Nahata MC, Jones JW, McCoy K, Yong G, Cox S, Barson WJ. Pharmacokinetics and safety of tobramycin after once-daily administration in patients with cystic fibrosis. Chest 112(5):1208-13, 1997. This paper notes no ototoxicity in 18 patients for once/day administration.
- Conlon BJ, McSwain SD, Smith DW. Topical gentamicin and ethacryinic acid: effects on cochlear function. Laryngoscope 108(7):1087-9, 1998.
- de Hoog M, van Zanten GA, Hoeve LJ, Blom AM, van den Anker JN. A pilot case control follow-up study on hearing in children treated with tobramycin in the newborn period. Int J Pediatr Otorhinolaryngol 2002; 65: 225-32.
- Edson RS, Terrell CL. The Aminoglycosides. Mayo Clin Proc 1991 Nov;66(11):1158-1164.
- Gendeh B, Gibb AG, Aziz N, Kong N, Zahir Z. Vancomycin administration in continuous ambulatory peritoneal dialysis: the risk of ototoxicity. Otol HNS 1998:118:551-8.
- Israel KS, Welles JS, Black HR. Aspects of the pharmacology and toxicology of tobramycin in animals and humans. J Infect Dis 1976 Aug;134 Suppl:S97-S103.
- Masur H, Whelton PK, Whelton A. Neomycin toxicity revisited. Arch Surg 1976 Jul;111(7):822-825.
- Matz GJ. Aminoglycoside cochlear ototoxicity. Otolaryngol Clin North Am 1993 Oct;26(5):705-712.
- Medical Letter. Hypoglycemia and hyperglycemia with fluoroquinolones. Vol 45 (issue 1162) Aug 14, 2003
- Nikolaidis P, Vas S, Lawson V, Kennedy-Vosu L, Bernard A, Abraham G, Izatt S, Khanna S, Bargman JM, Oreopoulos DG. Is intraperitoneal tobramycin ototoxic in CAPD patients? Perit Dial Int 1991;11(2):156-161.
- Rappaport BZ, Fausti SA, Schechter MA, et al. A prospective study of high-frequency auditory function in patients receiving oral neomycin. Scand Audiol 15:67-7, 1986
- Riggs LC, Shofner WP, Shah AR, Young MR, Hain TC, Matz GJ. Ototoxicity resulting from combined administration of metronidizazole and gentamicin. Am J Otol 20, 4, 1990, 430-
- Sacristin JA, Soto JA, de Cos MA. Erythromycin-induced hypoacusis: 11 new cases and literature review. Annals of Pharmacotherapy 27(7-8), 950-5, 1993.
- Swanson DJ, Sung RJ, Fine MJ, Orloff JJ, Chu SY, Yu VL. Erythromycin ototoxicity: prospective assessment with serum concentrations and audiograms in a study of patients with pneumonia. Am J Med 1992 Jan;92(1):61-68.
- Tange RA, Dreschler WA, Prins JM, Buller HR, Kuijper EJ, Speelman P. Ototoxicity and nephrotoxicity of gentamicin vs netilmicin in patients with serious infections. A randomized clinical trial. Clin Otolaryngol 1995 Apr;20(2):118-123.
- Thomas J, Marion MS, Hinojosa R. Neomycin ototoxicity. Am J Otolaryngol, 13, 1992, 54-55
- Vasquez R, Mattucci K. A proposed protocol for monitoring ototoxicity in patients who take cochleo- or vestibulotoxic drugs. ENT J. 82:3, 181-184
- Wilhelm MP. Vancomycin. Mayo Clin Proc 1991 Nov;66(11):1165-1170
ANTITUMORALI
|
farmaci |
Vestibolotossici |
Cocleotossici |
Livello di Tossicità |
|
Carboplatino |
|
1-10%
|
|
|
Cisplatino |
Minore |
69% |
dose totale> 200 mg / mq metro |
|
Mostarda azotata |
sì |
sì |
|
|
Vincristina |
sì |
sì
|
|
Cisplatino
Il cisplatino attualmente è il farmaco antitumorale più utilizzato nei pazienti affetti da umori solidi pediatrici selezionati .Nelle neoplasie trattati con cisplatino è stato osservato un severo effetto ototossico mediato dal chemioterapico (Riwelski et al.. 2001) che può danneggiare le cellule di sostegno (Ramirez-Camacho et al, 2004).. Alcuni studi condotti su pazienti trattati con protocolli chemioterapici allestiti con ci-splatino hanno evidenziato una severa ma reversibile ototossicità (Shellens et al., 2001). La tossicità inizia nelle cellule ciliate esterne (Reavis et al, 2011) e per questo motivo è stato suggerito che le DPOAE ‘ s ( Prodotti di Distorsione delle Otoemissioni Acustiche )rappresentino un metodo valido per rilevare la ototossicità. La tossicità del cisplatino è sinergica con gentamicina e è stato segnalato che alte dosi di cisplatino possano causare sordità totale. Rispetto al cisplatino, l’oxaliplatino è caratterizzato da una minore tossicità documentata nell’uomo (Haller et al, 2000; Su et al, 2000).
Livello d’azione/caratteristiche del danno: il danno ototossico mediato dal cisplatino si esplica a livello dell’organo del Corti. Le cellule ciliate esterne, specie quelle del giro basale, sono elettivamente coinvolte (Dehne et al.. 2001; Feghali et al.. 2001). Un possibile meccanismo ipotizzato per spiegarne l’ototossicità è l’alterazione dei sistemi antiossidanti con conseguente aumento dei radicali liberi mediato dal farmaco.
|
|
|
|
Fig. 1a mostra le soglie medie per tutti i gruppi (controllo e le tre sottogruppi di trattamento). |
L’ampiezza media del DP-grammi in funzione della frequenza f2 è mostrato nella Fig. 1b . |
|
|
|
Carboplatino
Livello d’azione e caratteristiche del danno: in pazienti sottoposti a chemioterapia per neoplasie sono stati osservati effetti ototossici negli esposti ad alte dosi di carboplatino.
In studi compiuti su topi esposti al chemioterapico è stato documentato che il carboplatino induce stress ossidativo nella coclea dell’animale generando radicali liberi e determinando inattivazione dei sistemi antiossidanti (Husain et al., 2001).
Chemotherapy ototoxicity references
• Freilich RJ, Kraus DH, Budnick AS, Bayer LA, Finlay JL. Hearing loss in children with brain tumors treated with cisplatin and carboplatin based high-dosed chemotherapy with autologous bone marrow rescue. Med Pediatr Oncol 1996 Feb;26(2):95-100.
• RAMIREZ-CAMACHO R, Garcia-Berrocal JR, Bujan J, Martin-Marero A, et al. Supporting cells as a target of cisplatin-induced inner ear damage: therapeutic implications. Laryngoscope 2004;114:533-7.
• Reavis KM and many others. Distortion-Product Otoacoustic Emission Test Performance for Ototoxicity Monitoring Ear&Hearing2011;32;61–74
• Rubin JS, Wadler S, Beitler JJ, Haynes H, Rozenblit A, McGill F, Goldberg G, Runowicz C. Audiological findings in a Phase I protocol investigating the effect of WR 2721, high-dose cisplatin and radiation therapy in patients with locally advanced cervical carcinoma. J Laryngol Otol 1995 Aug;109(8):744-747.
• Rybak LP, Husain K, Morris C, Whitworth C, Somani S. Effect of protective agents against cisplatin ototoxicity. Am J Otol 21:513-520, 2000
• KALKANIS JG, Whitworth C, Rybak LP. Vitamin E reduces cisplatin ototoxicity. Laryngoscope 2004;114:538-42.
• Salvinelli F, Casale M, Vincenzi B, Santini D, Di Peco V, Firrisi L, Onori N, Greco F, Tonini G.Bilateral irreversible hearing loss associated with the combination of carboplatin and paclitaxel chemotherapy: a unusual side effect. J Exp Clin Cancer Res 2003 Mar;22(1):155-8
Vasodilatatori diretti
Nitroprussiato di sodio
Livello «azione e caratteristiche del danno: è stato osservato che l’esposizione diretta della coclea a nitroprussiato determina perdita delle cellule ciliate interne cocleari dei giri basali, mentre continuando l’esposizione si è assistito ad un coinvolgimento delle cellule ciliate esterne apicali. A nessuna dose e per nessun periodo di esposizione si sono osservati danni alle cellule ciliate interne api- cali (Ruan et al.. 1997).
Antivirali
Inibitori della trascrittasi inversa
Caratteristiche del danno: in letteratura sono stati segnalati alcuni casi di ototossicità da utilizzo di antivirali in pazienti affetti da sindrome da immunodeficienza acquisita. In uno studio recente effettuato su pazienti affetti da HIV in terapia con inibitori della trascrittasi inversa, con storia di esposizione a rumore e in presenza di ipoacusia da rumore, è stato osservato un progressivo declino dell’udito dopo l’inizio della terapia antiretrovitale (Sirndon et aL, 2001).
ANTIMALARICI

DERIVATI chinino
|
FARMACI |
Vestibolotossicità |
Cocleotossici |
Commento |
|
Quinidex |
No |
Sì |
Acufene |
|
Atabrine |
No |
Sì |
|
|
Plaquenil |
No |
Sì |
|
|
Chinina solfato |
No |
Sì |
|
|
meflochina (Lariam) |
Probabile |
Sì |
Acufeni e vertigini |
|
Idrossiclorochina |
Improbabile |
Raro |
La perdita dell’udito |
|
Clorochina (Malaquin) |
Nessun rapporto |
Sì |
Acufene |
Commento: Mentre l’ingestione di chinino può causare sindrome che comprendono tinnitus, sordità neurosensoriale e vertigini (Obasikene et al, 2012), i farmaci derivati dal chinino raramente sono di per sé una fonte di sofferenza dell’udito. Alcuni derivati del chinino, come la eflochina (Larium) impiegata per la prevenzione della malaria raramente causano acufeni significativi e duraturi. C’è anche qualche sospetto di vestibolotossicità e tossicità del CNS (Dow et al, 2006). Studi recenti suggeriscono che la chinina altera la motilità delle cellule ciliate esterne (Jarboe e Hallworth, abstract ARO, 1999, N ° 237).
Clorochina
Livello d’azione e caratteristiche del danno: in animali da esperimento esposti a clorochina sono stati osservati danni alle cellule ciliate interne ed esterne per dosi superiori a 40 mg/Kg (Sykes et al.. 1984).
Chinino
Livello d’azione e caratteristiche del danno: come per i salicilati l’ototossicità del chinino è multifattoriale. Sono stati evidenziati danni diretti alle cellule ciliate, ma viene considerato quale fattore patogenetico anche la vasocostrizione e la conseguente riduzione del flusso ematico cocleare (Jung et al., 1993). In uno studio condotto su pazienti trattati con chinino (massima concentrazione plasmatica di 2 rng/L) è stata osservata l’insorgenza di ipoacusia neurosensoriale per le alte frequenze (20 dB a 14 kHz) dopo circa un anno di esposizione, reversibile al termine del trattamento. E stato quindi ipotizzato che l’ototossicità del chinino alle dosi terapeutiche per la malaria, sia un effetto collaterale comunque reversibile (Tange et al, 1997).
Meflochina
Caratteristiche del danno: sono stati descritti casi di ipoacusia neurosensoriale insorta in pazienti sottoposti a profilassi antimalarica con meflochina (Fusetti et al., 1999).
Idroclorochina
In letteratura sono stati segnalati alcuni casi di ipoacusia neurosensoriale in- sorta in soggetti esposti per alcuni anni alle dosi terapeutiche di idroclorochina (Johansen et al.. 1998; Seckin et al.. 2000).
Riferimenti:
- Bortoli R, Santiago M. Chloroquine ototoxicity. Clin Rheumatol. 2007 Novembre, 26 (11) :1809-10. Epub 2007 27 giu.
- Cardoso, B, et al. Brasile. Revista da Sociedade Brasileira de Medicina Tropicale 1996; 29 (3) :251-257.
- De Souza JM, et al. Un double_blind di fase II / III, dose_finding studio clinico di una combinazione di meflochina, pirimetamina, e pirimetamina (Fansimef) in malaria falciparum. Bollettino dell’Organizzazione Mondiale della Sanità 1987; Il 65: 357_361.
- Dow G e altri. Meflochina induce dose-correlati effetti neurologici in un modello di ratto. Agenti antimicrobici e la chemio, 2006, 50: 1045-1053
- Lysack, JT, et al. Una grave reazione avversa per la profilassi meflochina e clorochina. Australiana Famiglia Medico 1998; 27 (12): 1119-1120.
- Fusetti M, Eibenstein A, Corridore V, Hueck S, Chiti-Batelli S: Meflochina ed ototossicit: descrizione di tre CASI. Clinica Terapeutica (Roma) 1999; 150: 379-382. Un estratto di questo studio può essere trovato in PubMed:
- Obasikene, G., P. Adobamen, et al. (2012). “La prevalenza di ototossicità all’Università di Benin Teaching Hospital, Benin città:. Una revisione di 5 anni” Niger J Clin Pract 15 (4): 453-457.
Ringraziamo Lariam Action USA (sito web http://www.lariaminfo.org /), per la fornitura di alcuni dei riferimenti di cui sopra relativa al Lariam.
Salicilati e antinfiammatori non steroidei
Livello d’azione e caratteristiche del danno: generalmente salicilati e FANS determinano danni uditivi reversibili sulle alte frequenze. Questi includono Advil, Nuprin, Motrin (ibuprofene), Aleve, Naprosyn, Anaprox (Naproxen), Feldene, Dolobid, Indocin, Lodine, Relafin, Toradol, Volteran, i salicilati: Aspirina, Disalcid, Bufferin, Ecotrin, Trilisate, Ascriptin, Empirin, Excedrin, Fiorinal. Arthrotec (diclofenac e misoprostel) è stato associato con l’acufene e la riduzione dell’udito (Bombardier, Peloso et al. 1995). Secondo alcuni autori il danno da rumore può essere esacerbato dall’assunzione ditali farmaci. mentre secondo altri ciò non si verifica. Il meccanismo fisiopatogenetico alla base del1 ototossicità dei salicilati appare multifattoriale; studi morfologici hanno escluso danni cocleari permanenti. Dati morfologici, elettrofisiologici e in vitro hanno osservato un coinvolgimento delle cellule ciliate esterne, ed appare possibile un danno mediato dalla diminuzione della perfusione cocleare. La diminuzione delle prostaglandine. mediata da salicilati e FANS. associata all’aumento dei leucotrieni sembra spiegare l’ototossicità di questi farmaci (Jung et al., 1993).
Idrocodone in combinazione con acetaminofene (es. Vicodin), è stata anche associata con perdita di udito (Friedman, Casa et al 2000.. Oh, Ishiyama et al 2000). Un simile caso di sordità associata a MethodOne è stato anche segnalato (Vorasubin et al, 2013). Sordità completa, trattati con un impianto cocleare, può verificarsi in persone dipendenti da questi farmaci. Questo quadro clinico è talvolta confusa con la malattia autoimmune dell’orecchio interno .
Fiorinal contiene aspirina, che è ben conosciuto per essere un ototoxin in grado di provocare una perdita uditiva neurosensoriale e tinnito (Brien 1993).
Negli polveri mal di testa contatore anche comunemente contengono aspirina o composti correlati (salicilati) e quindi hanno un potenziale di causare la tossicità udienza.
DIURETICI ototossici
|
Farmaci |
Vestibolotossici |
Cocleotossici |
Commento |
|
Lasix (furosemide) |
No |
Sì |
Raramente significativo |
|
Bumex (bumetanide) |
No |
Sì |
Meno di Lasix |
|
Edecrin (acido etacrinico) |
No |
Sì |
Uguale lasix |
|
Piretamide |
Diuretici dell’ansa
Una maggiore probabilità di ototossicità si verifica con diuretici dell’ansa quando vengono somministrati contemporaneamente con un antibiotico aminoglicoside . I diuretici includono:
• bumetanide (Bumex)
• acido etacrinico (Edecrin)
• furosemide (Lasix)
• torsemide (Demadex)
Nota: l’ Idroclorotiazide (HCTZ) e Maxide-diuretici comunemente prescritti per le persone con malattia di Ménière o altre forme di idrope endolinfatica sono diuretici dell’ansa.
Furosemide
Livello d’azione e caratteristiche del danno: l’ototossicità della furosemide è dimostrata già da tempo (Witworth et al.. 1993: Mills et al.. 1997). I meccanismi alla base dell’effetto tossico sono ancora dibattuti. Alcuni autori hanno ipotizzato che l’effetto sia imputabile all’interferenza nel trasporto di membrana del Na, K e Ci a livello cocleare (Ikeda et al., 1997).
|
|
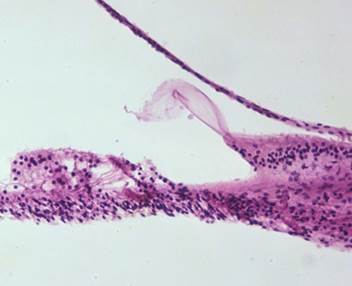
Titolo: R231 Furosemide Ototossicità Capitolo: Intossicazione sezione Capitolo: Furosemide (Lasix) Numero TB Caso: 415 Sesso: Maschio Età : 59 Otologic Dx: 1. Infiltrati linfatici nei tessuti molli e nello spazio dove sono i liquidi dell’orecchio interno, grave, e bilaterale 2. Emorragie sugli spazi perilinfatici, bilateralmente più gravi sulla destra 3. Atrofia dell’organo del Corti con grave perdita di cellule ciliate, bilateralmente 4. Degenerazione |
Diuretici generalmente considerati sicuri: Clorotiazide
Rybak LP. Ototossicità Furosemide: aspetti clinici e sperimentali. Laringoscopio 1985 Settembre; 95 (9 Pt. 2 Suppl 38) :1-14.
Altri
Interferone alfa 2°
L’ototossicità dell’interferone alfa 2a è stata dimostrata in studi sperimentali condotti su animali.
In gruppi di animali da esperimento esposti a diverse dosi di interferone alfa 2a sono state osservate alterazioni istologiche cocleari conseguenti all’esposizione a tale farmaco.
Rispetto ai controlli, la coclea degli animali esposti ad interferone, ha evidenziato una diminuzione dei fibroblasti nel limbo spirale, associata alla formazione di importanti vacuoli citoplasmatici di queste cellule, non evidenziati nei controlli non esposti. Non è stata però osservata morte delle cellule ciliate (Akyol et al, 2001).
Tirapazamina
La somministrazione di tirapazamina può indurre effetti ototossici irreversibili (Wouters et al, 2001).
Ioduro di potassio
Livello d’azione/caratteristiche del danno: recentemente è stato descritto un caso di deficit cocleovestibolare acuto dopo applicazione topica di una soluzione di ioduro di potassio in un orecchio. Nonostante i sintomi vestibolari siano progressivamente scomparsi, al termine dell’esposizione è residuata un importante ipoacusia neurosensoriale nonostante trattamento in camera iperbarica e somministrazione endovenosa di corticosteroidi e vasodilatatori (Boudewyns et al., 2001).
Perossido di idrogeno
Livello «azione: isolando cellule cocleari di Hensen di cavie in presenza di perossido di idrogeno è stata osservata inibizione della conduttanza gap giunzionale tra le cellule. Questa inibizione è alla base dei meccanismi fisiopatologici che vengono utilizzati per spiegare l’ipoacusia da rumore da esposizione ad ototossici quali aminoglicosidi in associazione alla produzione di radicali liberi (Todtetal., 2001).
Preparazioni otologiche
Livello d’azione/caratteristiche del danno: molti studi hanno dimostrato l’ototossicità delle comuni preparazioni otologiche come le gocce di corticosporina. In un recente studio cellule ciliate esterne cocleari isolate sono state trattate con “Cortisporina’. Cipro HC. “Ciloxan” e Floxin”. Al termine dello studio si è osservato che “Corticosporina’ è caratterizzata da una maggiore tossicità sulle cellule ciliate esterne e tra i fluorochinoloni “Floxin” è caratterizzato da una maggiore tossicità rispetto a “Cloxan” e “Cipro HC’.
|
|
|
|
|
Ototossicità da Tobramicina Hain, MD
|
|
|
La gentamicina è la causa più comune di perdita vestibolare bilaterale che incontriamo nella nostra pratica ( Vertigini e udito Chicago ). |
La tobramicina è un farmaco antibiotico. E’ più frequentemente usato in soggetti con fibrosi cistica che sviluppano infezioni polmonari ricorrenti con organismi resistenti come Pseudomonas. Tassi di ototossicità in unità fibrosi cistica eseguiti fino al 20% (Soulsby et al, 2009). Ototossicità sembra principalmente essere correlata con l’uso endovenoso, piuttosto che con l’uso per via inalatoria (Chuchalin et al, 2009). La tobramicina è usata raramente nella dialisi peritoneale (CAPD), dove il farmaco può persistere nel sangue per 72-96 ore (Mars et al, 2000). Mentre sappiamo di casi di ototossicità segnalati per questo protocollo, sembra probabile che questo effetto sia poco frequente solo per la rarità del suo utilizzo per CAPD.
|
|
|
. Audiogramma di paziente con ototossicità avanzata da tobramicina. la funzionalità uditiva è perduta alle alte frequenze |
La tobramicina è un ototossico misto, che causa ipoacusia da (ototossicità cocleare) e disturbi dell’equilibrio (ototossicità vestibolare). La ototossicità cocleare inizia alle alte frequenze, e si estende alle frequenze più basse con dose maggiori.
Alcuni autori suggeriscono che non vi è alcuna perdita di udito dopo l’uso tobramicina nei pazienti affetti da fibrosi cistica (Sheenstra et al, 2010). Questo è in qualche modo contrario alla nostra esperienza (es Figura 1.2), nonché contraria letteratura animale – tobramicina è un ototossico misto negli animali. Tuttavia, abbiamo visto alcuni esempi di una “wipeout vestibolare” e udito normale, simile alla situazione che si trovano comunemente con ototossicità gentamicina. La nostra posizione su questo è che la funzione vestibolare è probabilmente più sensibili alla tobramicina che sentire e, nonostante questo, con la droga sufficiente, sia danneggiato. Questa non è la situazione di consueto con gentamicina dove sentite la tossicità è molto insolito.
Sembra anche probabile che la tossicità da tobramicina dipenda dalla dose media utilizzata per lunghi periodi di tempo (ad esempio un anno). In altre parole, è probabile un effetto tempo . Vedi questa pagina per ulteriori dettagli sulla previsione di tossicità .
La vestibolotossicità da tobramicina è un vestibolopatia bilaterale, discusso più in dettaglio qui , si verifica quando sono danneggiate entrambe gli organi dell’equilibrio dell’ orecchio interno. I sintomi includono tipicamente squilibrio e sintomi visivi. Lo squilibrio è peggio nel buio, o in situazioni in cui basamento è incerto. Spinning vertigine è insolito.
|
|
Quando una persona ha un danno vestibolare bilaterale, come quelle che possono derivare da tossicità tobramicina, possono sperimentare oscillopsia. Quando la testa è in movimento, oggetti sfocatura. Quando si guida si può essere in grado di vedere i segni chiaramente su una strada accidentata. |
I sintomi visivi, chiamati “oscillopsia”, si verificano solo quando la testa è in movimento. Un film che mostra oscillopsia, da uno dei nostri educativa DVD , può essere visto cliccando qui . L’oscillopsia si verifica spesso durante la deambulazione (Freyss et al, 1988). Movimenti rapidi della testa sono associati con un offuscamento transitorio della vista. Ciò può causare difficoltà a vedere i segni durante la guida, o il riconoscimento delle facce mentre si cammina.
|
|
|
|
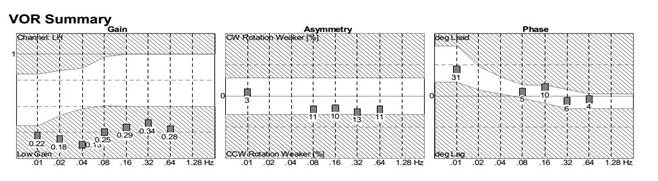
Audiogramma di persona esposta a tobramicina, con la perdita quasi totale delle risposte vestibolari sulla prova sedia rotatoria. La funzione uditiva comunemente è normale sino a 4000 Hz, e poi decade a frequenze più alte. |
OAE della stessa persona come a sinistra. Anche se la funzione vestibolare è notevolmente ridotta nel test rotatorio, le OAE sono normali sino a circa 10K. |
|
|
|
Caso T2 – risposte della sedia rotatoria molto bassa dopo un somministrazione di tobramicina IV. I punti di guadagno / fase più bassi non sono precisi (non c’era quasi nessuna risposta). |
|
|
|
|
Caso T2: audiometria quasi normale, senza perdita di alta frequenza. |
Caso T2: OAE di sono anche abbastanza buono per l’età, anche se la funzione vestibolare è molto povera. |
Altro che tobramicina, ci sono numerosi altri aminoglicosidi ototoxins .
Patologia
Negli studi patologici, grave tossicità degli aminoglicosidi è associato con la morte delle cellule ciliate dell’orecchio interno (Plogar et al, 2001). Le dosi che non sono abbastanza per uccidere le cellule dei capelli possono danneggiare i loro capelli sensibili al movimento (sterocilia), che li rende incapaci di rispondere al movimento, almeno per alcuni mesi. (Oei, Segenhout et al. 2004).
Gli studi osso Più temporali con gli esseri umani sono assolutamente necessarie! Se si dispone di tobramicina ototossicità, perche donare l’orecchio interno al Registro osso temporale , in caso di decesso.
Dosaggio della tobramicina:
Secondo Bragier e Brown (1998), l’emivita della tobramicina nei bambini con fibrosi cistica è 2.3h. Questo è simile allasituazione con gentamicina . Secondo Cipolle et al (1980), l’emivita varia 0,5-8,6 ore. Questo è più di una variazione di 10 volte, e suggerisce che il monitoraggio dei livelli è prudente.
Tipica dosaggio IV iniziale di tobramicina è di 10 mg / kg / die, regolato con livelli (Prescott e Nagel, 2010). Ciò a fronte di tipico dosaggio IV per Gentamicina essere circa 5 mg / kg / die. In altre parole, tobramicina viene somministrata in dosi elevate. Nella nostra esperienza, i pazienti con significativo ototossicità tobramicina hanno avuto almeno un corso per via endovenosa per 4 settimane o più.
Inalatoria tobramicina non è segnalato per essere ototossica (Chuchalin et al, 2009), anche se c’è un singolo caso clinico di esso si verificano in un paziente che aveva anche insufficienza renale.
Ci aspetteremmo che il dosaggio peritoneale di tobramicina è molto ototossici, ma sappiamo di non case report o serie che confermano questo. Nikolaidis et al (1991) ha trovato alcuna prova di udito tossicità.
In donne in gravidanza , Bourget et al (1991) ha suggerito che c’era clearance inferiore nel terzo trimestre, come pure la possibilità di accumulo di tobramicina nel feto.
Come gentamicina , tobramicina e furosemide (un diuretico) interagiscono. Kaka et al (1984) hanno riportato che furosemide riduce il volume di distribuzione, che possono aumentare i livelli. Come furosemide è ototossico sé, è ototossicità può aggiungere a quella di tobramicina. Altri diuretici dell’ansa è probabile simili.
Sembra probabile che tobramicina e Vancomicina dato insieme in forma endovenosa aumenterebbero ototossicità, come è il caso con gentamicina. Tuttavia, la letteratura tace su questa situazione.
Gentamicina e metronidazolo (Flagyl) probabilmente hanno una sinergia per la tossicità, e ci si aspetterebbe che la tobramicina e metronidazolo avrebbero anche ototossicità più combinato di uno dei due soli. Anche in questo caso, nessuna letteratura.
Sembra anche probabile che tobramicina data topica in un orecchio con una perforazione sarebbe, come gocce gentamicina, essere ototossico. Tobradex (tobramicina desametasone) gocce sono commercializzati per l’uso negli occhi, e gocce oculari sono a volte utilizzati nell’orecchio. Non sappiamo di casi di ototossicità segnalati da questa situazione. Estrapolando da altri aminoglicosidi contenente gocce, la tossicità probabilmente richiederebbe settimane di trattamento.
Vedi questa pagina per ulteriori discussione su di dosaggio.
Diagnosi
Diagnosi non è difficile. Ciò che è richiesto è l’esposizione alla tobramicina, la documentazione di sostanziale vestibolare bilaterale e / o riduzione dell’udito, e l’esclusione di alternative ragionevoli.
Per quanto riguarda la documentazione della riduzione vestibolare bilaterale (paresi), la prova con sedia rotatoria è preferita. la prova calorica a volte può indicare l’assenza di funzione ,anche quando in realtà vi è una notevole funzione. I VEMP’s sono ridotti o assenti nella maggior parte dei casi di rilevante ototossicità da aminoglicosidi. Nulla è stato segnalato finora in ototossicità tobramicina.
C’è un problema quando non si fanno prove caloriche con ghiaccio , o si utilizza l’aria, in quanto questi test sono a volte falsamente positivi. I Test di rotazione attiva della testa come il ” Vortec “o” IVA “ sono meno sensibili ai test sedia rotatoria.
L’esame audiometrico è generalmente utile in quanto la tobramicina colpisce sia l’udito e la funzione vestibolare. D’altra parte, il test della fistola e l’ABR hanno ruolo diverso per escludere diagnosi alternative.
Diagnosi alternative che dovrebbero essere considerati sono altre atassie sensoriali (perdita soprattutto propriocettiva, che si può essere trovare nei diabetici), atassie cerebellari, ipotensione ortostatica , VPPB , e simulazione di malattia(principalmente riscontrato in situazioni in cui gli infortunati sperano di essere pagati perché sono malati – Inoltre vedi qui ).
Prevenzione – monitoraggio della funzione vestibolare o acustica
A questa scrittura, non ci sono in corso protocolli di monitoraggio dell’orecchio interno che sono di uso comune e che possono impedire attendibile della tossicità tobramicina, e sembra improbabile che essi sono ancora possibili. La difficoltà è che la tossicità è ritardata – che non causi sintomi clinici per una settimana dopo l’assunzione, e danno può progredire dopo che il farmaco è fermato.
Fausti e colleghi (1994) hanno utilizzato l’audiometria ad alta frequenza, nel tentativo di individuare l’ototossicità. Solo il 37% di orecchi testati in questo modo hanno mostrato una significativa riduzione, dopo il trattamento con diversi aminoglicosidi per una durata media di 11,4 giorni .
Può audiometria ad alta frequenza la segnalazione di ototossicità? Questo studio non affronta questo punto come i farmaci monitorati varia nella loro propensione a causare la perdita dell’udito e inoltre non c’era alcun tentativo di correlare vestibulotoxicity con i risultati audiometrici. Un altro problema è che le persone anziane perdono generalmente alte frequenze in ogni caso, senza lasciare nulla di misurare.
Otoemissioni acustiche , in particolare quelle ottenute a frequenze estremamente alte, hanno un potenziale per rilevare l’ototossicità. (Orts et al, 2000) Non si è trovata la loro utilità nella pratica per il fatto, che gli anziani in genere non hanno OAE, le persone ancora più giovani spesso non hanno OAE ad alta frequenza e praticamente le OAE non sembrano siano molto sensibili alla tobramicina. In realtà, Katbamna et al (1999) hanno riferito che le ampiezze dei DPOAE non erano significativamente differenti nei pazienti trattati.
Nelle figure di cui sopra, le OAE sono conservate alle frequenze più basse mentre la funzione vestibolare è perduta. In altre parole, anche se ad altissima frequenza DPOAE può essere sensibile a ototossicità, finora, non ci sono dati per essere sicuri. Inoltre, è improbabile che possano essere specifico a causa del tasso elevato che goccia ad alta frequenza di DPOAE fuori, a causa di cose come l’ascolto di musica ad alto volume.
Katbamna et al (1998) suggeriva che una maggiore soppressione controlaterale può essere il primo segno di sviluppo di ototossicità da tobramicina. E ‘sconcertante per noi che la valorizzazione di ogni risposta deve essere un segno precoce di un farmaco distruttivo.
Altri approcci alla prevenzione sono discussi qui .
Altri dati
Si prega di consultare la nostra bilaterale vestibulopathy pagina per ulteriori informazioni riguardanti la diagnosi, il trattamento, la prognosi, e gli sforzi di ricerca relativi alla ototossicità vestibolare.
Inoltre, ![]() Comprendere il vostro vertigini e disturbi dell’equilibrio DVD ha un segmento drammatico che illustra oscillopsia.
Comprendere il vostro vertigini e disturbi dell’equilibrio DVD ha un segmento drammatico che illustra oscillopsia.
Riferimenti:
References:
- Bourget, P., H. Fernandez, et al. (1991). “Pharmacokinetics of tobramycin in pregnant women. Safety and efficacy of a once-daily dose regimen.” J Clin Pharm Ther 16(3): 167-176.
- Chuchalin, A., E. Amelina, et al. (2009). “Tobramycin for inhalation in cystic fibrosis: Beyond respiratory improvements.” Pulm Pharmacol Ther 22(6): 526-532.
- Cipolle, R. J., R. D. Seifert, et al. (1980). “Systematically individualizing tobramycin dosage regimens.” J Clin Pharmacol 20(10): 570-580.
- Kaka, J. S., C. Lyman, et al. (1984). “Tobramycin-furosemide interaction.” Drug Intell Clin Pharm 18(3): 235-238.
- Katbamna, B., D. N. Homnick, et al. (1998). “Contralateral suppression of distortion product otoacoustic emissions in children with cystic fibrosis: effects of tobramycin.” J Am Acad Audiol 9(3): 172-178.
- Katbamna, B., D. N. Homnick, et al. (1999). “Effects of chronic tobramycin treatment on distortion product otoacoustic emissions.” Ear Hear 20(5): 393-402.
- Mars, R. L., K. Moles, et al. (2000). “Use of bolus intraperitoneal aminoglycosides for treating peritonitis in end-stage renal disease patients receiving continuous ambulatory peritoneal dialysis and continuous cycling peritoneal dialysis.” Adv Perit Dial 16: 280-284.
- Nikolaidis, P., S. Vas, et al. (1991). “Is intraperitoneal tobramycin ototoxic in CAPD patients?” Perit Dial Int 11(2): 156-161.
· Orts Alborch, M., A. Morant Ventura, et al. (2000). “[Monitoring drug ototoxicity with distortion products].” Acta Otorrinolaringol Esp 51(5): 387-395.
· Prescott, W. A., Jr. and J. L. Nagel (2010). “Extended-interval once-daily dosing of aminoglycosides in adult and pediatric patients with cystic fibrosis.” Pharmacotherapy 30(1): 95-108.
- Scheenstra, R. J., H. G. Heijerman, et al. (2010). “No hearing loss after repeated courses of tobramycin in cystic fibrosis patients.” Acta Otolaryngol 130(2): 253-258.
- Soulsby, N., S. Bell, et al. (2009). “Intravenous aminoglycoside usage and monitoring of patients with cystic fibrosis in Australia. What’s new?” Intern Med J 39(8): 527-531.
OTOTOSSICI PROFESSIONALI
Solventi organici
I derivati del benzene (toluene, stirene, xilene) appartengono alla classe degli idrocarburi aromatici monociclici e sono assorbiti prevalentemente per via inalatoria. Non sono stati osservati effetti ototossici in tutti i lavoratori esposti a derivati benzenici, e la gravità del danno, qualora si manifesti, sembra correlata a diversi parametri tra i quali principalmente la diversa suscettibilità individuale all’azione di questi tossici.
Livello d’azione: le alterazioni isto funzionali più evidenti, conseguenti all’azione tossica dei solventi considerati, si manifestano principalmente a livello dei distretti anatomici più ricchi in lipidi, quali il sistema nervoso centrale e periferico, il fegato ed il midollo osseo, ma spiccano comunque per gravità e frequenza i disturbi del sistema nervoso e dell’epitelio stato-acustico. I disturbi audiovestibolari da inalazione dei vapori di derivati benzenici costituiscono l’iniziale e spesso unica manifestazione dell’ototossicità dei solventi organici. La complessità delle funzioni del labirinto, le sue elevate esigenze metaboliche ed energetiche e la sua discreta capacità di adattamento alle noxae chimiche spiegano perché l’area labirintica sia quella che più precocemente di ogni altra manifesta i segni di una sofferenza da agenti tossici (Pollastrini et al., 1994).
In uno studio condotto su 53 soggetti esposti cronicamente a vapori di benzene sono state valutate le alterazioni più precoci a carico delle funzioni vestibolo-oculomotorie e del sistema uditivo, conseguenti all’inalazione di derivati benzenici alle concentrazioni normalmente ammesse per l’aria degli ambienti di lavoro. I lavoratori sono stati sottoposti. oltre che ad una batteria di test vestibolari ed oculomotori, anche ad una serie di esami audiologici. Al termine dello studio i dati ottenuti dall’audiometria tonale liminare sono risultati nel range di normalità, mentre i’ audiometria vocale sensibilizzata, considerata strumento sensibile di diagnosi di lesioni corticali comprendenti la corteccia uditiva, ha evidenziato una riduzione di vario grado dell’intellegibilità in una percentuale superiore al 50% dei soggetti. In 24 soggetti le lesioni erano bilaterali mentre in 7 soggetti interessavano solo l’orecchio sinistro. Tale rilievo ha consentito di ipotizzare, come già evidenziato in passato (Larsby et al., 1980; Odkvist et ah, 1982), che nella esposizione cronica ad idrocarburi aromatici si può avere un interessamento della corteccia cerebrale, anche se lesioni del tronco encefalico possono essere alla base di risposte alterate quando vengano interessate le vie uditive. In questo studio il riflesso stapediale, ritenuto un test attendibile e sensibile per la diagnosi precoce di patologie del tronco encefalico, è risultato normale (Pollastrini et al., 1994).
Esposizioni multiple: alcuni studi condotti su animali da esperimento hanno dimostrato che gli effetti ototossici dei solventi, quando si ha un’esposizione combinata, mostrano interazioni additive, taluni sinergiche, altri antagonistiche.
Effetto sinergico con il rumore: da tempo è noto che il rumore interagisce in modo sinergico con i solventi organici nella patogenesi dell’ipoacusia (Dayal et al., 1975; Young et al., 1987).
In uno studio recente è stato dimostrato che l’esposizione contemporanea a rumore e solventi organici, anche a concentrazioni infèriori ai TLV, determina un danno uditivo (da insulto coclearie e corticale) maggiore della sola esposizione a rumore (Sliwimska-Kowalaska et al., 2001).
Toluene
Livello d’azione, caratteristiche del danno e progressione: numerosi studi hanno dimostrato insorgenza di ipoacusia ed evidenziato danni cocleari in topi esposti a toluene (Morata et aL, 1994). L’esame morfòlogico della coclea degli animali esposti ha mostrato perdita o danno delle cellule ciliate della parte basale della coclea.
In uno studio condotto su cavie esposte a bassi livelli di toluene (250, 500, 1000 ppm per 8 ore giorno, per 5 giorni/settimana, per 1-4 settimane) è stato osservato un danno uditivo conseguente ad alterazione del metabolismo energetico delle cellule ciliate, in particolare è stata osservata una diminuzione dell’attività enzimatica di succinato deidrogenasi nella regione cocleare delle medie frequenze. Tale alterazione insorge acutamente, e nonostante sia stata osservata una progressione della disfunzione uditiva da I a 4 settimane di esposizione, questi soggetti non hanno sviluppato un danno permanente, infatti non si è assistito a morte delle cellule ciliate. Questo studio evidenzia quindi un danno precoce al sistema uditivo della cavia esposta a basse dosi di toluene per deficit nel metabolismo energetico delle cellule ciliate (McWilliams et al., 2000).
In uno studio condotto su topi esposti a toluene è stato dimostrato che il danno interessa principalmente le alte frequenze (Johnson et al., 1988).
In un altro studio nel quale animali da esperimento sono stati esposti a livelli di toluene di 1750 ppm (per 6 ore/die, 5 giorni a settimana, per un mese) è stato osservato un deficit uditivo sia per frequenze di 12-14 kHz che 3-4 kHz (Books et al., 1999).
Effetto sinergico con il rumore: in uno studio trasversale sugli effetti dell’esposizione a rumore e solventi. Morata e collaboratori (1993) hanno dimostrato che esiste una interazione tra esposizione a rumore (88-98 dB) ed esposizione a toluene (100-365 ppm) nella genesi del danno uditivo. In un altro studio Morata e collaboratori (1997) hanno evidenziato che la prevalenza di ipoacusia in soggetti esposti a rumore e toluene, anche se al di sotto dei valori limite, era maggiore rispetto a gruppi di non esposti al solvente.
Altri studi hanno dimostrato che la simultanea esposizione a toluene e rumore determina un aumento della suscettibilità agli effetti uditivi di entrambi gli agenti (Morata et al.. 1994).
Relazione dose-risposta: in uno studio condotto su 193 donne non fumatrici e astemie esposte a toluene è stato dimostrato. suddividendo la casistica per classi di esposizione. che l’ipoacusia insorta in conseguenza a tale esposizione aveva un andamento dose-risposta, essendo correlata sia al tempo che all’intensità dell’esposizione (Lee-B-K et al., 1988).
Stirene
Tra i solventi organici l’ototossicità del toluene è stata spesso osservata in studi su animali.
Lo stirene è strutturalmente simile al toluene ed è ototossico per i topi.
Caratteristiche del danno e progressione: in alcuni studi è stato dimostrato che in lavoratori esposti a stirene in industrie plastiche non sono osservabili danni all’udito evidenziabili con l’audiometria; in particolare, in uno studio condotto da Sass-Kortsac e collaboratori (1995) su un gruppo di lavoratori di un’industria plastica, esposti a livelli di stirene inferiori a 50 ppm, non sono state osservate alterazioni a carico degli esami audiometrici.
E stato invece evidenziato un innalzamento della soglia uditiva in lavoratori esposti a bassi livelli di stirene.
Relazione dose-risposta: in questo studio l’innalzamento della soglia era direttamente proporzionale alla concentrazione di stirene nell’area respirabile. Inoltre è stata osservata una relazione dose-dipendente tra aumento della concentrazione di stirene nell’area respirabile, acido mandelico urinario e innalzamento della soglia uditiva.
Livello d’azione: molte sostanze ototossiche agiscono a livello dell’area cocleare corrispondente alle alte frequenze essendo questa la più suscettibile agli insulti dei farmaci.
I solventi organici, al contrario, determinano un danno iniziale che interessa le medie frequenze (Crofton et al., 1994), anche se studi condotti su animali esposti a stirene hanno evidenziato un coinvolgimento anche delle alte frequenze. Ciò ha condotto ad ipotizzare che l’ototossicità da stirene evidenzi una progressione dalle medie verso le alte frequenze (Marioka et al, 1999).
Effetto sinergico con il rumore: esposizione a stirene e rumore hanno effetto additivo nell’insorgenza del danno acustico (Morioka et al., 1999; Morata et al., 199.3).
Tricloro etilene
Livello d’azione e caratteristiche del danno: già da tempo è stato dimostrato che l’esposizione a tricloroetilene può determinare l’insorgenza di ipoacusia neurosensoriale con coinvolgimento delle alte frequenze in lavoratori esposti, anche se alcuni studi condotti su animali da esperimento hanno evidenziato l’insorgenza di ipoacusia a livello delle medie-alte frequenze (Rebert et al., 1991).
In uno studio più recente condotto su topi esposti a livelli di tricloroetilene variabili da 400 a 3200 ppm è stato osservato un calo uditivo corrispondente alle medie frequenze negli animali esposti alle dosi più alte di tricloroetilene (Crofton et al., 1997).
Solfuro di carbonio
Caratteristiche del danno: in uno studio effettuato per valutare il potenziale contributo di test audiologici ed otoneurologici per evidenziare intossicazioni da solfuro di carbonio sono stati testati 259 lavoratori esposti a varie concentrazioni di solfuro di carbonio (da 30 a 900 mg/m3) e a livelli di rumore compresi tra 84-88 dB. I test condotti su questo gruppo hanno evidenziato un aumento di incidenza di sintomi di patologie vestibolari ed ipoacusia neurosensoriale rispetto a quelli condotti su un gruppo di lavoratori esposti agli stessi livelli di rumore ma non esposti a solfuro di carbonio.
Effetto sinergico con il rumore: numerosi studi hanno dimostrato che l’incidenza di ipoacusia è maggiore negli esposti contemporaneamente a solfuro di carbonio e rumore ed inoltre che il grado di ipoacusia è maggiore nei co-esposti rispetto agli esposti agli stessi livelli di rumore, ma non a solfuro di carbonio (Morata et al., 1994).
Monossido di carbonio
Livello d’azione e caratteristiche del danno: numerosi autori hanno ipotizzato che il meccanismo attraverso il quale il monossido di carbonio provoca un danno a livello della coclea sia di tipo ischemico o da ipossia ipossica. In uno studio compiuto su ratti acutamente esposti a monossido di carbonio, è stata osservata una buona corrispondenza tra livelli ematici di carbossiemoglobina e declino della funzione cocleare, inoltre la sede preferenziale del danno è risultata essere localizzata alle alte frequenze (Tawackoli et al., 2001).
Effetto sinergico con il rumore: numerosi studi hanno dimostrato che la simultanea esposizione a monossido di carbonio e rumore incrementa il danno uditivo di quest’ultimo. Tossico e rumore hanno effetto sinergico (Young et al., 1987; Fechter et al.. 1995; Cary et al., 1997; Morley et al., 1999).
Ciò è stato spiegato tramite l’osservazione che il rumore può indurre danno cocleare riducendo la disponibilità di ossigeno nei tessuti attraverso un aumento della richiesta metabolica, e tale effetto associato all’ipossia indotta da tossici quali il monossido di carbonio facilita l’insorgenza del danno cocleare negli esposti a rumore e monossido di carbonio (Cary et al., 1997).
Cianuri
Livello d’azione, caratteristiche del danno e progressione: nello stesso studio di Tawackoli. descritto per il monossido di carbonio, gli animali da esperimento sono stati esposti acutamente anche a cianuro di potassio. In questo caso si è osservato che il danno cocleare, dopo somministrazione di cianuro. era più precoce rispetto a quello che si è osservato dopo esposizione a CO. Anche nel caso del cianuro si è osservato un maggior coinvolgimento delle alte frequenze. E stato però ipotizzato che la somministrazione di cianuro di potassio determini una progressiva distruzione della stria vascolare cocleare, interferendo con i canali di trasporto elettronico a livello di questa struttura metabolicamente attiva, mentre si ritiene che il bersaglio dell’azione ototossica del CO non sia la stria vascolare cocleare (Tawackoli et al., 2001).
Metilmercurio
Caratteristiche del danno: in topi esposti a dosi di metilmercurio di 4-8 mg/Kg è stato osservato un deficit uditivo per tutte le frequenze indagate (da 4 a 78 kHz) con maggior coinvolgimento delle alte frequenze (Books et al.. 1985).
Pesticidi
I dati riportati in letteratura circa l’ototossicità dei pesticidi sono ancora discordanti. In particolare. in un recente studio effettuato su 631 agricoltori è stata osservata una netta associazione tra deficit dell’udito e utilizzo di pesticidi. Tale risultato è però difficilmente interpretabile poiché la raccolta di informazioni sull’esatta tipologia di pesticidi utilizzati e il quantitativo è risultata difficoltosa. Inoltre l’operazione di applicazione dei pesticidi genera rumore. il che può contribuire all’ aggravamento dell’ ipoacusia (Beckett et al., 2000).
In un altro studio condotto su 9 lavoratori addetti allo spargimento di pesticidi da più di 20 anni è stato osservato un deficit uditivo conseguente a neurotossicità cronica (Horowitz et al.. 1999).
Statistiche sulla Ototossicità
L’Ototossicità può colpire chiunque riceve un trattamento CON I farmaci sopra elencati. Tuttavia, la probabilità di sviluppare ototossicità è altamente dipendente quale farmaco viene somministrato, alla durata dell’uso, e diversi altri fattori sottostanti, come funzione renale e l’uso di altri farmaci ototossici allo stesso tempo.
Circa il 10% delle persone che prendono antibiotici aminoglicosidici esperienza ototossicità, anche se fino al 33% è stata riportata anche in pazienti adulti, con una probabilità del 3% di tale danno sia permanente. In generale, ototossicità si verifica più comunemente negli adulti che nei bambini e neonati, dove il tasso di incidenza è di circa il 2%. Tossicità vestibolare da aminoglicosidi è documentato a verificarsi in circa il 4% dei pazienti adulti e circa il 2% dei pazienti trattati con il rapporto gentamicina perdita dell’udito.
Nei pazienti in trattamento con il cisplatino agente anti-cancro, ototossicità può verificarsi in circa il 50% dei pazienti. La velocità e la gravità di ototossicità è maggiore nei bambini e nei pazienti che hanno avuto precedente radioterapiaalla testa e al collo. Circa il 60% dei bambini trattati con chemioterapia a base di platino esperienza di perdita dell’udito.
C’è una incidenza 6% e 0,7% di ototossicità dai diuretici, furosemide e acido etacrinico, rispettivamente. Fino al 1% dei pazienti riferisce ototossicità da aspirina, anche se questo si verifica più frequentemente negli anziani.
Fattori di rischio per Ototossicità
Ci sono alcuni fattori che possono mettere i pazienti ad aumentato rischio di ototossicità:
· Dose e la durata della terapia
· Velocità di infusione e la dose cumulativa di vita
· Funzione renale alterata, che può portare ad un rapido accumulo del farmaco ototossico
· La somministrazione concomitante di un altro farmaco ototossici (ad esempio aminoglicosidi e di diuretici dell’ansa)
· Età
· Perdita dell’udito preesistente, sordità neurosensoriale
· L’esposizione durante la gravidanza
· Precedente esposizione di testa e di radiazione del collo (per gli agenti chemioterapici)
· Suscettibilità genetica
· Storia familiare di ototossicità
Progressione dell’ Ototossicità
I sintomi di ototossicità possono verificarsi rapidamente o apparire mesi dopo la somministrazione. Spesso, nelle prime fasi, ototossicità non diagnosticata, come quando la perdita dell’udito è molto minimale o ristretta ad alti suoni acuti. E ‘di solito quando la perdita dell’udito raggiunge le frequenze vocali basse che i pazienti notano nulla, e da quel momento si è già verificato un danno permanente.
Gli aminoglicosidi sono noti per la loro capacità di provocare la perdita permanente dell’udito, normalmente precedute da tinnito acuto e una graduale perdita dell’udito che inizia nelle frequenze più alte. Perdita di sensibilità vestibolare può anche essere permanente, e può causare visione del paziente di oscillare o rimbalzo.
Sintomi di aspirina e tossicità chinino sono dipendente dalla dose e sono generalmente reversibili. Essi sono caratterizzati da acufene e perdita di udito lieve. Grandi dosi di chinino, tuttavia, sono stati conosciuti per causare la perdita permanente dell’udito, in particolare nei pazienti anziani che assumono farmaci a lungo termine per i crampi alle gambe.
Gli agenti chemioterapici sono cause ben note di perdita che può essere grave e permanente dell’udito. La perdita dell’udito solito inizia come una perdita di alte frequenze in entrambe le orecchie, e progredisce ad una perdita di tutte le frequenze. La perdita dell’udito presenta come una sensazione di sentire voci soffocate. Effetti vestibolari (ad esempio perdita di equilibrio, incoordinazione, vertigini ) sono anche comuni. La perdita dell’udito si verifica in genere dopo 1-2 settimane di trattamento, anche se spesso può essere ritardata fino a 6 mesi dopo il trattamento.
Diuretici possono causare ronzio nelle orecchie o ridurre l’udito. Questo è di solito reversibile quando il trattamento viene interrotto.
I sintomi più comuni sperimentato da ototossicità sono:
· Acufene o ronzio nelle orecchie
· Perdita di udito bilaterale o unilaterale
· Incoordinazione dei movimenti
· Instabilità dell’andatura
· Visione oscillante o rimbalzare
Come viene diagnosticata l’Ototossicità?
Diversi test audiologici sono disponibili specifici che il medico può svolgere.Essi comprendono varie udito e prove di equilibrio. Questi dovrebbero essere effettuate prima dell’inizio del trattamento con un noto agente ototossico, così come durante il trattamento e dopo l’interruzione del trattamento.
· Tono di prova Pure conduzione aerea: Può rilevare piccolissime variazioni anche prima comparsa di acufeni, come la maggior parte agenti ototossici producono la perdita dell’udito nelle più alte frequenze per primo. La diagnosi precoce permette la modifica del trattamento prima frequenze vocali sono interessati.
· Pure tono osso di conduzione: Utilizzato per determinare la funzione neurosensoriale.
· Test di riconoscimento delle parole
· Test di Romberg: prova Balance per rilevare il danno vestibolare.
Per i neonati ei pazienti criticamente malati che sono allettati o coma, test alternativi sono disponibili:
· Emissioni otoacustiche (OAE): prevede l’utilizzo di un microfono per misurare i segnali che sono prodotte dalla coclea.
· Risposta uditivi del tronco encefalico (ABR): Misure funzione uditiva che utilizza le risposte prodotte dal nervo uditivo e il tronco encefalico. Aiuta a differenziare sensoriale da perdita dell’udito neurale.
Come un paziente recupera da ototossicità dipende dal tipo di farmaco e la dose e la durata del trattamento. Di solito la perdita dell’udito dal trattamento con cisplatino è irreversibile, considerando che si verificano da salicilati e chinino è più spesso reversibile.
La maggior parte delle sostanze chimiche ambientali sono associati con la perdita permanente dell’udito. Mercury è stato associato a problemi di equilibrio permanente.
Se i sintomi sono diagnosticati precocemente, allora la probabilità di guarigione è molto più alta. Tuttavia, la maggior parte dei pazienti non si accorgono di eventuali variazioni significative fino a quando è troppo tardi.
Come si tratta l’Ototossicità ?
Attualmente non ci sono trattamenti disponibili per ototossicità, oltre a ritirare il farmaco non appena si sospetta la tossicità. La prevenzione è fondamentale per evitare la perdita permanente dell’udito. Quando un noto agente ototossico è prescritto, l’udito frequenti e prove di equilibrio dovrebbero essere condotte, in particolare nei pazienti che sono ad alta rischio di insufficienza renale questa essere misurata prima di iniziare un farmaco ototossico.
Perdita di udito acuto spesso passa inosservato, e non è fino a quando una parola pronunciata non può essere sentito che i pazienti cercano di trattamento. A questo punto, il danno è in genere irreversibile. Questo è il motivo per test dell’udito regolari sono così importanti.
Ove possibile, i farmaci ototossici deve essere evitato, specialmente in combinazione.
I trattamenti disponibili sono volte a ridurre l’effetto del danno e ripristinare la funzione. Per ipoacusia grave e permanente, l’amplificazione usando apparecchi acustici o impianti cocleari può essere l’unica opzione di trattamento. Per ripristinare la funzione equilibrio perduto, terapia fisica può essere usato per aiutare riqualificare il cervello a sviluppare altri modi per mantenere l’equilibrio. Questo è spesso successo nei pazienti più giovani.
La ricerca ha scoperto che l’assunzione di taurina o un altro antiossidante (es. Vitamina E ) con il farmaco ototossico può essere in grado di ridurre la tossicità. Inhibitors di vie di morte cellulare sono anche oggetto di indagine, così come la terapia genica per aminoglicosidi ototossicità.
APPROFONDIMENTO
Aminoglicosidi
Fin dalla loro introduzione nel 1944,si sono resi disponibili molteplici preparazioni di aminoglicosidi, tra cui la streptomicina, diidrostreptomicina, kanamicina, gentamicina, neomicina, tobramicina, netilmicina, e amikacina. Gli aminoglicosidi sono antibiotici battericidi che si legano al ribosoma 30S e inibiscono la sintesi proteica batterica. Sono attivi solo contro i bacilli aerobi gram-negativi e cocchi.
Anche se gli effetti ototossici degli aminoglicosidi sono ben documentati, questa classe di farmaci ancora oggi è ampiamente usata. Gli aminoglicosidi possono essere utilizzati in combinazione con la penicillina contro gli stafilococchi, streptococchi, e, soprattutto, nell’endocardite da enterococchi. Un aminoglicoside è spesso aggiunto ad un antibiotico beta-lattamico, quando sono trattate gravi infezioni da Pseudomonas aeruginosa. Gli aminoglicosidi possono essere efficaci nel trattamento della tubercolosi. Alcuni gruppi particolari di pazienti, compresi quelli con fibrosi cistica , disfunzioni immunitarie e certe malattie infettive croniche, hanno maggiori probabilità di essere trattati con questa classe di antibiotici.
Di tutti i farmaci ototossici, gli aminoglicosidi sono i più vestibolotossici, anche se i loro effetti differenziali variano notevolmente sui sistemi vestibolare e cocleari.[2] kanamicina, amikacina, neomicina, e diidrostreptomicina sono preferenzialmente cocleotossici. La Gentamicina colpisce sia i sistemi cocleare ,che vestibolari; Tuttavia, la maggior parte degli autori considerano la gentamicina principalmente come vestibolotossico. La streptomicina, tobramicina e netilmicina sono principalmente vestibulotossici.
Fisiopatologia
La tossicità degli aminoglicosidi coinvolge principalmente il sistema renale e cocleovestibolare; Tuttavia, non esiste una chiara correlazione tra grado di nefrotossicità ed ototossicità. La tossicità cocleare che si traduce in una perdita di udito che di solito colpisce le alte frequenze ed è secondaria alla distruzione irreversibile delle cellule ciliate esterne dell’organo del Corti, prevalentemente a livello della zona basale della coclea. Nell’apparato vestibolare, le cellule cigliate di I tipo sono più sensibili delle cellule cigliate di II tipo . [3]
Gli aminoglicosidi sono liquidati più lentamente dai liquidi dell’orecchio interno che dal siero e quindi una latenza esiste al ototossica effetti di aminoglicosidi. Questa latenza può determinare la progressione della perdita o l’insorgenza della perdita uditiva dopo l’interruzione del trattamento aminoglicosidi dell’udito. E’ importante continuare a monitorare il paziente per gli effetti cocleotossici e vestibolotossici fino a 6 mesi dopo l’interruzione del trattamento con aminoglicosidi
I meccanismi esatti della ototossicità degli aminoglicosidi rimangono sconosciute. Molti processi cellulari sono stati implicati, e questo continua ad essere un’area attiva di ricerca. Sembra che gli agenti aminoglicosidi devono entrare nelle cellule ciliate i per indurre la morte delle cellule. [4] Dopo la penetrazione nelle cellule ciliate possono essere coinvolti, molti meccanismi e processi cellulari. Alterazione della sintesi proteica mitocondriale, formazione di radicali liberi dell’ossigeno, possono derivare dall’attivazione di c-Jun chinasi N-terminale (JNK), e dall’attivazione delle caspasi e nucleasi. Gli aminoglicosidi hanno anche dimostrato di avere effetti diretti sui potenziali di membrana cellulare attraverso le interazioni con i canali del potassio. [5] Inoltre, l’interazione degli aminoglicosidi con i metalli di transizione come il ferro e il rame potenziano la formazione dei radicali liberi con ulteriori danni alle cellule.
In definitiva, una certa interazione di molti di questi processi porta alla perdita permanente delle cellule ciliate sensoriali sia nella coclea che nell’apparato vestibolare, con conseguente perdita permanente dell’udito o dell’ equilibrio . [6, 7]
L’ototossicità degli aminoglicosidi è probabilmente multifattoriale, e si continua a studiare. Alcune ricerche stanno indagando sull’attività chelante del ferro e degli antiossidanti come possibili agenti per prevenire la perdita dell’udito durante la terapia, mentre altri studi stanno esplorando forme di terapia genica come future opzioni di trattamento. Attualmente, nessun trattamento è disponibile a parte l’utilizzo di protesi acustiche e di impianti cocleari ; Pertanto, la prevenzione è fondamentale.
Epidemiologia
In alcuni paesi, gli antibiotici sono prescritti liberamente o sono disponibili senza prescrizione medica. In queste aree, gli aminoglicosidi causano ben il 66% dei casi di sordomutismo. A seconda dell’ agente e del dosaggio, fino al 33% dei pazienti adulti trattati con aminoglicosidi possono avere cambiamenti audiometrici. Anche la tossicità vestibolare è ben documentata; si verifica in circa il 4% dei pazienti adulti. L’incidenza di pazienti che soffrono di tossicità dovuta agli aminoglicosidi sono in diminuzione a causa dei miglioramenti nel monitoraggio e della consapevolezza della ototossicità.
Gli studi indicano che la tossicità cocleare da aminoglicosidi è meno comune nei neonati e nei bambini che negli adulti. E’ stata stimata che l’incidenza di tossicità cocleare indotta da aminoglicosidi nei neonati sia intorno al 2%. [8]
Fattori di rischio
Alcuni fattori possono mettere i pazienti ad aumentato rischio di ototossicità. L’ ototossicità è più probabilità che si verifichi con dosi maggiori, livelli ematici più elevati o durata della terapia con aminoglicosidi. Altri pazienti ad alto rischio sono i pazienti anziani, quelli con insufficienza renale, quelli con problemi uditivi preesistenti, quelli con una storia familiare di ototossicità, e quelli che utilizzano diuretici o altri farmaci ototossici o nefrotossici.
Una predisposizione genetica esiste in una mutazione 1555A> G RNA mitocondriale, che si è trovata associata con una perdita uditiva non sindromica e aminoglicosidica indotta. [9] Il difetto crea un’alterazione nella sintesi delle proteine mitocondriali. Pazienti cinesi con questo difetto hanno effetti di ototossicità da aminoglicosidi più rapidi e gravi. Un’attenta valutazione della storia familiare è importante e può prevenire molti casi. Inoltre, alcuni hanno suggerito che le popolazioni ad alto rischio (ad esempio, pazienti con fibrosi cistica, una storia di famiglia, e disfunzione immunitaria) dovrebbero essere sottoposti a screening per questa mutazione. [10, 7]
Segni e sintomi
Clinicamente, il danno cocleare acuta può presentarsi come tinnito. Sordità precoce può non essere riconosciuti dal paziente e inizialmente manifesta come un aumento della soglia di frequenze più alte (> 4000 Hz). Con la progressione, frequenze vocali inferiori sono colpiti e il paziente può diventare sordi se il farmaco viene proseguita. Se il farmaco viene interrotto precocemente nel corso di danno, ulteriore perdita può essere impedito, e parziale recupero di soglie uditive può essere possibile. Tuttavia, la perdita è di solito permanente.
I sintomi di tossicità vestibolare includono tipicamente squilibrio e sintomi visivi. Lo squilibrio è peggiore al buio o in situazioni in cui basamento è incerto. Spinning vertigine è insolito. I sintomi visivi, chiamati oscillopsia, si verificano solo quando la testa è in movimento. Movimenti rapidi della testa sono associati con transitorio offuscamento della vista. Ciò può causare difficoltà di vedere i segni durante la guida o riconoscere i volti delle persone mentre si cammina. Clinicamente, nistagmo può essere presente come un segno precoce.
Prevenzione
Prevenzione della aminoglicosidi ototossicità comporta un attento monitoraggio dei livelli sierici di droga e la funzione renale, così come l’udito valutazioni prima, durante e dopo la terapia. Misurare basale funzione audiometrico prima della terapia; tuttavia, questo non è sempre possibile in situazioni acute. Somministrazione giornaliera riduce incidenza di ototossicità e dovrebbe essere considerata quando possibile. Coscienziosamente identificare i pazienti ad alto rischio e seleziona antibiotici alternativi per loro. Infine, perché aminoglicosidi rimangono nella coclea lungo dopo la terapia è terminata, istruire i pazienti ad evitare ambienti rumorosi per 6 mesi dopo il completamento della terapia in quanto rimangono più sensibili al rumore indotto danno cocleare.
Recenti studi sugli animali hanno coinvolto la somministrazione di spazzini dei radicali liberi, chelanti del ferro, e inibitori di vie di morte cellulare come possibili meccanismi di prevenzione ototossicità. Diversi agenti promettenti, compresa la vitamina E, acido alfa lipoico, Ebselen, e ginkgo biloba, sono stati trovati per essere otoprotective ed efficace in alcuni studi sugli animali. Ulteriori studi clinici sono necessari per determinare se i meccanismi protettivi dimostrato in studi su animali possono essere replicate in pazienti mantenendo effetti terapeutici degli aminoglicosidi. [11, 6]
Aminoglicosidi specifici
• Streptomicina: Streptomicina stato il primo aminoglicosidi applicata clinicamente ed è stato usato con successo contro batteri gram-negativi in passato.Streptomicina colpisce preferenzialmente il sistema vestibolare piuttosto che il sistema uditivo. Danno vestibolare dovuti alla streptomicina è comune con l’uso prolungato e in pazienti con funzione renale compromessa. A causa della sua tossicità, ed a causa della resistenza diffusa, questo agente è usato raramente oggi. Tuttavia, l’uso streptomicina è aumentato per il trattamento della tubercolosi.
• Gentamicina: Come con streptomicina, gentamicina ha una predilezione per il sistema vestibolare. Terapeutiche livelli sierici di picco di 10-12 mcg / ml sono generalmente considerati sicuri, ma possono ancora essere tossica in alcuni pazienti. Regolare accuratamente il dosaggio nei pazienti con malattia renale.
• Neomicina: Questo agente è uno degli aminoglicosidi più cochleotoxic quando somministrato per via orale e in dosi elevate; Pertanto, l’uso sistemico di solito non è raccomandato. Neomycin è tra i più lenti aminoglicosidi per cancellare dalla perilymph; di conseguenza, la tossicità ritardata (1-2 sett) può derivarne dopo la sospensione della terapia. Neomicina è usato principalmente come un efficace agente otic e ototopical. Anche se neomicina è generalmente considerato sicuro se usato per via topica nel canale uditivo o su piccole lesioni cutanee, alternative altrettanto efficaci sono disponibili.
• Kanamicina: Anche se meno tossico neomicina, kanamicina è abbastanza ototossico. Kanamicina ha una propensione a causare profonda danni alle cellule ciliate cocleari, marcata perdita di udito ad alta frequenza, e completa sordità.L’effetto dannoso è principalmente alla coclea, mentre il sistema vestibolare è solitamente risparmiato lesioni. Kanamicina ha limitato l’uso clinico di oggi. Come con neomicina, la somministrazione parenterale non è generalmente raccomandato.
• Amikacin: amikacina è un derivato di kanamicina e ha molto poco di tossicità vestibolare. I suoi effetti negativi riguardano principalmente il sistema uditivo;tuttavia, è considerata meno ototossico di gentamicina. Nel trattamento di infezioni gravi, amikacina è indicato principalmente sulla base dei risultati di test di sensibilità e la risposta del paziente.
• Tobramicina: Ototossicità di tobramicina è simile a quello di amikacina; ad alta frequenza risultati di perdita di udito. Come con kanamicina, la tossicità vestibolare è meno comune. La tobramicina è spesso utilizzato nelle preparazioni otic e di attualità. Uso topico, anche se non senza polemiche, è generalmente considerato sicuro.
Altri antibiotici
Macrolidi
Eritromicina è stato introdotto nel 1952 e ha visto l’uso diffuso nella medicina clinica. In generale, eritromicina è considerato un farmaco sicuro. Eritromicina è stato considerato il sostituto di scelta nel gruppo A le infezioni da streptococco e pneumococco per le persone sensibili alla penicillina. Eritromicina resta l’antibiotico di scelta per Legionella polmonite e altre polmoniti atipiche. Le prime segnalazioni di ototossicità non sono stati rilevati fino al 1973. Da allora, sono stati segnalati solo casi sporadici di ototossicità, e sono stati generalmente reversibili. Questi pazienti tendevano ad avere altri fattori di rischio, tra cui insufficienza renale, insufficienza epatica, le dosi di oltre 4 g / d, e la somministrazione per via endovenosa. Clinicamente significativa perdita dell’udito è stata anche riportata in destinatari di rene-trapiantati che sono stati trattati con eritromicina per via endovenosa. L’esordio è in genere entro 3 giorni dall’inizio del trattamento. Frequenze vocali possono essere colpite, piuttosto che le frequenze più alte. Gli effetti sono generalmente reversibili.
Azitromicina e claritromicina sono nuovi antibiotici macrolidi. Questi antibiotici hanno visto diffuso uso clinico perché hanno meno effetti collaterali GI e uno spettro antimicrobico più ampio rispetto eritromicina. Tuttavia, recentemente, alcuni rapporti sono apparse riguardo ai possibili effetti ototossici. [12] I rapporti sono attualmente sporadici e sono necessari ulteriori indagini.
Vancomicina
Vancomicina è un antibiotico glicopeptide che è stato introdotto nel 1950. E ‘un farmaco comunemente usato nella luce della sua efficacia in infezioni da stafilococco meticillina-resistenti . Diverse segnalazioni di ototossicità, di solito si manifesta come tinnito, sono stati presentati nei pazienti con concentrazioni sieriche elevate attribuiti ad insufficienza renale o nei pazienti sottoposti a terapia concomitante con aminoglicosidi. [13] I dati sono chiari, ma suggeriscono che ototossicità è reversibile, almeno in alcuni individui . Non esistono studi dimostrano prova conclusiva di ototossicità con vancomicina amministrazione da solo e in dosi terapeutiche. Non raccomandazioni sono state fatte per quanto riguarda il suo utilizzo; Tuttavia, gli autori suggeriscono cautela con la somministrazione concomitante di vancomicina e di altri agenti ototossici, e la documentazione dei livelli sierici vancomicina.
Loop Diuretici
Diuretici esercitano effetti terapeutici al di Henle. Questa classe di farmaci comprende diversi gruppi chimici diversi, tra cui i sulfamidici, derivati dell’acido fenilacetici, e composti eterociclici. Questi farmaci sono usati per trattare l’insufficienza cardiaca congestizia, insufficienza renale, cirrosi e ipertensione. I diuretici più efficaci e di uso frequente (per esempio, acido etacrinico, furosemide, bumetanide) possono causare ototossicità. Diversi diuretici dell’ansa meno comunemente utilizzati sono stati anche sperimentalmente dimostrato di causare ototossicità; questo gruppo comprende torsemide, azosemide, ozolinone, indacrinone, e piretanide.
Fisiopatologia
Gli effetti ototossici di diuretici dell’ansa sembrano essere associati con i vascularis stria, che è influenzata dalle variazioni dei gradienti ionici tra l’perilymph e endolymph. Questi cambiamenti causano edema dell’epitelio della vascularis stria. L’evidenza suggerisce anche che il potenziale endolymphatic è diminuito; tuttavia, questo di solito è dose-dipendente e reversibile.
Ototossicità causata da acido etacrinico sembra svilupparsi più gradualmente e richiede più tempo per risolvere quello causato da furosemide o bumetanide. Nel complesso, ototossicità attribuito a questo gruppo di farmaci è di solito autolimitante e reversibile in pazienti adulti, anche se la perdita irreversibile dell’udito è stata riportata nei neonati.
Epidemiologia
Ototossicità è stimato in 6-7% dei pazienti che assumono diuretici dell’ansa.Presenza di diuretico ototossicità dipende da diversi fattori, tra cui la dose, velocità di infusione, storia di insufficienza renale, e la co-somministrazione di altri agenti ototossici.
Segni e sintomi
A seconda del particolare diuretico dell’ansa, i pazienti di solito riguardano una storia di perdita dell’udito, dopo l’assunzione dell’agente. I pazienti possono anche lamentarsi di acufeni e disequilibrio; Tuttavia, questi sintomi sono meno comuni e raramente avvengono senza perdita dell’udito. Alcuni pazienti possono avvertire la perdita permanente dell’udito, soprattutto quelli con insufficienza renale , quelli che ricevono dosi elevate, o quelli che ricevono antibiotici aminoglicosidi contemporaneamente.
Prevenzione
Prevenzione della ototossicità causata da diuretici dell’ansa consiste nell’utilizzo di dosi più basse possibili per ottenere effetti desiderati ed evitando velocità di infusione rapida. Inoltre, i fattori di rischio associati con la somministrazione di questi farmaci devono essere diligentemente valutati, compreso il co-somministrazione di altri farmaci ototossici e la storia di insufficienza renale.Come potenziamento e la sinergia di effetti ototossici di aminoglicosidi e diuretici dell’ansa è ben documentato, co-prescrizione di questi farmaci non è raccomandato.
Agenti antineoplastici
Agenti antineoplastici più comunemente associati con ototossicità sono il cisplatino composti a base di platino e, in misura minore, carboplatino. Questi agenti sono ampiamente utilizzati in ginecologica, polmone , sistema nervoso centrale, testa e collo , e tumori testicolari . Antineoplastici sono ciclo cellulare agenti alchilanti non specifici che inseriscono nel elica del DNA, interrompendo la replicazione.
Il cisplatino è ampiamente distribuito, ma le concentrazioni più elevate si trovano nei reni, fegato e prostata. Cisplatino si lega in maniera irreversibile alle proteine plasmatiche e può essere rilevato fino a 6 mesi dopo il completamento della terapia. Carboplatino non è legato alle proteine plasmatiche e viene più facilmente eliminato dai reni. Dose e l’efficacia di cisplatino e carboplatino sono limitati in gran parte dagli effetti avversi. In particolare, questi agenti producono nefrotossicità e ototossicità con l’aumentare della dose.
Fisiopatologia
Il meccanismo di ototossicità platino è mediata dalla produzione di radicali liberi e la morte cellulare. Composti del platino danneggiano il vascularis stria nei media Scala e causano la morte delle cellule ciliate esterne a partire dalla giro basale della coclea. Specie di radicali liberi sono prodotti dalla NADPH ossidasi nelle cellule ciliate interne a seguito di esposizione cisplatino. NADPH ossidasi è l’enzima che catalizza la formazione di radicali superossido. Una forma particolare di NADPH ossidasi, NOX3, è fortemente e selettivamente prodotta nell’orecchio interno ed è un’importante fonte di generazione di radicali liberi nella coclea, che potrebbe contribuire alla perdita dell’udito. [6] I radicali liberi generati da questo meccanismo, allora conducono ai mitocondri-mediata e la morte cellulare per apoptosi caspasi-mediata, e la perdita dell’udito permanente definitiva.
Epidemiologia
L’incidenza e la gravità di ototossicità dipendono dalla dose, velocità di infusione, e il numero di cicli, lo stato renale e co-somministrazione di altri agenti ototossici.L’incidenza e la gravità è anche maggiore nella popolazione pediatrica e nei pazienti sottoposti a radioterapia alla testa e al collo. Alcuni studi descrivono una perdita uditiva del 61% dei bambini trattati con chemioterapia a base di platino.[14] Questo è paragonabile con gli studi precedenti.
Fattori di rischio
I seguenti fattori di rischio sono stati identificati per lo sviluppo e potenziamento di ototossicità indotta platino: (1) ad alta dose e il numero di cicli, (2) irradiazione cranica concomitante o passato, (3) età estreme, (4) disidratazione, (5 ) co-somministrazione di altri agenti ototossici, e (6) insufficienza renale.
Segni e sintomi
I pazienti con ototossicità indotta platino possono segnalare acufene e l’esperienza soggettiva perdita dell’udito. La perdita dell’udito associati a tossicità cisplatino è solitamente bilaterale, neurosensoriale, irreversibile e progressiva. Udito ad alta frequenza è tipicamente influenzata in primo luogo, ma la perdita non può essere visualizzato fino a diversi giorni o mesi dopo l’ultima dose. Al contrario, ipoacusia grave può verificarsi dopo una singola dose.
Prevenzione
Ottenere audiogrammi iniziali e periodici audiogrammi follow-up durante la terapia per tutti i pazienti trattati con questi farmaci. Eseguire questi studi immediatamente prima cicli successivi droga così l’effetto massimo del ciclo precedente può essere determinato. Infine, i pazienti devono continuare a sottoporsi a test audiometrico a causa di una significativa ritenzione farmaco a lungo dopo il completamento della terapia. Anche consigliare ai pazienti di evitare l’esposizione al rumore per un massimo di 6 mesi.
Recenti studi hanno esplorato agenti come l’a-tocoferolo (un derivato della vitamina E), D-metionina (un amminoacido), salicilati, chelanti del ferro, N-acetil-cisteina (un antiossidante), caspasi o inibitori calpaina, e anche la terapia genica come preventivi se usato in combinazione con agenti chemioterapici a base di platino. Questi studi hanno dimostrato un significativo beneficio in modelli animali, ma devono essere replicato in modelli umani preservando gli effetti antineoplastici di agenti come il cisplatino. [11]
Salicilati
Acido acetilsalicilico, comunemente noto come aspirina, è ampiamente utilizzato per le sue proprietà antinfiammatorie, antipiretiche e analgesiche. L’aspirina è un inibitore dell’aggregazione piastrinica e viene utilizzato per il trattamento di pazienti con una storia di attacchi ischemici transitori, ictus, angina instabile o infarto del miocardio . L’acido acetilsalicilico viene assorbito rapidamente dopo somministrazione orale e viene idrolizzata nel fegato nella sua forma attiva, acido salicilico. Livelli terapeutici variano 25-50 mcg / mL per analgesici ed antipiretici a 150-300 mcg / ml per il trattamento della febbre reumatica acuta. Tuttavia, tinnito può verificarsi a livelli sierici a partire da 200 mcg / mL.
Fisiopatologia
L’acido salicilico entra rapidamente la coclea, e livelli di perilymph livelli sierici paralleli. Livelli crescenti producono acufene e, in generale, una perdita uditiva neurosensoriale piatta reversibile. Il meccanismo è multifattoriale, ma sembra causare metabolica piuttosto che alterazioni morfologiche all’interno della coclea.
Epidemiologia
Incidenza di ototossicità è alto come 1% ed è più comunemente osservata nei pazienti anziani, anche a basse dosi.
Fattori di rischio
I fattori di rischio associati alla ototossicità salicilato comprendono alte dosi, età avanzata, e la disidratazione.
Segni e sintomi
L’acufene è l’effetto avverso più comune di tossicità salicilato. Altri effetti collaterali includono perdita dell’udito, nausea, vomito, mal di testa, confusione, tachicardia, tachipnea e. La perdita dell’udito è generalmente da lieve a moderata e simmetria bilaterale. Il recupero di solito si verifica 24-72 ore dopo la cessazione del farmaco.
L’insorgenza di acufeni è stata utilizzata in passato come un segno precoce di ototossicità. Studi successivi hanno trovato che l’insorgenza di tinnito non deve essere usato come predittore del livello salicilato siero perché gli effetti ototossici possono essere presenti a bassi livelli ematici. [15]
Trattamento
Tossicità salicilato è trattato monitoraggio degli elettroliti e la somministrazione di liquidi, con l’aggiunta della diuresi alcalina, se necessario. La somministrazione di ossigeno e la ventilazione meccanica possono essere necessari in casi gravi.
Chinino
Derivato da albero corteccia di china, il chinino è stato storicamente usato per trattare la malaria e per le sue qualità antifebbrili. Usa oggi è limitata dalla disponibilità di alternative meno tossiche. Il chinino è talvolta usato per trattare crampi notturni e in aggiunta alla terapia antimalarica. Il chinino subisce principalmente metabolismo epatico.
Segni e sintomi
Tossicità chinino può produrre tinnito, perdita, vertigini, mal di testa, nausea e perdita della vista dell’udito. La perdita dell’udito è di solito neurosensoriale e reversibile. Una caratteristica tacca neurosensoriale è spesso presente a 4000 Hz. Perdita irreversibile dell’udito raramente è stata riportata con l’uso chinino.
Trattamento
Trattamento per il chinino ototossicità consiste principalmente di interruzione della terapia; amplificazione può essere utilizzato in rari casi di sordità irreversibile.
References
- Kahlmeter G, Dahlager JI. Aminoglycoside toxicity – a review of clinical studies published between 1975 and 1982. J Antimicrob Chemother. Jan 1984;13 Suppl A:9-22. [Medline].
- Monsell EM, Cass SP, Rybak LP. Therapeutic use of aminoglycosides in Ménière’s disease. Otolaryngol Clin North Am. Oct 1993;26(5):737-46. [Medline].
- Hirvonen TP, Minor LB, Hullar TE, Carey JP. Effects of intratympanic gentamicin on vestibular afferents and hair cells in the chinchilla. J Neurophysiol. Feb 2005;93(2):643-55. [Medline].
- Hiel H, Schamel A, Erre JP, Hayashida T, Dulon D, Aran JM. Cellular and subcellular localization of tritiated gentamicin in the guinea pig cochlea following combined treatment with ethacrynic acid. Hear Res. Jan 1992;57(2):157-65. [Medline].
- Leitner MG, Halaszovich CR, Oliver D. Aminoglycosides inhibit KCNQ4 channels in cochlear outer hair cells via depletion of phosphatidylinositol(4,5)bisphosphate. Mol Pharmacol. Jan 2011;79(1):51-60.[Medline].
- Rybak LP, Whitworth CA. Ototoxicity: therapeutic opportunities. Drug Discov Today. Oct 1 2005;10(19):1313-21. [Medline].
- Selimoglu E. Aminoglycoside-induced ototoxicity. Curr Pharm Des. 2007;13(1):119-26. [Medline].
- Matz GJ. Aminoglycoside cochlear ototoxicity. Otolaryngol Clin North Am. Oct 1993;26(5):705-12.[Medline].
- Fischel-Ghodsian N. Genetic factors in aminoglycoside toxicity. Ann N Y Acad Sci. Nov 28 1999;884:99-109. [Medline].
- Roland PS. New developments in our understanding of ototoxicity. Ear Nose Throat J. Sep 2004;83(9 Suppl 4):15-6; discussion 16-7. [Medline].
- Rybak LP, Kelly T. Ototoxicity: bioprotective mechanisms. Curr Opin Otolaryngol Head Neck Surg. Oct 2003;11(5):328-33. [Medline].
- Uzun C, Koten M, Adali MK, et al. Reversible ototoxic effect of azithromycin and clarithromycin on transiently evoked otoacoustic emissions in guinea pigs. J Laryngol Otol. Aug 2001;115(8):622-8.[Medline].
- Levine DP. Vancomycin: a history. Clin Infect Dis. Jan 1 2006;42 Suppl 1:S5-12. [Medline].
- Knight KR, Kraemer DF, Neuwelt EA. Ototoxicity in children receiving platinum chemotherapy: underestimating a commonly occurring toxicity that may influence academic and social development. J Clin Oncol. Dec 1 2005;23(34):8588-96. [Medline].
- Jung TT, Rhee CK, Lee CS, et al. Ototoxicity of salicylate, nonsteroidal antiinflammatory drugs, and quinine. Otolaryngol Clin North Am. Oct 1993;26(5):791-810. [Medline].
- Bhansali SA, Stockwell CW, Bojrab DI. Oscillopsia in patients with loss of vestibular function. Otolaryngol Head Neck Surg. Jul 1993;109(1):120-5. [Medline].
- MacDougall HG, Weber KP, McGarvie LA, Halmagyi GM, Curthoys IS. The video head impulse test: diagnostic accuracy in peripheral vestibulopathy. Neurology. Oct 6 2009;73(14):1134-41. [Medline].
- Jonathan B Clark, MD, MPH. Evaluation of Visual Vestibular Interaction With the Dynamic Visual Acuity Test. micromedical.com. Available at http://www.micromedical.com/Newsletter/MMNewsletter20.pdf. Accessed 4/25/2010.
- Ishiyama G, Ishiyama A, Kerber K, Baloh RW. Gentamicin ototoxicity: clinical features and the effect on the human vestibulo-ocular reflex. Acta Otolaryngol. Oct 2006;126(10):1057-61. [Medline].
- Lai P, Coulson C, Pothier DD, Rutka J. Chlorhexidine ototoxicity in ear surgery, part 1: review of the literature. J Otolaryngol Head Neck Surg. Dec 2011;40(6):437-40. [Medline].
- Kaplan DM, Hehar SS, Bance ML, et al. Intentional ablation of vestibular function using commercially available topical gentamicin-betamethasone eardrops in patients with Meniere’s disease: further evidence for topical eardrop ototoxicity. Laryngoscope. Apr 2002;112(4):689-95. [Medline].
- Cohen-Kerem R, Kisilevsky V, Einarson TR, et al. Intratympanic gentamicin for Menière’s disease: a meta-analysis. Laryngoscope. Dec 2004;114(12):2085-91. [Medline].
- American Speech-Language Hearing Association. (1994). Audiologoc Managment of Individuals Recieving Cochleotoxic Drug Therapy [Guidelines]. Available at www.asha.org/policy.
- Barlow DW, Duckert LG, Kreig CS, et al. Ototoxicity of topical otomicrobial agents. Acta Otolaryngol. Mar 1995;115(2):231-5. [Medline].
- Campbell KC, Durrant J. Audiologic monitoring for ototoxicity. Otolaryngol Clin North Am. Oct 1993;26(5):903-14. [Medline].
- Dayal VS, Chait GE, Fenton SS. Gentamicin vestibulotoxicity. Long term disability. Ann Otol Rhinol Laryngol. Jan-Feb 1979;88(1 Pt 1):36-9. [Medline].
- Edson RS, Terrell CL. The aminoglycosides. Mayo Clin Proc. May 1999;74(5):519-28. [Medline].
- Fausti SA, Henry JA, Helt WJ, et al. An individualized, sensitive frequency range for early detection of ototoxicity. Ear Hear. Dec 1999;20(6):497-505. [Medline].
- Govaerts PJ, Claes J, van de Heyning PH, et al. Aminoglycoside-induced ototoxicity. Toxicol Lett. Aug 1990;52(3):227-51. [Medline].
- Henley CM, Rybak LP. Developmental ototoxicity. Otolaryngol Clin North Am. Oct 1993;26(5):857-71.[Medline].
- Huizing EH, de Groot JC. Human cochlear pathology in aminoglycoside ototoxicity–a review. Acta Otolaryngol Suppl. 1987;436:117-25. [Medline].
- Ikeda K, Oshima T, Hidaka H, et al. Molecular and clinical implications of loop diuretic ototoxicity. Hear Res. May 1997;107(1-2):1-8. [Medline].
- Knight KR, Kraemer DF, Neuwelt EA. Ototoxicity in children receiving platinum chemotherapy: underestimating a commonly occurring toxicity that may influence academic and social development. J Clin Oncol. Dec 1 2005;23(34):8588-96. [Medline].
- Lee KJ, ed. Essential Otolaryngology Head and Neck Surgery. 995-998. 8th. McGraw-Hill: 2003:104-105.
- Nielsen-Abbring FW, Perenboom RM, van der Hulst RJ. Quinine-induced hearing loss. ORL J Otorhinolaryngol Relat Spec. 1990;52(1):65-8. [Medline].
- Powell SH, Thompson WL, Luthe MA, et al. Once-daily vs. continuous aminoglycoside dosing: efficacy and toxicity in animal and clinical studies of gentamicin, netilmicin, and tobramycin. J Infect Dis. May 1983;147(5):918-32. [Medline].
- Rademaker-Lakhai JM, Crul M, Zuur L, et al. Relationship between cisplatin administration and the development of ototoxicity. J Clin Oncol. Feb 20 2006;24(6):918-24. [Medline].
- Roland PS. Summary of the findings of a joint consensus panel on the use of potentially ototoxic ototopicals. Ear Nose Throat J. Sep 2004;83(9 Suppl 4):13-4. [Medline].
- Rybak LP. Ototoxicity of loop diuretics. Otolaryngol Clin North Am. Oct 1993;26(5):829-44. [Medline].
- Rybak LP, Whitworth C, Scott V. Comparative acute ototoxicity of loop diuretic compounds. Eur Arch Otorhinolaryngol. 1991;248(6):353-7. [Medline].
- Schacht J, Weiner N. Aminoglycoside-induced hearing loss: a molecular hypothesis. ORL J Otorhinolaryngol Relat Spec. 1986;48(2):116-23. [Medline].
- Talbert RL, Ludden TM, West RE. Rapid establishment of therapeutic serum concentrations of salicylates.J Clin Pharmacol. Feb-Mar 1979;19(2-3):108-12. [Medline].
- Temple AR. Acute and chronic effects of aspirin toxicity and their treatment. Arch Intern Med. Feb 23 1981;141(3 Spec No):364-9. [Medline].
- Vasquez EM, Maddux MS, Sanchez J, et al. Clinically significant hearing loss in renal allograft recipients treated with intravenous erythromycin. Arch Intern Med. Apr 12 1993;153(7):879-82. [Medline].
Ototossicità Riferimenti
Akyol MU, Sarac S, Akyol G, Atac A, Poyraz A, Belgin E, Turan E. Investigation of the ototoxic effects ot interferon alpha 2A on the mouse cochlea. Otolaryngol Head Neck surg 2001: 124: 107-10.
Arnold W, Kau R, Schwaiger M. Clinical aspects of the osteolytic (inflammatory) phase of cochlear otosclerosis Laryngorhinobogie 1999: 78: 20-3
Aust G Early and late damage in the auditory and vestibular area after meningitis in childhood and adolescence. HNO 1994: 42: 14-21
Beckett WS, Chamberlain D, Hallman E, May I. Hwang SA, Gomez M, Eberly S, Cox C, Slark A. Hearing conservation for farmers: source apportionment of occupational and environmental factors contributing to hearing loss J. Occup Environ Med 2000: 42: 806-13
Bohme G Hearing disorders in obliteration of the carotid artery – Contribution to hearing loss in the aged Laryngorhinobogie 1989: 68: 367-71.
Bohme G Hearing disorders in peripheral arterial vascular diseases contribution on hearing loss in aged Laryngol Rhinol Otol (Stuttg) 1987: 638-42,
Boudewyns A. Claes J. Acute cochleovestibular toxicity due to topical application of potassium iodide Eur Arch Otorhynolaryngol 2001: 258: 109-lI.
Cary R. Clarke S. Delic J. Effects of combined exposure to noise and toxic substances- critical review of the literature Ann Occup Hyg 1997: 41:455-65,
Carzoli RP. Murphi SP. Hammer-Knisely J. Houry J. Evaluation of auditory brain-stein response in full-term infants of cocaine-abusing mothers. Am J Dis Child 1991: 149: 1013-6.
Cohen-Kerem R, Kisilevsky V, Einarson TR, et al. Intratympanic gentamicin for Meniere’s disease: a meta-analysis. Laryngoscope. Dec 2004;114(12):2085-91. [Medline].
Commissaris RI. Tavakoli-Nezhad M. Barron AJ, Pitts DK. Effects of chronic low-level oral lead exposure on prepulse inhibition of acoustic startle in the rat. Neurotoxicology and Teratology 2000: 22: 55-60.
Crofton KM, Zhao X The ototoxicity of trichloroethylene – extrapolation and relevance of high-concentration. short-duration animal exposure data, Fundam Appl Toxicol 1994; 38: 101-6.
Cruickshanks KJ. Wiley TI. Nondahl DM. Prevalence of hearing loss in older adults in Beaver dam. Wisconsin, The epidemiobogy of hearing loss study. Am J Epidemiol 1998; 148: 879-86.
Cunha BA, Antibiotic side effects. Med Clin North Am 2001; 85: 149-85.
Curch MW, Overbeck GW. Sensoneural hearing loss as evidenced by the auditory brainstem response following prenatal cocaine exposure in the Long Evans rat. Teratology 1991; 43: 561-70.
Dayal VS, Barek WG. Cochlear changes from noise, kanamycin and aging: II. Potentiating effects of noise and kanamycin. Laryngoscope 85 (suppi) 1975: 8-11.
Dehne N. Lautermann J, Petrat F Rauen U. de Groot FI. Cisplatin ototoxicity: involvement of iron and enhanced formation of superoxide anion radicals. Toxicol Apll Pharmacol 2001:174: 27-34.
Duck SW, Prazma J, Bennet PS, Pillsbury HC. lteraction between hypertension and diabetes mellitus in the pathogenesis of sensorineural hearing loss, Laryngoscope 1997: 107(l2pt 1): 1596-605.
Fang YY. Image analysis of arterial vessels of the intenal auditory meatus during presenile and aged with hypertension and atherosclerosis. Zhonghua Er Bi Yan Hou Ke Za Zhi 1993; 28: 91-3.
Fechter LD Combined effects of noise and chemicals. Occupational Medicine: State of the arts Reviews: 609-621TC. Morata: Philadelphia, De Dunn Eds, Hanley & Belfus Inc., 1995.
Feghali JG, Liu W, Van de Water TR. Related Article L-n-acetyl-cysteine protection against cisplatin-induced auditory neuronal and hair cell toxicity: Laryngoscope 2001; 11: 1147-55,
Fukuda S. Ishikawa K. Inuyama Y. Acute measles infection in the hasmster cochlea. Acta Otolaryngol Suppl 1994; 514: 11-15.
Fusetti M, Eibenstein A, Corridore V, Hueck S, Chiti-Batelli S. Mefloquine and ototoxicity – a report of 3 cases. Clin Ter 1999: 150: 379-82
Garstecki DC. Erler SF. Personal and social conditions potentially influencing women’s hearing loss management Am J Audiol 2001: 10: 78-90
Gates GA, Mills D. Nan B. D’agostino R. Rubel EW, Effects of age on the distortion product otoacustic emission growth functions. Hear res 2002; 163: 53-60.
Greenberg A Diuretic compactions. Am J Med Sci 2000: 319: 10-24.
Griefahn B. Noise effects not only the ears. But can damage to health be objectively evaluated? MMW Fortschr Med 2000: 6: 142: 26-9.
Haller DG Safety of oxaliplatin in the treatment of colonrectal cancer. Oncology 2000: 14 (12 Suppl 11): 15-20.
Henderson D, Subiamaniam M, Boettcher FA- Individual susceptibility to noise-induced hearing loss: an old topic revisited. Ear hear 1993: 14: 561-75
Hesse G, Hesch RD. Evaluation of risk factors in various forms of inner ear hearing loss. HN01986: 34: 503-7.
Hirvonen TP, Minor LB, Hullar TE, Carey JP. Effects of intratympanic gentamicin on vestibular afferents and hair cells in the chinchilla. J Neurophysiol. Feb 2005;93(2):643-55. [Medline].
Horowitz SR, Stark A, Marshall E, Mauser MP. A multi-modality assessment of peripheral nerve function in organophosphate-pesticide applicators. JOEM 1999: 41: 405-8.
Huang HM, Yeh RM, Tan CT, Chao MN. Lin KN. Auditory abnormalities associated with unilateral renal agenesis Int J Pediatr Otorhinobaryngo 2001: 60: 113-8
Husain K, Whitworth C, Somani SM, Rybak LP. Carboplatin-induced oxidative stress in rat cochlea. Hear Res 2001: 159: 14-22.
Hutchin ME, Gilmer C. Yarbrough WG. Delayed-onset sensorineural hearing loss in a 3 year-old survivor of persistent pulmonary hypertension of the newborn, Arch Otolaryngol head neck surg 2000: 126: 1014-17.
Ishiyama G, Ishiyama A, Kerber K, Baloh RW. Gentamicin ototoxicity: clinical features and the effect on the human vestibulo-ocular reflex. Acta Otolaryngol. Oct 2006;126(10):1057-61. [Medline].
Ikeda K, Oshima T, Hidaka H, Takasaka T. Molecular and clinical implication of loop diuretics ototoxicity Hear Res 1997: 107: 1-8.
ltoh A, NakashimaT, Arao H, Wakai K, Tamakoshi A, Kawamura T, Olmo Y. Smoking and drinking habits as risk factors for hearing loss in the elderly: epidemiological study of subjects undergoing routine health checks in Aichi. Japan Public Health 2001: 115: 192-6,
Jackler RK and Brackman DE. Ototoxicity. In: Neurotology. Mosby-Year Book Inc. Missouri. 1994; p. 642-4.
Jerger J. Chmiel R. Stach B. Spretnjak M. Gender affects audiometric shape in presbyacusis J Am Acad Audiol 1993: 4: 42-9.
Jerger S and Jerger J. Ototoxicity. In: Auditory Disorders: A Manual for Clinical Evaluation. Little Brown and Company. 1981; p.137-8.
Johansen PB, Gran JT. Ototoxicity due to hydroxychloroquine: report of 2 cases. Clin Exp Rheumatol 1998: 16: 472-4,
Johnson AC, Juntunen L, Nylen P, Borg E, Hoglung G. Effects of interaction between noise and toluene on auditory function in the rat. Acta Otolaryngol 1998: 105: 56-63
Jung TT, Rhee CK, Lee CS, Park YS, Choi DC. Ototoxicity of salicylate. non-steroidal anti-inflammatory drugs and quiniune. Otolaryngol Clin North Am 1993: 26: 791-810.
Kaplan DM, Hehar SS, Bance ML, et al. Intentional ablation of vestibular function using commercially available topical gentamicin-betamethasone eardrops in patients with Meniere’s disease: further evidence for topical eardrop ototoxicity. Laryngoscope. Apr 2002;112(4):689-95. [Medline].
Kayan A. Bellman H. Bilateral sensorineural hearing loss due to mumps: Br J Clin Pract 1990: 4-1: 757,
Kholmatov DI. Early detection of a sensorineural aspect of hypoacusis in patients with chronic purulent otitis media. Vestn Otolaringol 2001: (3): 26-8.
Knight KR, Kraemer DF, Neuwelt EA. Ototoxicity in children receiving platinum chemotherapy: underestimating a commonly occurring toxicity that may influence academic and social development. J Clin Oncol. Dec 1 2005;23(34):8588-96. [Medline].
Knott PD, Orloff LA, Harris JP. Novak RE. Burns JC. Sensorineural hearing loss and Kawasaki disease – a prospective study. Am J Otolaryngol 2002: 22: 313-48.
Konrad-Martin D, Helt WJ, Reavis KM, Gordon JS, Coleman LL, Bratt GW et al . Ototoxicity: Early detection and monitoring. The ASHA Leader .2005: 11-14. Available from URL: http://www.asha.org/ about/ publications/ leader-online/ archives/ 2005/ 050524/ 050524b.htm
Kowalska S. Sulkowski W. Sinczuk-Walczac H Assessment of the hearing system in workers chronically exposed to carbon disulfide and noise. Med P 2000r: 51: 123-38
Larsby B. Different neuro-phisiological methods for studyng the vestibular system: Lynkoping University Medical Dissertations, N.91 1980
Le BK, Le She, Le KM et al. Dose dependant increase in subjective symptom prevalence among toluene-exposed workers. md health 1988: 26: 11-23
Lai P, Coulson C, Pothier DD, Rutka J. Chlorhexidine ototoxicity in ear surgery, part 1: review of the literature. J Otolaryngol Head Neck Surg. Dec 2011;40(6):437-40. [Medline].
Lee KJ, ed. Essential Otolaryngology Head and Neck Surgery. 995-998. 8th. McGraw-Hill: 2003:104-105.
Leitner MG, Halaszovich CR, Oliver D. Aminoglycosides inhibit KCNQ4 channels in cochlear outer hair cells via depletion of phosphatidylinositol(4,5)bisphosphate. Mol Pharmacol. Jan 2011;79(1):51-60.[Medline].
Leone CA. Mosca F. Mincione A. Ablation therapy with gentamycin in the treatment of Meniere s disease, Acta otorhinolaryngol ItaI 2000: 20: 322-9,
Levine DP. Vancomycin: a history. Clin Infect Dis. Jan 1 2006;42 Suppl 1:S5-12. [Medline].
Li G, Frenz DA, Brahblatt S, Fegali JG. Ruben Ri. Berggren D. Arezzo J. Van Der Water TR. Round without membrane delivery of l-methionine provides protection from cisplatin ototoxicity without compromising chemoterapeutic efficacy Neurotoxicology 2001: 22: 163-76
Liu HY, Chi FL, Gao WY. Taurine attenuates aminoglycoside ototoxicity by inhibiting inducible nitric oxide synthase expression in the cochlea. Neuroreport . 2008; 19(1): 117-20.
Mamikoglu B. Mamikoglu O. Irreversible sensorineural hearing loss as a result of azithromycin ototoxicity. A case report. Ann Otol Rhinol Larhyngol 2000: 109: 435-7,
MacDougall HG, Weber KP, McGarvie LA, Halmagyi GM, Curthoys IS. The video head impulse test: diagnostic accuracy in peripheral vestibulopathy. Neurology. Oct 6 2009;73(14):1134-41. [Medline].
McFadden SL, Henselman LW, Zheng XY. Sex differences in auditory sensitivity of chinchillas before and after exposure to impulse noise. Ear Hear 1999: 20: 164-74.
McWilliams ML. Chen OD. Fechter LD. Low-level toluene disrups auditory function in guinea pigs. Toxicol Appl Pharmacol 2000: 167: 18-29.
Merluzzi F. Cornacchia L. Parigi O. Terrana T., Metodologia di esecuzione del controllo dell’udito dei lavoratori esposti a rumore Nuovo Arch Ital Otol 1979: 7: 695-7 11
Merluzzi F, Orsinì S, Di Credico N, Marazzi P. Rumore e udito in ambiente di lavoro: Franco Angeli ed: 1999
Mills CD, Whitworth C, Rybak LE, Henley CM. Quantification of furosemide from serum and tissue using high-performance liquid chromatography. J Chromatogr B Biomed Sci Appl 1997: 701: 65-70.
Morata TC, Derek ED. Occupational exposure to noise and ototoxic organic solvents, Archives of environmental health 1991: 19: 359-65.
Morata TC, Derek ED, Kretschmer LW, Lemasters OK, Keith RW Effects of occupational exposure to organic solvents and noise on hearing. Scand i Work Environ Health 1993: 19: 245-54
Morata TC, Engel T, Durao A, Costa TR, Krieg EF, Dono DE, Lozano MA. Hearing loss from combined exposures among petroleum refinery workers. Scand Audiol 1997: 26: 141-9,
Morioka l. Miyai N. Yamamoto H. Miyashita K Evaluation of combined effect of organic solvents and noise by the upper limit of hearing Industrial health 2000.38: 252-57
Morley C. Seitz T. Tubbs R Carbon monoxide and noise exposure at a monster truck and motocross show Applied Occupational and Environmental Hygiene 1999: 14: 645—55
Morpeth JF, Bent JP, Vatson T. A comparison of crtisporin and ciprofloxacin otic drops as prophylaxis against post—tympanostomy otorrhea. Int J pediatr Otorhinolaryngol 2001: 6: 99—104.
Mosnier I. Teixeira M. Loiseau A. Fernandez I. Sterkers O. AmieI O. Ferrari E. Effects of acute and chronic hypertension on the labyrinthic barriers in rat. Hear Res 2001: 151: 227-236.
Nakamura M, Aoki N, Nakashima T, Hoshino T. Yokoyama T, Morioka S, Kawamura T. Tanaka H. Hashimoto T. Ohno Y, Whtlock G. Smoking. alcohol, sleep and risk of idiopathic sudden deafness: a case-control study using pooled controls. J epidemiol 2001; 22: 81-6.
Nakashima T. Teranishi M. Hibi T. Kobayashi M. Umemura M. Vestibular and cochlear toxicity of aminoglycosides – a review. Acta Otolaryngol 2000; 120: 904-11.
Nuti D, Cosentino G, Vessio G. Total cholesterol and high-density lipoprotein cholesterol in sensorineural deafness, Quad Sclavo Diagn 1983; 19: 129-33.
Odvist LM, Larby B, Than R. Anderson B, Than R, Erikson B, Liedgren SRC. Vestibulo oculomotor disturbances in human exposed to styrene. Acta Otolaryngol 1982; 94: 487-493
Peklcarinen J. Noise, impulse noise and other physical factors – combined effects on hearing. Occup Med 1995: 10: 545-547,
Pikis A, Kavaliotis J, Tsikoulas J, Andrianopolus P, Venzon D, Manios S. Long-term sequelae of pneumococcal meningitis in children. Clin Pediatr 1996; 35: 72.
Pirodda A, Ferri GG, Modugno GC, Borghi C. Systemic hypotension and the development of acute sensorineural hearing bss in young healthy subjects. Arch Otolaryngol Head Neck Surg 2001;127: 1049-52
Plaza O. Vela L. Herraiz C. De Los Santos G. Benign intracranial hypertension and sensorineural hearing loss. Med Clin 2001; 116: 75,
Pollastrini L, Abramo A, Cristalli G, Baretti F, Greco A .Studio dei segni precoci di ototossicità professionale da inalazione di solventi industriali derivati dal benzene, Acta Otorhinol Ital 1994: 11: 503-12.
Popelka MM. Cruickshanks KJ. Wiley TL. Tweed TS, Klein BE. Klein R, Nondahl DM. Moderate alcohol consumption and hearing bss: a protective effect. J Am Geriatr Soc 2000: 48: 1273-8.
Powell SH, Thompson WL, Luthe MA, et al. Once-daily vs. continuous aminoglycoside dosing: efficacy and toxicity in animal and clinical studies of gentamicin, netilmicin, and tobramycin. J Infect Dis. May 1983;147(5):918-32. [Medline].
Pyykko 1. Starck i. serum Cholesterol and tryglycerine in the ethiology of sensoryneural hearing loss 15th NES Congress. 17-20 1988. In Claussen CF. Kirtane MV eds Vertigo. nausea. tinnitus and hypoacusis in metabolic disorders Amsterdam, Elsevier Science Publishers, B,V.. 355-58. 1988.
Rademaker-Lakhai JM, Crul M, Zuur L, et al. Relationship between cisplatin administration and the development of ototoxicity. J Clin Oncol. Feb 20 2006;24(6):918-24. [Medline].
Rebert CS. Day VL, Matteucci MJ. Pryor GT Sensory-evoked potentials in rats chronically exposed to thricloroethylene: predominant auditory disfunction, Neurotoxicol teratol 1991; 13: 83-90.
Roche PR, Dufour H, Figarebla-Branger D, Pellet W. Endobimphatic tumors – report of three cases Neurosurgery 1998; 42: 927-32.
Roland PS. Summary of the findings of a joint consensus panel on the use of potentially ototoxic ototopicals. Ear Nose Throat J. Sep 2004;83(9 Suppl 4):13-4. [Medline].
Roland PS. New developments in our understanding of ototoxicity. Ear Nose Throat J. Sep 2004;83(9 Suppl 4):15-6; discussion 16-7. [Medline].
Rosen S. Bergman M. Plester D, El-Mofty A, Sati MW. Presbycusis study of a relatively noise-free population in the Sudan. Trans Am Otol Soc 1962: 50: 135-151
Ruan RS. Leong SK. Yeoh KH. Ototoxicity of sodium nitroprusside. Hear Res 1997: 114: 169-78.
Russel PT, Church CA, Jinn TH, Kim DJ, John EO, Jung Tf. Effects of common topical otic preparations on the morphology of isolated cochlear outer hair cells. Acta otolaryngol 2001: 121: 135-9.
Rybak LP, Whitworth C, Scott V. Comparative acute ototoxicity of loop diuretic compounds. Eur Arch Otorhinolaryngol. 1991;248(6):353-7. [Medline].
Rybak LP. Ototoxicity of loop diuretics. Otolaryngol Clin North Am. Oct 1993;26(5):829-44. [Medline].
Rybak LP, Kelly T. Ototoxicity: Bio protective mechanisms. Current Opinion in Otolaryngology & Head & Neck Surgery . 2003; 11(5): 328-33.
Rybak LP, Whitworth CA. Ototoxicity: therapeutic opportunities. Drug Discov Today. Oct 1 2005;10(19):1313-21. [Medline].
Ryndina AM, Berdnikova IP, Tsvybeva ID. Alternating signal speech audiometry in the diagnosis of central lesions of the acoustic analyzer. Vestn Otolaringol 1998; 6: 13-4
Sass-Kortsac AM. Corey PN, Robertson JM, An investigation of the association between exposure to styrene and hearing bss Ann epidemiol 1995; 5: 15-24
Seckin U. Ozoran K. lkinciogullari A. Barman P. Bostan EE. Hydroxychloroquine ototoxicity in patients with rheumatoid arthritis, Rheumatol Int 2000; 19: 203-4,
Sedano HO, Moreira LC, De Souza RA, Moberi AB. Otodental syndrome – a case report and genetic considerations Oral Surg Med Oral Pathol Oral Radiol Endol 2001: 92: 3 12-7.
Seki M, Miyasaka H, Edamatsu H, Watanabe K. Changes in permeability of strial vessels following vibration given to auditory ossicle by drill. Otol Rhinol Laryngol 2001; 110: 122-6.
Selimoglu E. Aminoglycoside-induced ototoxicity. Current Pharmaceutical Design . 2007; 13: 119-26.
Schacht J, Weiner N. Aminoglycoside-induced hearing loss: a molecular hypothesis. ORL J Otorhinolaryngol Relat Spec. 1986;48(2):116-23. [Medline].
Shapiro A, Siglock TJ, Ritch R, Malinoff R. Lack of association between hearing loss and glaucoma. Am j Otol 1997: 18: 172-4,
Shellens JR, Planting AS, Ma I, Maliepaard M, de Vos A, de Boer Dennert M, Verweij J. Adaptive intrapatient dose escalation of cisplatin in patients with advanced head and neck cancer. Anticancer Drugs 2001; 12: 667-675
Siegelaub AB, Friedman GD, Kedar A, Oakland C, Seltzer CC. Hearing loss in adults. Relation to age, sex, exposure to lead noise and cigarette smoking. Arch Environ Health 1974; 29: 107-109.
Simdom J, Watters D, Bartlett S, Connick E. Ototoxicity associated with use of nucleoside analog reverse transcriptase inhibitors: a report of 3 possible cases and reviews of the literature Clin Infect Dis 2001; 32: 1623-7.
Sismanis A, Stamm MA, Sobel M. Objective tinnitus in patients with atherosclerotic carotid artery disease. Am J Otol 1994: 15: 404-7,
Sliwinska-Kowanska M et al. Hearing loss among workers exposed to moderate concentrations of solvents. Scand J Work Environ Health 2001: 27:335-342.
Starck J, Toppila, Pikko I. Smoking as a risk factor in sensory neural hearing loss among workers exposed to occupational noise. Acta Otolaryngol 1999: 119: 302-5.
Stewart BJ, Prabhu PU. Reports of sensorineural deafness after measles, mumps and rubella immunization. Arch Dis Child 1993; 69: 153-4.
Su WC, Chang SL, Chen TY. Chen JS, Tsao CJ. Comparison of in vitro grow inibitory activity of carboplatin and cisplatin on leukemic cells and ematopoietic progenitor – the myelosuppressive activity of carboplatin may be greater than its antileukemic effect. Jpn J Clin Oncol 2000: 30: 562-7.
Sykes H. The ototoxicity of chloroquine subphate in the guinea pig. Br J Audiol 1984; 18: .59-69.
Syms MJ, Arcila ME, Holtel MR. Waldenstrom’s macroglobulinemia and sensoneural hearing loss. Am J Otolaryngol 2001; 22: 349-353.
Tan CT, Lee SY, Yao CJ, Liu SR, Lin-Shiau SY. Effcts of gentamicin and ph on Ca2+ in apical and basal outer cells from guinea pigs. Hear resp 2001: 154: 81-7.
Talbert RL, Ludden TM, West RE. Rapid establishment of therapeutic serum concentrations of salicylates .J Clin Pharmacol. Feb-Mar 1979;19(2-3):108-12. [Medline].
Tanaka M. Orii T, Kobayashi R. Hirono S. Rebated Articles Reversible ototoxic effect of azitromvcin and clarithromycin on transiently evoked otoacoustic emission in guinea piggs. J Laryngob Otol 2001: 115: 622-8.
Tange RA, Dreschler WA, Claessen FA, Perenboom RM. Ototoxic reactions of quintine in healthy people and patients with plasmodium falciparum infection. Auris Nasus Larynx 1997: 24: 131-6.
Tawackobi W, Chen GD, Fechter LD. Disruption of cochlear potentials by chemical asphyxiates cyanide and carbon monoxide. Neurotoxicol teratol 2001: 23: 157-65.
Temple AR. Acute and chronic effects of aspirin toxicity and their treatment. Arch Intern Med. Feb 23 1981;141(3 Spec No):364-9. [Medline].
Todt I, Ngezehayo A, Enst A, Kobb RA. Hydrogen peroxide inhibits gap junctional coupling and modubates intracellular free calcium in cochlear cells. J Membr Biol 2001: 181: 107-14,
Tsunoda K, Akaogi J, Ohya N, Murofushi T. Sensorineural hearing loss as the initial manifestation of polyarteritis nodosa. .J Laryngol Otol 2001: 115: 311-315.
Uzun C, Koten M, Adali MK, Yorulmaz F, Yagiz R, Karazabihoglu AR. Reversible ototoxic effects of azithromycin and clarithromycin on transiently evoked otoacoustic emission in guinea pigs.. J Laryngol Otol 2001: 115: 662-8,
Vasquez EM, Maddux MS, Sanchez J, et al. Clinically significant hearing loss in renal allograft recipients treated with intravenous erythromycin. Arch Intern Med. Apr 12 1993;153(7):879-82. [Medline].
Wackym PA, Storper IS and Newman AN. Cochlear and vestibular ototoxicity. In: Canalis RF and Lambert PR, editors. The Ear: Comprehensive Otology. Philadelphia: Lipincott Williams and Wilkins; 2000;p. 571-83.
Ward WD, Endogenous factors rebated to susceptibility to damage from noise. Occup Med 1995: 10.561-75.
Wassick KR, Yonovitz A. Methyb mercury ototoxicity in mice determined by auditory brainslem responses. Acta Otorbaryngob 1985: 99: 35-45.
Whitworth C, Morris C, Scoti V. Rybak LP. Dose-response rebationships for furosemide ototoxicity in rat. Hear Res 1993: 71: 202-7.
Wouters BG. Mitochondriab dysfuction after aerobic exposure to the hypoxic cytotoxin tirapazamine. Cancer Res 2001: 61: 145-52.,
Xiang ML, Mu MY, Pao X. Chi FL. The reinnervation of regenerated hair cebls in the basibar papilba of chìcks after kanamycin ototoxicity. Acta Otobaryngob 2000: 120: 912-21.
Young JS. Upchurch MB. Kaufman MJ. Fedchter LD. Carbon monoxide exposure potentiates high-frequency auditory ihreshoid shifts induced by noise. Rear Res 1987: 26: 37-43,,
Zou J. Bretbau P. Pyykko i. Starck i. Toppila E. Sensorineurab hearing bss after vibration: an animaI model for evabuating prevention and treatment of inner hear hearing bss. Acta Oiorynobaryngob 2001: 121: 143-150.