ELETTROCOCLEOGRAFIA
(alcune attrezzature potenziali evocati studio Tanzariello)
|
|
|
|
Fig.1a:ICS Chartr – Fig.1b Interacoustics EP 25 |
Fig.1c Interacoustics- Fig.1d:ICS Chartr Fig.1e:Amplaid MK12 |
|
|
|
|
Fig.1f Preamplificatore ICS Chartr EP 200 Chartr |
Fig.1g Preamplificatore Neurosoft |
 Elettrococleografia (ECochG) è un termine che è stato applicato ad una famiglia di tecniche elettrofisiologiche diretti specificamente verso la registrazione dei potenziali di stimolo legate generate dalla coclea e ottavo nervo. L’elettrococleografia (ECOG) è un test diagnostico che studia la funzione dell’orecchio interno. Questo test misura i potenziali elettrici stimolo connessi (a differenza dei potenziali di riposo), generati nell’orecchio interno in risposta ad uno stimolo sonoro massivo(click ) e spesso include la misurazione dell’intero nervo o potenziale d’azione composto (AP) del nervo uditivo.
Elettrococleografia (ECochG) è un termine che è stato applicato ad una famiglia di tecniche elettrofisiologiche diretti specificamente verso la registrazione dei potenziali di stimolo legate generate dalla coclea e ottavo nervo. L’elettrococleografia (ECOG) è un test diagnostico che studia la funzione dell’orecchio interno. Questo test misura i potenziali elettrici stimolo connessi (a differenza dei potenziali di riposo), generati nell’orecchio interno in risposta ad uno stimolo sonoro massivo(click ) e spesso include la misurazione dell’intero nervo o potenziale d’azione composto (AP) del nervo uditivo.
Con la tecnica transtimpanica(Fig.2a-b) o peritimpanica(si utilizzano speciali elettrodi dorati che vengono introdotti nel condotto uditivo esterno) . L’ ECOG è più spesso utilizzata per determinare se l’orecchio interno ha una quantità eccessiva di pressione nell’endolinfa (liquido dell’orecchio interno ), che può causare sintomi come perdita dell’udito, senso di pienezza sonora, vertigini, e / o tinnito. Questi sintomi sono spesso indicativi di alcune patologie dell’orecchio come la malattia di Meniere o l’idrope endolinfatica. L’Elettrococleografia ci permette di studiare le risposte elettriche generate dalla coclea in seguito ad è possibile registrare precisamente:
a) il potenziale microfonico cocleare (CM); Fig.2b
b) il potenziale di sommazione (SP);
c) il potenziale d’azione del nervo VIII (nervo acustico) (AP). Fig.2b

|
|
|
|
Fig.3 Test-retest elettrococleografico |
Fig.4 Tracciati reali ECochG ottenuti in un soggetto normoacusico |

Figura 4b. Potenzialità dei componenti del electrocochleogram (umano) registrati dal canale uditivo con condensazione (C) e rarefazione (R) clicca stimoli: N1, principale componente del potenziale d’azione intero nervo (AP); CM, cocleare microfonica; SP, potenziale summating. Il CM e SP possono essere selettivamente migliorate manipolando le risposte R e C, come indicato. Ear-canale negativo (-EC) potenziali sono tracciate come deviazioni verso il basso. (Sulla base dei dati provenienti da Coats, 1981.)
L’ ECochG è una variante della risposta evocata uditiva del tronco encefalico (ABR) in cui l’elettrodo di registrazione è collocato il più vicino POSSIBILE alla coclea.
Lo scopo principale di tale tecnica è quella di diagnosticare la malattia di Ménière, ma soprattutto,l’idrope (aumento di pressione dell’endolinfa nel ‘orecchio interno). L’ECochG può anche essere anormale nella fistola perilinfatica, deiscenza del canale superiore La caratteristica comune che collega queste malattie è uno squilibrio di pressione tra il compartimento endolinfatico e perilinfatica dell’orecchio interno,
o nella sordità improvvisa (Filippo, 1997). Il potenziale microfonico cocleare dell’ dell’ ECochG può essere normale nella neuropatia uditiva (Arslan Santarelli e 2002), nonché in altre patologie nelle quali la coclea è sana, ma il nervo uditivo è danneggiato (Yokoyama, Nishida et al. 1999). L’ECochG è stata usata anche come un indicatore di scivolamento temporaneo di soglia che può derivare da un trauma acustico (Nam et al, 2004).
Storia
Un noto neurofisiologo dell’udito di nome di Glen Wever ha scoperto l’ ECochG nel 1930. Questa scoperta ha avuto un grande impatto sulla scienza dell’udito, compreso il lavoro svolto successivamente da Hallowell Davis. Come forse sapete, Hallowell Davis è il padre della evocati uditivi risposte. A Princeton, Wever e Bray (1930a, 1930b) hanno registrato l’attività uditiva da un gatto anestetizzato. Utilizzando un oscilloscopio, amplificatori ed elettrodi, erano in grado di registrare l’attività nella coclea e del nervo uditivo.
Secondo la storia, hanno presentato delle parole da un altoparlante durante le registrazioni. Le parole passavano da l’altoparlante nell’orecchio del gatto ed attraverso gli elettrodi impiantati sul nervo uditivo, erano in grado di decifrare qualcosa di ciò che veniva detto attraverso l’altoparlante. In altre parole, l’orecchio del gatto funzionava quasi come un microfono, di conseguenza, il termine microfonico cocleare (CM).
La figura 5 mostra una sequenza temporale della storia della ECochG. Poco dopo la scoperta del microfonico cocleare (CM) nel gatto, il lavoro è stato pubblicato su Science, che è la più prestigiosa rivista in ambito scientifico. La gente di tutto il mondo ha letto immediatamente il loro lavoro e hanno iniziato a replicare le loro tecniche negli esseri umani. Hallowell Davis, in particolare, scoprì che c’era qualcosa di più e non solo il CM ,ma l’attività del nervo uditivo. Ci fu un’altra risposta, che ha etichettato come Potenziale di Sommazione (SP) (Davis, Fernandez, McAuliffe, 1950). La gente cominciò a rendersi conto che la CM e SP erano interessanti, ma negli esseri umani vi era una componente in più ,un picco registrato, che hanno chiamato il Potenziale d’Azione (AP).
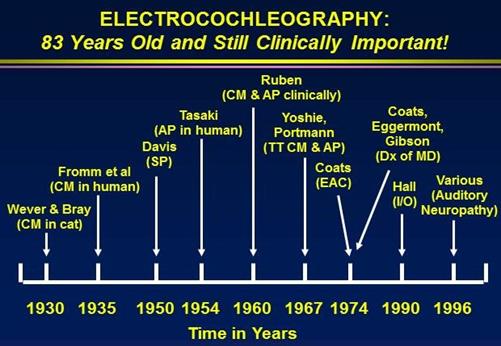
Fig. 5: sequenza temporale della storia della ECochG .
Entro la fine del 1950 e primi anni 1960, un audiologo Chuck a Berlino e l’otorinolaringoiatra Bob Ruben Johns Hopkins hanno dichiarato di poter eseguire questo esame in sala operatoria nei bambini che non potevano essere testati in qualsiasi altro modo. Hanno usato questo come test elettrofisiologico, come un test obiettivo della funzionalità uditiva. A differenza dei nostri piccoli computer che oggi utilizziamo, avevano delle i pesanti attrezzature che venivano portate in sala operatoria. Per ottenere un elettrodo vicino all’orecchio, hanno dovuto eseguire un miringotomia. Per un bambino che sicuramente aveva avuto una perdita di udito, valeva la pena fare una diagnosi accurata per determinare lai gravità dell’ipoacusia.
Nel 1960, la gente ha cominciato a rendersi conto che la registrazione del ECochG non era poi così difficile se veniva utilizzato un ago transtimpanico, che è un lungo ago appuntito, che viene inserito attraverso il timpano. E’ un intervento appena invasivo, e il timpano guarisce subito. Se si poggia l’ago sul promontorio, è ancora possibile registrare queste risposte senza passare effettuare la miringotomia e così è sufficiente praticare una minuscola fessura nel timpano.
Coats era un otorinolaringoiatra presso il Baylor College of Medicine dal 1960 attraverso 1980. Egli è accreditato per aver messo a punto la prima batteria dei test di elettronistagmografia (ENG). Egli era ben versato negli studi vestibolari, ma ha anche fatto una discreta quantità di lavoro con l’ECochG. Egli ha dimostrato che queste risposte possano essere registrati con una tecnica meno invasiva dal canale auricolare. Cappotti, Eggermont, Gibson e altri in tutto il mondo hanno cominciato a rendersi conto che l’ECochG aveva un valore nella diagnosi della malattia di Meniere. Molti di noi che stavano ottenendo nel monitoraggio intraoperatorio fine degli anni ’80 e primi anni ’90 ha iniziato ad adattare tali procedure in sala operatoria con grande successo. Recentemente, c’è stato un rinnovato interesse per ECochG a valutare e monitorare alcuni audiologici / disturbi otologici e neurologici, nel monitorare le procedure chirurgiche, e in integrando misure ABR (Ferraro, 1986). Più di recente, l’ECochG viene utilizzato in molti altri modi, compreso la diagnosi di neuropatia uditiva.
L’ ECochG è stato affascinante. E ‘diventata popolare ma poi è scomparsa quando nei primi anni 1970 è arrivata l’ABR, la maggior parte degli audiologi ha dimenticato l’ ECochG. Ma ora, penso che sia tornata per sempre. Ha troppo da offrire nella diagnosi delle perdite uditive.
Il modo in cui l’ ECochG è stato registrata dai puristi nei primi giorni era quella di mettere un elettrodo sul timpano o un ago attraverso il timpano sul promontorio, o fare un miringotomia con un elettrodo d’argento a palla. L’elettrodo a palla d’argento era un sottile filo che veniva saldato con una palla d’argento di uno o due millimetri lucidata e liscia che veniva posizionata proprio nella nicchia della finestra rotonda. Quando si inserisce l’elettrodo che non invertente e hanno il secondo elettrodo sul mastoide, per esempio, si finisce con di avere una forma d’onda generata con l’apice in giù. L’ N1, o Potenziale d Azione (AP), piuttosto che essere un onda positiva come ci si registra nell’ ABR, è un onda negativa. Risposte di grande ampiezza sono registrati in profondità all’interno del canale uditivo sulla parte ossea della parete del canale uditivo; la registrazione con elettrodi sul promontorio produce risposte di circa 5 microvolt, che sono molto più grandi di quelli ottenuti con una registrazione mediante tiptrode nel canale uditivo che sono di circa 0,5 microvolt
La SP verifica poco prima del N1. Noi registriamo le ampiezze della SP e AP e segniamo la latenza per ciascuno. A volte la gente calcolare la durata di ogni onda, in particolare la SP e AP, perché questo può essere anormale nel caso della malattia di Ménière.
I tre componenti principali dell’ ECochG sono il Microfonico Cocleare o CM, Potenziale di Sommazione o SP, e il Potenziale d’Azione o AP. Ogni paziente normale presenta ciascuna di queste tre componenti. Una delle caratteristiche dell’ ANSD è a volte un grande CM. Tuttavia, devo sottolineare che non tutti grandi uguali ANSD CM. La chiave è di avere un CM, ma non ABR, che trova suggerisce ANSD. Un grande CM seguito da un ABR è perfettamente normale.
Il CM è generata dalle cellule ciliate esterne. Quando la curva stereocilia avanti e indietro, producono una risposta elettrica all’apice della cella capelli, che viene registrata come CM. Questo è un evento normale. Non si sente bene senza CM. La SP deriva principalmente dalle cellule ciliate interne, anche se ci possono essere altri contributi provenienti dal resto della coclea compresi i vascularis stria. Per la maggior parte, villi interni devono essere intatto per registrare un SP normale. Questo è un punto molto importante quando si tratta di diagnosi di ANSD (Auditory Neuropathy Spectrum Disorder)
In sintesi, il Potenziale di Sommazione (SP) è prodotto principalmente dall’ attività delle cellule ciliate interne, il Microfonico Cocleare (CM) da attività delle cellule acustiche esterne ed il (AP) è esattamente la stessa risposta dell’onda I dell’ABR, deriva dalle fibre afferenti nella porzione distale del nervo VIII, quelle più vicini a coclea.
All’interno dell’organo del Corti, c’è una fila di cellule ciliate interne e tre o quattro file di cellule cigliate esterne. Il CM è generato dalla cima delle cellule ciliate esterne. Non ha nulla a che fare con la motilità delle cellule ciliate esterne. Il CM è registrato in una normale cellula ciliata esterna, e quei pazienti di solito hanno OAE normali. Di tanto in tanto, si vedrà un paziente che ha un CM, ma non OAE. Ci sono due spiegazioni per questo. La CM si dice che le cellule ciliate sembrano funzionare. L’assenza di OAE potrebbe essere dovuto ad un’anomalia dell’orecchio medio o è concepibile potrebbe esserci un problema con la motilità-up e down delle cellule ciliate esterne, ma che è più di una anomalia metabolica; non comporta stereocilia .
Parametri di acquisizione
L’amplificazione necessaria per un ECochG è inferiore a un ABR, soprattutto se si utilizza una risposta da un ago transtimpanico. È possibile utilizzare un guadagno di 75.000 o meno. Utilizzare un tempo di analisi di 5 o 10 millisecondi. Si vuole evidenziare queste componenti cocleari primi. Si può fare una registrazione combinata ABR / ECochG, ma il pericolo di che è in uso un tempo di analisi molto lunga, come ad esempio 20 millisecondi. In questo caso, si vadano a finire tutte le attività cocleare nei primi millisecondi ed è molto difficile distinguere le singole onde.
Il protocollo utilizzato Servizio nazionale per la diagnosi di perdita di udito in Inghilterra richiede 3.000 stimoli spazza con un minimo di 1.500. Tuttavia, poiché l’elettrodo è spesso vicino alla coclea per una ECochG, la risposta è abbastanza grande che non è necessario fare la media così tanto. Ho registrato belle ECochGs usando una tecnica transtimpanico dopo 25 stimoli. Potete immaginare se si sta presentando 21,1 stimoli al secondo e hai solo bisogno di media 25 per vedere una risposta chiara? Si prende circa un secondo per ottenere la risposta. La chiave è il rapporto segnale-rumore. Se si utilizza un tiptrode e la risposta è piccola, si ha bisogno in media di più. I record almeno quattro forme d’onda replicate di almeno 500 spazza ciascuna e poi aggiungo tutti insieme. Allora siete veramente alla ricerca di una forma d’onda di 2.000 stimoli.
Devi tenere le frequenze basse nelle impostazioni dei filtri, perché la SP è un potenziale corrente continua che contiene un sacco di basse frequenze. Io suggerisco di usare 10-1500 Hz. Inoltre, un filtro notch non è mai necessaria. Sarà filtrare troppo delle attività ECochG.
Tecniche di registrazione: Tipo di elettrodo e Montaggio
Ci sono due tecniche di registrazione generali disponibili per ECochG. Un metodo comporta l’inserimento di un elettrodo ad ago attraverso la membrana timpanica (TM) in appoggio sul promontorio cocleare. La natura invasiva di questo approccio ha limitato le sue applicazioni negli Stati Uniti. Per questo motivo, l’utilizzo di transtimpanica ECochG non sarà considerato direttamente in questa discussione. Tecniche timpanica (Extra) utilizzano la registrazione elettrodi posti sulla superficie laterale del TM o nel condotto uditivo. Cullen, Ellis, Berlino, e Lousteau (1972) prima descritto un metodo di registrazione superficie extratympanic utilizzando un elettrodo sfera d’argento avvolto in un tampone di cotone imbevuta di soluzione salina e posto dopo il TM. Questa tecnica fornito buoni risultati con il minimo disagio per il soggetto, anche se il soggetto è stato richiesto di sdraiarsi, e lo stimolo doveva essere presentata via campo sonoro. Un elettrodo extratympanic recentemente progettato (Stypulkowski & Staller, 1987) ha riacceso interesse per questo approccio per ECochG in quanto evita in gran parte i problemi con vecchi disegni.
Cappotti et al. (1974) hanno introdotto un gruppo elettrodi che si auto-sostegno, anche se il punto di registrazione è stata allontanata dal timpano e sul pavimento del canale uditivo. Questo elettrodo è illustrato in Figura 6a. Un clip leggero, flessibile ma elastico viene utilizzato per contenere un elettrodo a sfera d’argento contro la parete del canale. Questo elettrodo può essere utilizzato sotto auricolari, offre buone registrazioni, e livelli di rilevamento visivi (VDLs) in molti soggetti si approssima alla soglia comportamentale dello stimolo (vedi figura 6g).
Figura 6. Un gruppo elettrodi per la registrazione dal canale uditivo: (A) elettrodo a sfera argento sostenuta da fermo in acetato; (B) assemblaggio detenuta da pinze, come richiesto per l’inserimento; (C) inserimento nel condotto uditivo. Da Il Electrocochleographic elettrodi Design by AC Coats, 1974, Journal of Acoustical Society of America, 56, pag. 79. Copyright 1974 dalla American Institute of Physics. Ristampato da permesso.
Elettrodi
Se si desidera ottenere il meglio ECochG possibile, è necessario utilizzare un elettrodo transtimpanico.
Qualsiasi otorinolaringoiatra può inserire un ago attraverso la parte posteriore del quadrante inferiore del TM. Non si ha intenzione di colpire la catena degli ossicini. Si sta solo andando a tornare subito fino a raggiungere nel promontorio con l’ago, e poi rimarrà lì. L’elettrodo membrana timpanica è l’opzione migliore per audiologi senza accesso a un otorinolaringoiatra. L’opzione meno attraente e talvolta inadeguata è quello di utilizzare un tiptrode. In ciascuno di questi casi, abbiamo un elettrodo non invertente sulla fronte. L’elettrodo invertente è nel canale auricolare.
Io dico che il tiptrode è l’opzione meno attraente, perché nei pazienti con perdita dell’udito, si potrebbe ottenere così piccole risposte che si può a malapena identificare l’AP, e di solito non c’è SP o CM. Se il vostro AP è inferiore a 1 microvolt, per definizione, il vostro SP e CM stanno per essere molto piccolo. Ho molta voglia di sottolineare questo punto. Se pensate che un tiptrode è l’unica opzione, assicurarsi di inserire il più lontano lungo il canale uditivo possibile. E ‘fisicamente impossibile ottenere sul timpano, perché si esegue nella parte ossea della parete del canale uditivo. Se volete un chiaro, grande ECochG, non mi consiglia di utilizzare tiptrodes, soprattutto per i pazienti con perdita dell’udito conosciuto. Potreste essere in grado di fare un tentativo nei bambini, ma se non funziona, è necessario un piano di backup. L’opzione migliore è un elettrodo transtimpanico ago. Il più vicino è possibile ottenere l’elettrodo alla coclea, meglio è.
Tutto questo porta ad una conclusione molto importante. ECochG è una risposta in campo vicino. Ciò significa che è meglio registrata quando si dispone di un elettrodo all’interno della risposta campo elettrico che producono. L’ABR è una risposta di campo lontano. L’elettrodo è salita sulla testa, ma i generatori della risposta sono giù nel tronco encefalico, che non possiamo accedere superficialmente. L’ampiezza è enormemente ridotta nelle risposte di campo lontano. La risposta del cervello deve passare attraverso la dura, il cranio, la pelle e cuoio e poi all’elettrodo, quindi è solo una frazione di quello che doveva cominciare. Se si registra un ECochG un millimetro dai generatori, otterrete risposte che sono da 20 a 50 volte più grande di ABR.
Nel 1974, Alfred Coats ha sviluppato un elettrodo che è stato chiamato elettrodo a farfalla o l’elettrodo di Coats(fig.6). E ‘stato fatto con da una plastica sottile molto comprimibile. Era a forma di V ed è stato primaverile, quando strinse insieme. Aveva un filo d’argento incollata ad essa, e alla fine del filo argento era una piccola sfera d’argento. Per inserire questo elettrodo, si comprimeva la farfalla con una pinza a baionetta quindi è vicino insieme, e quindi rilasciare delicatamente verso il basso nel canale uditivo. Si mantiene in posizione. Questo elettrodo ha permesso di arrivare molto vicino alla parete ossea del canale uditivo. L’idea era buona. E ‘stato nel canale uditivo esterno. E ‘stato invasivo. Lo ha fatto prendere un po ‘di abilità per collocare questo e farlo tornare senza lacerare la pelle canale. Era molto scomodo, però, perché veniva esercitata molta pressione dalla sfera d’argento sulla delicata parete del condotto uditivo. So per esperienza personale perché ero un soggetto una volta quando Al Coats stava facendo un workshop ECochG. Avevo il sangue che esce dal mio canale uditivo entro la fine della sessione, che non era raro per questo elettrodo.
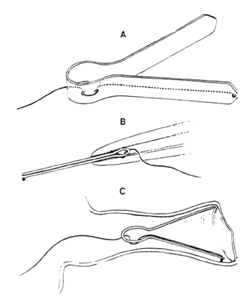
Fig. 6a
Per fortuna, qualcuno ha avuto l’idea di mettere lamina d’oro, che conduce l’elettricità, al di fuori di un auricolare inserimento, e quindi hanno lamina d’oro che scende il filo in modo che si poteva prendere un coccodrillo e agganciarlo al foglio esterno (Figura 6a). Nei primi anni, non appena sono stati sviluppati auricolari inserire, molti di noi ha preso un filo d’argento e avvolse proprio dietro la schiuma e collegato che a un coccodrillo all’altra estremità dell’inserto. Abbiamo fatto i nostri legami tiptrode, ma ora sono disponibili in commercio. Consiglio vivamente che si ottiene un insieme di circa 10 di questi inserti foglia d’oro, uno per ogni orecchio dei cinque pazienti, e ottenere una serie di speciali morsetti a coccodrillo. Qualsiasi dei produttori di risposta evocati loro avranno nel loro catalogo. Si potrebbe pagare $ 50, ma è possibile riutilizzare i coccodrilli più e più volte. Questa è una grande risorsa. Si utilizza l’inserto auricolare che invia lo stimolo al paziente, ma sta con il tiptrode nel canale uditivo si rileva anche la parte della risposta
|
|
|
|
|
|
|
attrezzatura utilizzate per registrare un ECochG |
|
Fig. 6f
|
Il passo successivo, che è ideale per audiologi, è quello di mettere un elettrodo sul timpano. Eravamo abituati a fare queste prendendo un filo d’argento e filettatura attraverso alcuni tubi microfono sonda. Abbiamo messo alla fine un piccolo pezzo di garza o di cotone. Vorremmo immergere il cotone in soluzione salina, scivolare giù nel canale uditivo al timpano ed avere un coccodrillo che permetterebbe di ottenere il filo d’argento regolare alla tua casella di elettrodi. Abbiamo poi inserito l’auricolare nel canale per tenere il filo in posizione. La Biologic per un pò di tempo ha realizzato questi elettrodi a membrana timpanica ‘, ma poi ha interrotto la produzione . Sistemi acustici intelligenti ora li fa. Essi sono approvati dalla FDA. Il filo d’argento
ha un pin elettrodo e spine in una scatola elettrodo normale. Problemi inerenti con questo tipo di elettrodo canale dell’orecchio sono la difficoltà di controllare il posizionamento e relativamente elevate impedenze elettrodo. Impedenze in genere sono in eccesso di 20 kohm (Durrant, 1986). Con preamplificatori moderni ei loro impedenze di ingresso molto elevati, la grandezza dell’impedenza dell’elettrodo non è tanto di preoccupazione in quanto è l’equilibrio tra ciascun ramo del circuito formato nel collegamento dell’amplificatore differenziale al paziente. L’equilibrio tra coppie di elettrodi è generalmente scarsa, e questo degrada CMR e del rumore. Impedenze più alti creano anche più artefatto rumore.
Altri disegni di elettrodi canale uditivo sono stati descritti che sono posizionato più vicino all’ingresso del canale uditivo (ad esempio, Whitaker & Lewis, 1984; Yanz & Dodds, 1985). Inoltre, un elettrodo earplug di questo tipo generale confronto con l’elettrodo cappotti, quando quest’ultima è inserita vicino all’ingresso del canale auricolare (Ferraro, Murphy, e Ruth 1986). Questi disegni più recenti hanno sostanzialmente ridotto il problema impedenza a causa delle loro superfici efficacemente grandi. L’ampiezza del potenziale registrata, tuttavia, viene ridotto per meno profonde posizionamento degli elettrodi (cappotti, 1974). Questi elettrodi non sembrano fornire registrazioni utili dell’AP e del PS. Il gruppo elettrodi earplug è simile a auricolari inserire delle tube. Pertanto, la risposta è molto meno sensibili agli stimoli manufatto, rispetto a risposte ottenute con altri tipi di elettrodi canale uditivo utilizzati in combinazione con le cuffie convenzionali.
Si ricorda che in differenziale registrazioni un secondo elettrodo, talvolta chiamato l’elettrodo di riferimento, è necessario, con un elettrodo di terra. Due possibili posizionamenti per l’elettrodo di riferimento sono il lobo ipsilaterale e mastoide. Alcune delle potenzialità desiderata, però, viene annullato dal amplificatore differenziale perché né la lobo ipsilaterale né mastoide ipsilaterale è totalmente inattivo. Siti preferibili per l’elettrodo di riferimento sono il nasion (appena sopra il ponte del naso) o controlaterale lobo / mastoide, che sono relativamente inattivo per il ECochGm. Durrant (1977, 1.986) anche suggerito registrazione tra il canale auricolare e il vertice o fronte per fornire pickup simultanea dei componenti nervose e tronco cerebrale ottavo, come illustrato dalla Figura 6. Anche se questo funziona bene in alcuni casi, in altri casi l’AP può Non essere ritirati molto meglio nel canale uditivo che sul lobo dell’orecchio o mastoide e in altri ancora l’AP può essere schiacciante grande (pregiudicare la soluzione dei componenti del tronco cerebrale). Tuttavia, questo approccio può contribuire a valorizzare la componente nervosa ottava (Wave I) del ABR (Durrant 1986, Eggermont, Don, e Brackmann 1980). In alternativa, un sistema a due canali può essere utilizzato per registrare simultaneamente da orecchio canale e di superficie degli elettrodi e quindi monitorare separatamente le risposte nervose e del tronco encefalico ottavo (Coats & Martin, 1977). Un’altra forma di ECochG non invasiva è quella di registrazione tramite un elettrodo per scalpo / superficie immessi sul lobo dell’orecchio o mastoide. Anche prima della comparsa della carta classico di Jewett, Romano, e Williston (1970), che descrive ABRs, Sohmer e Feinmesser (1967) hanno descritto ECochG utilizzando sostanzialmente le stesse posizionamento degli elettrodi. Le differenze tra questi studi sono stati il riferimento polarità e l’origine presunta delle risposte. Jewett ei suoi collaboratori considerano il vertice di essere attivo, e Sohmer e Feinmesser considerato il lobo di essere attivi. Entrambi sono realmente attivo, ma il lobo (o mastoide) è più attivo per il AP, e il vertice è più attivo per i componenti del tronco. Infatti, è ben noto che il ECoc hGm costituisce la parte iniziale della ABR come illustrato dalla Figura 6.
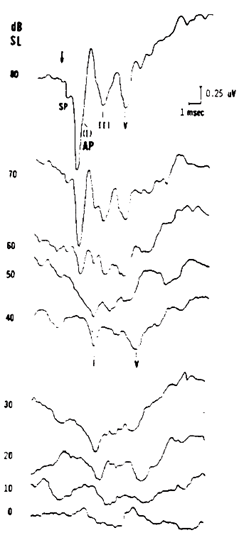
Figura 6g. Elettrococleogramma combinato con registrazione del potenziale del tronco cerebrale a diversi livelli sensazioni del click stimolo. Registrazione montaggio: elettrodo canale uditivo collegato all’ingresso non invertente dell’amplificatore differenziale, elettrodi di superficie posizionati sulla fronte a mezza altezza collegati all’ingresso invertente; elettrodo di superficie posizionato sopra il processo zigomatico collegato a terra. In virtù di questo montaggio nella registrazione, entrambi i potenziali negativi orecchio-canale e fronte / vertice ed i potenziali positivi sono tracciati come deviazioni verso il basso. Dal combinato ECochG-ABR Versus convenzionali ABR Recordings di JD Durrant, 1986 seminari in Udienza (elettrococleografia), 7, p. 292. Copyright 1986 da Thieme Medical Publishers. Ristampato da permesso
Problemi inerenti con questo tipo di elettrodo canale dell’orecchio sono la difficoltà di controllare il posizionamento e relativamente elevate impedenze elettrodo. Impedenze in genere sono in eccesso di 20 kohm (Durrant, 1986). Con preamplificatori moderni ei loro impedenze di ingresso molto elevati, la grandezza dell’impedenza dell’elettrodo non è tanto di preoccupazione in quanto è l’equilibrio tra ciascun ramo del circuito formato nel collegamento dell’amplificatore differenziale al paziente. L’equilibrio tra coppie di elettrodi è generalmente scarsa, e questo degrada CMR e del rumore. Impedenze più alti creano anche più artefatto rumore.
Altri disegni di elettrodi canale uditivo sono stati descritti che sono posizionato più vicino all’ingresso del canale uditivo (ad esempio, Whitaker & Lewis, 1984; Yanz & Dodds, 1985). Inoltre, un elettrodo earplug di questo tipo generale confronto con l’elettrodo cappotti, quando quest’ultima è inserita vicino all’ingresso del canale auricolare (Ferraro, Murphy, e Ruth 1986). Questi disegni più recenti hanno sostanzialmente ridotto il problema impedenza a causa delle loro superfici efficacemente grandi. L’ampiezza del potenziale registrata, tuttavia, viene ridotto per meno profonde posizionamento degli elettrodi (cappotti, 1974). Questi elettrodi non sembrano fornire registrazioni utili dell’AP e del PS. Il gruppo elettrodi earplug è simile a auricolari inserire delle tube. Pertanto, la risposta è molto meno sensibili agli stimoli manufatto, rispetto a risposte ottenute con altri tipi di elettrodi canale uditivo utilizzati in combinazione con le cuffie convenzionali.
Si ricorda che in differenziale registrazioni un secondo elettrodo, talvolta chiamato l’elettrodo di riferimento, è necessario, con un elettrodo di terra. Due possibili posizionamenti per l’elettrodo di riferimento sono il lobo ipsilaterale e mastoide. Alcune delle potenzialità desiderata, però, viene annullato dal amplificatore differenziale perché né la lobo ipsilaterale né mastoide ipsilaterale è totalmente inattivo. Siti preferibili per l’elettrodo di riferimento sono il nasion (appena sopra il ponte del naso) o controlaterale lobo / mastoide, che sono relativamente inattivo per il ECochGm. Durrant (1977, 1.986) anche suggerito registrazione tra il canale auricolare e il vertice o fronte per fornire pickup simultanea dei componenti nervose e tronco cerebrale ottavo, come illustrato dalla Figura 6. Anche se questo funziona bene in alcuni casi, in altri casi l’AP può Non essere ritirati molto meglio nel canale uditivo che sul lobo dell’orecchio o mastoide e in altri ancora l’AP può essere schiacciante grande (pregiudicare la soluzione dei componenti del tronco cerebrale). Tuttavia, questo approccio può contribuire a valorizzare la componente nervosa ottava (Wave I) del ABR (Durrant 1986, Eggermont, Don, e Brackmann 1980). In alternativa, un sistema a due canali può essere utilizzato per registrare simultaneamente da orecchio canale e di superficie degli elettrodi e quindi monitorare separatamente le risposte nervose e del tronco encefalico ottavo (Coats & Martin, 1977).
Un’altra forma di ECochG non invasiva è quella di registrazione tramite un elettrodo per scalpo / superficie immessi sul lobo dell’orecchio o mastoide. Anche prima della comparsa della carta classico di Jewett, Romano, e Williston (1970), che descrive ABRs, Sohmer e Feinmesser (1967) hanno descritto ECochG utilizzando sostanzialmente le stesse posizionamento degli elettrodi. Le differenze tra questi studi sono stati il riferimento polarità e l’origine presunta delle risposte. Jewett ei suoi collaboratori considerano il vertice di essere attivo, e Sohmer e Feinmesser considerato il lobo di essere attivi. Entrambi sono realmente attivo, ma il lobo (o mastoide) è più attivo per il AP, e il vertice è più attivo per i componenti del tronco. Infatti, è ben noto che il ECochGm costituisce la parte iniziale della ABR come illustrato dalla Figura 6g.
Recentemente sono apparsi in letteratura Confronti tra le registrazioni ECochG attraverso la membrana timpanica (TM), nel condotto uditivo e superficiali, (Ferraro e Ferguson, in press; Ferraro et al, 1986; Stypulkowski & Staller 1987, Ruth, Lambert, e Ferraro, in corso di stampa , Ruth, Mills, e Ferraro, in corso di stampa). Come previsto, le registrazioni dalla TM producono le risposte più grande, più sensibili e affidabili tra i tre approcci. Anche se è possibile registrare l’AP o anche il CM (Sohmer & Pratt 1976) dal lobo dell’orecchio o mastoide, registrazioni da questi siti soffrono di una sostanziale riduzione della sensibilità rispetto alle tecniche di registrazione nel canale auricolare (Ferraro et al. 1986). Registrazioni affidabili del SP da siti remoti come il lobo / mastoide devono ancora essere dimostrata.
L’opzione migliore è l’elettrodo transtimpanico ad ago (Fig. 7). Quest’esame viene eseguito in sala operatoria. L’ago è molto breve , circa 14 mm, la punta dell’ago va appoggiata sul promontorio. Quando si arriva in questo luogo, si inserisce un auricolare inserimento nell’orecchio. È possibile fissare con del nastro i fili sulla guancia per assicurarsi che non vengano tirati (Fig. 8). Non c’è modo che l’ago sta per venire fuori se non si tira fuori. Alcuni si preoccupano di lasciare un foro sulla membrana timpanica, ma se si dovesse fare un timpanogramma la mattina successiva, il timpano sarebbe già guarito.

Fig. 7.Elettrodo transtimpanico ad ago.
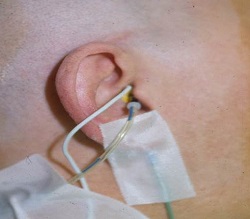
Fig.8. Posizionamento degli elettrodi transtimpanici con l’inserto auricolare nel canale uditivo .
Gli aghi per ECochG sono caduti in disuso perché sono generalmente ritenuti eccessivamente invasivi e dolorosi (Bonucci e Ippolito, 2009). Il loro uso principale sarebbe quello di utilizzarlo in un paziente che ha una perforazione, in questo caso, l’ago può essere piazzato tramite la perforazione e può fornire un segnale migliore senza fare ulteriori danni per l’orecchio. Le complicazioni degli aghi per ECochGs comprendono principalmente la perforazione e il dolore (Ng, Srireddy et al. 2001). Tuttavia sono ancora usati in alcune situazioni (Ge e Shea, 2002). Nella nostra esperienza, l’elettrodo sopra riportato funziona molto bene e generalmente non è necessario utilizzare una metodologia invasiva.
L’orecchio viene stimolato con clic di polarità alternata (anche se il” ton bursts “può essere utilizzato ). L’obiettivo è quello di registrare l’onda 1 (ci sono 5 onde), con maggiore precisione e per individuare il ” potenziale di sommazione “, che è più grande nella prima onda . In alcuni casi, il microfonico cocleare viene ispezionato. Una persona con una onda microfonica cocleare intatta, ma con una ridotta o assente prima onda, potrebbe avere una lesione del nervo VIII°. In altre parole, il suono arriva alla coclea (creando il’microfonico),, ma non passa attraverso il tronco cerebrale (ovvero non ci sono le onde prima quinta 1-5)

Figura 9: ECochG anormale sul lato destro. Nota: il più alto SP sulla destra.
I risultati ECochG sono riportati come rapporto SP / AP, per i quali un rapporto di 0,5 o più grande è considerato anormale. Mentre alcuni laboratori usano lo 0,35, , (Chung et al, 2004), considerando tutti i problemi tecnici con ECochG (vedi sotto), pensiamo che sia meglio essere più prudenti. La sensibilità del SP / AP in rapporto alla malattia di Mènière è del 60-71%. La sensibilità è più alta se l’esame è stato eseguito nel corso di un periodo di malattia (sintomatologico) (Devaiah et al, 2003), ma è difficile ottenere pazienti prenotati attesa per la prova quando sono in fase acuta . Inoltre, alcuni autori non sono d’accordo che la sensibilità è aumentata quando i pazienti sono sintomatici (Levine, Margolis et al. 1998). ECochG è sensibile all’ operatore (vedi sotto), che può aggiunge della confusione.
Ci sono molti problemi con il test ECochG.
È una deflessione in corrente continua del potenziale di base che compare nella registrazione del microfonico e del potenziale d’azione con elettrodo prossimale, solitamente come una deriva negativa dell’isoelettrica di base, di durata pari alla durata dello stimolo.
Il posizionamento degli elettrodi, la modalità di stimolo e di registrazione sarà la stessa dei due potenziali citati, è possibile mediante tone burst di 10 s ridurre la risposta AP del nervo acustico che compare unicamente all’On dello stimolo e favorire la registrazione del SP che essendo di origine sensoriale non adatta e ha maggior durata. Non ha un’utilizzazione clinica.
La Figura 10 mostra un confronto di un ABR registrato in sala operatoria utilizzando un tiptrode ABR con elettrodo ad ago. Le registrazioni a destra sono state registrate con un elettrodo tiptrode posizionato nel canale uditivo, mostrano elevate quantità di rumore di fondo da varie attrezzature utilizzate in sala operatoria. È possibile identificare onda V se sai quello che stai cercando, ma non è molto chiaro. Entro la fine del caso (figura 6, pannello di destra) c’era così tanto manufatto da apparecchiature aggiuntive che si può a malapena a vedere un’onda I o onda V. Confronta questo a una registrazione a due canali fronte-to-promontorio fatta allo stesso tempo. Onde I a V sono tutti identificabili e non vi è praticamente alcun artefatto. La dimensione della risposta è accettabile anche; 10 a 20 microvolt è molto tipico.

Figura 10. confronto Intraoperatorio ABR / ECochG utilizzando tiptrodi (migliori registrazioni) rispetto agli elettrodi ad ago (registrazioni a sinistra ).
Intensità. Compound AP crescono proporzionalmente all’ampiezza dello stimolo, come mostrato nella Figura 11. AP latenza dipende anche dall’intensità dello stimolo. La latenza del AP è definita come il ritardo tra l’inizio dello stimolo e la comparsa del picco risposta N1. Il grafico della latenza rispetto livello di stimolo è detta funzione di latenza intensità (Figura 11). Questi dati dimostrano che l’intensità dello stimolo diminuisce, la latenza aumenta sistematicamente.
Figura 11. Funzione AP latenza intensità e corrispondenti tracciati ECochG (registrato tramite un elettrodo orecchio-canale).

Lo spostamento di latenza intensità del AP è dimostrata ulteriormente dal ECochGm mostrato nella Figura 12a. La base di questo fenomeno è evidente dalle registrazioni presentate nella figura 12b. Questi ultimi sono stati ottenuti ECochGms in presenza di diverse maschere rumore passa alto. La sottrazione della risposta ottenuta con una maschera di taglio della frequenza più bassa da quella ottenuta con una maschera di una maggiore frequenza di taglio produce il contributo in gran parte dei neuroni che innervano la regione cocleare tra i luoghi segnati dalle frequenze di taglio (Tè, Eldridge, e Davis, 1962 ). La risposta di alto livello è dominato principalmente da contributi di fibre situati vicino alla base (regione ad alta frequenza) della coclea, mentre i contributi provenienti da regioni a bassa frequenza tendono ad annullarsi a vicenda (Eggermont, 1976a). Le risposte di basso livello mostrati nella Figura 12a hanno latenze corrispondenti alle risposte generate da bande centrate intorno al 2000 Hz, che è coerente con la maggiore sensibilità del vicino soglia 2.000 Hz regione. Lo spostamento di latenza intensità, pertanto, è principalmente un riflesso del tempo richiesto per l’onda viaggiante replicarsi al posto corrispondente lungo la membrana basilare. Come discusso in precedenza, lo scatto ha un ampio spettro ma lo stesso meccanismo è coinvolto anche con maggiore frequenza stimoli specifici come pacchetti di toni. Poiché più fibre basalward saranno reclutati come il livello dello stimolo viene aumentato, le latenze si accorciano. Il punto importante è che le diverse popolazioni di neuroni dominano il AP a differenti livelli e le frequenze di stimolazione.
Figura 12. (A) a larga banda AP click-evocato. Da elettrococleografia da JJ Eggermont 1976, in WD e WD Keidel Neff (Eds.), Manuale di fisiologia sensoriale, vol. 3: Sistema uditivo: argomenti clinici e speciali (650 p.). Berlin, Springer-Verlag. Copyright 1976 da Springer-Verlag, Berlin-Heidelberg-New York. Adattato con il permesso. (b) le risposte a banda stretta derivati che presentano click stimolo presentato a 90 dB peSPL. Da analisi di composti azione risposte potenziali per tonificare Bursts nel Umana e Guinea Pig Coclea da JJ Eggermont 1976, Journal of Acoustical Society of America, 60, pag. 1135. Copyrighted 1976 dalla American Institute of Physics. Adattato con il permesso. Entrambe le serie di registrazioni sono dal promontorio tramite un elettrodo transtimpanica.

Sia il CM e SP sono molto brevi latenze e nessuna dipendenza significativa di latenza intensità della stimolazione. L’entità CM, se rappresentato in unità logaritmiche, cresce in modo direttamente proporzionale alla pressione sonora in decibel, di solito con una pendenza di unità. Come mostrato in figura 9, i suoi acidi grassi saturi in uscita ad alti livelli di stimolazione e anche diminuisce con aumenti continui di intensità (Dallos, 1973).
Figura 13. Funzione CM ingresso-uscita (sulla base dei dati medi da un campione di soggetti normali acustici). Stimolo era un tono raffica 1 kHz della durata di 5 ms; registrazioni spillo dell’elettrodo nel pavimento del canale uditivo, prossimale al timpano. (Figura modificato e ridisegnato da Elberling & Solomon, 1973).
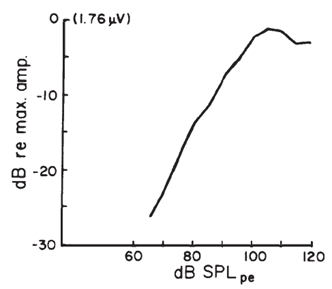
Il comportamento della SP è più complessa rispetto a quella complessiva del CM (Dallos 1973). In generale, solo SP negativo è visto in soggetti normali audizione umani (Eggermont, 1976b). La funzione di ingresso-uscita SP da registrazioni transtimpanica è caratterizzato da una crescita approssimativamente corrispondente con intensità dello stimolo, simile al CM (quando la funzione di ingresso-uscita viene tracciata in coordinate log-log) ma senza molta evidenza di saturazione.
Variabili spettrale e / o temporali. Gli effetti di spettro stimolo e / o caratteristiche temporali sulle brevi potenzialità di latenza sono stati discussi in termini generali precedenti, ma ci sono alcune questioni di interesse specifico per quanto riguarda l’elicitazione della ECochGm. Una variabile rilevante è fase di stimolo. Come illustrato dalla Figura 4b, il CM è sensibile alla fase, mentre il SP non è, e l’AP è solo leggermente sensibile alla fase (cappotti 1981). Inoltre, l’uso di tono che di solito scoppia outlast il clic richiede una particolare cura nella ECochG a causa della possibile contaminazione da radiazioni elettromagnetiche dal auricolare. Ancora una volta, ritardi acustici o schermatura elettromagnetica possono essere utilizzati per ridurre gli artefatti di stimolo.
Frequenza di ripetizione stimolo è un fattore importante per registrare la ECochGm, particolarmente il AP. Come illustrato dalla Figura 10, l’ampiezza del AP e diminuisce la latenza aumenta con l’aumentare della frequenza. Al contrario, la SP e CM (sebbene non evidente nella Figura 10) non sembrano esibire interazioni temporali di qualsiasi conseguenza e mantenere ampiezze essenzialmente costanti indipendentemente dalla frequenza di ripetizione. In effetti, una tecnica impiegata da alcuni per sottolineare la SP è quello di aumentare la frequenza di ripetizione fino a quando l’AP è al massimo depressa (Cappotti 1981, Gibson, Moffat, e Ramsden 1977). Questo metodo richiede frequenze di ripetizione dell’ordine di 100 / secondo, ma anche a questi elevati tassi di ripetizione del contributo AP alla risposta registrata non viene del tutto eliminato perché l’effetto di aumentare la frequenza di ripetizione non è uno di adattamento puro (Durrant 1986; Harris & Dallos 1979). La ripetizione dello stimolo stesso provoca una certa quantità di sincronizzazione di scariche neurali, che può verificarsi anche a frequenze di alcune centinaia di hertz. Altrimenti, l’AP sarebbe completamente adattarsi, piuttosto che accomodante allo stimolo ripetitivo.

Figura 10. Effetti del tasso di stimolo scatti al secondo (CPS); per riferimento, gli intervalli interstimulus (ISI) sono stati calcolati per ogni aliquota testata (*, artefatto). Il click di stimolo è stato presentato a 80 dB SL. AP nonché potenziali tronco cerebrale (I-V) sono stati registrati con elettrodi posti nel canale uditivo e al vertice. Dal combinato ECochG-ABR Versus convenzionali ABR Recordings di JD Durrant, 1986 seminari in Udienza (elettrococleografia), pag. 300. Copyright 1986 da Thieme Medical Publishers. Adattato con il permesso.
Età e sesso. Gli effetti di età e sesso su ECochG non sono stati studiati approfonditamente. Le differenze di genere sembrano sorgere a livello del sistema al di là della ottavo nervo (McClelland & McCrae, 1979). Gli effetti solo noti di età sono durante lo sviluppo precoce (Fria & Doyle, 1984, Starr, Amlie, Martin & Sanders, 1977). Nei neonati, in particolare i neonati prematuri, c’è un leggero ritardo nella AP che diminuisce progressivamente con la maturità. Tale diminuzione può riflettere maturazione del sistema periferico e / o la risoluzione di perdita dell’udito conduttivo che può essere associata con la presenza di fluido nell’orecchio neonatale.
Risposte elettriche cocleari periferiche precoci
Le risposte elettriche cocleari comprendono:
Il potenziale microfonico cocleare (CM)
Il potenziale di sommazione (SP)
Il potenziale d’azione (AP)
Risposte elettriche cocleari Da Arslan mod

Figura 11. Normale elettrococleogramma dalla membrana timpanica a click presentati a polarità alternata a 80 dB HL. L’ampiezza del Potenziale di Sommazione (SP) e del Potenziale d’Azione (AP) può essere misurata da picco a valle (pannello sinistro), o con riferimento a un valore basale (pannello di destra). l’ampiezza / temporale della scala è di 1,25 microvolt / 1 millisecondo per ogni gradazione. Il ritardo per la cuffia ad inserto è 0,90 millisecondi
POTENZIALE MICROFONICO COCLEARE (CM)

Il Microfonico cocleare (CM) Fig. 12a-b è una corrente alternata (AC) di tensione che rispecchia la forma d’onda dello stimolo acustico. Il microfonico cocleare è è una risposta pre-neurale dalle cellule ciliate cocleari esterne, che segue la forma d’onda dello stimolo – è come se la coclea agisce come un microfono, da qui il termine. Come le otoemissione acustiche (OAE), quando presente, può essere considerato come una prova della funzionalità delle cellule ciliate esterne , ma non può essere utilizzato per stimare soglia dell’udito. Il CM è un potenziale recettoriale che viene generato principalmente dalla superficie superiore delle cellule ciliate esterne (OHC), dell’organo del Corti, quest’ultime a causa della loro maggiore numero contribuiscono maggiormente alla generazione del CM. Ciò è suggerito da studi eseguiti su animali trattati con ototossici o sottoposti ad esposizione prolungata di rumore ad alta intensità: una distruzione selettiva delle sole cellule cigliate esterne, riduce di circa dieci volte l’ampiezza del MC. Al contrario, una lesione selettiva limitata alle sole cellule cigliate interne riduce di circa una metà l’ampiezza del MC, Le registrazioni intracellulari tuttavia hanno evidenziato che, nella generazione del MC, cellule cigliate esterne ed interne intervengono in modo molto complesso e probabilmente con contributi individuali diversi a seconda delle regioni cocleari studiate (base, giri intermedi, apice).Il MC è una risposta alternata, contemporanea allo stimolo e che ne ripete le caratteristiche fisiche. Sulla base della costante lunghezza stimata di questa attività extracellulare 8 10 , il CM registrata al promontorio o nel condotto uditivo è tenuto derivare principalmente dalle porzioni più basale della coclea, mentre le regioni apicali danno un contributo trascurabile alla sua generazione 11 . Questo potenziale viene evocato usando click acustici (passa banda 5-3000 Hz) o brevi burst tonali (5-lOms); l’intensità di stimolazione viene fissata a 100 – 110 dB HL, con una velocità di ripetizione di 10 click/secondo. L’attacco del segnale è immediato ed il potenziale risultante assomiglia alla stessa forma d’onda dello stimolo.
La registrazione viene fatta mediante elettrodi posti:
Esplorante: al promontorio (ago transtimpanico), presso l’anulus timpanico o nel condotto (elettrodo ad ago infisso nella cute del condotto o transfisso dal solco retroauricolare).
Elettrodo di riferimento: alla mastoide o al lobo (a coppetta).
Elettrodo di terra: solitamente alla fronte o al lobo controlaterale (a coppetta).
Lo stimolo può essere vario, dal click al tono puro continuo, purché in tale ultimo caso la finestra dell’averaging si apra sempre alla medesima fase di stimolo, la dimensione della finestra d’analisi è di solito di 10 ms, il numero degli stimoli dipende dalla posizione dell’elettrodo attivo, da 50 a 500 se al promontorio, 1000 se nel condotto.
Se si usano clicks si stimola alternativamente con stimoli di opposta polarità sottraendo poi le 2 risposte, ciò per eliminare il potenziale d’azione globale. Il filtro passa banda è di solito 10-3000Hz.
Con elettrodo attivo distante dalla sorgente, oltre a essere ridotta in modo inversamente proporzionale al quadrato della distanza l’ampiezza della risposta, avremo anche una registrazione che rispecchierà l’attività globale cocleare più che l’attività specifica della zona tonotopicamente stimolata, ciò specie per stimoli a bassa frequenza. L’analisi della soglia della risposta e l’andamento della funzione d’ampiezza ingresso/uscita (lineare fino a stimoli di 80 dB SPL per i clicks per poi decrescere) informerà sulla funzionalità cocleare. Ha ormai solo interesse speculativo di ricerca. Il CM è sempre stata considerata di uso clinico 3 – 5 estremamente limitato Recentemente, tuttavia, le registrazioni dei CM hanno attirato nuovo interesse in seguito alla individuazione di neuropatia uditiva (AN), una malattia caratterizzata da disturbi della funzione uditiva periferica con preservazione dell’integrità OHC 15 17 19 . Risposte microfoniche cocleari sono stati rilevati in tutti i pazienti con neuropatia uditiva, con ampiezze simili e le soglie a quelle calcolate per normalmente udenti SNC-soggetti.

Fig.12-b
a) il MC è un potenziale polifasico, la cui forma d’onda riproduce abbastanza fedelmente quella dello stimolo sonoro utilizzato per evocarlo. Rispetto allo stimolo, la latenza del MC è trascurabile e le sue caratteristiche di ampiezza, non essendo influenzate dalla durata dello stimolo né dal ritmo di stimolazione, indicano che non è soggetto a fenomeni di adattamento.
b) il MC evocato da stimoli transitori, presenta un massimo di ampiezza in corrispondenza dei giri basali della coclea; tuttavia anche i giri apicali della coclea rispondono a tali stimoli, contribuendo al MC con quote di potenziale in ritardo di fase e di minore ampiezza.
c) il MC evocato da transitori filtrati passa-basso o da toni di bassa frequenza, è caratterizzato da un’ampiezza massima in corrispondenza del giro apicale della coclea, mentre i giri basali contribuiscono con quote di potenziale di ampiezza ridotta.
d) il MC evocato da stimoli sinusoidali ad alta frequenza, oltre a dimostrare un massimo di ampiezza nei giri basali, “ricopia” fedelmente le fasi e l’inviluppo dello stimolo Se derivato dal giro medio, lo stesso MC presenta un’asimmetricità, essendo inserito in una deriva di corrente continua negativa.
In base a queste osservazioni, si può affermare che il MC derivato esternamente è un fenomeno frequenza-dipendente, che rispettando i principi di tonotopicità della meccanica cocleare, riflette essenzialmente i movimenti della partizione cocleare Rispetto all’intensità dello stimolo che lo evoca, il MC ha un’ampiezza che varia abbastanza linearmente fino a circa 60-80 dB SPL, Per intensità più elevate l’ampiezza della risposta tende a rimanere stabile o a ridursi leggermente (saturazione).
POTENZIALE DI SOMMAZIONE (SP)
Meccanismo
Cochlear Summating potenziale
Il potenziale di sommazione è un grosso potenziale che si manifesta con la stimolazione sonora . La polarità del potenziale di sommazione può essere sia positiva che negativa , e le proprietà di questo potenziale campo locale dipenderà dal fatto che le registrazioni siano realizzati con la tecnica di registrazione con elettrodo differenziale utilizzando elettrodi nella scala timpanica e scala vestibolare o semplicemente con un singolo elettrodo attivo sulla finestra rotonda . Fig. 13-A è uno schema che illustra come la polarità del di potenziali sommazione variazioni di frequenza quando registrazioni sono state effettuate dal giro apicale utilizzando la tecnica di registrazione differenziale . Il picco dell’envelope del percorso dell’ onda con un tono di 500 Hz si trova all’apice della coclea . il CF in questa posizione nella coclea . La polarità del potenziale di sommazione nel vertice della coclea mostra la massima negatività vicino a 500 Hz , il CF , e la negatività della risposta diminuisce a frequenze più basse e a frequenze più alte . A circa 1000 Hz . il potenziale di sommazione diventa positivo , raggiungendo il massimo intorno al 1200 Hz , e poi diminuisce gradualmente a frequenze più elevate . Pertanto , il potenziale di sommazione registrato con la tecnica elettrodo differenziale mostra una sintonizzazione spaziale relativamente forte ed una marcata inversione di polarità .
|
|
Figura 13 (A) Schema che illustra il potenziale di sommazione registrato dal giro apicale della coclea utilizzando le tecniche degli elettrodi differenziale con un solo elettrodo nella scala timpanica (ST) e di altro elettrodo nella scala vestibolare (SV) L’ordinata mostra la differenza di voltaggio tra ST e SV tracciati su una scala logaritmica. e l’ascissa indica la frequenza dello stimolo utilizzato per suscitare il potenziale di sommazione. Il potenziale di sommazione mostra la massima negatività intorno a 500 Hz, la frequenza caratteristica del giro apicale della coclea (8) Schema che illustra il potenziale summating contro ondata tempo [orm di tono 3kHz scoppiare registrato dalla finestra rotonda nota la risposta corrente-come positivo diretto (C) Schema che illustra il potenziale amplitude summating contro intensità sonora (summating potenziale ampiezza tracciati su una scala logaritmica). SPI, livello di pressione sonora |
La figura 13-B è uno schema che mostra le caratteristiche temporali del potenziale di sommazione registrati ( registrazione con filtri a larghezza di banda di circa 0,3 a 200 Hz ) con un solo elettrodo posto sulla membrana della finestra rotonda in risposta a tone burst di 8000 Hz. Il potenziale di sommazione consiste in uno spostamento DC positivo durante la durata del tone burst ; la risposta DC scende rapidamente a zero alla fine dello stimolo . Il potenziale di sommazione è una risposta graduata la cui ampiezza varia con l’intensità dello stimolo come schematizzato nella fig.13-C. Quando tracciati su una scala logaritmica , l’ampiezza del potenziale di sommazione tracciata inizialmente aumenta approssimativamente in forma lineare con l’aumentare dell’ intensità sonora e satura gradualmente ad alta intensità Le origini del potenziale di sommazione non sono pienamente compresi , ma gli studi delle lesioni con farmaci ototossici hanno dimostrato che l’ampiezza o il potenziale di sommazione si riduce notevolmente quando le cellule ciliate interne sono distrutti : ulteriore perdita di cellule ciliate esterne si traduce in un ulteriore ma più piccolo calo ( Durrant et al , 1998) . Questi risultati suggeriscono che le cellule ciliate interne svolgono un ruolo significativo nel generare il potenziale di sommazione
|
|
|
|
Figura 13 (B) Schema che illustra il potenziale di sommazione contro ondata tempo [orm di tono 8kHz scoppiare registrato dalla finestra rotonda nota la risposta corrente-come positivo diretto |
Figura 13 (C) Schema che illustra l’ anipiezza del potenziale summating contro intensità sonora (summating potenziale ampiezza tracciati su una scala locjarithmic). SPI, livello di pressione sonora |
I potenziali di sommazione, riflettono lo spostamento statico della membrana basilare La SP è una risposta complessa che comprende diversi componenti . Come il CM , il SP è stimolo – correlato e generato dalle cellule ciliate dell’organo del Corti. Anche come il CM , IL SP è un riflesso del modello di spostamento nel tempo della partizione cocleare. Considerando che il CM riflette la forma d’onda dello stimolo , tuttavia , il SP visualizza una versione rettificato corrente continua ( DC) di questo modello più rappresentativo o burst stimulus ( DaIIos. 1973) Il SP si manifesta come una camicia in base al CM , la direzione ( o polarità ) sono dettati da un effetto interattivo tra i parametri di stimolo ( Per esempio, frequenza e intensità) e la posizione o l’elettrodo di registrazione . Il rapporto tra le forme d’onda CM e SP è illustrato nella fig . 15 Quando viene registrato per via transtimpanica ( cioè , attraverso la TM o canale uditivo ) , il SP è spesso visto come una deflessione verso il basso ( negativo ) che persiste per tutta la durata dello stimolo acustico .
A causa della sua complessità , il SP è probabilmente il potenziale cocleare meno compreso ed il suo ruolo nella funzione uditiva rimane poco chiaro . Tuttavia , in risposta ad uno stimolo DC AC , la SP è pensato per rappresentare la somma o diversi processi associati di trasduzione non- lineari della coclea ( Dallos et al , 1972) Pertanto , l’entità del SP può essere un riflesso o la quantità di distorsione che accompagna o è prodotto da questi processi. Questa caratteristica ha reso utile l’SP in certe condizioni cliniche . In particolare è ormai ben documentato che l’ ECochGms di pazienti con MD / ELH mostrano spesso SP che sono ingranditi rispetto ai soggetti normali o pazienti con disturbi cocleari diversi dalla MD / ELH ( Cappotti , 1981; Daurnan et al , 1986 . Ferraro e Krishnan 1997;Ferraro et al 1983 ‘ , Gibson et al , 1977) . La spiegazione convenzionale di questo risultato è che un aumento del volume endolinfatico crea una distorsione aggiuntiva all’interno del sistema , che viene riflessa nel SP ;non è stato risolto se la natura di questa maggiore distorsione sia meccanica ( Gibson et al . 1977) e/o elettrica ( Durrant e Dailos , 1974), ed altri fattori quali cambiamenti biochimici e/o vascolari possono anche essere responsabile di una SP allargata. Indipendentemente dalla fisiopatologia specifica è emerso come applicazione primaria o della moderna ECochG di oggi che la misurazione della SP può aiutare a diagnosticare, valutare e monitorare MD / ELH Un altro termine utilizzato per indicare una pressione endolinfatica elevata è “Idrope”. Altre fonti di risposte non lineari sono raramente considerate e possono anche essere responsabile della generazione del SP in alcune situazioni. (Cheng et al. 1994).
Figura 14 relazione tra le forme d’onda o lo stimolo acustico (suono) e il risultante microfonico cocleare (CM) e potenziale di sommazione (SP) riquadri mostrano dettagli della CM e suono tracciati Via la base di tempo espansa. ( Da Durrant JD ( 1981) . Fisiologia uditiva e vista ol acufene diario di un fisiologo uditiva di Laringologia e Otology . 4 ( Suppl ) . 21-28 . Con permesso )

Figura 14: ECochG normale. L’ ECochG è interpretato confrontando l’altezza della SP con r l’AP.
Metodo
|
|

Figura 15: Le attrezzature utilizzate per registrare un ECochG, un Bio-Logic Pro Navigator
sia.
L’orecchio viene stimolato con clic di polarità alternata (anche se il” ton bursts “può essere utilizzato ). L’obiettivo è quello di registrare l’onda 1 (ci sono 5 onde), con maggiore precisione e per individuare il ” potenziale di sommazione “, che è più grande nella prima onda . In alcuni casi, il microfonico cocleare viene ispezionato. Una persona con una onda microfonica cocleare intatta, ma con una ridotta o assente prima onda, potrebbe avere una lesione del nervo VIII°. In altre parole, il suono arriva alla coclea (creando il’microfonico),, ma non passa attraverso il tronco cerebrale (ovvero non ci sono le onde prima quinta 1-5)

Figura 16: ECochG anormale sul lato destro. Nota: il più alto SP sulla destra.
I risultati ECochG sono riportati come rapporto SP / AP, per i quali un rapporto di 0,5 o più grande è considerato anormale. Mentre alcuni laboratori usano lo 0,35, , (Chung et al, 2004), considerando tutti i problemi tecnici con ECochG (vedi sotto), pensiamo che sia meglio essere più prudenti. La sensibilità del SP / AP in rapporto alla malattia di Mènière è del 60-71%. La sensibilità è più alta se l’esame è stato eseguito nel corso di un periodo di malattia (sintomatologico) (Devaiah et al, 2003), ma è difficile ottenere pazienti prenotati attesa per la prova quando sono in fase acuta . Inoltre, alcuni autori non sono d’accordo che la sensibilità è aumentata quando i pazienti sono sintomatici (Levine, Margolis et al. 1998). ECochG è sensibile alls operatore (vedi sotto), che può aggiunge della confusione.
· Una corrente continua (DC) che riflette l’andamento nel tempo-spostamento della partizione cocleare in risposta alla dotazione stimolo (Dallos, 1973).
· Generato prevalentemente dalle cellule ciliate esterne dell’organo del Corti
· Visto come un DC (unidirezionale) spostamento della linea di base CM. La direzione di questo spostamento (cioè, positivo o negativo) dipende da una complessa interazione tra i parametri di stimolo e la posizione degli elettrodi di registrazione.
· SP durata dipende dalla durata dello stimolo acustico.
· Indipendente fase di stimolo, ma tende ad essere oscurata dalla CM o stimolo artefatto quando registrate in risposta a stimoli presentati in condensazione o di rarefazione polarità.
Come risposta a stimoli DC AC, almeno alcuni dei componenti della SP sono pensati per rappresentare la somma di varie non linearità associati ai processi di trasduzione della coclea (Tasaki, Davis e Eldridge 1954; Whitfield e Ross, 1965; Davis 1968 ; Engebretson e Eldridge, 1968; Dallos, Schoeny e Cheatham, 1972; Gulick, Gescheider e Frisina, 1989; Ruth, 1994). Pertanto, l’entità del SP è un riflesso della quantità di distorsione che accompagna o è prodotto da questi processi. Questa caratteristica ha reso la SP utile per certe condizioni cliniche. In particolare, è ormai ben documentato che i ECochGms dei pazienti con malattia di Meniere / endolymphatic idrope (MD / ELH) spesso mostrano SP allargata. Logica convenzionale per questo risultato è che il processo di malattia (cioè idrope endolinfatico) aumenta la quantità di distorsione associata al processo di trasduzione, che, a sua volta, viene riflessa dalla SP. (Ad esempio, Schmidt, Eggermont e Odenthal, 1974, Gibson, Moffat e Ramsden, 1977; Gibson, 1978; Moriuchi e Kumagami, 1979; Morrison Moffat e O’Connor, 1980; Coats, 1981, 1986; Kitahara, Takeda e Yazama, 1981; Goin, Staller e Ascher, 1982; Kumagami, Nishida e Masaaki, 1982; Ferraro, Best e Arenberg, 1983; Ferraro, Arenberg e Hassanein, 1985; Staller, 1986; Ruth, Lambert e Ferraro, 1988; Ferraro e Krishnan, 1997).
POTENZIALE D’AZIONE (AP)
È la manifestazione dell’eccitazione delle cellule cigliate e delle fibre del nervo acustico conseguente alla attività elettrica cocleare.
La registrazione viene fatta mediante elettrodi posti:
Esplorante: al promontorio (ago transtimpanico), o presso l’anulus timpanico o nel condotto (elettrodo ad ago infisso nella cute del condotto o transfisso dal solco retroauricolare), avremo in tal caso un potenziale con polarità negativa verso il basso.
Va notato che l’ampiezza del potenziale al promontorio è 15-50 volte maggiore.
Il potenziale d’azione può essere registrato anche con elettrodo esplorante al vertice (onda dei potenziali troncoencefalici), in tal caso l’onda avrà polarità negativa verso l’alto.
Elettrodo di riferimento: alla mastoide o al lobo (a coppetta).
Elettrodo di terra: solitamente alla fronte o al lobo controlaterale (a coppetta).
Lo stimolo deve essere forzatamente impulsivo per generare una scarica sincrona su tutte le fibre del nervo, altrimenti in caso di scarica randomizzata la sommatoria dell’attività globale del nervo tenderà all ‘isoelettrica.
Normalmente vengono usati clicks o clicks filtrati per caratterizzare lo stimolo in frequenza, la polarità sarà alternata per potere eliminare, mediante somma delle risposte la componente microfonica.
Il numero degli stimoli varia da 50 a 500 se al promontorio, 1000 se al condotto, con frequenza di presentazione di 10 -20 pps e tempo di analisi di l0ms.
Il filtro passa banda è di solito 250-3200 Hz.
I parametri che caratterizzano la risposta sono:
La morfologia, studiata prevalentemente da Aran che distingue (Fig.18) onde :
normali, presenti in caso di normoacusia o ipoacusia trasmissiva.
reclutanti presenti nei deficit cocleari
dissociate, in cui alla soglia è presente latenza aumentata con crescita graduale dell’ampiezza (ipoacusie percettive sugli acuti)
allargate, tipica dei casi con Ménière o neurinoma
anormali, ove N 1 è preceduta da una deflessione positiva
Classificazione Aran e Portmann distinguono 5 tipi di risposte in base alle caratteristiche morfologiche dell’A.P. (Fig. 17):
° normale,
° dissociata,
° bifasica,
° allargata,
° anormale.
Risposta normale Le caratteristiche, descritte precedentemente, sono osservabili anche nelle sordità trasmissive senza compromissione cocleare. Uniche varianti sono, nel caso di gravi ipoacusie, la scomparsa del tratto H della funzione ingresso-uscita per l’ampiezza, mentre per la latenza si nota un lieve aumento.
Risposta dissociata È facilmente rilevabile nelle sordità neurosensoriali, soprattutto se la perdita riguarda le frequenze acute.
A valori di soglia si nota un considerevole aumento della latenza, mentre l’ampiezza si costruisce gradualmente, senza che si formi il plateau caratteristico attorno ai 60 dB.
Risposta bifasica Il termine bifasico sta ad indicare il tipico A.P. registrato nei deficit neurosensoriali con curva audiometrica piatta.
In questi casi la latenza, valutata a livelli di soglia, assume gli stessi valori del soggetto normale, mentre si nota un rapido incremento dell’ampiezza all’aumentare dell’intensità dello stimolo. Nella funzione ingresso-uscita dell’ampiezza viene a mancare il tratto L. Ad alte intensità sonore, l’ampiezza raggiunge valori normali.
Il comportamento anormale di crescita dell’ampiezza della risposta è clinicamente conosciuto come “recruitment”.
Risposta allargata È tipica dei soggetti affetti da sindrome di Ménière e da neurinoma dell’acustico. In questi casi è possibile trovare anche risposte del tipo dissociato.
Risposta anormale È detta così la risposta caratterizzata da una deflessione positiva che precede la componente negativa N1. Essa è facilmente riscontrabile nelle sordità neurosensoriali con perdita più evidente sulle frequenze acute.

Fìg.17. Diverse morfologie dell’A.P. sec. Aran
A: normale; B: dissociata; C: bifasica; D: allargata; E: anormale.
|
|
|
L’ampiezza, che normalmente cresce con l’aumentare dello stimolo in modo progressivo fino ai 60 dB, ove mostra un plateau per poi risalire più rapidamente.
Il duplice andamento descritto come fase L e fase H (Aran) è riferito alla risposta delle cellule cigliate esterne e quindi interne, pertanto nelle sordità neurosensoriali con distruzione delle cellule cigliate esterne scompare la fase L.
La latenza che varia da 1.5 a 5ms a seconda dell’intensità dello stimolo.
Le applicazioni cliniche si limitano oggi alla determinazione della funzione cocleare prevalentemente del giro basale e per determinare la latenza di N1 i in caso di assenza dell’onda Ia dei potenziali tronco encefalici e misurare così il tempo di conduzione centrale (intervallo Ia – Va).
APPLICAZIONI CLÌNICHE DELL’ELETTROCOCLEOGRAFIA
Ricerca della soglia uditiva
L’elettrococleografia è considerata una delle prove elettrofisiologiche più affidabili in uso oggi. Più specificamente, usando i click acustici il CAP( Potenziale Di Azione Composito) è in grado di predire la soglia uditiva entro 5-10 dB per le frequenze 3-4 kHz; usando, invece, i burst tonali si ha una correlazione abbastanza buona a 1, 2 e 4 kHz. Poiché la risposta è generata in corrispondenza del giro basale della coclea le informazioni sono limitate alle frequenze medie-alte.
Nei normoacusici, il CAP( Potenziale Di Azione Composito) sarà presente a circa 25 dB; quindi è possibile, per confronto, stabilire se la soglia del paziente è nei limiti della norma o meno.
Applicazioni Otoneurologic. Le utilità clinica nel settore della diagnosi otoneurologiche o differenziali può essere anche stata limitata per ECochG. Sohmer ei suoi colleghi hanno applicato la tecnica di superficie in una varietà di casi (Sohmer & Feinmesser 1973, 1974, Sohmer, Feinmesser, e BAUBERGER-Tell, 1972). Attualmente, la più popolare applicazione clinica della ECochG è per l’identificazione, la valutazione e il monitoraggio della malattia di Meniere o idrope endolinfatico. L’impulso principale per questo è stato il lavoro di Coats (1981), a seguito delle osservazioni di Eggermont (1976b) e Gibson et al. (1977) che l’ampiezza SP è alterata in molti casi. Anche se la logica di questo risultato deve essere ancora ampiamente spiegato, è ben documentato che il ECochGm di molti pazienti di Meniere è caratterizzato da una SP allargato, soprattutto in confronto alla componente AP (cappotti, 1981, 1986; Eggermont, 1976b; Ferraro , Arenberg, e Hassanein 1985; Gibson et al., 1977; Staller, 1986). Questo risultato è illustrato nella figura 11, il che dimostra il rapporto tra le ampiezze SP e AP per gruppi di soggetti che presentano compromissione retrococleare, compromissione cocleare, e la malattia di Meniere.
Figura 19. Grafici a dispersione di SP contro ampiezze AP per tre gruppi di orecchie patologiche. Le curve rappresentano stime di best-fit di ± 2 deviazioni standard per le risposte ottenute da normali orecchie. Le registrazioni dal canale auricolare. Dal potenziale Summating e la malattia di Meniere da AC Coats, 1981, Archivi di otorinolaringoiatria, 107, pag. 205. Copyright 1981 dalla American Medical Association. Ristampato da permesso.

Malattia di Ménière e altri disturbi di origine cocleare
Un aumento del potenziale di sommazione è spesso evidenziabile nella fase precoce di fluttuazione uditiva della malattia di Ménière; una riduzione dello stesso potenziale può essere osservata nella fase in cui la perdita uditiva diventa stabile. In questa fase più avanzata avviene una deplezione delle cellule ciliate. Per questo motivo la riduzione del potenziale può essere considerata un segno di irreversibilità della ipoacusia.
Il microfonico cocleare è più piccolo nei disturbi di origine cocleare (Gibson e Beagley, 1976), invece il potenziale di azione composto tende a manifestarsi in numerose risposte negative, forse segno di idrope endolinfatica (Brackmann e Selters, 1976).
Originariamente, si era sperato che la forma d’onda ECochGm, così come le funzioni di ingresso-uscita e la latenza intensità, sarebbero conformi a modelli distinti in caso di diverse patologie del sistema uditivo. Come riassunto in Figura 19, questo obiettivo è stato parzialmente realizzato utilizzando il metodo transtimpanica (ad esempio, Aran 1978). Qui si può vedere che cocleare, conduttivo, e modelli normali sono abbastanza distinguibili. In una certa misura, modelli simili sono stati dimostrati utilizzando tecniche non invasive come bene (ad esempio, Berlino e Gondra, 1976). Alcuni dati latenza intensità esemplari sono mostrati in Figura 20. Tuttavia, la frequente incapacità di rintracciare il AP fino a bassi livelli di stimolazione limita la misura in cui sia la funzione di latenza intensità o la funzione di ampiezza ingresso-uscita possono essere descritte. Inoltre, il rumore residuo nelle registrazioni non invasive esclude generalmente digitazione accurata della forma d’onda ECochG. Questi fattori hanno ridotto il valore clinico di ECochG non invasivo, anche se sembra che molti di loro possono essere superati registrando dalla TM (Stypulkowski & Staller, 1987).
Figura 20. (A) tipico input-output e funzioni di latenza intensità per i soggetti con udito normale (A) e conduttivo (B), il reclutamento di alta frequenza (C), e reclutando piatta (D) perdita dell’udito. (b) corrispondenti forme d’onda ECochG (registrazioni transtimpanica). Da “Contributi di elettrococleografia alla diagnosi nell’infanzia. Un 8-Year Survey “di JM Aran 1978, a SE Gerber & GT Mencher (Eds.), Diagnosi precoce di perdita dell’udito, pag. 218-219. New York: Grune & Stratton. Copyright 1978 da Grune & Stratton. Adattato con il permesso.

Figura 21. AP funzioni latenza intensità per il gruppo di pazienti con lieve-moderata conduttivo (a) e pendenza perdita dell’udito neurosensoriale (b). Le misurazioni effettuate da registrazioni dalla superficie del timpano. Dalla Applicazione clinica di registrazione VIII umano potenziali Nervo azione Dalla membrana timpanica da CI Berlino, JK Cullen, MS Ellis, RJ Lousteau, WM Warbrough, e GD Lione 1974, Atti della American Academy of Ophthalmology e Otorinolaringoiatria, 78, pag. 404-406. Copyright 1974 da CV Mosby Company. Adattato con il permesso.

Infine, forse la zona più trascurata ECochG è l’uso del CM. Un aspetto scoraggiante è la notevole difficoltà di eliminare stimoli artefatto ad un grado che uno è convinto che solo CM è in fase di registrazione. Sohmer e (di Pratt 1976) sistema di erogazione del suono, hanno discusso in precedenza, è stato progettato specificamente per aggirare questo problema; hanno descritto le registrazioni di successo del CM con elettrodi di superficie. Nonostante il sostegno dato da alcune autorità (ad esempio, Beagley, 1974; Hoke e Lutkenhoner 1981), deve essere ancora stabilito il valore di misura CM come strumento clinico.
Neurinoma dell’acustico
In presenza di un tumore del nervo VIII il microfonico cocleare è normale mentre il potenziale d’azione composto è allargato rispetto alla norma. La conservazione del complesso AP/SP nelle ipoacusie totali e subtotali è patognomonica di una lesione retrococleare (sempre che venga esclusa la possibilità di simulazione).
Tuttavia, nella diagnosi di neurinoma più che l’ECochG sono indicate le tecniche BSER in quanto sono molto più semplici e meno invasive.
ECOG nella sindrome da deiscenza del canale superiore (SCD)
In SCD, c’è un’apertura nel canale semicircolare superiore, che abbassa presumibilmente pressione nel vano perilinfatica, a causa di una finestra “terzo”. Si potrebbe pensare che questo sarebbe molto più prominente eretto rispetto supina. Diversi autori hanno riportato che l’ECOG è elevato in persone con SCD, e che si normalizza con la chirurgia (Arte, Adams et al. 2009, Adams, Kileny et al. 2011).
ECOG nella fistola perilinfatica (PLF).
In PLF c’è un’apertura nella finestra ovale o rotonda. Come nella situazione in SCD, questo può causare la una bassa pressione perilinfatica . Si potrebbe pensare che questo potrebbe essere più prominente eretto rispetto supina, così come l’instabilità del rapporto SP / AP, da corsa per correre o con Valsalva.
Campbell e Abbas (1993) ha riferito che la postura influisce sulla SP / AP in pazienti affetti da PLF. Hanno usato un protocollo inusuale – 6000 Hz tonebursts. Quando hanno fatto uno studio simile negli animali (1994), hanno trovato alta variabilità impedito significatività statistica.
Gibson (1992) con studi transtimpanico durante l’intervento ha riportato buoni risultati. Gibson utilizzato i criteri di un aumento del 15% del AP con o senza una diminuzione della SP durante un periodo di pressione intratoracica sollevata.In altre parole, un miglioramento con pressione sollevata. Risultati simili sono stati riportati da Saas e Densert, sempre utilizzando il metodo TT (1997).
Monitoraggio intraoperatorio
L’elettrococleografia transtimpanica può essere adoperata nel corso di shunt endolinfatico o di altra chirurgia di tipo conservativo per la malattia di Ménière, per controllare l’eventuale diminuzione del potenziale di sommazione che in questi casi è ingrandito a causa del processo patologico in atto.
|
Vantaggi |
svantaggi dell’elettrococleografia |
|
– non influenzata dall’anestesia |
– prova invasiva, richiede anestesia |
|
misura le perdite sia trasmissive |
– non può valutare le lesioni che neurosensoriali retrococleari
|
|
riesce a distinguere tra lesioni |
– limitata specificità in frequenza sensoriali e neurali
|
|
– valuta la funzione sia pre- che |
– ricerca di soglia al di sotto dei post-sinaptica 1 kHz incerta
|
|
– prova monoaurale |
– costo elevato (l’elettrodo TT va inserito dal medico)
|
|
|
|
I° APPROFONDIMENTO
Introduzione
Come il termine indica ,l ‘Electrococleografia (ECochG) è un metodo per registrare i potenziali elettrici della coclea. L’ECochG comporta in genere la misura dello stimolo correlato ai potenziali cocleari (in contrapposizione al potenziale di riposo), e spesso include la misurazione di tutto il nervo o del potenziale d’azione composto (AP), del nervo uditivo.
Il prodotto di un ECochG (vale a dire, un Electrococleografia ECochGm) è mostrato nella in Figura 1A.
Fig.1.A. Componenti di un elettrococleogramma umano evocato da stimoli (click). Il tracciati più alto visualizza le risposte a clic polarità di rarefazione (R) e di condensazione (C). Sommando le risposte separate R e le risposte C (figura al centro i) migliora il potenziale di sommazione (SP Summating Potential ) ed il potenziale d’azione del nervo acustico (AP). Sottraendo risposte R e C (ultima figura in basso ), migliora il potenziale microfonico cocleare CM ( Cochlear Microphonic) (da ASHA, 1988, pg. 9, basato sui dati di Coats, 1981).
Come illustrato in questa figura, i componenti di un ECochGms possono comprendere il microfonico cocleare (CM), il potenziale cocleare di formazione (SP), e AP misurata in modo indipendente o in varie combinazioni. Si rimanda il lettore a Ferraro (2000) per una revisione più approfondita della storia di queste potenzialità, registrati negli esseri umani.
![]() Anche se a disposizione dei ricercatori è clinici audiologi da oltre 50 anni, l’ECochG emerge come uno strumento clinico (così come tutti gli altri potenziali evocati uditivi) questo potenziale è stato rivalutato in parte dalla scoperta, l’applicazione e la popolarità della risposta uditiva del tronco encefalico (ABR). Un altro fattore importante, che ha agevolato la recente popolarità clinica di ECochG in particolare, è lo sviluppo e il perfezionamento di tecniche di registrazione non invasive. Le prime electrococleografie (ad esempio, Ruben, et al., 1960; Yoshie, Ohashi, e Suzuki, 1967; Aran e LeBert, 1968), le loro misurazioni eseguite su pazienti sottoposti a chirurgia dell’orecchio medio e / o utilizzato un approccio non chirurgico che ha comportato il superamento con un ago elettrodo che è attraversando lo la membrana timpanica (TM) poggiava sul promontorio cocleare. Anche se questo approccio ‘transtimpanico ‘ (TT), alla ECochG è ancora ampiamente utilizzato in Europa, i metodi di registrazione invasive non sono stati ben accolti negli Stati Uniti. Fortunatamente, i componenti della ECochG possono essere misurati anche in maniera non invasiva da ‘elettrodi extratimpanici’ (ET), situati ad esempio nel condotto uditivo esterno o sulla superficie laterale della TM. Sohmer e Feinmesser (1967), Coats e Dickey (1970) e Cullen et al. (1972), eseguito un lavoro pionieristico in questo settore (una descrizione più approfondita e la discussione sugli elettrodi transtimpanici( TT ))versus gli elettrodi extratimpanici ( ET ) verrà riportata successivamente ).
Anche se a disposizione dei ricercatori è clinici audiologi da oltre 50 anni, l’ECochG emerge come uno strumento clinico (così come tutti gli altri potenziali evocati uditivi) questo potenziale è stato rivalutato in parte dalla scoperta, l’applicazione e la popolarità della risposta uditiva del tronco encefalico (ABR). Un altro fattore importante, che ha agevolato la recente popolarità clinica di ECochG in particolare, è lo sviluppo e il perfezionamento di tecniche di registrazione non invasive. Le prime electrococleografie (ad esempio, Ruben, et al., 1960; Yoshie, Ohashi, e Suzuki, 1967; Aran e LeBert, 1968), le loro misurazioni eseguite su pazienti sottoposti a chirurgia dell’orecchio medio e / o utilizzato un approccio non chirurgico che ha comportato il superamento con un ago elettrodo che è attraversando lo la membrana timpanica (TM) poggiava sul promontorio cocleare. Anche se questo approccio ‘transtimpanico ‘ (TT), alla ECochG è ancora ampiamente utilizzato in Europa, i metodi di registrazione invasive non sono stati ben accolti negli Stati Uniti. Fortunatamente, i componenti della ECochG possono essere misurati anche in maniera non invasiva da ‘elettrodi extratimpanici’ (ET), situati ad esempio nel condotto uditivo esterno o sulla superficie laterale della TM. Sohmer e Feinmesser (1967), Coats e Dickey (1970) e Cullen et al. (1972), eseguito un lavoro pionieristico in questo settore (una descrizione più approfondita e la discussione sugli elettrodi transtimpanici( TT ))versus gli elettrodi extratimpanici ( ET ) verrà riportata successivamente ).
La capacità tecnica di registrazione dei potenziali cocleare e del nervo uditivo negli umani è riportato in una varietà di applicazioni cliniche per ECochG. Questi applicazioni ci permetteranno di avere più sui processi di trasduzione della coclea, e come affinare i nostri approci alla registrazione per renderli più sensibili e affidabili.
Le applicazioni più importante per ECochG al momento includono:
· diagnosi / valutazione / monitoraggio della malattia di Ménière / idrope endolinfatico e la valutazione / monitoraggio delle strategie di trattamento per questi disturbi;
· valorizzazione delle onde I della ABR in presenza di perdita uditiva o quando a meno di condizioni di registrazione ottimali sono stati utilizzati per ottenere la Ia onda
· la misurazione e il monitoraggio della funzione cocleare e del nervo dell’udito durante l’intervento che coinvolgono la periferia uditiva (Ruth, Lambert e Ferraro, 1988; Ferraro e Krishnan, 1997).
CM, SP e AP
Come indicato nel paragrafo precedente, i potenziali più spesso rilevati tramite ECochG includono la CM, SP e AP. Le descrizioni dettagliate di questi eventi elettrici sono abbondanti nella letteratura .. Il lettore è invitato a riesaminare questa letteratura per acquisire una migliore comprensione e l’apprezzamento delle caratteristiche specifiche di queste potenziali e la loro importanza per la funzione uditiva. Le chiavi relative alla registrazione del CM, SP e AP negli esseri umani sono presentati qui di seguito.
Microfonico cocleare (CM – Cochlear Microphonic) – potenziale recettore, presinaptico
Il microfonico cocleare è un potenziale recettore in quanto viene generato dalla superficie superiore delle cellule ciliate all’interno dell’organo del Corti (Tab.I). Questo potenziale viene evocato usando click acustici (passa banda 5-3000 Hz) o brevi burst tonali (5-lOms); l’intensità di stimolazione viene fissata a 100 – 110 dB HL, con una velocità di ripetizione di 10 click/secondo. L’attacco del segnale è immediato ed il potenziale risultante assomiglia alla stessa forma d’onda dello stimolo. Con toni di alta e media frequenza la relazione esistente tra ampiezza del potenziale C.M. e il livello di pressione sonora dello stimolo acustico (funzione ingresso-uscita) è lineare per un ampio tratto (in genere sino a 80-90 dB S.P.L.), indi perde la linearità e intorno ai 100 dB mostra una flessione (Fig.2.A). La distribuzione dei potenziali C.M. lungo la coda è funzione della frequenza di stimolazione. Stimoli acustici di bassa frequenza generano C.M. in tutti i giri della coclea a differenza dei toni acuti che sono più specifici per il giro basale (Fig. 3A). La registrazione del potenziale microfonico cocleare può avvenire con elettrodo esplorante posizionato sul promontorio mediante la tecnica transtimpanica (derivazione a campo vicino), oppure con elettrodo posto nel condotto uditivo, sul lobulo e sulla mastoide (registrazione a campo lontano) (Fig. 4.A). Viene applicata una finestra di analisi di l0-2Oms.
![]()
Fig.2.A. Funzione ingresso-uscita di ampiezza per CM, registrati dalla coclea in una cavia con tone burst di 8 kHz, Si noti come all’aumentare dell’intensità dello stimolo acustico la funzione cresca raggiungendo un massimo attorno ai 90 dB SPL. per poi decrescere per livelli di intensità sonora superiori da A. Arpini e coll. Manuale di audiologia :Del Bo e coll. Masson 1995
![]()
Fig.3.A. Potenziali CM. registrati dal giro basale e lii giro della coclea di una cavia.
Si noti come, a differenza del giro basale, toni di frequenza acuta non generino CM. nel III giro della coclea, (Da Tasaki I., Nerve impulses in individuai auditory nerve fibres ofguineapig J. Neurophysiol., 17, 97-122(1954).
![]()
Fig. 4.A Confronto di potenziali micro tonici cocleari, evocati da una stimolazione tonale di 0,5 kHz, registrati dalla coclea umana con elettrodo posto al promontorio e nel meato acustico esterno. (Da Yoshie. Clinical cochlear response audiometry by meatus of an average response computer: non surgicai technique and clinical use. Revue de Laringologie Otologie Rinologie, supp. 92, 1971).
Il C.M. registrato a distanza X0 dalla cellula cigliata riflette in prima approssimazione l’integrale di convoluzione delle componenti elettriche legate ad ogni cellula cigliata. Il potenziale sarà quindi:
C.M.(Xo) = H(x) W(xo—x)dx dove FI è il voltaggio prodotto da una cellula cigliata posta in un punto della membrana basilare (x), W(x0—x) l’attenuazione spaziale che subisce il voltaggio dei potenziali delle cellule cigliate al punto di registrazione x0.
Quanto minore sarà la distanza x0 — x tanto più ampio sarà il potenziale, perché risulterà minima la contaminazione subita dal C.M. È questo il motivo che fa preferire la tecnica a campo vicino a quella a campo lontano.
CM
· Una corrente alternata (AC) di tensione che rispecchia la forma d’onda dello stimolo acustico a basso-moderato livello di stimolazione.
· Generato prevalentemente dalle cellule esterne i dell’organo del Corti.
· Riflette prevalentemente l’attività basale e cocleare, quando registrate dalla finestra rotonda e da siti più remoti.
· Fase e la durata dipendono dallo stimolo .
· Spesso è difficile da separare gli stimoli dagli artefatti nelle registrazioni non invasive .
· La risposta è inibita quando vengono presentati stimoli a polarità alternata .
· Deve ancora essere stabilita l’efficacia nella diagnosi differenziale di disordini dell’orecchio interno / Disturbi del nervo acustico.
Potenziale di sommazione (SP – Summating Potential)
Questo potenziale è di origine complessa ma deriva primariamente dalle cellule ciliate nella coclea. La risposta della coclea alla stimolazione acustica predispone la membrana basilare in una direzione e questo crea un potenziale secondario in corrente diretta (c d ) che nell’uomo e negativo ( SP) a tutte le frequenze e a tutti i livelli di intensità. Usando i click per la stimolazione il potenziale di sommazione si presenta come una tacca sulla parte discendente del N1 del potenziale d’azione composto. Qualche volta questo viene chiamato complesso AP/SP.
Allo scopo di evidenziare meglio il potenziale di sommazione si possono adoperare i burst tonali (2-3 kHz, durata 6 ms, tempo di salita/discesa 1 ms). Usando questa modalità di stimolazione, il tracciato assomiglia all’inviluppo di un burst tonale (Tab.9.1). E facilmente rilevabile mediante un elettrodo posto nella scala media o in prossimità della finestra rotonda quando la coclea viene stimolata con stimoli acustici di alta frequenza, alta intensità e rapidi tempi di salita. Può essere positivo + S.P. o negativo — S.P. in rapporto al potenziale della scala timpanica preso come riferimento e praticamente uguale a zero.
Kupperman, ponendo l’elettrodo esplorante nella rampa timpanica e quello di riferimento a livello dei muscoli del collo, registrò S.P. che chiamò:
– S.P. in quanto avevano la stessa fase, negativa, del potenziale d’azione N1 (Fig. 5.A).
La sorgente del potenziale di sommazione non è ben conosciuta.
Si è osservato che — S.P. viene notevolmente aumentato da una moderata anossia e che + S.P. è estremamente sensibile alle variazioni chimiche dell’endolinfa. Ciò farebbe supporre — in accordo con la teoria di Von Békésy secondo cui le cellule ciglia- te interne sono più sensibili all’anossia rispetto a quelle esterne — che i + S.P. sarebbero legati all’attività delle cellule cigliate interne mentre i — S.P. deriverebbero da quelle esterne. Davis ha formulato l’ipotesi che questi potenziali siano prodotti da deformazioni della membrana tectoria e più precisamente che i + S.P siano originati da spostamenti radiali o perpendicolari della membrana, mentre gli S.P, da flessioni longitudinali.
Nell’uomo è possibile registrare entrambi i potenziali (+ S.P., — S.P.) la cui funzione ingresso-uscita è molto simile a quella dei C.M.
![]()
Fig.5.A. Potenziale di sommazione (— SP.) e d’azione (A.P.) (N1-N2-N3) registrati alla finestra rotonda di una cavia con la stimolazione mediante click 100 dB S.P.L, (Da Arpini et AI. Auditory function in Guinea pigs. Archives of Otorhinolaryngology, Springer Verlag, 1979).
Il potenziale di sommazione può essere ulteriormente evidenziato come segue:
– il nervo VIII non può far fronte a velocità di stimolazione molto elevate a causa dei suoi tempi di recupero;
invece il potenziale di sommazione non è condizionato da questo fattore;
– si effettuano due registrazioni: una a velocità di presentazione bassa (lO/s) ed una a velocità alta (50/s o 100/s). Poi, usando il dispositivo a memoria divisa nel sistema di averaging, le due risposte vengono inserite entrambe nella memoria del computer;
– la risposta ottenuta nella seconda registrazione rappresenta soprattutto il potenziale di sommazione poiché – a causa della fatica indotta al nervo dalla alta velocità di ripetizione del segnale – il potenziale di azione avrà subìto un processo di “adattamento”;
– di conseguenza, se la seconda registrazione viene sottratta alla prima, la “risultante” rappresenterà il potenziale di azione del nervo VIII senza il potenziale dì sommazione
SP
· Una corrente continua (DC), che riflette lo spostamento time-pattern della partizione cocleare in risposta alla FORMA DELLO stimolo (Dallos, 1973).
· Generato prevalentemente dalle cellule acustiche esterne dell’organo del Corti
· Visto come un spostamento DC (unidirezionale) della base di riferimento MC (Microfonico cocleare). La direzione di questo cambiamento (vale a dire, positiva o negativa) dipende da una complessa interazione tra i parametri di stimolo e la posizione degli elettrodi di registrazione.
· SP durata dipende dalla durata dello stimolo acustico.
· Indipendente fase di stimolo, ma tende ad essere oscurato dal MC (Microfonico cocleare) o artefatto di stimolo, quando registrati in risposta a stimoli presentati in condensazione o rarefazione polarità.
Come risposte a stimoli AC DC, almeno alcuni dei componenti del PS si pensa che rappresentano la somma dei vari non linearità associati ai processi di trasduzione della coclea (Tasaki, Davis e Eldridge, 1954; Whitfield e Ross, 1965; Davis, 1968 ; Engebretson e Eldridge, 1968; Dallos, Schoeny e Cheatham, 1972; Gulick, Gescheider e Frisina, 1989; Ruth, 1994). Pertanto, l’entità del PS è un riflesso della quantità di distorsione che accompagna o è prodotto da questi processi. Questa caratteristica ha fatto della SP utile per alcune condizioni cliniche. In particolare, è ormai ben documentato che la ECochGms dei pazienti con malattia di Ménière / idrope endolinfatico (MD / ELH) spesso display SP allargata. Logica convenzionale per questo risultato è che il processo di malattia (ad esempio, idrope endolinfatico) aumenta la quantità di distorsione connessi con il processo di trasduzione, che, a sua volta, si riflette con la SP. (ad esempio, Schmidt, Eggermont e Odenthal, 1974; Gibson, Moffat e Ramsden, 1977; Gibson, 1978; Moriuchi e Kumagami, 1979; Morrison Moffat e O’Connor, 1980; Coats, 1981, 1986; Kitahara, Takeda e Yazama, 1981; Goin, Staller e Ascher, 1982; Kumagami, Nishida e Masaaki, 1982; Ferraro, Best e Arenberg, 1983; Ferraro, Arenberg e Hassanein, 1985; Staller, 1986; Ruth, Lambert e Ferraro, 1988; Ferraro e Krishnan, 1997).
Potenziale Di Azione Composta (CAP – Compound Action Potential)
POTENZIALE D’AZIONE
I fenomeni elettrici dinamici, evocati in sede cocleare dalla stimolazione acustica, sono trasmessi alle fibre del nervo acustico e danno luogo al potenziale d’azione composto che rappresenta la somma di potenziali d’azione (A.P.) di ogni singola fibra (Fig. 6A).
![]()
Fig.6.A. Teorica rappresentazione di potenziali d’azione di 4 singole fibre, 1, 2, 3, 4. (A) I singoli potenziali concorrono alla formazione del potenziale d’azione globale del nervo (8). da A. Arpini e coll. Manuale di audiologia :Del Bo e coll. Masson 1995
L’eccitazione di ogni singolo neurone dipende dalla forza applicata alle cellule cigliate, la quale è determinata dagli spostamenti dell’onda viaggiante. A tale proposito occorre pensare che i neuroni connessi con le cellule della base cocleare saranno stimolati prima di quelli connessi con le cellule del giro apicale. L’ampiezza del potenziale d’azione composto, limitatamente alla componente N1 quando è evocata da click, è rappresentata dalla seguente espressione che esprime l’integrale di convoluzione:
A(t) =N S(r) a(t — r) dr ove N rappresenta il numero di fibre; s(T) la densità di probabilità della popolazione di neuroni sincronizzati e a(t) la risposta unitaria del neurone registrata alla finestra rotonda.
Metodica di registrazione — Elettrococleografia
L’elettrococleografia (E.Co.G.) si propone di studiare tutta l’attività elettrica periferica con particolare riguardo all’A.P. La metodica di registrazione prevede due differenti tecniche:
• derivazione a campo vicino (tecnica transtimpanica) = elettrodo esplorante:
— al promontorio;
• derivazione a campo lontano = elettrodo esplorante:
— a livello della membrana timpanica (anulus);
— nel condotto uditivo esterno;
— sul palato;
— sulla mastoide;
— sul lobulo.
Grazie al favorevole rapporto segnale-rumore (S/R) la tecnica a campo vicino consente di registrare potenziali più ampi rispetto a quella a campo lontano; infatti quelli al promontorio risultano di 15 ÷ 50 volte più ampi rispetto a quelli registrati in altra sede.
La tecnica transtimpanica consiste nel disporre la triade degli elettrodi in modo differenziale nei punti seguenti:
°elettrodo attivo: al promontorio;
° elettro di riferimento: alla mastoide;
° elettrodo di terra: alla fronte.
L’elettrodo attivo che viene posto al promontorio mediante perforazione della membrana timpanica a livello del quadrante postero-inferiore (Fig. 7A)
![]()
Fig.7A. Schema del posizionamento dell’elettrodo transtimpanico per l’indagine elettrococleografica. (Da Aran IM, L ‘elettrocochléogramme. In Le Cahiers de La CFA, 1971).
consta di un sottile ago di acciaio o tungsteno lungo 5 mm, con un diametro di circa 0,3 mm, ed isolato elettricamente per tutta la sua lunghezza ad eccezione dell’estremità (Fig. 8A).
![]()
Fig. 8.A. da A. Arpini e coll. Manuale di audiologia :Del Bo e coll. Masson 1995
Per contro gli elettrodi di superficie, applicati alla mastoide e alla fronte, sono di Ag-AgC1 (vedi Apparecchiature).
Gli stimoli acustici inviati tramite cuffia auricolare o altoparlante sono costituiti generalmente da click o toni con brevi costanti di tempo.
Nella pratica corrente lo stimolo più usato è il click bifasico della durata di 60 ÷ 100/sec. La scelta del click con fase positiva e negativa è di fondamentale importanza poiché consente di eliminare i potenziali microfonici cocleari, migliorando il riconoscimento dell’A.P. (Fig. 9.A).
![]()
Fig.9.A. Separazione dei CM. dal potenziale AP. impiegando click di fase positiva (A) e negativa (B).
Le operazioni algebriche che si possono fare su A e B portano per A—8 la visualizzazione dei CM. e per A + B la visualizzazione dell’AP. da A. Arpini e coll. Manuale di audiologia :Del Bo e coll. Masson 1995.
Il numero minimo di stimoli utili ad ottenere un potenziale facilmente riconoscibile è di circa 2.000, ma questo parametro può variare a seconda delle condizioni d’esame.
La cadenza di presentazione degli stimoli varia da 10 a 20 impulsi/sec. I preamplificatori di segnali biologici usati a scopo clinico, consentono un guadagno sul segnale di uscita variabile da a 106.
Essendo la risposta E.Co.G. un potenziale precoce, che si esaurisce mediamente entro i 6 msec, il tempo di analisi utilizzato dovrà essere almeno 10 msec e la banda passante dei filtri selezionata tra i 250 Hz e 3,2 kHz rispettivamente per le frequenze di taglio inferiori e superiori.
Solitamente, impiegando la tecnica transtimpanica l’adulto viene esaminato in anestesia locale, mentre nel bambino è d’obbligo l’anestesia generale.
Quando vengono adottate metodiche a campo lontano ovviamente non si ricorre ad alcuna anestesia.
Caratteristiche I parametri che caratterizzano l’A.P. sono, come per ogni altro potenziale evocato:
morfologia, ampiezza, latenza.
Morfologia L’A.P. registrato nel soggetto normale presenta tre picchi negativi chiamati N1 N2 N3, dei quali 1V1 e N2 sono i più importanti (Fig. 10A).
![]()
Fig. 10.A. Tipico esempio di AP. registrato con elettrodo
transtimpanico da un soggetto normoudente con click di 80 dB
SPL, Si notino le componenti caratteristiche N1, N2 e N3. (Da Arpini
A., Rossi P. L’elettrococleografia. Audiomètrie, 19, 1975).
Le variazioni morfologiche del potenziale assumono la massima importanza nelle indagini topo- diagnostiche delle lesioni uditive.
Ampiezza L’ampiezza dell’A.P. in un soggetto normale è dell’ordine di alcuni oV ed è direttamente proporzionale all’intensità dello stimolo acustico (Fig.11.A).
![]()
Fig.11.A. Potenziali d’azione registrati con la tecnica transtimpanica in un soggetto normoacusico.
Si osservi come l’ampiezza del potenziale aumenti con il variare dell’intensità del click.
A livelli d’intensità attorno ai 60 dB le ampiezze di N1 e N2 tendono a uguagliarsi mentre per i livelli superiori il voltaggio di N1 aumenta notevolmente. da A. Arpini e coll. Manuale di audiologia :Del Bo e coll. Masson 1995
Per valori inferiori a 60 dB l’A.P. compare come un’unica deflessione negativa riferibile al picco N1. Questo fenomeno è da attribuire al fatto che ad intensità differenti le cellule cigliate partecipano alla costruzione dell’A.P. in modo diverso; più precisamente le cellule cigliate esterne, a soglia più bassa, fornirebbero il picco N1 mentre le cellule cigliate interne, dotate di soglia più elevata, darebbero origine al picco N2.
Nella figura 12A è riportato l’andamento della funzione ingresso-uscita di ampiezza caratterizzata da tre tratti chiamati: “L” (Low) per valori inferiori a 60 dB, plateau per valori attorno ai 60 dB, e “H” (High) per valori superiori ai 60 dB (Yoshie).
![]()
Fig.12.A. Funzione ingresso-uscita di ampiezza di A.P. evocato da click in un soggetto normoudente, Si osservino i tratti LH. separati dal plateau attorno ai 60 dB da A. Arpini e coll. Manuale di audiologia :Del Bo e coll. Masson 1995
Per stimoli tonali attorno ai 2 kHz il comportamento ditale funzione è analogo a quello dei click.
Latenza La latenza dell’A.P. varia nel soggetto normoacusico da 1,5 ÷ 5 msec in rapporto all’intensità dello stimolo ed ha un comportamento di tipo esponenziale negativo. All’aumentare dell’intensità dello stimolo acustico la latenza diminuisce come è dimostrato dalla figura 13A.
![]()
Fig.13.A. Andamento della funzione ingresso-uscita di latenza di AP. evocato da click in un soggetto normoudente. da A. Arpini e coll. Manuale di audiologia :Del Bo e coll. Masson 1995
Il comportamento della latenza varia inoltre leggermente tra stimoli tonali e click. Infatti, come mostra la figura 14.A, le funzioni ingresso-uscita di latenza agli stimoli di 2, 4, 8 kHz corrono parallele, mentre il comportamento della funzione al click si differenzia leggermente dopo i 40 dB. Il range di latenza del click è più ristretto dei tone burst.
![]()
Fig.14.A. Funzione ingresso-uscita di latenza per un soggetto normoudente costruita stimolando con tone burst e con click. (Da J.J. Eggermont. In Handbook ofsensoryphysiology. Auditory sistem. Cap. 15, voI. 3. W.D. Keidel e W.D. Neff (Ed.). Springer Verlag, Berlin-New York, 1977).
La funzione ampiezza-latenza, descritta da Eggermont e Odenthal, ha l’andamento di una iperbole divisibile in due tratti, un tratto con valori minori di 3 msec ed un altro con valori maggiori. Questa relazione è particolarmente evidente nel primo tratto corrispondente a valori inferiori a 3 msec.
Sulla base di queste osservazioni gli stessi Autori hanno calcolato il coefficiente di correlazione tra latenza ed ampiezza, che è risultato statisticamente significativo. Questo fatto dimostra l’interdipendenza tra ampiezza e latenza entro valori di 1-10 V e <3 msec.
Dal punto di vista clinico è consigliabile costruire la funzione utilizzando la scala logaritmica. Questa trasformazione fa sì che l’iperbole assuma l’andamento di una retta, il che consente lo studio della funzione in rapporto alle frequenze di stimolazione.
Classificazione Aran e Portmann distinguono 5 tipi di risposte in base alle caratteristiche morfologiche dell’A.P. (Fig. 15.A):
° normale,
° dissociata,
° bifasica,
° allargata,
° anormale.
Risposta normale Le caratteristiche, descritte precedentemente, sono osservabili anche nelle sordità trasmissive senza compromissione cocleare. Uniche varianti sono, nel caso di gravi ipoacusie, la scomparsa del tratto H della funzione ingresso-uscita per l’ampiezza, mentre per la latenza si nota un lieve aumento.
Risposta dissociata È facilmente rilevabile nelle sordità neurosensoriali, soprattutto se la perdita riguarda le frequenze acute.
A valori di soglia si nota un considerevole aumento della latenza, mentre l’ampiezza si costruisce gradualmente, senza che si formi il plateau caratteristico attorno ai 60 dB.
Risposta bifasica Il termine bifasico sta ad indicare il tipico A.P. registrato nei deficit neurosensoriali con curva audiometrica piatta.
In questi casi la latenza, valutata a livelli di soglia, assume gli stessi valori del soggetto normale, mentre si nota un rapido incremento dell’ampiezza all’aumentare dell’intensità dello stimolo. Nella funzione ingresso-uscita dell’ampiezza viene a mancare il tratto L. Ad alte intensità sonore, l’ampiezza raggiunge valori normali.
Il comportamento anormale di crescita dell’ampiezza della risposta è clinicamente conosciuto come “recruitment”.
Risposta allargata È tipica dei soggetti affetti da sindrome di Ménière e da neurinoma dell’acustico. In questi casi è possibile trovare anche risposte del tipo dissociato.
Risposta anormale È detta così la risposta caratterizzata da una deflessione positiva che precede la componente negativa N1. Essa è facilmente riscontrabile nelle sordità neurosensoriali con perdita più evidente sulle frequenze acute.
![]()
Fìg.15.A. Diverse morfologie dell’A.P.
A: normale; B: dissociata; C: bifasica; D: allargata; E: anormale.
Fattori di variabilità Latenza, ampiezza e morfologia dell’E.Co.G. sono strettamente correlate oltre che alle condizioni patologiche e non del recettore cocleare, anche alla posizione degli elettrodi e ai parametri prescelti per la stimolazione e registrazione.
Posizione degli elettrodi Nel caso di registrazione con elettrodo transtimpanico il segnale elettrico sarà più ampio perché derivato in prossimità del centro di elettrogenesi e sarà pure più facilmente identificabile sino a bassi valori di soglia. Se, invece, si effettueranno registrazioni a campo lontano i segnali saranno più deboli e si potranno evidenziare con sicurezza ad elevati valori di soglia intorno ai 40 dB S.L.
La tabella IIA riporta i valori di ampiezza in V del potenziale A.P. registrato con tecniche differenti.
![]()
Effetto della frequenza di ripetizione degli stimolo. Questo fenomeno conosciuto in elettrofisiologia con il termine adattamento incide sensibilmente sulle caratteristiche del potenziale.
Eggermont e Spoor notarono che al diminuire dell’intervallo interstimolo (I.S.I.: tempo che intercorre tra la fine di uno stimolo e l’inizio del successivo) la latenza, l’ampiezza e la morfologia dell’A.P. variavano a causa del periodo di refrattarietà o recupero delle singole fibre, mentre il C.M. e il S.P. rimanevano costanti (Fig.16.A).
![]()
Fig.16.A. Cambiamento della forma d’onda di AP. al variare della frequenza di ripetizione degli stimoli,
Si osservi come le componenti N1, 112, t13 siano facilmente riconoscibili con IS]. compresi da 512 a 128. Con lSl. di 64 sono riconoscibili solo N1 ed N2, mentre per valori inferiori solo N1 è identificabile. (Da Sanford E. Gerber. Audiometry in Infancy. Grune & Stratton, New York, 1977).
Effetto del mascheramento selettivo Il potenziale d’azione varia di ampiezza, latenza e morfologia anche per effetto del mascheramento. Infatti il rumore mascherante stimola una certa quantità di fibre per cui solo una parte di esse sono disponibili per l’inoltro del messaggio.
Valore e limiti Per valutare compiutamente la risposta periferica occorre prendere in considerazione tutti gli elementi che la compongono: C.M., S.P., A.P.
I microfonici cocleari variano considerevolmente di ampiezza in rapporto alla frequenza e alla intensità dello stimolo sonoro: incominciano ad apparire a 60 dB S.L. e sono più ampi per le basse frequenze.
Nelle sordità trasmissive, per ovvie ragioni fisiche, si osserverà una riduzione di ampiezza dei C.M., strettamente correlabile all’entità del deficit conduttivo. Anche nei deficit cocleari si può evidenziare lo stesso fenomeno, rapportabile, però, a diversa causa e precisamente alla riduzione numerica delle cellule sensoriali funzionanti.
Molto importanti sono i rapporti che si possono stabilire tra C.M. e A.P. In assenza di A.P. si potrà porre diagnosi di lesione dell’Vili quando si saranno registrati C.M., mentre si dovrà ammettere una lesione cocleare quando vi sarà contemporanea assenza di C.M. In definitiva, valori normali di C.M. indicano un normale funzionamento dell’orecchio medio e delle cellule cigliate.
Nella pratica corrente, è opportuno isolare i C.M. dall’A.P. — impiegando stimoli acustici bifasici e sistemi di elaborazione statistica — poiché la loro registrazione simultanea complica la interpretazione della risposta evocata.
A tutt’oggi, il potenziale di sommazione fornisce scarse indicazioni cliniche perché non viene evocato sistematicamente. Nei soggetti normali + S.P. è rilevabile per stimoli (oltre 2 kHz), mentre — S.P. è
prevalentemente presente per stimolazioni con frequenze gravi.
Tanto nelle ipoacusie trasmissive quanto nelle cocleari l’ampiezza dei S.P. risulta ridotta. Nelle sordità retrococleari alcuni Autori hanno osservato un allargamento complessivo di S . P . /A. P., valutabile in un aumento relativo dell’area totale.
Il potenziale di azione composto ci fornisce le informazioni più affidabili sulla funzionalità della periferia permettendoci sia il rilievo dei valori di soglia, sia alcune precisazioni topodiagnostiche.
Per quanto concerne il rilievo della soglia uditiva si può affermare che i risultati più sicuri si ottengono nei deficit pantonali (specie se trasmissivi).
Per contro le perdite localizzate alle frequenze gravi non saranno registrate fedelmente.
Inoltre sfuggiranno all’indagine elettrococleografica i residui uditivi sino a 500 Hz poiché la risposta E.Co.G., viene fornita in prevalenza dai giri basale e medio della coclea.
Analogamente sarà impossibile evidenziare flessioni zonali sulle frequenze acute usando click, che eccitano I’ intera partizione cocleare.
Per avere informazioni della funzionalità del giro apicale è necessario utilizzare stimoli tonali come tone pip, tone burst con rapide costanti di tempo e breve durata, oppure mediante il mascheramento selettivo dei giri medio e basale.
Impiegando la tecnica a campo vicino il rilievo della soglia cocleografica nel normoudente si colloca a ± 5 dB dalla soglia soggettiva mentre nel soggetto ipoacusico non offre sempre fini e sicure precisazioni.
A maggior ragione, con la tecnica a campo lontano questi inconvenienti vengono ulteriormente accentuati poiché in funzione del posizionamento dell’elettrodo esplorante, al lobo, alla mastoide, al pa lat ecc., si hanno soglie E.Co.G. che si discostano da quelle soggettive di circa 5-30 dB.
Per poter fare una diagnosi differenziale fra normoacusia e danno uditivo (trasmissivo, neurosensoriale, retrococleare) è necessario analizzare i parametri che caratterizzano l’A.P. Nelle ipoacusie trasmissive le funzioni ingresso-uscita per latenza e ampiezza sono spostate a destra rispetto a quelle normali in relazione all’innalzamento di soglia, ma l’andamento delle stesse non differisce significativamente da quelle del normoacusico (Fig. 17.A).

Fig.17.A. Funzione ingresso-uscita di latenza ed ampiezza di A.P, in un soggetto di anni 48, sordo trasmissivo,
L’andamento è simile a quello del soggetto normale però con slittamento verso destra, in relazione alla perdita uditiva, Si noti come la latenza resti analoga al soggetto normale (2-4 msec) usando click di modesta intensità. (Da Portmann M, Aran J-M, e Lagourge P.: Testing for recruitment by electrocochleography. Ann. Otol, 82, 36-43, 1973).
Nelle forme percettive occorre distinguere i casi di danno cocleare con recruitment (ad esempio, labirintosi menierica) dai casi di patologia retrococleare, in particolare neurinoma dell’acustico. Nella malattia di Ménière la morfologia dell’A.P. non è ben classificabile, però, frequentemente, è dato osservare un’onda di tipo bifasico della classificazione riportata a pag. 207 Del Bo.
Il parametro ampiezza fornisce dati assai più importanti. Il comportamento anomalo consiste in un rapido aumento dell’ampiezza del potenziale, che a partire dai 50-60 dB, per incrementi di pochi dB, raddoppia o triplica i suoi valori iniziali. Tale fenomeno modifica radicalmente le funzioni ingresso-uscita di latenza e ampiezza (Fig. 18.A) il cui andamento tende a farsi rettilineo in rapida ascesa con assenza del tratto L e del plateau.

Fig.18.A. Funzione ingresso-uscita di latenza ed ampiezza dell’AR corrispondente ad un’ipoacusia neurosensoriale con recruitment. Si notino le caratteristiche tipiche ditale patologia: riduzione della latenza, elevati valori di ampiezza a 90 dB H.L. e rapida bifasicità dell’onda. (Da Portmann et Al., op. cit., 1973).
Per contro, la funzione della latenza tende ad avere un andamento quasi simile a quello dei soggetti normali, però con una sensibile riduzione del suo valore e uno spostamento verso destra, direttamente correlato alla perdita uditiva.
Molto più complessa è la diagnosi di neurinoma dell’acustico, in primo luogo perché non vi è una sistematica riproducibilità dell’onda, in secondo luogo per il fatto che i valori di latenza ed ampiezza poco si discostano da quelli che si riscontrano nel normoacusico. Maggiore importanza assume la valutazione della morfologia dell’onda che — per ammissione di vari Autori — appare allargata e deformata (tipo D). In base a queste alterazioni formali sembrerebbe possibile trarre alcune informazioni sulle dimensioni del tumore.
In sintesi, si può concludere che l’E.Co.G. offre i seguenti vantaggi:
° consente sondaggi assai affidabili nel settore periferico;
° trova applicazione tanto nell’adulto, quanto nel bambino sin dall’età neonatale;
° utilizzabile nei casi di immaturità della elettrogenesi cerebrale o di cerebropatia che rendono difficoltosa e talora impossibile la visualizzazione delle risposte corticali;
° non subisce alcuna modificazione variando lo
Tecniche audiometriche
stato del soggetto sottoposto ad esame (veglia, attenzione, sonno spontaneo o sonno farmacologico);
• non viene mascherata da rumore di fondo biologico;
• non necessita di mascheramento dell’orecchio controlaterale essendo una risposta periferica monoaurale.
Per contro, il test presenta alcune limitazioni, ossia:
• sono evidenziabili unicamente deficit uditivi di tipo periferico, mentre sfuggono all’indagine le sordità retrococleari e centrali;
o mancando i dati relativi alla funzionalità dei centri superiori, non è possibile focalizzare le sordità
psicogene;
o il rilievo dei valori di soglia è sufficientemente preciso per i deficit pantonali, ma è meno sicuro per le curve in discesa o ascesa e soprattutto per i residui uditivi sulle frequenze gravi. Per queste ragioni occorre attuare il mascheramento selettivo;
o nei bambini il rilievo dei valori di soglia è più difficoltoso rispetto all’adulto perché il potenziale presenta un’ampiezza ridotta e una latenza aumentata;
o le tecniche di registrazione a campo lontano non forniscono dati sufficienti a svelare le gravi compromissioni della funzionalità uditiva;
° le tecniche di registrazione a campo vicino necessitano di un approccio chirurgico, particolarmente delicato nei bambini. Si impone in tal caso una anestesia generale che richiede, oltre ad una apposita attrezzatura, la presenza di un anestesista per tutta la durata dell’esame. Pertanto, nei bambini il test non può essere effettuato dal solo audiologo in modo routinario e ambulatoriale;
e la durata dell’esame nei bambini è ovviamente lunga.
Questa è una risposta postsinaptica e imita il pattern di scarica di numerosi neuroni uditivi. Può essere prelevato dopo l’estrapolazione del microfonico cocleare e/o del potenziale di sommazione come sopra.
Ad intensità molto elevate il potenziale è grande e riproducibile; assume la forma di un ampio picco negativo (N2) (Tab, 9.1).
Può essere registrato in diversi punti dentro ed intorno all’orecchio e comprende la onda i del complesso dei potenziali del tronco.
AP
· E’ un potenziale AC, che rappresenta la somma delle risposte elettriche sincrone di ,diverse migliaia di fibre del nervo uditivo.
· Dominata dai contributi delle fibre nervose ad alta frequenza,quando questi potenziali sono generati in risposta a stimoli con rapid tempo di salita (come ad esempio quando si stimola con un click a banda larga) (Kiang, 1965)
· Si verifica al momento della comparsa dello stimolo, anche per tonebursts.
· Caratterizzato da una serie di brevi, picchi prevalentemente negativi. N1 e N2 (il primo e secondo picco del AP sono negativi) sono praticamente gli stessi componenti, come le onde I e II del ABR.
· Sono indipendenti dalle fasi di stimolo e di durata.
Per scopi clinici, le caratteristiche più utili del AP riguardano la sua ampiezza e latenza. Il primo è un riflesso del numero degli stimoli elettrici inviati dalle fibre nervose. La latenza del AP rappresenta il tempo che intercorre tra l’inizio dello stimolo e il picco N1. Questa misura è analoga a quella ‘di latenza assoluta’ per le componenti ABR.
Attualmente, forse l’applicazione più diffusa del AP comporta la misura della sua ampiezza rispetto a quella del PS nei pazienti sospettati di aver MD / ELH. Come descritto in precedenza, l’allargamento SP spesso caratterizza la ECochGms di pazienti con MD / ELH. La consistenza clinica di questi dati, però, migliora notevolmente quando l’ampiezza SP viene confrontato con l’ampiezza di N1 per formare il rapporto l’SP / AP (Coats, 1981). È ormai ampiamente riconosciuto che l’allargamento del rapporto di ampiezza SP / AP agli stimoli di tipo clic è patognomonico di ELH.
Tecniche di registrazione
ECochG Transtimpanica versus Extratimpanica
Ci sono due approcci generali per la registrazione ECochG: con elettrodi TransTimpanici (TT) e Extra-Timpanici (ET). L’ECochG con elettrodi (TT )è una procedura invasiva che consiste nel far passare un ago elettrodo attraverso la TM e collocarlo sul promontorio cocleare. Durante gli interventi chirurgici che espongono lo spazio dell’orecchio medio, la registrazioni con elettrodi TransTimpanici TT può essere fatta anche con un elettrodi a palla poggiato sulla finestra rotonda attraverso il campo chirurgico. La maggior parte degli audiologi che utilizzano la ECochG nella diagnostica clinica preferiscono un approccio con ‘elettrodi Extra-Timpanici (ET), in cui le registrazioni vengono effettuate con un elettrodo appoggiato sulla pelle del condotto uditivo esterno o sulla superficie della MT. Per quest’ultimo sito di registrazione, la procedura è indicata anche come ‘ ECochG timpanica (o TM) ‘ (Ferraro e Ferguson, 1989), anche se questo approccio è ancora considerato come con ‘elettrodi extratimpanici’ ET. La figura 19.A mostra un disegno del elettrodo TM utilizzati nella nostra clinica / laboratorio. Dettagli in merito alla sua fabbricazione e al suo posizionamento si possono trovare in Ferraro (1997, 2000). Come osservato in Figura 19.A, la punta del elettrodo è costituito da un piccolo pezzo di gommapiuma impregnato con un gel conduttivo. Recentemente, la gommapiuma è stata sostituita con del morbido cotone e si sono ottenuti degli ottimi risultati con un minore disagio per il paziente.

Fig.19.A. Costruzione del Tymptrode (punta di gommapiuma può essere sostituita con del cotone morbido).
Entrambi i TT e gli approcci di ET ECochG hanno vantaggi e svantaggi. Il principale vantaggio del approccio TT è che la vicinanza degli elettrodi (nella registrazione)ai generatori di risposta prevede un rapporto segnale /rumore molto favorevole. In questa situazione “di campo vicino “si hanno dei risultati con componenti di grandi dimensioni e con una elaborazione media del segnale relativamente breve . Il limite principale del ECochG con elettrodi TransTimpanici (TT )è che è una tecnica invasivo e che richiede l’assistenza di un medico in un ambiente medico. Inoltre, la penetrazione della TM con un ago tende ad essere doloroso, anche quando vengono utilizzati anestetici locali.
In confronto, le registrazioni ET richiedono in media più elaborazioni del segnale ed le componenti tendono ad avere un ampiezza più piccola rispetto ai risultati omologhi otto minuti con TT. Tuttavia, gli approcci ET sono generalmente indolore e possono essere eseguito dagli audiologi, in ambienti non medici e senza sedazione e/ o anestesia locale.
Come sopra indicato, si preferisce utilizzare la TM come sito per la registrazione per ECochG. La TM offre un buon compromesso tra il canale uditivo esterno e la registrazione attraverso gli TT per quanto riguarda le grandezze dei componenti e del segnale tempo medio, e la procedura rimane non-invasiva e, se fatto correttamente, è indolore (Lambert e Ruth, 1988; Ferraro, Thedinger, et al., 1994; Ferraro, Blackwell, et al., 1994; Schoonhoven, Fabius e Grote, 1995). Abbiamo mostrato i modelli di forme d’onda importanti per l’interpretazione della ECochGms nelle registrazioni TM rispetto alle misurazioni TT (Ferraro, Thedinger, et al., 1994). Bisogna fare attenzione, tuttavia, quando si appoggia l’elettrodo sulla TM che è altamente sensibile. Questo approccio a volte può tradursi in una maggiore disagio del paziente rispetto agli altri approcci i, non invasivi, ma certamente non lo stesso disagio che sia quando si associa la ECochG agli elettrodi TT. Inoltre, come accennato in precedenza, utilizzando un cotone morbido invece che la gommapiuma negli elettrodi tymptrode si allevia e/o elimina il disagio del paziente.
La registrazione dei parametri
Le componenti dell’ ECochG in genere si hanno in un periodo di latenza di 10 millisecondi (ms) subito dopo uno stimolo sonoro , pertanto sono considerati far parte della famiglia degli AEP a latenza corta o’ breve ‘(Picton, Hillyard, et al., 1974). La tabella 1 illustra i parametri utilizzati nel nostro laboratorio / ambulatorio per registrare insieme i PS e AP , che sono i componenti che interessano quando l’ ECochG viene utilizzato per la diagnosi di MD / ELH. Questi parametri sono simili a quelli usati per la registrazione l’ABR, con le seguenti eccezioni:
· L’elettrodo di registrazione primario / non-invertente / (+)è stato progettato per essere posizionato sulla MT rispetto al cuoio capelluto / lobo dell’orecchio. In questa configurazione l’AP verrà visualizzato come una deviazione negativa o verso il basso (è convenzione visualizzare le componenti ABR come una deflessione positiva verso l’alto );
· le impostazione a bassa frequenza del filtro passa-banda viene abbassata per registrare il PS (che è una componente DC).
· Considerazioni sugli Stimoli
· Il click a banda larga tende ad essere lo stimolo più importante per la breve latenza del AEP perché si determina una scarica sincrona da una vasta popolazione di neuroni che producono componenti ben definite . Allo stesso modo, è una scelta comune inviare, impulsi rettangolari (della durata di 100 microsecondi ), che produce il click perché il primo spettra, per un clic di questo periodo, si verifica a 10.000 hertz. (cioè, 1 / 100 microsecondi). In realtà, lo spettro del segnale acustico di raggiungere la coclea non è piatta, né larga come 10.000 Hz a causa della limitata gamma di frequenza del trasduttore acustico, nonché per gli effetti di filtraggio dell’orecchio esterno e medio .
La brevità del clic rende lo stimolo meno ideale per lo studio dei potenziali cocleari, dal momento che la durata sia della CM che del e SP sono stimolo-dipendente. Entrambi questi elementi appaiono come brevi deviazioni quando evocate da click (vedi Figura 1). Nonostante questa limitazione, l’utilizzo di click si è dimostrato efficace nel evocare il complesso SP /AP per certe applicazioni ECochG , anche se la durata del PS è abbreviato in queste condizioni (Durrant e Ferraro, 1991).
Anche se il click continua a rimanere molto utilizzato per l’ECochG, l’uso di stimoli tonali è stato applicato in numerosi studi recenti. (Levine, Margolis et al., 1992; Ferraro, Blackwell et al., 1994; Ferraro, Thedinger et al., 1994; Koyuncu, Mason e Shinkwin, 1994; Margolis, Rieks et al., 1995). Gli stimoli tonali in genere danno un più elevato grado di specificità della risposta in frequenza al numero di click, e l’utilizzo di uno stimolo esteso in durata, come i tonebursts consente una migliore visualizzazione del PS e CM (Durrant e Ferraro, 1991).
La polarità dello stimolo è un fattore importante per ECochG. Presentando clic o tonebursts a polarità alternata si inibisce la presenza degli artefatti dovuti allo stimolo ed al CM, che sono entrambi dipendenti dalla fase di stimolo. Gli artefatti di stimolo a volte possono essere abbastanza grandi da oscurare(eliminare )le componenti precoci della ECochG, e la CM può oscurare sia la SP che l’ AP. Poiché sia la SP e AP sono indipendenti dalla fase di stimolo, l’uso di stimoli a polarità alternata è preferibile in quanto le ampiezze di questi componenti sono importanti (come ad esempio nella diagnosi di MD / ELH). La registrazione separate delle risposte per condensazione e rarefazione da click si è dimostrata utile nella diagnosi di MD / ELH, come certi pazienti con questi disturbi mostrano al display AP anomali con una differenze di latenza agli clik con polarità opposta (Margolis e Lilly, 1989; Levine, Margolis, et al., 1992; Margolis, Levine, et al., 1992; Orchik, Shea e Ge, 1993; Margolis, Rieks, et al., 1995; Sass, Densert, et al., 1997). Vengono misurate le risposte ai click di condensazione e rarefazione separatamente per valutare la differenza di latenza AP-N1, quindi a si uniscono le forme d’onda insieme off-line per ricavare l’ ampiezza SP e AP e il loro rapporto.
Per l’ECochG, come per molti segnali evocati AEP , è importante che le risposta cocleare / neurale ad uno stimolo essere completata prima che sia presentato lo stimolo successivo. L’aumento di questa frequenza di oltre il 10 – 30/secondi può causare qualche adattamento della AP (Suzuki e Yamane, 1982). Teoricamente, i tassi di frequenza di 100/secondi determinano la massima soppressione della AP, pur lasciando la SP relativamente inalterata. Gibson, Moffat e Ramsden (1977) e Coats (1981) applicano questa impostazione per ottimizzare la visualizzazione del PS. Purtroppo, l’uso dei tassi di ripetizione di stimoli molto rapidi dimostrato di essere utile in clinica, in parte perché il contributo AP non è stato completamente eliminato e la SP può essere anche ridotta (Durrant e Ferraro, 1991). Inoltre, i clicks presentati rapidamente a bassa frequenza tendono ad essere fastidiosi per i pazienti.
quando l’ECochG viene eseguita per aiutare a a fare diagnosi di MD / ELH, il segnale dovrebbe essere abbastanza forte da evocare una ben definita complesso SP- AP. Così, per questa applicazione iniziammo a presentare gli stimoli ad un livello vicino alla potenza massima erogata del generatore di stimolo. Purtroppo, come accennato in precedenza, vi è una mancanza di standardizzazione per stimoli AEP in materia di calibrazione del segnale e riferimento dB. Riferimenti comuni includono dB Hearing Level (HL, o per l’audizione di soglia ((HTL)), dB Sensation Level (SL), ed equivalente di picco dB Sound Pressure Level (pe SPL). Noi cabriamo i segnali ECochG in entrambe le modalità HL e SPL pe. 0 dB HL rappresenta la soglia media comportamentale di un gruppo di soggetti con udito normale ai vari stimoli utilizzati per ECochG (ad esempio, click e tonebursts). Per dB SPL PE, usiamo un oscilloscopio in modo che il livello del click corrisponda a quella di una sinusoide continua di 1.000 Hz. Coerentemente con i risultati di Stapells et al. (1982), 0 dB HL per i click corrisponde a circa il 30 pe dB SPL.
Il mascheramento dell’orecchio controlaterale non è un problema per l’ECochG convenzionali perché la grandezza di una risposta elettrofisiologica dell’orecchio non testato è molto piccola. Inoltre, le i componenti del ECochG vengono generati prima che venga interessata la via uditiva.
Una nota finale per quanto riguarda gli stimoli si riferisce a un artefatto di stimolo, che può essere abbastanza grande per ECochG a causa della natura elettrodi extra timpanici ET (soprattutto TM). Questi dispositivi possono anche servire come antenne che sono ricettivi ai campi elettromagnetici prodotti dal trasduttore e da altre fonti elettriche presenti nel l’ambiente. Si consigliano i seguenti suggerimenti per contribuire a ridurre gli artefatto dovuti allo stimolo:
• utilizzare un trasduttore ad inserto nel condotto;
• separare il trasduttore e relativi cavi dall’elettrodo ;
• intrecciare i cavi degli elettrodi;
• soggetti in prova in cabina con l’esaminatore e l’unità AEP situato al di fuori della cabina; le finestre della cabina devono essere schermati con uno schermo di rame;
• collegare l’unità AEP ad una una presa elettrica isolato dotato di una vera terra;
• utilizzare un cavo di messa a terra per l’elettrodo primario (tali cavi sono disponibili in commercio);
• spegnere le luci in sala prove e scollegare apparecchiature elettroniche non necessarie (anche può essere necessario spegnere le luci in sala dell’esaminatore);
• considerare che il trasduttore deve essere stretto in terra schermatura metallica Mu.
Interpretazione dell’ ECochGm
La figura 20.A. mostra una ECochGms normale agli stimoli registrate dalla TM. Stimoli sonori di intensità pari a 95 dB HL, e click a polarità alternata per SP e AP. Per ECochG effettuati al livello della TM preferiamo per misurare l’ampiezza ‘assoluta’ o picco-picco del PS e AP (grafica sinistra), anziché utilizzare come riferimento di base (grafico a destra), che viene sostenuto da altri autori (ad esempio, Margolis, Levine, et al ., 1992; Ruth, 1994). La ragione di questa scelta riguarda la considerevole labilità ampiezza di base per le registrazioni ET. Utilizzando i valori da picco a picco dal nostro laboratorio, i valori normali di ampiezza SP (misurata dalla TM a 95 dB HL click )il range varia da 0,1 a 0,8 microvolt, con una media di 0,4 microvolt. L’ ampiezze AP da un range di 0,6 a 2,7 microvolt, con una media di 1,4 microvolt. La latenza AP-N1 è misurata a partire dall’inizio dello stimolo per il picco di N1 e dovrebbe essere identica a quella di latenza di Ia onda del ABR a 95 dB HL, latenze normale del nostro N1 in genere varia dal 1,3-1,7 ms con una media di circa 1,5 ms. Quando si utilizza un trasduttore inserito nella , questi valori avranno un ritardo di circa 0,9 ms. Anche se riportato nella nostra figura,l’ N2 ha avuto uno scarso interesse per le applicazioni EcochG

Fig.20.A. Normale elettrococleogramma dalla membrana timpanica a click i presentati a polarità alternata a 80 dB HL. L’ampiezza del Summating Potential (SP) e del potenziale d’azione (AP) può essere misurata da picco a valle (pannello sinistro), o con riferimento a un valore basale (pannello di destra). Ampiezza / temporale della scala è di 1,25 microvolt / 1 millisecondo per ogni gradazione. Il ritardo per la cuffia ad inserto è 0,90 millisecondi.
Inoltre, come mostrato in figura 21.A, L’ampiezze SP e AP sono realizzati dai punti principali estremi di entrambe le componenti. I valori risultanti sono utilizzati per ricavare il rapporto di ampiezza SP / AP.
I nostri rapporto di ampiezza media SP / AP ai click su soggetti normali è di circa 0,25 + 0,10 deviazioni standard (SD). Anche se la nostra gamma normale per questo valore si estende da 0,10-0,50, si considera che il rapporto di ampiezza SP / AP superiore al 45% (2 DS sopra la norma) debba essere ulteriormente ampliato.
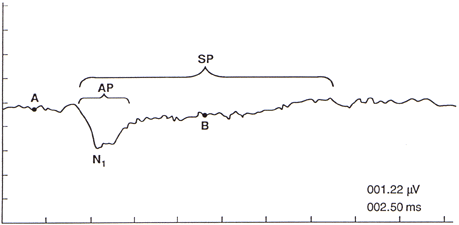
Fig.21.A. Elettrococleogramma normale dalla membrana timpanica a un tone burst 2.000 Hz presentato in polarità alternata a 80 dB HL. Potenziale d’azione (AP) e il suo primo picco negativo (N 1) sono considerati al momento della comparsa di risposta. Summating Potential (SP) persiste fino a quando è presente lo stimolo. l’ampiezza SP è misurata a metà della risposta (punto B), con riferimento a un valore di base (punto A). L’ampiezza (microvolts) / tempo (millisecondi), scala in basso a destra (da Ferraro, Blackwell et al., 1994, pg. 19).
Figura 21.A. mostra una elettrococleogramma normale evocata da un 90 dB HL, 2.000 tone burst Hz (2 ms salita / discesa, 10 ms durata, polarità alternata). A differenza delle risposte evocato dai click- in cui la SP appare come una piccolo deflessione che precede l’AP, la SP per tone bursts persiste fino a quando è presente lo stimolo. L’AP e il suo N1, a sua volta, si vedono al momento della comparsa di risposta. Noi ampiezza misura SP a metà della forma d’onda per ridurre al minimo l’influenza della AP, e con riferimento alla ampiezza di base. La Figura 22.A illustra SP toneburst a frequenze diverse registrate sia dal TM e promontorio (TT) del paziente stesso. Un aspetto importante illustrato in questa figura è che le ampiezze di tone burst-SP sono molto piccoli normalmente in audizione i soggetti. Un altro aspetto degno di nota della Figura 5 è che, sebbene le grandezze delle risposte TM sono circa ¼ che delle risposte promontorio (scale di ampiezza nota), i modelli corrispondenti del TM e registrazioni TT ad ogni frequenza sono praticamente identici.
![]()
Fig. 22.A.. Elettrococleogramma evocato da tone bursts di frequenze diverse presentati a 80 dB HL. Stimolo di frequenza in kHz indicato a destra di ogni forma d’onda. Ampiezza (microvolts ) / tempo (millisecondi), scala in basso a destra (da Ferraro, Blackwell et al., 1994, pg. 20).
![]()
Fig.23.A.
Valorizzazione della I onda
Nel soggetti ipoacusici , compresi quelli con tumori del nervo acustico , L’onda I del ABR può essere ridotta, distorta o assente, nonostante la presenza di un identificabile V onda (Hyde e Blair, 1981; Cashman e Rossman, 1983). Questa situazione riduce significativamente l’utilità diagnostica del ABR poiché gli intervalli tra le onde I-V e III-V non sono misurabili i. In queste e altre condizioni ‘meno ottimali’ di registrazione (ad esempio, rumore elettrico e / o l’ambiente acustico, soggetto inquieto), la registrazione simultanea di AP-N1 attraverso la via ECochG e l’ABR è stato effettuata (Ferraro e Ferguson, 1989; Ferraro e Ruth, 1994). La figura 9 illustra l’approccio combinato ECochG ABR. La I onda è assente in presenza di una V onda nel ABR convenzionalmente registrati per questo paziente (tracciati in alto). Tuttavia, quando l’ABR viene indicata utilizzando come vertice (+)-rispetto alla TM (-) utilizzata come elettrodi di riferimento (calchi in basso), L’N1 è identificabile, e permette di misurare l’intervallo N1-V IWI.
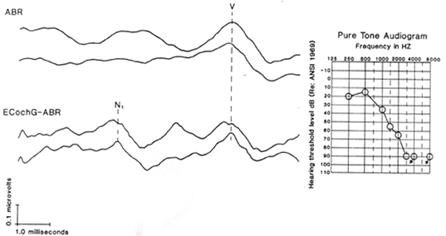
Fig.24.A. ABR registrati come vertice [elettrodo positivo (+)] rispetto al lobo omolaterale (-) elettrodi riferimento , e ECochG-ABR registrati con un vertice (+)-rispetto membrana timpanica -ipsilaterale (-) elettrodi di terra (di riferimento ) da un paziente con perdita uditiva . La I onda è assente nelle tracciati convenzionali ABR ma registrabile con l’approccio ECochG ABR (da Ferraro e Ferguson, 1989, pg. 165).
Monitoraggio intraoperatorio
Il monitoraggio intraoperatorio della dell’orecchio interno e lo stato del nervo uditivo nel corso interventi che coinvolgono il sistema uditivo periferico è diventata una importante utilizzazione per ECochG. Tale controllo di solito viene fatto per aiutare il chirurgo ad evitare traumi potenziale per l’orecchio / nervo nel tentativo di preservare la funzionalità uditiva (Lambert e Ruth, 1988; Ferraro e Ruth, 1994). Inoltre, le registrazioni ECochG intraoperatoria possono essere utili per l’identificazione di punti di riferimento anatomici (come ad esempio il sacco endolinfatico) (Gibson e Arenberg, 1991). Infine, il monitoraggio ECochG è stato esaminato come un metodo per prevedere l’esito post-operatorio, in particolare per i pazienti sottoposti a decompressione endolinfatico / shunt chirurgico per il trattamento di MD / ELH (Gibson, Arenberg e Best, 1988; Gibson e Arenberg, 1991; Arenberg , Gibson e Bohlen, 1993; Wazen, 1994; Mishler, Loosmore, et al., 1994).
Neuropatia Uditiva e Potenziali cocleari R. Santarelli E Arslan Omega Editore 2013
Almeno in prima approssimazione. la diagnosi di neuropatia uditiva non presenta particolari difficoltà in pazienti che mostrano un quadro uditivo tipico, soprattutto se associato a una polineuropatia periferica correlata con una diagnosi genetica definita, Questa affermazione è sostanzialmente valida anche per le forme di AN sottese dalle mutazioni di otoferlina che comportano l’inattivazione della proteina. Tuttavia, è documentato che le OAE5 scompaiono in almeno un terzo dei pazienti che mostrano un tipico quadro di AN (Starr et al, 2008; Rodrìguez-Ballesteros et al, 2008). Inoltre, in alcuni soggetti la soglia uditiva può presentarsi normale (Butinar et al, 2008), mentre in altri casi la percezione verbale risulta compromessa solo in particolari condizioni come l’aumento della temperatura corporea (Wynne et al., 2013)0 in presenza di rumore di competizione (Butinar et al, 2008; Starr et al, 2008). In tutte queste situazioni, ai fini di un correffo inquadramento diagnostico, si rende necessario il ricorso a una valutazione obiettiva specifica che dimostri la presenza di unq alterazione della funzione uditiva periferica. Questo obiettivo può essere conseguito unicamente attraverso la valutazione della morfologia e dei parametri che caratterizzano i potenziali cocleari registrati mediante elettrococleografia con tecnica intratimpanica (electrocochleography, ECochG) (McMahon et al, 2008; Santarelli et al, 2008). L’indicazione diventa evidentemente anche più rilevante nei bambini dimessi dalla TIN per la possibile sovrapposizione di una componente di desincronizzazione centrale che contribuisce in misura variabile e imprevedibile alle alterazioni della risposta ABR (Santarelli e Arslan, 2013).
Più in generale, tutte le forme di neuropatia uditiva, incluse quelle che non sembrano apparentemente mostrare specifiche difficoltà diagnostiche, richiedono comunque il ricorso a una definizione delle caratteristiche dei potenziali generati perifericamente. Questa valutazione si rende necessaria al fine di stabilire il sito di lesione, che potrebbe essere correlato a una disfunzione delle IHCs o a un disordine primitivamente neurale che coinvolge le fibre del nervo uditivo. Tale informazione è ovviamente cruciale ai fini della programmazione della strategia terapeutica per quel che riguarda in parilcolar modo la formulazione di una previsione riguardo ai benefici dell’utilizzo dell’impianto cocleare.
Lesioni delle IHCs e del nervo uditivo
La risposta registrata all’elettrococleografia risulta dalla sovrapposizione di tre componenti, delle quali due sono di origine recettoriale, il microfonico cocleare (cochlear microphonic, CM) e il potenziale di sommazione (summating potential, SP), mentre l’altra risulta dall’attivazione sincrona delle tre del nervo uditivo (compound action potential, CAP) (Eggermont, 1974; Santarelli e Arslan, 2013). Il microfonico cocleare origina dalla somma delle componenti extracellulari dei potenziali di recettore che si generano per l’affivazione delle OHCs (Eggermont 1974), mentre il potenziale di sommazione registrato al promontorio è correlato con la componente di distorsione del potenziale di recettore recettoriale relativa all’attivazione delle lHCs localizzate nella porzione basale della partizione cocleare (Durrant et al, 1998).
Un esempio di registrazione ottenuto da un orecchio normoudente durante la stimolazione con clicks presentati a intensità decrescenti di stimolazione è riportato nella Fig. 2. lI microfonico cocleare appare come una attività con andamento oscillatorio che si sovrappone ai complesso SP-CAR Le risposte mostrate nella figura sono state ottenute dopo aver effettuato una preliminare elaborazione dei potenziali registrati alle varie intensità. Infatti, dal momento che il microfonico cocleare riproduce strettamente lo spostamento della membrana basilare, è possibile effettuarne la cancellazione con conseguente estrazione delle varie componenti della risposta ECochG utilizzando un procedimento che consiste nel mediare i potenziali evocati separatamente dalla presentazione di stimoli in condensazione o rarefazione (Eggermont, 1974).
![]()
Fig. 2. Potenziali cocleari ottenuti mediante registrazione dell’Elettrococleografia (ECochG) a intensità decrescenti di stimolazione in un bambino normoudente.
![]() Nel soggetto normoudente la risposta ottenuta dopo la cancellazione del CM inizia con una rapida deflessione di polarità negativa, l’SP, che si in- scrive quindi nella fase iniziale della risposta neurale. Quest’ultima è rappresentata da un picco negativo con ritorno alla baseline entro 1.5-2 ms alle elevate intensità di stimolazione. Entrambe le componenti, SP e CAP; si riducono di ampiezza e mostrano un aumento della latenza di picco al ridursi dell’intensità dello stimolo, mentre la durata dell’intero complesso SP-CAP mostra un significativo aumento solo in prossimità della soglia (Eggermont, 1974; Santarelli e Arslan, 2013). Le caratteristiche della risposta ECochG risultano alterate profondamente e in vario grado nelle diverse forme di neuropatia uditiva. Un tipico esempio di registrazione ottenuto da una paziente affetta da atrofia offica dominante per la presenza della mutazione R445H in OPA1 è riportato nella Fig. 3. Le risposte registrate a intensità decrescente di stimolazione sono state sovrapposte alle corrispondenti curve registrate da un soggetto normoudente. Come si può rilevare, le risposte ottenute dal soggetto con AN appaiono come un potenziale negativo di ampiezza ridotta nel quale non è possibile distinguere separatamente le componenti SP e CAR Inoltre, rispetto al normale, tale risposta mostra un ritardo della latenza di picco e un considerevole aumento di durata (Huang et al, 2009).
Nel soggetto normoudente la risposta ottenuta dopo la cancellazione del CM inizia con una rapida deflessione di polarità negativa, l’SP, che si in- scrive quindi nella fase iniziale della risposta neurale. Quest’ultima è rappresentata da un picco negativo con ritorno alla baseline entro 1.5-2 ms alle elevate intensità di stimolazione. Entrambe le componenti, SP e CAP; si riducono di ampiezza e mostrano un aumento della latenza di picco al ridursi dell’intensità dello stimolo, mentre la durata dell’intero complesso SP-CAP mostra un significativo aumento solo in prossimità della soglia (Eggermont, 1974; Santarelli e Arslan, 2013). Le caratteristiche della risposta ECochG risultano alterate profondamente e in vario grado nelle diverse forme di neuropatia uditiva. Un tipico esempio di registrazione ottenuto da una paziente affetta da atrofia offica dominante per la presenza della mutazione R445H in OPA1 è riportato nella Fig. 3. Le risposte registrate a intensità decrescente di stimolazione sono state sovrapposte alle corrispondenti curve registrate da un soggetto normoudente. Come si può rilevare, le risposte ottenute dal soggetto con AN appaiono come un potenziale negativo di ampiezza ridotta nel quale non è possibile distinguere separatamente le componenti SP e CAR Inoltre, rispetto al normale, tale risposta mostra un ritardo della latenza di picco e un considerevole aumento di durata (Huang et al, 2009).
Fig. 3. Potenziali cocleari ottenuti mediante registrazione dell’elettrococleografia (ECochG) in una paziente che presento a mutazione R445H in OPA1. Le risposte registrate a intensità decrescenti di stimolazione sono state sovrapposte ai corrispondenti tracciati ottenuti da un soggetto normoudente.
Al fine di stabile la natura ditale risposta, se cioè essa originasse da una componente neurale o recettoriale, è stato utilizzato un protocollo di adattamento neurale che consiste nella presentazione di un click iniziale seguito a distanza dii 5 ms da un treno dii 10 clicks separati da un intervallo di 2.9 ms. Questa sequenza veniva ripetuta ogni 191 ms. Le risposte ottenute nella paziente con AN alla intensità di 110 dB SPL sono state messe a confronto con le corrispondenti risposte ottenute da un soggetto normoudente nella Fig. 4, Nel soggetto normale l’ampiezza del OAP si riduce considerevolmente dal primo al secondo stimolo della sequenza e per poi mostrare un’ulteriore riduzione nel corso dei primi 3-4 clicks del treno ad alta frequenza.
![]()
Fig. 4. Adattamento dei potenziali cocleari ottenuti mediante registrazione dell’Elettrococleografia (EcochG) all’intensità di 110 dB SPL in risposta al paradigma di stimolazione riportato nella parte inferiore della figura. I tracciati si riferiscono rispettivamente a un soggetto normoudente, una paziente con mutazione R445H in OPA1, un bambino con mutazione biallelica in OTOF e un bambino con il tipico quadro elettrofisiologico di neuropatia uditiva proveniente dalla TIN.
Di conseguenza l’ampiezza della risposta, misurata dallà baseline al picco, si riduce del 47% dal primo all’ultimo stimolo della sequenza (media calcolata per 34 orecchie di soggetti normoudenti 57%, range 41-75%)(Santarelli et al, 2008; Santarelli e Arslan, 20i3). Anche l’ampiezza dell’SP risulta attenuata durante la siimolazione ad alta frequenza, ma il grado di attenuazione (22%) è di gran lunga inferiore rispetto a quello calcolato per I OAP (media calcolata per 34 orecchie di soggetti normoudenti 27%, range 0-53%), Nel soggetto con AN le variazioni di ampiezza sono state misurate unicamente sulla risposta nel suo complesso, non essendo possibile la distinzione tra SP e CAR Anche in questo caso si osserva una attenuazione della risposta dal primo al secondo click della sequenza seguita da un’ulteriore riduzione durante la stimolazione con treni di click. Il grado di attenuazione totale è risultato del 50%, e quindi dello stesso ordine di grandezza della riduzione calcolata per la componente CAP nel normoudente, Si conclude quindi che il potenziale di bassa ampiezza e lunga durata osservato in questa categoria di pazienti con AN deriva verosimilmente dall’anomala attivazione delle fibre nervose.
Analoghe risposte sono state registrate in pazienti con AN sostenute da eziologie di altro tipo, come per es. soggetti affetti da polineuropatia tipo Charcot-Marie-Tooth o disordini neurologici fin qui non categorizzati (Santarelli e Arslan, 2013).
In tuffi questi casi la riduzione del numero degli assoni e i fenomeni di demielinizzazione a carico dei neuroni residui costituiscono una ragionevole base per la spiegazione della riduzione dì ampiezza e l’aumento di durata delle risposte neurali , Tuttavia, la mancata identificazione dell’SP in alcune neuropatie, come quelle dovute alla mutazione in OPA1, potrebbe indicare un coinvolgimento primario o coesistente delle IHC5 con la patologia neurale. Questo rappresenta un aspetto rilevante dal punto di vista del trattamento riabilitativo in quanto l’efficacia della stimolazione elettrica ottenuta con un impianto cocleare dipende essenzialmente dal numero e dalla funzionalità delle fibre neurali residue nelle forme a prevalente coinvolgimento neurale, mentre è indipendente da tale fattore nelle condizioni in cui la neuropatia sia sostenuta unicamente dalla perdita della componente recettoriale.
Disordini delle sinapsi a nastro: alterazioni della funzione dell’otoferlina
Nei bambini con mutazione biallelica in OTOF la risposta ECochG mostra un CM di ampiezza normale (Santarelli et al, 2009). Questo dato è in sostanziale accordo con la conservazione della funzionalità delle OHCs indicata dalla presenza delle otoemissioni acustiche, Dopo la cancellazione del CM la risposta ECochG mostra la presenza del potenziale di bassa ampiezza e lunga durata registrato in altre forme di AN (Santarelli et al, 2009). In particolare, le risposte registrate all’intensità di 120dB SPL da cinque bambini con mutazione biallelica in QTOF, che presentavano una ipoacusia profonda associata alla presenza delle otoemissioni acustiche, sono riportate nella Fig. 5 (lato sinistro), I tracciati sono stati sovrapposti al “Grand Average” ottenuto alla stessa intensità da un gruppo di 26 bambini normoudenti. Come si può rilevare dalla figura, le risposte ottenute dai piccoli pazienti iniziano con una rapida deflessione negativa, verosimilmente identificabile come SP per la sua sovrapposizione in termini di ampiezza e latenza con il potenziale sommazione registrato nel normale. Questo dato è indicativo di una normale attivazione delle IHCs nei piccoli pazienti con mutazioni nel gene codificante per otoferlina.
L’SP è seguito da un potenziale di bassa ampiezza e lunga durata al quale si sovrappone in alcuni casi un CAP di ampiezza bassissima. E’ interessante rilevare come la componente prolungata sia identificabile a intensità ben inferiori rispetto alla soglia psicoacustica (Fig. 5. lato destro). Anche nelle neuropatie dovute ad una alterata funzione dell’otoferlina la risposta di lunga durata che segue l’SP è ragionevolmente generato a livello della fibra nervosa, dal momento che il grado di attenuazione rilevato con l’utilizzo di un protocollo di adattamento neurale è dello stesso ordine di grandezza (47%) di quello rilevato per il CAP nel soggetto normoudente (Fig. 4).
Il tipo di risposta registrato nei bambini con mutazione biallelica in QTOF è simile a quello ottenuto da Patuzzi e collaboratori (Sellick et al, 2003) nell’animale da esperimento dopo blocco della generazione dei potenziali d’azione per somministrazione intratimpanica di tetrodotossina, Si potrebbe pertanto ragionevolmente ipotizzare che l’assenza della funzione dell’otoferlina determini una alterazione del rilascio sinaptico nei termini di una riduzione della quota di neurotrasmettitore rilasciato associata alla compromissione del rilascio multi vescicolare, Ne consegue una ridotta attivazione della componente dendritica della fibra nervosa con generazione di potenziali post-sinaptici ridotti di ampiezza e dispersi nel tempo, quali solo occasionalmente e alle alte intensità raggiungono il valore di soglia per l’innesco del
![]()
Fig. 5. Potenziali cocleari ottenuti mediante registrazione dell’elettrococleografia (ECochG) in bambini portatori di mutazione biallelica in OTOR Nella parte sinistra le risposte registrate a 120 dB SPL in cinque soggetti sono state sovrapposte al Grand Average dei tracciati corrispondenti ottenuti da 26 bambini normoudenti. Le risposte registrate da un paziente a intensità decrescenti di stimolazione sono illustrate nella parte destra della figura.
potenziale di azione. In ultima analisi, il potenziale di lunga durata registrato con l’Eleffrococleografla potrebbe derivare dalla somma della componente extracellulare di tuffi questi eventi “sottto-soglia”, Pertanto, dati forniti dalla registrazione dell’ECochG presentano notevoli implicazioni dal punto di vista clinico-terapeutico dal momento che, confermando le ipotesi relative alla localizzazione e al meccanismo del danno formulate in ambito sperimentale, inducono a ritenere che le fibre nervose “per se” non sono coinvolte dal processo patologico. Su questa base è possibile spiegare l’eccellente outcome dell’impianto cocleare osservato in tuffi i pazienti affeffi da questo tipo di disordine (Pouillon et al, 2006; Rodrìguez-Ballesteros et al, 2008; Santarelli et al, 2011).
Potenziali cocleari registrati dai bambini dimessi dalla TIN: lesione delle IHCs o disordine neurale?
Uno dei criteri fondamentali nella identificazione di un quadro di neuropatia uditiva è ‘la riduzione della percezione verbale a fronte di una ipoacusia di gra do lieve o moderato, Nei piccoli pazienti selezionati con procedure di screening evidentemente questo tipo di valutazione non può essere effettuato e pertanto l’unico segno distintivo è rappresentato dal riscontro QAE5 associato all’assenza della risposta ABP, In questi casi ovviamente solo la registrazione dell’ECochG può fornire informazioni sulla funzione della periferia uditiva per quel che riguarda sia la componente neurale sia i potenziali recettoriali. In aggiunta, i bambini provenienti dalla TIN possono presentare una desincronizzazione dell’attività elettrica dei generatori centrali con conseguente dissociazione tra la soglia della risposta ABR e rispettivamente la soglia uditiva determinata con metodo psicoacustico (Kraus et al, 1984) e la soglia della risposta neurale registrata all’ECochG (Arslan et al, 1997).
Focalizzando l’analisi ai bambini dimessi dalla TIN che presentano il tipico quadro elettrofisiologico della neuropatia uditiva, vengono riportate alcune osserva zioni relative a 23 bambini sottoposti alla registrazione dell’ECochG presso il nostro Servizio dal 2001 aI 2012 (età media 23.6 mesi). I potenziali cocleari registrati a livelli decrescenti di stimolazione in un piccolo paziente che presentava il tipico quadro di neuropatia uditiva vengono messi a confronto con le corrispondenti curve ottenute da un soggetto normoudente nella Fig. 6.
![]()
Fig. 6. Potenziali cocleari ottenuti mediante registrazione dell’Eleffrococleografla (ECochG) in un bambino con il tipico quadro elettrofisiologico di neuropatia uditivo proveniente dallo TIN. Le risposte registrate a intensità decrescenti di stimolazione sono state sovrapposte ai corrispondenti tracciati ottenuti do un soggetto normoudente.
La risposta registrata nel soggetto patologico inizia con un potenziale di sommazione, di ampiezza ridotta rispetto al normale, seguito dalla componente di lunga durata analoga a quella registrata in altre forme di neuropatia. L’utilizzo di un protocollo di adattamento (Fig. 4) conferma la genesi neurale ditale componente, dal momento che la riduzione di ampiezza al termine della stimolazione ad alta frequenza risulta pari al 60%.ln questo particolare bambino la riduzione di ampiezza del potenziale di sommazione indicativo di un difetto di attivazione delle IHCs. Questo doto sarebbe pertanto in accordo con il reperto di una riduzione seleffiva delle IHCs evidenziato all’esame istologico post-mortem nel gruppo di piccoli pazienti deceduti in TIN che sono studiati da Liberman e collaboratori (Amatuzzi et al, 2011). Tuttavia, oltreché alla riduzione del numero di IHCs, un’alterata attivazione delle fibre nervose potrebbe risultare anche da un coinvolgimento patologico della componente dendritica delle fibre stesse, analogamente a quanto evidenziato in animali da esperimento in seguito all’induzione di un trauma acustico(Lin et al, 2011). E’ pertanto necessario approfondire lo studio dei potenziali cocleari in questa categoria di pazienti e correlarlo con i dati forniti da altre indagini strumentali al fine di chiarire il processo fisiopatologico alla base del disordine uditivo.
Inaspettatamente, risposte di lunga durata sono state registrati anche in bambini (59 soggetti) provenienti dalla TIN che mostravano alterazioni della risposta ABR associate all’assenza di QAE5, In particolare, il 61% di questi soggetti presentava il quadro tipico di una risposta prolungata con assenza di distinzione tra SP e CAP. nel 13% l’SP era identificabile ed era seguito da una risposta neurale di durata aumentata, mentre nel restante 25% i potenziali cocleari erano assenti ad eccezione del CM. In altri termini, il quadro elettrofisiologica riscontrato nella maggioranza di questi soggetti è sovrapponibile a quello rilevato nei pazienti che mostrano il profilo elettrofisiologico della neuropatia uditivo, mentre solo un quarto dei soggetti è risultato affetto da una ipoacusia di grado severo-profondo. Tenendo conto della variabilità dei fattori di rischio che agiscono nella TIN, è possibile ipotizzare che i relativi effetti si traducono in uno “spettro” di lesioni cocleari che comprendono in varia misura la perdita di cellule ciliate interne ed esterne, il danno sinaptico e la sofferenza delle fibre nervose, In questa ottica, ciò che è veramente importante ai fini della diagnosi e della programmazione della strategia terapeutica non è tanto l’associazione ABR assente-OAEs presenti, quanto piuttosto la valutazione della localizzazione e del tipo di danno che coinvolge la periferia uditiva,
Conclusioni
La registrazione dei potenziali cocleari con l’utilizzo deIl elettrococleografia intratimpanica permette di evidenziare alterazioni dei potenziali recettoriali e dello risposta neurale nei pazienti che presentano un quadro di neuropatia uditiva. In particolare, l’esecuzione dì questo esame permette di definire la diagnosi e di ipotizzare possibili meccanismi fisiopatologici alla base dell’alterazione della funzione neurale. Tali informazioni sono cruciali nella programmazione della strategia terapeutica per quel che riguarda in particolare l’indicazione all’utilizzo di un impianto cocleare per ripristinare la codifica temporale dell’ingresso acustico.
Altre applicazioni
Le tre applicazioni più importante per l’ECochG sono quelle sopra descritte (ad esempio, la valutazione di MD / ELH, l’identificazione dell’ onda I, il monitoraggio intraoperatorio). Tuttavia, sono stati segnalati altri utilizzazioni , come la stima della soglia uditiva , (Laureano, Murray, et al. 1995). Ferraro e Ferguson (1989) non hanno trovato differenze tra l’AP registrati alla TM- e la registrazione convenzionale della soglie del’ onda V nei soggetti con udito normale . La soglia dell’onda V , certamente , spesso viene utilizzata per stimare la soglia uditiva nei bambini o in soggetti con altre difficoltà .Nonostante gli studi di cui sopra, è improbabile che ECochG verrà utilizzato come ‘strumento di scelta’ per la valutazione della soglia uditiva . Nella maggior parte dei casi, sono disponibili altri approcci elettrofisiologici e comportamentali che tendono ad essere più precisi e sono più facili e impiegano meno tempo per fare diagnosi e,. Questo non vuol dire, tuttavia, che il rapporto tra ECochG e lo soglia uditiva non dovrebbe continuare a essere studiato. Lilly (comunicazione personale), per esempio, ha riferito l’utilità di ECochG per la stima di riserva uditiva nei candidati per un impianto cocleare Schoonhoven, Fabius e Grote (1995), hanno trovato un rapporto tra funzioni input -output AP di uscita misurata dal TM e il recruitment cocleare. Keith, Kereiakes, et al., (1992) hanno utilizzato ECochG per valutare l’integrità dell’orecchio interno prima della stapedectomia in un paziente che non ha potuto essere testata con una audiometria comportamentale.
In sintesi, ECochG continua ad essere utile nella valutazione delle dell’orecchio interno e della funzione del nervo uditivo per una varietà di applicazioni cliniche. Questa premessa di base si scontra con le continue controversie concernenti la modalità di registrazione della ECochG , interpretazione ed utilizzazione. Maggiore attenzione a risolvere i tali controversie e ad ampliare le attuali applicazioni di ECochG sono evidenti nella letteratura recente, che fa ben sperare per il futuro di questa molto utile, strumento clinico.
L’ ECochG è un test tecnicamente difficile, ha una logica discutibile, è priva di regole affidabili, privo di standard, ed è sensibile all’ operatore.
Il problema principale che affligge il tecnico ECochG è il rumore. È necessario introdurre un piccolo elettrodo dentro una piccola cavità (il condotto uditivo esterno). L’orecchio deve essere ben pulito, è necessaria pazienza. Il test richiede almeno un’ora. Alcuni Elettrodi hanno un migliore rapporto segnale rumore rispetto ad altri. Non abbiamo avuto molta fortuna con l elettrodo d’oro “tiptrodes”. Gli Elettrodi gelificata in stoppino in cotone, che si possono ottenere dalla Biologic, funzionano meglio . Mentre elettrodi ad ago hanno il miglior segnale / rumore, ma possono essere mal tollerata dai pazienti
Motivazioni per la prova: circa il 6% della popolazione nelle autopsie mostra una idrope (Honrubia, 1999;
Rauch et al, 2001), ci si aspetterebbe che il 6% della popolazione normale dovrebbe avere un ECochG positivo. Considerando che solo 1 / 2000 persone hanno la malattia di Ménière (0,2%), ci si aspetterebbe un elevato numero di falsi-positivi nei test ECochG. Ci si aspetta inoltre un numero molto basso di falsi negativi.
Da questo punto di vista, l’utilità principale dei test ECochG dovrebbe essere quello di individuare idrope, e ad escludere di Ménière (come se uno non ha Idrope, poi di Ménière non dovrebbe essere la diagnosi). Inoltre, se uno non ha idrope, allora la dose bassa comporta protocollo Intratympanic gentamicin per la malattia di Ménière dovrebbe essere evitata .
La difficoltà principale con questa logica è che i test ECochG è difficile, e spesso non interpretabili nella stessa popolazione in cui è importante (persone con Ménière), a causa della perdita di udito.
Quindi, per riassumere, buon senso, l’esperienza e le conoscenze cliniche sono un must per interpretare correttamente l’ECochGs.
La mancanza di norme affidabili: è importante quando si interpretano ECochG a prendere in considerazione il livello di rumore, che è generalmente valutata ottenendo prove multiple. Se sono tutti simili, quindi la deviazione standard dovrebbe essere piccolo e il risultato è probabile che sia corretto. Se variano ampiamente, l’affidabilità della media SP / AP rapporto può essere discutibile. Allo stesso modo, se le prove multiple sono fatto e l’SP / AP rapporto varia ampiamente, la propria fiducia nel risultato dovrebbe essere inferiore se è molto stretto.
References
Ackley RS, Ferraro JA, Arenberg IK. (1994). Diagnosis of patients with perilymphatic fistula. Seminars in Hearing 15:37-41.
American Speech-Language-Hearing Association (1988). The short latency auditory evoked potentials: a tutorial paper by the Working Group on Auditory Evoked Potential Measurements of the Committee on Audiologic Evaluation.
Aran JM, Lebert G. (1968). Les responses nerveuse cochleaires chex l’homme, image du fonctionnement de l’oreille et nouveau test d’audiometrie objectif. Revue de Laryngologie, Otologie, Rhinologie (Bordeaux) 89:361-365.
Arenberg IK, Gibson WPR, Bohlen HKH. (1993). Improvements in audiometric and electrophysiologic parameters following nondestructive inner ear surgery utilizing a valved shunt for hydrops and Meniere’s disease. Proceedings of the Sixth Annual Workhops on Electrocochleography & Otoacoustic Emission, International Meniere’s Disease Research Institute, pp. 545-561.
Bonucci AS, Hyppolito MA. Comparison of the use of tympanic and extratympanic electrodes for electrocochleography. Laryngoscope. 2009 Feb 23;119(3):563-566.
Cashman M, Rossman R. (1983). Diagnostic features of the auditory brainstem response in identifying cerebellopontine angle tumors. Scand Audiol 12:35-41.
Cheng J, He L and Gu R (1994). “[Relationship between summating potentials and perilymphatic fistula].” Zhonghua Er Bi Yan Hou Ke Za Zhi 29(5): 278-81.
Chung WH and others. Clinical usefulness of extratympanic electrocochleography in the diagnosis of Meniere’s disease. Otol Neurotol 25:144-149, 2004 .
Coats AC. (1981). The summating potential and Meniere’s disease. Arch Otolaryngol 104:199-208.
Coats AC. (1986). Electrocochleography: Recording technique and clinical applications. Seminars in Hearing 7:247-266.
Coats AC, Dickey JR. (1970). Non-surgical recording of human auditory nerve action potentials and cochlear microphonics. Ann Otol Rhinol Laryngol 29:844-851.
Dallos P. (1973). The auditory periphery: Biophysics and physiology. New York: Academic Press.
Dallos P, Schoeny ZG, Cheatham MA (1972). Cochlear summating potentials: Descriptive aspects. Acta Otolaryngologica 301(suppl.):1-46.
Davis H. (1968). Mechanisms of the inner ear. Ann Otol Rhinol Laryngol 77:644-656.
Devaiah AK, Dawson KL, Ferraro JA, Ator GA Utility of area curve ratio electrocochleography in early Mènière disease. Arch Otolaryngol Head Neck Surg 2003 May;129(5):547-51
Durrant, JD (1986). Combined EcochG-ABR approach versus conventional ABR recordings. Seminars in Hearing, 7:289-305.
Durrant JD, Ferraro JA (1991). Analog model of human click-elicited SP and effects of high-pass filtering. Ear and Hearing 12:144-148.
Engebretson AM, Eldridge DH. (1968). Model for the nonlinear characteristics of cochlear potentials. J Acoust Soc Am 44:548-554.
Ferraro JA. (1997). Laboratory Exercises in Auditory Evoked Potentials. San Diego: Singular Publishing Group, Inc.
Ferraro JA (2000). Electrocochleography. In RJ Roeser, M Valente and H Hosfort-Dunn (Eds.). Audiology Diagnosis. New York/Stuttgart: Thieme, pp. 425-450.
Ferraro JA, Arenberg IK, Hassanein RS. (1985) Electrocochleography and symptoms of inner ear dysfunction. Arch Otolaryngol 111:71-74.
Ferraro JA, Best LG, Arenberg IK. (1983). The use of electrocochleography in the diagnosis, assessment and monitoring of endolymphatic hydrops. Otolaryngol Clin No Am 16:69-82.
Ferraro JA, Blackwell W, Mediavilla SJ, Thedinger B. (1994). Normal summating potential to tonebursts recorded from the tympanic membrane in humans. J Am Acad Aud 5:17-23.
Ferraro JA, Ferguson R. (1989). Tympanic ECochG and conventional ABR: A combined approach for the identification of wave I and the I-V interwave interval. Ear and Hearing 3:161-166.
Ferraro JA, Krishnan G. (1997). Cochlear potentials in clinical audiology. Audiology & Neuro-Otology 2:241-256.
Ferraro JA, Thedinger B, Mediavilla SJ, Blackwell W. (1994). Human summating potential to tonebursts: Observations on TM versus promontory recordings in the same patient. J Am Acad Aud 6:217-224.
Ferraro JA, Tibbils R. (1999). SP/AP area ratio in the diagnosis of Meniere’s disease. Am J Aud 8:21-27.
Filipo and others. Electrocochleographic findings: Meniere’s disease vs. sudden sensorineural hearing loss. Acta Otol 526:21-3, 1997 .
Gamble BA, and others. Salt-load electrocochleography. Am J. Otol 20:325-330, 1999
Ge X, Shea JJ Jr. Transtympanic electrocochleography: a 10-year experience. Otol Neurotol 2002 Sep;23(5):799-805 .
Gibson WPR. (1978). Essentials of Electric Response Audiometry. New York: Churchill and Livingstone.
Gibson, WPR, Arenberg IK, Best LG. (1988). Intraoperative electrocochleographic parameters following nondestructive inner ear surgery utilizing a valved shunt for hydrops and Meniere’s disease. In: Nadol JG, ed. Proceedings of the Second International Symposium on Meniere’s Disease. Amsterdam: Kugler and Ghedini Publications, pp. 170-171.
Gibson WPR, Arenberg IK. (1991). The scope of intraoperative electrocochleography. In: Arenberg IK, ed. Proceedings of the Third International Symposium and Workshops on the Surgery of the Inner Ear. Amsterdam: Kugler Publications, pp. 295-303.
Gibson WPR, Moffat DA, Ramsden RT. (1977). Clinical electrocochleography in the diagnosis and management of Meniere’s disorder. Audiology 16:389-401.
Goin DW, Staller SJ, Asher DL, Mischke RE. (1982). Summating potential in Meniere’s disease. Laryngoscope 92:1381-1389.
Gulick WL, Gescheider GA, Frisina RD. (1989). Hearing: Physiological Acoustics, Neural Coding, and Psychoacoustics. New York: Oxford University Press.
Hyde ML, Blair RL. (1981). The auditory brainstem response in neuro-otology: Perspectives and problems. J Otololaryng 10:117-125.
Honrubia V. Pathophysiology of Meniere’s disease. Meniere’s Disease (Ed. Harris JP) 231-260, 1999, Pub: Kugler (The Hague) .
Keith RW, Kereiakes TJ, Willging JP, Devine J. (1992). Evaluation of cochlear function in a patient with ‘far-advanced’ otosclerosis. Am J Otol 13:347-349.
Kiang NS. (1965). Discharge patterns of single nerve fibers in the cat’s auditory nerve. Research Monograph 35. Cambridge, MA: MIT Press.
Kitahara M, Takeda T, Yazama T. (1981). Electrocochleography in the diagnosis of Meniere’s disease. In: Volsteen KH, ed. Meniere’s Disease, Pathogenesis, Diagnosis and Treatment. New York: Thieme-Stratton, pp. 163-169.
Kobayashi H, Arenberg IK, Ferraro JA, Van der Ark G. (1993). Delayed endolymphatic hydrops following acoustic tumor removal with intraoperative and postoperative Auditory Brainstem Response improvements. Acta Otolaryngol (Stockh) 504(suppl.):74-78.
Koyuncu M, Mason SM, Shinkwin C. (1994). Effect of hearing loss in electrocochleographic investigation of endolymphatic hydrops using tone-pip and click stimuli. J Laryngol Otol 108:125-130.
Kumagami H, Nishida H, Masaaki B. (1982). Electrocochleographic study of Meniere’s disease. Arch Otol 108:284-288.
Lambert P, Ruth RA. (1988). Simultaneous recording of noninvasive ECoG and ABR for use in intraoperative monitoring. Otolaryngology – Head and Neck Surgery 98:575-580.
Laureano AN, Murray D, McGrady MD, Campbell KCM. (1995). Comparison of tympanic membrane-recorded electrocochleography and the auditory brainstem response in threshold determination. Am J Otol 16:209-215.
Levine SM, Margolis RH, Fournier EM, Winzenburg SM. (1992). Tympanic electrocochleography for evaluation of endolymphatic hydrops. Laryngoscope 102:614-622.
Levine S, Margolis RH and Daly KA (1998). “Use of electrocochleography in the diagnosis of Meniere’s disease.” Laryngoscope 108(7): 993-1000.
Lilly DJ. (1997). Personal communication.
Margolis RH, Levine SM, Fournier MA, Hunter LL, Smith LL, Lilly DJ. (1992). Tympanic electrocochleography: Normal and abnormal patterns of response. Audiology 31:18-24.
Margolis RH, Rieks D, Fournier M, Levine SM.(1995). Tympanic electrocochleography for diagnosis of Meniere’s disease. Arch Otolaryngol Head & Neck Surg 121:44-55.
Margolis RH, Lilly DJ. (1989). Extratympanic electrocochleography: Stimulus considerations. Asha 31:183(A).
Mishler ET, Loosmore JL, Herzog JA, Smith PG, Kletzker GK. (1994). The efficacy of electrocochleography in monitoring endolymphatic shunt procedures. Ann Meet Am Neuro-Otol Soc , p. 45(A).
Moriuchi H., Kumagami H. (1979). Changes of AP, SP and CM in experimental endolymphatic hydrops. Audiology 22:258-260.
Morrison AW, Moffat DA, O’Connor AF. (1980). Clinical usefulness of electrocochleography in Meniere’s disease: An analysis of dehydrating agents. Otolaryngologic Clin No Am 11:703-721.
Nam Ec, Won JY. Extratympanic electrocochleographic changes on noise-induced temporary threshold shift. Otolaryngol Head Neck Surg 2004;130:437-42.
Ng M, Srireddy S, Horlbeck DM and Niparko JK (2001). “Safety and patient experience with transtympanic electrocochleography.” Laryngoscope 111(5): 792-5.
Noell Ca, Roland PS, Mabry RL, Shoup AG. Inhalant allergy and Meniere’s disease: Use of electrocochleography and intranasal allergen challenge as investigational tools. Otolaryngol Head Neck Surg 2001; 125: 346-50.
Orckik DJ, Shea JJ Jr., Ge X. (1993). Transtympanic electrocochleography in Meniere’s disease using clicks and tone-bursts. Am J Otol 14:290-294.
Orchik JG, Ge X, Shea JJ. (1997). Action potential latency shift by rarefaction and condensation clicks in Meniere’s disease. Am J Otol 14:290-294.
Picton TW, Hillyard SH, Frauz HJ, Galambos R. (1974). Human auditory evoked potentials. Electroenceph Clin Neurophysiol 36:191-200.
Rauch SD, Merchant SN, Thediner BA. Meniere’s syndrome and endolymphatic hydrops: double blind temporal bone study. Ann ORL 98(11):873-883, 1989.
Ruth RA. (1990). Trends in electrocochleography. J Am Acad Aud 1:134-137.
Ruth RA. (1994). Electrocochleography. In: Katz J, ed. Hanbook of Clinical Audiology, Fourth Edition. Baltimore:Williams & Wilkins, pp. 339-350.
Ruth RA, Lambert PR, Ferraro JA. (1988). Electrocochleography: Methods and clinical applications. Am J Otol 9:1-11.
Ruben R, Sekula J, Bordely JE. (1960). Human cochlear responses to sound stimuli. Ann Otorhinolaryngol 69:459-476.
Santarelli R and Arslan E (2002). “Electrocochleography in auditory neuropathy.” Hear Res 170(1-2): 32-47.
Sass K, Densert B, Arlinger S. (1997). Recording techniques for transtympanic electrocochleography in clinical practice. Acta Otolaryngol (Stockh) 118:17-25.
Schmidt P, Eggermont J, Odenthal D. (1974). Study of Meniere’s disease by electrocochleography. Acta Otolaryngologica 316(suppl.):75-84.
Schoonhoven R, Fabius MAW, Grote JJ. (1995). Input/output curves to tonebursts and clicks in extratympanic and transtympanic electrocochleography. Ear & Hearing 16:619-630.
Sohmer H, Feinmesser M. (1967). Cochlear action potentials recorded from the external canal in man. Ann Otol Rhinol Otolaryngol 76:427-435.
Stapells D, Picton TW, Smith AD. (1982). Normal hearing thresholds for clicks. J Acoust Soc Am 72:74-79.
Suzuki JF, Yamane H (1982). The choice of stimulus in the auditory brain stem response test for neurological and audiological examinations. Annals of the New York Academy of Science 388:731-736.
Tasaki I, Davis H, Eldridge DH. (1954). Exploration of cochlear potentials in guinea pig with a microelectrode. J Acoust Soc Am 26:765-773.
Whitfield IC, Ross HF (1965). Cochlear microphonic and summating potentials and the outputs of individual hair cell generators. J Acoust Soc Am 38:126-131.
Wazen JJ. (1994). Intraoperative monitoring of auditory function: Experimental observation, and new applications. Laryngoscope 104:446-455.
Yokoyama K, Nishida H, Noguchi Y and Komatsuzaki A (1999). “Hearing impairment in patients with acoustic neuroma–analysis by electrocochleography.” Auris Nasus Larynx 26(4): 401-9.
Yoshie N, Ohashi T, Suzuki T. (1967Yoshie N, Ohashi T, Suzuki T. (1967). Non-surgical recording of auditory nerve action potentials in man. Laryngoscope 77:76-85.
Riferimenti: References:
· Bonucci AS, Hyppolito MA. Comparison of the use of tympanic and extratympanic electrodes for electrocochleography.Laryngoscope. 2009 Feb 23;119(3):563-566.
· Cheng J, He L and Gu R (1994). “[Relationship between summating potentials and perilymphatic fistula].” Zhonghua Er Bi Yan Hou Ke Za Zhi 29(5): 278-81.
· Chung WH and others. Clinical usefulness of extratympanic electrocochleography in the diagnosis of Meniere’s disease. Otol Neurotol 25:144-149, 2004
· Devaiah AK, Dawson KL, Ferraro JA, Ator GA Utility of area curve ratio electrocochleography in early meniere disease. Arch Otolaryngol Head Neck Surg 2003 May;129(5):547-51
· Filipo and others. Electrocochleographic findings: Meniere’s disease vs. sudden sensorineural hearing loss. Acta Otol 526:21-3, 1997
· Gamble BA, and others. Salt-load electrocochleography. Am J. Otol 20:325-330, 1999
· Ge X, Shea JJ Jr. Transtympanic electrocochleography: a 10-year experience.Otol Neurotol 2002 Sep;23(5):799-805 .
· Honrubia V. Pathophysiology of Meniere’s disease. Meniere’s Disease (Ed. Harris JP) 231-260, 1999, Pub: Kugler (The Hague)
· Levine S, Margolis RH and Daly KA (1998). “Use of electrocochleography in the diagnosis of Meniere’s disease.” Laryngoscope 108(7): 993-1000.
· NAM EC, Won JY. Extratympanic electrocochleographic changes on noise-induced temporary threshold shift. Otolaryngol Head Neck Surg 2004;130:437-42.
· Ng M, Srireddy S, Horlbeck DM and Niparko JK (2001). “Safety and patient experience with transtympanic electrocochleography.” Laryngoscope 111(5): 792-5.
· NOELL CA, Roland PS, Mabry RL, Shoup AG. Inhalant allergy and Meniere’s disease: Use of electrocochleography and intranasal allergen challenge as investigational tools. Otolaryngol Head Neck Surg 2001; 125: 346-50.
· Rauch SD, Merchant SN, Thediner BA. Meniere’s syndrome and endolymphatic hydrops: double blind temporal bone study. Ann ORL 98(11):873-883, 1989
· Santarelli R and Arslan E (2002). “Electrocochleography in auditory neuropathy.” Hear Res 170(1-2): 32-47.
· Yokoyama K, Nishida H, Noguchi Y and Komatsuzaki A (1999). “Hearing impairment in patients with acoustic neuroma–analysis by electrocochleography.” Auris Nasus Larynx 26(4): 401-9.
Neuropatia Uditiva e Potenziali cocleari R. Santarelli E Arslan Omega Editore 2013 Bibliografia
Amatuzzi M, Liberman MC, Northrop C. (2011) Selective inner hair cell loss in prematurity: a temporal bone study of infants from a neonatal intensive care unit. J Assoc Res Otolaryngol. 12, 595-604.
Aran JM, Charlet de Sauvage R, Pelerin J. (1971) Comparaison des scuds electrocochleographiques et de l’audiogramme. Etude statistique. Rev Laryngol Otol Rhinol (Boma 92, 477491.
Arslan E, Prosser S, Conti G, Michelini S. (1983) Electrocochleography and brainstem potentials in the diagnosis of the deaf child. In( J Pediotr Otorhinolaryngol, 5, 251-259.
Arslan E, Turrini M, Lupi G, Genovese E, Orzan E. (1997) Hearing threshold assessment with auditory brainstem response (ABR) and ElectroCochleoGraphy (ECochG) in uncooperative children. Scand Audio? Suppl. 46, 32-37.
Aso S, Gibson WP. (1994) Electrocochleography in profoundly deaf children: comparison of promontory and round window techniques. Am /Ow/. 15, 376-379.
Cheatham MA, Naik K, Dallos P. (2011) Using the cochlear micro-phonic as a tool to evaluate cochlear function in mouse models of hearing. J Assoc Res Otolaryngol. 12, 113-125.
Chertoff M, Lichtenhan J, Willis M. (2010) Click- and chirp-evoked human compound action potentials. J Acoust Sac Am. 127, 2992-2996.
Durrant JD, Wang J, Ding D, Salvi R. (1998) Are inner or outer hair cells the source of summating potentials recorded from the round window? J Acoust Sor Am. 104, 370-377.
Eggermont JJ. (1974) Basic principles for electrocochleography. Acta Otolaryngol Suppl. 316, 7-16.
Eggermont 11. (1976) Electrocochleography. In: Keidel WD, Neff WD, eds. Handbook of Sensory Physiology. Auditory System. Clinical and Special Topics. New York: Springer; pp 625-706.
Elberling C. (1976) Simulation of cochlear action potentials recorded from the ear canal in man. In: Ruben RJ, Elberling C, Salomon G, eds. Electrocochleography. Baltimore, MD: University Park Press; pp 151-168.
Ferraro JA, Tibbils RR (1999) SP/AP area ratio in the diagnosis of Meniere’s disease. Am J Audio’. 8, 21-28.
Goldstein M, Kiang N. (1958) Synchrony of neural activity in electric responses evoked by transient acoustic stimuli. I Acoust Sor Am. 30, 107-114.
Huang T, Santarelli R, Starr A. (2009) Mutation of OPA1 gene causes deafness by affecting function of auditory nerve termila’s. Brain Res. 1300, 97-104.
Iseli C, Gibson W. (2010) A comparison of three methods of using transtympanic electrocochleography for the diagnosis of Meniere’s disease: click summating potential measurements, tone burst summating potential amplitude measurements,and biasing of the summating potential using a low frequency tone. Acta Otolaryngol. 130, 95-101.
Jiang ZD, Wu YY, Liu XY, Wilkinson AR. (2011) Depressed brain-stem auditory function in children with cerebral palsy. J Child Neurol. 26, 272-278.
Jiang ZD, Zhou Y, Yin R, Wilkinson AR. (2013) Amplitude reduction in brainstem amplitude response in term infants under neonatal intensive care. J Child Neurol. 26, 272-278.
Kiang NYS, Moxon E, Kahn A. (1976) The relationship of gross potentials recorded from the cochlea to single unit activity in the auditory nerve. In: Ruben RJ, Elberling C, Salomon G, eds. Electrocochleography. Baltimore, MD: University Park Press; pp 95-115.
![]() Kraus N, Ozdamar 0, Stein L, Reed N. (1984) Absent auditory brain stem response: peripheral hearing loss or brain stem dysfunction? Laryngoscope. 94, 400-406.
Kraus N, Ozdamar 0, Stein L, Reed N. (1984) Absent auditory brain stem response: peripheral hearing loss or brain stem dysfunction? Laryngoscope. 94, 400-406.
McMahon CM, Patuzzi RB, Gibson WPR, Sanli H. (2008). Frequency-specific electrocochleography indicates that pre‘ synaptic and postsynaptic mechanisms of auditory neuropathy exist. Ear Hear. 29, 314-325.
Mod N, Asai H, Doi K, Matsunaga T. (1987) Diagnostic value of extratympanic electrocochleography in Meniere’s disease. Audiology. 26, 103-110.
Orchik DJ, Ge NN, Shea JJ Jr. (1998) Action potential latency shift by rarefaction and condensation clicks in Meniere’s disease. J Am Arad Audio!. 9,121-126.
Orchik DJ, Shea JJ Jr, Ge X. (1993) Transtympanic electrocochleography in Meniere’s disease using clicks and tone-bursts. Am J Otol. 14, 290-294.
Parving A, Elberling C, Salomon G. (1981) ECochG and psycho-acoustic tests compared in identification of hearing loss in young children. Audiology. 20, 365-381.
Patuzzi RB, Yates GK, Johnstone BM. (1989) The origin of the low-frequency microphonic in the first cochlear turn of guinea-pig. Hear Res. 39, 177-188.
Pou AM, Hirsch BE, Durrant JD, Gold SR, Kamerer DB. (1996) The efficacy of tympanic electrocochleography in the diagnosis of endolymphatic hydrops. Am J Otol. 17, 607-611.
Ryerson 5, Beagley H. (1981) Brainstem electric responses and electrocochleography. Br J Audio’. 15, 41-48.
Santarelli R. (2010) Information from cochlear potentials and genetic mutations helps localize the lesion site in auditory neuropathy. Genome Merl. 2, 91.
Santarelli R, Arslan E. (2002) Electrocochleography in auditory neuropathy. Hear Res. 170, 32-47.
Santarelli R, Arslan E. (2013) Electrocochleography. In: Celesia GG, ed. Disorders of Peripheral and Central Auditory Processing. Handbook of Clinical Neurophysiology. Vol 10. Amsterdam: Elsevier; pp 83-113.
Santarelli R, Del Castillo I, Rodriguez-Ballesteros M, Scimemi Cama E, Arslan E, et al. (2009) Abnormal cochlear potentials from deaf patients with mutations in the otoferlin gene. /Assoc Res Otolaryngol. 10, 545-556.
Santarelli R, Del Castillo I, Starr A. (2013) Auditory neuropathies and electrocochleography. Hero; Balance Commun. II, 130137.
Santarelli R, Scimemi P, Dal Monte E, Arslan E. (2006a) Cochlear microphonic potential recorded by transtympanic electrocochleography in normally- hearing and hearing-impaired ears. Acta Otorhinolaryngol Ital. 26, 78-95.

















