ABR –BAEP Potenziali evocati uditivi del tronco encefalico
(alcune attrezzature per potenziali evocati dello studio Tanzariello)
|
|
|
|
Fig.1a:ICS Chartr – Fig.1b Interacoustics EP 25 |
Fig.1b Interacoustics- Fig.1d:ICS Chartr Fig.1e:Amplaid MK12 |
|
|
|
|
Fig.1f Preamplificatore ICS Chartr EP 200 Chartr |
Fig.1g Preamplificatore Neurosoft |
ABR -BAEP)Potenziali evocati uditivi tronco encefalici
ABR 1) SINTESI:
· Che cosa è un potenziale evocato uditivo del tronco encefalico (ABR -BAEP)?
· Quando viene utilizzato l’ABR – BAEP?
· Come prepararsi per un esame ABR – BAEP
· Cosa succede durante un un esame ABR – BAEP?
· Gli effetti collaterali di un esame ABR -BAEP
· Fattori che influenzano un esame ABR -BAEPs
· Quali risultati può mostrare un esame ABR – BAEP
· Utilità clinica del ABR -BAEP
![]()
Che cosa è un potenziale evocato uditivo del tronco encefalico (ABR-BAEP)?
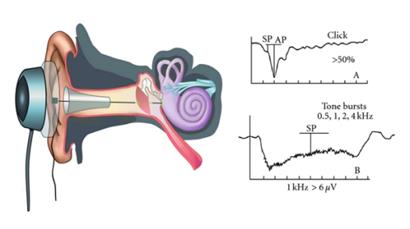
Un potenziali evocato udivto dal tronco encefalico (ABR -BAEP) (ABR: “Auditory Brainstem Response”) rappresenta la risposta eleffrofisiologica che origina dalla porzione della via uditiva anatomicamente compresa fra il nervo acustico e la regione sotto talamica, è un potenziale evocato provocato da stimoli sonori (suono), impulsivi inviati in numero di 1500-2000 L’attività bioelettrica viene raccolta da elettrodi di superficie (vertice-mastoide) posizionati sul cuoio capelluto ed elaborata attraverso funzioni di “averaging” e di condizionamento del segnale comprendenti amplificazione e filtraggio, questi potenziale vengono poi visti come una tracciato elaborato da un elettroencefalogramma (EEG) . Le risposte a stimoli uditivi provengono da strutture relè all’interno deltronco encefalico. Si evidenzia con una tipica morfologia costituita da 6-7 onde che si sviluppano entro una latenza di 7-8 ms dall’invio dello stimolo, Tali onde dipendono dalla modalità di attivazione che nel tempo interessa le popolazioni neuronali fra recettore cocleare e corpo genicolato mediale Più in particolare (Fig.31), come è stato dimostrato nell’uomo durante registrazioni intra-operatorie,
l’onda I corrisponde al potenziale globale della porzione distale del n. VIII,
l’onda II è generata dalla porzione prossimale del nervo, al suo punto di ingresso nel tronco cerebrale (giunzione bulbo-pontina).
L’onda III è associata all’attività dei nuclei cocleari ipsilaterali (CN) rispetto all’orecchio stimolato di parte del complesso olivare superiore (SO) e dei nuclei del corpo trapezoide controlaterali
Il complesso di onde IV e V, nell’uomo è in relazione all’attività del lemnisco laterale (LL) all’ingresso del collicolo inferiore (IC) controlaterale all’orecchio stimolato, mentre il voltaggio negativo successivo all’onda V corrisponderebbe a potenziali dendritici del collicolo inferiore Tale struttura rappresenta una regione cui fanno capo quasi tutti i tratti neurali provenienti dalla porzione inferiore del tronco
Le successive componenti. onda VI e VII (quest’ultima spesso mal definita) si ritengono generate dal corpo genicolato mediale (MG)
|
|
|
|
Quando viene utilizzato l’ABR-BAEP ?
Un medico può raccomandare di essere sottoposti ad un esame ABR-BAEP se si sono riscontrati cambiamenti nella capacità uditiva che possono essere dovuto a problemi nel percorso del nervo uditivo.
Che cosa rileva l’esame l’ABR- BAEP?
Un oto-neurologo/audiologo/orl con l’ ABR- BAEP è in grado di determinare il tempo necessario per cui uno stimolo uditivo impiega per andare dalla coclea,( punto dell’orecchio interno in cui il suono fisico si trasforma in un impulso bioelettrico), al tronco encefalico. Da questi dati l’oto-neurologo/audiologo può avere un’idea se il nervo uditivo funziona correttamente. Ad esempio, il neurinoma del nervo acustico(un tumore benigno del canale uditivo interno) può allungare o comprimere il nervo uditivo costringendo così ,il nervo uditivo ,ad impiegare un tempo maggiore per l’elaborazione degli stimoli uditivi.
Come prepararsi per una esame per essere sottoposti ad un ABR- BAEP
· Lavarsi i capelli la sera prima
· Fare un pasto normale il giorno della prova non dovrebbe creare problemi .
· Prima di eseguire l’ABR- BAEP si deve eseguire un esame audiometrico completo.
Cosa succede durante un esame ABR- BAEP?
La procedura BAEP è sicura e non invasiva. Per la procedura, alcuni elettrodi saranno incollati in particolari zone del cuoio capelluto o sul lobo dell’orecchio.
1. Vi saranno dato cuffie speciali o cuffie ad inserti da inserire nei condotti uditivi.
2. E ‘importante ascoltare con attenzione ciò che l’audiologo o l’audiometrista che conduce il test dice e seguire le loro istruzioni. Il paziente dovrà sentire una serie di ‘ suoni detti clicks ‘ attraverso le cuffie.
3. Le risposte ai ‘clicks (suoni)’ vengono registrati attraverso gli elettrodi usando speciali attrezzature.
4. Dopo la procedura gli elettrodi verranno rimossi dalla testa.
5. Il medico discuterà i risultati del test con voi dopo che sono state analizzati i tracciati.
|
|
|
Immagine per gentile concessione del Dr K Ng ) |
|
|
|
|
Gli effetti collaterali della prova ABR-BAEP
La procedura per la taratura dell’ABR BAEP è indolore e gli effetti collaterali sono molto rari. C’è una possibilità che può avere qualche lieve irritazione cutanea causata dagli elettrodi. Dopoché la procedura è terminata, i pazienti sono solitamente in grado di tornare a casa il giorno stesso. Dato che state abbastanza bene, dovreste essere in grado di guidare a casa dopo la procedura.
Fattori che influenzano l’ABR-BAEP
L’Età ed il sesso sono hanno effetto sulle misurazioni ABR-BAEP, i neonati tendono ad avere latenze più lunghe, che cambiano con l’età. Le donne tendono ad avere modelli di risposta rispetto diversi agli uomini. Le Risposte del tronco encefalico sono molto più resistenti agli anestetici dei potenziali evocati visivi (PEV) o potenziali evocati somatosensoriali (SSEP) , maì che questo di solito non è un problema.
Quali risultati possono mostrare gli ABR-BAEP ?
ABR-BAEPs possono essere utili nella diagnosi di:
· Perdita dell’udito – Anche se non è completo, l’ipoacusia può essere rilevato come questo provoca cambiamenti nell’ ABR-BAEP.
· Neuroma acustico – si tratta di un tumore benigno del canale uditivo interno che può allungare o comprimere il nervo uditivo, causando possibili complicazioni.
· La sclerosi multipla – I pazienti con SM possono avere un BAEP anomalo, anche se i segni o sintomi di compromissione del tronco encefalico non sono presenti.
· Infiammazione Sub aracnoide – questo può essere causato da emorragia subaracnoidea, meningite o sindrome di Guillain-Barre .
· Altri disturbi neurologici sono stati associati con una BAEP anormale tra cui atassia di Friedreich , atassia cerebellare ereditaria e deficit B2.
· l’ABR- BAEP può essere utilizzato per valutare con precisione la conduzione nervosa attraverso il tronco cerebrale ed il nervo uditivo, percorsi che non sono accessibili con altri esami strumentali.
BAEP può essere utilizzato per valutare con precisione la conduzione nervosa attraverso il tronco cerebrale ed il nervo uditivo, percorsi che non sono accessibili con altri esami strumentali.
· l’ABR- BAEP può fornire informazioni sui pazienti con possibile sclerosi multipla o altre lesioni che interessano il sistema nervoso uditivo.
- Monitoraggio l’ABR-BAEP è utilizzato anche per monitorare lo stato del paziente durante gli ‘interventi chirurgico di neurochirurgia in fossa cranica posteriore, (tumori dell’angolo ponto-cerebellare) che mettono a rischio tronco encefalico e nervi cranici (VII e VIII) e, talvolta, nel reparto di terapia intensiva (ICU).
· I test l’ABR-BAEP spesso sono meno costosi di altre tecniche come la risonanza magnetica .
· La registrazione dei BAEP in età pediatrica consente di acquisire informazioni obiettive per la diagnosi precoce di disfunzioni neurologiche ed uditive nel piccolo paziente non collaborante clinicamente
· Utilità clinica dei BAEP nei bambini
La registrazione dei BAEP in età pediatrica consente di acquisire informazioni obiettive per la diagnosi precoce di disfunzioni neurologiche ed uditive nel piccolo paziente non collaborante clinicamente
- Applicazioni neurologiche
Valutazione maturazione del sistema nervoso
Contributo alla localizzazione del livello di danno del tronco in condizioni critiche
Monitoraggio via acustica durante interventi su tumori del tronco
- Applicazioni audiologiche
Precoce diagnosi di disfunzione uditiva in bambini, e neonati a rischio per danno uditivo, prima che si manifestino ritardi nel linguaggio, con possibilità di anticipare l’applicazione di tecniche riabilitative o di protesi.
Possibilità di discriminare in età neonatale tra ipoacusie di conduzione e neurosensoriali in base a presenza/ assenza dell’onda I
I test dei potenziali evocati uditivo del tronco encefalico (l’ABR-BAEP) comporta il monitoraggio di una serie risposte ai ‘click’ utilizzando elettrodi posizionati sul cuoio capelluto. È utile per rilevare problemi associati al sistema nervo uditivo compreso dal neurinoma dell’acustico o nella sclerosi multipla.
Articolo gentilmente scritto e recensito da:
Il dottor Karl Ng MB BS (Hons 1) FRCP FRACP CCT Neurofisiologia Clinica (UK)
Walsh P, Kane N, Butler S. Il ruolo clinico dei potenziali evocati. J Neurol Neurosurg Psychiatry. 2005; 76 Suppl 2: ii16-22.
1. Biacabe B, Chevallier JM, Avan P, Bonfils P. Anatomia funzionale dei nuclei del tronco encefalico uditivi: Applicazione alla base anatomica dei potenziali evocati uditivi del tronco encefalico Auris Nasus Laringe..2001 28 (1) :85-94.
2. Nicholas JF, Samra SK. Sensory potenziali evocati. Semin Anesth. 1997 16 (1) :14-27.
3. Nuwer MR. Fondamenti di potenziali evocati ed applicazioni cliniche comuni oggi. Electroencephalogr Clin Neurophysiol. 1998; 106 (2) :142-8.
4. Deuschl G, Eisen A (eds). Raccomandazioni per la Pratica di Neurofisiologia Clinica:. Linee guida della Federazione Internazionale di Neurofisiologia Clinica Electroenceph Clin Neurophysiol 1999 Suppl 52 (2a edizione). Amsterdam: Elsevier Science, 2000.
Malattie che utilizzano questo esame :
· Sindrome di Guillain-Barre (GBS)
· Meningite (eosinofila meningite)
APPROFONDIMENTO
ABR 2 ) INTRODUZIONE
AUDIOMETRIA A RISPOSTE ELETTRICHE EVOCATE: E.R.A. (ELECTRIC RESPONSES AUDIOMETRY)
L’audiometria a risposte elettriche è una forma di indagine basata sul rilievo dei potenziali elettrici che, a seguito di stimoli sonori, vengono evocati a partire dall’orecchio interno, lungo il nervo acustico, le vie uditive centrali sino alla corteccia cerebrale.
Tale metodica consente di esplorare la funzione del recettore nervoso, nonchè di un’area del sistema nervoso centrale, e le risposte ottenibili non dipendono dalla collaborazione del paziente.
I campi di utilizzazione sono in sintesi i seguenti:
— determinazione della soglia uditiva anche in soggetti non collaboranti, quali neonati o bambini, cerebropatici, psicopatici, simulatori;
— diagnosi di sede nei deficit neurosensoriali della funzione uditiva;
— studio funzionale del tronco encefalico e delle aree uditive corticali, anche in assenza di ipoacusia;
— valutazione dell’ integrità funzionale delle vie uditive centrali;
— studio fisiopatologico delle funzioni associative superiori.
Lo studio dei potenziali uditivi evocati si basa sul concetto che se si effettua una adeguata stimolazione acustica, l’attività bioelettrica di base di tutte le strutture nervose uditive, periferiche, intermedie e centrali, viene a modificare i propri caratteri qualitativi e quantitativi. Quindi in sintonia e contemporaneamente alla stimolazione se l’apparato uditivo è integro, si verifica una modificazione dell ‘attività bioelettrica di riposo, legata alle variazioni dell ‘attività biochimica e metabolica ed ai processi di trasduzione meccanoeletfrica cocleare. Tali modificazioni indotte prendono il nome di potenziali evocati.
Il substrato fisiologico della audiometria a risposte elettriche è il seguente: qualsiasi stimolazione sensoriale, incluso quindi quella acustica, induce una attivazione delle strutture nervose che ricevono e veicolano lo stimolo, le quali subiscono variazioni di potenziale elettrico; questo fenomeno si traduce in una variazione del ritmo e della morfologia nell’elettroencefalogramma.
Tale attività neuroelettrica può essere derivata o con elettrodi posti in prossimità della sorgente (tecnica “near field: campo vicino” sono dette derivazioni a campo vicino quelle elettrococleografiche con elettrodo transtimpanico). ovvero con elettrodi applicati alla cute del cranio (tecnica “far field: campo lontano” ABR. MLR. SVR, CNV, ASSR,P300,MNN ecc.).
Da quanto detto si può quindi classificare lo studio dei potenziali evocati uditivi secondo un criterio topografico (Fig. 2):

Fig. 2
— una prima categoria riguarda lo studio dell’attività elettrica periferica (coclea e nervo VIII), nonché delle strutture centrali più basse (vie e centri bulbo-pc mesencefalici); i potenziali evocati relativi sono denominati precoci a motivo della latenza relativamente breve che li contraddistingue;
— una seconda categoria di potenziali è quella delle cosiddette risposte intermedie che testimoniano l’attivazione delle strutture neuronali mesencefaliche alte, talamiche e della corteccia primaria uditiva: si tratta di potenziali evocati ancora di scarsa utilizzazione clinica per cui ne tralasceremo la trattazione;
— una terza categoria infine studia i cosiddetti potenziali evocati uditivi tardivi o lenti che indicano l’attivazione della corteccia uditiva secondaria, delle vie e della corteccia associativa.
ABR 3 DESCRIZIONE GENERALE DELLA RISPOSTA UDITIVA DEL TRONCO
POTENZIALI UDITIVI PRECOCI
Il primo gruppo di indagini che, come si è detto, riguarda i potenziali “precoci”, comprende l’Elettrococleografia (ECochG) ed i potenziali evocati uditivi del tronco (Auditory Brainstem Responses, ABR).
l’Elettrococleografia (ECOCHG)
L’ECochG si può effettuare con metodica a “campo vicino” o metodica a “campo lontano”. Nel primo caso l’elettrodo di riferimento, costituito da un ago in tungsteno, è applicato attraverso la membrana timpanica (Fig. 3a-b-c) in modo da toccare la zona del promontorio (prominenza ossea dovuta al giro basale della coclea) e studia l’attività bio-elettrica della coclea e soprattutto del nervo uditivo. Necessita di anestesia locale se effettuata su un soggetto adulto e di anestesia generale se si tratta di un bambino, in quanto è necessario che l’elettrodo rimanga assolutamente immobile sul promontorio. Nell’ECochG a campo lontano si utilizza un elettrodo posizionato nel Condotto Uditivo Esterno, a livello dell’anulus. La differenza tra le due tecniche consiste in una riduzione d’ampiezza dei potenziali della coclea nella metodica a campo lontano. Essendo comunque, anche nel secondo caso, il posizionamento dell’elettrodo non agevole, si preferisce comunque la tecnica a campo vicino.
 Le risposte elettrococleografiche sono rappresentate dai potenziali: Microfonico Cocleare (MC), Potenziale di Sommazione (PS) e Potenziale d’Azione (PA). Il MC è generato dalle cellule del Corti, e rappresenta la vibrazione della Membrana Basilare, soprattutto a livello del giro basale della coclea, che è la più vicina all’elettrodo. Essendo esso molto limitato, data la zona di esplorazione, non può essere utilizzato come indicatore della funzionalità uditiva. Anche il PS è generato dalle cellule del Corti, ed il suo significato non è ancora del tutto chiarito. Anch’esso, come il MC, ha scarso significato clinico. Il PA è il potenziale su cui si basa la diagnosi elettrococleografica.
Le risposte elettrococleografiche sono rappresentate dai potenziali: Microfonico Cocleare (MC), Potenziale di Sommazione (PS) e Potenziale d’Azione (PA). Il MC è generato dalle cellule del Corti, e rappresenta la vibrazione della Membrana Basilare, soprattutto a livello del giro basale della coclea, che è la più vicina all’elettrodo. Essendo esso molto limitato, data la zona di esplorazione, non può essere utilizzato come indicatore della funzionalità uditiva. Anche il PS è generato dalle cellule del Corti, ed il suo significato non è ancora del tutto chiarito. Anch’esso, come il MC, ha scarso significato clinico. Il PA è il potenziale su cui si basa la diagnosi elettrococleografica.
Fig.3a
Fig.3b-3c
Applicazioni cliniche
1) Diagnosi di cofosi: è la metodica di elezione per escludere qualsiasi attività cocleare, perché è l’unico test in cui non è richiesto il mascheramento controlaterale, che è molto complicato da effettuare in caso di sordità profonda.
2) Ipoacusia recettiva cocleare (presbiacusia, danno ototossico e da rumore): in questi casi la sede del danno risiede prevalentemente nelle cellule acustiche esterne del giro basale. Il potenziale d’azione è quindi difasico, con componente P2 (onda positiva immediatamente precedente all’onda N2) di grande ampiezza, quindi con un notevole contributo delle cellule acustiche interne.
3) Malattia di Ménière: il dato più significativo in questo caso è un PS di grande ampiezza, ed uno slargamento del complesso PS-PA.
4) Fistola perilinfatica: si manifesta con un aumento abnorme dell’ampiezza del PA, dato dall’aumentata fuoriuscita di perilinfa.
5) Sordità improvvisa: in questo caso possiamo avere risposte con caratteristiche molto diverse tra di loro, essendo la sordità improvvisa espressione di diversi meccanismi patogenetici. In alcuni casi il tracciato è utile per diagnosi differenziale e quindi per fornire elementi utili per la terapia e la prognosi.
6) Tumori dell’angolo ponto-cerebellare: sebbene non sia la metodica di indagine di elezione per la diagnosi nella patologia dell’APC, alcune alterazioni del tracciato sono tuttavia apparse con frequenza maggiore, come ad esempio un allargamento del complesso PS-PA, ma soprattutto una soglia del PA migliore della soglia psicoacustica.
7) Monitoraggio intraoperatorio nella chirurgia dell’orecchio, rilevando modificazioni dei parametri dell’E.Coch.G durante le varie manovre chirurgiche.
8) Diagnosi di Neuropatia Uditiva: presenza di MC (generato dalle cellule ciliate esterne) con ABR fortemente alterato.
DESCRIZIONE GENERALE DELLA RISPOSTA UDITIVA DEL TRONCO
ABR3.1) Misure Fondamentali Risposta Uditiva del Tronco Encefalico ABR
DGR2)Origini della Risposta Uditiva del Tronco Encefalico
ABR 4)ARAMETRI DEGLI STIMOLi
ABR.4.1)Tipi di Stimolo
ABR.4.2)Polarità dello Stimolo
ABR.4.3)Frequenza Durata degli Stimoli
ABR.4.4) Mascheramento controlaterale all’orecchio testato
ABR.4.5)Calibrazione dell’ Intensità degli Stimoli
ABR 5.) TECNICHE DI REGISTRAZIONE
ABR 5.1) Elettrodi
ABR 5.2) Variabili di registrazione Impostazioni dei filtri
ABR 5.3) Variabili extrauditive del soggetto
ABR 5.4) Analisi Periodo
ABR 5.5) Chirps
Variabili di registrazione
ABR 6) APPLICAZIONI CLINICHE DELLA RISPOSTA UDITIVA DEL TRONCO
ABR 6.1))Risposta Uditiva del Tronco e Stima della Sensibilità Uditiva
ABR 6.2)Risposta Uditiva del Tronco nella Valutazione Otoneurologica
ABR 6.3)Auditory risposta Brainstem in Chirurgia Monitoraggio intraoperatorio
ABR 7) FATTORI CHE INFLUENZANO LA RISPOSTA UDITIVA DEL TRONCO
ABR 7.1) Genere Età e sesso
ABR 7.2))Variabili patologiche
ABR 7.3 )ABR nei neonati e bambini – Maturazione
ABR 7.4)Agenti Farmacologici
ABR 7.5)Temperatura corporea
ABR 8) UTILITÀ CLINICA
ABR 9) RUOLO CLINICO ATTUALE DEI POTENZIALI EVOCATI
ABR 3) POTENZIALI UDITIVI EVOCATI TRONCOENCEFALICI (ABR)
Potenziali evocati uditivi del tronco encefalico (Le sigle ABR: Auditory Brainstein Response;BAEP/BAER: Brainstem Auditory Evoked Potentials: BSER: Brain Stem Evoked Response; PEA potenziali evocati auditivi, sono usate indifferentemente per lo stesso esame)
Potenziali evocati uditivi del tronco encefalico (ABR: Auditory Brain Stem Responses)
La registrazione degli ABR ha senz’altro maggiori e più interessanti possibilità applicative rispetto alla E.Co.G., sia perchè è una metodica incruenta, sia perchè offre la rappresentazione dell’attività di un più ampio tratto della via acustica: dal nervo acustico al corpo genicolato mediale del talamo.
L’ambito diagnostico degli ABR riguarda pertanto: la patologia dell’ottavo nervo cranico, le affezioni dell’angolo ponto-cerebellare, le affezioni vascolari, proliferative, degenerative del tronco encefalico.
Gli ABR comprendono:
— i potenziali precoci ABR – BSER: Brain Stem Evoked Responses;
— i potenziali precoci da basse frequenze FFR: Frequency Following Responses;
— i potenziali miogenici PAM: Post Auricolar Muscle.
Questi ultimi (FFR e PAM) hanno una modesta importanza clinica, pertanto se ne farà solo un breve accenno.
BSER (ABR). La registrazione degli ABR BSER si effettua con una tecnica del tipo “far field”, ovvero misurando le variazioni di attività elettrica delle strutture nervose in esame con elettrodi applicati a livello della superficie cranica (fronte; vertice; mastoide).
Anche in questo caso, come in tutti gli ERA, la metodologia consiste nell’invio all’orecchio di un gran numero di segnali sonori, circa 2000, ognuno dei quali produce una risposta elettrica standard la quale, tramite il computer, viene amplificata rispetto all’attività elettrica delle altre strutture nervose, così da renderla visibile.
E’ bene anticipare come l’uso di farmaci sedativi, che si rendono necessari nei pazienti non collaboranti, non viene ad influenzare il risultato dello esame BSER.
Lo stimolo acustico è rappresentato da cicks non filtrati – il cui massimo contenuto energetico è posto fra 1000 e 4000 Hz – inviati con cadenza di 10 al secondo.
L’intensità di erogazione naturalmente è calibrata in funzione dell’obiettivo dell’esame: se il quesito clinico concerne la funzione delle vie nervose, lo stimolo è inviato ad alta intensità (70 dB SL); se interessa trovare la soglia uditiva, lo stimolo è inviato ad intensità decrescente, partendo da valori in dB presunti sopraliminari. In quest’ultimo caso, onde avere stimolazioni selettive sulla coclea, si possono usare clicks filtrati, tone bursts, o mascheramenti selettivi; i risultati però sono meno affidabili di quelli ottenibili, con analoghi espedienti, tramite E.Co.G.
Il pattern BSER è costituito da 6 onde, numerate con numeri romani, ognuna delle quali è correlabile con una definita sezione anatomica della via acustica.
Onda I: porzione distale dell’VIII° n.s.
Onda II: porzione prossimale dell’VIII° n.c. e nucleo cocleare pontino.
Onda III: complesso olivare pontino.
Onda IV: nucleo del lemnisco laterale ponto-mesencefalico.
Onda V: collicolo – o tubercolo quadrigemino – inferiore del mesencefalo.
Onda VI: corpo genicolato mediale talamico.
Alcuni AA. riconoscono anche una onda VII, non correlabile con sicurezza ad una precisa struttura anatomica..
La sequenza di onde è apprezzabile per intero solo per intensità di stimolazione di almeno 60 db SL.
In tale condizione la latenza dell’onda I è di I msec.; le altre si succedono regolarmente ad intervalli di i msec. l’una dall’altra. La latenza normale dell’onda V è pertanto, di norma, di 5 msec.
Con intensità sonore progressivamente decrescenti i vari elementi del pattern scompaiono: sotto i 50 db SL si riconoscono ancora solo le onde III e V, mentre sotto i 30 db SL è visibile solo la onda V.

Fig. 4 – Registrazione di B.S.E.R. ad intensità di stimolazione decrescente. Si noti la persistenza dell’onda V anche a basse intensità sopraliminari.
L’onda V è obiettivabile fino a 15-10 db SL, quindi, oltre ad avere un’ottima evidenziabilità nei tracciati nettamente sopraliminari, è anche l’unica a rimanere visibile nei tracciati debolmente sopraliminari. Rappresenta pertanto un essenziale punto di riferimento nell’esame dei tracciati BSER (Fig. 4).
Con la diminuzione dell’intensità sonora si osserva, anche a carico delle onde più stabili, un aumento di latenza, oltre al citato decremento di ampiezza.
ABR 3.1) Misure Fondamentali della Risposta Uditiva del Tronco Encefalico ABR
I due parametri della forma d’onda ABR che di solito vengono misurati sono l’ampiezza e la latenza. Ampiezza viene tipicamente misurata tra un picco positivo e il seguente “picco” negativo o (trogolo Figura 5 ). Misure picco-picco sono favoriti perché evitano la difficoltà di determinare la linea di base del potenziale.
Figura 5 . ampiezza e latenza misure di base della ABR.

Ci sono diverse misure di latenza di interesse. Il più semplice è la latenza assoluta, che è definita come la differenza di tempo tra stimolo insorgenza e il picco dell’onda ( Figura 5 ). Latenze Interwave (o intervalli interpicco) sono le differenze tra latenze assolute dei due picchi, come I-V, I-III, e III-V ( Figura 5 ). Nel valutare le latenze ABR, l’accento di solito è posto sulle vette vertice-positiva della forma d’onda.
protocollo di test ABR
Torna alla fine del 1970, abbiamo avuto l’attrezzatura clinica e ABRs diventati piuttosto comune nei grandi centri medici. Allora, stavamo prendendo attrezzature che è stato progettato per essere utilizzato con gli adulti, utilizzando protocolli progettati per ABRs neuro diagnostici, quando alla ricerca di tumori acustici, e stiamo applicando i protocolli per i bambini. Per tentativi ed errori e un sacco di sistematica studio clinico, abbiamo cominciato a raffinare tale protocollo di prova.
Fortunatamente, nel 2013, abbiamo un protocollo che è evidence-based. Ognuno dei parametri raccomandati viene selezionato sulla base di evidenze della ricerca. Vi garantisco che se hai un bambino tranquillo e utilizzare questo protocollo, si otterrà il miglior ABR un bambino in grado di produrre. Ci sono variazioni nel protocollo di tutti i professionisti e, ma il protocollo generale è ampiamente accettata.
Trasduttori
Negli Stati Uniti, e la maggior parte dei posti, tranne l’Inghilterra, gli inserti sono il trasduttore di scelta. Gli inglesi sono molto scettici sull’utilizzo di inserti, perché sono preoccupati che non possiamo calibrare il suono in un piccolo canale uditivo. Più grande è l’auricolare, il minore impatto piccola rispetto a grandi canali auricolari hanno l’intensità reale. Ma in realtà, i risultati di migliaia di bambini ha dimostrato che anche i bambini con udito perfettamente normale non hanno soglie di -20 o -25 dB, che è quello che ci si aspetterebbe se siamo stati sempre molto alto efficace intensità di stimolo con inserti. Il vantaggio di inserti superano di gran lunga qualsiasi leggero svantaggio di non sapere esattamente ciò che l’intensità è per un neonato specifico.
ABR 4)PARAMETRI DEGLI STIMOLI
ABR 4.1)Tipo di stimolo : transitori , toni puri e Chirps .
L’ABR può essere evocato da qualsiasi stimolo acustico, a patto che si verifichi una perturbazione dinamica nella coclea nel minor tempo possibile. Ciò favorisce l’attivazione sincrona del maggior numero di fibre del nervo cocleare e delle vie uditive ad esso connesse Lo stimolo più adeguato a riprodurre questa condizione è un transitorio (Fig.6a), La scarica neurale è infatti tanto più sincrona quanto più breve è il tempo di salita del fronte dell’onda acustica. In queste condizioni tutte le componenti dell’ABR risulteranno meglio definite e più ampie rispetto al rumore di fondo, al contrario risulteranno meno definite e meno ampie se il fronte di salita dell’onda acustico è più lento. L’ABR evocato da transitori è in funzione della risposta dinamica della coclea a questo tipo di stimolo e quindi riflette la funzionalità della coclea nella sue regioni basali Pertanto I’ABR è sensibile alla soglia uditivo con un’ottima correlazione per le frequenze fra 2 e 4 kHz ed in misura minore per le frequenze i e 0.5 kHz come “2-1-2’, vale a dire toni puri con 2 cicli di salita e discesa ed 1 ciclo di “plateau”. Con questi stimoli le componenti della risposta sono meno ampie e caratterizzate da latenze superiori a quella ottenuta da transitori, L’aumento di latenza delle componenti dipende in parte dalla frequenza dello stimolo ed in parte dal tempo di salita. Latenze più prolungate si ottengono con stimoli di frequenza relativamente bassa, ad esempio 500 Hz, e tempi di salita lunghi, ad esempio 4-6 ms. Con “tone-pip” di bassa frequenza i livelli della soglia eleffrofisiologica possono essere di 20-30 dB più elevati rispetto alla soglia comportamentale. Queste limitazioni, unitamente al fatto che le registrazioni con toni in bassa frequenza possono richiedere un numero elevato di ripetizioni, e più di due repliche per confermare la risposta a livello di soglia, riducono di fatto l’utilizzo clinico dell’ABR a toni puri,
Per migliorare la specificità dell’ABR nei confronti delle frequenze inferiori a 2 kHz è possibile utilizzare, anziché transitori, stimoli tonali brevi (“tone-pip”), di durata di qualche ms è con tempi di salita di 1-4 ms La configurazione più utilizzata è definita I due principali tipi di stimoli sono clic e toni-puri, ma ora abbiamo anche stimoli Chirp. È possibile utilizzare ciascuno di essi in qualche momento durante la valutazione ABR. Abbiamo strumenti sempre più nella nostra cassetta degli attrezzi per fare un lavoro migliore nella valutazione dei bambini.

Fig.6a
PS2)Parametri Stimolo
Intensità. funzioni di latenza intensità per i principali componenti della ABR click-evocato sono mostrati in figura 6b . Le latenze aumentano quando l’intensità dello stimolo diminuisce, sostanzialmente in parallelo con i cambiamenti di latenza del AP (Wave I). Le ampiezze delle onde diminuiscono quando l’intensità diminuisce. Inoltre, come l intensità diminuisce le prima onda diminuisce ed infine scompare , mentre l’Onda V rimane spesso distinguibile man mano che ci si avvicina alle soglie comportamentali per lo stesso stimolo.
Fig. 6b . ABR funzioni di latenza intensità e corrispondenti forme d’onda ABR.

La base primaria per il passaggio di latenza intensità sopra descritto viene rivelato da dati provenienti Don e Eggermont ( 1978 ), che ha usato il metodo mascheratura sottrattiva. Questo metodo è stato originariamente sviluppato per indicare le regioni della coclea che contribuiscono al click evocato AP ( Teas et al. 1962 ). Come mostrato in Figura 6 , rumori diversi passa alto sono utilizzati per ottenere mascherati ABRs click-evocata. Il ABR ottenuto con una frequenza inferiore cutoff maschera viene sottratta dalla risposta ottenuta con una maggiore frequenza di taglio maschera. La risposta smascherato alto livello è dominato dai contributi fibre al fine basale della coclea. Lo spostamento di latenza intensità poi sembra riflettere il tempo necessario per l’onda di propagare al posto sulla membrana basilare domina la risposta. Tuttavia, se si assume che questa tecnica comporta la mascheratura delle regioni cocleari basali, poi diffondersi verso l’alto dell’eccitazione possono non del tutto conto di cambiamenti in latenza per le singole bande derivati (vedi figura 6 di Eggermont & Don, 1980 ).
ABR 4.2)Polarità dello stimolo (compressione-rarefazione)
Figura 7 . Effetti della polarità dei click (cioè fase iniziale) sull ABR: C = condensazione; R = rarefazione. Dalla ricostruzione della Audiogram Uso risposte tronco encefalico e passa-alto rumore di mascheramento da M.Don, JJ Eggermont, e DE Brackman, 1979. Annals of Otology, Rinologia, e Laryngology , 88 (Suppl. 57), p. 6. Copyright 1979 da Annals Publishing Company. Ristampato con il permesso.
Gli effetti della fase non sono molto grandi nella maggior parte dei soggetti. Di conseguenza, molti esaminatori preferiscono utilizzare stimoli di polarità alternata, che aiutano a minimizzare l’artefatto elettrico (che, prodotto dal trasduttore e raccolto dall’elettrodo alla mastoide, alle alte intensità può mascherare la porzione iniziale della risposta dello stimolo) e il CM, entrambi i quali possono oscurare la I Onda . Questo approccio può ridurre o eliminare la necessità di utilizzare cuffie con schermatura elettromagnetica . Eppure, è generalmente preferibile mantenere le distinte fasi alla fine di evitare distorsioni della forma d’onda dell’ABR. Questo è particolarmente importante nei soggetti che hanno risposte sostanzialmente diverse agli stimoli di rarefazione e condensazione. . La polarità dello stimolo di per sé produce lievi modificazioni nell’ABR. stimoli di rarefazione tendono a ridurre la latenza delle componenti e facilitano la separazione delle componenti IV e V, Tuttavia non è del tuffo evidente se ciò possa contribuire a migliorare la sensibilità clinica dell’ABR nei confronti di determinate patologie. In certi casi, in cui non sia dimostrabile un’onda V alla massima intensità di stimolazione, alcuni autori suggeriscono di ripetere la registrazione con stimoli di rarefazione a cadenza lenta: questo procedimento potrebbe facilitare la comparsa dell’onda V La stimolazione con transitori monofasici (in compressione o in rarefazione) tuttavia, può favorire la comparsa di un potenziale microfonico cocleare. In certi casi di sordità infantile profonda, il microfonico cocleare, prodottoo dalle stimolo monofasico ad elevata intensità, può simulare le onde ABR, causando importanti errori nelle stime di soglia. Se necessario, la condizione alternata può essere derivato dalla combinazione di risposte per ogni polarità stimolo nella memoria del computer. Nessuna informazione è perso perché possono essere esaminate le risposte di rarefazione e condensazione e le risposte combinate .
ABR 4.3)Frequenza degli stimoli – Ripetizione
Le ampiezze e le latenze dei componenti dell’ ABR dipendono dalla frequenza di ripetizione dello stimolo (vedi Picton, Stapells, e Campbell, 1981 , per una rassegna). Aumentando la cadenza di ripetizione degli stimoli, ad esempio passando da 10 stimoli /sa 100 stimoli/s, l’ampiezza delle componenti dell’ABP si riduce e la loro latenza aumenta Tali variazioni, indipendenti dall’intensità di stimolazione, diventano particolarmente significative con cadenze di oltre 50/s. L’aumento di latenza è differenziato per le varie componenti’ è meno consistente per le componenti generate dalla periferia (onde I,II) ed è più accentuato per le componenti generate più centralmente (onda V) Di conseguenza l’intervallo I-V può subire un aumento di 0.15-0.30 ms passando da cadenze di circa 10/s a cadenze attorno a 80/s La figura 35 riporta questo effetto rilevato in un normoudente, per stimoli di 90 dB nHL
Il fenomeno dell’allungamento dell’intervallo I-V è probabilmente dovuto a processi cumulativi di adattamento e fatica, sia a livello recettoriale che a livello neuro-sinaptico. Con elevate cadenze di stimolo anche la differenza fra soglia elettrofisiologica dell’ABR (onda V) e soglia psicoacustica risulta maggiore rispetto a quanto si osserva con cadenze attorno a 10/s. Ciò è dovuto alla ridotta ampiezza dell’onda V e quindi al suo più difficoltoso riconoscimento a livello di soglia, ma anche ad una migliore percezione di loudness (soglia psicoacustica “migliore”) che si verifica inviando transitori molto ravvicinati fra loro.
Stimolazioni a cadenze elevate sono talvolta utilizzate per rendere I’ABR più sensibile nei confronti di lesioni della via uditiva centrale, quali ad esempio sclerosi a placche, encefalopatie dismetaboliche o il neurinoma dell’acustico in stadio precoce. In queste patologie, l’ABR a cadenza elevata può mostrare significative deviazioni parametriche rispetto ai soggetti normali, in misura più evidente a quanto osservabile con stimoli a cadenza lenta. Tempi di 10/secondi o meno sono necessari per la definizione massima di tutte le onde; l’intervallo interstimolo a questa velocità è sufficientemente lungo per evitare un qualsiasi adattamento significativo della risposta a stimoli di alta intensità. Non ci sono prove che suggeriscono che alti tassi influiscono negativamente sulla risposta a stimoli di basso livello. Come illustrato nella figura 8 , i tassi più veloci prolungano progressivamente le latenze di tutte le onde, in modo che l’ Onda I è ritardata di circa 0,1 ms e la V è ritardata di circa 0,3 ms tra i tassi di 10 e 50/second ( Fowler & Noffsinger, 1983 ). La Frequenza degli stimoli con tassi elevati può anche diminuire l’ ampiezze delle onde I e V. Sono più colpiti la II e IV onda , seguito dalla I e III. Sebbene i tassi di 10/secondo siano stati proposti per migliorare la diagnosi differenziali sulla base dell’esame ABR, i risultati della ricerca non sono conclusivi ( Campbell & Abbas, 1987 ; Fowler & Noffsinger, 1983 ).Basse Frequenze Sono consigliabili basse frequenze quando è necessaria una serie completa di onde, come nel caso di valutazioni otoneurologica. Per altri scopi, come il test della soglia, sono accettabili tassi di frequenza di 25-40 stimoli al secondo, in quanto l’ampiezza della V onda è minimamente ridotta. Questo migliora l’efficienza delle misure ABR perché più medie possono essere effettuate nello stesso periodo di tempo.
Figura 8 . Effetto di stimolo (click), frequenza di ripetizione sul ABR.

ABR.4.4) Mascheramento controlaterale all’orecchio testato
L’ABR evocato da uno stimolo di elevata intensità può essere influenzato dalla contemporanea attivazione del recettore controlaterale. Ciò avviene per il trasferimento di una quota di energia acustica per via ossea. Poiché per i transitori l’attenuazione interaurale è stimata attorno ai 60 dB, stimolando un orecchio a 90 dB nHL, all’ABR contribuisce anche l’orecchio controlaterale, per una quota corrispondente a 30 dB (90-60 dB), Nella pratica clinica il mascheramento dell’orecchio controlaterale va sempre eseguito, utilizzando rumore bianco, inviato ad un’intensità inferiore di 20-30 dB rispetto all’intensità inviata all’orecchio testato. La Fig. 36 mostra il risultato ottenuto in un paziente con anacusia sinistra. L’ABR ottenuto stimolando l’orecchio anacusico, senza mascherare l’orecchio normoudente, evidenzia un’onda V a circa 8 ms Essa scompare quando si ripete il test utlizzando il mascheramento dell’orecchio normoudente
Durata
Il click ha una durata di 0,1 millisecondi (100 microsecondi), che è molto breve. Per le raffiche di tono negli Stati Uniti, la maggior parte delle persone usano due cicli di crescita, due cicli di caduta e plateau zero. Così per 1000 Hz, i due cicli sarebbero 2 millisecondi. Per 500 Hz, i due cicli sarebbero 4 millisecondi. In Inghilterra, si raccomandano due cicli di tempo di salita, un plateau, e due cicli di caduta. Probabilmente non fa molta differenza in entrambi i modi.
Rampa
Il consenso è che Blackman rampa è la cornice ideale. Ramping è il modo ogni stimolo va dalla mancanza di uno stimolo alla massima intensità. Blackman era un ingegnere elettrico che ha sviluppato una equazione matematica che ha fornito una rapida insorgenza di stimolo senza generare splatter spettrale indesiderati.
Per la maggior parte dei sistemi, vogliamo che il manufatto respingere funzione, in modo che i movimenti estranei di un bambino vengono rifiutati. Il manufatto c’è più, più lento è il test andrà perché quegli stimoli vengono rifiutate. Come regola generale, se il movimento muscolare e artefatto non riprende più del 10% degli stimoli, è necessario cercare di calmare il bambino, se il manufatto è costantemente elevato e una registrazione non può essere fatta, si potrebbe pensare alla possibilità di sedazione. Alcuni sistemi sono ponderati media, il che significa che invece di arrestare la registrazione rifiutare manufatto, mantiene la raccolta dei dati e pesa più campioni che contengono una risposta contro i campioni con rumore.
Analisi
Epoca
Quando si utilizza raffiche di tono a bassa frequenza come 500 o 1000 Hz, è necessario un tempo di analisi di 20 millisecondi. Quando sto usando un clic stimolo o un segnale ad alta frequenza scoppiata come 4000 Hz, userò 15 millisecondi. Quando si sta registrando ABR, si vuole un lasso di tempo che permette di vedere l’ABR nel bel mezzo di quel lasso di tempo. Tu non vuoi il ABR a essere schiacciata all’inizio, e certamente non vuole la maggior parte della ABR, alla fine del periodo di tempo, perché se c’è qualche ritardo nella risposta, si può anche non vede.
Se avete registrato un clic ABR ad una ad alta intensità e la latenza è di circa 6 millisecondi, un lasso di tempo di circa 12-15 millisecondi è perfetto. Se si sta registrando una raffica tono a bassa frequenza, come il 500 Hz, la risposta onda V è di circa 5 millisecondi più a lungo. Ci vogliono 5 millisecondi per l’onda che parte per ottenere dalla base all’apice. Anche ad alta intensità, la latenza tipica per un’onda V a 500 Hz è di circa 10 millisecondi, quindi un lasso di tempo di 20 millisecondi sarebbe sufficiente.
Sweep
“Sweep” è un antico termine che si riferisce ad ogni volta che uno stimolo è presentato. Con ogni presentazione, il sistema spazza attraverso il tempo di analisi alla ricerca di una risposta. Il numero di movimenti è il numero di stimoli. Il gruppo britannico raccomanda di forme d’onda replicate con 3000 spazza ciascuno. Questo è dove mi discosto dai miei colleghi britannici. Per me, questo è più tempo di quanto necessario se si dispone già di un ottimo rapporto segnale-rumore. Se si dispone di un tranquillo, dormendo bambino con sensibilità udito normale, vi garantisco che si sta andando a vedere una ABR dopo 500 spazza quando si utilizza un click stimolo.
Il mio approccio è quello di fermare presentare stimoli, non a un numero specifico, ma quando il rapporto segnale-rumore è adeguata. Se la risposta è due o tre volte più grande di qualsiasi rumore di fondo dopo 500 spazza, si guadagna nulla con la presentazione di altri 2.500 stimoli. D’altra parte, se avete un bambino con una perdita uditiva o sei giù di soglia, potrebbe essere necessario in media 3.000 o più scansioni, al fine di migliorare la risposta di diventare grande abbastanza per voi a vedere al di sopra del rumore di fondo. Raccomando cautela fermare la stimolazione quando il rapporto segnale-rumore è chiaro, e poi la replica se si utilizza tali informazioni per soglia.
ABR.4.5)Calibrazione dell’ Intensità degli Stimoli
La calibrazione dello stimolo è cruciale per definire una normativa e soprattutto per confrontare i dati di risposte ottenute da laboratori e da strumentazioni differenti, Il metodo più comunemente usato è di riferire le intensità dello stimolo ad un livello definito come O dB nHL Tale livello di intensità corrisponde alla soglia media di detezione dello stimolo, ottenuta in un gruppo di almeno 10 normoudenti. Lo stimolo va presentato attraverso il trasduttore (cuffie od inserto) ed alla stessa cadenza di ripetizione che si prevede di usare nelle registrazioni dell’ABP. Lo “zero” (0 dB nHL) così determinato corrisponderà al valore centrale di una distribuzione normale, le cui code se ne possono discostare di circa 7-8 dB (Fig.34). Per i più comuni trasduttori (cuffie TDH 39) il livello medio di O dB nHL, quando ottenuto da un congruo numero di normoudenti, corrisponde a 36 dB peak SPL e a 30 dB pe SPL
ABR 5.) TECNICHE DI REGISTRAZIONE
ABR 5.1)Posizione degli Elettrodi
Ognuno ha la sua preferenza, quando si tratta di elettrodi. Elettrodi monouso offrono il vantaggio di prevenzione delle infezioni, perché sono sterili quando escono della confezione. Ci sono una varietà di elettrodi, e alcuni funzionano meglio di altri.
Per quanto riguarda il posizionamento degli elettrodi, fronte alta è sufficiente nella maggior parte dei casi. Fronte alta è indicata dall’etichetta Fz, F è per lobo frontale, z per linea mediana. Ci sono quelli che insistono sul vertice, Cz, ma non mi piace lavare la fontanella di un bambino, che è sostanzialmente lavando dura del bambino sul cervello. La ricerca mostra chiaramente alcun vantaggio consistente nell’utilizzo del vertice sopra la fronte alta per bambini. Se possibile, vorrei mettere l’elettrodo sul lobo dell’orecchio, notata da A, per auris o l’orecchio. Se si sta mettendo l’elettrodo su una mastoide, il simbolo sarebbe M.
Ci sono alcuni notevoli vantaggi del lobo dell’orecchio sopra mastoide, in particolare un’onda I. grande Ci sono anche meno la crescita dei capelli lì, e si può tenere l’elettrodo lontano dal oscillatore osso se si ha a che fare conduzione ossea. L’elettrodo di terra può essere posizionato ovunque, ma una posizione fronte inferiore è molto conveniente, perché si sta già strofinando quella zona, e non ci sono peli, in modo da nastro o l’elettrodo monouso appiccicoso tende a rimanere molto bene.
Montaggio degli Elettrodi. primi studi di ABR e la sua utilità clinica affidamento principalmente sulle registrazioni da elettrodi posizionati sul vertice e il lobo dell’orecchio / mastoideo dell’orecchio stimolato con un terreno sul nasion, la fronte, o lobo dell’orecchio opposto o mastoideo. Il posizionamento degli elettrodi sulla fronte alla attaccatura dei capelli e la mastoide ipsilaterale o lobo dell’orecchio (con l’elettrodo di massa in genere immessi sul mastoide controlaterale) attualmente è popolare. Questo montaggio evita problemi di apposizione di elettrodi alla pelle con i capelli e le rese simili, anche se non identici, i risultati per il montaggio vertice-tomastoid ( Beattie, Beguwala, Mills, e Boyd, 1986 ). Un elettrodo sul vertice o fronte capta le onde del tronco cerebrale primari come potenziale positivo verso terra, e questi siti forniscono pickup ottimale del ABR ( van Olphen, Rodenburg, e Verway 1978 ). Se le onde sono tracciate come positivi (come in Figura 14deviazioni) o negativi (come in figura 6 ) è una questione di come gli elettrodi sono collegati all’amplificatore. Anche se nessun sito sulla testa è totalmente inattivo per il ABR ( Terkildsen, Osterhammel, e Huis int Veld, 1974 ), un sito di riferimento cefalico è preferibile in quanto prevede la soppressione del rumore superiore perché la quantità e la natura del rumore sia amplificatore differenziale ingressi saranno simili (rispetto ad un riferimento noncephalic, come il collo). Poiché il sito lobo / mastoide è attiva per il potenziale nervo ottavo, l’AP viene registrato principalmente come una grande onda negativa ma combina con le potenzialità del tronco cerebrale tramite inversione amplificatore per formare un picco della stessa polarità evidente come i componenti del tronco cerebrale, come illustrato in Figura 21 . Sebbene diversi posizionamenti degli elettrodi possono migliorare vari componenti della ABR, piccole differenze di posizionamento avrà scarso effetto ( Martin & Moore 1977 ).
Figura 9 . Derivazione della ABR ipsilaterally registrata (ad esempio, registrato tra il vertice e mastoide ipsilaterale. simulato dalla registrazione di due canali con la registrazione controlaterale intesa come la stima di vertice pick-up e la derivazione trasversale, intesa come la stima del pickup mastoide.)
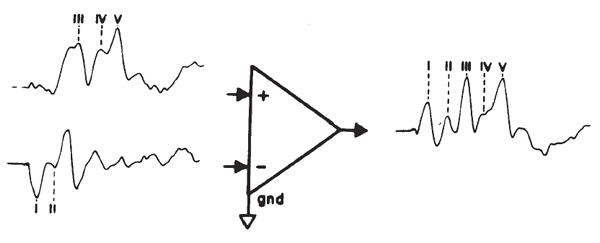
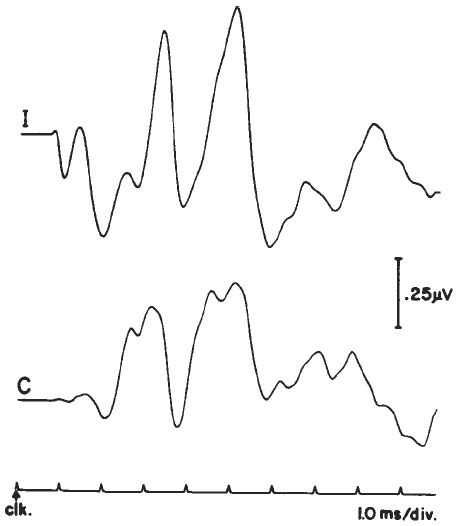
Sistemi di test EP con due o più canali consentono la registrazione simultanea da più montaggi.Per scopi clinici, un montaggio di registrazione controlaterale è usato frequentemente. Gli ingressi vertex / fronte sono legati tra loro e gli elettrodi di ogni lobo dell’orecchio / mastoide sono collegati singolarmente a ciascun canale. Come mostrato in Figura 10 , Onda I è assente o sostanzialmente attenuato nella registrazione controlaterale, anche se la deflessione negativa seguente Onda I può rimanere prominente intensità elevate. L’ampiezza differenze diminuiscono per ondate successive, leggere differenze di latenza può essere visto, rispetto al ABR ipsilaterally registrato (ad esempio, vedere dati di Creel, Garber, Re, e Witkop 1980 ). Onda V registrata controlaterale può essere fino a 0,2 ms entro la ipsilaterally registrato Onda V. Una applicazione di registrazioni controlaterali è in casi in cui il complesso IVN è fuso nella registrazione omolaterale ( Figura 10 ); Waves IV e V sono generalmente separati nella registrazione controlaterale ( Stockard, Stockard, e Sharbrough 1978 ).
Figura 10 . omolaterale (I) rispetto controlaterali (C) registrazioni del ABR.
Effetti differenziali di livello del tronco encefalico patologia sui ABRs registrati contra-versus ipsilaterally sono stati suggeriti ( Hashimoto, Ishiyama, e Tozuka, 1979 ), ma una certa cautela è necessaria nell’interpretazione delle risposte registrate in queste condizioni. Tali registrazioni non forniscono opinioni indipendenti dei due lati del tronco encefalico. Al massimo, un certo grado di unilateralità sembra probabile solo per Waves I-III, che rappresenta l’attività dall’ottavo nervo e, molto probabilmente, i nuclei cocleari ( Durrant, Shelhamer, Fria, e Ronis, 1981 ). Centrale, i generatori delle risposte sono troppo vicini per essere risolti facilmente nelle registrazioni di campo lontano. Un altro uso di registrazioni a due canali è prendere la differenza tra i canali (vedereFigura 11 ). Questo metodo dà la derivazione trasversale, che produce gli stessi risultati di registrazione differenziale tra i lobi delle orecchie / mastoidi. Anche se sottolinea la ripresa di nervi e bassa del tronco cerebrale potenziali uditivi ( Durrant, Shelhamer, Fria & Ronis, 1981 ), questa derivazione non è un sostituto per ECochG perché in realtà fa ben poco per migliorare l’SNR Wave I, che è il problema principale con registrazione dell’onda I ( Durrant, 1986 ).
Variabili di registrazione
Impostazioni dei filtri
La linea di fondo è di mantenere le frequenze basse in quanto possibile. Se è possibile utilizzare un’impostazione passa alto 30 Hz, quindi di includere tutti ABR energia del bambino. Se dovete andare fino a 75 Hz o 100 Hz, farlo, ma essere consapevoli che si hanno maggiori probabilità di filtrare alcune ABR di un neonato più giovane. La fine passa-basso del filtro può essere 2000 o 3000 Hz, a seconda di come peaky voi i vostri ABRs. Mi piace cime aguzze, ma forse non lo faccio.
Non usare il filtro notch. Che rimuove l’energia nella regione di 60 Hz, ma anche sopra e sotto. Il filtro notch prende una grossa fetta di energia ABR dalla risposta del bambino prima ancora di provare a registrarlo.
Filtro larghezza. La larghezza di banda del filtro per il ABR viene scelta per evitare effetti di aliasing sul segnale registrato e rifiutare rumore fisiche e fisiologiche cadere fuori dello spettro del ABR. Per soggetti normali, i potenziali indotti da stimoli ad alta intensità sono composti di frequenze comprese tra 50 e 1000 Hz ( Kevanishvili & Aponchenko 1979 ), ma, come l’intensità degli stimoli abbia diminuisce, i potenziali possono essere costituiti da componenti a frequenza inferiore ( Elberling , 1979a ). Aumentare il cutoff di un filtro analogico passa alto stabilizza la linea di base, ma anche diminuire le latenze delle onde componenti e diminuisce le loro ampiezze (vedi dati analogici in Figura 12 ). Risposte anomale possono anche essere composti da frequenze inferiori sono reazioni normali, quindi non c’è impostazione ugualmente applicabile in tutte le situazioni un filtro. Pratiche attuali suggeriscono che la frequenza di taglio filtro passa alto (cioè, 3 dB punti) non deve superare i 100 Hz per filtri passivi singolo stadio (cioè, 6 dB / ottava rolloffs). Il taglio dovrebbe essere abbassato quando si utilizzano filtri con pendenze più ripide, quando si misurano le risposte dai bambini, e quando vengono utilizzati stimoli a bassa frequenza. Il cutoff anche dovrebbe essere abbassata e l’epoca campionamento esteso a 20 ms quando si registra risposte a stimoli a bassa frequenza perché il contenuto di bassa frequenza del ABR è relativamente maggiore che nel caso di stimoli ad alta frequenza o clic ( Suzuki & Horiuchi, 1977 ).
Figura 11 . Effetti analogico (X) rispetto digitale (O) filtraggio sul ABR. Impostazioni dei filtri analogici sono per un amplificatore di registrazione Grass (cioè, tagli a metà tensione di un filtro passivo con le impostazioni iniziali di 30-3000 Hz). Da Effetti della Analogico e filtraggio digitale su Brainstem Potenziali evocati uditivi da JR Boston e PJ Ainslie,  1980 Elettroencefalografia e Neurofisiologia Clinica , 48 , p. 362 .Copyright 1980 da Elsevier Scientific Publishers. Ristampato con il permesso.
1980 Elettroencefalografia e Neurofisiologia Clinica , 48 , p. 362 .Copyright 1980 da Elsevier Scientific Publishers. Ristampato con il permesso.
Ridurre il taglio passa basso di un filtro analogico leviga le risposte ma potrebbe aumentare le latenze (vedi dati analogici in Figura 12 ). Di conseguenza, frequenze di taglio inferiore a 1600 Hz sono raramente utilizzati, con 3000 Hz che rappresenta una tipica frequenza di taglio.
Frequenza di campionamento è importante perché determina la risoluzione temporale della forma d’onda e, insieme al numero di punti campionati, la durata dell’epoca registrato. In tutta la gamma di intensità, la ABR click-suscitato è generalmente contenuta entro una finestra di tempo di 10 ms (vedi figure 12 e 13 ). Con questa finestra e 256 punti di dati, ci saranno 40 ms risoluzione temporale (tempo di sosta), che è più che sufficiente, anche se le finestre fino a 20 ms (risoluzione 80 ms con 256 punti di dati) sono adeguati per lavoro ABR. Queste finestre temporali più lunghi sono necessari per la valutazione delle soglie ABR, soprattutto per gli stimoli a bassa frequenza, a causa delle lunghe latenze di onda V in queste condizioni. In generale, le finestre sono più consigliati per le valutazioni audiologiche in modo che la risposta desiderata può rientrare entro i tempi dell’analisi.
|
Fig. 12 |
|
|
Derivazione monolaterale e bilaterale.
Gli strumenti che dispongono di due canali di acquisizione consentono di registrare la risposta ABR da due derivazioni’ vertice-mastoide ipsilaterale all’orecchio stimolato e vertice-mastoide controlaterale all’orecchio stimolato L’utilizzo ditale metodica non ha un evidente vantaggio clinico. Nel tracciato derivato controlateralmente le onde I e Il risultano molto attenuate, data la maggior distanza dell’elettrodo mastoideo rispetto alle sedi di generazione (Fig 14)

Fig. 14
Evitare potenziali di origine muscolare
Usando stimoli di elevata intensità (90-80 dB nHL) è spesso possibile osservare un potenziale di ampiezza elevata ad una latenza di circa 11-14 ms. Tale componente non è di origine neurale, ma muscolare, Si ritiene che essa sia causata dalla contrazione riflessa dei muscoli retroauricolari, Se la sua ampiezza è molto elevata e se la strumentazione scala automaticamente il tracciato, le componenti dell’ABR che la precedono possono essere difficilmente identificabili. Per evitare di registrare la componente muscolare (PAM) si suggerisce di allontanare l’elettrodo dal solco retroauricolare, spostandolo in basso sul muscolo sternocleido-mastoideo, a 1-2 cm al di soffo dell’eminenza mastoidea, Un altro accorgimento può essere di limitare la finestra d’analisi a 10 ms Nella Fig.15a sono riportati i tracciati ABR offenuti simultaneamente da una derivazione retroauricolare (presenza di potenziale miogenico) e da una derivazione sotto-mastoidea

Fig.15a
ABR 5.3) Variabili extrauditive del soggetto
I più importanti fattori di variazione della morfologia e dei parametri dell’ABR riguardano a funzionalità del recettore e della via uditivo tronco-encefalico. Questi saranno trattati nel capitolo successivo Qui verranno considerati alcuni fattori che indipendentemente dalla funzionalità uditivo, vanno considerati come potenziali fonti di variazione della risposta
Età
Le principali modificazioni dell’ABR sicuramente età-correlate si possono osservare nella prima infanzia Tali modificazioni sono espressione della progressiva maturazione della via uditiva tronco-encefalica. che ha luogo fino all’età di 18-36 mesi. Studi condotti su popolazioni di neonati pretermine, a termine e su bambini osservati longitudinalmente fino ai 2-3 anni di età hanno permesso di misurare nel tempo le variazioni di latenza delle componenti dell’ABR (Fig.15b). Alla nascita le latenze assolute delle componenti ABR sono maggiori di quelle dell’adulto. Inoltre le componenti I, Il. III possono essere poco definite, Il dato di maggior rilevanza clinica è costituito dall’intervallo l-V Ad un’età concezionale di 24 settimane (neonati pretermine) è di circa 8 ms e raggiunge i valori tipici dell’adulto (4 ms) attorno a 18-24 mesi. Questa variazione, definita anche come “traiettoria di maturazione”, riflette la progressiva mielinizzazione ed organizzazione della via uditiva. E’ importante conoscere i dati normali dell’evoluzione di questo parametro per poter individuare i casi con ritardo di maturazione o con patologie centrali di altra natura. La Fig.15c riporta le variazioni di latenza in funzione dell’età concezionale, per le onde I e V, e per l’intervallo l-V Si può osservare che anche l’ampiezza della deviazione standard è più ampia rispetto ai valori tipici dell’adulto

Fig.15b
Nei soggetti di età superiore a 60-65 anni I’ABR può mostrare qualche variazione rispetto alle risposte di riferimento dell’adulto. Le componenti sono di minor ampiezza e l’intervallo l-V può risultare lievemente aumentato Il significato ditali risultati non è ben chiaro, infatti una popolazione geriatrica comprende quasi sempre una proporzione relativamente elevata di individui con sordità neurosensoriale (presbiacusia) e questo aspetto rende difficile attribuire le caratteristiche dell’ABR alla disfunzione della periferia uditiva piuttosto che della via uditiva centrale. D’altra parte l’invecchiamento modifica in qualche misura anche i meccanismi di trasduzione neurale, pertanto è verosimile che I’ABR nell’anziano rifletta una condizione diversa da quella del giovane, nella quale interagiscono gli effetti dovuti al danno recettoriale e al danno centrale.

Fig.15c
Sesso- Misure cefaliche
Negli adulti di sesso femminile l’ampiezza dell’ ABR è superiore e le latenze delle onde III-V ed i relativi intervalli interpicco (I-III, I-V) risultano lievemente inferiori (0,1- 0,2 ms) rispetto ai maschi. L’origine ditali differenze è incerta. Forse dipendono da fattori ormonali, dal momento che esse non sono osservabili in età pre-puberale e dopo la menopausa Un altro fattore chiamato in causa riguarda le dimensioni cefaliche’ i minori intervalli inter-onda potrebbero dipendere dal minor diametro cefalico nelle femmine E’ tuttavia da rilevare che, nell’uso clinico, l’entità delle variazioni dell’ABR dipendenti dal sesso, non ha mai reso necessario il ricorso a normative di riferimento separate per maschi e femmine.
Temperatura
La temperatura corporea modifica significativamente le latenze e ditale effetto è importante tener conto in alcune applicazioni dell’ABR (terapia intensiva. monitoraggio intra-operatorio) L’ipotermia determina un aumento delle latenze, in particolare l’intervallo l-V cii di sotto di 35°C, aumenta di circa 0,16 ms/grado L’ipertermia ha un effetto opposto, determinando una riduzione delle latenze per temperature corporee di oltre 38°C (Fig.15d.) Variazione della latenza delle onde in rapporto alla temperatura corporea- cavia)

Fig.15d
Sonno-veglia-attenzione
L’ABR non subisce modificazioni in relazione ai diversi gradi di vigilanza o agli stadi del sonno naturale o indotto. La sedazione ed il sonno sono condizioni che facilitano la registrazione dell’ABR, in quanto eliminano gran parte degli artefatti dovuti alla tensione muscolare e ai movimenti che possono peggiorare il rapporto segnale/rumore
Farmaci
L’ABR è particolarmente resistente all’azione dei farmaci del s n.c Ciò permette di poterlo registrare in condizioni di sedazione, di anestesia e di intossicazione da farmaci del s n c In quest’ultima condizione, caratterizzata da un’importane depressione dell’attività cerebrale, il riscontro di un ABR normale esclude una errata diagnosi di morte cerebrale
In breve: quasi tuffi i sedativi del snc, gli anestetici, i neuroleffici non hanno apprezzabili effetti sui parametri dell’ABR. Per alcuni anestetici come l’enfluorano (isomero del fluorano), l’alotano, la lidocaina è stato segnalato un aumento di latenza dell’onda V e dell’intervallo I-V
ABR 5.4) Misura e Analisi del Periodo
Misurazione e analisi possono essere fonte di confusione per alcune persone. Ho intenzione di rendere semplice. Dobbiamo fare di taratura secondaria di stimoli per stimoli ABR perché sono così brevi che la maggior parte di noi non può usare i nostri fonometri economici per calibrarlo. A differenza di toni puri e audiometria vocale, non siamo in genere l’esecuzione di misure ABR in una stanza del suono trattata dove il rumore ambientale soddisfa determinati standard. Stiamo facendo di loro in una stanza clinica regolare.Si può andare al vivaio di terapia intensiva. Si può andare in sala operatoria. Potremmo andare nella stanza di un paziente. Potremmo essere off-site. Abbiamo bisogno di raccogliere i nostri dati normativi su un piccolo numero di adulti normali acustici. Sistemi ABR moderni sono molto stabili. Una volta che avete fatto questo per il vostro sistema, non dovete farlo su base regolare. Guardate come più di una verifica sistematica biologica, prima si inizia a usare il sistema.
In primo luogo, trovare 3-5 adulti con soglie uditive di 10 dB o meglio fuori a 8000 Hz e OAE normali. Assicurati di ricordare i loro nomi in modo da potete farli tornare, se mai hai bisogno di farlo di nuovo. Trova le soglie comportamentali per l’aria e l’osso-conduzione click, 500, 1000, 2000 e 4000 Hz. Eseguire questo nella vostra clinica nella stanza dove hai intenzione di fare il ABR. È necessario conoscere le soglie comportamentali più bassi per quelle raffiche di tono. Non possiamo aspettarci di registrare un ABR sotto dove la persona normale udito percepisce appena gli stimoli.
Il valore medio sullo schermo del vostro equipaggiamento per la loro soglia comportamento diventa 0 dB NHL. Ad esempio, la persona media normale udito può solo sentire il tono di 500 Hz scoppiò comportamentale a 20 dB, 20 dB così sullo schermo diventa 0 dB NHL, 40 dB sullo schermo è 20 dB NHL e poi da lì. Non eseguire questa correlazione in una cabina del suono e poi uscire e testare il paziente altrove.
Vi è un altro valore che avete bisogno di pensare. La soglia ABR genere non si verifica alla soglia comportamentale. Lo stimolo deve essere un po ‘al di sopra della soglia comportamentale per attivare i neuroni e rilevare la risposta a distanza con l’elettrodo sul cuoio capelluto. Quando si sta registrando un ABR, si traccia il ABR onda V fino al livello più basso possibile, e poi scompare. Ad esempio, diciamo che la risposta non era lì a 15 dB, ma ha cominciato ad emergere a 20 dB. Che non è la soglia comportamentale. La soglia comportamentale sarà un po ‘meglio. Vi è una certa discussione e il dibattito su esattamente quanto è necessario sottrarre dalla soglia ABR per stimare il livello dell’udito. A volte viene chiamato EDB HL (stimato dB HL), gli inglesi usano un’espressione un po ‘diverso, ma è tutto lo stesso. Se si utilizza un fattore di correzione di 10 dB per tutti gli stimoli, tra cui click, non sarà lontano. Si potrebbe scoprire che alcune persone non usano alcuna correzione per un clic, perché il click è così grande, ma usano 10 dB per tutti i burst di tono. Vi è abbondanza di informazioni nella letteratura su questo. Io vi consiglio di parlare con alcuni colleghi e venire con il proprio piano. Molte persone sottrarre 15 dB per l’intensità di soglia ABR stimare dB HL a 500 Hz, e 10 dB per il resto dei burst di tono. È quindi possibile tracciare le soglie uditive in una forma che assomiglia a un audiogramma. Tracciare le soglie ABR e poi mostrare il HL dB stimato.
La figura 16 fornisce una rapida ripartizione dei fattori di correzione in base ai diversi ricercatori (Bagatto, Moodie, Scollie, Seewald, Moodie, et al, 2005;. Hall, 2007). Questo è quanto si potrebbe sottrarre dalla soglia ABR per stimare il livello dell’udito.
![]()
Figura 16. Fattori di correzione applicati alle soglie ABR dal tono di frequenza raffica di stimare il livello dell’udito. BCEHP = British Columbia Programma precoce dell’udito.
Questo è l’ultimo passo.Hai trovato il livello di intensità più bassa che produce un’onda V, e ora si vuole stimare la soglia audiogramma. Questi sono i valori che si utilizza. David Stapells, così come molti altri in studi replicati (Stapells & Oates, 1997), ha chiaramente dimostrato che la soglia comportamentale in dB è altamente correlata con soglia ABR in dB. Questo funziona. Questa è la prova più importante a sostegno di utilizzo ABR per stimare le soglie uditive per apparecchi acustici montaggio, e la correlazione è stabile.
ABR 5.5) Chirps
Ci sono prove molto importante che cinguettii hanno valore. Non sto suggerendo eliminiamo lo scoppio tono. Penso clic e scoppia tono sono i cavalli di lavoro per ABR, ma c’è sicuramente un ruolo per il frinire, e la prova sta montando molto rapidamente. Se non avete sentito il cinguettio, suona come il cinguettio degli uccelli.
Anche in questo caso, quando si stimola la coclea con un click, si sta attivando l’intero coclea dalla base all’apice. Il problema è che l’ABR è generato principalmente dai neuroni della regione basale. Quando si utilizza una raffica di tono, si sta attivando una gamma relativamente ampia della coclea, ma solo la prima parte della squillo sta producendo la risposta. Gran parte dell’energia nello stimolo è sprecato. Con il cinguettio, stiamo dando l’energia a bassa frequenza un inizio testa che si muove verso l’apice della coclea.Che tende a spostare l’onda V, che di solito è in ritardo per le frequenze più basse. Dà l’onda V la possibilità di essere prodotto cinque millisecondi prima di quanto farebbe normalmente. Onda V per 500 Hz viene prodotta intorno allo stesso tempo come onda V per altre frequenze, perché lo stesso processo viene utilizzato per altre frequenze. Onda V per il 2000 Hz inizia 1-2 millisecondi prima, 500 Hz inizia 5 millisecondi prima, e 4000 Hz inizia circa 1 millisecondo in precedenza. Il click è istantanea. Finiamo impilare le risposte onda V, risultando in un più ampio V. onda Tutta la coclea sta contribuendo al Chirp fare clic su ABR.
È importante notare che il chirp è stato progettato per l’utilizzo a basse intensità. Alle alte intensità, ci sono fattori meccanici quando stimolando la coclea che rendono il cinguettio anche peggio lo stimolo tradizionale. La figura 3 mostra i tracciati di clic e Chirp stimolo. Nota la forma d’onda prodotta da una alta intensità click in alto. C’è una buona morfologia con onde ben formate I, latenze III e V. Interwave sono normali.
![]()
Figura 17. Confronto tra un cinguettio click stimolo rispetto ad un tradizionale click.
Poi, ho lasciato cadere giù a 45 dBnHL click (Figura 16). Ho registrato una bella onda V, e la latenza spostato su come ci si aspetterebbe 85-45 dB. Io non replicare. Una volta che sono abbastanza fiducioso c’è una risposta, non replicare come diminuire l’intensità. Ho diminuito di nuovo a 25 dB per un tradizionale scatto e vedo una bella onda V; è rintracciare splendidamente. Scendo a 20 dB, e la risposta è ancora lì, ma è sempre più piccolo. Tutti i piccoli dossi che vedete a 20 dB sono rumori di fondo. Questo è probabilmente circa ad un rapporto di 2:1 segnale-rumore, dove la risposta è appena lì sopra del rumore. Si può sempre replicare per dimostrarlo.
Poi ho provato con il cinguettio di aiutarmi a dimostrare che si trattava di una risposta. Potete vedere il 20 dBnHL cinguettare sotto i 20 dB click (Figura 18), ed è bellissimo. Non c’è dubbio che il 20 dB è la risposta. Ho fatto decremento di 15 dB sia per il click e il cinguettio, e le risposte scomparso. In questo caso, il cinguettio mi ha fatto molto fiducioso che la soglia di questo bambino per lo scatto è di 20 dBnHL.
La figura 18 illustra lo stesso concetto, ma con un tono Hz scoppio 4000. Tutto inizia lo stesso, ma diventa molto piccola molto rapidamente. Sono andato a 25 dB con le raffiche toni tradizionali e non c’è alcuna risposta e nulla che replica. Questo è tutto rumore di fondo. Sono andato a 30 dB con il frinire, ed è bellissimo. Poi sono andato giù a 25 dB per il frinire, ed era perfettamente ripetibile. Sulla base di quanto abbiamo già imparato, se vi è un ABR a 25 dB a 4000 Hz, è probabile che la soglia dell’udito è probabilmente di circa 15 dB, che è normale. Io normalmente non andare più in basso perché sono interessati a ottenere informazioni per altre frequenze. In questo caso (figura 3), ero record grado 5 dB al di sotto della soglia, da 30 dB a 25 dB, utilizzando il chirp. Questo è un altro vantaggio del Chirp, ed è dovuto al fatto più della coclea è attivata e le ampiezze sono più grandi in modo che possiate vederle.
![]()
Figura 18. Confronto tra 4000 Hz tono scoppiò a 4000 Hz cinguettii.
Mi fermavo la media ogni volta che vedo una risposta chiara. La figura 3 mostra un buon esempio di questo quando si usa cinguettii. Sto usando un tasso di stimolo di 37.7/sec, quindi non sta prendendo molto a lungo. In ogni tracciato, ognuno di voi potrebbe facilmente identificare onda V. E ‘proprio dove dovrebbe essere. Io probabilmente replicare l’intensità più bassa (15 dB), ma il tempo totale inferiore a 3000 scansioni ero poco più di un minuto per tutto questo. Si può ovviamente variare questo. Si potrebbe replicare intensità inferiore o scendere ulteriormente per trovare la risposta. In breve, questo è un modo per ottenere tutte le informazioni necessarie per tutte le frequenze in entrambe le orecchie in un ragionevole lasso di tempo. Il cinguettio ha valore.
Quando abbiamo finito con quello, noi tracciamo le soglie ABR. Poi stimiamo le soglie comportamentali. Queste stime sono quello che si usa per decidere se o non avete bisogno di amplificazione.
Uno studio internazionale pubblicato l’anno scorso (Gøtsche-Rasmussen, Poulsen e Elberling, 2012) ha mostrato che le ampiezze sono gli stessi per bande di ottava chirp e scoppia toni normali. Givens e Stuart alla East Carolina University hanno dimostrato che lo spettro per il burst tradizionale tono e lo spettro per il chirp è lo stesso. Le informazioni che stiamo ottenendo dagli stimoli chirp è equivalente le informazioni per scoppi di tono, tranne l’ampiezza è maggiore per i cinguettii. Stangl, Rentmeester e Hood (2013) hanno presentato i dati che l’ampiezza di cinguettii è maggiore di entrambi i clic e scoppia di tono, tutta la strada fino alla più bassa intensità. Io sono un credente in cinguettii.
Vorrei sottolineare che le forme d’onda di burst di tono sono più arrotondata rispetto scatti. Si perderà onda io come ci si sposta alle basse frequenze, e le latenze si sposterà fuori, che è associato con il tempo di viaggio. Riconoscere questi cambiamenti vi aiuterà utilizzano il ABR nella stima soglia. Sempre confrontare le latenze delle forme d’onda a diverse intensità e guardare l’intero ABR in tale contesto. Questo è il modo in cui si può tranquillamente identificare le soglie a livelli bassi, che è molto importante.
ABR 6 )APPLICAZIONI CLINICHE DELLA RISPOSTA UDITIVA DEL TRONCO
ABR 6 .1) Stima della Soglia Uditiva
Gli ABR Sono utilizzati per ricerca della soglia anche quando ci si trova davanti a pazienti non collaboranti, la risposta è affidabile e attendibile con sostanziale assenza di falsi negativi, permettono di rilevare l’indice di soglia, ossia la onda V sino a circa 20/30 dB HL. Le frequenze testate sono concentrate sui 2 e 4 KHz, infatti lo stimolo utilizzato è il click che possiede questo range frequenziale
ABR 6 .2)Risposta Uditiva del Tronco nella Valutazione Otoneurologica
L’identificazione della patologia retrococleare
Risposta uditivi del tronco encefalico (ABR) audiometria è considerato un efficace strumento di screening per la valutazione di sospetta patologia retrococleare come un neuroma acustico o schwannoma vestibolare. Tuttavia, un ABR anomalo trovare suggestivo di patologia retrococleare indica la necessità di RM del ponto-cerebellare.
I sintomi della patologia ottavo nervo
I sintomi clinici possono includere, ma non sono limitati a quanto segue:
· perdita dell’udito neurosensoriale asimmetrica o unilaterale
· Perdita dell’udito asimmetrico alle alte frequenza
· Acufene unilaterale
· Audiometria vocale con scarsa intelligibilità vocale, con parole bisillabiche, rispetto al grado di perdita dell’udito neurosensoriale(dissociazione verbo tonale)
· Distorsione ai suoni quando l’audiometria tonale è sostanzialmente normale
Valutazione della risposta uditivi del tronco encefalico
Oltre alle patologie retrococleare, molti fattori possono influenzare i risultati dell’ABR, compreso il grado di perdita dell’udito neurosensoriale, l’asimmetria della perdita ‘uditiva, parametri di prova, e di altri fattori paziente. Queste fattori devono essere presi in considerazione durante l’esecuzione e l’analisi di un risultato ABR.
Giudizio suggestivi di patologia retrococleare possono includere qualsiasi di uno o più dei seguenti elementi:
· Latenza assoluta interaurale differenza V onda (IT5) – prolungata
· inter picco, intervallo differenza interaurale I-V- prolungata
· Latenza assoluta dell’onda V – prolungata rispetto ai dati normativi
· Latenze assolute e intervalli inter picco latenze I-III, I-V, III-V – prolungate rispetto ai dati normativi
· Risposta tronco cerebrale uditivo assente nell’orecchio coinvolto
In generale, l’ABR presenta una sensibilità superiore al 90% e una specificità di circa il 70-90%.
La sensibilità per i piccoli tumori non è così elevata. Per questo motivo, un paziente sintomatico con un risultato normale ABR dovrebbe ricevere un audiogramma di follow-up in 6 mesi per monitorare eventuali variazioni di sensibilità o dell’acufene. L’ABR può essere ripetuto se indicato. In alternativa, la risonanza magnetica con gadolinio, che è diventato il nuovo criterio standard, può essere utilizzato per identificare schwannoma vestibolare .molto piccoli (3 mm)
La sensibilità ABR nella diagnosi di tumori VIII NC per dimensione secondo vari studi è la seguente:
· In uno studio 1994 da Dornhoffer, Helms, e Hoehmann, la sensibilità è stata del 93% per i tumori inferiore a 1 cm. [1]
· Nel 1997, Zappia, O’Connor, Wiet, e Dinces riportato una sensibilità del 89% per i piccoli tumori di dimensioni inferiori a 1 cm, il 98% per i tumori medie 1,1-2 cm, e il 100% per i tumori di dimensioni superiori a 2 cm. La sensibilità complessiva è stata del 95%. [2]
· In uno studio del 1995, Chandrasekhar, Brackmann, e Devgan riportato una sensibilità del 83,1% per i tumori inferiori ad 1 cm e una sensibilità del 100% per i tumori più grandi di 3 cm. Sensibilità complessiva è stata del 92%. [3]
· Nel 1995, Gordon e Cohen riportati i seguenti sensibilità: 69% per i tumori più piccoli di 9 mm, 89% per i tumori 1-1,5 cm, 86% per i tumori 1.6-2 cm, e 100% per i tumori più grandi di 2 cm. [4 ]
· In un rapporto del 2001 da Schmidt, Sataloff, Newman, Spiegel, e Myers, la sensibilità è stata del 58% per i tumori più piccoli di 1 cm, 94% per i tumori 1,1-1,5 cm, e il 100% per i tumori di dimensioni superiori a 1,5 cm. La sensibilità complessiva è stata del 90%. [5]
· In un ampio studio prospettico che rispetto ABR con un contrasto-enhanced MRI (criterio standard) in 312 pazienti con asimmetrica perdita dell’udito neurosensoriale, Cueva scoperto che aprile ha prodotto una sensibilità e una specificità del 71% e 74%, rispettivamente, nel rivelare la causa del Le lesioni per senso asimmetrico e perdita dell’udito orale (compresi, ma non limitatamente a, schwannoma vestibolare). Il valore predittivo ABR-positivo è stato solo del 23%, mentre il valore predittivo negativo era del 96%. Sette dei 31 casi positivi hanno avuto altre lesioni che ABR non poteva identificare come causa della perdita dell’udito. [6]
Sebbene le misure tradizionali ABR diminuzione della sensibilità come fattore di dimensione del tumore, studi recenti hanno dimostrato che utilizzando un nuovo impilati ABR derivato bande che misura l’ampiezza, molto piccoli tumori possono essere rilevati con maggiore precisione. Questa nuova tecnica, in combinazione con la tradizionale audiometria ABR, potrebbe presto rendere possibile l’individuazione di tumori molto piccoli con una precisione che si avvicina al 100% con ABR audiometria.
Altre applicazioni di risposta del tronco cerebrale uditivo
Altre applicazioni di ABR continuano a evolversi. Recenti ricerche suggeriscono che, sebbene le latenze globali dell’onda ABR siono entro i limiti normali nei pazienti con acufeni, questi pazienti hanno latenze più lunghe rispetto ai pazienti di controllo senza acufene. [7] Ciò suggerisce che l’ABR può essere utile nel monitoraggio e comprensione dell’acufene .L’ ABR è stato utilizzato anche per la prognosi nei pazienti in coma. I ricercatori hanno trovato che i pazienti con una scala di Glasgow di coma di 3° e che hanno anche un ABR significativamente anomalo hanno avuto una maggiore probabilità di morire rispetto a quelli con un normale ABR [8](vedere la Glasgow Coma Scale calcolatrice).
ABR 6 .3)Auditory risposta Brainstem in Chirurgia Monitoraggio intraoperatorio
Monitoraggio intraoperatorio
Risposta uditiva del tronco encefalico (ABR), spesso usato durante l’intervento con elettrococleografia, fornisce l’identificazione precoce dei cambiamenti dello stato neurofisiologico del sistema nervoso centrale e periferico. Questa informazione è utile nella prevenzione di disfunzione neurotologic e la conservazione della perdita uditiva postoperatoria. Per molti pazienti con tumori di CN VIII o ponto-cerebellare, l’udito può essere ridotta o completamente perso dopo l’intervento, anche quando il nervo uditivo è stato conservato anatomicamente.
Valutazione della risposta uditivi del tronco encefalico
L’Onda I, che è generata dalla fine dell’ VIII nervo cocleare ’, fornisce preziose informazioni in tempo reale riguardo al flusso di sangue alla coclea. Poiché l’ ischemia è una delle cause primarie di perdita dell’udito correlata alla chirurgia , viene monitorata da vicino per qualsiasi spostamento di latenza o diminuzione di ampiezza.
Intervalli inter picco onda I-II e I-III possono fornire informazioni prossimali e distali durante interventi chirurgici sull’VIII nervo cocleare
Onda V e l’intervallo latenze inter picco I-V vengono monitorati per turni o alterazioni nella latenza e ampiezza. La latenza I-V fornisce informazioni per quanto riguarda l’integrità del VIII nel tronco cerebrale .
Limitazioni
Alterazioni dell’onda V che si verificano durante l’intervento non riflettono necessariamente cambiamenti della funzionalità uditiva . Le variazioni di latenza possono essere invece causati da desincronizzazione dei neuroni o da altri fattori esterni. Inoltre, esiste un potenziale ritardo tra l’effettivo verificarsi dell’ insulto e quando appare lo spostamento della V onda. I pazienti con preesistente perdita neurosensoriale dell’udito possono avere una scarsa morfologia della forma d’onda e nessuna risposta o.
Gli usi tipici di intraoperatoria risposta uditivi del tronco encefalico
Controllo della funzione cocleare diretta a preservazione dell’udito
· Ponto-cerebellare resezione del tumore (chirurgia neuroma acustico)
· Decompressione vascolare della nevralgia del trigemino
· Sezione del nervo vestibolare per il sollievo di vertigine
- Esplorazione del nervo facciale per la decompressione del nervo facciale
· Endolymphatic decompressione sac per la malattia di Meniere
· Monitoraggio dell’integrità del tronco encefalico
· Resezione del tumore Brainstem
· Brainstem aneurisma ritaglio o la resezione malformazioni arterovenose
ABR 7) FATTORI CHE INFLUENZANO LA RISPOSTA UDITIVA DEL TRONCO
Stato del paziente L’ABR è relativamente influenzato da cambiamenti di stato soggetto, tra cui il sonno naturale e sedato ( Amadeo & Shagass 1973 ; Sohmer, Gafni, e Chisin, 1978 ) e attenzione ( Picton & Hillyard, 1974 ). Di conseguenza, ABRs di soggetti sedati possono essere paragonati alle norme stabilite nei soggetti non sedati ( Stockard, Stockard, e Sharbrough, 1978 ). Per i bambini, ei bambini più grandi e gli adulti che non riescono a rilassarsi, sedazione dovrebbe essere disponibile dopo l’autorizzazione da parte del medico del paziente. Immediata accessibilità alle cure mediche di emergenza è necessaria per affrontare eventuali effetti collaterali spiacevoli.
Anestesia non modifica sostanzialmente le latenze o ampiezze dei potenziali meno che la temperatura interna del corpo si abbassa al di sotto di 33 gradi centigradi, nel qual caso sarà prolungata la latenza dell’onda V. Temperatura ridotta prolunga le latenze assolute e relative di tutte le onde ( Stockard, Sharbrough, e Tinker, 1978 ). L’alcol può anche aumentare la latenza di Wave V, apparentemente a causa di una riduzione indotta a temperatura interna ( Squires, Chu, e Starr, 1978 ).
Età e sesso. cambiamenti affettivo durante primi anni di vita si riflettono nei cambiamenti legati all’età nel ABR. I dati presentati in Figura 18 , sulla base di dati provenienti da neonati ( Cevette, 1984 ), mostrano cambiamenti maturazione in onde III e V attraverso il 18 ° mese. Di conseguenza, le valutazioni ABR nei neonati prematuri e nei neonati richiedono l’uso di norme adeguate all’età e richiedono l’uso di una finestra di analisi più ampio (ad esempio, 15-20 ms) a quello tipicamente utilizzato per adulti (ad esempio 10 ms).
Figura 18 . latenze ABR onda V e latenze interpicco I-V al indicati NHL contro l’età concettuale. Matura concettuali mesi (troppo) sono in realtà 44 settimane (sett) + il numero di mesi indicato. Le barre orizzontali sopra ogni punto dati DeMark latenze che sono 2 deviazioni standard (SD) al di sopra dei mezzi (N = 580 neonati). Da Auditory Brainstem Response Test in Unità di Terapia Intensiva da MJ Cevette, 1984 Seminari in udienza , 5 , p. 62 . Copyright 1984 dal Thieme Medical Publishers. Adattato da permesso.
![]()
Per tutta l’infanzia l’ABR cambia poco, ma in adolescenza, i maschi cominciano a svilupparsi più lunghi tempi di latenza dell’onda V rispetto alle femmine, che da adulta ammonta a una differenza media intersessuale di circa 0,2 ms ( Rowe, 1978 ). Inoltre, le femmine mostrano leggermente più grandi ampiezze dell’onda V di quanto non facciano i maschi ( Jerger & Hall, 1980 ). Così, norme separati sono suggeriti per l’interpretazione della ABR nei maschi contro femmine per scopi diagnostici neurologici. Perché vi è una notevole sovrapposizione tra le distribuzioni delle latenze ABR per i due sessi, tuttavia, alcuna indennità per genere deve essere applicato con giudizio.
Come soggetti adulti di età, ampiezze delle onde può diminuire e la riproducibilità delle risposte potrebbero deteriorarsi. Il consenso delle prove sperimentali dimostrano che latenze assolute di onde I, III, e V sono 0,1-0,2 ms più per i soggetti di età compresa tra 50 anni e di età superiore a quelli di età 20-30 anni. I dati riguardanti l’influenza dell’età sulla latenza interwave non sono conclusivi, ma anche suggeriscono che ci possa essere un prolungamento legata all’età di 0,1-0,2 ms per l’I-V intervallo interpicco ( Chu, 1985 ; Rosenhall, Bjorkman, Pederson, e Kall, 1985 ).Cambiamenti legati all’età possono essere confusi dalla presenza di perdita uditiva sensoriale.L’età e la perdita dell’udito sembrano avere effetti opposti sulla latenza interwave ed effetti simili, ma non additivi sulla latenza assoluta. Quando la soglia a 4000 Hz è di 50 dB HL o meno, la principale determinante di Wave V latenza è l’età. Quando la perdita di udito a 4000 Hz superiore a 50 dB HL, sia l’età e la perdita dell’udito contribuiscono alla latenza prolungamenti, ma il fattore principale è la perdita (ascoltando Hyde, 1985 ). Pertanto, è auspicabile disporre di dati comparativi per gli adulti di età superiore ai 50 anni che non hanno più di una perdita uditiva cocleare lieve a 4000 Hz ( Brewer, 1987 ). Per gli adulti anziani la cui soglia a 4000 Hz supera la gamma di perdita dell’udito lieve, gli effetti dell’invecchiamento e la perdita dell’udito sulla latenza assoluta dovrebbero essere considerati.
Perdita Trasmissiva dell’udito. ipoacusie conduttive causano energia sonora da essere attenuato attraverso l’orecchio esterno o medio. Tali perdite prolungherà le latenze di tutte le onde del ABR dall’effettiva abbassamento del livello di stimolo. La valutazione del ABR è più facile e l’interpretazione più precisa se le lesioni conduttivi sono identificati o risolti prima della ABR viene misurata. Pertanto, l’esame otoscopico, test di impedenza, e l’aria e l’osso di conduzione audiometria sono preziosi per un esame approfondito ABR se lo scopo è per la diagnosi neurologica.
Perdite uditive conduttive prolungare le latenze delle onde, senza che incidono notevolmente il valore di latenza interpicco I-V e causare essenzialmente lo stesso grado di variazione di latenza a tutti i livelli di stimolo ( Fria, 1980 ; Mendelson, salamy, Lenoir, e McKean, 1979 ). Pertanto, la funzione di latenza intensità per un soggetto con una perdita uditiva viene spostato lungo l’asse di intensità, sostanzialmente, l’importo della perdita uditiva ( Figura 19 ). Inoltre, le onde prima onda V possono essere persi, come è generalmente il caso con stimoli di basso livello. Ci sono anche eccezioni alla spostamento parallelo della funzione di latenza intensità, ad esempio in caso di perdite conduttive non piane attraverso frequenza. In questi casi, la funzione di latenza intensità può essere modificata perché la configurazione della perdita dell’udito produce spostamenti nella regione cocleare che dominano la risposta ( Gorga, Reiland, e Beauchaine 1985).
Figura 19 . Esempio degli effetti della patologia conduttivo su latenze di ABR Waves I, III e V. zona Stippled rappresenta ± 2 deviazioni standard di latenze per soggetti normali acustici.
![]()
Diverse correzioni Wave V latenza sono state suggerite per tener conto grado di perdita periferico ( Hyde & Blair 1981 ; Selters & Brackmann 1977 ). In alternativa, i dati di riferimento possono essere raccolti su persone con diversi gradi e configurazioni di perdita dell’udito cocleare. Infine, gli stimoli tono PIP o mascheramento ipsilaterale possono essere usati per limitare la risposta alle aree di risposta equivalenti in soggetti normali e cocleari ridotta ( Eggermont & Don, 1980 ; Kileny, Schlagheck, e Spak, 1986 ). A causa di dati insufficienti confrontando questi metodi, non esiste un metodo chiaro di scelta in questo momento.
ABR 7.3)ABR test nei neonati e bambini
ABRs da neonati differiscono sostanzialmente da quelli ottenuti da adulti. Maturazione del sistema uditivo non è completo al momento della nascita. Di conseguenza, l’ABR subisce cambiamenti significativi primi anni di vita. Tuttavia, ABRs sono stati utilizzati nello screening di neonati prematuri e altri ad alto rischio per identificare la presenza di perdita dell’udito e per determinare la necessità di un intervento. Inoltre, c’è stato interesse a utilizzare i ABR come base per stimare i livelli acustici in pazienti che non producono dati comportamentali adeguati (ad esempio, a causa della grave ritardo mentale). Alcuni fattori che devono essere considerati nella domanda di test ABR ad una popolazione pediatrica sono discussi di seguito.
ABRs nei bambini sono diversi da quelli osservati negli adulti ( Fria, 1980 ; Starr et al, 1977. ).Come mostrato in Figura 20 , la forma d’onda morfologia e latenze di risposta subiscono una varietà di cambiamenti in funzione dell’età. Un riepilogo delle modifiche latenza legate all’età è mostrato in Figura 18 . Latenze onda raggiungo valori degli adulti da 6-24 settimane, mentre latenze di onde III e V non raggiungono i valori degli adulti fino a circa 18 mesi. Per i neonati pretermine, latenze di tutti i componenti sono prolungati rispetto ai neonati a termine. A circa 27-30 settimane di età gestazionale (GA) un basso ABR ampiezza del lungo periodo di latenza può essere registrato. Nelle prossime settimane, la latenza diminuisce rapidamente fino a 35 settimane GA e quindi diminuisce più gradualmente fino al termine (38-40 settimane GA). Inoltre, durante i primi 18 mesi di vita, l’intervallo interpicco onda I-V riduce sistematicamente ( salamy & McKean, 1976 ). Nei neonati pretermine questa latenza interwave può essere fino a 7-8 ms (vale a dire 30 settimane GA) e diminuisce di circa 5,2 ms a termine, in contrasto con i circa 4,0 ms della risposta matura.
Figura 20 . ABR da soggetti di diversa età, come indicato. Dalla Auditory Brainstem Risposta: Contesto e applicazioni cliniche da TJ Fria 1980 , in postnatale sviluppo della vita tronco cerebrale umana A. Salamy e CM McKean, 1976 Elettroencefalografia e Neurofisiologia Clinica , 40 , p. 421 . Copyright 1976 da Elsevier Scientific Publishers. Adattato da permesso.
![]()
L’ABR mostra anche i cambiamenti di maturazione in termini di ampiezze di singoli componenti (salamy, Fenn, e Bronshvag, 1979 ). Onde I e III aumento di ampiezza fino a circa 6 mesi di età cronologica (CA), poi diminuire leggermente fino all’età adulta. Onda V ampiezza aumenta fino ad un valore di picco tra i 24 ei 60 mesi di CA, e quindi diminuisce leggermente fino all’età adulta.
In genere, la soglia di click-evocato ABR onda V mostra effetti poco o niente età-dipendente, almeno per i bambini di 33 settimane di età concezionale ( Gorga, Reiland, Beauchaine, Worthington, e Jesteadt, 1987 ). Quando sono stati utilizzati stimoli specifica frequenza, effetti maturativi variano con frequenza. In generale, è stato dimostrato che quando ABRs sono limitate alla regione basale della coclea, che presentano le maggiori differenze legate all’età soglia e latenze ( Klein, 1984 ; Tè, Klein, e Kramer, 1982 ). Quando le risposte sono limitati a porzioni apicali della coclea, attraverso l’uso di mascheramento o specifici frequenza stimoli, le ABRs da bambini sono simili a ABRs da adulti sia in termini di VDLs e Onda V latenze ( Folsom & Wynne, 1986 ; Klein 1984 ). Di conseguenza, l’interpretazione di studi ABR nei bambini deve essere effettuato alla luce degli stimoli utilizzati per ottenere risposte. Il calendario per lo sviluppo di una matura onda V latenze, utilizzando metà o stimoli a bassa frequenza, è significativamente più breve di quando si utilizza click stimoli ( Teas et al., 1982 ).
La mancata tenere conto delle differenze età-correlate nelle risposte infantili può portare a errori sostanziali nel sentire stima di livello (fino a 30 dB), in particolare se gli stimoli sono pips toni ad alta frequenza ( Klein, 1984 ). Ad esempio, se (sia per la latenza o di rivelazione) sono usati norme adulti, un bambino potrebbe sembrare discostarsi sostanzialmente dalla norma quando, in realtà, le risposte del bambino sono all’interno del range di normalità per il suo / la sua età. Se solo click vengono utilizzati stimoli, soglie di rilevamento di risposta sono relativamente stabili attraverso l’età.
Il rapporto tra ABR e le soglie comportamentali consente accurate previsioni di perdita dell’udito.Questa funzione è utile perché consente la valutazione di pazienti difficili da test che possono essere in grado di fornire risposte volontarie a suonare. Di conseguenza, la perdita dell’udito può essere identificato speditamente permettendo tempestivo (ri) intervento habilitative. Va riconosciuto che ci sono alcuni casi in cui l’ABR può non riflettere accuratamente la sensibilità uditiva, anche se questi casi sono estremamente rari ( Murray, Javel & Watson, 1985 ;Worthington e Peters, 1980 ). La precisione interpretativa della valutazione ABR può essere migliorata quando è combinato con altri dati, come le misure acustiche di impedenza, misure comportamentali audiologici e le informazioni case history.
Anche se è oltre la portata di questo scritto per approfondire i dettagli di strategie e protocolli per la valutazione ABR diretti verso la valutazione uditiva, può essere fornita una breve panoramica della procedura tipica. Una serie di intensità di solito è condotta. Onda V è rintracciato alla VDL, che è generalmente meno di 10 dB della soglia comportamentale, almeno per le frequenze più alte ( Gorga, Reiland, e Beauchaine, 1985 ; Jerger & Mauldin 1978 ). La funzione di latenza intensità può anche essere utile a tali valutazioni ( Cappotti & Martin, 1977 , Gorga, Reiland, e Beauchaine, 1985 , Gorga, Worthington, Reiland, Beauchaine, e Goldgar, 1985 ), ma il VDL viene invocato più pesantemente per la stima soglia. Questa procedura di solito viene ripetuta per ogni orecchio, utilizzando stimoli di diverse frequenze, anche se tali valutazioni possono essere avviate con un semplice clic.
Lattanti e bambini fino a 7 anni di età (o più, se non cooperativi) di solito richiedono una qualche forma di sedazione, al fine di migliorare l’SNR e consentire un tempo sufficiente per completare il test. Sonno naturale è in genere sufficiente per i neonati fino a 6 mesi di età, anche se di solito è sicuro per sedare i bambini più piccoli ( Fria, 1980 ).
Il sedativo più comune utilizzato è cloralio idrato, anche se altri (ad esempio, secobarbitale e un “cocktail” di Demerol, Phenergan e Thorazine) sono spesso utilizzati. È necessario controllo medico dell’amministrazione del sedativo e disponibilità del personale medico per l’intervento di emergenza. La valutazione deve essere coordinato con cautela con i genitori del bambino o tutori modo che il bambino sarà opportunamente sedato al momento della prova. Ad esempio, potrebbe essere utile negare un bambino suo / suo pelo durante il giorno del test. Test ABR deve essere effettuato in maniera efficiente a causa sedazione svanisce rapidamente. E ‘anche importante ricordare che questi sedativi differiscono da anestesia, in modo che la stimolazione necessaria (ad es, eccessiva o brusco movimento del corpo) dovrebbero essere evitati. Infine, in alcuni casi in cui non sedazione qualsiasi forma è successo, anestesia generale può essere l’unica soluzione. In scegliendo di testare in anestesia generale, l’equazione rischio-beneficio deve essere valutato con attenzione. Linee guida per l’uso di sedazione e anestesia generale nei pazienti pediatrici sono state formulate dalla American Academy of Pediatrics ( 1985 ).
Interpretazione Diagnostica della valutazione ABR
Ci sono due usi generali della ABR: stima di soglia e di identificazione delle lesioni nervose ed uditiva del tronco encefalico. Valutazioni Otoneurologically orientate della ABR sono al centro di questa sezione. Diverse variabili precludono la specificazione di una precisa procedura o un metodo per analizzare il ABR. In primo luogo, l’ABR deve essere interpretato nel contesto delle altre informazioni a disposizione, come la storia, i risultati della valutazione audiologica, ei risultati dell’esame fisico. In secondo luogo, il sistema uditivo è complesso, e ogni onda del ABR ha più generatori. In terzo luogo, le lesioni variano nella loro dimensione e posizione. Infine, diverse patologie che causano lesioni allo stesso livello possono avere effetti simili sul ABR (es. tumori acustico e compressione vascolare dell’ottavo nervo). La conseguenza di questi fattori è che non esiste uno schema ABR che è unicamente caratteristica di una determinata patologia, per esempio, tumore acustico contro la compressione vascolare dell’ottavo nervo o sclerosi multipla contro tronco cerebrale infarto. Questo vale per qualsiasi prova audiologic che viene utilizzato per indicare sito di lesione. Vi è, tuttavia, una relazione generale tra il livello di lesione e gli effetti della lesione sulla ABR.
Modelli di Onde. altro approccio alla valutazione ABR è l’uso di un modello per la normale risposta ( Elberling, 1979b ). Il potenziale vantaggio di procedure automatizzate di scoring è quello di aumentare l’oggettività nell’interpretazione ABR. Questo metodo richiede l’istituzione di una risposta modello da un gruppo di soggetti normali udito e confronto dei ABR da singoli pazienti al modello. Tale modello può essere formata la media della risposta dal gruppo normale, e il confronto può essere quantificata calcolando il coefficiente di correlazione tra il modello e l’individuo ABR. Questo approccio è afflitta da difficoltà se l’SNR in ABR in esame non viene mantenuto costante. Si richiede attrezzature e la programmazione per le analisi sofisticate, e ci può essere la necessità di sviluppare modelli appropriati per i pazienti di diverse età, generi e tipi di perdita dell’udito. Nonostante le limitazioni, i potenziali vantaggi di queste tecniche sono evidenti e nuovi algoritmi sono in corso di valutazione (ad esempio Arnold, 1985 , Don, Elberling, e Waring, 1984 ; Elberling & Don, 1987 ).
Assenza di onde. L’assenza di onde a seguito dell’onda che è una forte indicazione di patologia retrococleare ( Figura 21b ). D’altra parte, l’assenza di onde prima V può derivare da patologia cocleare, età avanzata, elevati livelli di rumore fisiologici, o alcuni parametri di stimolo. L’assenza di onde a seguito III è una forte indicazione di patologia che colpisce le ponte rostrale e mesencefalo. Onde II e IV tendono ad essere dimostrata meno affidabile e sono di significato diagnostico inferiore Waves I, III e V. L’assegnazione dei numeri d’onda verso le cime del ABR può essere confuso da quello che sembrano essere i componenti aggiuntivi a punta o doppie. L’interpretazione dei risultati ABR può essere migliorata usando prove multiple a diversi livelli di stimolo, diverse polarità stimolo, e due registrazioni dei canali.
![]()
Figura 21. ABRs registrati da pazienti con tumori acustici chirurgicamente confermato. La forma d’onda superiore in ogni pannello è da un orecchio normale. La forma d’onda inferiore (a) mostra l’intervallo I-V prolungato da un paziente con neurinoma dell’acustico. La forma d’onda inferiore (b) mostra l’assenza di onde oltre Wave II da un paziente con un meningioma nel ponto-cerebellare.
Applicazioni cliniche
La registrazione dei potenziali BSER è realizzata al fine di:
— determinare la soglia uditiva con metodica obiettiva (indispensabile nei bambini molto piccoli o comunque non collaboranti e nei simulatori);
— dirimere la sede cocleare o retrococleare di una ipoacusia neurosensoriale(funzione ingresso-uscita della V onda);
— fornire elementi funzionali nella diagnostica di alcune affezioni neurologiche (diagnosi di neurinoma dell’VIII nervo cranico, diagnosi di sclerosi multipla,ECC.).
— Utile infine anche nella prognosi del corna e nella valutazione della maturazione delle strutture del troncoencefalo;
Vantaggi e svantaggi
— È un esame obiettivo con un’ampia ripetibilità intra- ed inter-individuale.
— Non è influenzato dal ritmo sonno-veglia né da farmaci sedativi.
— È un test veloce da effettuare e non invasivo.
Per quanto riguarda gli svantaggi bisogna dire che le onde hanno una piccola ampiezza, per cui possono essere mascherate da potenziali miogeni; è quindi importante che il paziente sia tranquillo ed in posizione comoda; inoltre non possono essere rilevate lesioni più centrali rispetto al collicolo inferiore. Lo svantaggio principale è però quello di non poter valutare la soglia delle basse frequenze, in quanto lo stimolo normalmente utilizzato (click) ha la maggiore rappresentazione sulle frequenze elevate (2000-3000 Hz). A questo svantaggio si può ultimamente ovviare con l’utilizzo dei potenziali ASSR (Auditory Steady-State Responses). Essi permettono una rappresentazione simil-audiometrica della risposta, utilizzando stimoli tonali modulati in ampiezza. La frequenza di modulazione ditali stimoli determina il campo di esplorazione: basse frequenze di modulazione esplorano la corteccia primaria e le aree associative (Fig. 45). Frequenze intermedie attivano generatori posizionati nel troncoencefalo, nel talamo e nella corteccia primaria, mentre alte frequenze di modulazione attivano il tronco, il nervo acustico e la coclea. Bisogna però sottolineare la notevole durata di esecuzione ditale test, che ne impedisce a tutt’oggi l’utilizzo routinario.
|
|
|
Fig. 4. Potenziali del tronco: si noti l’aumento di latenza e la diminuzione d’ampiezza col diminuire dell’intensità di stimolazione (nella figura i dB sono espressi in SPL) e la soglia di evocabilità e di identificazione posizionata fra 20 e 30 dB SPL, corrispondenti approssimativamente a 0 dB di sensazione |
Per determinare la soglia uditiva mediante la registrazione BSER la cadenza di stimoli viene inizialmente inviata ad intensità sufficiente per evocare la comparsa dell’intero pattern BSER.
Successivamente l’intensità viene progressivamente diminuita: si assiste così al progressivo impoverimento e appiattimento del tracciato, fino a che nemmeno l’onda V è più riconoscibile. L’intensità più bassa alla quale si riesce ancora ad isolare l’onda V viene considerata da 10 a 20 db – a seconda dei vari AA – peggiore della soglia uditiva reale.
Siccome vengono impiegati dei clicks la risposta evocata non permette esatte deduzioni sulla curva tonale; d’altronde, siccome il massimo di energia sonora veicolata dai clicks è compreso fra 1000 e 4000 Hz, con un picco attorno ai 1500 Hz, si può ragionevolmente supporre che la soglia BSER con clicks rispecchia la capacità di comprensione della voce umana.
Di recente è stato introdotto l’uso di clicks filtrati, tone bursts e mascheramenti selettivi che permettono l’esame di zone limitate della partizione cocleare.
Per quanto riguarda la diagnosi di neurinoma del n. acustico (VIII n.c.). lo studio delle risposte BSER condotto ad intensità nettamente sopraliminari (65 dB SL o più) consente di ottenere informazioni importanti e precoci.
I parametri da considerare sono:
— latenza dell’onda I e dell’onda V;
— differenza di latenza dell’onda V fra lato sano e lato patologico (ILD V):
se essa è superiore a 0,2 msec. è verosimile che vi sia una patologia del nervo acustico;
— differenza fra l’intervallo I-V del lato sano e del lato patologico (I-V): nel normale esso non deve superare 0,3 msec.
In generale, l’evoluzione schematica degli BSER ottenuti in presenza di un neurinoma del n. acustico in accrescimento è la seguente:
— inizialmente si allungano la latenza dell’onda V e l’intervallo I-V, a causa di un aumento dell’intervallo I-ITT, realizzatosi perchè il potenziale di azione percorre più lentamente il nervo acustico affetto da neurinoma;
— successivamente si realizza una compromissione delle strutture troncoencefaliche, per cui anche l’intervallo III-V si allunga;
— infine tutte le onde successive alla I scompaiono per il sovvertimento delle strutture dell’angolo ponto-cerebellare, fino a che anche l’onda I scompare.
L’esame BSER ha inoltre un ruolo non puramente complementare nella diagnosi di sclerosi a placche, di alcune malattie neurologiche eredo-degenerative, della patologia ischemica vertebro-basilare, nonchè nella definizione dei comi,
In precedenza sono stati citati i potenziali precoci da basse frequenze (FFR) e i potenziali miogeni (PAM e TR).
Si tratta di potenziali evocati che hanno avuto finora una limitata applicazione clinica, poiché i reperti permessi sono di valore inferiore a quelli ottenibili con gli BSER o con gli MLC o con gli SVR.
2) FFR. Gli FFR sono onde con latenza fra i 10 e i 12 msec., originate nel tronco encefalico a seguito di tone bursts a bassa frequenza (500 Hz).
3) Potenziali miogeni. I potenziali miogeni sono onde che esprimono una risposta riflessa dei muscoli che si inseriscono al processo mastoideo, o dei muscoli cervicali posteriori. Tale risposta origina in seguito allo stimolo sonoro, con latenza fra 8 e 30 msec. Naturalmente tale risposta muscolare è modificata dall’anestesia.
ABR 8)UTILITÀ CLINICA
Gli usi più comuni del BAEP sono nella sclerosi multipla (SM) e neuroma acustico. Esso è un test di screening utile, anche se ha alcune limitazioni; risonanza magnetica (MRI) può essere preferibile quando una piccola lesione è allo studio.
Aumento della latenza inter picco I-III indica una lesione da CN VIII al nucleo olivare superiore, mentre un aumento della latenza III-V inter picco suggerisce una lesione dal nucleo olivare superiore al collicolo ipsilaterale inferiore all’orecchio stimolato. Monitoraggio intraoperatorio durante la chirurgia tumorale ponto-cerebellare può essere utile per aiutare il chirurgo preservare il più possibile funzione.
Lesioni Ponto-Cerebellare (Neurinomi del Nervo Acustico)
Il BAEP può essere anormale quando audiometria non riesce a rivelare una lesione. I risultati caratteristici sono aumentati IV e maggiore interpicco I-III latenze ipsilaterale alla lesione. I meningiomi e di altri tumori ponto-cerebellare non possono produrre eventuali anomalie fino a quando non sono grandi abbastanza per essere esternamente compressione.
Malattie demielinizzanti
Una risposta anormale può essere visto con frequenza maggiore nei pazienti sintomatici con malattia demielinizzante. A volte, tuttavia, un test positivo può essere registrato in assenza di sintomi clinici tronco cerebrale.
Emicrania
Zgorzalewicz trovato significativo prolungamento delle onde III e IV in bambini e adolescenti con emicrania, una scoperta che supporta l’idea che il tronco cerebrale contribuisce al meccanismo patologico di emicrania. [27]
Sclerosi Multipla
Valutazione BAEP dovrebbe essere considerato se i sintomi clinici implicano una lesione al di fuori del tronco encefalico. In questo caso, un BAEP anormale sosterrà ulteriormente la diagnosi di SM. Se, tuttavia, il segno clinico (ad esempio, diplopia) punti per il tronco cerebrale, una anomalia BAEP meramente confermativo. In vari studi, circa il 20% dei pazienti testati per una seconda lesione have an BAEP anormale, e circa la metà di questi vanno a sviluppare MS nei prossimi 1-3 anni.
Purves et al hanno riferito che i pattern-turno potenziali evocati visivi (PEV) erano anormali nel 45% dei pazienti senza segni del tronco encefalico, potenziali evocati somatosensoriali (SEP) erano anormali nel 35%, e BAEPs erano anormali nel 14%. [28] Quando l’ 3 modalità sono stati considerati insieme, il 97% dei pazienti con SM definite, l’86% dei pazienti con SM probabili, e il 63% dei pazienti con SM erano possibili risultati anomali su almeno uno di questi test. [28] Risultati simili sono stati riportati da Ferrer et al. [29]
Kjaer ha riportato un tasso del 38% di BAEPs anormali in pazienti con SM con lesioni silenti, mentre il 50% di questi pazienti aveva un VEP anormale e solo il 13% di un SEP anormale. [30] Kjaer ha anche riferito di 22 pazienti con soli sintomi spinali, il 55% dei quale ha mostrato un BAEP anormale. [31]
Chiappa ha rilevato che il BAEP è stato positivo nel 21% dei casi clinicamente insospettabili della SM. [32] Molti autori hanno concluso che le 3 prove, BAEP produce la più piccola percentuale di pazienti, tuttavia, aggiunge ancora il tasso di rilevamento, perché è anormale in un diverso sottoinsieme di pazienti.
Tumore del Tronco Cerebrale
Prolungamento bilaterale di latenza e latenze interpicco può essere visto. Gordon et al ha valutato l’efficacia di ABR come test di screening per i piccoli neurinomi del nervo acustico valutando la sensibilità diagnostica del BAEP in questi tumori.[33] I pazienti con neurinomi del nervo acustico chirurgicamente collaudate sono stati sottoposti a test BAEP preoperatori entro 2 mesi dalla chirurgia. Un risultato è stato considerato anormale se il interaurale onda IV differenza di latenza superato 0,2 msec, la latenza dell’onda V assoluto è stato prolungato in modo anomalo, o la forma d’onda morfologia era anormale o assente.
Dei 105 pazienti, 92 (87.6%) hanno avuto un risultato BAEP anormale, e 13 (12,4%) avevano forme d’onda completamente normali e onda latenze. [33] Dei 18 pazienti che avevano tumori di dimensioni maggiori di 2 cm, 12 avevano tumori 2,5 centimetri o più grandi e 6 avevano tumori tra 2,1 e 2,4 centimetri, tutti i 18 avevano BAEPs anormali. Dei 29 pazienti con tumori tra 1.6 e 2 cm, 25 (86%) avevano BAEPs anormali. Dei 45 pazienti con tumori tra 1 e 1,5 cm, 40 (89%) ha avuto una risposta anormale. Del 13 con tumori 9 millimetri o più piccolo, solo 9 (69%) aveva una anormale constatazione ABR.
Questi dati mostrano che la sensibilità BAEP diminuisce al diminuire delle dimensioni del tumore. [33] Pertanto, scansione MRI è lo studio preferito in questa impostazione poiché la precisione di rilevamento dei tumori più piccoli di 1 cm attraverso test BAEP è del 70%. Tuttavia, gli studi BAEP sono utili nei pazienti che hanno impiantati dispositivi medici (ad esempio, pacemaker ) che impediscono la scansione MRI.
Meningomielocele
Taylor et al hanno studiato BAEP e VEP in 47 bambini con mielomeningocele, nel tentativo di stabilire se potenziali evocati EP riflettere presto lo stato neurologico e se BAEPs e PEV avere un valore prognostico per l’esito neurologico. [34] I bambini, di età compresa tra 1 giorno a 3 mesi, sono stati testati mentre ancora in ospedale dopo la riparazione mielomeningocele.
BAEPs normali si sono riscontrate nel 41% dei pazienti e PEV normali in 62%.BAEPs erano anormali in 9 bambini studiati che avevano sintomatico di Arnold-Chiari; PEV erano anormali in solo il 55% dei bambini sintomatici. PEV non sembra essere abbastanza sensibile per avere un valore prognostico in questi bambini. Tuttavia, BAEPs erano costantemente anormali nei pazienti sintomatici con Arnold-Chiari e ha mostrato un valore predittivo positivo del 88% e una precisione del 84% nel predire centro neurologico sequele.
Corsa Brainstem
La risposta agli studi BAEP è variabile in casi di ictus del tronco encefalico; alcune lesioni provocano latenze anormali, e alcuni non lo fanno (per esempio, BAEP negativo nella sindrome midollare laterale).
Insufficienza respiratoria dopo encefalite
Schwarz et al hanno mostrato latenze interpicco prolungate (I-III, IV, III-V, IV-V) e differite latenze assolute delle onde II, III, V, e io, almeno su 1 lato, nel BAEP. [35]Le vie uditive sono in prossimità dei centri di controllo respiratori del tronco cerebrale, pertanto, le anomalie elettrofisiologiche di onda III e il complesso IV-V possono essere un riflesso del controllo centrale disturbato di ventilazione.
Indicatore Pronostico nel Coma
BAEP può essere fatto mentre il paziente è sedato. Può essere utilizzato come indicatore prognostico. La sopravvivenza è improbabile in assenza di BAEP. Il paziente cerebralmente morto ha sempre BAEPs-sia anormali l’assenza di tutte le forme d’onda o la presenza di onde I e l’assenza di tutte le forme d’onda successive.
BAEP e settembre sono stati condotti studi entro 72 ore dal ricovero in 127 bambini con trauma cranico grave di prevedere l’esito di coma post-traumatico (la morte cerebrale o di sopravvivenza). In prima valutazione, 50 bambini in stato di coma avevano BAEP normale e settembre, il 78% è sopravvissuto e il 22% è peggiorato ed è morto. Dei 45 che ha avuto risultati anormali; 69% è migliorata ed è sopravvissuto, mentre il 31% si è deteriorata ed è morto. Tutti i 32 bambini che non hanno BAEP registrabile e settembre sono morti. Questi dati suggeriscono che BAER è utile per predire l’esito neurologico in questa impostazione.
Indicatore Pronostico nell’ Asfissia Perinatale
In uno studio su 78 bambini affetti da asfissia perinatale, che sono stati proiettati con BAEPs, solo 37 dei 78 hanno sviluppato alterazioni dello sviluppo cerebrale, costituito da encefalopatia statica o ritardo dello sviluppo. [36] BAEP anomalie sono state osservate nel 40,5% di questi pazienti e ha dimostrato una specificità del 87,8%. Con questi risultati, BAEPs possono aiutare a predire i risultati negativi sullo sviluppo neurologico dopo asfissia perinatale. Disturbi del linguaggio Infanzia
Maassen ed altri hanno trovato che i bambini con deficit di linguaggio parlato e mostrato uditivo anormale potenziali evocati nel 95% del gruppo di studio. [37]
Demenza
EP uditive P300 lunga latenza sono stati considerati per l’utilizzo nella valutazione per la malattia di Alzheimer. Nella malattia di Alzheimer, i componenti del cuoio capelluto posteriori sono selettivamente persi. Questo test è stato anche trovato ad essere fortemente correlato con hypometabolism sulla tomografia ad emissione di positroni in questa popolazione malattia. Anche se il test mostra la promessa, i suoi risultati sono considerati aspecifici e non diagnostico e non sono limitati a demenza di Alzheimer. [38]
ABR 9) RUOLO CLINICO ATTUALE DEI POTENZIALI EVOCATI
Durante l’ultimo decennio, il rapido progresso in risonanza magnetica tecnologia (MRI) ha diminuito l’utilizzo di test elettrofisiologico. In una certa misura, ciò è giustificato dall’alta resa e generalmente buona correlazione dei risultati di MRI con la patologia sottostante. Inoltre, la RM è spesso meglio in grado di visualizzare l’anatomia patologica sottostante uno stato di malattia.
Tuttavia, ci sono alcune situazioni in cui sia il disturbo non è facilmente visibile da una modalità di imaging o MRI è fattibile né conveniente. Per tali evenienze, potenziali evocati (EP) studi, tra cui potenziali evocati visivi (PEV), del tronco cerebrale Potenziali evocati uditivi (BAEP), e somatosensoriale potenziali evocati (SEP)-sono particolarmente adatto. Il loro ruolo clinico corrente può essere brevemente riassunta come segue.
In un’ampia varietà di malattie del sistema visivo primario e secondario, prove VEP fornisce un’estensione sensibile dell’esame clinico. MRI è altamente accurato modalità localizzante, che VEP è utile principalmente per valutare la funzione del nervo ottico nel anteriore (prechiasmatic) parte (è lateralizzante ma non la localizzazione alla lesione). Nei pazienti con esordio insidioso e adeguati risultati della risonanza magnetica per la sclerosi multipla (SM), PEV sono raccomandati per aiutare a confermare la diagnosi.
BAEP è utile in neurinoma dell’acustico, ma negli ultimi anni alla resa in piccole lesioni è stata superata da quella di risonanza magnetica, e in molti casi MRI è chiaramente superiore. Tuttavia, la RM può essere inapplicabili in alcuni pazienti (ad esempio, la sempre più grande percentuale di persone anziane che sono dotati di pacemaker ), mentre gli studi BAEP può essere fatto in pazienti con una varietà di dispositivi impiantati. BAEP fornisce buona definizione anatomica.
Settembre, anche se limitato rispetto alla localizzazione spaziale, è un buon strumento funzionale, il suo uso primario è quello di determinare compromissione del sistema nervoso centrale (SNC) di conduzione. Essa può contribuire a confermare i sintomi quando alcuni segni fisici sono noti. Essa può anche rivelare lesioni asintomatiche, facilitando in tal modo l’iter della SM sospetti. Test di settembre e la RM possono servire modalità complementari. Settembre è un valore limitato in disturbi della colonna vertebrale. Malattia degenerativa del disco, stenosi spinale e lesioni compressive mostrano scarsa correlazione physioanatomic.
Settembre può confermare o rifiutare la presenza di un blocco di conduzione sospetta. BAEPs e SEPs a breve latenza (SLSEPs) possono essere in grado di stabilire una regione anatomica in cui si verifica il disturbo di conduzione o il blocco. Essi forniscono uno strumento sensibile per la valutazione della uditivi del tronco encefalico e delle vie somatosensoriali e strutture vicine. Anomalie dimostrate da questi test sono eziologicamente aspecifici e devono essere integrate con cura nella situazione clinica da un medico esperto in usi clinici ei limiti di questi test.
Nei pazienti che hanno sperimentato un arresto cardiaco, MRI del cervello spesso è irrilevante per la patologia e quindi è meno utile nel predire gli esiti neurologici del pregiudizio. In queste situazioni, studi settembre possono essere utili per aiutare a predire esiti negativi.
Con i progressi della tecnologia e aumento della frequenza con la quale alcuni impianti e dispositivi medici sono utilizzati nei pazienti, il numero di persone che non sono in grado di sottoporsi a risonanza magnetica è in crescita. Per questi pazienti, studi PE può essere una strada adatto per la diagnosi. Infine, EP intraoperatori possono fornire informazioni tempestive in sala operatoria che ha il potenziale di migliorare i risultati chirurgici neurochirurgici o neurovascolari.
References
American Speech-Language-Hearing Association (ASHA). (1987). The Short Latency Audirory Evoked Potentials. Rockville Pike, MD: ASHA.
American Speech-Language-Hearing Association (ASHA). (1992). Neurophysiologic intraoperative monitoring. ASHA, 34(Suppl 7), 34—36.
American Speech-Language-Hearing Association (ASHA). (2004). Scope of Practice in Audiology. Rockville Pike, MD: ASHA.
Aoyagì, M., Kiren, T., Kim, Y., Suzuki, Y., Fuse, T., & Koike, Y. (1993). Optimal modulation frequency for amplitude modulation following response in young children during sleep. Hearing Research, 65, 253—261.
Arnold, 5. A. (2007). The auditory brain stem response. In Roeser RJ, Valente M, Hosford-Dunn H (Eds.): Audiology Diagnosis, 2nd ed. New York: Thieme, 426—442.
Beck, 0. L (Ed.) (1993). Audiology: Beyond the sound booth. Seminars in Hearing, 14, 1—2 14.
Burkhard, R. F., & Don, M. (2007). The auditory brainstem response. In Burkhart RF, Don M, Eggermont (Eds.):
Auditory Evoked Potentials: Basic Principles and Clinical Applications. Philadelphia: Lippincott Williams & Wilkins, 229—253.
Burkhard, R. F., Don, M., & Eggermont, J. J. (eds.) (2007). Auditory Evoked Potentials: Basic Principles and Clinical Applications. Philadelphia: Lippincott Williams & Wilkins.
Burkhard, R., & Hecox, 1<. (1983). The effect of broadband noise on the human brainstem auditory evoked response, I: Rate and intensity effects.
Journal of the Acoustical Society of America, 74, 1204—1213.
Chandrasekhar, S. S., Brackmann, D. E., & Devgan, K. K. (1995). Utility of auditory brainstem response audiometry in diagnosis of acoustic neuromas. American Journal of Otology, 16, 63—67.
Chiappa, K. H. (Ed.) (1997). Evoked Potentials in Clinical Medicine, 3rd ed. New York: Lippincott-Raven.
Chung, W. H., Cho, D. Y., Choi, J. Y., & Hong, 5. H. (2004). clinical usefulness of extra tympanic electrocochleography in the diagnosis of Ménière’s disease. Otology & Neurotology, 25, 144—1 49.
Cohen, LT., Rickards, F., & Clark, G. (1991). A comparison of steady-state evoked potentials to modulated tones in awake and sleeping humans. journal of the Acoustical Society of America, 90, 2467—2479.
Cone-Wesson, B., DoweII, R., Tomlin, D., Rance, G., & Ming, W. (2002). The auditory steady-state response: Comparisons with the auditory brainstem response. Journal of the American Academy of Audiology, 13, 173—187.
Cone-Wesson, B., Parker, J., Swiderski, N., & Richards, F. (2002). The auditory steady-state response: FuII-term and premature neonates. Journal of the American Academy of Audiology, 13, 260—269.
Dennis, J. M. (Ed.) (1988). intraoperative monitoring with evoked potentials. Seminars in Hearing, 9, 1—164.
Dirnitrijevic, A., John, M., Van Roon, P., Purceil, D., Adamonis,J., Ostroff,J., er al. (2002). Estimating the audiogram using multiple auditory steady-state responses. Journal o! the Amen con Academy of Audiology, 13, 205—224.
Don, M., Eggermont,J.J., & Brackmann, D. E.(1979). Reconstruction of the audiogram using brain stem responses and high-pass noise masking. Annals of Otology, Rhinology &Laryngology. Supplement, 57, 1—20.
Don, M., & Kwong, B. (2002). Auditory brainstem response: Differential diagnosis. In Katz,J. Burkard R.F., Medwetsky L .(Eds.): Handbook of Clinical Audiology, 5th ed. Philadelphia: Lippincott Williams & Wilkins, 274—297.
Don, M., l<wong, B., Tanaka, C., Brackmann, D., & Nelson, R. (2005). The stacked ABR: A sensitive and specifìc screening tool for detecting small acoustic tumors. Audiology &Neuro-Otology, 10, 274—290.
Don, M., Masuda, A., Nelson, R. A., & Brackmann, D. E. (1997). Successful detection of small acoustic tumors using the stacked derived-band ABR amplitude. The American Journal of Otology, 18, 608—621.
Ferraro, J. A. (2000). Electrocochleography. In Roeser RJ, Valente M, Hosford-Dunn H (Eds.): Audiology Diagnosis. New York: Thieme, 425—450.
Ferraro, J. A., & Krishnan, G. (1997). Cochlear potentials in clinical audiology. Audiology & Neuro-Otology, 2, 241 —256.
Ferraro, J. A., 8? Tibbils, R. P. (1999). SP/AP area ratio in the diagnosis of Meniere’s disease. Amenican Journal of Audiology, 8, 2 1—28.
Fria, T.J. (1980). The auditory brainstem response: Background and clinical applications. Monographs in Contemporary Audiology, 2, 1—44.
Gans, R. E., & Roberts, R. A. (2005). Understanding vestibular-evoked myogenic potentials (VEMPs). Audiology Today, 17(1), 23—25.
Gelfand, S. A. (2004). Hearing: An Introduction to PsychoIogical and Physiological Acoustics, 4th ed. New York:Marcel Dekker.
Glattke, T.J. (1993). Short-Latency Auditory Evoked Potentials. Austin: Pro-Ed Gorga, M. P., Johnson, T. A., Kaminski, J. R., Beauchaine, 1<. L, Garner, C. A., & Neely, 5. T. (2006). Using a combination of click- and tone burst-evoked auditory brain stem response measurements to estimate pure-tone thresholds. Ear and Hearing, 27, 60—74.
Gorga, M. P., Neely, S. T., Hoover, B. M., Dierking, D. M., Beauchaine, 1<. L, & Manning. C. (2004). Determining the upper limits of stimulation for auditory steady-state response measurements. Ear and Hearing, 25, 302—307.
Gorga, M. P., & Thornton, A. R. (1989). The choice of stimuli for ABR measurements. Ear and Hearing, 10, 217—230.
Grason-Stadler, Inc. (GSI). (2001). Auditory Steady-State Response: A New TooI for Frequency-Specific Hearing Assessment in Infants and Children. Madison: Viasys Neuro Care/GSI.
HaII, J. W. (2007). New Handbook for Auditory Evoked Responses. Boston: Allyn & Bacon.
Hecox, k., & Galambos, R. (1974). Brain stem auditory evoked responses in human infants and adults. Archives of Otolaryngology, 99, 30—33.
Herdman, A. T., Lins, O., Van Roon, P., Stapells, D. R., Scherg, M., & Picton, T. W. (2002). Intracerebral sources of human auditory steady-state responses. Brain Topography, 15, 69—86.
Herdman, A. T., & Stapells, D. R. (2001). Thresholds determined using the monotic and dichotic multiple auditory steady-state response technique in normal-hearing subjects. Scandinavian Audiology, 30,41—49.
Herdman, A. T., & Stapells, D. R. (2003). Auditory steadystate response thresholds of adults with sensorineural hearing impairment. lnternational Journal of Audiology, 42, 237—248.
Hood, L. J. (2007). Auditory neuropathy and dys-synchrony. In l3urkhard RF, Don M, Eggermont JJ (Eds.): Auditory Evoked Potentials: Basic Principles and Clinical Applications. Philadelphia: Lippincott Williams & Wilkìns, 275—290.
Hood, LJ., Berlin, C. I., Hurley, A., Cecola, R. P., & Beh, B. (1996). Contralateral suppression of chick-evoked otoacoustic emissions: lntensity effects. Hearing Research, 101, 113—118.
Hurley, R. M., Hurley, A., & Berlin, C. 1. (2005). Development of low-frequency tone burst versus the chick auditory brainstem response. Jounnal of the Amenican Academy of Audiology, 16,114—121.
Jacobson, J. T. (1985). The Auditory Brainstem Response. San Diego: College-Hill.
Jerger,J., Chmiel, R., Frost,J., & Coker, N. (1986). Effect of sleep on the auditory steady state evoked potential. Ear and Hearing, 7, 240—245.
Jerger,J., & Hall, J. (1980). Effects of age and sex on the auditory brainstem response. Archives of Otolaryngology, 106, 387—391.
Jerger,J., &Johnson, 1<. (1988). Interactions of age, gender, and sensorineural hearing bss on ABR latency. Ear and Heaning,9, 168—176.
John, M. 5., Brown, D. 1<., Muir, P.J., & Picton, T. W. (2004). Recording auditory steady-state responses in young infants. Ear and Hearing, 25,
539—553.
Johnsen, N.J., & Elberling, C. (1982). Evoked acoustic emissions from the human ear. Scandinavian Audiology, 11, 3—12.
Lins, O. G., Picton, T. W., Boucher, B. L, Durieux-Smith, A., Champagne, 5. C., Moran, L M., et aI. (1996). Frequency specific audiometry using steady-state responses. Ear and Hearing, 17, 81—96.
Lonsbury-Martin, B. L, Whitehead, M. L, & Martin, G. 1<. (1991). Clinica! applications of otoacoustic emissions. Journal of Speech and Hearing Research, 34, 964—981.
Martin, B. A., Tremblay, K. L, & Stapells, D. R. (2007). Principles and applications of cortical auditory evoked potentials. In Burkhard RF, Don M, Eggermont,J.J (Eds): Auditory Evoked Potentials: Basic Principles and Clinical Applications. Philadelphia: Lippincott Williams & Wilkins, 482—507.
Martin, M., & Shi, B. Y. (2007). Intraoperative monitoring. In Burkhard RF, Dan M, Eggermont JJ (Eds.): Auditory Evoked Potentials: Basic Principles and Clinica! Applications. Philadelphia: Lippincott Williams & Wilkins, 355—384.
Mauldin, L., &Jerger, J. (1979). Auditory brain stem evoked responses to bone-conduction signals. Archives of Otolaryngology, 105, 656—661.
McPherson, D. L, & Ballachanda, B. (2000). Middle and long latency auditory evoked potentials. In Roeser RJ, Valente M, Hanford-Dunn H (Eds.):
Audiology Diagnosis. New York: Thieme, 471—502.
MøIler , A. R. (2000). Intraoperative neurophysiological monitoring. In Roeser RJ, Valente M, Hosford-Dunn H
(Eds.): Audiology Diagnosis. New York: Thieme, 545— 570.
MøIler, A. R. (2007). Neural generators far auditory brainstem evoked potentials. In Burkhard RF, Dan M, Eggermont JJ (Eds.): Auditory Evoked Potentials: Basic Principles and Clinica! Applications. Philadelphia: Lippincott Williams & Wilkins, 336—354.
MøIler, A. R., &Janetta, P.J. (1985). Neural generators of the auditory brainstem response. In Jacobson jT (Ed.): The Auditory Brainstem Response. San Diego: College Hill, 13-31.
Moore, E. J. (1983). Bases of Auditory Brain-Stem Evoked Responses. New York: Crune & Stratton.
Moore, J. 1<. (1987). The human auditory brainstem as a generator of auditory evoked potentials. Hearing Research, 29, 33—43.
Musiek, F. E., Borenstein, S. P., Hall, J. W., & Schwaber, M. K. (1994). Auditory brainstem response: Neuro diagnostic and intraoperative applications. In katz J. (Ed.):
Handbook of Clinica! Audiology, 4th ed. Baltimore: Williams & Wilkins, 351—374.
Parker, D.J., & Thornton, A. R. D. (1978). Derived cochlear nerve and brainstem evoked responses of the human auditory system. Scandinavian Audiology, 7, 73—80.
Picton, T. W., Dimitrijevic, A., Perez-Abalo, M. C., & Van Roon, P. (2005). Estimating audiometric thresholds using auditory steady-state responses. Journal of the American Academy of Audiology, 16, 140—156.
Picton, T. W., John, M. 5., Purcel!, D. W., & Plourde, G. (2003). Human auditory steady-state responses: The effects of recording technique and state of arousal. Anaesthesia and Analgesia, 97, 1396—1402.
Pratt, H. (2007). Middle-Iatency responses. In Burkhard RF, Dan M, EggermontJJ (Eds.): Auditory Evoked Potentials: Basic Principles and Clinica! Applications. Philadelphia: Lippincott WiI!iams & Wilkins. 463—481.
Probst, R., Lonsbury-Martin, B. L, & Martin, G. K. (1991). A review of otoacoustic emissions.Journal of the Acoustical Soci ety of America, 89,
2027—2067.
Probst, R., Lonsburry-Martin, B. L, Martin. G. 1<., & Coats, A. C. (1987). Otoacoustic emissions in ears with hearing loss. American Journal of Otolaryngology, 8. 73—81.
Rance, G., Rickards, F., Cohen, L, De Vidi, 5., & Clark, G. (1995). The automated prediction of hearing thresholds in sleeping subjects using auditory steady state evoked potentials. Ear and Hearing, 16, 499—507.
Rance, G., & Tomlin, D. (2006). Maturation of auditory steady-state responses in normal babies. Ear and Hearing, 27, 20—2 9.
Rance, G., Tombin, D., & Rickards, F. W. (2006). Comparison of auditory steady-state responses and tone-burst auditory brainstem responses in normal! babies. Ear and Hearing, 27. 751—762.
Robinette, M. 5., Bauch, C. D., Olsen, W. O., Hamer, 5. C., & Beatty, C. W. (1992). Use of TEOAE, ABR and acoustic
reflex measures to assess auditory function in patients with acoustic neuroma. Amen can Journal of Audiology, 1, 66—72.
Robinette, M. S., & Glattke, T. J. (Eds.) (2002). Otoacoustic Emissions: Clinica! Applications, 2nd ed. New York: Thieme.
Rudeli, A. P.(1987). A fiber tract model of auditory brainstem responses. Electroencephalography and Clinical Neurophysiology, 67. 53—62.
Ruth, R. A., Lambert, P., & Ferraro,J. A. (1988). Electrocochleography: Methods and clinical applications. Amenican Journal af Otology, 9, 1—11.
Sass, 1<. (1998). Sensitivity and specificity of trans tympanic electrocochleography in Meniere’s disease. Acta Oto-Laryngologica, 118, 150—156.
Savio, G., Crdenas, J., Pérez Abalo, M., Conzlez, A., & Valdés, j. (2001). The low and high frequency auditory steady state responses mature at different rates. Audiology &Neuro-Otology, 6, 279—287.
Scherg, M., & vonCramon, D. (1985). A new interpretation of the generators of BAEP waves l—V: Results of a spatiotemporal dipole model. Electroencephalography and Clinica! Neurophysiology, 62, 290—299.
Schmidt, R. J., Sataloff, R. T., Newman, J., Spiegel, J. R., & Myers, D. L (2001). The sensitivity of auditory brainstem response testing far the diagnosis of acoustic neuromas. Archives of Otolaryngology—Head & Neck Surgery, 127, 19—22.
Schoonhoven, R. (2007). Responses from the cochlea. In Burkhard RF, Dan M, Eggermont JJ (Eds.): Auditory Evoked Potentials: Basic Principles and Clinica! Applications. Philadelphia: Lippincott Williams & Wilkins, 180—198.
Schwartz, D. M., Iarson, V. D., & De Chicchis, A. R. (1985). Spectral characteristics of air and bone conduction transducers used to record the auditory brainstem response. Ear and Hearing, 6, 274—277.
Shepard, N. T. (2007). Dizziness and balance disorders:
The role of history and laboratory studies in diagnosis and management. ASHA Leader, 12(7), 6—17.
Shepard, N. T., & Telian, 5. A. (1996). Practical Management of the Balance Disorder Patient. San Diego: Singular.
Sininger, Y. 5. (2007). The use of auditory brainstem response in screening for hearing loss and audiometric threshold prediction. In Burkhard RF,
Don M, Eggermont JJ (Eds.): Auditory Evoked Potentials: Basic Principles and Clinica! Applications. Philadelphia: Lippincott Williams & Wilkins, 254—274.
Sohmer, H., & Feinmesser, M. (1967). Cochlear action potentials recorded from the external ear in man. Annals of Otology, Rhinology, and Laryngology, 76, 427—435.
Squires, K. C., & Hecox, 1<. E. (1983). Electrophysioiogical evaluation of higher level auditory processing. Seminars in Hearing, 4,415—433.
Stapells, D. R. (2000). Threshold estimation of the tone evoked auditory brainstem response: A literature metaanalysis. Journal af Speech-Language Pathology and Audialogy, 24, 74—83.
Stapells, D. R., & Kurtzberg, D. (1991). Evoked potential assessment of auditory integrity in infants. Clinics in Perinatology, 18,497—518.
Stapells, D. R., Picton, T. W., Durieux-Smith, A., Edwards, C. G., & Morna, L. M. (1990). Thresholds far short-Iatency auditory-evoked potentials ta tones in notched noise in normal-hearing and hearing-impaired subjects. Audiology, 29, 2 62—274.
Stapells, D. R.. Picton. T. W.. & Smith. A. D. (1982). Normal hearing thresholds far clicks. Journal of the Acoustical Saciety of America, 72, 74—7 9.
Starr, A., & Gobob, E.j. (2007). Cognitive factors modulating auditory cortical potentials. In Burkhard RF, Dan M, Eggermont JJ (Eds.), Auditory Evoked Potentials: Basic Principles and Clinical Applications. Philadelphia: Lippincott Williams & Wilkins, 508—524.
Starr, A., Picton, T. W., Sininger, Y. 5., Hood, LJ., & Berlin, C. 1. (1996). Auditory neuropathy. Brain, 119, 741 —753.
Stockard, J. E., Stockard, J. J., Westmoreland, B. F., & Corflts, j. L. (1979). Brainstem auditory-evoked response: Normal variation as a function of stimulus and subject characteristics. Archives of Neurology, 36, 823—831.
Stockwell, C. W. (1983). ENG Workbook. Austin: Pro-Ed.
Sutton, 5., Barren, M., Zubin,J., &John,J. E. (1965). Evoked potential correlates of stimulus uncertainty. Science, 150, 1187—1188.
Turner, R. G., Shepard, N. T., & Frazer, G. J. (1984). Clinical performance of audiological and related diagnostic tests. Ear and Heaning, 5, 187—194.
van der Drift, j. F. C., Brocaar, M. P., & van Zanten, G. A. (1988a). Brainstem response audiometry: I. lts use in distinguishing between conductive and cochlear hearing bss. Audiology, 27, 260—270.
van der Drift, J. F. C., Brocaar, M. P., & van Zanten, G. A. (1988b). Brainstem response audiometry, Il: Classification of hearing bss by discriminant analysis. Audiology, 27, 271—278.
VanderWerff, 1<. R., & Brown, C. F.(2005). Effect of audiometric configuration on threshold and suprathreshold auditory steady-state responses. Ear and Heaning, 26, 3 10—326.
Wagner, W., Heppelmann, G., Miilber, J., Janssen, T., & Zenner, H.-P. (2007). Olivocochlear reflex effect on human distortion product otoacoustic emissions is largest at frequencies with distinct fine structure dips. Hearing Research, 223, 83—92.
Weber, B. A. (1983). Pitfalls in auditory brain stem response audiometry. Ear and Hearing, 4, 179—184.
Yamada, O., Kodera, K., & Yagi, T. (1979). Cochlear processes affecting wave V Iatency of the auditory evoked brainstem respanse: A study of patients with sensory hearing bss. Scandinavian Audialogy, 8, 67—70.
YeIlin, M. W. (2000). Assessment of vestibular function. In Roeser RJ, Valente M, Hosford-Dunn H (Eds.): audiology Diagnosis. New York: Thieme, 571—592.
Zapaba, D. (2007). The VEMP: Ready far the clinic. Hearing Journal, 60(3), 10—18.
References
Achor, LJ, & Starr, A. (1980a). Auditory brainstem responses in the cat I: Intracranial and extracranial recordings. Electroencephalography and Clinical Neurophysiology, 48 , 154–173.
Achor, LJ, & Starr, A. (1980b). Auditory brainstem responses in the cat II: Effects of lesions. Electroencephalography and Clinical Neurophysiology, 48 , 174–190.
Amadeo, M., & Shagass, C. (1973). Brief latency clickevoked potentials during waking and sleep in man. Psychophysiology, 10 , 244–250.
American Academy of Pediatrics. (1985). Guidelines for the elective use of conscious sedation, deep sedation, and general anesthesia in pediatric patients. Pediatrics, 76 , 317–321.
Aran, JM (1978). Contributions of electrocochleography to diagnosis in infancy. An 8 year survey. In SE Gerber & GT Mencher (Eds.), Early diagnosis of hearing loss (pp. 215–242). New York: Grune & Stratton.
Arnold, SA (1985). Objective versus visual detection of the auditory brainstem response. Ear and Hearing, 6 , 144–150.
Bauch, CD, & Olsen, WO (1986). The effect of 2000–4000 Hz hearing sensitivity on ABR results. Ear and Hearing, 7 , 314–317.
Beagley, HA (1974). Can we use the cochlear microphonic in electrocochleography? Revue de Laryngologie, 95 , 531–536.
Beattle, RC, Beguwala, FE, Mills, DM, & Boyd, RL (1986). Latency and amplitude effects of electrode placement on the early auditory evoked response. Journal of Speech and Hearing Disorders, 51 , 63–70.
Beauchaine, KA, Gorga, MP, Reiland, JK, & Larson, LL (1986). The application of auditory brainstem response measurements to the selection of hearing aids: Preliminary data. Journal of Speech and Hearing Research, 29 , 120–128.
von Bekesy, G. (1974). Experiments in hearing . New York: McGraw-Hill.
Berlin, CI, Cullen, JK, Ellis, MS, Lousteau, RJ, Yarbrough, WM, & Lyons, GD (1974). Clinical application of recording human VIIIth nerve action potentials from the tympanic membrane. Transactions of the American Academy of Ophthalmology and Otolaryngology, 78 , 401–410.
Berlin, CI, & Gorga, MI (1976). Extratympanic clinical electrocochleography with clicks. In RJ Ruben, C. Elberling, & G. Salomon (Eds.), Electrocochleography (pp. 457–469). Baltimore: University Park Press.
Berlin, CI, Gondra, MI, & Casey, D. (1978). Bone conduction electrocochleography: Clinical applications. Laryngoscope, 88 , 56–763.
Binnie, CD, Rowan, AJ, & Gutter, T. (1982). A manual of electroencephalographic technology . Cambridge, England: Cambridge University Press.
Boston, JR, & Ainslie, PJ (1980). Effects of analog and digital filtering on brainstem auditory evoked potentials. Electroencephalography and Clinical Neurophysiology, 48 , 361–364.
Brewer, CC (1987). Electrophysiologic measures. In HG Mueller & VC Geoffrey (Eds.), Communication disorders in aging (pp. 334–380). Washington, DC: Gallaudet University Press.
Brewer, CC, & Resnick, DM (1984). The value of BAEP in assessment of the comatose patient. In RH Nodar & C. Barber (Eds.), Evoked potentials II (pp. 578–581). Boston: Butterworth Publishers.
Buchwald, JS, & Huang, CM (1975). Far-field acoustic response: Origins in the cat. Science, 189 , 382–384.
Campbell, KCM, & Abbas, PJ (1987). The effect of stimulus repetition on the auditory brainstem response in tumor and nontumor patients. Journal of Speech and Hearing Research, 30 , 494–502.
Cann, J., & Knott, J. (1979). Polarity of acoustic click stimuli for eliciting brainstem auditory evoked responses: A proposed standard. American Journal of Electroencephalography and Technology, 19 , 125–132.
Cevette, MJ (1984). Auditory brainstem response testing in the intensive care unit. Seminars in Hearing, 5 , 57–68.
Chu, NS (1985). Age related changes in the brainstem auditory evoked potentials. Electroencephalography and Clinical Neurophysiology, 62 , 431–436.
Clemis, JD, Ballad, J., & Killion, MC (1986). Clinical use of an insert earphone. Annals of Otology, Rhinology, and Laryngology, 95 , 520–524.
Clemis, JD, & McGee, T. (1979). Brainstem electric response audiometry in the differential diagnosis of acoustic tumors. Laryngoscope, 89 , 31–42.
Clemis, JD, & Mitchell, C. (1977). Electrocochleography and brainstem responses used in the diagnosis of acoustic tumors. Journal of Otolaryngology, 6 , 447–459.
Coats, AC (1974). On electrocochleographic electrode design. Journal of the Acoustical Society of America, 56 , 708–711.
Coats, AC (1981). The summating potential and Meniere’s disease. Archives of Otolaryngology, 107 , 199–208.
Coats, AC (1983). Instrumentation. In EJ Moore (Ed.), Bases of auditory brainstem evoked responses (pp. 197–220). New York: Grune & Stratton.
Coats, AC (1986). Electrocochleography: Recording techniques and clinical applications. Seminars in Hearing (Electrocochleography), 7 , 247–266.
Coats, AC, & Martin, JL (1977). Human auditory nerve action potentials and brainstem evoked responses. Archives of Otolaryngology, 103 , 605–622.
Creel, D., Garber, SR, King, RA, & Witkop, CJ (1980). Auditory brainstem anomalies in human albinos. Science, 209 , 1253–1255.
Cullen, JK, Ellis, MS, Berlin, CI, & Lousteau, RJ (1972). Human acoustic nerve action potential recordings from the tympanic membrane without anesthesia. Acta Otolaryngologica, 74 , 15–22.
Dallos, P. (1973). The auditory periphery . New York: Academic.
Davis, H. (1976). Principles of electric response audiometry. Annals of Otology, Rhinology, and Otolaryngology, 85 (Suppl. 28), 1–96.
Dobie, RA, & Berlin, CI (1979). Binaural interaction in brainstem-evoked responses. Archives of Otolaryngology, 105 , 391–398.
Dobie, RA, & Norton, SJ (1980). Binaural interaction in human auditory evoked potentials. Electroencephalography and Clinical Neurophysiology, 49 , 303–313.
Domico, WD, & Kavanaugh, KT (1986). Analog and zero phase-shift digital filtering of the auditory brainstem response waveform. Ear and Hearing, 7 , 377–382.
Don, M., & Eggermont, JJ (1978). Analysis of the clickevoked brainstem potentials in man using high-pass noise masking. Journal of the Acoustical Society of America, 63 , 1084–1092.
Don, M., Eggermont, JJ, & Brackmann, DE (1979). Reconstruction of the audiogram using brainstem responses and high-pass noise masking. Annals of Otology, Rhinology, and Laryngology, 88 (Suppl. 57), 1–20.
Don, M., Elberling, C., & Waring, M. (1984). Objective detection of averaged auditory brainstem responses. Scandinavian Audiology, 13 , 219–228.
Durrant, JD (1977). Study of a combined noninvasive ECochG and BSER recording technique. Journal of the Acoustical Society of America, 62 , S87.
Durrant, JD (1983). Fundamentals of sound generation. In EJ Moore (Ed.), Bases of auditory brainstem evoked responses (pp. 15–49). New York: Grune Stratton.
Durrant, JD (1986). Combined ECochG-ABR versus conventional ABR recordings. Seminars in Hearing (Electrocochleography), 7 , 289–305.
Durrant, JD, Gabriel, S., & Walter, M. (1981). Psychophysical tuning functions for brief stimuli: Preliminary report. American Journal of Otolaryngology, 2 , 108–113.
Durrant, JD, & Lovrinic, JH (1984). Bases of hearing science (2nd ed.). Baltimore: Williams & Wilkins.
Durrant, JD, Shelhamer, M., Fria, TJ, & Ronis, ML (1981). Examination of the sidedness of the brainstem auditory evoked potential . Paper presented at the biennial symposium of the international response audiometry study group, Bergamo. Italy.
Eggermont, JJ (1976a). Analysis of compound action potential responses to tone bursts in the human and guinea pig cochlea. Journal of the Acoustical Society of America, 60 , 1132–1139.
Eggermont, JJ (1976b). Electrocochleography. In WD Keidel & WD Neff (Eds.), Handbook of sensory physiology, Vol. V/3: Auditory system-Clinical and special topics (pp. 625–705). Berlin: Springer-Verlag.
Eggermont, JJ, & Don, M. (1980). Analysis of the clickevoked brainstem potentials in humans using high-pass noise masking. II. Effect of click intensity. Journal of the Acoustical Society of America, 68 , 1671–1675.
Eggermont, JJ, Don, M., & Brackmann, DE (1980). Electrocochleography and auditory brainstem electric responses in patients with pontine angle tumors. Annals of Otology, Rhinology, and Laryngology, 89 (Suppl. 75), 1–19.
Eggermont, JJ, Odenthal, DW, Schmidt, PH, & Spoor, A. (1974). Electrocochleography: Basic principles and clinical application. Acta Otolaryngologica (Suppl. 316), 1–84.
Elberling, C. (1979a). Auditory electrophysiology: Spectral analysis of cochlear and brainstem evoked potentials. Scandinavian Audiology, 8 , 57–64.
Elberling, C. (1979b). Auditory electrophysiology: The use of templates and cross correlation functions in the analysis of brainstem potentials. Scandinavian Audiology, 8 , 187–190.
Elberling, C., & Don, M. (1987). Threshold characteristics of the human auditory brainstem response. Journal of the Acoustical Society of America, 81 , 115–121.
Elberling, C., & Salomon, G. (1973). Cochlear microphonics recorded from the ear canal in man. Acta Otolaryngologica, 75 , 489–495.
Emerson, RG, Brooks, EB, Parker, SW, & Chiappa, KH (1982). Effects of click polarity on brainstem auditory evoked potentials in normal subjects and patients: Unexpected sensitivity of Wave V. Annals of the New York Academy of Science, 288 , 710–721.
Ferraro, JA (Ed.). (1986). Seminars in Hearing (Electrocochleography) , 7 , 241-337.
Ferraro, JA, Arenberg, IK, & Hassanein, RS (1985). Electrocochleography and symptoms of inner ear dysfunction. Archives of Otolaryngology, 111 , 71–74.
Ferraro, JA, & Ferguson, R. (in press). Tympanic ECochG and conventional ABR: A combined approach for the identification of Wave I and the I–V interwave interval. American Journal of Otology .
Ferraro, JA, Murphy, GB, & Ruth, RA (1986). A comparative study of primary electrodes used in extratympanic electrocochleography. Seminars in Hearing, 7 , 279–287.
Finitzo-Hieber, T., Hecox, K., & Cone, B. (1979). Brainstem auditory evoked potentials in patients with congenital atresia. Laryngoscope, 89 , 1151–1158.
Folsom, RC (1984). Frequency specificity of human auditory brainstem responses as revealed by pure-tone masking profiles. Journal of the Acoustical Society of America, 66 , 919–914.
Folsom, RC, & Wynne, MK (1986). Auditory brainstem responses from human adults and infants: Restriction of frequency contribution by notched-noise masking. Journal of the Acoustical Society of America, 80 , 1057–1064.
Fowler, CG, & Noffsinger, D. (1983). The effects of stimulus repetition rate and frequency on the auditory brainstem response in normal, cochlear-impaired, and VIII nerve/brainstem-impaired subjects. Journal of Speech and Hearing Research, 26 , 560–567.
Fowler, CG, & Swanson, MR (1988). Binaural and monaural phasic differences in the auditory brainstem response Manuscript submitted for publication.
Fria, TJ (1980). The auditory brainstem response: Background and clinical applications. Monographs in Contemporary Audiology, 2 , 1–44.
Fria, TJ, & Doyle, WJ (1984). Maturation of the auditory brainstem response (ABR): Additional perspectives. Ear and Hearing, 5 , 361–365.
Galambos, R., Makeig, S., & Talmachoff, PJ (1981). A 40-Hz auditory potential recorded from the human scalp . In Proceedings of the National Academy of Science (Vol. 78, pp. 2643–2647).
Geddes, LA (1972). Electrodes and the measurement of bioelectric events . New York: Wiley-Interscience.
Gibson, WPR, Moffat, DA, & Ramsden, RT (1977). Clinical electrocochleography in the diagnosis and management of Meniere’s disorder. Audiology, 16 , 389–401.
Glattke, TJ (1983). Short latency auditory evoked potentials . Baltimore: University Park Press.
Gorga, MP, Abbas, PJ, & Worthington, DW (1985). Stimulus calibration in ABR measurements. In JT Jacobson (Ed.), The auditory brainstem response (pp. 49–62). San Diego, CA: College-Hill.
Gorga, MP, Beauchaine, KA, & Reiland, JK (1987). Comparison of onset and steady-state responses of hearing aids. Implications for use of the auditory brainstem response in the selection of hearing aids. Journal of Speech and Hearing Research, 30 , 130–136.
Gorga, MP, Beauchaine, KA, Reiland, JK, Worthington, DW, & Javel, E. (1984). The effects of stimulus duration on ABR and behavioral thresholds. Journal of the Acoustical Society of America, 76 , 616–619.
Gorga, MP, Reiland, JK, & Beauchaine, KA (1985). Auditory brainstem responses in a case of high-frequency conductive hearing loss. Journal of Speech and Hearing Disorders, 50 , 346–350.
Gorga, MP, Reiland, JK, Beauchaine, KA, Worthington, DW, & Jesteadt, W. (1987). Auditory brainstem responses from graduates of an intensive care nursery: Normal patterns of response. Journal of Hearing Research, 30 , 311–318.
Gorga, MP, Worthington, DW, Reiland, JK, Beauchaine, KA, & Goldgar, DE (1985). Some comparisons between auditory brainstem response thresholds, latencies, and the pure-tone audiogram. Ear and Hearing, 6 , 105–112.
Grundy, BL, Janetta, PJ, Procopio, P., Lina, A., Boston, JR, & Doyle, E. (1981). Intraoperative monitoring of brainstem auditory evoked potentials. Journal of Neurosurgery, 57 , 674–681.
Hall, JW, Mackey-Hargadine, JR, & Kim, EE (1985). Auditory brainstem response in the determination of brain death. Archives of Otolaryngology, 111 , 613–620.
Hall, JW, & Tucker, DA (1986). Sensory evoked responses in the intensive care unit. Ear and Hearing, 7 , 220–232.
Harris, DM, & Dallos, PJ (1979). Forward masking of auditory nerve fiber responses. Journal of Neurophysiology, 42 , 1083–1107.
Harris, FJ (1978). On the use of windows for harmonious analysis with the discrete Fourier Transform . In Proceedings of the IEEE (Vol. 66, pp. 51–83).
Hashimoto, I., Ishiyama, Y., & Tozuka, G. (1979). Bilaterally recorded brainstem auditory evoked responses. Their asymmetric abnormalities and lesions of the brainstem. Archives of Neurology, 36 , 161–167.
Hecox, KE (1983). Role of auditory brainstem responses in the selection of hearing aids. Ear and Hearing, 4 , 51–55.
Hecox, K., Squires, N., & Galambos, R. (1976). Brainstem auditory evoked responses in man. I. Effect of stimulus rise-fall time and duration. Journal of the Acoustical Society of America, 60 , 1187–1192.
Hoke, M., & Lutkenhoner, B. (1981). Electrophysiological findings in patients with sudden deafness: A survey. In Advances in otorhinolaryngology (pp. 83–99). Basel: S. Karger.
Hood, LJ, & Berlin, CI (1986). Auditory evoked potentials . Austin, TX: Pro-Ed.
Hyde, ML (1985). The effect of cochlear lesions on the ABR. In JT Jacobson (Ed.), The auditory brainstem response (pp. 133–146). San Diego, CA: College Hill Press.
Hyde, ML, & Blair, RL (1981). The auditory brainstem response in neuro-otology: Perspectives and problems. Journal of Otolaryngology, 10 , 117–125.
Jacobson, JD (Ed.). (1985). The auditory brainstem response . San Diego, CA: College-Hill Press.
Jerger, J., & Hall, J. (1980). Effects of age and sex on auditory brainstem response. Archives of Otolaryngology, 106 , 387–391.
Jerger, J., & Mauldin, L. (1978). Prediction of sensorineural hearing level from the brainstem evoked response. Archives of Otolaryngology, 104 , 454–461.
Jewett, DL (1970). Volume-conducted potentials in response to auditory stimuli as detected by averaging in the cat. Electroencephalography and Clinical Neurophysiology, 28 , 609–618.
Jewett, DL, Romano, MN, & Williston, JS (1970). Human auditory evoked potentials: Possible brainstem components detected on the scalp. Science, 167 , 1517–1518.
Jewett, DL, & Williston, JS (1971). Auditory evoked far fields averaged from the scalp of humans. Brain, 94 , 681–696.
Joint Commission on Accreditation of Hospitals. (1987). Standard PI.9: Patient care equipment. Accreditation Manual for Hospitals , 199–200.
Keith, WJ, & Greville, KA (1987). Effects of audiometric configuration on the auditory brainstem response. Ear and Hearing, 8 , 49–55.
Kevanishvili, Z., & Aphonchenko, V. (1979). Frequency composition of brainstem auditory evoked potentials. Scandinavian Audiology, 8 , 51–55.
Kileny, P., Schlagheck, G., & Spak, C. (1986). Site of lesion ABR testing with tonal stimuli . Paper presented at the annual convention of the American Speech-Language-Hearing Association, Detroit.
Klein, AJ (1984). Frequency and age-dependent auditory evoked thresholds in infants. Hearing Research, 16 , 291–297.
Kodera, K., Marsh, RR, Suzuki, M., & Suzuki, J. (1983). Portions of tone pips contributing to frequency-selective auditory brainstem responses. Audiology, 22 , 209–218.
Martin, M., & Moore, E. (1977). Scalp distribution of early (0–10 msec) auditory evoked responses. Archives of Otolaryngology, 103 , 326–328.
Mauldin, L., & Jerger, J. (1979). Auditory brainstem evoked responses to bone-conducted signals. Archives of Otolaryngology, 105 , 656–661.
McClelland, RJ, & McCrea, RS (1979). Intersubject viability of the auditory-evoked brainstem potentials. Audiology, 18 , 462–471.
Mendel, MI, & Wolf, KE (1983). Clinical applications of the middle latency responses. Audiology: A Journal for Continuing Education, 8 , 141–155.
Mendelson, T., Salamy, A., Lenoir, M., & McKean, C. (1979). Brainstem evoked potential findings in children with otitis media. Electroencephalography and Clinical Neurophysiology, 105 , 17–20.
Michelini, S., Arslan, E., Prosser, S., & Pedrielli, F. (1982). Logarithmic display of auditory evoked potentials. Journal of Biomedical Engineering, 4 , 62–64.
Moller, AR (1986). Effect of click spectrum and polarity on round window N1N2 response in the rat. Audiology, 25 , 29–43.
Moller, AR, & Jannetta, PJ (1982). Comparison between intracranially recorded potentials from the human auditory nerve and scalp recorded auditory brainstem responses (ABR). Scandinavian Audiology, 11 , 3340.
Moller, AR, & Jannetta, PJ (1983). Monitoring auditory functions during cranial nerve microvascular decompression operations by direct monitoring from the eighth nerve. Journal of Neurosurgery, 59 , 493–499.
Moller, AR, Jannetta, PJ, Bennett, M., & Moller, MB (1981). Intracranially recorded responses from the human auditory nerve: New insights into the origin of brainstem evoked potentials (BSEP). Electroencephalography and Clinical Neurophysiology, 52 , 18–27.
Moller, K., & Blegvad, B. (1976). Brainstem responses in patients with sensorineural hearing loss. Scandinavian Audiology, 5 , 115–127.
Moore, EJ (1983). Bases of auditory brainstem evoked responses . New York: Grune Stratton.
Murray, AD, Javel, E., & Watson, CS (1985). Prognostic validity of auditory brainstem evoked response screening in newborn infants. American Journal of Otolaryngology, 6 , 120–131.
Naunton, RF, & Zerlin, SS (1976). Basis and some diagnostic implications of electrocochleography. Laryngoscope, 86 , 475–482.
Noffsinger, D., & Fowler, CG (1983). Brainstem auditory evoked potentials: Applications in clinical audiology. Bulletin of the Los Angeles Neurological Societies, 47 , 43–54.
Nuttall, AH (1981). Some windows with very good sidelobe behavior. IEEE Transactions on Acoustics, Speech and Signal Processing, 29 , 84–91.
Nyquist, H. (1924). Certain factors affecting telegraph speed. Bell System Technical Journal, 3 (2), 324–346.
Pfeiffer, RR (1974). Consideration of the acoustic stimulus. In WD Keidel & WD Neff (Eds.), Handbook of sensory physiology, Vol. V/l: Auditory system-Anatomy and physiology (ear) (pp. 9–38). Berlin: Springer-Verlag.
Picton, TW, & Hillyard, SA (1974). Human auditory evoked potentials. II. Effects of attention. Electroencephalography and Clinical Neurophysiology, 36 , 191–200.
Picton, TW, & Hink, RF (1974). Evoked potentials: How? What? Why? American Journal of EEG Technology, 14 , 9–44.
Picton, TW, Ouellette, J., Hamel, G., & Smith, AD (1979). Brainstem evoked potentials to tonepips in notched noise. Journal of Otolaryngology, 8 , 289–314.
Picton, TW, Stapells, DR, & Campbell, KB (1981). Auditory evoked potentials from the human cochlea and brainstem. Journal of Otolaryngology, 10 (Suppl. 9), 1–41.
Probst, R. (1983). Electrocochleography: Using extratympanic or transtympanic methods? ORL-Journal of Otorhinolaryngology and Related Specialties, 45 , 322–329.
Reneau, JP, & Hnatiow, GZ (1975). Evoked response audiometry . Baltimore: University Park Press.
Rosenhall, U., Bjorkman, G., Pederson, K., & Kall, H. (1985). Brainstem auditory evoked potentials in different age groups. Electroencephalography and Clinical Neurophysiology, 62 , 426–430.
Rowe, MJ (1978). Normal variability of the brainstem auditory evoked response in young and old adult subjects. Electroencephalography and Clinical Neurophysiology, 44 , 459–470.
Ruth, RA, Lambert, RR, & Ferraro, JA (in press). Electrocochleography: Methods and clinical applications. American Journal of Otology .
Ruth, RA, Mills, JA, & Ferraro, JA (in press). The use of disposable ear canal electrodes in auditory brainstem response testing. American Journal of Otology .
Salamy, A., Fenn, E., & Bronshvag, M. (1979). Ontogenesis of human auditory brainstem evoked potential amplitude. Developmental Psychology, 12 , 519–526.
Salamy, A., & McKean, CM (1976). Postnatal development of human brainstem potentials during the first year of life. Electroencephalography and Clinical Neurophysiology, 40 , 418–426.
Salt, AN, & Thornton, AR (1983). The effects of stimulus rise-time and polarity on the auditory brainstem responses. Scandinavian Audiology, 13 , 119–127.
Schwartz, DM, Larson, VD, & DeChicchis, AR (1985). Spectral characteristics of air and bone conduction transducers used to record the auditory brainstem response. Ear and Hearing, 6 , 274–277.
Schwent, VL, Hillyard, SA, & Galambos, R. (1976). Selective attention and the auditory vertex potential. I. Effects of stimulus delivery rate. Electroencephalography and Clinical Neurophysiology, 40 , 604–614.
Seales, DM, Rossiter, VS, & Weinstein, MD (1979). Brainstem auditory evoked responses in patients comatose as a result of blunt head trauma. Journal of Trauma, 19 , 347–353.
Selters, WA, & Brackmann, DE (1977). Acoustic tumor detection with brainstem electric response audiometry. Archives of Otolaryngology, 103 , 181–187.
Sohmer, H., & Feinmesser, M. (1967). Cochlear action potentials recorded from the external ear in man. Annals of Otology, Rhinology, and Laryngology, 76 , 427–435.
Sohmer, H., & Feinmesser, M. (1973). Routine use of electrocochleography (cochlear audiometry) on human subjects. Audiology, 12 , 167–173.
Sohmer, H., & Feinmesser, M. (1974). Electrocochleography in clinical-audio logical diagnosis. Archives of Otolaryngology, 206 , 91–102.
Sohmer, H., Feinmesser, M., & Bauberger-Tell, L. (1972). Routine use of cochlear audiometry in infants with uncertain diagnosis. Annals of Otology, Rhinology, and Laryngology, 81 , 72–75.
Sohmer, H., Feinmesser, M., & Szabo, G. (1974). Electrocochleographic (auditory nerve and brainstem auditory nuclei) responses to sound stimuli in patients with brain damage. Electroencephalography and Clinical Neurophysiology, 37 , 663–669.
Sohmer, H., Gafni, M., & Chisin, R. (1978). Auditory nerve and brainstem responses: Comparison in awake and unconscious subjects. Archives of Neurology, 35 , 228–230.
Sohmer, H., & Pratt, H. (1976). Recording of the cochlear microphonic potential with surface electrodes. Electroencephalography and Clinical Neurophysiology, 40 , 253–260.
Squires, KC, Chu, N., & Starr, A. (1978). Acute effects of alcohol on auditory brainstem potentials. Science, 201 , 174–176.
Staller, S. (1986). Electrocochleography in the diagnosis and management of Meniere’s disease. Seminars in Hearing (Electrocochleography), 7 , 267–277.
Stapells, DR, & Picton, TW (1981). Technical aspects of brainstem evoked potential audiometry using tones. Ear and Hearing, 2 , 20–29.
Stapells, DR, Picton, TW, Perez-Abalo, M., Read, D., & Smith, A. (1985). Frequency specificity in evoked potential audiometry. In JT Jacobson (Ed.), The auditory brainstem response (pp. 147–177). San Diego, CA: College-Hill.
Stapells, DR, Picton, TW, & Smith, AD (1982). Normal hearing thresholds for clicks. Journal of the Acoustical Society of America, 72 , 74–79.
Starr, A., & Achor, LJ (1975). Auditory brainstem responses in neurological disease. Archives of Neurology, 32 , 761–768.
Starr, A., Amlie, RN, Martin, WH, & Sanders, S. (1977). Development of auditory function in newborn infants revealed by auditory brainstem potentials. Pediatrics, 60 , 831–839.
Stockard, JJ, Sharbrough, FW, & Tinker, JA (1978). Effects of hypothermia on the human brainstem auditory response. Annals of Neurology, 3 , 368–370.
Stockard, JJ, Stockard, JE, & Sharbrough, FW (1978). Nonpathologic factors influencing brainstem auditory evoked potentials. American Journal of Electroencephalogram Technology, 18 , 177–209.
Stypulkowski, PH, & Staller, SJ (1987). Clinical evaluation of a new ECochG recording electrode. Ear and Hearing, 8 , 304–310.
Suzuki, T., Hirai, Y., & Horiuchi, K. (1977). Auditory brainstem responses to pure tone stimuli. Scandinavian Audiology, 6 , 51–56.
Suzuki, T., & Horiuchi, K. (1977). Effect of high-pass filter on auditory brainstem responses to tone pips. Scandinavian Audiology, 6 , 123–126.
Suzuki, JI, & Yamane, H. (1982). The choice of stimulus in the auditory brainstem response test for neurological and audiological examinations. Annals of the New York Academy of Sciences, 388 , 731–736.
Teas, DC, Eldridge, DH, & Davis, H. (1962). Cochlear responses to acoustic transients and interpretation of the whole nerve action potentials. Journal of the Acoustical Society of America, 34 , 1438–1459.
Teas, DC, Klein, AJ, & Kramer, SK (1982). An analysis of auditory brainstem responses in infants. Hearing Research, 7 , 19–54.
Terkildsen, K., Osterhammel, P., & Huis int Veld, F. (1974). Far field electrocochleography: Electrode positions. Scandinavian Audiology, 3 , 123–129.
Thornton, ARD (1975). Statistical properties of surfacerecorded electrocochleographic responses. Scandinavian Audiology, 4 , 91–102.
Turner, RG, Frazer, GJ, & Shepard, NT (1984). Formulating and evaluating audiological test protocols. Ear and Hearing, 5 , 321–330.
Turner, RG, & Nielsen, DW (1984). Application of clinical decision analysis to audiological tests. Ear and Hearing, 5 , 125–133.
Turner, RG, Shepard, NT, & Frazer, GJ (1984). Clinical performance of audiological and related diagnostic tests. Ear and Hearing, 5 , 187–194.
van Olphen, AF, Rodenburg, M., & Verway, C. (1978). Distribution of brainstem responses to acoustic stimuli over the human scalp. Audiology, 17 , 511–578.
Wada, SI, & Starr, A. (1983a). Generation of auditory brainstem responses (ABRs). I. Effects of injection of a local anesthetic (procaine HCL) into the trapezoid body of guinea pigs and cat. Electroencephalography and Clinical Neurophysiology, 56 , 326–339.
Wada, SI, & Starr, A. (1983b). Generation of auditory brainstem responses (ABRs). II. Effects of surgical section of the trapezoid body on the ABR in guinea pigs and cat. Electroencephalography and Clinical Neurophysiology, 56 , 340–351.
Wada, SI, & Starr, A. (1983c). Generation of the auditory brainstem responses (ABRs). III. Effects of lesions of the superior olive, lateral lemniscus and inferior colliculus on the ABR in guinea pig. Electroencephalography and Clinical Neurophysiology, 56 , 352–366.
Weber, BA (1983). Masking and bone conduction testing in brainstem response audiometry. Seminars in Hearing, 4 , 343–352.
Weber, BA, Seitz, MR, & McCutcheon, MJ (1981). Quantifying click stimuli in auditory brainstem response audiometry. Ear and Hearing, 2 , 15–19.
Wever, EG, & Bray, CW (1930). Action currents in the auditory nerve in response to acoustic stimulation . In Proceedings of the National Academy of Sciences of the United States of America (Vol. 16, pp. 344–350).
Whitaker, SR, & Lewis, AE (1984). The clinical usefulness of extratympanic electrocochleography . Paper presented at the Midwinter Meeting of the Association for Research in Otolaryngology, St. Petersburg Beach, FL.
Worthington, DW, & Peters, JF (1980). Quantifiable hearing and no ABR: Paradox or error? Ear and Hearing, 1 , 281–285.
Yanz, JL, & Dodds, HJ (1985). An ear-canal electrode for the measurement of the human auditory brainstem response. Ear and Hearing, 6 , 98–104.
medscape
1. Dornhoffer JL, Helms J, Hoehmann DH. Presentation and diagnosis of small acoustic tumors. Otolaryngol Head Neck Surg. Sep 1994;111(3 Pt 1):232-5. [Medline].
2. Zappia JJ, O’Connor CA, Wiet RJ, Dinces EA. Rethinking the use of auditory brainstem response in acoustic neuroma screening. Laryngoscope. Oct 1997;107(10):1388-92. [Medline].
3. Chandrasekhar SS, Brackmann DE, Devgan KK. Utility of auditory brainstem response audiometry in diagnosis of acoustic neuromas. Am J Otol. Jan 1995;16(1):63-7. [Medline].
4. Gordon ML, Cohen NL. Efficacy of auditory brainstem response as a screening test for small acoustic neuromas. Am J Otol. Mar 1995;16(2):136-9. [Medline].
5. Schmidt RJ, Sataloff RT, Newman J, Spiegel JR, Myers DL. The sensitivity of auditory brainstem response testing for the diagnosis of acoustic neuromas. Arch Otolaryngol Head Neck Surg. Jan 2001;127(1):19-22.[Medline].
6. Cueva RA. Auditory brainstem response versus magnetic resonance imaging for the evaluation of asymmetric sensorineural hearing loss. Laryngoscope. Oct 2004;114(10):1686-92. [Medline].
7. Kehrle HM, Granjeiro RC, Sampaio AL, Bezerra R, Almeida VF, Oliveira CA. Comparison of auditory brainstem response results in normal-hearing patients with and without tinnitus. Arch Otolaryngol Head Neck Surg. Jun 2008;134(6):647-51. [Medline].
8. de Sousa LC, Colli BO, Piza MR, da Costa SS, Ferez M, Lavrador M. Auditory brainstem response: prognostic value in patients with a score of 3 on the Glasgow Coma Scale. Otol Neurotol. Apr 2007;28(3):426-8. [Medline].
9. ASHA Joint Committee On Infant Hearing. Year 2000 Position Statement: Principles and Guidelines for Early Hearing Detection and Intervention Programs. Available at: http://professional.asha.org.
10. Don M, Masuda A, Nelson R, Brackmann D. Successful detection of small acoustic tumors using the stacked derived-band auditory brain stem response amplitude. Am J Otol. Sep 1997;18(5):608-21; discussion 682-5. [Medline].
11. Doyle KJ. Is there still a role for auditory brainstem response audiometry in the diagnosis of acoustic neuroma?. Arch Otolaryngol Head Neck Surg. Feb 1999;125(2):232-4. [Medline].
12. Hall JW III. Handbook of Auditory Evoked Responses. Needham Heights, Mass: Allyn & Bacon; 1992.
13. Katz J. Handbook of Clinical Audiology. Baltimore, Md: Lippincott Williams & Wilkins; 1994.
14. Kileny PR, Niparko JK, Shepard NT, Kemink JL. Neurophysiologic intraoperative monitoring: I. Auditory function. Am J Otol. Dec 1988;9 Suppl:17-24. [Medline].
15. Lieu JE, Champion G. Prediction of auditory brainstem reflex screening referrals in high-risk infants.Laryngoscope. Feb 2006;116(2):261-7. [Medline].
16. Markand ON. Brainstem auditory evoked potentials. J Clin Neurophysiol. May 1994;11(3):319-42.[Medline].
17. National Institutes of Health. Acoustic Neuroma. NIH Consens Statement. 1991;9 (4):1-24.
18. Oudesluys-Murphy AM, van Straaten HL, Bholasingh R, van Zanten GA. Neonatal hearing screening. Eur J Pediatr. Jun 1996;155(6):429-35. [Medline].
Potenziali evocati uditivi a latenza Breve
Audiologic valutazione del gruppo di lavoro sulla Potenziali evocati uditivi Misure
Sommario
o Sfondo
o Portata
· Principi Strumentazione-Basic
o Elettrodi e elettrodi impedenza
o Analisi
o Schermatura e le questioni connesse
o Tecniche di registrazione: Tipo di elettrodo e Montage
o Applicazioni cliniche di elettrococleografia
· Misurazione della Auditory Brainstem Potenziali Evocati
o Tasso di ripetizione di stimoli
o Monofonico Versus Binaural Stimolazione
o Soggetto / variabili non-patologiche
o Interpretazione Diagnostica della valutazione ABR
· ABRs e ABR test in neonati e bambini
· Altri Potenziali evocati uditivi
Il gruppo di lavoro Potenziali evocati uditivi Misure si è costituita (a) per esaminare le prove ed elevare il grado di consenso esistente rispetto alle variabili procedurali e strumentazione nell’applicazione della sensibilità uditiva e (b) fornire un rapporto che è altamente specifico la natura e lo scopo di essere un aggiornamento di stato-of-the-scienza sulla metodologia.
In parziale risposta a tale mandato, il gruppo di lavoro scelto di sviluppare una panoramica di base o tutorial concentrata sul breve latenza potenziali evocati uditivi (AEPs). Questa classe di AEPs comprende le aree di elettrococleografia (ECochG) e la risposta uditivi del tronco encefalico (ABR) misura. Questi potenziali rappresentano risposte sensoriali o neurali da livelli più bassi del sistema uditivo. La latenza termine è usato per descrivere il tempo di occorrenza di un dato potenziale che, per questi potenziali, generalmente rientra 10 ms di dello stimolo. Questa restrizione portata è stata fatta in considerazione della voluminosa letteratura che ha sviluppato circa la breve potenzialità latenza. Nonostante la rapida espansione delle informazioni continua, principi di base si possono trarre dalla ricerca e l’esperienza clinica con queste potenzialità.
AEPs latenza brevi sono popolari per la valutazione elettrofisiologica di otologia e compromissione neurologica. La stabilità di queste potenzialità oltre lo stato soggetto, la relativa facilità con cui possono essere registrati, e la loro sensibilità alle disfunzioni dei sistemi uditivi periferici e del tronco cerebrale li rende particolarmente adatti per l’applicazione clinica. Tuttavia, l’applicazione clinica delle misure AEP richiede la comprensione di alcune variabili procedurali e soggetti.
Le brevi potenzialità di latenza sono piccola ampiezza, potenziali di campo lontano; cioè, essi sono iscritti ad una certa distanza dalle loro fonti. Sono necessarie tecniche sofisticate per misurare queste potenzialità, perché sono sepolti in uno sfondo di rumore fisico e fisiologico. Inoltre, variabili come l’età del soggetto, il sesso, e la temperatura interna e lo stato del esterno, medio e orecchio interno possono prevedibilmente influenzare queste risposte. I modi in cui questi fattori influenzano la misurazione, analisi, e / o interpretazione dei brevi potenzialità di latenza sono discussi in questo rapporto.
L’intento di questo documento non è quello di mandato una serie di standard per la misurazione e la valutazione dei AEPs latenza brevi. Piuttosto, l’obiettivo è quello di presentare un background di informazioni che il gruppo di lavoro ritiene essere necessarie per una comprensione di base di queste misure. L’audiologo che desiderano entrare questo settore di studio clinico è incoraggiato a seguire corsi appropriati e cercare esperienze cliniche supervisionate. Inoltre, numerosi testi su questo argomento sono apparsi che possono essere riferimenti utili (vedi Glattke 1983; Hood & Berlino, 1986; Jacobson, 1985; Moore, 1983).
Il tutorial è diviso in tre sezioni principali. Le prime, principi Strumentazione-base, presenta strumentazione per metodi sia per la generazione di stimolo e la registrazione e di analisi che sono comuni a ECochG non invasiva e la misurazione ABR. La seconda sezione, elettrococleografia, i dettagli della registrazione, di stimolo, e le variabili oggetto relativo a questo argomento. Queste sezioni volutamente precedono il trattamento specifico della misura di uditivi del tronco encefalico Potenziali Evocati (l’ultima sezione) perché le informazioni nelle prime due sezioni è fondamentale per la comprensione delle potenzialità del tronco cerebrale. Il lettore è invitato vivamente di leggere questo documento, dall’inizio alla fine, perché ogni sezione parte dal presupposto che le sezioni precedenti sono state lette e comprese.
La comprensione dei potenziali evocati come (EPS) sono registrati e analizzati richiede la comprensione di alcuni principi di strumentazione. Alcuni di questi concetti sono affrontati in sezioni che seguono.
Elettrodi e elettrodi impedenza
Il corpo umano è un campo di attività elettrica continua. Le fonti di questa attività possono comprendere contrazioni muscolari, risposte di organi terminali sensoriali ed eventi neurali del sistema nervoso centrale e periferico. Questi eventi elettrici sono spesso condotti alla superficie del corpo in forma attenuata e possono essere registrati con metodi e attrezzature adeguate. Tuttavia, è difficile misurare la AEPs perché sono piccoli in ampiezza e sepolto in uno sfondo di rumore elettrico. In aggiunta a questi problemi sono le caratteristiche elettricamente isolante della pelle, in particolare lo strato più esterno, lo strato corneo e lo strato di pelle morta. C’è anche una differenza fondamentale tra elettricità biologica e fisica. Nei sistemi fisici, corrente elettrica è mediata tramite elettroni, mentre nei sistemi biologici è mediata tramite ioni, cioè atomi / molecole con una valenza netta positiva o negativa. Applicando un elettrodo, un conduttore metallico, alla pelle costituisce una barriera sul quale non vi può essere alcun trasferimento carica netta. Tale interfaccia si oppone o ostacola, flusso di corrente. Impedenza varia con la frequenza: nel presente contesto l’impedenza varia inversamente con frequenza perché l’interfaccia elettrodo-pelle agisce come un condensatore (Geddes 1972). Per le applicazioni discussi in questo tutorial, impedenza è generalmente valutata a una frequenza all’interno della gamma di circa 10-1000 Hz.
Impedenza dell’elettrodo è un prodotto dell’area di materiale elettrodico e la superficie, pelle, muscolo, o mucosa al quale è interfacciato e nulla in mezzo (ad esempio, olio, sporco, fluido, etc.). Argento, oro e platino hanno impedenze inferiori e potenziali semicella maggior parte degli altri metalli. Il potenziale semicella è una tensione che risulta dalla tendenza per la carica di costruire su ciascun lato dell’interfaccia dell’elettrodo, quanto l’elettrodo di una batteria. Il potenziale mezzo cellulare sarà destabilizzata da movimento meccanico, quindi un grande potenziale semi-cella rende la registrazione dei potenziali bioelettrici molto più vulnerabili al movimento artefatto. L’argento è un materiale particolarmente utile per la costruzione di elettrodi perché anche può essere placcato con sale, formando un cloruro d’argento argento (Ag-AgCl) dell’elettrodo, che ha un’impedenza ancora più basso ma richiede rechloriding regolarmente. A differenza di elettrodi di metalli o leghe di argento puro o altro, l’elettrodo Ag-AgCl è reversibile o non-polarizzata. Ciò significa che può essere usato per registrare (o pass) in corrente continua (DC) ed esegue quindi ben a frequenze molto basse. L’impedenza è anche più basso quando l’elettrodo entra in contatto diretto con i fluidi corporei, anche solo sotto la superficie della pelle. Elettrodi ad ago forniscono tale contatto, ma non sono attraenti per il lavoro clinico di routine, perché la pelle deve essere perforata.
Buon contatto elettrico può essere realizzato utilizzando elettrodi di superficie. La pelle deve essere purificato accuratamente per rimuovere lo sporco, l’olio e la pelle morta superficiali. Un gel elettrolitico, pasta o crema è applicata per migliorare la conduttività dello strato di pelle morta, dare stabilità contatto, e aumentare efficacemente la superficie dell’elettrodo. Numerose tecniche per ottenere basse impedenze si trovano nei testi in elettroencefalografia (EEG, ad esempio, Binnie, Rowan, e grondaia, 1982). Impedenze interelettrodica, che sono le impedenze tra ogni possibile coppia di elettrodi, deve essere misurata sistematicamente e, di norma, non deve superare 5 kohm.
L’ampiezza di AEPs-registrato superficiali è piccolo rispetto all’ampiezza di fondo dell’attività elettro-fisiologico e rumore elettrico; Pertanto, è necessario migliorare il rapporto segnale-rumore (SNR). Valutazioni EP sono diventate routine possibile principalmente attraverso l’avvento e la disponibilità di relativamente piccole e poco costosi computer digitali che possono efficacemente svolgere il segnale di media. Computerizzata media del segnale riduce il rumore di fondo e la varianza nel potenziale suono suscitato. Il segnale registrato, che è una funzione continua del tempo, è rappresentato da un insieme di campioni discreti al computer, come illustrato in Figura 1a. Il campionamento del segnale avviene attraverso un processo noto come (AD) di conversione analogico-digitale, in cui l’ampiezza del segnale in un determinato punto nel tempo si traduce in un valore binario che può essere manipolato dal computer.
Figura 1. (A) campionamento digitale e la ricostruzione di un segnale analogico. (b) il segnale ricostruito campionato a due volte il tasso come in (a). Da “Strumentazione” di AC Coats, 1983 a EJ Moore (Ed.), Basi di tronco cerebrale evocati uditivi risposte (p. 210-211). New York: Grune & Stratton. Copyright 1983 da Grune & Stratton. Adattato con il permesso.

L’accuratezza con la quale un computer rappresenta la struttura fine, e quindi il contenuto di frequenza, è determinato, in parte, per il numero di punti campionati sulla forma d’onda (vedi figure 1a e 1b). Questo numero dipende dalla velocità massima di campionamento del processo di conversione AD, che è inversamente proporzionale a quanto tempo ogni conversione avviene. La quantità di tempo necessario per il convertitore AD e computer per campionare ogni punto è chiamato il tempo di sosta. La frequenza di campionamento determina quindi direttamente la risoluzione temporale della forma d’onda.
Risoluzione di ampiezza dipende dalla precisione numerica del convertitore AD, che è specificato dal numero di bit o luoghi nel numero binario che rappresenta il suo fondo scala di sensibilità. Ad esempio, supponiamo che un convertitore AD a 4 bit sono stati usati per misurare la tensione di una comune batteria torcia, e che questo convertitore AD aveva una sensibilità del ± 5 V. La tensione di una batteria torcia è 1,5 V. fabbricato da binario a decimale , i numeri che sono disponibili per rappresentare le tensioni misurate rientrano nell’intervallo da 0 a 15 (cioè, da nessun bit impostati tutti i bit impostati), come mostrato nella tabella 1. La tensione effettiva della batteria non rientra esattamente in una valore intero, ma non fa nessuno 0 V. Questo convertitore AD quindi poteva solo approssimare l’equivalente binario effettivo della tensione, e le eventuali tensioni compresi tra -0,33 V e 0,33 V sarà rappresentata da 0.
Tabella 1. Risoluzione di ampiezza di un convertitore AD a quattro bit.
|
Binario |
Decimale |
Voltaggio |
|
1111 |
15 |
+ 5.00 |
|
1110 |
14 |
+ 4.33 |
|
1101 |
13 |
+ 3.67 |
|
1100 |
12 |
+ 3.00 |
|
1011 |
11 |
+ 2.33 |
|
1010 |
10 |
+ 1.67 |
|
1001 |
9 |
+ 1.00 |
|
1000 |
8 |
+ 0,33 |
|
0111 |
7 |
– 0,33 |
|
0110 |
6 |
– 1.00 |
|
0101 |
5 |
– 1.67 |
|
0100 |
4 |
– 2.33 |
|
0011 |
3 |
– 3.00 |
|
0010 |
2 |
– 3.67 |
|
0001 |
1 |
– 4.33 |
|
0000 |
0 |
– 5.00 |
Media del segnale è necessaria perché le AEPs devono essere estratti da molto più rumore di fondo. Povero SNR è superata sommando numerose forme d’onda digitali, ogni tempestiva bloccato allo stimolo. Eventi sincroni che sono tempo-locked allo stimolo dovrebbe avere come fasi e quindi sarà sommare e “crescere” fuori dal rumore di fondo. Eventuali eventi che non sono bloccati tempo allo stimolo (cioè, la maggior parte del rumore di fondo) avranno fasi variabile casuale (d’epoca in epoca) e tenderà a cancellare, lasciando solo il segnale tempo-locked (forma d’onda). Il miglioramento SNR è proporzionale alla radice quadrata del numero di campioni che vengono sommati (media) (Picton & Hink 1974). Pertanto, aumentando il numero di campioni di un fattore 4 aumenterà il SNR di un fattore s4 = 2. Uno dei fattori limitanti di miglioramento SNR è la precisione della conversione AD. Risoluzione otto bit sembra essere sufficiente per misure di potenziale più evocati. Attuali strumenti di test commerciali impiegano convertitori 8-12 bit.
La piccola ampiezza di EP-registrato di superficie richiede l’uso di amplificazione prima di segnalare media. L’obiettivo è non solo di amplificare le potenzialità registrati, ma anche di ottimizzare il campionamento di tensione per il potenziale desiderato respingendo segnali indesiderati comuni a ciascuno degli ingressi dell’amplificatore. Questo principio è illustrato nella Figura 2 L’amplificatore differenziale ha un ingresso che inverte. (-) Ed uno che non invertire (+) il segnale all’uscita dell’amplificatore. Il segnale amplificato è la differenza tra i due ingressi; specificamente questo segnale è la differenza algebrica tra i due ingressi ad ogni istante di tempo. Qualsiasi segnale comune a entrambi gli ingressi è quindi annullati o respinti; questo è noto come reiezione di modo comune (CMR). Ciascun canale di controllo richiede un elettrodo come terra e due elettrodi a raccogliere il potenziale desiderato. Tutti e tre gli elettrodi generalmente sono posti sulla testa per le registrazioni del PE. La maggior parte dei reperti miogeniche e rumori elettrici estranei appariranno nei due siti elettrodi con quasi uguali ampiezze e fasi a causa della loro vicinanza e, pertanto, saranno respinte. Altri segnali non sarà respinto e, in effetti, può essere migliorata, come illustrato dalla Figura 2. Segnali di modo comune possono essere più grandi di segnali differenziali, a seconda della posizione degli elettrodi rispetto alla posizione e l’orientamento della sorgente del potenziale desiderato. I dettagli di posizionamento degli elettrodi saranno discussi in seguito nel contesto di procedure di test specifici.
Figura 2. Rinforzo differenziale. Il segnale ad alta frequenza è di modo comune (stessa ampiezza e fase ai due ingressi) ed è respinto. Al contrario, il segnale a bassa frequenza è di fase opposta e si arricchisce.

Ci sono diverse specifiche dell’amplificatore (talvolta indicato come un preamplificatore) che sono importanti. Uno è quantità di CMR, che di solito è specificato in decibel ed è definita come la quantità di riduzione dell’ampiezza dei segnali comuni. Disponibili in commercio amplificatori bioelettrici sono capaci di sostanze CMR di 80-120 dB, il che è sufficiente per le misure del PE. Non si può sempre presumere, tuttavia, che l’amplificatore sia correttamente regolata per permettere questa quantità di CMR, e un controllo occasionale e forse riaggiustamento (come da raccomandazioni del fabbricante) sono obbligatori. Sebbene CMR dipende dall’equilibrio tra gli elettrodi, se impedenze elettrodo sono meno di 5 kohm, quindi rischi di equilibrio sono ridotti a causa della elevata impedenza di ingresso di amplificatori differenziali. L’impedenza di ingresso deve essere di almeno 1 Mohm, in modo da non trarre alcuna quantità significativa di corrente dagli elettrodi.
Il guadagno dell’amplificatore dipende dalla gamma di tensione di fondo scala del convertitore AD e requisiti minimi di ingresso tensione. Valori tipici di guadagno per i sistemi di risposta evocati vanno da 10.000 a 500.000. L’obiettivo è quello di presentare il convertitore AD con un segnale la cui tensione è quasi piena scala. Ad esempio, se un convertitore AD sono stati usati con un ± 5 V (cioè, 10 V fondo scala) e il segnale registrato (compreso il rumore di fondo) erano 10 mV (0,00001 V) da picco a picco, quindi un guadagno di circa 100.000 ( vale a dire, 10 / 0,00001) sarebbero necessari.
Tutti i circuiti elettrici creano un po ‘di rumore termico, e questo rumore possono essere amplificati. Rumore interno dovrebbe essere inferiore a 10 mV picco-picco per massimizzare miglioramento SNR raggiunto il valore medio. L’amplificatore dovrebbe anche essere in grado di sopportare la presenza accidentale di tensioni relativamente alte di tutti i suoi ingressi o overvoltaging, e dovrebbe essere in grado di recuperare speditamente. Una certa quantità di maltrattamento dell’amplificatore è inevitabile in situazioni cliniche. Un esempio è la rimozione degli elettrodi dal soggetto prima di scollegare loro e girando l’elettrodo con ciò conduce in antenne per rumore elettrico dalle luci e cavi della zona di prova. L’amplificatore deve essere in grado di prendere tali abusi senza guasto elettronico. Overvoltaging riflette la saturazione dell’amplificatore. Pertanto, è importante che non si verificano durante overvoltaging risposta media perché questo tipo di amplificazione lineare può influenzare il processo di media del segnale. Tecniche come rifiuto artefatti sospendere media durante overvoltaging e il successivo periodo di recupero. Infine, al basale (cc) deriva dovrebbe essere trascurabile per assicurare la stabilità sessioni di test lunghi.
Tutte queste caratteristiche sono facilmente soddisfatta dai moderni amplificatori bioelettrici. Tuttavia, i produttori di apparecchiature di prova EP forniscono alcuni protocolli per la verifica di questi parametri e in genere non danno le specifiche di amplificazione nei loro manuali.
Gli spettri della maggior parte EP sono concentrati in modo tale che la maggior parte del rumore di fondo può essere rimosso mediante filtrazione. Il filtraggio può essere fatto prima e / o dopo la media del segnale, ma alcuni prefiltraggio solito è incorporato nel (pre) processo di amplificazione, prima media. Filtering deve essere applicata giudiziosamente e con la consapevolezza che potrebbe alterare la forma d’onda del potenziale desiderato e può influenzare le misurazioni di latenza e ampiezza. Filtraggio analogico introduce sfasamenti che diventano sempre più gravi come la frequenza di taglio del filtro raggiunge i limiti di frequenza più bassa dello spettro del potenziale. Non tutti i componenti di un potenziale registrata sono ottimamente filtrati utilizzando le stesse impostazioni di filtro e / o le caratteristiche di risposta del filtro. Al contrario, non tutti i potenziali o componenti sono interessate nello stesso modo da una determinata risposta del filtro. In alcuni amplificatori di registrazione un solo stadio (unipolare), (resistenza-capacità) filtro passivo è usato che fornisce una pendenza rifiuto di 6 dB / ottava. Altri possono avere due o più fasi e / o utilizzare uno dei vari circuiti filtro attivo per fornire altre caratteristiche di risposta e / o pendenze rifiuto superiori. La frequenza di taglio generalmente è specificato nel punto di metà potenza della risposta del filtro, che è la frequenza alla quale la risposta del filtro è di 3 dB dalla risposta massima.
È auspicabile filtro passa-alto, o coppia ac, per eliminare potenziali molto bassa frequenza e cc. Questi potenziali causare deriva nella linea di base della registrazione e tendono a rendere le registrazioni vulnerabile agli artefatti da movimento. L’amplificatore differenziale front-end è dc accoppiato, in modo che il giunto filtraggio o ac avviene in una fase successiva di amplificazione. Di conseguenza, la cura deve essere esercitata per ridurre al minimo la presenza di grandi DC o potenziali molto basse frequenza alternata agli ingressi dell’amplificatore. Ciò può essere realizzato utilizzando una preparazione adeguata pelle, utilizzando elettrodi grandi a superficie e reversibili per mantenere impedenze basse, e riducendo al minimo il movimento dell’elettrodo.
Filtro passa-basso è necessario perché il rumore ad alta frequenza può essere sovrapposto per il rintracciamento e può oscurare l’identificazione di picco EP. L’uso di filtro passa-basso è anche determinata dalla frequenza di campionamento del convertitore AD. Di conseguenza, vi è un limite di frequenza superiore per lo spettro ammissibile del segnale elaborato. Se si supera questa frequenza, c’è avvolgente o aliasing dello spettro del segnale, in cui le frequenze sopra una certa frequenza sono rappresentati come frequenze più basse in modo prevedibile. Poiché ci devono essere almeno due punti di campionamento per definire un ciclo di una forma d’onda, il limite superiore delle frequenze ammissibili è una metà della frequenza di campionamento della conversione AD (ad esempio, 5000 Hz se la frequenza di campionamento è 10000 Hz). La frequenza più alta consentita è chiamata frequenza di Nyquist (Nyquist, 1924). Ad esempio, un segnale complesso composto da 3000 Hz e 6000 Hz apparirà essere costituito da componenti 3000 Hz e 4000 Hz se la frequenza di campionamento è 10000 Hz (frequenza di Nyquist è di 5000 Hz). Questo si verifica perché 6000 Hz supera la frequenza Nyquist ed è rappresentata a sua frequenza di 4000 Hz aliasing (questa è la differenza tra la frequenza di campionamento e la vera frequenza da analizzare o 10000 Hz 6000 Hz in meno). In pratica è necessario essere ancora più conservativa se la forma d’onda reale è di essere adeguatamente riprodotte, come è il caso in opera risposta evocata. Un limite massimo inferiore o uguale a metà della frequenza di Nyquist o un quarto della frequenza di campionamento (nell’esempio precedente, -2500 Hz) è più appropriato (Picton & Hink 1974).
Alcuni rumori ad alta frequenza è destinato a rimanere, anche con filtro passa-basso. Questo può essere trattata con una qualche forma di filtraggio o alberino smoothing, che è una forma di filtro passa-basso. Molti sistemi di segnale delle medie, forniscono un certo tipo di funzione levigante. L’approccio più comune è la media mobile in cui ciascun punto è media con uno o più punti adiacenti. Bisogna fare attenzione che l’algoritmo di smoothing per sé non causa ritardi o che tali ritardi sono correggibile. In generale, il filtraggio digitale fornisce più precisi gonne filtra e sfasamento nullo, minimizzando i problemi associati con filtraggio analogico e alcuni algoritmi di livellamento. Anche se il filtraggio digitale è diventato più ampiamente disponibile, molti strumenti ancora utilizzano una combinazione di filtraggio analogico e smoothing digitale.
Registrazione di una risposta ben definita dipende dal SNR iniziale, il numero di campioni in media, e la misura in cui il rumore di fondo è veramente casuale. È possibile che un evento si verifichi durante media che non può essere interrotto da un certo numero di campioni clinicamente pratico. Ad esempio, una rondine accidentali può creare un grande manufatto electromyogenic che non possono essere mediati. Media segnale può fornire notevole riduzione del rumore, anche con la presenza di tali fluttuazioni incidentali nel rumore di fondo; Tuttavia, generalmente è preferibile escludere insolitamente grandi campioni di rumore di ampiezza.
Molti manufatti incontrati nelle registrazioni EP sono sufficientemente grandi in relazione al potenziale desiderato che possono essere esclusi sulla base della loro ampiezza. Più diffuse sul mercato sistemi di test disponibili includono la possibilità di specificare una finestra di ampiezza di ingresso accettabile o la regolazione della sensibilità di ingresso durante il test per i campioni che superano fondo scala. Schemi di rifiuto artefatto sono più efficaci per eliminare campioni contenenti picchi di tensione accidentale, ma sono relativamente inefficaci nell’affrontare continuamente elevati livelli di rumore. L’aumento della soglia di rifiuto artefatto o ridurre il guadagno dell’amplificatore solo ammette più rumore senza migliorare il SNR perché il SNR è sostanzialmente invariato.
Schermatura e le questioni connesse
L’amplificazione richiesta per la registrazione della breve latenza e altri AEPs rende facile raccogliere disturbi elettrici estranei via elettrostatica e / o accoppiamento elettromagnetico. Il primo è esemplificato dalla ricezione di 60 rumore Hz da una luce fluorescente, e quest’ultimo è esemplificato dalla ricezione di 60 rumore Hz indotta nel circuito amplificatore per irraggiamento da un trasformatore di potenza, macchine elettriche, o cablaggio elettrico intorno alla camera di prova. I campi elettromagnetici sono anche creati da auricolari e trasduttori simili, e sono la fonte più importante di stimolo artefatto. Precauzioni per ridurre al minimo tali artefatti includono l’attenta separazione dei cavi auricolari dai fili degli elettrodi, drappeggi l’elettrodo porta vicino al corpo del soggetto, calza e / o schermatura porta elettrodi, e rendendo l’elettrodo porta più breve pratico.
Auricolari possono essere schermati elettromagneticamente mediante uno o più strati di mumetal (Elberling & Salomon 1973), un materiale che tende a favorire la cancellazione del campo magnetico. Fornisce inoltre protezione elettrostatica se si fonda. Il modo in cui è applicata, tuttavia, può alterare l’acustica del trasduttore.
Un modo particolarmente efficace per ridurre gli artefatti di stimolo è stato descritto da Sohmer e Pratt (1976), in cui un tubo è utilizzato per accoppiare l’auricolare all’orecchio del soggetto e quindi creare una linea di ritardo acustica. C’è stato un crescente interesse per l’uso di alcuni tipi di auricolari inserti, che forniscono il vantaggio dell’effetto di linea di ritardo (ad esempio, vedere Clemis, ballata, e Killion 1986). Ci ora sono commercialmente disponibili auricolari inserto con caratteristiche di uscita simili al Telephonics TDH-39 auricolare. L’unità trasduttore è posizionato lontano dall’orecchio, e il suono viene diretto attraverso un tubo di plastica flessibile che è accoppiato al condotto uditivo con un tappo auricolare. Il ritardo imposto dal tubo deve essere preso in considerazione nel determinare latenze di risposta assoluti, in modo da ottenere valori coerenti con quelli ottenuti con gli auricolari convenzionali. Latenze ottenuti con questo tipo di inserto auricolare saranno diverse decine di millisecondi o più lungo rispetto a quelli osservati da risposte stimolate tramite gli auricolari convenzionali. Inserire auricolari hanno il vantaggio aggiunto di maggiore comfort e più attenuazione intraurale, riducendo la necessità di mascheramento dell’orecchio nontest.
Interferenza da 60 Hz rumore può essere minimizzato scegliendo tassi stimolo tale che l’intervallo interstimulus uguale un multiplo dispari di una metà del periodo di 60 Hz (cioè 8.333 msec). Ad esempio, a 17 stimoli al secondo, l’intervallo interstimulus = 1/17 = 58,8 ms ~ 7 x 8.333 ms. Analogamente, stimolo manufatto può essere ridotto presentando stimoli di polarità alternata / fase o fasi variabile casuale. Qualche cautela deve essere esercitato in applicazione di tale metodo in quanto, se c’è una distorsione nella artefatto stimolo, la cancellazione non sarà completa. Cancellazione con fasi alterne anche in grado di oscurare potenziali che possono essere desiderati. Infine, alcuni strumenti commerciali forniscono la possibilità di azzeramento della parte iniziale del tracciato risposta in cui il manufatto è prominente. Questo può ridurre al minimo gli effetti di stimolo manufatti su scala risposta ma non elimina artefatti o loro effetti sulla qualità delle risposte registrate.
La corretta cablaggio elettrico dei sistemi di produzione e registrazione sonora risposta è importante, non solo per ridurre al minimo gli artefatti elettrici, ma anche per ridurre al minimo i pericoli elettrici (Pfeiffer, 1974). Evocati apparecchiature di prova risposta dovrebbe essere valutato per la sicurezza elettrica secondo le norme pubblicate (ad esempio, della Commissione congiunta sulla Accreditamento degli Ospedali, 1987). Un sistema di EP non dovrebbe mai essere utilizzato senza un intatto a tre punte, spina di tipo ospedaliero, né deve essere collegata a una presa elettrica non è noto per essere liberi di guasti a terra. L’uso di un adattatore tre a due poli è inaccettabile. Lo strumento di prova e presa a cui è collegato devono essere controllati da un elettricista qualificato o responsabile della sicurezza elettrica. L’uso di apparecchiature difettose, cablaggio difettoso, o la messa a terra improprio deve essere evitato.
È necessario tenere conto della posizione di test risposta evocata, sia per quanto riguarda la schermatura elettrica ed acustica. Una camera di isolamento del suono metallico, progettato appositamente per schermatura elettromagnetica ed elettrostatica, è ideale ma non essenziale in ogni situazione. La necessità dipende dall’ambiente elettrico e acustico. Poiché il test di solito è fatto sotto gli auricolari, un ufficio tranquillo può risultare adeguata per alcune applicazioni (per esempio, le valutazioni otoneurologic coinvolgono solo stimolazione di alto livello).
Il determinante finale della fedeltà con cui la forma d’onda del PE è riprodotto dipende dal modo in cui i dati sono tracciati. In caso di plotter digitali, in cui le coordinate X e Y sono cambiati in passi, la riproduzione sarà fedele alla forma dell’onda digitalizzato, tranne che ci sarà sempre un carattere leggermente frastagliato nei dettagli della forma d’onda a causa della rafforzamento dell’azione della penna (un po ‘come la forma d’onda mostrata nella Figura 1b). La scorrevolezza del tracciato dipende dalla risoluzione associato con l’analisi, il tasso al quale il plotter funziona e caratteristiche dello strumento che sono raramente sotto il controllo dell’utente.
Il outputting di dati tramite dispositivi analogici, come il plotter XY, richiede digitale-analogico (DA) conversione dei dati nella memoria del computer. Alcune delle stesse considerazioni riportate alle conversioni AD applicare alla conversione DA sebbene, in pratica, le richieste sono molto meno in termini di tempo di permanenza e la risoluzione.
Spettro:. Clic Versus Bursts tono stimoli temporalmente concise producono scariche neuronali sincronizzate ed EP robuste. Sfortunatamente, la specificità temporale dello stimolo è ottenuta a scapito della specificità di frequenza. Un click un suono ottenuta applicando un impulso dc a un auricolare o altoparlante (Figura 3a.1), e fornisce un eccellente stimolo per suscitare brevi potenziali latenza. Il suo esordio improvviso e breve durata contribuiscono alla buona sincronizzazione, ridurre al minimo stimolo artefatto, e di fornire un ampio spettro che stimola molte fibre nervose. Tuttavia, la risposta in frequenza di auricolari può alterare lo spettro di un impulso dc (Figura 3a.2). Il sistema uditivo si filtra anche lo stimolo. Così, ci sono sempre limiti di frequenza imposti al potenziale click evocati (Durrant 1983).
Figura 3. (A.1) uscita acustica di un auricolare (Telephonics TDH-39) in risposta a fasi dirigere impulsi di corrente applicati all’ingresso auricolare, producendo scatti avviate mediante condensazione (con.) O rarefazione (RAR.). (a.2) Spettro dell’uscita acustica, che è il clic (linea continua), contro l’impulso elettrico (linea tratteggiata) che guida l’auricolare. Da “Fondamenti di suono Generation” di JD Durrant, a EJ Moore (Ed.), Base di tronco cerebrale evocati uditivi risposte (p. 31). New York: Grune & Stratton. Copyright 1983 da Grune & Stratton. Adattato con il permesso. (b) Spettro di una breve raffica tono, mostrando principali bande laterali lobo centrale.

Quando si desidera specificità frequenza, possono essere utilizzati impulsi sinusoidali (Pip tono o burst) o passa-banda clic filtrati. Poiché tali stimoli sono transitori, i loro spettri sono caratterizzati da energia diffusa in tutto il frequenza nominale o al centro (Figura 3b). Impulsi sinusoidali producono potenziali latenza brevi cui latenze variare in funzione della frequenza (per una data intensità), che riflette piuttosto il tempo di propagazione dell’onda viaggiante nella coclea (Naunton & Zerlin 1976). Livelli di rilevamento visivi (VDLs) dei potenziali nervose e uditiva del tronco encefalico indotte da clic filtrati e brevi raffiche di tono correlano abbastanza bene con soglie audiometriche a frequenze e al di sopra 500 Hz. Questo accordo aggiunge credibilità al presupposto che la regione frequenza appropriata della coclea sta generando la risposta.
Ci sono alcune difficoltà con l’uso di impulsi sinusoidali o clic filtrati. Innanzitutto, ci può essere un vasto modello di eccitazione nella coclea ad alti livelli di stimolo (Bekesy, 1960; Durrant, Gabriel, e Walter 1981). Questo è vero anche per sinusoidi allo stato stazionario, sinusoidi gated, e clic. In secondo luogo, vi è ancora una intensità spostamento latenza dipendente, proprio come nel caso della stimolazione banda larga click, riflettendo la diffusione basalward di eccitazione a intensità più elevate (Folsom, 1984). In terzo luogo, il cambiamento di latenza riflette frequenza, in parte, una variazione del tempo di salita dello stimolo (ad esempio, più a frequenze più basse). In quarto luogo, vi è una maggiore possibilità di contaminazione da stimolo artefatto con questi stimoli più lunghi rispetto al clic. Infine, le ampiezze delle EPs latenza brevi diminuiscono e la forma d’onda è meno nettamente definita come la frequenza diminuisce stimolo, in particolare inferiore a 1000 Hz.
Fattori temporali. Ci sono vari parametri temporali associati con la stimolazione, in particolare per quanto riguarda l’uso di pacchetti di toni. Questi includono durata plateau, salita / discesa durata, e la funzione di gating o finestre da cui si forma l’inviluppo di ampiezza della sinusoide (ad esempio, rettangolare, coseno, accesso, ecc). Le brevi potenzialità di latenza sono relativamente insensibili alla durata altopiano dello stimolo perché sono risposte in gran parte insorgenza. La durata ascesa-caduta, tuttavia, influisce queste risposte. In generale, più lento è il tempo di salita, minore è l’ampiezza e più lunga la latenza della risposta evocata. I conseguenti variazioni delle EPs presumibilmente sono il risultato della diminuzione della sincronizzazione degli scarichi dello stimolo, la concomitante diminuzione dell’ampiezza stimolo vicino l’istante di inizio, e la larghezza di banda stretta dello stimolo come tempo di salita stimolo viene aumentato. La forma della funzione di gating influenza anche lo spettro di stimolo, e alcune funzioni ha maggiore concentrazione di energia di altri nel lobo principale spettrale e minore energia nelle bande laterali (Harris, 1978; Nuttall, 1981).
Frequenza di ripetizione stimolo è anche un parametro importante. La frequenza di ripetizione dello stimolo deve essere sufficientemente bassa da impedire ogni adattamento della risposta. Tassi di ripetizione di 10 / secondo o meno non hanno effetti significativi brevi potenzialità di latenza, ma i tassi di 20 / secondo o più sono spesso soddisfacenti per scopi clinici. Tassi più alti migliorano l’efficienza di raccolta dei dati, ma compromettono l’identificazione di una risposta o alcune onde componente del PE, in particolare in alcuni casi patologici. Perché ci sono effetti del crescente tasso di ripetizione specifiche per ciascuno dei brevi potenzialità di latenza, ulteriori discussioni sarà riservato per più tardi.
Calibrazione degli Stimoli. Calibrazione dello stimolo test è parte integrante della valutazione della risposta evocata. L’intensità di un clic è frequentemente segnalata dBnHL, che è il numero di decibel sopra la soglia comportamentale di un gruppo di ascoltatori normali. (Nota: questa misura è stata definita in modo variabile in letteratura come Nhl, HL, nSL o SL.) Anche se la NHL può servire da riferimento clinica utile, non fornisce una misurazione fisica di intensità che consente controlli di uscita dello stimolo o confronti tra cliniche. Le procedure di calibrazione sono difficili a causa della natura transitoria degli stimoli impiegati. Metri del suono di livello tipicamente utilizzati per la calibrazione audiometrico richiedono segnali a lunga durata per la misurazione accurata. Diverse tecniche devono essere utilizzati per misurare l’ampiezza di brevi stimoli.
Anche se nessuna procedura di calibrazione standard esiste per clic e altri transienti, un approccio popolare è quello di determinare il livello di picco di pressione acustica equivalente (peSPL). Questa misurazione si ottiene utilizzando un oscilloscopio per corrispondere l’ampiezza di un’onda sinusoidale con l’ampiezza di picco del click stimolo. L’ampiezza del tono puro lunga durata può essere misurata su un fonometro. Stapells, Picton, e Smith (1982) hanno dimostrato che 0 dBnHL per i clic si verifica in circa il 30 dB peSPL. Una procedura alternativa è quella di utilizzare un fonometro che può catturare transitori quali i clic.
Stimolo polarità non influenza lo spettro di ampiezza (Figura 3a), ma può influenzare le brevi potenziali latenza. Pertanto, è essenziale per misurare la fase di avvio del segnale per determinare se lo stimolo inizia con condensa o rarefazione (Figura 3a.1). La fase dello stimolo può essere esaminato connettendo l’uscita di un fonometro ad un oscilloscopio e confrontare la fase dello stimolo della variazione di pressione noto (Cann & Knott 1979).
Lo spettro dello stimolo deve essere misurato se la strumentazione disponibile. Le caratteristiche temporali della forma d’onda di stimolo anche devono essere esaminati. La risposta transitoria di un auricolare dovrebbe essere caratterizzato da minimi di chiamata (cioè superamenti minimi alla insorgenza e offset dello stimolo). La forma d’onda dovrebbe essere esaminato per le modifiche che possono verificarsi nel corso del tempo, soprattutto con un auricolare che può essere stato fatto cadere o altrimenti abusato. Per garantire stimoli acustici comparabili a ogni orecchio, i due auricolari dovrebbero creare stimoli di forme d’onda quasi identici. Ancora una volta, tali osservazioni possono essere fatte con l’aiuto di un fonometro accoppiato ad un oscilloscopio. Se un oscilloscopio non è disponibile, allora il sistema della compensazione segnale può essere utilizzato (Weber, Seitz, McCutcheon e 1981).
Infine, nel determinare i livelli di udito, il metodo psicofisico per la misurazione della soglia e il numero e il tasso di presentazioni di stimolo sono fattori importanti. L’integrità della audizione del campione di gruppo normativo deve essere affermato. Tutti questi fattori devono essere documentati e fatto riferimento nel disciplinare livello uditivo fino al momento che una norma nazionale si sviluppa. Per ulteriori discussioni approfondite su questi e altri aspetti della taratura stimolo (per esempio, la scelta e l’effetto di durata dell’impulso per la stimolazione click), si rimanda ai capitoli da Durrant (1983) e Gorga, Abbas, e Worthington (1985).
Conduzione ossea. Nel audiometria convenzionale l’entità delle lesioni conduttivi è verificata confrontando soglie ottenuti per via aerea contro stimoli conduzione ossea. E ‘anche possibile utilizzare questo approccio nelle valutazioni di AEPs (sebbene lesioni conduttivi si manifestano in altri modi, come discusso di seguito).
Gli sforzi fino ad oggi per integrare stimolazione conduzione ossea a testare le potenzialità breve latenza si sono concentrati intorno all’uso dei tradizionali vibratori ossei audiometrici con strumenti di test AEP (vedi Schwartz, Larson, e DeChicchis 1985). Purtroppo, anche quando le uscite cuffie e ossa vibratori sono corretti per i livelli di sensazioni uguali (per i clic), la conduzione ossea ha suscitato la risposta è in ritardo di 0,5 ms o più (Weber, 1983). Alcuni ricercatori hanno attribuito questo ritardo ai poveri risposta ad alta frequenza del vibratore osseo (Mauldin & Jerger 1979). Il vibratore osso tende ad avere un notevole picco spettrale compreso tra 1 e 2 kHz con una sostanziale roll-off nella risposta in frequenza sopra circa 1.6-2.5 kHz. Pertanto, i clic aria e conduzione ossea hanno diversi spettri. Questo è stato rivelato confrontando l’uscita auricolare misurata in 6 cm 3 cavità con l’uscita vibratore osseo misurato su un mastoide artificiale, nonché misure resi in termini di livelli acustici stimati (Schwartz et al. 1985).
L’uscita del vibratore è di circa 40 dB inferiore a quello degli auricolari, anche quando entrambi sono spinti a livelli di saturazione dell’uscita, proprio come nel caso di audiometria tono puro. Tuttavia, i livelli acustici realizzabili (ad esempio, 40-50 dB) consentono solo relativamente lievi perdite uditive conduttive da quantificare. Pertanto, l’assenza di un potenziale di click-evocato da conduzione ossea non implica necessariamente di valore esclusivamente neurosensoriale; un grado moderato o più grave di perdita mista potrebbe essere coinvolto. Viceversa, a causa l’enfasi bassa frequenza della conduzione ossea click, una lesione conduttivo potrebbe essere erroneamente dedurre quando, in effetti, c’è una precipitosamente pendenza perdita ad alta frequenza. Tuttavia, questo problema può essere viziata con l’uso di timpanometria, riflessi acustici, e la misurazione di Wave I latenza.
C’è un altro problema con vibratori osso esistente. Come l’auricolare convenzionale, il vibratore osso è un dispositivo elettromagnetico ed emette quindi onde elettromagnetiche, causando stimolo manufatto. Il vibratore osso è in realtà un trasgressore peggio grazie alla sua efficienza inferiore (cioè, un elevato segnale di pilotaggio di tensione è necessario per ottenere lo stesso livello di ascolto di quello ottenuto utilizzando un auricolare).
Nonostante queste limitazioni, i produttori di audiometro risposta più evocati ora offrono opzioni conduzione ossea, e il sostegno è stato espresso per l’utilizzo di conduzione ossea nei test AEP (Berlino, Gondra, e Casey 1978; Mauldin & Jerger 1979, Weber, 1983). Test conduzione ossea può aiutare in proiezioni neonati e altre applicazioni audiologiche, ma, chiaramente, la cura deve essere presa per l’uso e l’interpretazione dei risultati ottenuti.
Elettrococleografia (ECochG) è un termine che è stato applicato ad una famiglia di tecniche elettrofisiologiche diretti specificamente verso la registrazione dei potenziali di stimolo legate generate dalla coclea e ottavo nervo. I tentativi di applicazioni cliniche di data ECochG indietro quasi per quanto la scoperta delle potenzialità cocleari da Wever e Bray (1930), ma le applicazioni pratiche non sono state realizzate fino alla fine del 1960. Tuttavia, il lavoro in questo settore è diminuito nel prossimo decennio come l’interesse clinico in ABRs ampliato. Recentemente, c’è stato un rinnovato interesse per ECochG a valutare e monitorare alcuni audiologici / disturbi otologici e neurologici, nel monitorare le procedure chirurgiche, e in integrando misure ABR (Ferraro, 1986).
Il record dei potenziali registrate tramite ECochG è chiamato electrocochleogram (ECochGm). Sebbene la ECochGm costituito da più di un potenziale elettrico (figura 4), il componente più evidente e più facilmente è registrato l’intero potenziale di azione dei nervi (AP) dell’ottavo nervo. L’AP è caratterizzato da una serie di uno a tre onde prevalentemente negativi, il maggiore dei quali è conosciuto come N1 (Figura 4). La componente AP N1 è la caratteristica più saliente del ECochGm (Coats, 1974).
Figura 4. Potenzialità dei componenti del electrocochleogram (umano) registrati dal canale uditivo con condensazione (C) e rarefazione (R) clicca stimoli: N1, principale componente del potenziale d’azione intero nervo (AP); CM, cocleare microfonica; SP, potenziale summating. Il CM e SP possono essere selettivamente migliorate manipolando le risposte R e C, come indicato. Ear-canale negativo (-EC) potenziali sono tracciate come deviazioni verso il basso. (Sulla base dei dati provenienti da Coats, 1981.)

I potenziali stimolo connessi generati dalle cellule cigliate (cioè, prima eccitazione del nervo uditivo) sono microfonico cocleare (CM) e il potenziale summating (SP). Il CM ha una forma d’onda simile allo stimolo. Per esempio. se un burst tono è presentato, si registra una tensione sinusoidale. Il potenziale registrata, tuttavia, spesso è asimmetrica, con offset dal basale suo asse zero. Ciò è dovuto alla presenza del SP. Il SP può essere isolato tramite filtrazione passa-basso o cancellazione di fase del CM (Figura 4). A seconda della combinazione di parametri di stimolo e sito di registrazione e metodo, il SP può essere sia di polarità positiva o negativa. Quando indotta da uno stimolo transitorio quale un click, SP appare come una deviazione transitoria in cui il AP è sovrapposta e forma uno spallamento sul bordo della forma d’onda AP, come mostrato nella Figura 4 (cappotti, 1981). Per una spiegazione più ampia di questi potenziali, si rimanda al Dallos (1.973) e Durrant e Lovrinic (1984).
Tecniche di registrazione: Tipo di elettrodo e Montage
Ci sono due tecniche di registrazione generali disponibili per ECochG. Un metodo comporta l’inserimento di un elettrodo ad ago attraverso la membrana timpanica (TM) in appoggio sul promontorio cocleare. La natura invasiva di questo approccio ha limitato le sue applicazioni negli Stati Uniti. Per questo motivo, l’utilizzo di transtimpanica ECochG non sarà considerato direttamente in questa discussione. Tecniche timpanica (Extra) utilizzano la registrazione elettrodi posti sulla superficie laterale del TM o nel condotto uditivo. Cullen, Ellis, Berlino, e Lousteau (1972) prima descritto un metodo di registrazione superficie extratympanic utilizzando un elettrodo sfera d’argento avvolto in un tampone di cotone imbevuta di soluzione salina e posto dopo il TM. Questa tecnica fornito buoni risultati con il minimo disagio per il soggetto, anche se il soggetto è stato richiesto di sdraiarsi, e lo stimolo doveva essere presentata via campo sonoro. Un elettrodo extratympanic recentemente progettato (Stypulkowski & Staller, 1987) ha riacceso interesse per questo approccio per ECochG in quanto evita in gran parte i problemi con vecchi disegni.
Cappotti (1974) hanno introdotto un gruppo elettrodi che si auto-sostegno, anche se il punto di registrazione è stata allontanata dal timpano e sul pavimento del canale uditivo. Questo elettrodo è illustrato in Figura 5. Un leggero, flessibile ma elastica clip viene utilizzato per contenere un elettrodo a sfera d’argento contro la parete del canale. Questo elettrodo può essere utilizzato sotto auricolari, offre buone registrazioni, e livelli di rilevamento visivi (VDLs) in molti soggetti approssimare la soglia comportamentale dello stimolo (vedi figura 6).
Figura 5 Un’assemblea elettrodo per la registrazione dal condotto uditivo:. (A) elettrodo di argento palla sostenuto da fermo in acetato; (B) assemblaggio detenuta da pinze, come richiesto per l’inserimento; (C) inserimento nel condotto uditivo. Da Il Electrocochleographic elettrodi Design by AC Coats, 1974, Journal of Acoustical Society of America, 56, pag. 79. Copyright 1974 dalla American Institute of Physics. Ristampato da permesso.
Figura 6. Elettrococleogramma combinata e registrazione potenziale del tronco cerebrale a diversi livelli di sensazioni con stimolo click. Registrazione montaggio: elettrodo canale uditivo collegato all’ingresso non invertente dell’amplificatore differenziale, elettrodi di superficie posizionata sulla linea media della fronte collegata all’ingresso invertente; surfacer elettrodo sopra il processo zigomatico collegato a terra. In virtù di questo montaggio registrazione, entrambi potenziali negativi orecchio-canale e fronte / vertice potenziali positivi sono tracciati come deviazioni verso il basso. Dal combinato ECochG-ABR Versus convenzionali ABR Recordings di JD Durrant, 1986 seminari in Udienza (elettrococleografia), 7, p. 292. Copyright 1986 da Thieme Medical Publishers. Ristampato da permesso.

Problemi inerenti con questo tipo di elettrodo canale dell’orecchio sono la difficoltà di controllare il posizionamento e relativamente elevate impedenze elettrodo. Impedenze in genere sono in eccesso di 20 kohm (Durrant, 1986). Con preamplificatori moderni ei loro impedenze di ingresso molto elevati, la grandezza dell’impedenza dell’elettrodo non è tanto di preoccupazione in quanto è l’equilibrio tra ciascun ramo del circuito formato nel collegamento dell’amplificatore differenziale al paziente. L’equilibrio tra coppie di elettrodi è generalmente scarsa, e questo degrada CMR e del rumore. Impedenze più alti creano anche più artefatto rumore.
Altri disegni di elettrodi canale uditivo sono stati descritti che sono posizionato più vicino all’ingresso del canale uditivo (ad esempio, Whitaker & Lewis, 1984; Yanz & Dodds, 1985). Inoltre, un elettrodo earplug di questo tipo generale confronto con l’elettrodo cappotti, quando quest’ultima è inserita vicino all’ingresso del canale auricolare (Ferraro, Murphy, e Ruth 1986). Questi disegni più recenti hanno sostanzialmente ridotto il problema impedenza a causa delle loro superfici efficacemente grandi. L’ampiezza del potenziale registrata, tuttavia, viene ridotto per meno profonde posizionamento degli elettrodi (cappotti, 1974). Questi elettrodi non sembrano fornire registrazioni utili dell’AP e del PS. Il gruppo elettrodi earplug è simile a auricolari inserire delle tube. Pertanto, la risposta è molto meno sensibili agli stimoli manufatto, rispetto a risposte ottenute con altri tipi di elettrodi canale uditivo utilizzati in combinazione con le cuffie convenzionali.
Si ricorda che in differenziale registrazioni un secondo elettrodo, talvolta chiamato l’elettrodo di riferimento, è necessario, con un elettrodo di terra. Due possibili posizionamenti per l’elettrodo di riferimento sono il lobo ipsilaterale e mastoide. Alcune delle potenzialità desiderata, però, viene annullato dal amplificatore differenziale perché né la lobo ipsilaterale né mastoide ipsilaterale è totalmente inattivo. Siti preferibili per l’elettrodo di riferimento sono il nasion (appena sopra il ponte del naso) o controlaterale lobo / mastoide, che sono relativamente inattivo per il ECochGm. Durrant (1977, 1.986) anche suggerito registrazione tra il canale auricolare e il vertice o fronte per fornire pickup simultanea dei componenti nervose e tronco cerebrale ottavo, come illustrato dalla Figura 6. Anche se questo funziona bene in alcuni casi, in altri casi l’AP può Non essere ritirati molto meglio nel canale uditivo che sul lobo dell’orecchio o mastoide e in altri ancora l’AP può essere schiacciante grande (pregiudicare la soluzione dei componenti del tronco cerebrale). Tuttavia, questo approccio può contribuire a valorizzare la componente nervosa ottava (Wave I) del ABR (Durrant 1986, Eggermont, Don, e Brackmann 1980). In alternativa, un sistema a due canali può essere utilizzato per registrare simultaneamente da orecchio canale e di superficie degli elettrodi e quindi monitorare separatamente le risposte nervose e del tronco encefalico ottavo (Coats & Martin, 1977).
Un’altra forma di ECochG non invasiva è quella di registrazione tramite un elettrodo per scalpo / superficie immessi sul lobo dell’orecchio o mastoide. Anche prima della comparsa della carta classico di Jewett, Romano, e Williston (1970), che descrive ABRs, Sohmer e Feinmesser (1967) hanno descritto ECochG utilizzando sostanzialmente le stesse posizionamento degli elettrodi. Le differenze tra questi studi sono stati il riferimento polarità e l’origine presunta delle risposte. Jewett ei suoi collaboratori considerano il vertice di essere attivo, e Sohmer e Feinmesser considerato il lobo di essere attivi. Entrambi sono realmente attivo, ma il lobo (o mastoide) è più attivo per il AP, e il vertice è più attivo per i componenti del tronco. Infatti, è ben noto che il ECochGm costituisce la parte iniziale della ABR come illustrato dalla Figura 6.
Confronti tra membrana timpanica (TM), condotto uditivo, e le registrazioni ECochG superficiali sono recentemente apparsi in letteratura (Ferraro e Ferguson, in press; Ferraro et al, 1986; Stypulkowski & Staller 1987, Ruth, Lambert, e Ferraro, in corso di stampa , Ruth, Mills, e Ferraro, in corso di stampa). Come previsto, registrazioni dal TM producono le risposte più grande, più sensibili e affidabili tra i tre approcci. Anche se è possibile registrare l’AP o anche il CM (Sohmer & Pratt 1976) dal lobo dell’orecchio o mastoide, registrazioni da questi siti soffrono di riduzione sostanziale sensibilità rispetto alle tecniche di registrazione canale auricolare (Ferraro et al. 1986). Registrazioni affidabili di SP da siti come remoto come il lobo / mastoide devono ancora essere dimostrata.
Intensità. Compound AP crescono proporzionalmente all’ampiezza dello stimolo, come mostrato nella Figura 7. AP latenza dipende anche dall’intensità dello stimolo. La latenza del AP è definita come il ritardo tra l’inizio dello stimolo e la comparsa del picco risposta N1. Il grafico della latenza rispetto livello di stimolo è detta funzione di latenza intensità (Figura 7). Questi dati dimostrano che l’intensità dello stimolo diminuisce, la latenza aumenta sistematicamente.
Figura 7 la funzione. AP latenza intensità e corrispondenti tracciati ECochG (registrato tramite un elettrodo orecchio-canale).

Lo spostamento di latenza intensità del AP è dimostrata ulteriormente dal ECochGm mostrato nella Figura 8a. La base di questo fenomeno è evidente dalle registrazioni presentate nella figura 8b. Questi ultimi sono stati ottenuti ECochGms in presenza di diverse maschere rumore passa alto. La sottrazione della risposta ottenuta con una maschera di taglio della frequenza più bassa da quella ottenuta con una maschera di una maggiore frequenza di taglio produce il contributo in gran parte dei neuroni che innervano la regione cocleare tra i luoghi segnati dalle frequenze di taglio (Tè, Eldridge, e Davis, 1962 ). La risposta di alto livello è dominato principalmente da contributi di fibre situati vicino alla base (regione ad alta frequenza) della coclea, mentre i contributi provenienti da regioni a bassa frequenza tendono ad annullarsi a vicenda (Eggermont, 1976a). Le risposte di basso livello mostrati nella Figura 8a hanno latenze corrispondenti alle risposte generate da bande centrate intorno al 2000 Hz, che è coerente con la maggiore sensibilità del vicino soglia 2.000 Hz regione. Lo spostamento di latenza intensità, pertanto, è principalmente un riflesso del tempo richiesto per l’onda viaggiante replicarsi al posto corrispondente lungo la membrana basilare. Come discusso in precedenza, lo scatto ha un ampio spettro ma lo stesso meccanismo è coinvolto anche con maggiore frequenza stimoli specifici come pacchetti di toni. Poiché più fibre basalward saranno reclutati come il livello dello stimolo viene aumentato, le latenze si accorciano. Il punto importante è che le diverse popolazioni di neuroni dominano il AP a differenti livelli e le frequenze di stimolazione.
Figura 8. (A) a larga banda AP click-evocato. Da elettrococleografia da JJ Eggermont 1976, in WD e WD Keidel Neff (Eds.), Manuale di fisiologia sensoriale, vol. 3: Sistema uditivo: argomenti clinici e speciali (650 p.). Berlin, Springer-Verlag. Copyright 1976 da Springer-Verlag, Berlin-Heidelberg-New York. Adattato con il permesso. (b) le risposte a banda stretta derivati che presentano click stimolo presentato a 90 dB peSPL. Da analisi di composti azione risposte potenziali per tonificare Bursts nel Umana e Guinea Pig Coclea da JJ Eggermont 1976, Journal of Acoustical Society of America, 60, pag. 1135. Copyrighted 1976 dalla American Institute of Physics. Adattato con il permesso. Entrambe le serie di registrazioni sono dal promontorio tramite un elettrodo transtimpanica.

Sia il CM e SP sono molto brevi latenze e nessuna dipendenza significativa di latenza intensità della stimolazione. L’entità CM, se rappresentato in unità logaritmiche, cresce in modo direttamente proporzionale alla pressione sonora in decibel, di solito con una pendenza di unità. Come mostrato in figura 9, i suoi acidi grassi saturi in uscita ad alti livelli di stimolazione e anche diminuisce con aumenti continui di intensità (Dallos, 1973).
Figura 9 funzione. CM ingresso-uscita (sulla base dei dati medi da un campione di soggetti normali acustici). Stimolo era un tono raffica 1 kHz della durata di 5 ms; registrazioni spillo dell’elettrodo nel pavimento del canale uditivo, prossimale al timpano. (Figura modificato e ridisegnato da Elberling & Solomon, 1973).

Il comportamento della SP è più complessa rispetto a quella complessiva del CM (Dallos 1973). In generale, solo SP negativo è visto in soggetti normali audizione umani (Eggermont, 1976b). La funzione di ingresso-uscita SP da registrazioni transtimpanica è caratterizzato da una crescita approssimativamente corrispondente con intensità dello stimolo, simile al CM (quando la funzione di ingresso-uscita viene tracciata in coordinate log-log) ma senza molta evidenza di saturazione.
Variabili spettrale e / o temporali. Gli effetti di spettro stimolo e / o caratteristiche temporali sulle brevi potenzialità di latenza sono stati discussi in termini generali precedenti, ma ci sono alcune questioni di interesse specifico per quanto riguarda l’elicitazione della ECochGm. Una variabile rilevante è fase di stimolo. Come illustrato dalla Figura 4, il CM è sensibile alla fase, mentre il SP non è, e l’AP è solo leggermente sensibile alla fase (cappotti 1981). Inoltre, l’uso di tono che di solito scoppia outlast il clic richiede una particolare cura nella ECochG a causa della possibile contaminazione da radiazioni elettromagnetiche dal auricolare. Ancora una volta, ritardi acustici o schermatura elettromagnetica possono essere utilizzati per ridurre gli artefatti di stimolo.
Frequenza di ripetizione stimolo è un fattore importante per registrare la ECochGm, particolarmente il AP. Come illustrato dalla Figura 10, l’ampiezza del AP e diminuisce la latenza aumenta con l’aumentare della frequenza. Al contrario, la SP e CM (sebbene non evidente nella Figura 10) non sembrano esibire interazioni temporali di qualsiasi conseguenza e mantenere ampiezze essenzialmente costanti indipendentemente dalla frequenza di ripetizione. In effetti, una tecnica impiegata da alcuni per sottolineare la SP è quello di aumentare la frequenza di ripetizione fino a quando l’AP è al massimo depressa (Cappotti 1981, Gibson, Moffat, e Ramsden 1977). Questo metodo richiede frequenze di ripetizione dell’ordine di 100 / secondo, ma anche a questi elevati tassi di ripetizione del contributo AP alla risposta registrata non viene del tutto eliminato perché l’effetto di aumentare la frequenza di ripetizione non è uno di adattamento puro (Durrant 1986; Harris & Dallos 1979). La ripetizione dello stimolo stesso provoca una certa quantità di sincronizzazione di scariche neurali, che può verificarsi anche a frequenze di alcune centinaia di hertz. Altrimenti, l’AP sarebbe completamente adattarsi, piuttosto che accomodante allo stimolo ripetitivo.
Figura 10 Effetti del tasso di stimolo scatti al secondo (CPS).; per riferimento, gli intervalli interstimulus (ISI) sono stati calcolati per ogni aliquota testata (*, artefatto). Il click di stimolo è stato presentato a 80 dB SL. AP nonché potenziali tronco cerebrale (I-V) sono stati registrati con elettrodi posti nel canale uditivo e al vertice. Dal combinato ECochG-ABR Versus convenzionali ABR Recordings di JD Durrant, 1986 seminari in Udienza (elettrococleografia), pag. 300. Copyright 1986 da Thieme Medical Publishers. Adattato con il permesso.

Mascheratura. Fondamentalmente, il problema di verificare selettivamente un orecchio è la stessa per ECochG come per audiometria convenzionale. Il problema, tuttavia, è molto meno acuta in ECochG e mascheratura non viene utilizzato di routine. Mascheramento è inutile per la maggior parte delle applicazioni di ECochG per due ragioni. In primo luogo, i potenziali componenti il ECochGm vengono registrati in modo quasi campo vicino (Davis, 1976); di conseguenza, il ECochGm è più forte in prossimità di elettrodi più vicino al produttore del cocleare e potenzialità nervose ottavo. Registrazione sul lato della testa di fronte l’orecchio stimolati quindi produce una risposta sostanzialmente attenuato. In secondo luogo, a causa dell’attenuazione transcranial sostanziale del suono, l’ampiezza della risposta indotta da stimolazione di crossover sarà notevolmente ridotto, con uno spostamento di latenza concomitante, rispetto a quello ottenuto con stimolazione diretta di quella dell’orecchio.
Normale variabilità. Considerevole variabilità dell’ampiezza del ECochGm è tipicamente osservata. Anche con le registrazioni transtimpanica, in cui il segnale registrato è di solito un ordine di grandezza superiore a quella ottenuta con i metodi extratympanic, ampiezze AP variano di ben il 20: 1 (vedi dati di Eggermont, 1976b). Sebbene la extratympanic ECochGm è intrinsecamente vulnerabile a varianza posizionamento degli elettrodi, la sua varianza realtà non sembra essere superiore a quello sperimentato con il metodo transtimpanica ed è paragonabile a quello ottenuto con le registrazioni di superficie della mastoide (Durrant 1986). La difficoltà principale con metodi extratympanic è un povero SNR che è il risultato di una riduzione di ampiezza del segnale senza variazioni di ampiezza del rumore. Naturalmente, più remota del sito della registrazione, peggiore è il SNR.
La variabilità della latenza è molto inferiore a quella di ampiezza ed è relativamente indipendente dalla tecnica di registrazione. Le deviazioni standard sono in genere meno di 0,2 ms per l’AP registrato da soggetti normoudenti (Durrant, 1986).
Età e sesso. Gli effetti di età e sesso su ECochG non sono stati studiati approfonditamente. Le differenze di genere sembrano sorgere a livello del sistema al di là della ottavo nervo (McClelland & McCrae, 1979). Gli effetti solo noti di età sono durante lo sviluppo precoce (Fria & Doyle, 1984, Starr, Amlie, Martin & Sanders, 1977). Nei neonati, in particolare i neonati prematuri, c’è un leggero ritardo nella AP che diminuisce progressivamente con la maturità. Tale diminuzione può riflettere maturazione del sistema periferico e / o la risoluzione di perdita dell’udito conduttivo che può essere associata con la presenza di fluido nell’orecchio neonatale.
Applicazioni cliniche di elettrococleografia
Clinicamente, AEPs sono stati utilizzati nelle diagnosi otoneurologic e le previsioni soglia uditiva. ECochG è stato utilizzato in entrambe queste aree, anche se i primi lavori ha coinvolto principalmente le misure transtimpanica. La discussione qui si concentrerà su l’utilità clinica dei metodi extratympanic.
Audizione Soglia previsione. Orecchio canale ECochG non si è dimostrato particolarmente utile per la stima di soglia e non fornisce determinazioni affidabili delle stime di soglia tecnica transtimpanica (Probst, 1983). È difficile registrare il AP sicuramente al di sotto di circa 30 dB rispetto alla soglia comportamentale dell’individuo (Cullen et al. 1972). Questi risultati concordano con i dati riportati per i primi componenti della ABR. Per alcuni scopi, il divario tra la soglia di AP e la soglia del comportamento potrebbe essere accettabile, ma il ABR può essere registrato in modo affidabile vicino alla soglia comportamentale e quindi ha sostituito ECochG extratympanic per la stima di soglia.
Applicazioni Otoneurologic. Le utilità clinica nel settore della diagnosi otoneurologic o differenziali anche essere stata limitata per ECochG. Sohmer ei suoi colleghi hanno applicato la tecnica di superficie in una varietà di casi (Sohmer & Feinmesser 1973, 1974, Sohmer, Feinmesser, e BAUBERGER-Tell, 1972). Attualmente, il più popolare applicazione clinica della ECochG è per l’identificazione, la valutazione e il monitoraggio della malattia di Meniere o idrope endolinfatico. L’impulso principale per questo è stato il lavoro di Coats (1981), a seguito delle osservazioni di Eggermont (1976b) e Gibson et al. (1977) che l’ampiezza SP è alterata in molti casi. Anche se la logica di questo risultato deve essere ancora ampiamente spiegato, è ben documentato che il ECochGm di molti pazienti di Meniere è caratterizzato da una SP allargato, soprattutto in confronto alla componente AP (cappotti, 1981, 1986; Eggermont, 1976b; Ferraro , Arenberg, e Hassanein 1985; Gibson et al., 1977; Staller, 1986). Questo risultato è illustrato nella figura 11, il che dimostra il rapporto tra le ampiezze SP e AP per gruppi di soggetti che presentano compromissione retrococleare, compromissione cocleare, e la malattia di Meniere.
Figura 11. Grafici a dispersione di SP contro ampiezze AP per tre gruppi di orecchie patologiche. Le curve rappresentano stime di best-fit di ± 2 deviazioni standard per le risposte ottenute da normali orecchie. Le registrazioni dal canale auricolare. Dal potenziale Summating e la malattia di Meniere da AC Coats, 1981, Archivi di otorinolaringoiatria, 107, pag. 205. Copyright 1981 dalla American Medical Association. Ristampato da permesso.

Originariamente, si era sperato che la forma d’onda ECochGm, così come le funzioni di ingresso-uscita e la latenza intensità, sarebbero conformi a modelli distinti in caso di diverse patologie del sistema uditivo. Come riassunto in Figura 12, questo obiettivo è stato parzialmente realizzato utilizzando il metodo transtimpanica (ad esempio, Aran 1978). Qui si può vedere che cocleare, conduttivo, e modelli normali sono abbastanza distinguibili. In una certa misura, modelli simili sono stati dimostrati utilizzando tecniche non invasive come bene (ad esempio, Berlino e Gondra, 1976). Alcuni dati latenza intensità esemplari sono mostrati in Figura 13. Tuttavia, la frequente incapacità di rintracciare il AP fino a bassi livelli di stimolazione limita la misura in cui sia la funzione di latenza intensità o la funzione di ampiezza ingresso-uscita possono essere descritte. Inoltre, il rumore residuo nelle registrazioni non invasive esclude generalmente digitazione accurata della forma d’onda ECochG. Questi fattori hanno ridotto il valore clinico di ECochG non invasivo, anche se sembra che molti di loro possono essere superati registrando dalla TM (Stypulkowski & Staller, 1987).
Figura 12. (A) tipico input-output e funzioni di latenza intensità per i soggetti con udito normale (A) e conduttivo (B), il reclutamento di alta frequenza (C), e reclutando piatta (D) perdita dell’udito. (b) corrispondenti forme d’onda ECochG (registrazioni transtimpanica). Da “Contributi di elettrococleografia alla diagnosi nell’infanzia. Un 8-Year Survey “di JM Aran 1978, a SE Gerber & GT Mencher (Eds.), Diagnosi precoce di perdita dell’udito, pag. 218-219. New York: Grune & Stratton. Copyright 1978 da Grune & Stratton. Adattato con il permesso.

Figura 13. AP funzioni latenza intensità per il gruppo di pazienti con lieve-moderata conduttivo (a) e pendenza perdita dell’udito neurosensoriale (b). Le misurazioni effettuate da registrazioni dalla superficie del timpano. Dalla Applicazione clinica di registrazione VIII umano potenziali Nervo azione Dalla membrana timpanica da CI Berlino, JK Cullen, MS Ellis, RJ Lousteau, WM Warbrough, e GD Lione 1974, Atti della American Academy of Ophthalmology e Otorinolaringoiatria, 78, pag. 404-406. Copyright 1974 da CV Mosby Company. Adattato con il permesso.

Infine, forse la zona più trascurata ECochG è l’uso del CM. Un aspetto scoraggiante è la notevole difficoltà di eliminare stimoli artefatto ad un grado che uno è convinto che solo CM è in fase di registrazione. Sohmer e (di Pratt 1976) sistema di erogazione del suono, hanno discusso in precedenza, è stato progettato specificamente per aggirare questo problema; hanno descritto le registrazioni di successo del CM con elettrodi di superficie. Nonostante il sostegno dato da alcune autorità (ad esempio, Beagley, 1974; Hoke e Lutkenhoner, 1981), non è ancora possibile stabilire il valore della misurazione CM come strumento clinico.
Misurazione della Auditory Brainstem Potenziali Evocati
La ABR è costituito da una serie di onde 5-7, come illustrato in Figura 14. Sono stati utilizzati due sistemi di etichettatura, uno attribuibile a Sohmer, Feinmesser e Szabo (1.974) e l’altra di Jewett e Williston (1.971), con il Quest’ultimo schema ora usato più ampiamente. I potenziali costituenti il ABR derivano dal nervo uditivo, così come le strutture del tronco cerebrale (Jewett, 1970). La vista semplice della genesi del ABR è che ogni onda nasce da un unico sito anatomico. Tuttavia, questo punto di vista si affaccia la complessità delle vie neurali, tra rappresentazione bilaterale, decussazione di fibre nervose a vari livelli, percorsi che non comportano sinapsi in ogni nucleo, neuroni con più sinapsi all’interno di una struttura, e cotture secondari e terziari di neuroni. Negli esseri umani, Wave II è ora crede che derivare dalla fine centrale della ottavo nervo (Moller e Jannetta 1982). Solo le onde al di là di II sono ora crede di rappresentare il livello di attività del tronco cerebrale. Onde I e II derivanti da strutture ipsilaterale al lato della stimolazione. Ondate successive possono provenire da strutture che ricevono ipsilaterale, controlaterale, o ingressi bilaterali dalla periferia uditiva (Achor e Starr, 1980a, 1980b; Buchwald e Huang, 1975, Moller, Jannetta, Bennett, e Moller, 1981; Wada e Starr, 1983a , 1983b, 1983c).
Figura 14. Tronco cerebrale uditiva di risposta-Jewett Waves I-VII. Insorgenza di scatto (CLK.) Stimoli come indicato. Registrazione montaggio: elettrodi di superficie al vertice (collegato all’ingresso non invertente dell’amplificatore registrazione), mastoide (ingresso invertente), e nasion (massa); Pertanto, a seguito della convenzione più ampiamente adottata, (+ Cz) potenziali vertici positivi sono tracciati come deviazioni verso l’alto. Identificatori di picco tra parentesi: terminologia da Sohmer e Feinmesser (1967) che hanno utilizzato il lobo per l’ingresso non invertente e il ponte del naso per l’ingresso invertente.

Poiché Onda I rappresenta la risposta iniziale del sistema nervoso uditivo, le onde successive tendono ad imitare il suo comportamento, in particolare la sua dipendenza parametri di stimolo e lo stato delle orecchie medio ed interno (Davis, 1976). Tuttavia, vi è un certo grado di indipendenza tra il tronco cerebrale e componenti dei nervi periferici.
Misure fondamentali ABR
I due parametri della forma d’onda ABR che di solito si misurano sono l’ampiezza e la latenza. Ampiezza viene tipicamente misurata tra un picco positivo e il seguente “picco” negativa o depressione (Figura 15). Misure picco-picco sono favoriti perché evitano la difficoltà di determinare la linea di base del potenziale.
Figura 15. Ampiezza di base e le misure di latenza della ABR.

Ci sono diverse misure di latenza di interesse. Il più semplice è latenza assoluto, che è definito come la differenza di tempo tra stimolo insorgenza e il picco dell’onda (Figura 15). Latenze Interwave (o intervalli interpicco) sono le differenze tra latenze assoluti di due picchi, come I-V, I-III, e III-V (Figura 15). Nel valutare latenze ABR, enfasi di solito è posto sui picchi vertex-positivo della forma d’onda.
Parametri Stimolo
Intensità. Funzioni latenza intensità per i principali componenti del ABR click evocata sono mostrati in Figura 16. Le latenze aumentano intensità dello stimolo diminuisce, approssimativamente in parallelo con i cambiamenti di latenza del AP (Wave I). Le ampiezze delle onde diminuire l’intensità diminuisce. Inoltre, l’intensità diminuisce le onde prima di onda V diminuire e alla fine svaniscono, mentre onda V spesso resta visibile fino a livelli di ravvicinamento delle soglie comportamentali per lo stesso stimolo.
Figura 16. ABR funzioni latenza intensità e corrispondenti forme d’onda ABR.

La base primaria per il passaggio di latenza intensità sopra descritto viene rivelata dai dati Don e Eggermont (1978), che ha usato il metodo di mascheramento sottrattiva. Questo metodo è stato originariamente sviluppato per indicare le regioni della coclea che contribuiscono al click evocati AP (Teas et al. 1962). Come mostrato in Figura 17, rumori diversi passa alto sono usati per ottenere mascherati ABRs click-evocata. Il ABR ottenuto con una minore frequenza di cutoff maschera viene sottratta dalla risposta ottenuta con una maggiore frequenza di taglio mascherina. La risposta smascherato alto livello è dominato da contributi fibre alla fine basale della coclea. Lo spostamento di latenza intensità quindi sembra riflettere il tempo richiesto per l’onda replicarsi al posto sulla membrana basilare domina la risposta. Tuttavia, se si assume che questa tecnica comporta la mascheratura delle regioni cocleari basali, diffusione poi verso l’alto di eccitazione non possono interamente spiegare cambiamenti nella latenza per singole bande derivati (vedi figura 6 di Eggermont & Don, 1980).
Figura 17. (A) a larga banda ABRs click-suscitato. (b) derivati risposte a banda stretta. Dall’analisi del Click-Evocati tronco cerebrale Potenziali in Man Using passa-alto rumore di mascheramento da M. Don e JJ Eggermont 1978, Journal of Acoustical Society of America, 63, pag. 1087. Copyright 1978 dalla American Institute of Physics. Adattato con il permesso.

Spettro:. Clicks Versus Pips tono Clic sono gli stimoli più comunemente usati per suscitare l’ABR. L’esordio brusco e ampio spettro di un risultato click in sincrono eccitazione di una vasta popolazione di neuroni. Il click è di solito lo stimolo più efficace e in grado di fornire informazioni ad alta frequenza (Coats & Martin, 1977; Don, Eggermont, e Brackmann 1979, Gorga, Worthington, Reiland, Beauchaine & Goldgar 1985; Jerger & Mauldin 1978; Moller & Blegvad 1976). Semi di tono, i clic filtrati o il mascheramento sottrattiva (banda derivato) tecnica devono essere utilizzati per le informazioni specifiche più frequenza (Stapells, Picton, Perez-Abalo, Read, e Smith, 1985).
Le stesse preoccupazioni che sono evidenti per l’uso di stimoli specifici frequenza di suscitare l’AP sono presenti anche per l’ABR. Semi di tono sono stimoli transienti, per cui vi è uno spread di energia intorno alla frequenza centrale. In secondo luogo, con intensità crescente le fibre basali progressivamente dominano la risposta, indipendentemente dalla frequenza dello stimolo (Folsom 1984). Questo problema esiste per convenzionale audiometria tonale pura pure. In terzo luogo, il tempo di salita effettiva può diventare progressivamente più come la frequenza diminuisce. Ciò può ridurre la sincronia alla fine apicale della coclea, rendendo più difficile la misurazione. Tuttavia, la ABR può essere suscitato da stimoli a partire da 500 Hz con le opportune impostazioni del filtro ed epoche di campionamento (Stapells & Picton 1981, Suzuki, Hirai, e Horiuchi, 1977). È stata riportata buon accordo tra il tono scoppio ABR e soglie comportamentali alla corrispondente frequenze audiometriche (Suzuki & Yamane, 1982).
Lo spettro dello stimolo è influenzato dal plateau stimolo e salita / discesa durate, nonché dalla funzione gating con cui il suono viene attivato e disattivato. I componenti del tronco encefalico, come AP, sono relativamente insensibili alla durata dello stimolo (Gorga, Beauchaine, Reiland, Worthington, e Javel, 1984), ma piuttosto legato alla salita / discesa (Kodera, Marsh, Suzuki, e Suzuki, 1983) . Risposta ampiezze diminuiscono e latenze aumentano all’aumentare del tempo di salita. Onda V è la meno colpita in termini di ampiezza diminuisce con l’aumentare i tempi di stimolo di salita / discesa (Hecox, Squires, e Galambos, 1976).
Diverse funzioni gating possono essere utilizzati per minimizzare splatter spettrale di pacchetti di toni (Harris 1978; Nuttall 1981). Un altro approccio è quello di utilizzare tacca-banda (o stop-band) rumore per mascherare tutti, ma la regione frequenza del principale lobo spettrale dello stimolo (Picton, Ouellette, Hamel, e Smith, 1979; Stapells et al., 1985) o il paradigma di mascheramento sottrattiva. La VDL del ABR può essere determinata per ogni banda di frequenza di interesse. Questi metodi possono essere più tecnicamente impegnativo e richiede tempo che l’uso di pacchetti di toni non mascherate o clic filtrati.
Polarità dello stimolo (compressione-rarefazione).
L’ABR viene comunemente registrato in risposta a transitori a polarità alternata, che nel trasduttore generano variazioni acustiche di compressione e rarefazione, in successione Questo tipo di stimolazione ha il vantaggio di annullare l’artefaffo elettrico che, prodotto dal trasduttore e raccolto dall’elettrodo alla mastoide, alle alte intensità può mascherare la porzione iniziale della risposta. La polarità dello stimolo di per sé produce lievi modificazioni nell’ABR. stimoli di rarefazione tendono a ridurre la latenza delle componenti e facilitano la separazione delle componenti IV e V, Tuttavia non è del tutto evidente se ciò possa contribuire a migliorare la sensibilità clinica dell’ABR nei confronti di determinate patologie. In certi casi, in cui non sia dimostrabile un’onda V alla massima intensità di stimolazione, alcuni autori suggeriscono di ripetere la registrazione con stimoli di rarefazione a cadenza lenta: questo procedimento potrebbe facilitare la comparsa dell’onda V La stimolazione con transitori monofasici (in compressione o in rarefazione) tuttavia, può favorire la comparsa di un potenziale microfonico cocleare. In certi casi di sordità infantile profonda, il microfonico cocleare, prodotto dalle stimolo monofasico ad elevata intensità, può simulare le onde ABR, causando importanti errori nelle stime di soglia.
Polarità o fase di avvio dello stimolo possono influenzare le latenze delle onde e la morfologia della forma d’onda dettagliata ABR. Diverse polarità / fasi possono influenzare in modo differenziato le ampiezze, latenze, e / o la risoluzione di alcuni picchi (Figura 18). Ad esempio, la fase di rarefazione può suscitare ABRs con latenze leggermente più brevi e una migliore risoluzione dei picchi nel complesso IVN. Tuttavia, alcuni soggetti possono mostrare le tendenze opposte o differenze significative tra le polarità. Quando si osservano effetti di polarità, raramente ammontano a più di una differenza 0,1-0,2 ms a latenza nella udito normale, i soggetti neurologicamente intatto, ma la presenza di una perdita dell’udito ad alta frequenza pendenza può causare effetti più drammatici (Coats & Martin, 1977) . Effetti di fase sembrano dipendere dal contenuto a bassa frequenza dello stimolo (Moller, 1986), anche se sale e Thornton (1983) arrivano leggermente diverse conclusioni per quanto riguarda le fonti di effetti di fase.
Figura 18 Effetti di clic polarità (ad esempio, in fase di partenza) sul ABR:. C = condensazione; R = rarefazione. Dalla Ricostruzione del Audiogramma Utilizzando Risposte tronco cerebrale e passa-alto rumore di mascheramento da M. Don, JJ Eggermont, e DE Brackman, 1979. Annals of Otology, Rhinology, e Laringologia, 88 (Suppl. 57), pag. 6. Copyright 1979 da Annali Publishing Company. Ristampato da permesso.

Gli effetti di fase non sono molto grandi nella maggior parte dei soggetti. Di conseguenza, molti esaminatori preferiscono usare stimoli di polarità alternata, che aiutano a ridurre al minimo stimolo manufatto e il CM, entrambi i quali possono oscurare Onda I. Questo approccio può ridurre o eliminare la necessità di schermatura elettromagnetica del trasduttore. Tuttavia, è generalmente preferibile mantenere le fasi separate per evitare di distorcere la forma d’onda ABR. Questo è particolarmente importante nei soggetti che hanno sostanzialmente diverse risposte a depressione e condensazione stimoli. Se necessario, la condizione alternata può essere ottenuto combinando risposte per ogni polarità stimolo nella memoria del computer. Nessuna informazione viene persa a causa di rarefazione, condensazione, e le risposte uniti ciascuno possono essere esaminate.
Tasso di ripetizione di stimoli – Cadenza di stimolazione
Aumentando la cadenza di ripetizione degli stimoli, ad esempio passando da 10 stimoli /sa 100 stimoli/s, l’ampiezza delle componenti dell’ABP si riduce e la loro latenza aumenta Tali variazioni, indipendenti dall’intensità di stimolazione, diventano particolarmente significative con cadenze di oltre 501s. L’aumento di Latenza è differenziato per le varie componenti’ è meno consistente per le componenti generate dalla periferia (onde 1,11) ed è più accentuato per le componenti generate più centralmente (onda V) Di conseguenza l’intervallo I-V può subire un aumento di 0,15-0 30 ms passando da cadenze di circa 10/s a cadenze attorno a 80/s La figura 19a riporta questo effetto rilevato in un normoudente, per stimoli di 90 dB nHL
Il fenomeno dell’allungamento dell’intervallo I-V è probabilmente dovuto a processi cumulativi di adattamento e fatica, sia a livello recettoriale che a livello neuro-sinaptico. Con elevate cadenze di stimolo anche la differenza fra soglia elettrofisiologica dell’ABR (onda V) e soglia psicoacustica risulta maggiore rispetto a quanto si osserva con cadenze attorno a 1 0/s. Ciò è dovuto alla ridotta ampiezza dell’onda V e quindi al suo più difficoltoso riconoscimento a livello di soglia, ma anche ad una migliore percezione di loudness (soglia psicoacustica “migliore”) che si verifica inviando transitori molto ravvicinati fra loro.
Stimolazioni a cadenze elevate sono talvolta utilizzate per rendere I’ABR più sensibile nei confronti di lesioni della via uditiva centrale, quali ad esempio sclerosi a placche, encefalopatie dismetaboliche o il neurinoma dell’acustico in stadio precoce. In queste patologie, I’ABR a cadenza elevata può mostrare significative deviazioni parametriche rispetto ai soggetti normali, in misura più evidente a quanto osservabile con stimoli a cadenza lenta
 Figura 19a
Figura 19a
Le ampiezze e latenze dei componenti ABR dipendono stimolo frequenza di ripetizione (vedi Picton, Stapells, e Campbell, 1981, per una rassegna). Poiché il tasso di stimolo è aumentata, le latenze di tutte le onde si prolungano e le ampiezze dei primi onde sono diminuiti. Tempi di 10 / secondo o meno sono necessari per definizione massimo tutte le onde; l’intervallo interstimulo percentuale è sufficientemente lungo per evitare qualsiasi adattamento significativo della risposta per stimoli di alto livello. Non ci sono prove che suggeriscono che alti tassi di influenzare negativamente la risposta di stimoli di basso livello. Come illustrato nella figura 19, i tassi più rapidi prolungare le latenze di tutte le onde progressivamente, in modo da onda I è ritardato di circa 0,1 ms e Wave V è in ritardo di circa 0,3 ms tra i tassi di 10 e 50 / secondo (Fowler e Noffsinger 1983). Tassi elevati anche diminuire le ampiezze delle prima onda e dell’onda V. Le onde II e IV sono le più colpite, seguita dall’onda I e III. Sebbene i tassi di 10 / secondo sono state proposte per migliorare la diagnosi differenziali basate sull’esame ABR, i risultati della ricerca non sono conclusivi (Campbell e Abbas, 1987; Fowler & Noffsinger 1983). Scarsi tassi consigliabile quando una serie completa di onde è necessario, come nel caso di valutazioni otoneurologic. Per altri scopi, come ad esempio il test della soglia, i tassi di 25-40 / secondo sono accettabili perché l’ampiezza di onda V è minimamente ridotta. Questo migliora l’efficienza delle misure ABR perché più medie possono essere prese nello stesso periodo di tempo.
Figura 19b. Effetto di stimolo (clicca) frequenza di ripetizione sul ABR.

Vi è una notevole dibattito sul fatto che il mascheramento non è mai necessario. In primo luogo, almeno per i clic, sembra che vi sia una maggiore attenuazione transcranica che incontra in toni puri audiometria (Finitzo-Hieber, Hecox, e Cono, 1979). Inoltre, ulteriore attenuazione transcraniale può essere realizzato attraverso l’uso di auricolari ad inserto (Clemis et al. 1986). In secondo luogo, in termini di determinare la possibilità di patologia retrococleare, una risposta a stimoli di crossover potrebbe essere ritardata in modo da sollevare il più sospetto come una risposta assente.
Mascheramento controlaterale all’orecchio testato
L’ABR evocato da uno stimolo di elevata intensità può essere influenzato dalla contemporanea attivazione del recettore controlaterale. Ciò avviene per il trasferimento di una quota di energia acustica per via ossea. Poiché per i transitori l’attenuazione interaurale è stimata attorno ai 60 dB, stimolando un orecchio a 90 dB nHL, all’ABR contribuisce anche l’orecchio controlaterale, per una quota corrispondente a 30 dB (90-60 dB), Nella pratica clinica il mascheramento dell’orecchio controlaterale va sempre eseguito, utilizzando rumore bianco, inviato ad un’intensità inferiore di 20-30 dB rispetto all’intensità inviata all’orecchio testato. La Fig. 36 mostra il risultato ottenuto in un paziente con anacusia sinistra. L’ABR ottenuto stimolando l’orecchio anacusico, senza mascherare l’orecchio normoudente, evidenzia un’onda V a circa 8 ms Essa scompare quando si ripete il test utlizzando il mascheramento dell’orecchio normoudente.
Nella (sensibilità) una valutazione audiologica-oriented, però, considerazioni analoghe per la mascheratura devono essere somministrate in audiometria comportamentale. Mascheramento controlaterale è necessaria ogni volta che gli stimoli sono sufficientemente intensa da produrre risposte di crossover. Una risposta di crossover sarà di piccola ampiezza e latenza più lungo, rispetto ad una risposta omolaterale, per l’intensità molto più bassa dello stimolo che raggiunge l’orecchio controlaterale. Idealmente, ogni clinica deve determinare i livelli di mascheramento efficaci per il loro proprie attrezzature e stimoli. La quantità appropriata di mascheramento è determinato aumentando il livello di mascheratura nell’orecchio nontest raggiungimento di una risposta di crossover è eliminato.
Monofonico Versus Binaural Stimolazione
Le risposte del tronco encefalico binaurale stimolate sono più grandi di risposte in modalità mono indotte da quasi doppio (Dobie e Norton, 1980). Stimolazione binaurale può essere utilizzato per proiezioni o in applicazioni in cui è sufficiente sapere che il meccanismo uditivo periferico è intatto in almeno un orecchio o che vi sia la funzione livello del tronco cerebrale (ad esempio, in pazienti in coma). Stimoli mono sono raccomandate per la maggior parte degli scopi diagnostici neurologiche e per la stima delle soglie separatamente per le orecchie.
La differenza tra le risposte mono e biauricolare costituisce anche la base per la misurazione della cosiddetta interazione biauricolare potenziale (Figura 20). Le risposte mono sinistro e destro vengono aggiunti (formando una risposta binaurale previsto), e la risposta binaurale viene sottratto da questa somma (Dobie e Berlino, 1979; Dobie & Norton, 1980). Questa differenza di potenziale è associato con Waves V-VII ed è attribuita ai neuroni che sono condivisi dai percorsi uditivi del tronco cerebrale sinistro e destro. L’utilità clinica di questo componente non è stata stabilita ed è ostacolato dalla scarsa ampiezza del potenziale di interazione binaurale e la sua tagliente dipendenza dalla forma d’onda della morfologia delle risposte mono (Fowler e Swanson, 1988).
Figura 20 Binaural (BIN) rispetto ABRs mono (L e R) e la derivazione (cioè, BIN – [L + R]). Della componente dell’interazione binaurale (BIC, demarked da picchi A e B).

Tecniche di registrazione sono selezionati per migliorare l’SNR del nervo e del tronco potenziali uditivi, che in genere sono meno di 1 V in ampiezza e sono sepolti in 10 o più V di rumore. I seguenti fattori possono influenzare la rilevabilità e la qualità del ABR: (a) configurazione degli elettrodi, (b) amplificazione (compreso l’amplificazione differenziale), (c) filtrazione, (d) una media di risposta, e (e) il rifiuto artefatti.
Montaggio degli Elettrodi. I primi studi della ABR e la sua utilità clinica affidamento principalmente sulle registrazioni da elettrodi posizionati sul vertice e il lobo / mastoideo dell’orecchio stimolato con un terreno sul nasion, la fronte, o lobo opposto o mastoide. Il posizionamento degli elettrodi sulla fronte di attaccatura dei capelli e mastoide ipsilaterale o dal lobo dell’orecchio (con l’elettrodo di massa in genere immessi sul mastoide controlaterale) attualmente è popolare. Questo montaggio evita problemi di apposizione elettrodi alla pelle con i capelli e rese simili, anche se non identici, risulta il montaggio vertex-tomastoid (Beattie, Beguwala, Mills, e Boyd 1986). Un elettrodo sul vertice o sulla fronte capta le onde del tronco cerebrale primari potenziali positivi verso terra, e questi siti forniscono pickup ottimale del ABR (van Olphen, Rodenburg, e Verway 1978). Sia le onde sono tracciate come positivi (come in Figura 14) o deviazioni negative (come in figura 6) è una questione di come gli elettrodi sono collegati all’amplificatore. Anche se nessun luogo sulla testa è totalmente inattivo per l’ABR (Terkildsen, Osterhammel, e Huis int Veld, 1974), un sito di riferimento cefalica è preferito in quanto fornisce per la soppressione del rumore superiore perché la quantità e la natura del rumore sia per amplificatore differenziale ingressi saranno simili (rispetto ad un riferimento noncephalic, come il collo). Poiché il sito lobo / mastoide è attiva per il potenziale del nervo ottavo la AP viene registrato principalmente come una grande onda negativa ma combina con le potenzialità del tronco cerebrale tramite inversione amplificatore per formare un picco della stessa polarità evidente come i componenti del tronco cerebrale, come illustrato in Figura 21. Sebbene diversi posizionamenti elettrodi possono migliorare varie componenti del ABR, piccole differenze di posizionamento avranno pochi effetti (Martin e Moore 1977).
Figura 21. Derivazione del ABR ipsilaterale registrato (cioè, registrato tra vertice e mastoideo omolaterale. Simulata da registrazione a due canali con la registrazione controlaterale intesa come la stima di vertice pick-up e la derivazione trasversale intesa come la stima del pickup mastoide.)

Sistemi di test EP con due o più canali consentono la registrazione simultanea da più montaggi. Per scopi clinici, un montaggio di registrazione controlaterale è usato frequentemente. Gli ingressi vertici / fronte sono legati tra loro e gli elettrodi di ciascun lobo / mastoide sono collegati individualmente a ciascun canale. Come mostrato in Figura 22, Onda I è assente o sostanzialmente attenuato nella registrazione controlaterale, anche se la deflessione negativa seguente Onda I può rimanere prominente intensità elevate. Le differenze di ampiezza diminuiscono per ondate successive, lievi differenze di latenza può essere visto, rispetto al ABR ipsilaterale registrato (per esempio, vedere i dati di Creel, Garber, Re, e Witkop 1980). Onda V registrato controlaterale può essere tanto quanto 0,2 ms entro la ipsilaterally registrato Onda V. Una applicazione di registrazioni controlaterali è nei casi in cui il complesso IVN è fuso nella registrazione omolaterale (Figura 22); Onde IV e V sono generalmente separati nella registrazione controlaterale (Stockard, Stockard, e Sharbrough 1978).
Figura 22. Omolaterale (I) rispetto controlaterale (C) registrazioni del ABR.

Effetti differenziali di livello del tronco encefalico patologia sulle ABRs registrati contraddizione rispetto ipsilaterale sono state suggerite (Hashimoto, Ishiyama, e Tozuka 1979), ma un po ‘di cautela è necessaria nell’interpretazione delle risposte registrate in queste condizioni. Tali registrazioni non forniscono opinioni indipendenti dei due lati del tronco encefalico. Al massimo, un certo grado di parzialità sembra probabile solo per Waves I-III, che rappresenta l’attività dal ottavo nervo e, molto probabilmente, i nuclei cocleari (Durrant, Shelhamer, Fria, e Ronis, 1981). In posizione centrale, i generatori delle risposte sono troppo vicini per essere risolti facilmente nelle registrazioni di campo lontano. Un altro uso di registrazioni a due canali è di prendere la differenza tra i canali (vedi Figura 21). Questo metodo permette di derivazione trasversale, che produce gli stessi risultati come la registrazione in modo differenziale tra i lobi delle orecchie / mastoidi. Pur sottolineando la ripresa del nervo uditivo e potenzialità bassa del tronco encefalico (Durrant, Shelhamer, Fria & Ronis, 1981), questa derivazione non è un sostituto per ECochG perché in realtà fa ben poco per migliorare il SNR per Wave io, che è il problema principale con registrazione onda I (Durrant, 1986).
Filtro larghezza. La larghezza di banda del filtro per l’ABR è selezionata per impedire effetti aliasing sul segnale registrato e respingere rumore fisico e fisiologico cadere fuori dello spettro del ABR. Per soggetti normali, le potenzialità indotte da stimoli ad alta intensità sono composti di frequenze comprese tra 50 e 1000 Hz (Kevanishvili & Aponchenko, 1979), ma, come l’intensità degli stimoli che provochino diminuisce, i potenziali possono essere composti da componenti a frequenza inferiore (Elberling , 1979a). Aumentare il cutoff di un filtro passa alto analogico stabilizza la linea di base, ma anche diminuire le latenze delle onde componenti e riduce le loro ampiezze (vedi dati analogici in Figura 23). Risposte anomale possono anche essere composti da frequenze inferiori sono risposte normali, quindi non c’è impostazione ugualmente applicabile in tutte le situazioni un filtro. Pratiche attuali suggeriscono che il taglio del filtro passa-alto (ad esempio, 3 dB punti) non deve superare i 100 Hz per filtri passivi singolo stadio (ad esempio, 6 dB rolloffs / ottava). Il cutoff deve essere abbassata quando si usano filtri con pendii più ripidi, quando si misura risposte da neonati, e quando vengono utilizzati stimoli a bassa frequenza. Il cutoff dovrebbe anche essere abbassato e l’epoca campionamento esteso a 20 ms durante la registrazione di risposte a stimoli a bassa frequenza perché il contenuto a bassa frequenza del ABR è relativamente maggiore che nel caso di stimoli ad alta frequenza o clic (Suzuki e Horiuchi, 1977).
Figura 23. Effetti analogico (X) rispetto digitale (O) filtraggio sulla ABR. Impostazioni di filtro analogici sono per un amplificatore di registrazione Grass (cioè interruzioni mezzo di tensione di un filtro passivo con impostazioni iniziali di 30-3000 Hz). Da Effetti di analogico e filtro digitale sul tronco cerebrale potenziali evocati uditivi di JR Boston e PJ Ainslie, 1980 Elettroencefalografia e Neurofisiologia Clinica, 48, pag. 362. Copyright 1980 da Elsevier Scientific Publishers. Ristampato da permesso.

Ridurre il passa-basso di taglio di un filtro analogico attenua le risposte, ma può aumentare le latenze (vedi dati analogici in Figura 23). Di conseguenza, frequenze di taglio inferiori a 1600 Hz sono raramente utilizzati, con 3000 Hz rappresenta una tipica frequenza di taglio.
Poiché filtri analogici causano distorsione di fase e, di conseguenza, i valori di latenza di polarizzazione, vi è un crescente interesse per l’uso dello zero sfasamento filtraggio digitale. Questi filtri realizzano larghezze di banda più strette, senza la distorsione temporale di filtri analogici (Boston e Ainslie, 1980; Domico & Kavanaugh, 1986). Poiché il filtro è molto più accentuato, SNRs migliori possono essere ottenuti con meno distorsione di forma d’onda (anche se questo dipende dalla funzione di filtro specifico utilizzato). Un confronto degli effetti analogico rispetto filtraggio digitale è mostrato in Figura 23.
Pochi sistemi disponibili sul mercato offrono la possibilità di filtro digitale passa-banda, anche se la maggior parte offrono una qualche forma di livellamento digitale. Così, filtraggio analogico con le reti di filtro attivi e 12 rolloffs dB / ottava sono prevalenti tra apparecchiature prodotte. Nonostante queste critiche, va riconosciuto che ABRs adeguate possono essere misurati con opportune impostazioni dei filtri analogici. Se più di un insieme di condizioni di filtro viene utilizzato di routine, tuttavia, quindi norme separati dovrebbero essere raccolti per ogni. La discussione precedente sottolinea il fatto che le forme d’onda di risposta possono essere alterati dalla risposta del filtro e, quindi, l’uso di filtri di banda molto strette non è raccomandato.
Campionamento variabili. Il numero di scansioni del segnale che deve essere in media per produrre un ABR ripetibile è determinata da diversi fattori (ad esempio, l’intensità dello stimolo, statali soggetto, e la sensibilità uditiva). Ad esempio, quando si lavora a livelli relativamente bassi di stimolo, può essere utile per aumentare il numero di passate perché l’ampiezza del ABR diminuisce con intensità decrescente. Il numero esatto di sweep è forse meno importante è la riproducibilità delle risposte mediate per condizioni di stimolo identiche. Non ci dovrebbero essere essenzialmente non riproducibilità tra le risposte ottenute sotto stimolo contro condizioni nonstimulus. Si consiglia di ripetere ogni condizione almeno una volta e occasionalmente includere condizioni nonstimulus o di controllo a intervalli per tutta la sessione di prova, in particolare nei casi rumorosi. Nella maggior parte dei casi, è la capacità di pattern recognition dell’esaminatore che è il responsabile ultimo per giudicare la risposta. La ripetibilità degli eventi è più facile giudicare che è il verificarsi di eventi isolati. Inoltre, i confronti di tracciati attraverso condizioni di stimolo può essere utile. Ad esempio, i picchi del ABR potrebbero muoversi in maniera abbastanza prevedibile come variazioni di intensità (vedi figure 16 e 17a).
Frequenza di campionamento è importante perché determina la risoluzione temporale della forma d’onda e, insieme con il numero di punti campionati, la durata dell’epoca registrata. Durante l’intervallo di intensità, l’ABR click-suscitato è generalmente contenuto in una finestra temporale di 10 ms (vedi figure 14 e 16). Con questa finestra e 256 punti di dati, ci saranno 40 ms risoluzione temporale (tempo di sosta), che è più che sufficiente, anche se le finestre fino a 20 ms (80 ms risoluzione con 256 punti di dati) sono adeguati per lavoro ABR. Queste finestre temporali più lunghi sono necessari per le valutazioni di soglie ABR, specialmente per stimoli a bassa frequenza, a causa dei lunghi tempi di latenza di onda V in queste condizioni. In generale, le finestre sono più consigliati per le valutazioni audiologiche in modo che la risposta desiderata può rientrare entro i tempi dell’analisi.
Soggetto / variabili non-patologiche
. Oggetto Stato La ABR è relativamente insensibile alle variazioni dello stato soggetto, tra cui il sonno naturale e sedato (Amadeo e Shagass 1973, Sohmer, Gafni, e Chisin 1978) e l’attenzione (Picton & Hillyard, 1974). Di conseguenza, ABRs di soggetti sedati possono essere paragonati a norme stabilite in soggetti non sedati (Stockard, Stockard, e Sharbrough, 1978). Per i bambini, ei bambini più grandi e gli adulti che non riescono a rilassarsi, sedazione dovrebbe essere disponibile dopo un rinvio medico del paziente. Immediata accessibilità alle cure mediche di emergenza è necessario per affrontare eventuali effetti collaterali spiacevoli.
Anestesia non modifica sostanzialmente le latenze o ampiezze dei potenziali meno che la temperatura interna del corpo si abbassa al di sotto di 33 gradi centigradi, nel qual caso si prolungherà la latenza di Wave V. Temperatura ridotta prolunga le latenze assolute e relative di tutte le onde (Stockard, Sharbrough, e Tinker, 1978). L’alcol può anche aumentare la latenza di Wave V, apparentemente a causa di una riduzione indotta a temperatura interna (Squires, Chu, e Starr, 1978).
Età e sesso. Affettivo cambiamenti durante la vita precoce si riflettono nei cambiamenti legati all’età nel ABR. I dati presentati in Figura 24, sulla base di dati provenienti da neonati (Cevette, 1984), presentano variazioni maturazione in onde III e V attraverso il 18 ° mese. Di conseguenza, le valutazioni ABR nei neonati prematuri e neonati richiedono l’uso di norme età adeguata e richiedono l’utilizzo di una finestra di analisi più ampio (ad esempio, 15-20 ms) che viene in genere utilizzato per gli adulti (ad esempio 10 ms).
Figura 24. Latenze ABR onda V e I-V latenze interpicco presso indicate NHLs contro età concettuale. Matura concettuali mesi (troppo) sono in realtà 44 settimane (sett) + il numero di mesi indicato. Barre orizzontali sopra ogni punto dati DeMark latenze che sono 2 deviazioni standard (SD) al di sopra dei mezzi (N = 580 neonati). Da uditiva Brainstem Response Test nel reparto di terapia intensiva da MJ Cevette, 1984 seminari in udienza, 5, p. 62 Copyright 1984. Da Thieme Medical Publishers. Adattato con il permesso.

Per tutta l’infanzia l’ABR cambia poco, ma in adolescenza, i maschi cominciano a svilupparsi più lunghe latenze onda V rispetto alle femmine, che per l’età adulta ammonta a una differenza media di circa 0,2 intersessuale ms (Rowe, 1978). Inoltre, le femmine mostrano leggermente più grandi ampiezze onda V di quanto non facciano i maschi (Jerger & Hall, 1980). Pertanto, le norme separati sono suggeriti per l’interpretazione della ABR nei maschi contro femmine per scopi diagnostici neurologiche. Perché vi è una notevole sovrapposizione tra le distribuzioni di latenze ABR per i due sessi, tuttavia, alcuna indennità per genere deve essere applicato con giudizio.
Come soggetti adulti di età, ampiezze delle onde può diminuire e la riproducibilità delle risposte potrebbero deteriorarsi. Il consenso di evidenze sperimentali dimostrano che latenze assoluti di Waves I, III, e V sono 0.1 a 0.2 ms più per i soggetti di età compresa tra 50 anni e più vecchio di quelli di età per 20-30 anni. I dati relativi l’influenza dell’età sulla latenza Interwave sono conclusivi, ma anche suggeriscono che ci possa essere un prolungamento legata all’età di 0,1 a 0,2 ms per l’intervallo I-V interpicco (Chu, 1985; Rosenhall, Bjorkman, Pederson, e Kall, 1985 ). Cambiamenti legati all’età possono essere confusi dalla presenza di perdita dell’udito sensoriale. L’età e la perdita di udito sembrano avere effetti opposti sulla latenza Interwave e effetti simili ma non additivi sulla latenza assoluta. Quando la soglia a 4000 Hz è di 50 dB HL o meno, il determinante principale di Wave V latenza è età. Quando la perdita di udito a 4000 Hz supera i 50 dB HL, sia l’età e la perdita dell’udito contribuiscono alla latenza prolungamenti, ma il fattore principale è la perdita dell’udito (Hyde, 1985). Pertanto, è opportuno disporre di dati comparativi per gli adulti di età superiore ai 50 anni che non hanno più di una perdita uditiva cocleare lieve a 4000 Hz (Brewer, 1987). Per gli adulti anziani la cui soglia a 4000 Hz supera il campo di perdita dell’udito lieve, gli effetti dell’invecchiamento e perdita di udito sulla latenza assoluta dovrebbe essere considerato.
Variabili patologiche
Conductive Hearing Loss. Ipoacusie conduttive causano energia sonora per essere attenuato attraverso l’orecchio esterno o medio. Tali perdite prolungano le latenze di tutte le onde del ABR causa della effettiva abbassamento del livello di stimolo. La valutazione del ABR è più facile e l’interpretazione più precisa se le lesioni conduttive vengono identificati o risolti prima della ABR viene misurata. Così, l’esame otoscopico, test immittance, e l’aria e ossa di conduzione audiometria sono utili per un esame approfondito ABR se lo scopo è per la diagnosi neurologica.
Perdite uditive conduttive prolungano le latenze delle onde, senza notevolmente influenzare il valore di latenza interpicco I-V e causare essenzialmente lo stesso grado di turno latenza a tutti i livelli di stimolo (Fria, 1980; Mendelson, Salamy, Lenoir, e McKean, 1979). Pertanto, la funzione di latenza intensità per un soggetto con una perdita uditiva conduttiva viene spostato lungo l’asse intensità essenzialmente l’importo della perdita dell’udito conduttivo (Figura 25). Inoltre, le onde prima onda V possono essere persi, come è generalmente il caso con stimoli basso livello. Ci sono anche eccezioni alla spostamento parallelo della funzione latenza intensità, ad esempio in caso di perdite conduttive che non planari attraverso frequenza. In questi casi, la funzione di latenza intensità può essere modificata perché la configurazione della perdita uditiva produce spostamenti nella regione cocleare che dominano la risposta (Gorga, Reiland, e Beauchaine 1985).
Figura 25. Esempio degli effetti della patologia conduttivo su latenze di ABR Waves I, III, e V zona Stippled rappresenta ± 2 deviazioni standard delle latenze per soggetti normali acustici.

Alcune perdite uditive conduttive apparenti possono derivare da problemi non-patologiche che possono essere evitati. Le cause più comuni sono canale uditivo crollo sotto auricolari e lo slittamento degli auricolari durante la prova. Crollano condotti uditivi possono essere affrontati con più precisione ed efficacia con l’uso di auricolari inserti. Procedure alternative possono includere utilizzando un auricolare aperto, un auricolare con un cuscino circumaurale, o tenendo l’auricolare vicino (ma non contro) l’orecchio. Tali procedure possono influenzare lo spettro stimolo e, di conseguenza, le latenze di risposta. Anche se questo può compromettere il giudizio di normalità delle latenze assoluti, valutazioni ragionevolmente accurate delle latenze Interwave e differenze interaurali possono essere effettuate prove entrambe le orecchie nello stesso modo. Slittamento auricolare può essere rilevato ripetendo la prima condizione di prova. Se le latenze delle onde sono più lunghi sulla risposta finale, l’auricolare ha probabilmente scivolato dal suo corretto posizionamento sopra l’orecchio (Noffsinger & Fowler 1983).
Perdita dell’Udito Cocleare. La ABR può essere fortemente influenzato da perdita uditiva cocleare. L’effetto complessivo dipende dalla gravità e della configurazione della perdita, nonché la composizione frequenza dello stimolo. Sebbene banda larga in natura, lo spettro del click è modellato principalmente dalle caratteristiche di risposta del trasduttore. Un TDH-49 auricolare, per esempio, ha un picco di risonanza a circa 4000-6000 Hz, che aumenta l’energia in tale intervallo di frequenza di circa 10 dB. Questo picco di risonanza, le caratteristiche passa-banda dell’orecchio esterno e medio, e il fatto che la coclea produce risposte più sincroni a fine basale, portano a latenze ABR che dipendono dallo stato di neuroni alta frequenza, almeno per la stimolazione click .
Onda V latenze nei soggetti con perdite uditive cocleari sono sostanzialmente equivalenti a quelli raccolti allo stesso nhl in soggetti normali acustici (Selters & Brackmann 1977) a condizione che questi stimoli sono almeno 20 dB al di sopra della soglia a 4000 Hz, la configurazione di la perdita di udito non è in forte pendenza, e la perdita non è maggiore di entità da lieve a moderata. Funzioni latenza intensità di questi soggetti convergono anche su quelle dei soggetti normoudenti a livelli elevati di intensità, come mostrato ad un soggetto in Figura 26. (In questo caso la perdita di udito era piuttosto piatta nella configurazione e di un grado moderato.) Perdite dell’udito limitato alle basse frequenze non hanno alcun effetto apprezzabile sul onda V latenze.
Figura 26. Esempio degli effetti della patologia cocleare su latenze ABR Waves I, III, e V come mostrato da cerchi. Zona punteggiata rappresenta ± 2 deviazioni standard delle latenze per soggetti normali-udito.

Precipitosamente pendenza perdite ad alta frequenza di moderata gravità, però, causa un incremento nelle latenze (Bauch e Olsen, 1986; Cappotti e Martin, 1977; Gorga, Reiland, e Beauchaine, 1985, Gorga, Worthington, Reiland, Beauchaine, e Goldgar, 1985). Presumibilmente questo è perché sia del tempo aggiunto per dell’onda viaggiante raggiungere regioni più normali della coclea e della riduzione di intensità dello stimolo alle frequenze stimolanti efficaci del picco di risonanza del trasduttore. Inoltre, va riconosciuto che gli effetti della perdita dell’udito ad alta frequenza possono non essere identiche per tutti i componenti della ABR (Coats & Martin, 1977; Fowler & Noffsinger 1983; Keith & Greville 1987). Chiaramente, per scopi diagnostici neurologici, l’audiogramma tono puro sarebbe utile per l’interpretazione accurata della valutazione ABR.
Diversi metodi sono stati proposti per spiegare il ritardo di latenza introdotta da perdite uditive cocleari quando tenta di screening per le lesioni retrococleare. Un metodo è quello di identificare Onda I attraverso la normale configurazione degli elettrodi o posizionamento dell’elettrodo di riferimento nel condotto uditivo. Poi si può determinare se la I-V differenza latenza interpicco è entro i limiti normali. Per le perdite uditive cocleari, la I-V interpicco differenza di latenza può essere normale o leggermente più corto del normale (Coats & Martin, 1977). Tuttavia, l’intervallo di latenza interpicco I-III può prolungare leggermente in perdite uditive cocleari (con accorciamento concomitante dell’intervallo III-V), anche quando la I-V differenza latenza interpicco è entro limiti normali (Fowler & Noffsinger, 1983).
Varie correzioni Wave V latenza sono stati suggeriti per tener conto della perdita periferico gradi (Hyde & Blair 1981; Selters & Brackmann 1977). In alternativa, i dati di riferimento possono essere raccolti su persone con diversi gradi e configurazioni di perdita dell’udito cocleare. Infine, il tono stimoli PIP o mascheramento ipsilaterale può essere utilizzato per limitare la risposta alle aree di risposta equivalenti in soggetti normali e cocleari ridotta (Eggermont & Don, 1980, Kileny, Schlagheck, e Spak 1986). A causa dei dati insufficienti confrontando questi metodi, non esiste un metodo di scelta chiara in questo momento.
Interpretazione Diagnostica della valutazione ABR
Ci sono due usi generali della ABR: stima di soglia e individuazione delle lesioni dei nervi e uditiva del tronco encefalico. Valutazioni Otoneurologically orientati della ABR sono al centro di questa sezione. Diverse variabili precludono la specificazione di una procedura precisa o un metodo per analizzare il ABR. In primo luogo, la ABR deve essere interpretato nel contesto delle altre informazioni a disposizione, come la storia, i risultati di una valutazione audiologica, e risultati di un esame fisico. In secondo luogo, il sistema uditivo è complesso, e ogni onda del ABR ha generatori multipli. In terzo luogo, le lesioni variano nella loro dimensione e posizione. Infine, diverse patologie che causano lesioni allo stesso livello possono avere effetti simili sul ABR (ad esempio, tumore acustico e compressione vascolare del ottavo nervo). La conseguenza di questi fattori è che non esiste uno schema ABR che è unicamente caratteristica di una determinata patologia, per esempio, tumori acustica contro la compressione vascolare dell’ottavo nervo o sclerosi multipla contro tronco cerebrale infarto. Questo vale per qualsiasi prova audiologica che viene utilizzato per indicare sito di lesione. Vi è, tuttavia, una relazione generale tra il livello di lesione e gli effetti della lesione sul ABR.
La presenza di una perdita uditiva periferica può confondere l’interpretazione di forme d’onda proprio in quei pazienti per i quali i risultati della valutazione ABR sono più importanti. Se udito è simmetrico e quasi normale (supponendo che non altri sintomi di conseguenza neurologico), sospetto di una patologia retrococleare è bassa rispetto al caso in cui vi è una perdita uditiva unilaterale e colonne asimmetriche su altri test uditivo. Quest’ultimo caso, però, è quello in cui ci può essere scarsa morfologia della forma d’onda e latenze onda prolungati a causa della perdita uditiva periferica. Ci sono segnalate manifestazioni ABR nel 95% o più casi con neurinomi del nervo acustico (ad esempio, Selters & Brackmann 1977). Tuttavia, un tasso di falsi positivi fino al 30% può verificarsi in casi con perdite uditive asimmetrici (Clemis & Mitchell, 1977). Così, un completo audiologic work-up in combinazione con la valutazione ABR diagnostico può fornire più informazioni che solo uno di valutazione. Accuratezza, tuttavia, dipende dalle sensibilità combinati e specificità di ciascuna prova e la loro intercorrelazione. Per un trattamento esteso di questi fattori e le prestazioni di prova, si rimanda il lettore a una serie di documenti di Turner ei suoi soci (Turner, Frazer, e Shepard, 1984; Turner & Nielsen 1984, Turner, Shepard, e Frazer, 1984) .
Anche se non è il nostro scopo di prescrivere parametri specifici per le valutazioni ABR, alcuni approcci in genere utili alla valutazione possono servire come punti di riferimento. Ai fini diagnostici neurologiche, stimoli generalmente sono presentati in una sufficientemente elevata intensità di suscitare le potenzialità nei pressi o loro latenze più brevi. Cioè, fare clic su stimoli devono essere presentati almeno 20 dB al di sopra della soglia del paziente a 4000 Hz e / o almeno a 95 dB peSPL (pari a circa 60-65 dB NHL). Più di un livello di intensità è spesso necessario individuare chiaramente singole onde e per assistere l’interpretazione delle anomalie nelle risposte.
Il fatto che la popolazione di neuroni che dominano il ABR cambia attraverso intensità ha diverse implicazioni cliniche. Innanzitutto, per applicazioni neurologiche, norme latenza dell’onda V dovrebbero basarsi sulla assoluta intensità dello stimolo e non sulla soglia personale (ad esempio, livello sensazione) o volume percepito dello stimolo. In secondo luogo, nei casi di alta frequenza ipoacusie cocleari, le latenze di risposta possono essere prolungati perché i neuroni provenienti dalle regioni più apicale domineranno la risposta. In altre parole, ci sarà un ritardo, imputabile alle caratteristiche di propagazione dell’onda viaggiante (Coats & Martin, 1977; Gorga, Reiland, e Beauchaine, 1985, Gorga, Worthington, Reiland, Beauchaine, e Goldgar, 1985). Se, e solo se, vi è sufficiente integrità della regione basale della coclea e non vi è sufficiente intensità dello stimolo, allora questo effetto può essere superato. In terzo luogo, è l’intensità dello stimolo effettivamente raggiungere la coclea che è importante. Ad esempio, aumenta di intensità possono essere utilizzate per compensare eventuali perdite conduttivo che può essere presente.
I criteri per determinare la normalità del ABR possono essere basati su diverse caratteristiche di risposta tra cui: (a) latenze assoluti, (b) differenze latenza interwave, (c) differenze latenza intraurale, (d) ampiezze assolute e relative, (e ) riproducibilità delle forme d’onda, (f) i modelli di forme d’onda con analisi cross-correlazione, e (g) la decisione di presenza contro l’assenza di componenti d’onda. Di questi, latencybased misure sono tipicamente utilizzati e sono considerati più affidabile misure basate in ampiezza. Come in qualsiasi procedura, è necessario sviluppare limiti di confidenza al fine di spiegare la varianza nella distribuzione dei punteggi di soggetti normali.
Latenze assoluti. Confrontando le latenze onda alla gamma di valori normali è il metodo più semplice per valutare un ABR e tuttavia è la più vulnerabile. Queste latenze possono essere influenzati da diversi patologica (ad esempio, perdita di udito periferico) e fattori patologici non (ad esempio, l’età). Ancora, latenze assolute sono il parametro più usato singola della valutazione ABR e sono particolarmente critiche per interpretare i risultati in caso di insufficienza bilaterale quando non c’è orecchio normale per il confronto.
Interwave latenza differenze. Presumibilmente, gli intervalli interpicco (vedi figura 15) in qualche modo riflettere il tempo necessario per un impulso nervoso per viaggiare da un luogo ad un altro generatore (Starr & Achor 1975). Per questo motivo, il tempo di trasmissione termini o tempo di conduzione centrale sono spesso applicate a interpicco intervalli. Di interesse primario sono gli intervalli tra Waves I e III, I e V, e III e V. Tali misure hanno il vantaggio di separare un ritardo dell’onda V nella sua più periferica (I-III) e componenti più centrali (III-V) . Prolungamento di questi intervalli di là delle norme è generalmente indicativa di patologia retrococleare (Figura 27a). Perdite uditive conduttive e cocleari non incidono sostanzialmente il tempo di trasmissione da Waves I a V, anche se gli intervalli di I-V prolungati possono essere osservati in casi di intaglio perdita dell’udito cocleare (Keith e Greville, 1987). Quindi, cautela deve essere esercitata nell’interpretare intervalli interpicco in questi casi, così come in caso di perdite cocleari unilaterali o asimmetriche perché le perdite cocleari possono ritardare onda III senza indugio concomitante onda V (Fowler e Noffsinger 1983) o accorciare la I- Intervallo V. Un problema maggiore nei casi di perdita dell’udito sostanziale e la maggiore limitazione nell’uso degli intervalli I-III e I-V è quell’onda I può essere risolto in modo inadeguato o può essere rilevabile. In questi casi, l’applicazione di ECochG per risolvere onda I può essere utile (Eggermont et al, 1980).
Figura 27. ABRs registrati da pazienti con tumori acustici chirurgicamente confermato. La forma d’onda superiore in ogni pannello è da un orecchio normale. La forma d’onda inferiore (a) mostra l’intervallo I-V prolungato da un paziente con neurinoma dell’acustico. La forma d’onda inferiore (b) mostra l’assenza di onde oltre Wave II da un paziente con un meningioma nel ponto-cerebellare.

. Le differenze di latenza interaurale confronti di latenza interaurale vengono applicati principalmente per assoluti latenze onda V (Clemis e McGee, 1979; Selters & Brackmann, 1977). Normale variabilità della differenza di latenza interaurale suggerisce che generalmente dovrebbe essere inferiore a 0,3-0,4 ms. (Vedere Figura 27a per un esempio di un anomalo interaurale differenza di latenza.) Il vantaggio principale di questa misura è che può essere fatta in assenza di Wave I. Un altro vantaggio è che i piccoli disturbi retrococleare possono essere rilevati da piccole differenze tra latenza orecchie , anche quando entrambi (assoluti) latenze possono rientrare nei limiti della norma. Ogni soggetto è il suo / la sua proprio controllo. Il principale svantaggio è che le perdite uditive periferiche unilaterali o asimmetriche possono creare differenze di latenza tra orecchie, che può portare a risultati falsi positivi. Qui, le differenze interaurali negli intervalli interpicco possono essere utili.
Ampiezze. Norme per ampiezze assolute anche possono essere sviluppati e utilizzati per scopi di valutazione. La limitazione principale è che le ampiezze sono molto variabili (Thornton 1975). Questa variabilità è dovuta principalmente al rumore residuo nella registrazione ma anche può riflettere variabili associate con posizionamento degli elettrodi e la variabilità nei potenziali stessi.
Un’alternativa alla ampiezza misura assoluti è l’uso di ampiezze relative, in particolare il rapporto tra onda V (o IV / V) e ampiezze dell’onda I (Starr & Achor, 1975). Questo metodo ha il vantaggio potenziale di controllo per le fonti di variabilità comuni ai due onde. In pratica il V: rapporto I non migliora la precisione della misura oltre che delle misure assolute, principalmente a causa della variabilità di Wave I ampiezza (Durrant 1986). Inoltre, questa misura fornisce solo informazioni relative sull’integrità dei generatori di onde I e V e non è una misura dell’ampiezza complessiva del ABR. Gli effetti dei parametri di stimolo (per esempio, vedere Emerson, Brooks, Parker, e Chiappa, 1982) e il posizionamento degli elettrodi devono essere considerati. Il problema finale e più evidente risiede nella necessità per entrambe le onde di essere presenti, anche se Saluto posso essere difficile da misurare in molti casi che si presentano con la perdita dell’udito.
Riproducibilità di forme d’onda. Il confronto di uno tracciato della ABR con un altro dà una determinazione qualitativa o meno le due tracce sono simili. In discussioni precedenti, questo metodo è stato suggerito come un mezzo per giudicare la presenza di una risposta. Tale confronto può anche essere fatto per valutare le differenze interaurali in onda morfologia. Anche in assenza di chiare differenze interaurali nelle misure di latenza, diverse forme d’onda che appaiono per le due orecchie di stimolazione potrebbe essere suggestivo di coinvolgimento patologico. Anche se questo metodo manca di obiettività e soffre di una mancanza di controllo sui livelli di rumore fluttuante, le differenze di forma d’onda evidente e coerente tra le orecchie non possono essere ignorati. Perdita dell’udito asimmetrico può anche causare differenze interaurali nelle forme d’onda ABR.
Forma d’onda Modelli. Un altro approccio alla valutazione ABR è l’uso di un modello per la risposta normale (Elberling, 1979b). Il potenziale vantaggio di procedure automatizzate di punteggio è quello di aumentare l’oggettività nell’interpretazione ABR. Questo metodo richiede l’istituzione di una risposta modello da un gruppo di soggetti normoudenti e confronto del ABR da singoli pazienti al modello. Tale modello può essere formato facendo la media della risposta dal gruppo normale, e il confronto può essere quantificata calcolando il coefficiente di correlazione tra il modello e l’individuo ABR. Questo approccio è afflitta da difficoltà se il SNR nella ABR in fase di valutazione non viene mantenuta costante. Essa richiede attrezzature sofisticate e di programmazione per le analisi, e ci può essere la necessità di sviluppare modelli appropriati per i pazienti di diversa età, generi e tipi di perdita dell’udito. Nonostante le limitazioni, i potenziali vantaggi di queste tecniche sono evidenti e nuovi algoritmi vengono valutati (per esempio Arnold, 1985, Don, Elberling, e Waring, 1984; Elberling & Don, 1987).
Assenza di onde. L’assenza di onde a seguito dell’onda che è una forte indicazione di retrococleare patologia (Figura 27b). D’altra parte, l’assenza di onde prima V può derivare da patologia cocleare, età avanzata, elevati livelli di rumore fisiologici, o alcuni parametri di stimolo. L’assenza di onde seguenti III è una forte indicazione di patologia che colpisce pons rostrali e mesencefalo. Onde II e IV tendono ad essere dimostrata meno affidabile e sono di significato diagnostico inferiore a onde I, III, e V. L’assegnazione dei numeri d’onda alle vette del ABR può essere confusi da quelli che sembrano essere i componenti aggiuntivi a punta o doppie. L’interpretazione dei risultati ABR può essere migliorata utilizzando prove multiple a diversi livelli di stimolo, diverse polarità stimolo, e due registrazioni dei canali.
ABRs e ABR test in neonati e bambini
ABRs da neonati differiscono sostanzialmente da quelli ottenuti da adulti. Maturazione del sistema uditivo non è completo al momento della nascita. Di conseguenza, la ABR subisce cambiamenti significativi primi anni di vita. Tuttavia, ABRs sono stati utilizzati nello screening di neonati prematuri e altri ad alto rischio per identificare la presenza di perdita dell’udito e per determinare la necessità di un intervento. Inoltre, vi è stato interesse a utilizzare i ABR come base per stimare i livelli acustici in pazienti che non producono dati comportamentali adeguati (ad esempio, a causa di grave ritardo mentale). Alcuni fattori che devono essere considerati nella domanda di test ABR ad una popolazione pediatrica sono discussi di seguito.
ABR Maturazione
ABRs nei neonati sono diversi da quelli osservati negli adulti (Fria, 1980;. Starr et al, 1977). Come mostrato in Figura 28, la forma d’onda morfologia e latenze di risposta subiscono una serie di cambiamenti in funzione dell’età. Una sintesi della movimentazione di latenza legati all’età è mostrato nella figura 24. Latenze Saluto I raggiungono valori di adulti per 6-24 settimane, mentre latenze di Waves III e V non raggiungono i valori degli adulti fino a circa 18 mesi. Per i neonati pretermine, latenze di tutti i componenti sono prolungati rispetto a neonati a termine. A circa 27-30 settimane di età gestazionale (GA) un basso ABR ampiezza del lungo periodo di latenza può essere registrato. Nelle prossime settimane, la latenza diminuisce rapidamente fino a 35 settimane, GA e poi diminuisce più gradualmente fino a termine (38-40 settimane GA). Inoltre, durante i primi 18 mesi di vita, l’intervallo di interpicco onda I-V si riduce sistematicamente (Salamy e McKean, 1976). Nei neonati prematuri questa latenza interwave può essere fino a 7-8 ms (cioè, a 30 settimane GA) e diminuisce di circa 5,2 ms a termine, contrariamente ai circa 4,0 ms della risposta matura.
Figura 28. ABR da soggetti di età diverse, come indicato. Dalla Auditory Brainstem risposta: Background e cliniche Applicazioni per TJ Fria, 1980, nello sviluppo postnatale della vita tronco cerebrale umana A. Salamy e CM McKean, 1976 Elettroencefalografia e Neurofisiologia Clinica, 40, pag. 421. Copyright 1976 da Elsevier Scientific Publishers. Adattato con il permesso.

Il ABR mostra anche i cambiamenti di maturazione in termini di ampiezze dei singoli componenti (Salamy, Fenn, e Bronshvag, 1979). Onde I e III aumento di ampiezza fino a circa 6 mesi di età cronologica (CA), poi diminuire leggermente fino all’età adulta. Onda V ampiezza aumenta fino ad un valore di picco a tra i 24 ei 60 mesi di CA, e quindi diminuisce leggermente fino all’età adulta.
In genere, la soglia di click-evocato ABR onda V mostra effetti poco o niente età-dipendente, almeno per bambini di 33 settimane di età concezionale (Gorga, Reiland, Beauchaine, Worthington, e Jesteadt, 1987). Quando sono stati utilizzati stimoli specifica frequenza, effetti maturativi variano con frequenza. In generale, è stato dimostrato che quando ABRs sono limitate alla regione basale della coclea, che presentano le maggiori differenze legate all’età a soglia e latenze (Klein, 1984; Teas, Klein, e Kramer 1982). Quando le risposte sono limitati a porzioni apicali della coclea, attraverso l’uso di mascheramento o specifici frequenza stimoli, le ABRs da bambini sono simili a ABRs da adulti sia in termini di VDLs e latenze onda V (Folsom & Wynne, 1986; Klein 1984). Di conseguenza, l’interpretazione di studi ABR nei bambini deve essere effettuato alla luce degli stimoli utilizzati per ottenere risposte. Il calendario per lo sviluppo di una matura Saluto V latenze, quando si utilizza metà o bassa frequenza stimoli, è molto più breve di quando si usa clic stimoli (Tè et al., 1982).
Applicazione clinica
La mancata tenere conto delle differenze legate all’età nelle risposte infantili può portare a errori sostanziali nel sentire la stima di livello (fino a 30 dB), in particolare se stimoli sono pips toni ad alta frequenza (Klein, 1984). Ad esempio, se si utilizzano norme adulti (sia per la latenza o soglia di rilevamento), un bambino potrebbe sembrare deviare sostanzialmente dalla norma quando, in realtà, le risposte del bambino sono all’interno del range di normalità per il suo / sua età. Se si usano solo click stimoli, le soglie di rilevazione risposta sono relativamente stabili in tutta l’età.
Il rapporto tra ABR e soglie comportamentali consente accurate previsioni di perdita dell’udito. Questa funzione è utile perché consente di valutare difficili da test di pazienti che possono essere in grado di fornire risposte volontarie a suonare. Di conseguenza, la perdita dell’udito può essere identificato speditamente permettendo puntuale (ri) habilitative intervento. Va riconosciuto che ci sono alcuni casi in cui il ABR possa non riflettere accuratamente la sensibilità uditiva, anche se questi casi sono estremamente rari (Murray, Javel e Watson, 1985; Worthington e Peters, 1980). La precisione interpretativa della valutazione ABR può essere migliorata quando è combinato con altri dati, come le misure acustiche immittance, misure audiologiche comportamentali e informazioni case history.
Anche se è oltre la portata di questo scritto per approfondire i dettagli di strategie e protocolli per la valutazione ABR diretti verso la valutazione uditiva, si può dare una breve panoramica della procedura tipica. Una serie di intensità di solito è condotta. Onda V è rintracciato alla VDL, che è generalmente entro 10 dB della soglia comportamentale, almeno per le frequenze più alte (Gorga, Reiland, e Beauchaine, 1985; Jerger & Mauldin, 1978). La funzione di latenza intensità può anche essere utile in tali valutazioni (Cappotti e Martin, 1977, Gorga, Reiland, e Beauchaine, 1985, Gorga, Worthington, Reiland, Beauchaine, e Goldgar, 1985), ma la VDL è invocato più pesantemente per la stima di soglia. Questa procedura di solito viene ripetuto per ogni orecchio, usando stimoli di diverse frequenze, anche se tali valutazioni possono essere avviate con un clic.
La sedazione
Lattanti e bambini fino a 7 anni di età (o superiore, se non cooperativi) di solito richiedono una qualche forma di sedazione, al fine di migliorare l’SNR e per consentire un tempo sufficiente per completare il test. Sonno naturale è in genere sufficiente per i bambini fino a 6 mesi di età, anche se è generalmente sicuro per sedare i bambini più piccoli (Fria, 1980).
Il sedativo più comune è di cloralio idrato, anche se sono spesso utilizzati altri (ad esempio, secobarbital e un “cocktail” di Demerol, Phenergan e Thorazine). È necessario controllo medico dell’amministrazione del sedativo e la disponibilità di personale medico per il pronto intervento. La valutazione deve essere coordinato con attenzione con i genitori del bambino o dei tutori in modo che il bambino sarà adeguatamente sedato al momento del test. Ad esempio, potrebbe essere utile negare un bambino suo / suo pelo durante il giorno del test. Test ABR deve essere eseguita in modo efficiente perché sedazione si esaurisce rapidamente. E ‘anche importante ricordare che questi sedativi differiscono da anestesia, in modo che la stimolazione non necessaria (ad esempio, il movimento del corpo eccessivo o brusca) dovrebbero essere evitati. Infine, in alcuni casi in cui non sedazione di qualsiasi forma è di successo, l’anestesia generale può essere l’unica soluzione. In scegliendo di testare in anestesia generale, l’equazione rischio-beneficio deve essere valutato con attenzione. Linee guida per l’uso di sedazione e anestesia generale nei pazienti in età pediatrica sono state formulate dalla American Academy of Pediatrics (1985).
Altri Potenziali evocati uditivi
L’obiettivo di questo tutorial è stato sul ECochGm e ABR, che sono i primi segmenti della risposta elettrica del cervello al suono. L’intero AEP può durare diverse centinaia di millisecondi o più (Figura 29). Le stime di sensibilità dell’udito, utilizzando misure elettrofisiologici, non si sono limitati a brevi risposte latenza. Per esempio, le risposte nell’epoca 10-50 ms, noto come risposte medio di latenza (MLRS), sono registrati facilmente con parametrico minore e cambiamenti procedurali dalla registrazione ABR e sono riferito utili per ottenere informazioni soglia vicino di stimoli a bassa frequenza (Mendel & Wolf, 1983). L’evento-correlati 40 Hz o potenziale di steady-state è stato segnalato per essere utile per stimare la sensibilità a bassa frequenza, come pure (Galambos, Makeig, e Talmachoff 1981), anche se la variabilità di risposta in funzione di stato di sonno è problematico. EP corticali latenza ritardo o lunghi hanno una lunga storia di applicazione clinica (vedi Reneau & Hnatiow 1975). Anche se alla fine risposte possono fornire ragionevolmente buone stime di soglie uditive, sono vulnerabili a sottoporre variabili di stato, come il livello di eccitazione o addirittura stato di attenzione (Schwent, Hillyard, e Galambos, 1976), e non sono attualmente utilizzati per la stima di soglia. I potenziali corticali sono stati di interesse a causa della loro presunta relazione agli attributi percettivi delle differenze interemisferiche suono e e per le loro varie applicazioni neurologici e psichiatrici.
Figura 29. Evocati uditivi potenziale analizzati in tempo logaritmico-base per rivelare i potenziali componenti con circa la stessa ponderazione e classificati in arbitrarie ma comunemente usati finestre temporali di breve (SLR), medio (MLR), ea lungo (LLR) latenza risposte. (Figura modificato e ridisegnato da Michelini et al., 1982)
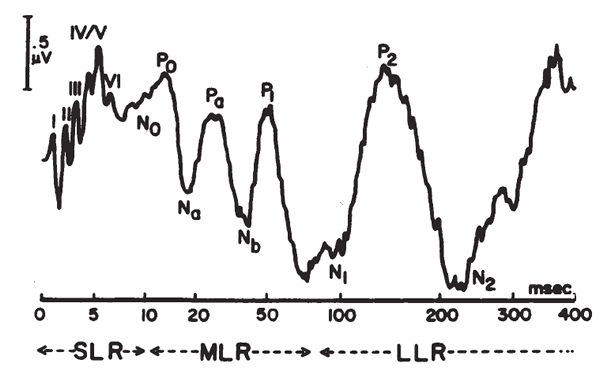
Le MLRS e le risposte più recenti sono oltre la portata di questo scritto, ma è importante riconoscere che ci possono essere informazioni utili da attività registrata al di là della finestra temporale discusso in questo tutorial. Inoltre, ci sono altri fenomeni e le applicazioni relative ai brevi potenzialità di latenza che non sono stati trattati in questo documento. Questi temi ed i loro riferimenti del kernel includono: la seguente risposta in frequenza e la risposta SN-10 (Davis, 1976), l’udito selezione aiuto basato su misure ABR (Beauchaine, Gorga, Reiland & Larson, 1986, Gorga, Beauchaine, e Reiland, 1987 ; Hecox 1983), monitoraggio ABR durante l’intervento chirurgico (Grundy, Janetta, Procopio, Lina, Boston, e Doyle 1981; Moller & Janetta 1983), e l’uso della valutazione ABR per assistere nella previsione risultato per il paziente in coma e come una parte della valutazione di morte cerebrale (Brewer & Resnick, 1984, Hall, Mackey-Hargadine, e Kim, 1985; Sala & Tucker, 1986; Seales, Rossiter, e Weinstein, 1979).
L’intento di questa esercitazione era quello di fornire una visione d’insieme per i medici di corte AEPs latenza. L’influenza di variabili strumentali, di stimolo, e materia è stata rivisitata nel contesto dei loro effetti sulla applicazione clinica di AEPs. Entrambi i punti di forza ei limiti di ECochG e ABR misure per la determinazione della soglia e la diagnosi otoneurologic sono stati discussi. Le applicazioni di queste tecniche sono nell’ambito della pratica di audiologi clinici, sia da prospettive tradizionali e contemporanei. Questa esercitazione ha lo scopo di servire come uno strumento utile per quei audiologi clinica, utilizzando queste tecniche e di prepararli per i futuri sviluppi in questo settore.
References
Achor, LJ, & Starr, A. (1980a). Auditory brainstem responses in the cat I: Intracranial and extracranial recordings. Electroencephalography and Clinical Neurophysiology, 48 , 154–173.
Achor, LJ, & Starr, A. (1980b). Auditory brainstem responses in the cat II: Effects of lesions. Electroencephalography and Clinical Neurophysiology, 48 , 174–190.
Amadeo, M., & Shagass, C. (1973). Brief latency clickevoked potentials during waking and sleep in man. Psychophysiology, 10 , 244–250.
American Academy of Pediatrics. (1985). Guidelines for the elective use of conscious sedation, deep sedation, and general anesthesia in pediatric patients. Pediatrics, 76 , 317–321.
Aran, JM (1978). Contributions of electrocochleography to diagnosis in infancy. An 8 year survey. In SE Gerber & GT Mencher (Eds.), Early diagnosis of hearing loss (pp. 215–242). New York: Grune & Stratton.
Arnold, SA (1985). Objective versus visual detection of the auditory brainstem response. Ear and Hearing, 6 , 144–150.
Bauch, CD, & Olsen, WO (1986). The effect of 2000–4000 Hz hearing sensitivity on ABR results. Ear and Hearing, 7 , 314–317.
Beagley, HA (1974). Can we use the cochlear microphonic in electrocochleography? Revue de Laryngologie, 95 , 531–536.
Beattle, RC, Beguwala, FE, Mills, DM, & Boyd, RL (1986). Latency and amplitude effects of electrode placement on the early auditory evoked response. Journal of Speech and Hearing Disorders, 51 , 63–70.
Beauchaine, KA, Gorga, MP, Reiland, JK, & Larson, LL (1986). The application of auditory brainstem response measurements to the selection of hearing aids: Preliminary data. Journal of Speech and Hearing Research, 29 , 120–128.
von Bekesy, G. (1974). Experiments in hearing . New York: McGraw-Hill.
Berlin, CI, Cullen, JK, Ellis, MS, Lousteau, RJ, Yarbrough, WM, & Lyons, GD (1974). Clinical application of recording human VIIIth nerve action potentials from the tympanic membrane. Transactions of the American Academy of Ophthalmology and Otolaryngology, 78 , 401–410.
Berlin, CI, & Gorga, MI (1976). Extratympanic clinical electrocochleography with clicks. In RJ Ruben, C. Elberling, & G. Salomon (Eds.), Electrocochleography (pp. 457–469). Baltimore: University Park Press.
Berlin, CI, Gondra, MI, & Casey, D. (1978). Bone conduction electrocochleography: Clinical applications. Laryngoscope, 88 , 56–763.
Binnie, CD, Rowan, AJ, & Gutter, T. (1982). A manual of electroencephalographic technology . Cambridge, England: Cambridge University Press.
Boston, JR, & Ainslie, PJ (1980). Effects of analog and digital filtering on brainstem auditory evoked potentials. Electroencephalography and Clinical Neurophysiology, 48 , 361–364.
Brewer, CC (1987). Electrophysiologic measures. In HG Mueller & VC Geoffrey (Eds.), Communication disorders in aging (pp. 334–380). Washington, DC: Gallaudet University Press.
Brewer, CC, & Resnick, DM (1984). The value of BAEP in assessment of the comatose patient. In RH Nodar & C. Barber (Eds.), Evoked potentials II (pp. 578–581). Boston: Butterworth Publishers.
Buchwald, JS, & Huang, CM (1975). Far-field acoustic response: Origins in the cat. Science, 189 , 382–384.
Campbell, KCM, & Abbas, PJ (1987). The effect of stimulus repetition on the auditory brainstem response in tumor and nontumor patients. Journal of Speech and Hearing Research, 30 , 494–502.
Cann, J., & Knott, J. (1979). Polarity of acoustic click stimuli for eliciting brainstem auditory evoked responses: A proposed standard. American Journal of Electroencephalography and Technology, 19 , 125–132.
Cevette, MJ (1984). Auditory brainstem response testing in the intensive care unit. Seminars in Hearing, 5 , 57–68.
Chu, NS (1985). Age related changes in the brainstem auditory evoked potentials. Electroencephalography and Clinical Neurophysiology, 62 , 431–436.
Clemis, JD, Ballad, J., & Killion, MC (1986). Clinical use of an insert earphone. Annals of Otology, Rhinology, and Laryngology, 95 , 520–524.
Clemis, JD, & McGee, T. (1979). Brainstem electric response audiometry in the differential diagnosis of acoustic tumors. Laryngoscope, 89 , 31–42.
Clemis, JD, & Mitchell, C. (1977). Electrocochleography and brainstem responses used in the diagnosis of acoustic tumors. Journal of Otolaryngology, 6 , 447–459.
Coats, AC (1974). On electrocochleographic electrode design. Journal of the Acoustical Society of America, 56 , 708–711.
Coats, AC (1981). The summating potential and Meniere’s disease. Archives of Otolaryngology, 107 , 199–208.
Coats, AC (1983). Instrumentation. In EJ Moore (Ed.), Bases of auditory brainstem evoked responses (pp. 197–220). New York: Grune & Stratton.
Coats, AC (1986). Electrocochleography: Recording techniques and clinical applications. Seminars in Hearing (Electrocochleography), 7 , 247–266.
Coats, AC, & Martin, JL (1977). Human auditory nerve action potentials and brainstem evoked responses. Archives of Otolaryngology, 103 , 605–622.
Creel, D., Garber, SR, King, RA, & Witkop, CJ (1980). Auditory brainstem anomalies in human albinos. Science, 209 , 1253–1255.
Cullen, JK, Ellis, MS, Berlin, CI, & Lousteau, RJ (1972). Human acoustic nerve action potential recordings from the tympanic membrane without anesthesia. Acta Otolaryngologica, 74 , 15–22.
Dallos, P. (1973). The auditory periphery . New York: Academic.
Davis, H. (1976). Principles of electric response audiometry. Annals of Otology, Rhinology, and Otolaryngology, 85 (Suppl. 28), 1–96.
Dobie, RA, & Berlin, CI (1979). Binaural interaction in brainstem-evoked responses. Archives of Otolaryngology, 105 , 391–398.
Dobie, RA, & Norton, SJ (1980). Binaural interaction in human auditory evoked potentials. Electroencephalography and Clinical Neurophysiology, 49 , 303–313.
Domico, WD, & Kavanaugh, KT (1986). Analog and zero phase-shift digital filtering of the auditory brainstem response waveform. Ear and Hearing, 7 , 377–382.
Don, M., & Eggermont, JJ (1978). Analysis of the clickevoked brainstem potentials in man using high-pass noise masking. Journal of the Acoustical Society of America, 63 , 1084–1092.
Don, M., Eggermont, JJ, & Brackmann, DE (1979). Reconstruction of the audiogram using brainstem responses and high-pass noise masking. Annals of Otology, Rhinology, and Laryngology, 88 (Suppl. 57), 1–20.
Don, M., Elberling, C., & Waring, M. (1984). Objective detection of averaged auditory brainstem responses. Scandinavian Audiology, 13 , 219–228.
Durrant, JD (1977). Study of a combined noninvasive ECochG and BSER recording technique. Journal of the Acoustical Society of America, 62 , S87.
Durrant, JD (1983). Fundamentals of sound generation. In EJ Moore (Ed.), Bases of auditory brainstem evoked responses (pp. 15–49). New York: Grune Stratton.
Durrant, JD (1986). Combined ECochG-ABR versus conventional ABR recordings. Seminars in Hearing (Electrocochleography), 7 , 289–305.
Durrant, JD, Gabriel, S., & Walter, M. (1981). Psychophysical tuning functions for brief stimuli: Preliminary report. American Journal of Otolaryngology, 2 , 108–113.
Durrant, JD, & Lovrinic, JH (1984). Bases of hearing science (2nd ed.). Baltimore: Williams & Wilkins.
Durrant, JD, Shelhamer, M., Fria, TJ, & Ronis, ML (1981). Examination of the sidedness of the brainstem auditory evoked potential . Paper presented at the biennial symposium of the international response audiometry study group, Bergamo. Italy.
Eggermont, JJ (1976a). Analysis of compound action potential responses to tone bursts in the human and guinea pig cochlea. Journal of the Acoustical Society of America, 60 , 1132–1139.
Eggermont, JJ (1976b). Electrocochleography. In WD Keidel & WD Neff (Eds.), Handbook of sensory physiology, Vol. V/3: Auditory system-Clinical and special topics (pp. 625–705). Berlin: Springer-Verlag.
Eggermont, JJ, & Don, M. (1980). Analysis of the clickevoked brainstem potentials in humans using high-pass noise masking. II. Effect of click intensity. Journal of the Acoustical Society of America, 68 , 1671–1675.
Eggermont, JJ, Don, M., & Brackmann, DE (1980). Electrocochleography and auditory brainstem electric responses in patients with pontine angle tumors. Annals of Otology, Rhinology, and Laryngology, 89 (Suppl. 75), 1–19.
Eggermont, JJ, Odenthal, DW, Schmidt, PH, & Spoor, A. (1974). Electrocochleography: Basic principles and clinical application. Acta Otolaryngologica (Suppl. 316), 1–84.
Elberling, C. (1979a). Auditory electrophysiology: Spectral analysis of cochlear and brainstem evoked potentials. Scandinavian Audiology, 8 , 57–64.
Elberling, C. (1979b). Auditory electrophysiology: The use of templates and cross correlation functions in the analysis of brainstem potentials. Scandinavian Audiology, 8 , 187–190.
Elberling, C., & Don, M. (1987). Threshold characteristics of the human auditory brainstem response. Journal of the Acoustical Society of America, 81 , 115–121.
Elberling, C., & Salomon, G. (1973). Cochlear microphonics recorded from the ear canal in man. Acta Otolaryngologica, 75 , 489–495.
Emerson, RG, Brooks, EB, Parker, SW, & Chiappa, KH (1982). Effects of click polarity on brainstem auditory evoked potentials in normal subjects and patients: Unexpected sensitivity of Wave V. Annals of the New York Academy of Science, 288 , 710–721.
Ferraro, JA (Ed.). (1986). Seminars in Hearing (Electrocochleography) , 7 , 241-337.
Ferraro, JA, Arenberg, IK, & Hassanein, RS (1985). Electrocochleography and symptoms of inner ear dysfunction. Archives of Otolaryngology, 111 , 71–74.
Ferraro, JA, & Ferguson, R. (in press). Tympanic ECochG and conventional ABR: A combined approach for the identification of Wave I and the I–V interwave interval. American Journal of Otology .
Ferraro, JA, Murphy, GB, & Ruth, RA (1986). A comparative study of primary electrodes used in extratympanic electrocochleography. Seminars in Hearing, 7 , 279–287.
Finitzo-Hieber, T., Hecox, K., & Cone, B. (1979). Brainstem auditory evoked potentials in patients with congenital atresia. Laryngoscope, 89 , 1151–1158.
Folsom, RC (1984). Frequency specificity of human auditory brainstem responses as revealed by pure-tone masking profiles. Journal of the Acoustical Society of America, 66 , 919–914.
Folsom, RC, & Wynne, MK (1986). Auditory brainstem responses from human adults and infants: Restriction of frequency contribution by notched-noise masking. Journal of the Acoustical Society of America, 80 , 1057–1064.
Fowler, CG, & Noffsinger, D. (1983). The effects of stimulus repetition rate and frequency on the auditory brainstem response in normal, cochlear-impaired, and VIII nerve/brainstem-impaired subjects. Journal of Speech and Hearing Research, 26 , 560–567.
Fowler, CG, & Swanson, MR (1988). Binaural and monaural phasic differences in the auditory brainstem response Manuscript submitted for publication.
Fria, TJ (1980). The auditory brainstem response: Background and clinical applications. Monographs in Contemporary Audiology, 2 , 1–44.
Fria, TJ, & Doyle, WJ (1984). Maturation of the auditory brainstem response (ABR): Additional perspectives. Ear and Hearing, 5 , 361–365.
Galambos, R., Makeig, S., & Talmachoff, PJ (1981). A 40-Hz auditory potential recorded from the human scalp . In Proceedings of the National Academy of Science (Vol. 78, pp. 2643–2647).
Geddes, LA (1972). Electrodes and the measurement of bioelectric events . New York: Wiley-Interscience.
Gibson, WPR, Moffat, DA, & Ramsden, RT (1977). Clinical electrocochleography in the diagnosis and management of Meniere’s disorder. Audiology, 16 , 389–401.
Glattke, TJ (1983). Short latency auditory evoked potentials . Baltimore: University Park Press.
Gorga, MP, Abbas, PJ, & Worthington, DW (1985). Stimulus calibration in ABR measurements. In JT Jacobson (Ed.), The auditory brainstem response (pp. 49–62). San Diego, CA: College-Hill.
Gorga, MP, Beauchaine, KA, & Reiland, JK (1987). Comparison of onset and steady-state responses of hearing aids. Implications for use of the auditory brainstem response in the selection of hearing aids. Journal of Speech and Hearing Research, 30 , 130–136.
Gorga, MP, Beauchaine, KA, Reiland, JK, Worthington, DW, & Javel, E. (1984). The effects of stimulus duration on ABR and behavioral thresholds. Journal of the Acoustical Society of America, 76 , 616–619.
Gorga, MP, Reiland, JK, & Beauchaine, KA (1985). Auditory brainstem responses in a case of high-frequency conductive hearing loss. Journal of Speech and Hearing Disorders, 50 , 346–350.
Gorga, MP, Reiland, JK, Beauchaine, KA, Worthington, DW, & Jesteadt, W. (1987). Auditory brainstem responses from graduates of an intensive care nursery: Normal patterns of response. Journal of Hearing Research, 30 , 311–318.
Gorga, MP, Worthington, DW, Reiland, JK, Beauchaine, KA, & Goldgar, DE (1985). Some comparisons between auditory brainstem response thresholds, latencies, and the pure-tone audiogram. Ear and Hearing, 6 , 105–112.
Grundy, BL, Janetta, PJ, Procopio, P., Lina, A., Boston, JR, & Doyle, E. (1981). Intraoperative monitoring of brainstem auditory evoked potentials. Journal of Neurosurgery, 57 , 674–681.
Hall, JW, Mackey-Hargadine, JR, & Kim, EE (1985). Auditory brainstem response in the determination of brain death. Archives of Otolaryngology, 111 , 613–620.
Hall, JW, & Tucker, DA (1986). Sensory evoked responses in the intensive care unit. Ear and Hearing, 7 , 220–232.
Harris, DM, & Dallos, PJ (1979). Forward masking of auditory nerve fiber responses. Journal of Neurophysiology, 42 , 1083–1107.
Harris, FJ (1978). On the use of windows for harmonious analysis with the discrete Fourier Transform . In Proceedings of the IEEE (Vol. 66, pp. 51–83).
Hashimoto, I., Ishiyama, Y., & Tozuka, G. (1979). Bilaterally recorded brainstem auditory evoked responses. Their asymmetric abnormalities and lesions of the brainstem. Archives of Neurology, 36 , 161–167.
Hecox, KE (1983). Role of auditory brainstem responses in the selection of hearing aids. Ear and Hearing, 4 , 51–55.
Hecox, K., Squires, N., & Galambos, R. (1976). Brainstem auditory evoked responses in man. I. Effect of stimulus rise-fall time and duration. Journal of the Acoustical Society of America, 60 , 1187–1192.
Hoke, M., & Lutkenhoner, B. (1981). Electrophysiological findings in patients with sudden deafness: A survey. In Advances in otorhinolaryngology (pp. 83–99). Basel: S. Karger.
Hood, LJ, & Berlin, CI (1986). Auditory evoked potentials . Austin, TX: Pro-Ed.
Hyde, ML (1985). The effect of cochlear lesions on the ABR. In JT Jacobson (Ed.), The auditory brainstem response (pp. 133–146). San Diego, CA: College Hill Press.
Hyde, ML, & Blair, RL (1981). The auditory brainstem response in neuro-otology: Perspectives and problems. Journal of Otolaryngology, 10 , 117–125.
Jacobson, JD (Ed.). (1985). The auditory brainstem response . San Diego, CA: College-Hill Press.
Jerger, J., & Hall, J. (1980). Effects of age and sex on auditory brainstem response. Archives of Otolaryngology, 106 , 387–391.
Jerger, J., & Mauldin, L. (1978). Prediction of sensorineural hearing level from the brainstem evoked response. Archives of Otolaryngology, 104 , 454–461.
Jewett, DL (1970). Volume-conducted potentials in response to auditory stimuli as detected by averaging in the cat. Electroencephalography and Clinical Neurophysiology, 28 , 609–618.
Jewett, DL, Romano, MN, & Williston, JS (1970). Human auditory evoked potentials: Possible brainstem components detected on the scalp. Science, 167 , 1517–1518.
Jewett, DL, & Williston, JS (1971). Auditory evoked far fields averaged from the scalp of humans. Brain, 94 , 681–696.
Joint Commission on Accreditation of Hospitals. (1987). Standard PI.9: Patient care equipment. Accreditation Manual for Hospitals , 199–200.
Keith, WJ, & Greville, KA (1987). Effects of audiometric configuration on the auditory brainstem response. Ear and Hearing, 8 , 49–55.
Kevanishvili, Z., & Aphonchenko, V. (1979). Frequency composition of brainstem auditory evoked potentials. Scandinavian Audiology, 8 , 51–55.
Kileny, P., Schlagheck, G., & Spak, C. (1986). Site of lesion ABR testing with tonal stimuli . Paper presented at the annual convention of the American Speech-Language-Hearing Association, Detroit.
Klein, AJ (1984). Frequency and age-dependent auditory evoked thresholds in infants. Hearing Research, 16 , 291–297.
Kodera, K., Marsh, RR, Suzuki, M., & Suzuki, J. (1983). Portions of tone pips contributing to frequency-selective auditory brainstem responses. Audiology, 22 , 209–218.
Martin, M., & Moore, E. (1977). Scalp distribution of early (0–10 msec) auditory evoked responses. Archives of Otolaryngology, 103 , 326–328.
Mauldin, L., & Jerger, J. (1979). Auditory brainstem evoked responses to bone-conducted signals. Archives of Otolaryngology, 105 , 656–661.
McClelland, RJ, & McCrea, RS (1979). Intersubject viability of the auditory-evoked brainstem potentials. Audiology, 18 , 462–471.
Mendel, MI, & Wolf, KE (1983). Clinical applications of the middle latency responses. Audiology: A Journal for Continuing Education, 8 , 141–155.
Mendelson, T., Salamy, A., Lenoir, M., & McKean, C. (1979). Brainstem evoked potential findings in children with otitis media. Electroencephalography and Clinical Neurophysiology, 105 , 17–20.
Michelini, S., Arslan, E., Prosser, S., & Pedrielli, F. (1982). Logarithmic display of auditory evoked potentials. Journal of Biomedical Engineering, 4 , 62–64.
Moller, AR (1986). Effect of click spectrum and polarity on round window N1N2 response in the rat. Audiology, 25 , 29–43.
Moller, AR, & Jannetta, PJ (1982). Comparison between intracranially recorded potentials from the human auditory nerve and scalp recorded auditory brainstem responses (ABR). Scandinavian Audiology, 11 , 3340.
Moller, AR, & Jannetta, PJ (1983). Monitoring auditory functions during cranial nerve microvascular decompression operations by direct monitoring from the eighth nerve. Journal of Neurosurgery, 59 , 493–499.
Moller, AR, Jannetta, PJ, Bennett, M., & Moller, MB (1981). Intracranially recorded responses from the human auditory nerve: New insights into the origin of brainstem evoked potentials (BSEP). Electroencephalography and Clinical Neurophysiology, 52 , 18–27.
Moller, K., & Blegvad, B. (1976). Brainstem responses in patients with sensorineural hearing loss. Scandinavian Audiology, 5 , 115–127.
Moore, EJ (1983). Bases of auditory brainstem evoked responses . New York: Grune Stratton.
Murray, AD, Javel, E., & Watson, CS (1985). Prognostic validity of auditory brainstem evoked response screening in newborn infants. American Journal of Otolaryngology, 6 , 120–131.
Naunton, RF, & Zerlin, SS (1976). Basis and some diagnostic implications of electrocochleography. Laryngoscope, 86 , 475–482.
Noffsinger, D., & Fowler, CG (1983). Brainstem auditory evoked potentials: Applications in clinical audiology. Bulletin of the Los Angeles Neurological Societies, 47 , 43–54.
Nuttall, AH (1981). Some windows with very good sidelobe behavior. IEEE Transactions on Acoustics, Speech and Signal Processing, 29 , 84–91.
Nyquist, H. (1924). Certain factors affecting telegraph speed. Bell System Technical Journal, 3 (2), 324–346.
Pfeiffer, RR (1974). Consideration of the acoustic stimulus. In WD Keidel & WD Neff (Eds.), Handbook of sensory physiology, Vol. V/l: Auditory system-Anatomy and physiology (ear) (pp. 9–38). Berlin: Springer-Verlag.
Picton, TW, & Hillyard, SA (1974). Human auditory evoked potentials. II. Effects of attention. Electroencephalography and Clinical Neurophysiology, 36 , 191–200.
Picton, TW, & Hink, RF (1974). Evoked potentials: How? What? Why? American Journal of EEG Technology, 14 , 9–44.
Picton, TW, Ouellette, J., Hamel, G., & Smith, AD (1979). Brainstem evoked potentials to tonepips in notched noise. Journal of Otolaryngology, 8 , 289–314.
Picton, TW, Stapells, DR, & Campbell, KB (1981). Auditory evoked potentials from the human cochlea and brainstem. Journal of Otolaryngology, 10 (Suppl. 9), 1–41.
Probst, R. (1983). Electrocochleography: Using extratympanic or transtympanic methods? ORL-Journal of Otorhinolaryngology and Related Specialties, 45 , 322–329.
Reneau, JP, & Hnatiow, GZ (1975). Evoked response audiometry . Baltimore: University Park Press.
Rosenhall, U., Bjorkman, G., Pederson, K., & Kall, H. (1985). Brainstem auditory evoked potentials in different age groups. Electroencephalography and Clinical Neurophysiology, 62 , 426–430.
Rowe, MJ (1978). Normal variability of the brainstem auditory evoked response in young and old adult subjects. Electroencephalography and Clinical Neurophysiology, 44 , 459–470.
Ruth, RA, Lambert, RR, & Ferraro, JA (in press). Electrocochleography: Methods and clinical applications. American Journal of Otology .
Ruth, RA, Mills, JA, & Ferraro, JA (in press). The use of disposable ear canal electrodes in auditory brainstem response testing. American Journal of Otology .
Salamy, A., Fenn, E., & Bronshvag, M. (1979). Ontogenesis of human auditory brainstem evoked potential amplitude. Developmental Psychology, 12 , 519–526.
Salamy, A., & McKean, CM (1976). Postnatal development of human brainstem potentials during the first year of life. Electroencephalography and Clinical Neurophysiology, 40 , 418–426.
Salt, AN, & Thornton, AR (1983). The effects of stimulus rise-time and polarity on the auditory brainstem responses. Scandinavian Audiology, 13 , 119–127.
Schwartz, DM, Larson, VD, & DeChicchis, AR (1985). Spectral characteristics of air and bone conduction transducers used to record the auditory brainstem response. Ear and Hearing, 6 , 274–277.
Schwent, VL, Hillyard, SA, & Galambos, R. (1976). Selective attention and the auditory vertex potential. I. Effects of stimulus delivery rate. Electroencephalography and Clinical Neurophysiology, 40 , 604–614.
Seales, DM, Rossiter, VS, & Weinstein, MD (1979). Brainstem auditory evoked responses in patients comatose as a result of blunt head trauma. Journal of Trauma, 19 , 347–353.
Selters, WA, & Brackmann, DE (1977). Acoustic tumor detection with brainstem electric response audiometry. Archives of Otolaryngology, 103 , 181–187.
Sohmer, H., & Feinmesser, M. (1967). Cochlear action potentials recorded from the external ear in man. Annals of Otology, Rhinology, and Laryngology, 76 , 427–435.
Sohmer, H., & Feinmesser, M. (1973). Routine use of electrocochleography (cochlear audiometry) on human subjects. Audiology, 12 , 167–173.
Sohmer, H., & Feinmesser, M. (1974). Electrocochleography in clinical-audio logical diagnosis. Archives of Otolaryngology, 206 , 91–102.
Sohmer, H., Feinmesser, M., & Bauberger-Tell, L. (1972). Routine use of cochlear audiometry in infants with uncertain diagnosis. Annals of Otology, Rhinology, and Laryngology, 81 , 72–75.
Sohmer, H., Feinmesser, M., & Szabo, G. (1974). Electrocochleographic (auditory nerve and brainstem auditory nuclei) responses to sound stimuli in patients with brain damage. Electroencephalography and Clinical Neurophysiology, 37 , 663–669.
Sohmer, H., Gafni, M., & Chisin, R. (1978). Auditory nerve and brainstem responses: Comparison in awake and unconscious subjects. Archives of Neurology, 35 , 228–230.
Sohmer, H., & Pratt, H. (1976). Recording of the cochlear microphonic potential with surface electrodes. Electroencephalography and Clinical Neurophysiology, 40 , 253–260.
Squires, KC, Chu, N., & Starr, A. (1978). Acute effects of alcohol on auditory brainstem potentials. Science, 201 , 174–176.
Staller, S. (1986). Electrocochleography in the diagnosis and management of Meniere’s disease. Seminars in Hearing (Electrocochleography), 7 , 267–277.
Stapells, DR, & Picton, TW (1981). Technical aspects of brainstem evoked potential audiometry using tones. Ear and Hearing, 2 , 20–29.
Stapells, DR, Picton, TW, Perez-Abalo, M., Read, D., & Smith, A. (1985). Frequency specificity in evoked potential audiometry. In JT Jacobson (Ed.), The auditory brainstem response (pp. 147–177). San Diego, CA: College-Hill.
Stapells, DR, Picton, TW, & Smith, AD (1982). Normal hearing thresholds for clicks. Journal of the Acoustical Society of America, 72 , 74–79.
Starr, A., & Achor, LJ (1975). Auditory brainstem responses in neurological disease. Archives of Neurology, 32 , 761–768.
Starr, A., Amlie, RN, Martin, WH, & Sanders, S. (1977). Development of auditory function in newborn infants revealed by auditory brainstem potentials. Pediatrics, 60 , 831–839.
Stockard, JJ, Sharbrough, FW, & Tinker, JA (1978). Effects of hypothermia on the human brainstem auditory response. Annals of Neurology, 3 , 368–370.
Stockard, JJ, Stockard, JE, & Sharbrough, FW (1978). Nonpathologic factors influencing brainstem auditory evoked potentials. American Journal of Electroencephalogram Technology, 18 , 177–209.
Stypulkowski, PH, & Staller, SJ (1987). Clinical evaluation of a new ECochG recording electrode. Ear and Hearing, 8 , 304–310.
Suzuki, T., Hirai, Y., & Horiuchi, K. (1977). Auditory brainstem responses to pure tone stimuli. Scandinavian Audiology, 6 , 51–56.
Suzuki, T., & Horiuchi, K. (1977). Effect of high-pass filter on auditory brainstem responses to tone pips. Scandinavian Audiology, 6 , 123–126.
Suzuki, JI, & Yamane, H. (1982). The choice of stimulus in the auditory brainstem response test for neurological and audiological examinations. Annals of the New York Academy of Sciences, 388 , 731–736.
Teas, DC, Eldridge, DH, & Davis, H. (1962). Cochlear responses to acoustic transients and interpretation of the whole nerve action potentials. Journal of the Acoustical Society of America, 34 , 1438–1459.
Teas, DC, Klein, AJ, & Kramer, SK (1982). An analysis of auditory brainstem responses in infants. Hearing Research, 7 , 19–54.
Terkildsen, K., Osterhammel, P., & Huis int Veld, F. (1974). Far field electrocochleography: Electrode positions. Scandinavian Audiology, 3 , 123–129.
Thornton, ARD (1975). Statistical properties of surfacerecorded electrocochleographic responses. Scandinavian Audiology, 4 , 91–102.
Turner, RG, Frazer, GJ, & Shepard, NT (1984). Formulating and evaluating audiological test protocols. Ear and Hearing, 5 , 321–330.
Turner, RG, & Nielsen, DW (1984). Application of clinical decision analysis to audiological tests. Ear and Hearing, 5 , 125–133.
Turner, RG, Shepard, NT, & Frazer, GJ (1984). Clinical performance of audiological and related diagnostic tests. Ear and Hearing, 5 , 187–194.
van Olphen, AF, Rodenburg, M., & Verway, C. (1978). Distribution of brainstem responses to acoustic stimuli over the human scalp. Audiology, 17 , 511–578.
Wada, SI, & Starr, A. (1983a). Generation of auditory brainstem responses (ABRs). I. Effects of injection of a local anesthetic (procaine HCL) into the trapezoid body of guinea pigs and cat. Electroencephalography and Clinical Neurophysiology, 56 , 326–339.
Wada, SI, & Starr, A. (1983b). Generation of auditory brainstem responses (ABRs). II. Effects of surgical section of the trapezoid body on the ABR in guinea pigs and cat. Electroencephalography and Clinical Neurophysiology, 56 , 340–351.
Wada, SI, & Starr, A. (1983c). Generation of the auditory brainstem responses (ABRs). III. Effects of lesions of the superior olive, lateral lemniscus and inferior colliculus on the ABR in guinea pig. Electroencephalography and Clinical Neurophysiology, 56 , 352–366.
Weber, BA (1983). Masking and bone conduction testing in brainstem response audiometry. Seminars in Hearing, 4 , 343–352.
Weber, BA, Seitz, MR, & McCutcheon, MJ (1981). Quantifying click stimuli in auditory brainstem response audiometry. Ear and Hearing, 2 , 15–19.
Wever, EG, & Bray, CW (1930). Action currents in the auditory nerve in response to acoustic stimulation . In Proceedings of the National Academy of Sciences of the United States of America (Vol. 16, pp. 344–350).
Whitaker, SR, & Lewis, AE (1984). The clinical usefulness of extratympanic electrocochleography . Paper presented at the Midwinter Meeting of the Association for Research in Otolaryngology, St. Petersburg Beach, FL.
Worthington, DW, & Peters, JF (1980). Quantifiable hearing and no ABR: Paradox or error? Ear and Hearing, 1 , 281–285.
Yanz, JL, & Dodds, HJ (1985). An ear-canal electrode for the measurement of the human auditory brainstem response. Ear and Hearing, 6 , 98–104.













