Potenziali Vestibolari Evocati Miogenici Oculari (o-VEMPs) riflesso vestibolo-oculare
Introduzione
Che Cosa È l’o-VEMPs
Anatomia e Fisiologia dell’o-VEMPs
A Che Cosa Serve l’o-VEMPs
Utilità clinica CVEMP E OVEMP
Metodologia
Analisi dei Tracciati
Applicazioni cliniche degli o-VEMPs approfondimento
Introduzione
 I Tests diagnostici del sistema vestibolare sono una componente essenziale per la diagnosi e successiva cura dell’ equilibrio erettile. Fino a poco tempo, i tests valutavano primariamente l’integrità del canale semicircolare orizzontale, che è solo una parte del sistema vestibolare. I recenti progressi nella tecnologia hanno offerto ai medici la possibilità di valutare la funzione degli otoliti attraverso i Potenziali Vestibolari Evocati Miogenici (VEMPs ). Questa procedura di nuova concezione migliora la gestione dei pazienti vertiginosi aumentando la specificità nell’ambito delle indagini nel sito di lesione.
I Tests diagnostici del sistema vestibolare sono una componente essenziale per la diagnosi e successiva cura dell’ equilibrio erettile. Fino a poco tempo, i tests valutavano primariamente l’integrità del canale semicircolare orizzontale, che è solo una parte del sistema vestibolare. I recenti progressi nella tecnologia hanno offerto ai medici la possibilità di valutare la funzione degli otoliti attraverso i Potenziali Vestibolari Evocati Miogenici (VEMPs ). Questa procedura di nuova concezione migliora la gestione dei pazienti vertiginosi aumentando la specificità nell’ambito delle indagini nel sito di lesione.
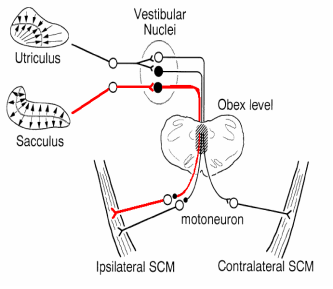
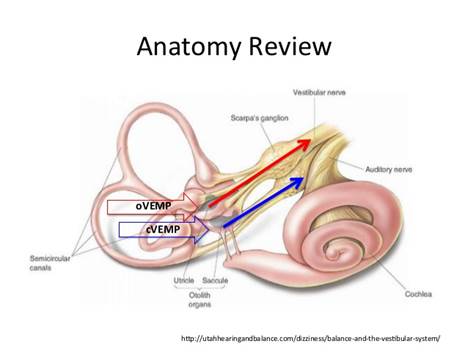
Il Potenziale Evocato Vestibolare Miogenico (VEMPs) è un potenziale muscolare di breve latenza che può essere registrato 1)da elettrodi di superficie posizionati sotto gli occhi vicino al obliquo inferiore è stato definito un VEMP oculare = VEMP oculare ( o-VEMPs )che compare quando il sistema vestibolare viene stimolato da un suono intenso;2) Un VEMP registrata dalla SCM è tradizionalmente indicato come un VEMP cervicale= VEMP cervicale (c-VEMP). Il potenziale può essere evocato da stimoli per via aerea , ossea o stimolazione galvanica, il VEMPs è un potenziale bifasico che rappresenta la risposta degli otoliti la stimolazione ad alta intensità . Il potenziale miogenico può essere registrato da varie località. Il sito di registrazione clinicamente più utilizzato è il muscolo sternocleidomastoideo (SCM) lungo la colonna vertebrale cervicale. Nonostante i suoi vantaggi, la procedura ha ancora limitazioni per quanto riguarda luogo ad una risposta c-VEMPs del SCM dei pazienti con scarso tono muscolare, ridotto range di movimento del collo e le popolazioni pediatriche e geriatriche.
Il test o-VEMPs oculare è prodotto da afferenze otolitiche nella divisione del nervo vestibolare superiore. l’o-VEMPs oculare è un potenziale di breve latenza, composto da risposte miogeniche extraoculari attivate dalla stimolazione sonora e registrate con elettromiografia di superficie tramite attivazione otolitica muscolare extraoculari ipsilaterale e controlaterale. Il muscolo obliquo inferiore è il più superficiale delle sei muscoli estrinseci responsabili per il movimento degli occhi. Pertanto, la misurazione degli o-VEMPs oculari può essere eseguita facilmente utilizzando elettrodi superficiali posizionati sulla pelle sotto gli occhi ipsi e controlaterali al lato stimolato. Questa nuova variante della procedura VEMPs può integrare i test convenzionali in popolazioni difficili da testare o, eventualmente, può essere in grado di valutare informazioni precedentemente inaccessibili sul sistema vestibolare. La ricerca ha dimostrato che questo potenziale non è influenzato dall’attività neuronale dei nervi cocleari e facciali, dimostrando che l’o-VEMP ha un’origine vestibolo-oculare. Sebbene gli studi clinici suggeriscono che questo potenziale è di origine vestibolare, la sua esatta provenienza e percorso non sono noti.(Rosengren SM, et al.2008; Todd NP,et.,al 2007/8)
Che Cosa È l’o-VEMPs
Un nuovo test per lo studio della funzione utriculare è stato recentemente introdotto e validato, cioè il potenziale evocato miogenico vestibolare oculare (o-VEMPs), che si riferisce ai potenziali miogenici registrati da elettrodi EMG posizionati sotto entrambi gli occhi in risposta alla vibrazione ossea esercitata (BCV) sulla testa o a stimolazione acustiche per via aerea (ACS). Il test o-VEMP differisce da un altro potenziale miogenico vestibolo-evocato registrato da elettrodi EMG di superficie, posizionati sui muscoli sternocleidomastoidei, che misura il potenziale evocato miogenico vestibolare cervicale (c-VEMP) in seguito all’attivazione sacculare. L’o-VEMPs è un test clinico affidabile che si basa su ampie prove fisiologica da studi su cavie, e in particolare la registrazione di risposte vestibolari afferenti a BCV, che dimostrano che la stessa BCV provoca movimenti oculari simili in entrambi cavie ed uomo.. L’o-VEMP è un potenziale a breve latenza, composto di risposte miogeniche extraoculari che vengono attivate dalla stimolazione sonora e registrati con elettromiografia di superficie tramite l’attivazione muscolare extraoculare otolitica ipsilaterale e controlaterale.( Kingma H. 2006 ; Leigh RJ., Zee DS.,1999; Park HJ.,et al., 2010; Rosengren SM., et al.,2008; Todd NP.,ET AL2007/8.)Il muscolo obliquo inferiore è il più superficiale dei sei muscoli estrinseci che sono responsabili dei movimenti oculari.Pertanto, la misurazione degli o-VEMPs può essere eseguita facilmente utilizzando elettrodi superficiali sulla pelle sotto gli occhi, ipsi e controlateralmente al lato stimolato. (Todd NP.,ET AL2008.)
|
|
• nei c-VEMPs la forma d’onda è positiva / negativa
• negli o-VEMPs la forma d’onda è negativa / positiva
|
Pannello sinistro mostra un c-VEMPs (in alto) e o-VEMPs (in basso) registrati dall’orecchio sinistro ed il pannello di destra mostra un c-VEMPs (in alto) e o-VEMPs (in basso) registrato dall’orecchio destro. Lo stimolo era uno tono-pipe di 500 Hz presentato a 100 dB NHL. (A): IL c-VEMP è costituito da un picco iniziale positivo registrato a ~ 13 msec (P1) seguito da un picco negativo registrato a ~ 23 msec (N1). (B): Al contrario del c-VEMPs, l’ o-VEMPs è costituito da un picco negativo iniziale registrato a ~ 10 msec (N1) seguito da un picco positivo registrato a ~ 15 msec (P1). c’è una differenza di scala tra le forme d’onda c-VEMPs e o-VEMPs. Il c-VEMPs è notevolmente più grande del o-VEMPs, molto probabilmente perché il muscolo sternocleidomastoideo SCM è un muscolo più grande del muscolo obliquo inferiore.
Anatomia e Fisiologia dell’o-VEMPs
La ricerca ha dimostrato che questo potenziale non è influenzato dall’attività neuronale dei nervi cocleari e facciali, dimostrando che l’o-VEMP ha un’origine vestibolo-oculare. Sebbene gli studi clinici suggeriscono che questo potenziale è di origine vestibolare, la sua esatta provenienza e percorso non sono noti. (Rosengren SM., et al.,2008; Todd NP.,ET AL2007/8.)
Rosengren, Welgampola, e Colebatch (2010) postulano il percorso neuronale per o-VEMP tramite il riflesso vestibolo-oculare: la stimolazione dell’utricolo attiva il nervo vestibolare superiore e successivamente il complesso nucleare vestibolare viaggiando sino al fascicolo longitudinale mediale dove ad un certo punto dopo decussazione termina al nuclei oculomotori, nervi oculari e ai muscoli estrinseci
|
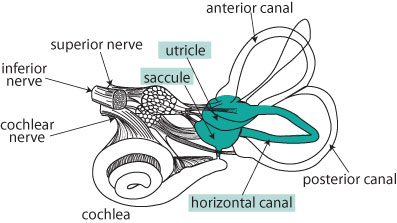
Arco Riflesso degli o-VEMPs: organo di origine: -Utricolo • via afferente : – Nervo vestibolare Superiore • connessioni centrali : nucleo -vestibolare • via efferente ( bilaterale) : – Fascicolo longitudinale mediale ( MLF ) diretto verso il III nervo cranico – il III CN innerva quattro dei sei muscoli estrinseci • organo finale muscolare : – Muscolo Obliquo Inferiore Contralaterale La Stimolazione utriculare porta all’eccitazione dell’ obliquo e retto inferiore dell’occhio controlaterale e di eccitazione retto o obliquo superiore dell’occhio ipsilaterale ( Suzuki et al 1969 ;Tokumasu et al. 1971) .
|
|
|
|
Arco Riflesso dei c-VEMPs: organo di origine -Sacculo • via afferente – Nervo vestibolare Inferiore • Collegamenti Centrali nucleo -vestibolare • via efferente – tratto Mediale o laterale del nucleo dorsale vestibulospinale del nervo cranico ‘accessorio XI – XI nervo Cranico cine innerva i motoneuroni del SCM • organo finale: i muscoli dello SCM
|
|
|
A Che Cosa Serve l’o-VEMPs
Messaggi chiave
1.Il test dei potenziali oculari (o-VEMP5) rappresenta una svolta in ambito diagnostico, perché permette di studiare selettivamente la funzione della macula utricolare — uno dei sensori dell’equilibrio del labirinto vestibolare — che proietta le proprie informazioni solo al Nervo Vestibolare Superiore.
2. Nella pratica otoneurologica, l’interesse del test consiste nella possibilità di identificare la patologia di una singola componente del nervo vestibolare, il cosiddetto nervo dell’equilibrio
3 La svolta importante della ricerca condotta dall’équipe italo-australiana, che ha portato alla messa a punto del test con o-VEMPs, è nell’identificazione di una nuova possibilità di interpretazione dei disturbi dell’equilibrio, con ricadute rilevanti in ambito terapeutico, in pazienti che abbiano subito una lesione acuta di tale nervo di varia origine, ad esempio virale o vascolare
L’o-VEMPs può essere il modo migliore per determinare se la sindrome da deiscenza del canale semicircolare superiore è anatomica (dove le scansioni TAC mostrano una SCDS ma in cui la deiscenza non influenzare la funzione dell’orecchio interno) o fisiologica (quando il SCDS colpisce la funzione dell’orecchio interno e può essere la causa dei sintomi del paziente) quando i c-VEMPs non mostrano una variazione delle soglie o ampiezze in un orecchio che è sintomatico per SCDS e le scansioni TAC mostrano una deiscenza. L’o-VEMPs può essere utile nei pazienti che hanno SCDS bilaterali e sintomi bilaterali per determinare l’orecchio che ha risentito più dalla deiscenza.
nei pazienti con Otosclerosi sono più frequenti le anomalie degli i o-VEMPs ,rispetto all’impulse test coerente con le più frequenti anomalie del utricolo.
spesso si osserva nella neurite vestibolare (VN) o Schwannoma vestibolare. Nei pazienti che non presentavano alcuna risposta su entrambi i lati per ACS, BCV era l’unico metodo che permette di valutare la funzione del nervo vestibolare superiore. Preferiamo utilizzare la stimolazione AFZ prima perché è più facile da eseguire nella pratica clinica di stimolazione mastoide.
Utilità clinica CVEMP E OVEMP
|
Caloric, Rotary Chair,vHIT► |
|
►o-VEMPs
►c-VEMPs
►Audio, ABR, AR |
Il più forte vantaggio dei test c-VEMP e o-VEMP è la loro capacità di misurare una parte diversa del sistema vestibolare (cioè gli organi finali otolitici ) ,mentre con la videonistagmografia (VNG) ed i test rotazionali si valuta contemporaneamente il canale laterale semicircolare (SCC) destro e sinistro e le sue connessioni con il superiore nervo vestibolare. I VEMPs esaminano e valutano separatamente il labirinto di destra e sinistra, rendendo i VEMPs ulteriormente utili a localizzare il lato della lesione. Un altro vantaggio è che entrambi questi test sono relativamente veloci e molto tollerabile per i pazienti, utili anche nei bambini . Tuttavia, uno dei maggiori limiti degli VEMP test è che il tasso di risposta diminuisce nei pazienti anziani. Uno dei limiti dei test clinici VEMP è che, come la maggior parte prove vestibolari, i VEMPs valutano il sito di lesione, non necessariamente la presenza o assenza di malattia. Ad esempio, i c-VEMPs sono spesso anormali nei casi di neurite vestibolare inferiore, mentre gli o-VEMPs ed test calorico (ad esempio, entrambi misurano la funzione del nervo vestibolare superiore) sono di solito normali. (Kim JS, Kim HJ. 2012) Tuttavia, la diagnosi di neurite inferiore si basa in ultima analisi, case history. Inoltre, c-VEMPs sono ipotizzati per essere utile nella malattia di Meniere, un’altra diagnosi in base alla storia clinica e risultati audiometrici, perché il sacculo si crede di essere la struttura più coinvolti in idrope endolinfatico, seguendo la coclea. I tests Calorici e i tests con sedia rotatoria non valutano il sacculo e possono pertanto sottovalutare i disturbi vestibolari nella malattia di Meniere. Tuttavia, la sensibilità e la specificità di c-VEMPs sono solo nel 50% e 48,9%, rispettivamente, in pazienti con malattia monolaterale definitiva di Meniere. (Egami N, et al.,2013) I VEMPs non sono essenziali per la diagnosi di emicrania, che è una diagnosi clinica, ma può essere importante quantificare il coinvolgimento vestibolare. Un recente rapporto ha suggerito che I VEMPs sono più spesso bilateralmente assenti nei pazienti con emicrania rispetto ai controlli. (Hong SM,et al 2010) , infine, è stato ipotizzato che i pazienti con menomazioni del sacculo ed utricolo e misurata utilizzando le prove c-VEMP e o-VEMP, possono essere più suscettibili alla BPPV in quanto gli otoconi responsabile della canalitiasi originano negli organi finali otoliti.(Lee JD.,et al.,2013)
Nonostante le limitazioni, c’è almeno una patologia vestibolare dove test VEMP sono estremamente utile e, in effetti, misurano la presenza della malattia. Cioè, uno dei migliori usi del VEMP risiede nella sua capacità di aiutare nella diagnosi di deiscenza canale semicircolare superiore (SCD).
Deiscenza del Canale Semicircolare Superiore
Nel 1998, Minor e colleghi hanno riportato una nuova patologia vestibolare IN cui il suono e le variazioni di pressione possono indurre vertigini e questa patologia è causata da un difetto di osseo (cioè, una deiscenza) sul CANALE SEMICIRCOLARE SUPERIORE (SCD )che si trova sotto il pavimento della fossa cranica media. Questi pazienti tendevano a lamentare sintomi strani come vertigini quando si starnutisce, sentendo muoversi i propri occhi una particolare sensibilità ai forti rumori. I test dell’udito di questi pazienti di solito hanno mostrato bassa cadute atipiche per le basse frequenze, in presenza di normali test impedenzometrici (quindi molti di questi pazienti avevano subito un intervento chirurgico esplorativo dell’orecchio medio con esito negativo). (Minor LB., et al.,1998)
La Deiscenza dell’osso sovrastante il SCC superiore è chiamato deiscenza del canale semicircolare superiore, o. Considerando che il sistema cocleare è composto da due aperture (finestre ovale e rotonda) che hanno un’ impedenza relativamente bassa, i fluidi vestibolari sono essenzialmente incomprimibili, in un sistema sano, e minimamente influenzata dalla pressione sonora. Nel caso della SCD, esiste una “terza finestra” (cioè, l’osso deiscente) che permette agli stimoli sonori modifiche della pressione, che spostano l’endolinfa all’interno del SCC interessato. I pazienti con SCD spesso riferiscono un gruppo di sintomi vestibolari e uditivi, il più comunemente riportato indicato nella tabella 1.
Tabella 1. I sintomi più comuni e segni di SCD *
|
sintomi |
% |
|
Autofonia |
97 |
|
Ipoacusia Trasmissiva |
89 |
|
Il suono determina vertigini (fenomeno di Tullio) |
83 |
|
Acufeni |
81 |
|
Disequilibrio Cronico |
73 |
|
Variazioni di Pressione Determinano Vertigini (segno di Hennebert) |
68 |
|
Senso di Pienezza o Pressione nell’ Orecchio |
62 |
|
Vertigine Posizionale |
42 |
|
segni |
|
|
Il suono determina nistagmo |
72 |
|
Variazioni di pressione/Valsalva determina nistagmo |
53 |
|
Il suono determina oscillopsia |
33 |
|
VEMPS anormali |
|
|
Ipoacusia trasmissiva con normale timpanometria |
|
|
Riduzione del guadagno del VOR del canale semicircolare superiore |
|
* Percentuali, quando somministrato, si basano su uno studio di 34 pazienti con SCD14 e uno studio di 26 pazienti con SCD. 15 Fonte: dati da Baloh, 13 . Tavassolie, et al, 14 . e Zhou 15
la SCD è tipicamente confermata con una tomografia computerizzata ad alta risoluzione dell’osso temporale (CT).Tuttavia, scansioni CT tendono a sovrastimare la dimensione della deiscenza e, a causa di artefatti di imaging, si può erroneamente rilevare deiscenza in pazienti con un rivestimento osseo molto sottile e in pazienti asintomatici.(Tavassolie TS, et al.,2012; Williamson RA et al.,2003) Per produrre un’immagine, crudo CT dati viene filtrato con un filtro di riduzione del rumore e rilevamento dei bordi sono applicati algoritmi, che può effettivamente rimuovere osso sottile da un’immagine finale risultante in quello che sembra essere un deiscenza. 14 Ciò può comportare un falso-positivo e una diagnosi errata di SCD. In altre parole, scansioni CT hanno una sensibilità elevata, ma possono produrre falsi negativi con conseguente bassa specificità per la diagnosi di SCD.
VEMP test possono essere utilizzati per rilevare se una deiscenza provoca trasmissione della pressione patologica nel labirinto vestibolare, e sono quindi particolarmente adatto per l’identificazione di SCD. In orecchie sani, acustico con una sufficiente intensità elevata stimolare il sacculo e otricolo conseguente riflesso muscolare possiamo registrare utilizzando elettrodi di superficie sopra il muscolo di interesse (cioè, un VEMP).Con un canale deiscenti, la pressione sonora provoca maggiore stimolazione degli organi terminali vestibolari quanto sarebbe altrimenti normale in un normale funzionamento a labirinto. Il risultato è spesso un aumento dell’ampiezza del VEMP e una soglia anormalmente bassa VEMP. Di conseguenza, sia cVEMPs e oVEMPs si sono dimostrati utili per valutare la presenza di SCD.
Cenni storici, definizione e basi anatomo-funzionali
|
Normali Volontari , stimolazione sonora AC dell’orecchio ( ad esempio , a sinistra nella figura ) , le registrazioni dei movimenti dell’occhio sia con EOG che con elettrodi oculari – EOG mostrato picchi a 8.1 ~ 12.7 ms – Picco Cerca coil a 16.5 ~ 20.1 ms -Evidenza di potenziali evocati vestibolari miogenici , NON dipolo Corneo – retinico (Todd et al., 2007 , Welgampola et al.2009) • attività EOG registrati in pazienti con enucleazione del bulbo oculare ma con muscoli estrinseci conservati ( Chihara et al. , 2009) • Studio su Animali (cane),EOG e registrazione intramuscolare EMG la a breve latenza. – Risposte con EOG di superficie: latenza e ampiezza simile a registrazione intramuscolare (muscoli extra- oculari ) , e NON dipendano dalla presenza della retina ( Sasaki et al. , 2002) • i burst evocati vestibolare a breve latenza dei muscoli extra- oculari ( EMG ) possono essere rilevate dal montaggio e registrazione EOG
|
|
Potenziali Evocati Oculari Vestibolari Miogenici

La scoperta della risposta c-VEMP e il suo percorso neuronale ha incoraggiato i ricercatori ad esplorare nuove stimolazione e metodi registrazione. Le Ricerche di Todd e colleghi (2003 ) hanno dimostrato una potenziale evocato vestibolare di breve latenza con un picco negativo a 10 ms ( n10 ) e un picco positivo circa 15 ms in risposta ad un stimolo forte 500 Hz per via ossea quando si registra da Cz e Fpz , che sono rispettivamente al vertice e sulla linea mediana della fronte ,
|
Fz |
10ms n10 |
Gli o-VEMPs sono molto più piccoli rispetto ai c-VEMP (solo circa 10 microvolt, contro i circa 50 microvolt ottenuti con i c-VEMPs)
· Il filtro cut-off è fissato a 20Hz -500Hz. (Questa risposta non è un EOG, è in primo luogo un EMG)
· Di solito sono sufficienti 50 stimoli (a 3 / sec = 17 secondi)
· L’ampiezza delle risposte Fnz 10 misurata dalla linea basale al picco è di circa 5-10 μV ed è circa uguale in entrambi gli occhi
· il potenziale è negativo (eccitatorio) non positivo (inibitorio) come ilP13 dei c-VEMP,s Si . Pensa che questo potenziala o-VEMPs rifletta l’attivazione dei muscoli obliquo inferiore e retto inferiore
Allora la n10 è di origine vestibolare ?????
Come posso testarla ????

o-VEMPs ottenuto con vibrazioni trasmesse sull’osso a Fz
c-VEMPs con suoni trasmessi omolateralmente per via aerea
Perchè si conferisce tanta enfasi alla vibrazione al Fz ????
Perché questa è un punto di stimolazione speciale, privilegiato per entrambi i labirinti , simultaneo ed uguale
Le vibrazioni arrivano ad ognuna delle due mastoidi allo stesso momento e sono della stessa ampiezza e sono un trigger per le risposte
|
|
|
|
|
|
conclusione
-n10 del o-VEMP di Fz BCV indica in primo luogo la funzione della macula utricolare controlaterale
-p13 del VEMP to Fz BCV indica in primo luogo la funzione della macula sacculare omolaterale


La figura è un esempio di una risposta n10 trovato in un soggetto normale .
Le soglie di queste risposte sono state simili alle soglie c-VEMP dei soggetti , non erano presenti in soggetti con e senza perdita di udito , non erano presenti in soggetti con sistemi vestibolari ipoattivi ed erano presenti in soggetti con sintomi vestibolari iperattivi (Todd, Rosengren, e Colebatch, 2003). non erano presenti in soggetti con segni di iperattività vestibolare
Suono evoca risposte peri oculare Halmagyi et al (2003 ) riportarono una risposta bifasica a registrabile con un EOG Montaggio: risposte erano assenti nei controlli normali, ma registrabile in SCD .
|
|
|

Il più grande vicino all’occhio
Nessuna inversione di fase
Assente in vestibolopatie totali
Potenziali perioculari in soggetti normali ( Rosengren et al., 2005 )fig n°

Intensi ( 110 dB ), ma brevi ( 0,1 ms ) click attivano afferenze vestibolari ed evocano una movimento dell’ occhio di latenza breve nei soggetti con SCDS ( Halmagyi et al., 2003 ;Aw et al 2006) .
Questi risultati hanno portato a postulati che la risposta era vestibolare, e possibilmente sacculare, in natura. Rosengren e colleghi (2005) non ha visto la componente n10 in pazienti normali quando si utilizza uno stimolo per via ossea ad alta frequenza, che è coerente con le precedenti risultati che suggeriscono che gli organi otoliti sono più sensibili alle basse frequenze (Sheykholeslami, Kermany, e Kaga, 2001). Ulteriori ricerche hanno confermato che il componente n10 risposta è stata vestibolare origine e molto probabilmente proveniente dalla via otolito-oculare (Chihara, Iwasaki, Ushio, e Murofushi, 2007; Govender, Rosengren, e Colebatch, 2009;Iwasaki, et al., 2008; Rosengren, Todd, e Colebatch, 2005; Todd Rosengren, Aw, e Colebatch,2007; Wang, Mascella, & Young, 2009).. Con le sue origini negli organi otoliti, le risposte n10 sono registrati più dai muscoli extraoculare un po’ sotto l’occhio controlaterale alla stimolazione (Rosengren et al., 2005). Il potenziale non è in risposta al movimento degli occhi, ma invece è miogenico in natura e nasce dal riflesso vestibolo – oculare ( Chihara et al , 2009; . Rosengren et al , 2005; . . Todd et al, 2007 ;Welgampola , Migliaccio , Myrie , Minor , e Carey , 2009) ma invece è miogenico in natu
La componente del potenziali n10 viaggia attraverso la via vestibolare e viene registrato dal muscolo obliquo inferiore controlaterale (Rosengren et al., 2005) anche se altri ipotizzano che il retto inferiore può anche contribuire alla risposta (Welgampola et al., 2009). Todd et al. (2007) ne deducono ricerca c-VEMP precedente (Colebatch & Rothwell, 2004) che la risposta n10 a livello della muscoli estrinseci è eccitatorio a causa della sua iniziale risposta di picco negativo.
I muscoli estrinseci inferiori sono meglio attivate quando gli occhi guardano in alto (Chihara et al, 2007;. Govender et al, 2009;. Rosengren et al., 2005; Wang et al., 2009;Welgampola et al., 2009). Rosengren et al. suggeriscono che la registrazione dei potenziali extraoculari potrebbe “ampliare la gamma delle vie vestibolari e oculari centrali e periferiche che possono essere valutato elettrofisiologicamente “(2005, p. 1947). Il metodo di registrazione del VEMP n10 che da informazioni da una posizione extraoculare è stato quindi nominato Potenziale Evocato Vestibolare Miogenico Oculare (o-VEMP).
Dalla analisi della ricerca di cui sopra, Rosengren, Welgampola, e Colebatch (2010) postula il percorso neuronale per o-VEMP tramite il riflesso vestibolo-oculare: attivazione del nervo vestibolare e complesso nucleare vestibolare che viaggia fino al fascicolo longitudinale mediale dove ad un certo punto con una decussazione termina nei nuclei oculomotori, nervi oculari e suoi muscoli estrinseci.
Come il percorso o-VEMP viene confermata, i ricercatori stanno studiando contemporaneamente i risultati o-VEMP. Vari sono i metodi di stimolazione per suscitare la risposta o-VEMP: conduzione aerea, conduzione ossea, percussione della fronte e la stimolazione galvanica, anche se la stimolazione per via aerea ed ossea sono le tecniche più studiate. Quando si utilizza uno stimolo acustico per via aerea , il Tono Pipe di 500 Hz è il più efficace nel produrre risultati ottimali rispetto a quando si utilizza come stimolo il click (Chihara et al., 2007). Le risposte o-VEMP per conduzione aerea ed e ossea si sono dimostrato avere frequenze analoghe (ossia 500 Hz Tone burst) a quelle necessarie per ottenere risposte c-VEMPs (Park, Lee, Shin, Lee, & Park, 2010; Rosengren et al., 2005;Todd et al., 2003; Todd et al., 2007). Parco et al. (2010) sostengono che il c-VEMP è una misura più affidabile e robusto dei test o-VEMPs. Possono essere ottenuti VEMPs per via aerea attraverso una presentazione dello stimolo mono o binaurale con simili. Risultati (Wang et al., 2009) con soglie normali per gli o-VEMP si ottengo a 80-90 dB NHL quando si utilizza uno stimolo per via aerea a 500 Hz e quando ottenute in posizione seduta (Parco et al., 2010;Wang et al., 2009).
Mentre i parametri di stimolo ed i successiva valori normativi di soglia sono stati ottenuto per i test o-VEMP, gli effetti della posizione del corpo sono ancora poco conosciuti. Govender et al. (2009) hanno esplorato gli effetti della posizione del corpo, rotazione della testa e la visione sulle risposte o-VEMPs
Questi ricercatori non hanno trovato risultati significativi con i cambiamenti nella rotazione della testa o della visione. Tuttavia, hanno riscontrato che la posizione del corpo con il tronco posizionato, con un angolo di 30 ° interessa l’ampiezza degli o-VEMPs, che è in contrasto con la tipica posizione seduta utilizzata in studi precedenti per evocare o-VEMPs. Dopo una revisione della letteratura, è evidente che è necessaria un’ulteriore comprensione della o-VEMP.
L’attuale studio ha indagato le tecniche di posizionamento o-VEMP per migliorare le future procedure o-VEMP.
L’ipotesi testata afferma che modificando la posizione del corpo, si può ottenere una differenziazione del sacculo dall’ utricolo durante i test o-VEMP. A causa della orientamento anatomico ortogonale delle macule degli otoliti, potenziali differenziale a riposo specifici per la gravità dovrebbe verificarsi durante il posizionamento specifico del corpo come risultato delle forze gravitazionali sugli otoconi delle membrane sacculare rispetto agli otoconi delle membrane utricolari.
Gli o-VEMPs originerebbero prevalentemente dall’attività utricolare (Rosengen et al., 2005 ).
Negli ultimi 10 anni si è assistito ad una crescita esponenziale dei contributi scientifici finalizzati a sviscerare il ruolo clinico-diagnostico di questi nuovi test. In realtà, mentre particolarmente estesa è la letteratura concernente i c-VEMPs, ancora scarsi sono i contributi cimici sui più recenti o-VEMPs. Ciononostante, anche considerando che non tutti gli aspetti concettuali sono pienamente condivisi, oggi è possibile considerare lo studio dei VEMPs una insostituibile ed affida bile metodica di studio della funzionalità maculare ricca di importanti implicazioni cliniche.
Lo stimolo meccanico, erogato con specifici vibratori a membrana o piezoelettrici, invece, è in grado di eccitare sia il sacculo che l’utricolo I neuroni afferenti dal sacculo sono gli stessi che vengono eccitati dallo stimolo acustico (via discendente). I neuroni afferenti dall’utricolo, per contro, percorrono il nervo vestibolare superiore e trovano connessione sinaptica con i motoneuroni dei nuclei oculomotori (via ascendente) controlaterali, Purtroppo, non sono del tutto note le modalità di distribuzione delle fibre irregolari all’interno dei nuclei oculomotori, ma si ritiene che il contingente maggiore sia destinato al controllo dei muscoli retto inferiore ed obliquo inferiore. A differenza di quanto avviene per la via discendente “sacculare”, in questo caso la stimolazione dell’utricolo evoca un riflesso di tipo eccitatorio e crociato. Lo stimolo meccanico ha il grande svantaggio di non consentire una stimolazione esclusivamente monolaterale dei recettori maculari ma, per contro, ha il grande vantaggio di poter essere “opportunamente manipolato” per ottenere le caratteristiche frequenziali e direzionali idonee per rendere più selettivo lo stimolo nei confronti non solo di uno specifico recettore (sacculo od utricolo), ma anche di specifiche aree all’interno dello stesso. Si ricorda, infatti, che i recettori maculari giacciono prevalentemente su uno specifico piano (orizzontale per l’utricolo e verticale per il sacculo) e che possiedono verosimilmente una frequenza di risonanza meccanica intrinseca diversa (centrata sulle basse frequenze per l’utricolo e sulle alte frequenze per il sacculo). E per questo motivo che sono state proposte diverse modalità di stimola zione meccanica che differiscono non solo per la direzione dello stimolo (ad incidenza frontale, piuttosto che laterale o verticale, ecc.), ma anche per le caratteristiche frequenziali dello stimolo (stimoli ripetitivi centrati sulle frequenze medio gravi piuttosto che sulle frequenze acute o stimoli asimmetrici impulsivi in grado di eccitare piuttosto che inibire una specifica area del recettore maculare). E intuibile come il grado elevato di complessità di queste problematiche e l’ancora scarsa conoscenza delle vie anatomiche di questi riflessi non facilita il processo di standardizzazione della metodica (essenzialmente per quanto concerne lo studio degli o-VEMPs da stimolo meccanico).
Da un punto di vista clinico, comunque, ha ormai preso il sopravvento una modalità di stimolazione meccanica basata su uno stimolo ripetitivo (tone-burst centrato sui 500 Hz) erogato in senso anteroposteriore (punto di applicazione sulla zona centrale della fronte, Fz). Questo stimolo sarebbe in grado di determinare una distorsione meccanica del cranio in grado di translare lateralmente in direzione opposta le aree laterali dove giacciono le macule utricolari. Il tutto si tradurrebbe in una stimolazione eccitatoria sul piano orizzontale (stimolo non fisiologico) di uguale intensità di entrambi gli utricoli che favorirebbe pertanto il riconoscimento di un eventuale stato di asimmetria funzionale tra i due recettori (Iwasaki et al., 2008).
Arco Riflesso degli o-VEMP:
• orecchio esterno / medio ( se AC )
• utricolo
• Nervo Vestibolare Superiore
• Nuclei Vestibolari
• Fascicolo Longitudinale Mediale
• III nervo cranico – Oculomotore
• Muscolo Obliquo Inferiore
• Sembra che sia il sacculo che l’utricolo sono stimolati da ad alto livello
di stimoli per via aerea ed osseo – stimoli a bassa frequenza .
La Stimolazione utriculare porta all’eccitazione dell’ obliquo e
retto inferiore dell’occhio controlaterale e di eccitazione retto o obliquo
superiore dell’occhio ipsilaterale ( Suzuki et al 1969 ;Tokumasu et al. 1971) .

Metodologia
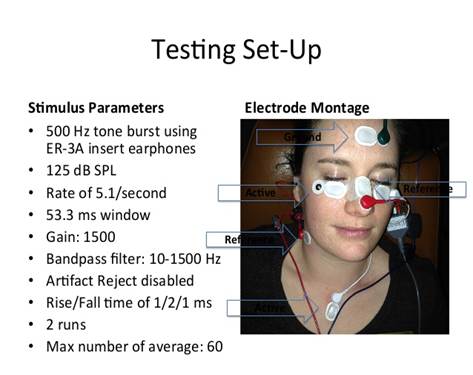
Da un punto di vista metodologico, per acquisire i VEMPs è sufficiente disporre della stessa strumentazione utilizzata per lo studio dei potenziali uditivi del tronco. Trattandosi di potenziali miogenici, ovvero variazioni dell’attività elettromiografica di base, è fondamentale la collaborazione attiva del paziente nel mantenere un livello costante di contrazione del distretto muscolare analizzato, rappresentato dai SCM per quanto concerne i c-VEMPs (Colebatch et al., 1994) e dai muscoli obliquo inferiore (01) e retto inferiore (RI) per gli o-VEMPs (Rosengren et al., 2005). E stata infatti dimostrata l’esistenza, oltre che di un intuitivo rapporto diretto tra intensità dello stimolo applicato ed ampiezza del potenziale, anche di un rapporto lineare tra quest’ultima ed entità della contrazione muscolare (Colebatch et al., 1994): da qui nasce il reale limite clinico di questa metodica rappresentato dell’ampia variabilità intra- ed inter-individuale dei parametri quantitativi della risposta (soprattutto per quanto concerne i c-VEMPs), anche considerando il processo di normalizzazione ottenibile rapportando l’entità della risposta all’attività mioelettrica di base (ovvero il valore medio calcolato sul tracciato rettificato pre-stimolo).
Sinteticamente, le caratteristiche fondamentali per l’assetto di esecuzione sono:
a. posizione del paziente supino su un lettino (l’esecuzione dell’esame è possibile comunque anche a paziente seduto); L’ampiezza del o-VEMP è ampiamente influenzata dalla direzione dell’occhio. E ‘alto quando guardando in alto, basso quando guardando avanti, e abolito quando guardando in basso. (Rosengren SM, et al.2008; Todd NP, et., al 2007/8) Durante la misurazione di o-VEMPs, quindi, il paziente viene istruito a guardare verso l’alto, fissando un punto fisso, perché le risposte sono di ampiezza superiore quando il soggetto guarda in questa direzione. (Kingma H.,2006;Rosengren SM, et al.2008; Todd NP, et., al 2007/8) Si raccomanda che il punto fisso sia collocato in alto a 2 m dagli occhi del paziente. Durante l’esame, gli occhi devono rimanere fissi. Le risposte sono registrate ipsilaterale alla stimolazione applicata e controlateralmente al muscolo extraoculare obliquo inferiore. Così, l’ampiezza del potenziale diventa più evidente quando guardando, come in questa situazione il muscolo obliquo inferiore rimane vicino all’elettrodo registro. (Chihara Y, et al 2007) Una possibile spiegazione aggiuntiva di questo fenomeno è che quando il muscolo si contrae durante la ricerca, più unità motorie sono attivate in maniera sincrona, producendo un componente di ampiezza maggiore. (Chihara Y, et al 2007; Rosengren SM, et al.2008)pl test continuo e ripetitivo può causare affaticamento della vista e / o involontaria contrazione irregolare , deteriorando la qualità della forma d’onda. Pertanto, la stimolazione binaurale è stato suggerito come opzione per ridurre la durata della prova. (Todd NP, et., al 2007)
Potenziale Vestibolare Evocato Oculare Miogeno ” OVEMP “
( Rosengren et al. , 2005)

Utilizza lo stesso stimoli
• Registrato intra orbitalmente
• Inoltre potenziale a breve
latenza ( ” n10 ” )
• Eccitatorio piuttosto
che inibitorio .
• predominante
controlateralmente

b. 5 elettrodi (AgJAgC1) pregelificati ad impedenza bassa e costante (<Skfl), come i comuni elettrodi da ECG. Nonostante la polarità non sia fondamentale (Colebatcì2 et al., 1994), per uniformare i tracciati a quelli presenti in letteratura, è utile che la posizione degli elettrodi segua i seguenti schemi:
o-VEMPs: 2 coppie di elettrodi disposti simmetricamente al di sotto di ciascun occhio (l’elettrodo attivo i cm sotto la palpebra, quello indifferente a 2 cm), con un quinto elettrodo (di terra) posto sempre sulla porzione superiore dello sterno (Chihara et al., 2007);
Essendo l’ampiezza degli o-VEMPs all’incirca di un ordine di grandezza inferiore rispetto a quella dei potenziali cervicali, l’amplificazione non deve essere eccessiva per questi ultimi (50 pV/div), e la finestra temporale di analisi può essere impostata sui 50-100 ms per l’idonea visualizzazione dei potenziali cervicali e perioculari, che occorrono normalmente entro i primi 30 ms dall’inizio dello stimolo.
Analoghe considerazioni si possono riservare per la stimolazione condotta per via ossea, ricordando che essa può essere erogata sia in maniera simmetrica a direzione frontale, applicando il vibratore su Fz (Iwasaki et al., 2008), che a livello mastoideo (Todd et aL, 2008) ottenendo così uno stimolo impulsivo laterale asimmetrico, ma sicuramente in grado di attivare i recettori maculari più fisiologicamente.
Per ottenere una corretta attivazione della muscolatura in esame, è necessario istruire il paziente utilizzando le seguenti indicazioni:
b. nel rilevamento degli o-VEMPs, si invita semplicemente il soggetto a dirigere lo sguardo supero-medialmente mantenendo il capo fermo, Tali contrazioni devono essere chiaramente mantenute costanti per tutta la durata della stimolazione.
Analisi dei Tracciati
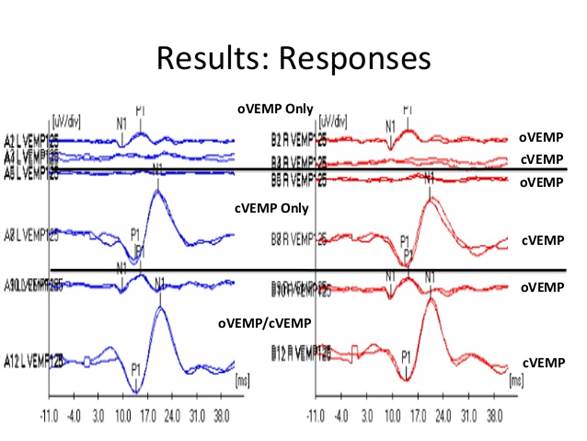
Nel soggetto sano i VEMPs si caratterizzano per la presenza di un complesso polifasico (li onde, rappresentato da oscillazioni ondulatorie rispetto alla linea isoelettrica a polarità negativa (dette “n”, per convenzione dirette verso l’alto rispetto all’isoelettrica) e a polarità positiva (“p” verso il basso), ognuna delle quali si contraddistingue per una specifica latenza dall’inizio dello stimolo. I suffissi possono essere ordinali (p1, n 1, ecc.) oppure sostituiti dal valore della latenza, espressa in ms, in cui si registra il picco (n10, p13, ecc.).
Per quanto concerne gli o-VEMPs, l’aspetto che maggiormente li differenzia dalle risposte colliche è la presenza di una risposta eccitatoria crociata (Figura 2), caratterizzata da una serie di picchi a polarità positiva e negativa la cui espressione principale è l’onda negativa a latenza di circa 10 ms (n10 o n1) rilevabile in corrispondenza del lato controlaterale a quello stimolato (Chihara et al., 2007; Iwasaki et al., 2008). Questa risposta, rilevabile quindi a livello dei muscoli dell’occhio controlaterale, può essere evocata da stimolazioni acustiche sia per VA che per VO ed è mediata verosimilmente da vie sacculo-oculari (Chihara et al., 2007) ed utricolo-oculari (Iwasaki et al., 2008), rispettivamente. Chiaramente, anche nel caso dei potenziali perioculari per VA, è indispensabile l’integrità del sistema di conduzione dell’orecchio.
Utile infine ricordare che, per meglio riconoscere le componenti significative del tracciato, è sempre conveniente effettuare il re-test, per verificarne la ripetibilità e quindi la validità in termini elettrofisiologici, ed eventualmente ridurre la finestra del filtro passa banda sui 10 Hz – 1 kHz.

FIGURA 2 – o-VEMPs per via ossea (deiscenza del CSS destra): Lo stimolo TB 500Hz in Fz evoca la risposta perioculare bilateralmente con una asimmetria di ampiezza a favore del lato destro .
Applicazioni cliniche degli o-VEMPs
I primi studi clinici, che risalgono al 2007, hanno permesso di comprendere non solo l’utilità clinica di questo test ma anche di verificare, sul piano clinico, le ipotesi emerse dagli studi di tipo fisiologico sulla ancor poco conosciuta funzione maculare legata all’attività di tipo fasico.
Lo studio della Neurite Vestibolare (NV) rappresenta non solo l’ambito di maggior interesse, ma anche il modello su cui i principali autori hanno delineato le modalità di stimolazione clinicamente più appropriate ed i criteri interpretativi più validi.
vestibolare neurite
• Utilizzando sia i c-VEMPs che o-VEMPs possiamo localizzare il coinvolgimento del nervo superiore vs ill nervo inferiore
• Ricordiamo :
-gli o-VEMPs studiano e misurano l’Utricolo ed il Nervo Vestibolare Superiore
– i c-VEMPs studiano e misurano il Sacculo ed il Nervo Vestibolare Inferiore
• Se il paziente ha la neurite vestibolare superiore , dovrebbe avrebbe dovuto compromessa gli o-VEMPs su quel lato , ma il c-VEMPs dovrebbe essere normale
• Se il paziente ha la neurite vestibolare inferiore , il paziente dovrebbe aver degli o-VEMPs conservati bilateralmente ed il c-VEMPs dovrebbe essere assente sul lato della neurite
In caso di neurite vestibolare superiore in fase acuta si può assistere infatti ad una riduzione (o assenza) di risposta degli o-VEMPs del lato interessato e ad una consensuale ipo-areflessia canalare al test Calorico bitermico; risultano preservati invece i c-VEMPs, indicando la corretta funzionalità del nervo vestibolare inferiore (Iwasaki et al., 2009). Ciò avverrebbe indipendentemente dalla modalità di stimolazione utilizzata per evocare i potenziali indicando quindi una specificità funzionale “in efferenza”: gli o-VEMPs sembrerebbero esprimere essenzialmente la funzionalità della componente fasica utricolare mentre i c-VEMPs di quella sacculare. Se da un lato i primi studi sulla nevrite vestibolare superiore hanno previsto per gli o-VEMPs il solo utilizzo dello stimolo meccanico frontale (tone burst 500 Hz erogato mediante un vibratore clinico applicato su Fz), più recentemente accanto a questa modalità è stato affiancato anche lo stimolo per via aerea riscontrando a favore della sua ipotesi analoghe percentuali di alterazione della risposta perioculare (Curthoys et al., 2011).
Soggetto Normale Paziente con SVN

Al contrario, studiando pazienti affetti da neurite vestibolare superiore in fase acuta con protocolli di stimolazione per via aerea (clicks o short tone burst) ed ossea (stimolo impulsivo per via mastoidea o taps frontali/mastoidei), altri Autori hanno riscontrato percentuali diverse di alterazione delle risposte cervicali ed oculari a seconda degli stimoli utilizzati (Govender et al., 2011). Se risulta chiara la dissociazione tra c-VEMPs ed o-VEMPs dopo stimolo condotto per via aerea, analoghe percentuali di alterazione di entrambi i tipi di potenziali sono stati riscontrati dopo stimolo impulsivo mastoideo, confermando che anche a livello clinico non è possibile considerare in senso assoluto la visione di Curthoys, in quanto non si può escludere anche una dipendenza dello stimolo nella genesi della risposta: così come lo stimolo meccanico può influenzare l’utricolo nella genesi dei c-VEMPs, è verosimile che anche il sacculo contribuisca alla genesi degli o-VEMPs dopo stimolazione condotta per via aerea (specificità funzionale “in afferenza”). Nonostante queste due visioni in parte contrastanti abbiano contribuito alla fioritura di un proficuo dibattito scientifico, ancora non si è giunti ad una visione universalmente condivisa.
Sempre seguendo la teoria della specificità funzionale in efferenza, è stato dimostrata su 59 casi di sospetta neurite vestibolare inferiore una dissociazione tra c-VEMPs (assenti o ridotti in ampiezza in corrispondenza del lato patologico) ed o-VEMPs (nei limiti della normalità) evocati dal solo stimolo vibratorio su Fz (Manzari et al., 2012).
Esempio di Neurite del Nervo Vestibolare Inferiore
|
Caloriche: Normali |
o-VEMPs: Normali |
|
|
|
|
|
c-VEMPs: Anormali, 50% asimmetria |
|
Prima della nostra capacità di valutare il nervo vestibolare inferiore e localizzare la sofferenza , molti pazienti con interessamento del IV°N erano scambiati come pazienti con disturbi vestibolari centrali ( Kim & Kim , 2012) Jacobson |
Jacobson, McCaslin, & Piker (2011) |

ALTRI UTILIZZI DEI VEMPs
• i c-VEMPs e gli o-VEMPs sono utilizzati OLTRE CHE nella neurite vestibolare anche nella valutazione di molte altre patologie quando si studia la funzione del sistema vestibolare
– la malattia di Meniere , vertigini associate ad emicrania , sclerosi multipla , deiscenza del canale superiore ( SCD )
• Una delle limitazioni dei test clinici VEMP è che , come la maggior parte prove vestibolari , i VEMPs valutano il sito di lesione … non necessariamente la presenza o l’assenza di malattie
• i c-VEMPs sono anormali nei casi di neurite vestibolare inferiore (IVN) , mentre gli o-VEMPs e test calorico di solito sono normali
-Tuttavia , La diagnosi di neurite vestibolare inferiore si basa in ultima analisi sulla storia clinica
• si ipotizza che i c-VEMPs siano utili nella malattia di Meniere , perché si crede che il sacculo sia la seconda struttura più coinvolta in nell’idrope endolinfatica
-Tuttavia , La sensibilità e la specificità del cVEMPs sono solo del 50 % e del 48,9 % , rispettivamente , nei pazienti con malattia di Meniere definitiva unilaterale
• i VEMPs non sono essenziali per la diagnosi di emicrania
-ma Può essere importante quantificare il coinvolgimento vestibolare
• I pazienti con menomazioni dell’utricolo e sacculo , misurata utilizzando i tests
c-VEMPs e o-VEMPs , possono essere più suscettibili rispetto alla BPPV poiché gli otoconi responsabili della canalolitiasi originano dagli organi otolitici
Hong et al., 2011; Kim & Kim, 2012; Egami et al., 2013

Che cosa accade nei pazienti che presentano la perdita completa della funzione vestibolare di un lato?
|
|
Occhio Sinistro
Occhio Destro |
|
Risposta: o-VEMPs n10s asimmetrici
Piccola o Assente n10s dal lato opposto alla lesione
Risposta Vestibolo-Oculare Crociata Sinistra
Perchè si conferisce tanta enfasi alla vibrazione al Fz ????
Perché questa è un punto di stimolazione speciale, privilegiato per entrambi i labirinti , simultaneo ed uguale
Le vibrazioni arrivano ad ognuna delle due mastoidi allo stesso momento e sono della stessa ampiezza e sono un trigger per le risposte.
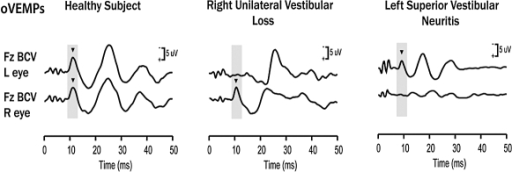
Risposte o-VEMPs per un soggetto sano (pannello di sinistra), un paziente con perdita unilaterale vestibolare destra (pannello centrale), e un paziente con la neurite vestibolare superiore sinistra (pannello di destra). Le barre gialle segnano il tempo di risposte o-VEMPs e N10 sani. Il soggetto sano mostra risposte n10 di grandezza simile, sotto entrambi gli occhi. Il paziente con perdita vestibolare unilaterale destra ha risposte n10 normali sotto il lato destro (ipsilesionale) degli occhi, ma nessuna risposta n10 sotto l’occhio a sinistra (controlesionale). Questi risultati sono coerenti con una perdita completa della funzione otolitica sul lato sinistro. Il paziente con la neurite vestibolare superiore sinistra non mostra o-VEMPs sotto l’occhio a destra (controlesionale), ma una risposta o-VEMPs normale sotto l’occhio a sinistra (ipsilesionale). Ciò è coerente con gli o-VEMPs che sono una risposta prevalentemente utricolare. (Modificata da Iwasaki et al. 2008, con il permesso 14).
VEMPs e SCD

• i tests VEMP possono essere utilizzati per rilevare se una deiscenza provoca un aumento di pressione patologica nel labirinto vestibolare
• nell’ orecchio sano , gli stimoli sonori attivano gli organi otoliti portano all’inibizione di SCM e all’eccitazione dei muscoli extraoculari evidenziabili con i c-VEMPs ed o-VEMPs
• Nella SCD , la presenza della deiscenza e pertanto della ” terza finestra mobile” – crea di fatto un percorso di bassa impedenza per la trasmissione di pressione sonora al vestibolo
Analogamente a quanto avviene per i c-VEMPs, nel caso di una DCSS si può assistere ad una notevole riduzione della soglia di evocazione e ad un aumento di ampiezza dei potenziali perioculari in corrispondenza del lato patologico. Ciò sembra essere ancora più significativo per gli o-VEMPs, in quanto essendo potenziali eccitatori, non sembrerebbero andare incontro a saturazione ad elevati livelli di stimolazione acustica. In particolare il solo criterio assoluto di ampiezza del potenziale perioculare (> 5 pV) può essere virtualmente diagnostico dopo un’intensa stimolazione condotta per via aerea (Rosengren et al., 2008).
|
|
|
|

Threshold= 80 dB SPL
(67 dB nHL)
Threshold 110 dB SPL
(97 dB nHL)
|
|
|
o-VEMP

• SCD verificate con TAC in 22soggetti , 22 controlli sani
• Obiettivo è stato quello di trovare in un unico passaggio screening la diagnosi differenziale che separava la SCD dagli orecchi sani
• oVEMPs a più frequenze
• 100% dei soggetti con SCD producono o-VEMPs a 4000 Hz , i controlli sani non producono o-VEMPs a 4000 Hz
o-VEMP, 4000 Hz, 95dBnHL
•500 Hz o-VEMPs: Left = 71.2 μV, Right = 6.69 uV
•4000 Hz o-VEMPs: Left = 37.33 μV, Right = absent
|
|
|
|
4.98 ms/div, 10 uV/div |
4.98 ms/div, 10 uV/div |
La tuning curve degli o-VEMPs in pazienti con DCSS presenta un aumento della differenza di ampiezza (lei potenziale tra lato patologico e lato sano incrementando la frequenza di stimolazione per via aerea ed ossea fino a 2 kHz (Taylor et al, 2012). Ciò sembrerebbe indicare che i cambiamenti nella DCSS non sono legati solamente ad una riduzione della soglia di eccitabilità del vestibolo, bensì ad una facilitazione complessiva dell’attività vestibolare, in particolare del CSS deiscente, che contribuirebbe in modo determinante a questo pattern di risposta degli o-VEMPs.
test VEMP cervicale o oculare
Ci sono due tipi di test VEMP – VEMPs cervicali o oculari. I c-VEMPs sono diventati un test standard in workup di un paziente con SCDS sospetti.
I pazienti con SCDS hanno spesso risposte soglia c-VEMP basso (soglie A meno di 70 dB per tone pipe a 250 o 500 Hz).Le risposte c-VEMP evocate dai click sono ottenute con sogli leggermente superiori – 75-80 DB o meno nei pazienti con SSCD.
Tuttavia, ci sono alcuni pazienti con soglie normali sui c-VEMPs e quindi se la presentazione clinica è ancora sospetta l’imaging deve essere ottenuta. In questi casi, gli o-VEMPs oculari (oVEMPs) possono essere una misura più specifica di un cambiamento della funzione del canale semicircolare superiore quando una deiscenza è presente. Gli o-VEMPs possono essere un metodo migliore per determinare se la deiscenza è anatomica (dove le scansioni CT mostrano una SCDS, ma in cui la deiscenza non influenza la funzione dell’orecchio interno) o fisiologica (quando il SCDS colpisce la funzione dell’orecchio interno e può essere la causa dei sintomi del paziente) quando i c-VEMPs non mostrano una variazione di soglia o ampiezza in un orecchio che è sintomatico per SCDS e le scansioni CT mostrano una deiscenza. Gli o-VEMPs possono essere utile nei pazienti che hanno SCDS bilaterali e sintomi bilaterali per determinare l’orecchio che ha risentito più dalla deiscenza.
Nuovi criteri : Ampiezza degli o-VEMPs
• – soglie tendono ad essere ~ 10 dB NHL più bassa nei pazienti SCD … .ma le ampiezze
degli o-VEMPs sono spesso dieci volte più grandi in un orecchio con SCD !

• ampiezze medie :
• Normale = 2.9 UV ( 3.0 )
• SCD = 29,0 UV ( 16,6 )
Janky et al. 2014
Zuniga et al. (2013)

• ampiezza media SCD = 48.9 uV
• Controllo ampiezza media = 3,8 uV
Zuniga et al. (2013)

• L’ampiezza degli o-VEMP : differisce per un migliori cut – off per l’età , sensibilità 90/100 % e una specificità 94/100 %
• La soglia c-VEMP : differisce per un migliore cut – off per l’età , sensibilità 45/100 % e specificità del 46/100 %
Zuniga et al. (2013)
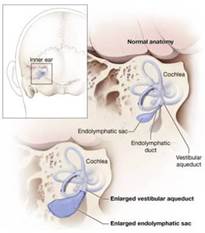
Analogamente alla DCSS, anche nella Sindrome da Acquedotto Vestibolare Allargato è possibile assistere e ad un aumento sostanziale di ampiezza del potenziale perioculare in corrispondenza del lato patologico con una differenza (di ampiezza tra lato patrologico e sano molto più significati a rispetto ai c-VEMPs .
Sebbene non esista un pattern i di risposta degli o-VEMPs patognomonico di MdM alcuni Autori hanno evidenziato un aumento significato di ampiezza della risposta perioculare in corrispondenza del lato patologico in corso di attacco acuto ed in generale durante fasi precoci della patologia (Manzari et al., 2010). Questa alterazione della risposta, non è accompagnata da un aumento consensuale dei c-VEMPs, bensì da una loro riduzione in ampiezza nella maggior parte dei casi, sembrerebbe indicare modificazioni opposte della dinamica degli organi otolitici nelle prime fasi della malattia.
|
|
|
Malattia di Ménière Studiando la tuning curve degli o-VEMPs è stata riscontrata la presenza degli o-VEMPs in pazienti affetti da MdM sino ad una frequenza di stimolazione per via aerea di 4 kHz (Sandhu et al., 2012). Sebbene l’alterata tuning curve possa rappresentare un reperto strumentale interessante, non può ancora essere considerata come criterio diagnostico di MdM.
Recentemente diversi Autori hanno valutato la possibilità di differenziare la MdM dalla VE in base alle risposte dei c-VEMPs ed o-VEMPs.
Utilizzando diversi protocolli di stimolazione per via aerea ed ossea, è stata riscontrata una riduzione dell’ ampiezza dei c-VEMPs ed o-VEMPs nei soggetti affetti da MdM e VE solo dopo stimolazione per via aerea. In particolare, l’o-VEMPs dopo tone burst a 500 Hz per via aerea permetterebbe di evidenziare differenze significative tra MdM e VE (minor ampiezza dell’o-VEMPs per i pazienti con MdM), senza comunque definire un criterio certo di diagnosi differenziale tra i due quadri clinici (Zuniga et al., 2012).


I lavori riguardanti lo studio degli o-VEMPs in pazienti affetti da Neurinoma dell’acustico hanno confermato la concordanza tra questo test ed il test calonico bitermico nella valutazione della funzionalità del nervo vestibolare superiore. La sensibilità degli o-VEMPs nell’individuare alterazioni indicative di lesioni precoci (al di sotto dei 20 mm) risulta comunque bassa e dipendente fortemente dal tipo di stimolazione utilizzata per evocare il potenziale (Piras et al., 2013).
Piccolo Schwannoma inferiore Sinistro VN:
suono evocato CVEMP / OVEMP

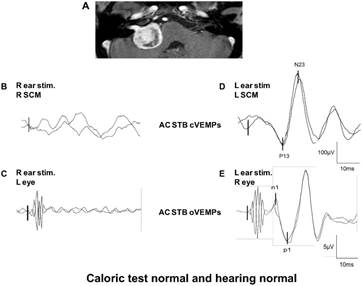
Descrizione
Questo paziente aveva uno schwannoma vestibolare a destra nell’angolo ponto-cerebellare . Nonostante le dimensioni del VS ( MRI in A ) , aveva sia un udito normale e risultati ai test calorici normali. Il paziente aveva una disfunzione del nervo vestibolare superiore ( assenza di AC STB c-VEMP, sul lato dello SCM destro quando l’orecchio destro è stato stimolato : B ) e disfunzione del nervo vestibolare inferiore ( anormale AC STB o-VEMPs sull’occhio sinistro quando l’orecchio destro è stato stimolato : C ) . Quando l’orecchio sinistro normale è stato stimolata , sono stati osservati normali AC STB c-VEMPs ( D ) e normale AC STB oVEMPs ( E). Che cosa costituisce una normale ” OVEMP “
SOMMARIO
• VEMP cervicale – sacculo e nervo vestibolare inferiore
• oculare VEMP – utricolo e nervo vestibolare superiore
• VEMPs sono sensibili e specifici per SCD perché forniscono una misura oggettiva della trasmissione anomala di pressione nell’orecchio interno
-c-VEMP diminuisce con la Soglia
-o-VEMP risposta di Ampiezza aumentata ( possono essere più sensibili a livello di soglia rispetto ai c-VEMPs )
-o-VEMP la risposta è registrabile fino a 4 kHz
• TAC a rischio di SOPRADIAGNOSI NELLA SCD – difficoltà a distinguere tra ‘ assottigliamento ‘ e vero deiscenza – Ed i risultati devono essere corroborata con sintomi e VEMP
• Audiogramma probabilmente mostrerà un Gap tra via Area ed ossea con impedenza normale
-si possono riscontrare soglie per via ossea inferiori a 0
• Gli interessamenti della SCD possono essere cocleari , vestibolari o entrambi
• Trattamenti chirurgici per la SCD possono per migliorare alcuni sintomi , forse non tutti .
• Il trattamento chirurgico può portare ad altri problemi di equilibrio e / o perdita di udito
Bibliografia
REFERENCES
Aw ST, Fetter M, Cremer PD, Karlberg M, Halmagyi GM -Individual semicircular canal function
in superior and inferior vestibular neuritis. Neurology 2001;57:768-74.
Bickford, R., Jacobson, J., & Cody, D. (1964). Nature of average evoked potentials to sound
and other stimuli in man. Annals of New York Academy of Sciences, 112, 204-218.
Brantberg, K., Tribukait, A., & Fransson, P. (2003). Vestibular evoked myogenic potentials in
response to skull taps for patients with vestibular neuritis. Journal of Vestibular Research,
13, 121-130.
Brantberg, K. & Verrecchia, L. (2009). Testing vestibular-evoked myogenic potentials with 90-
db clicks is effective in the diagnosis of superior canal dehiscence syndrome. Audiology &
Neurotology, 14, 54-58.
Cazals, Y., Aran, J., Erre, J., Guilhaume, A., & Aurousseau, C. (1983). Vestibular acoustic
reception in the guinea pig: A saccular function? Acta Oto-Laryngologica, 95(1-4), 211-217.
Chihara, Y., Iwasaki, S., Ushio, M., & Murofushi, T. (2007). Vestibular-evoked extraocular
potentials by air-conducted sound: Another clinical test for vestibular function. Clinical
Neurophysiology, 118(12), 2745-2751. [ Links ]
Chihara, Y., Iwasaki, S., Ushio, M., Fujimoto, C., Kashio, A., Kondo, K., et al. (2009). Ocular
vestibular-evoked myogenic potentials (oVEMPs) require extraocular muscles but not facial
or cochlear nerve activity. Clinical Neurophysiology, 120(3), 581-587.
Cianfrone G, Gagliardi M, Cuiuli G, D’Amico R. Vestibular evoked myogenic potentials and
distortion product Otoacoustic emissions combined with glycerol testing in endolymphatic hydrops: Their value in early diagnosis. Ann Otol, Rhinol and Laryngol 2004;113:1000-04.
Bronstein, A., Davies, R., Gresty, M., Luxon, L., & Rothwell, J. (1998).
Vestibular hypersensitivity to clicks is characteristic of the tullio phenomenon. Journal of
Neurology, Neurosurgery, and Psychiatry,65, 670-678.
Colebatch, J. & Halmagyi, G. (1992). Vestibular evoked potentials in human neck muscles
before and after unilateral vestibular deafferentation. Neurology, 42(8), 1635-1636.
Colebatch, J., Halmagyi, G., & Skuse, N. (1994). Myogenic potentials generated by a click evoked
vestibulocollic reflex. Journal of Neurology, Neurosurgery, and Psychiatry, 57(2),
190-197.
Colebatch, J. & Rothwell, J. (2004). Motor unit excitability changes mediating vestibulocollic
reflexes in the sternocleidomastoid muscle. Clinical Neurophysiology, 115, 2567-2573.
Curthoys IS, Kim J, McPhedran SK, Camp AJ – Bone conducted vibration selectively activates
irregular primary otolithic vestibular neurons in the guinea pig. Exp Brain Res.2006;175:256-67.
De Burlet HM – Zur Innervation der Macula sacculi bei Säugetieren. Anat. Anzeig 1924;58:26-32.
Dumas G, Perrin P, Schmerber S – Nystagmus induced by high frequency vibrations of the skull
in total peripheral vestibular lesions. Acta Otolaryngol 2008;128:255-62.
Fetter M, Dichgans J – Vestibular neuritis spares the inferior division of the vestibular nerve.
Brain 1996;119:755-63.
Geisler, C., Frishkopf, L., & Rosenblith, W. (1958). Extracranial responses to acoustic clicks in
man. Science, 128(3333), 1210-1211.
Govender, S., Rosengren, S., & Colebatch, J. (2009). The effect of gaze direction on the ocular
vestibular evoked myogenic potential produced by air-conducted sound. Clinical
Neurophysiology, 120(7), 1386-1391.
Hall, J. (2007). New handbook of auditory evoked responses. Boston, MA: Pearson Education,
Inc.
Haque, A. & Dickman, J. (2008). Vestibular system function: From physiology to pathology. In
W. Clark & K. Ohlemiller (Eds.), Anatomy and physiology of hearing for audiologists
(pp.284-308).Clifton Park, NY: Thomson Delmar Learning.
Halmagyi GM, Curthoys IS – A clinical sign of canal paresis.
Arch. Neurol. 1988;45:737-9.
Halmagyi GM, Yavor RA, Colebatch JG – Tapping the head
activates the vestibular system: a new use for the clinical reflex
hammer. Neurology 1995;45:1927-9.
Hong SM, Kim SK, Park CH, Lee JH. Vestibular-evoked myogenic potentials in Migrainous
vertigo. Otolaryngol Head Neck Surg 2011;144(2):284–87.
Isaacson, B., Murphy, S., & Cohen, H. (2006). Does the method of sternocleidomastoid muscle
activation affect the vestibular evoked myogenic potential response? Journal of Vestibular
Research, 16, 187-191.
Iwasaki S, McGarvie LA, Halmagyi GM, et al. Head taps evoke a crossed
vestibulo-ocular reflex. Neurology 2007;68: 1227-1229 [ Links ]
Iwasaki, S., Smulders, Y. E., Burgess, A. M., McGarvie, L. A., MacDougall, H. G., Halmagyi,
G. M., et al. (2008). Ocular vestibular evoked myogenic potentials in response to bone conducted
vibration of the midline forehead at fz: A new indicator of unilateral otolithic
loss. Audiology and Neurotology, 13(6), 396-404.
Janky KL, Nguyen KD, Welgampola M, Zuniga MG, Carey JP. Air-conducted oVEMPs provide
the best separation between intact and superior canal dehiscent labyrinths.
Otol Neurotol 2013;34(1):127–34.
Kushiro, K. (1999). Saccular and utricular inputs to sternocleidomastoid motoneurons of
decerebrate cats. Experimental Brain Research, 126(3), 410-416.
Lee JD, Park MK, Lee BD, Lee TK, Sung KB, Park JY. Abnormality of cervical vestibular-evoked
myogenic potentials and ocular vestibular-evoked myogenic potentials in patients with recurrent
benign paroxysmal positional vertigo. Acta Oto-Laryngol 2013;133(2):150–53.
Lowenstein, O. & Roberts, T. (1951). The localization and analysis of the responses to vibration
from the isolated esasmobranch labyrinth. A contribution to the problem of the evolution of
hearing in vertebrates. Journal of Physiology, 114, 471-489.
McCue, M. & Guinan, J., Jr. (1994). Acoustically responsive fibers in the vestibular nerve of the
cat. Journal of Neuroscience, 14(10), 6058-6070.
McCue, M. & Guinan, J., Jr. (1995). Spontaneous activity and frequency selectivity of
acoustically responsive vestibular afferents in the cat. Journal of Neurophysiology, 74(4),
1563-1572.
Minor LB, Solomon D, Zinreich JS, Zee DS. Sound- and/or pressure-induced vertigo
due to bone dehiscence of the superior semicircular canal. Arch Otolaryngol
Head Neck Surgery 1998;124(3):249–58.
Murofushi, T. & Curthoys, I. (1997). Physiological and anatomical study of click-sensitive
primary vestibular afferents in the guinea pig. Acta Oto-laryngologica, 117, 66-72.
Murofushi, T., Matsuzaki, M., Mizuno, M. (1998). Vestibular evoked myogenic potentials in
patients with acoustic neuromas. Archives of Otolaryngology-Head & Neck Surgery, 124,
509-512.
Park, H., Lee, I., Shin, J., Lee, Y., & Park, M. (2010). Frequency-tuning characteristics of
cervical and ocular vestibular evoked myogenic potentials induced by air-conducted tone
bursts. Clinical Neurophysiology, 121, 85-89.
Popper, A., Platt, C., & Saidel, W. (1982). Acoustic functions in the fish ear. Trends in
Neurosciences, 5(C), 276-280.
Rauch, S., Zhou, G., Kujawa, S., Guinan, J., & Herrmann, B. (2004). Vestibular evoked
myogenic potentials show altered tuning in patients with ménière’s disease. Otology &
Neurotology, 25, 333-338.
Rosengren, S., McAngus Todd, N., & Colebatch, J. (2005). Vestibular-evoked extraocular
potentials produced by stimulation with bone-conducted sound. Clinical Neurophysiology,
116(8), 1938-1948.
Rosengren, S., Welgampola, M., & Colebatch, J. (2010). Vestibular evoked myogenic potentials:
past, present and future. Clinical Neurophysiology, 121, 636-651.
Sheykholeslami, K. & Kaga, K. (2002). The otolithic organ as a receptor of vestibular hearing
revealed by vestibular-evoked myogenic potentials in patients with inner ear anomalies.
Hearing Research, 165(1-2), 62-67.
Sheykholeslami, K., Kermany, M., & Kaga, K. (2001). Frequency sensitivity range of the
saccule to bone-conducted stimuli measured by vestibular evoked myogenic potentials.
Hearing Research, 160, 58-62.
Shimizu, K., Murofushi, T., Sakurai, M., & Halmagyi, M. (2000). Vestibular evoked myogenic
potentials in multiple sclerosis. Journal of Neurology, Neurosurgery & Psychiatry, 69, 276-
277.
Tavassolie TS, Penninger RT, Zuniga MG, Minor LB, Carey JP. Multislice computed
tomography in the diagnosis of superior canal dehiscence: how much error, and how to
minimize it? Otol Neurotol 2012;33(2):215–22.Todd, N., Rosengren, S., Aw, S., & Colebatch,
J. (2007). Ocular vestibular evoked myogenic
potentials (ovemps) produced by air- and bone-conducted sound. Clinical Neurophysiology,
118(2), 381-390.
Todd, N., Rosengren, S, & Colebatch, J. (2003). A short latency vestibular evoked potential
(VsEP) produced by bone-conducted acoustic stimulation. Journal of the Acoustical Society
of America, 114(6 I), 3264-3272.
Todd, N., Cody, F., & Banks, J. (2000). A saccular origin of frequency tuning in myogenic
vestibular evoked potentials?: Implications for human responses to loud sounds. Hearing
Research, 141(1-2), 180-188.
Todd NP, Rosengren SM, Aw ST, Colebatch JG. Ocular vestibular evokedmyogenic potentials
(OVEMPs) produced by air- and boneconducted sound. Clin Neurophysiol 2007;118:381-390
[ Links ]
Todd NP, Rosengren SM, Colebatch JG. Ocular vestibular evoked myogenic potentials
(OVEMPs) produced by impulsive transmastoid accelerations. Clin Neurophysiol 2008;
119:1638-1651 [ Links ]
Wang, S., Jaw, F., & Young, Y. (2009). Ocular vestibular-evoked myogenic potentials elicited
from monaural versus binaural acoustic stimulations. Clinical Neurophysiology, 120(2),
420-423.
Watson, S., Halmagyi, G., & Colebatch, J. (2000). Vestibular hypersensitivity to sound (Tullio
phenomenon) structural and functional assessment. Neurology, 54, 722-728.
Welgampola, M. & Colebatch, J. (2001). Characteristics of tone burst-evoked myogenic
potentials in the sternocleidomastoid muscles. Otology and Neurotology, 22(6), 796-802.
Welgampola MS, Rosengren SM, Halmagyi GM, Colebatch JG – Vestibular activation by
bone conducted sound. J Neurol Neurosurg Psychiatry 2003;74:771-778.
Welgampola, M. & Colebatch, J. (2005). Characteristics and clinical applications of vestibular
evoked myogenic potentials. Neurology, 64, 1682-1688.
Welgampola MS. Evoked potential testing in neuro-otology. Curr Opin Neurol 2008;21:29-35
[ Links ]
Welgampola, M., Migliaccio, A., Myrie, O., Minor, L., & Carey, J. (2009). The human sound
evoked vestibulo-ocular reflex and its electromyographic correlate. Clinical Neurophysiology,
120, 158-166.
Williamson RA, Vrabec JT, Coker NJ, Sandlin M. Coronal computed tomography prevalence
of superior semicircular canal dehiscence. Otolaryngol Head Neck Surgery 2003;129(5):481–89.
Young, E., Fernández, C., & Goldberg, J. (1977). Responses of squirrel monkey vestibular
neurons to audio-frequency sound and head vibration. Acta Oto-Laryngologica, 84(1-6),
352-360.
Young, Y., Wu, C., & Wu, C. (2002). Augmentation of vestibular evoked myogenic potentials:
an indication for distended saccular hydrops. The Laryngoscope, 112, 509-512.
Zhou G, Gopen Q, Poe DS. Clinical and diagnostic characterization of canal dehiscence
syndrome: a great otologic mimicker. Otol Neurotol 2007;28(7):920–26.
Zhou, G. & Cox, L. (2004). Vestibular evoked myogenic potentials: History and overview.
American Journal of Audiology, 13(2), 135-143
Zuniga MG, Janky KL, Nguyen KD, Welgampola MS, Carey JP. Ocular versus cervical
VEMPs in the diagnosis of superior semicircular canal dehiscence syndrome.
Otol Neurotol 2013;34(1):121–26.