TESTS ROTO-ACCELERATORI ATTIVI
 Fig.1 a1
Fig.1 a1
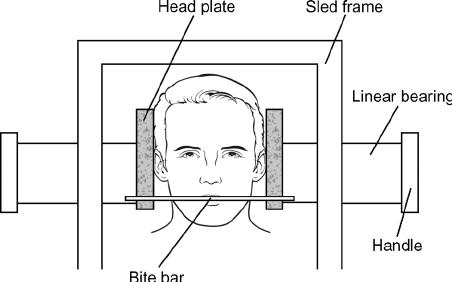
Nostra sedia rotatoria
I TEST ROTO-ACCELERATORI possono essere classificati in PASSIVI ED ATTIVI: nei primi passivi l’intero corpo del paziente è ruotato senza nessun movimento fra la testa ed il corpo, nei secondi attivi il paziente ruota la testa mentre il corpo rimane fermo
Verranno trattati i TESTS ROTO-ACCELERATORI ATTIVI:
INDICE
Elenco test
rotoaccelleratori passivi riabilitativi ed attivi
PROVE-STIMOLAZIONI ROTATORIE
ROTOACCELLERATORIE
Perché praticare le prove vestibolari?
Ruolo del Test con Sedia Rotatoria nella Diagnosi delle
Vertigine
SOTTOTIPI DEI TEST CON SEDIA ROTATORIA:
TESTS
ROTO-ACCELERATORI PASSIVI:
1. TEST SINUSOIDALE ARMONICO LENTO NEL BUIO
2. ROTAZIONE SINUSOIDALE AD ALTA FREQUENZA O AD ALTA VELOCITÀ O TEST A IMPULSI (STEP RESPONSES)
3. ROTAZIONE CON FISSAGGIO DELLA TESTA CHE FISSA OBIETTIVI FISSI (CIOÈ TEST DI SOPPRESSIONE NELLA INTERAZIONE VISUO- VESTIBOLARE (VVI)
4. TEST DEL NISTAGMO OTTICOCINETICO(OKN)
5. VARIAZIONE DI VELOCITÀ NEL BUIO
6. TEST OKAN (POSTNISTAGMO OTTICOCINETICO) CON SEDIA ROTATORIA
7. ROTAZIONE AL DI FUORI DELL’ASSE DI ROTAZIONE (OVAR)
8. PROVE ROTATORIE CON ROTAZIONE AL DI FUORI DELL’ASSE DI ROTAZIONE OVAR E SSV DINAMICO
Tests Roto-Acceleratori Passivi
Diagnostici e Riabilitativi
9. Sedie Ruotanti (Rotundum-TRV Interacoustics– Epley Omniax)
Test Roto-Acceleratori Attivi:
10. Test di Autorotazione – VAT (Vestibular Autorotation Test)
11. Blance Testing VORTEQ® (Vestibular Ocular Reflex Test Equipment). and DVA-Test (Dynamic Visual Acuity test) o test di acuita’ visiva dinamica
12. L’Head Impulse Test (HIT) o Head Thrust Test (Test di Halmagyi); Test Impulsivi per il VOR Angolare
13. Il Video Head Impulse Test (vHIT); Test Impulsivo Cefalico
14. L’Head Heave Test (HHT); Test Impulsivi per il VOR Lineare– Test Impulsivo Traslatorio
15. L’Head Shaking Test (HST); Il Nistagmo da Scuotimento Cefalico
16. Il Functional Head Impulse Test (f-HIT)
17. Lo Studio dell’Acuità Visiva Dinamica(Dynamic Visual Acuity test) e Test di Lettura
Il Test con la Sedia Rotatoria nella Perdita Vestibolare Bilaterale
Il Test con Sedia Rotatoria nella Perdita Vestibolare Unilaterale
TEST ROTO-ACCELERATORI ATTIVI
10) Test Attivo della Testa: VAT
11) VORTEQ (Rotazione Sinusoidale ad Alta Frequenza o ad Alta Velocità)
Ci sono diversi dispositivi commerciali, che non incorporano sedie motorizzati, che forniscono dati che si sovrappongono in parte con i dati forniti dalle sedi
rotatoria. Questi dispositivi sono chiamati ” dispositivi attivi della testa ” e confrontare i movimenti oculari indotti dal movimento attivo della testa (piuttosto che il movimento passivo indotta da una sedia motorizzata).
Entrambi questi test misurano – il contributo dell’orecchio interno, input cognitivi intenzionale e ingressi di nistagmo dal collo, piuttosto che il contributo dell’orecchio interno da solo (Dell Santina et al., 2002). I nomi delle ditte per questi dispositivi includono tra gli altri .il “VAT E VORTEQ “,
PROVE ROTO-ACCELERATORIE ATTIVE il paziente ruota la testa mentre il corpo rimane fermo
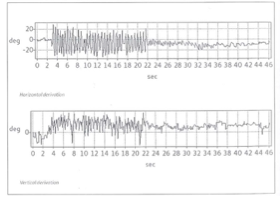
1.d) Test di Autorotazione — VAT (Vestibular Autorotation Test) Fig.10-a/10-b/10-c
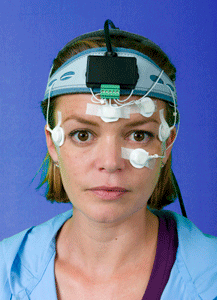
Fig. 10-a


I limiti principale dei tradizionali test vestibolari (il test calorico ed il test rotatorio), pur se correttamente eseguiti e tra loro integrati sono di non poter studiare in modo diretto la principale funzione labirintica, ovvero la correlazione tra i movimenti del capo e quelli degli occhi, a frequenze rapide di spostamento del capo quali quelle normalmente utilizzate nella vita di tutti i giorni, e di studiare soloil canale orizzontale e non quelli verticali. Il test vestibolare di autorotazione del capo (brutta traduzione dell’originale Vestibular Autorotation Test, che preferiamo continuare ad utilizzare) è stato ideato proprio per supplire a tale lacuna, nonostante la sua diffusione, in Italia, sia ancora pressoché inesistente, anche a causa dei costi ancora eccessivi della strumentazione necessaria.
Per risolvere i problemi tecnici legati alla realizzazione di rotazioni ad alta frequenza, Fineberg et al. (1987) hanno realizzato il test di autorotazione (Vestibular Autorotation Test – VAT), che si differenzia significativamente dalle altre metodiche rotoacceleratorie classiche presentando alcuni aspetti peculiari.
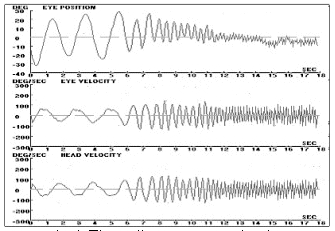
Nel VAT è assente qualunque dispositivo elettromeccanico per lo spostamento della sedia secondo le varie tipologie di movimento ed accelerazione, Il paziente èseduto e compie volontariamente delle oscillazioni con il capo, a destra e asinistra, seguendo il ritmo crescente dettato da un metronomo mentre i movimenti oculari sono registrati da un comune sistema elettrooculografico ed i movimenti del capo da un sensore posto su un leggero caschetto. Il sistema vestibolare viene studiato nel range delle frequenze medie (0,8— 6 Hz). Il test viene effettuato ad occhi chiusi e chiedendo al paziente di fissare una mira valutando così sia la risposta vestibolo-oculomotoria sia quella visuo-vestibolo-oculomotorie.
Il VAT presenta indiscutibili vantaggi teorici rispetto alle prove rotatorie classiche:
si tratta di una prova che effettivamente simula la stimolazione fisiologica, i tempi di esecuzione sono estremamente veloci, non presenta particolari difficoltà nell’istruzione del paziente, raramente induce reazioni neurovegetative fastidiose ed i costi sono abbondantemente al di sotto di quelli delle più comuni sedie rotatorie; è di indubbio interesse anche la possibilità di studiare la performance dei canali verticali. Va segnalato, peraltro, che non tutti i soggetti riescono ad eseguire correttamente la prova, in particolaregli anziani ed i pazienti con cervicalgie. Sul piano clinico il VAT sembra possedere una alta sensibilità diagnostica (O’Leary e Davis, 1990; Ng et al., 1993; Saadat et al., 1995), in particolare nei confronti di patologie vestibolari periferiche (Ménière, neurinomi), mentre non offrirebbe una specificità diagnostica selettiva. Gli aspetti negativi della metodica consistono fondamentalmente nei problemi tecnici legati alla affidabilità di rilevazione e alla riproducibilità dei movimenti della testa e/o degli occhi. Sin dalla sua introduzione, inoltre, è stata mossa a questo test l’obiezione dell’inevitabile interferenza cervicale. Con questa metodica la stimolazione vestibolare infatti non può prescindere da quella cervicale in quanto la muscolatura del collo rappresenta la forza motrice. Abbiamo però l’opportunità di valutare globalmente la funzione oculomotoria in una condizione che si avvicina a quella fisiologica in cui si ha un’integrazione di informazioni visive, vestibolari e cervicali. In realtà il guadagno del riflesso cervico-oculomotore è influente (>02) solo per frequenze di oscillazione inferiori a 0,05 Hz, mentre per velocità di stimolo superiori, quali quelle ottenute con il test di autorotazione, tale influenza sarebbe trascurabile nel soggetto normale (Fineberg et al., 1987). Nel normale si segnala, per esempio, che già a 0,1 Hz il guadagno del VOR è praticamente nullo (Sawyer et al., 1994). Il sistema VAT può essere considerata una prova ad alta frequenza del VOR, se confrontato con i test più tradizionali. Ad esempio, il calorico, basato sulla stimolazione di ogni labirinto separatamente, è un test a frequenza ultra-bassa. Se consideriamo il tempo per stimolare termicamente il canale orizzontale (circa 100 secondi per raggiungere un equilibrio termico stazionario) per essere ½ periodo di una sinusoide, questo si traduce in una frequenza di 1/200 = 0,005 Hz. Le sedie Rotatorie disponibili commercialmente abbracciano una gamma da 0,01 a 1 Hz, ben al di sotto delle alte frequenze utilizzate nel VAT. Paradossalmente, entrambi questi test “tradizionali” sono ben al di sotto delle frequenze di locomozione (> 1 Hz) dove il VOR è considerato più attivo e utile durante le ore di veglia. Come un’analogia, proprio come Audiometri sono considerate più utili alle frequenze che abbracciano la gamma essere considerato più utile perché testa il VOR al di sopra della gamma di prestazioni naturali utilizzate nella vita quotidiana – 2 a 6 Hz. Fig. 10-c-d-e-f
 |  |
| Fig. 10-c | Fig. 10-d |
 |  |
| Fig. 10-e | Fig. 10-f |
Balance Testing
VORTEQ® (Vestibular Ocular Reflex Test Equipment). and DVA-Test o17) test di acuita’ visiva dinamica
 Il VORTEQ ® è progettato per fornire informazioni sul riflesso vestibolare oculare (VOR) in pazienti con problemi di equilibrio o vertigini. VORTEQ ® offre, un metodo semplice e poco costoso per valutare il guadagno, fase e simmetria del VOR. Il Test dinamico dell’acuità visiva (DVA) misure acuità visiva durante il movimento di testa. Il DVA-Test fornisce preziose informazioni circa il Visual Vestibular Ocular Reflex (VVOR) in soggetti ben allenati (piloti, atleti) oltre a pazienti con deficit vestibolare
Il VORTEQ ® è progettato per fornire informazioni sul riflesso vestibolare oculare (VOR) in pazienti con problemi di equilibrio o vertigini. VORTEQ ® offre, un metodo semplice e poco costoso per valutare il guadagno, fase e simmetria del VOR. Il Test dinamico dell’acuità visiva (DVA) misure acuità visiva durante il movimento di testa. Il DVA-Test fornisce preziose informazioni circa il Visual Vestibular Ocular Reflex (VVOR) in soggetti ben allenati (piloti, atleti) oltre a pazienti con deficit vestibolare
Fig. 11-a
Questo riflesso è responsabile della stabilizzazione dell’immagine sulla retina durante i movimenti, generando movimenti degli occhi compensatori in direzione opposta al movimento della testa o
| Fig. 11-b | Fig. 11-c | Fig. 11-d |
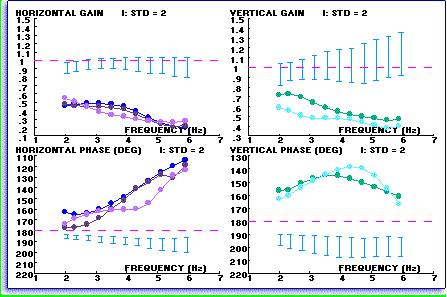
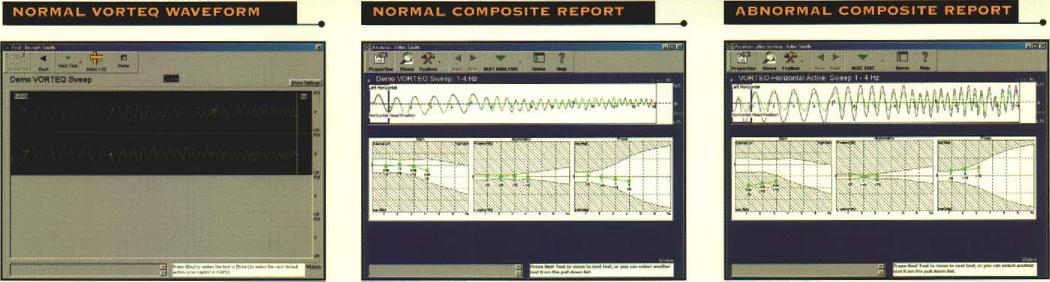
Fig. 11-c) Facile da interpretare la relazione di sintesi VORTEQ mostra i dati compositi del test con una media di linee normative per i test VVOR orizzontale e verticale.
Fig.11-d) Scarsa risposta VVOR è mostrato da questo paziente con una iporeflettività vestibolare bilaterale periferica. L’esame VORTEQ mostra che la perdita vestibolare è completa e non solo alle frequenze di prova più basso che sono equivalenti alla prova calorica, contribuendo così ad indirizzare il medico sulla migliore strategia di trattamento
CONSIDERAZIONI CONCLUSIVE sul VAT E VORTEQ
L’utilizzo della metodica dei movimenti attivi del capo ci ha consentito di valutare vantaggi e svantaggi rispetto alle metodiche stimolatorie vestibolari più vecchie e collaudate.
Numerosi sono gli aspetti positivi, quali:
· Rapidità di esecuzione.
I tempi medi di esecuzione di una batteria di test e retest, sul piano trasversale e su quello sagittale, sono sensibilmente inferiori a quelli di una stimolazione calorica tipo Hallpike ma anche a quelli di quasi tutte le stimola
· Facile calcolo della risposta vestibolare.
L’analisi di movimenti oculari a frequenze elevate di stimolazione, al di sopra dei 2 Hz, consente l’indagine della quota vestibolare pura, minimizzando la quota dovuta agli altri sistemi oculomotori. I movimenti rapidi ma limitati del capo evocano un movimento oculare di ridotta ampiezza che generalmente scatena poche fasi rapide (nistagmo), pertanto vi è un immediato riscontro della risposta vestibolare visionando i tracciati, ed il calcolo della velocità, pur eseguito dal calcolatore, risulta semplificato.
· ![]() Analisi dinamica del sistema vestibolare.
Analisi dinamica del sistema vestibolare.
Questa metodica appare la più idonea e pratica per completare lo studio del sistema vestibolare sull’intero range di frequenze che normalmente controlla e calcolare la funzionalità vestibolare residua in quei pazienti che appaiono areflettici a basse frequenze di rotazione o alle stimolazioni caloriche (ad esempio i pazienti trattati con aminoglicosidi). Lo studio delle frequenze tra 0.5 e 2 Hz consente l’analisi dell’efficienza delle interazioni visive sul sistema vestibolare.
· Registrazione del VOR verticale.
Non solo questo punto è estremamente innovativo rispetto le metodiche convenzionali, rotatorie o caloriche, ma ha anche dimostrato una sua autonoma validità nell’analisi di certe patologie vestibolari periferiche unilaterali.
· Utilizzo di movimenti naturali e fisiologici.
Certamente questa è la metodica di studio del sistema vestibolare e delle interazioni visuo-vestibolari più fisiologica che ci sia. La sua fisiologicità la rende ben tollerata dai pazienti, al contrario delle stimolazioni caloriche tipo Hallpike o delle stimolazioni rotatorie a gradino. La partecipazione attiva del paziente evita fenomeni di sonnolenza.
·Metodica poco costosa.
In fondo l’attrezzatura e il software d’analisi possono ormai quasi essere realizzati “in casa” con l’aiuto di un bravo tecnico.
Gli aspetti svantaggiosi sono i seguenti:
·Assoluta necessità di collaborazione del paziente.
La prova calorica e quella rotatoria non implicano nessuna collaborazione da parte del paziente, può essere effettuata anche su pazienti non collaboranti. Al contrario i movimenti attivi del capo richiedono una valida collaborazione del paziente.
· ![]() Talora di difficile esecuzione.
Talora di difficile esecuzione.
Vi possono essere delle difficoltà di esecuzione in pazienti anziani, o con problemi cervicali, o all’esordio di una patologia vestibolare severa.
· ![]() Scarso valore topodiagnostico.
Scarso valore topodiagnostico.
A differenza delle stimolazioni rotatorie a bassa o media frequenza, i movimenti attivi del capo ad alta frequenza non consentono una buona identificazione del labirinto o del nervo vestibolare ipofunzionanti, tranne che con il calcolo della simmetria, fatto sulle velocità e non sulle posizioni. Inoltre la metodica dei movimenti attivi del capo non è stata finora utilizzata nelle patologie del Sistema Nervoso Centrale, e pertanto è piuttosto difficile prevedere se essa possa avere degli sviluppi topodiagnostici. Certamente la scarsità di fasi rapide nei tracciati renderà carente la visione di quel complesso meccanismo di interazioni tra fasi lente e fasi rapide che ha scatenato la fantasia e le fini interpretazioni topodiagnostiche degli studiosi di nistagmo provocato calorico o rotatorio.
· Difficile interpretazione.
Vi sono molte domande che non hanno trovato risposta. Facciamo due esempi derivati dalla nostra esperienza personale.
E’ proprio vero che nei soggetti normali il guadagno del VOR verticale a frequenze elevate è superiore a 1, e che finalità avrebbe? Non è forse un errore dovuto ai limiti della tecnologia di rilevazione? Con la tecnica del search coil (difficilmente applicabile in campo clinico) non sembra che i guadagni del VOR a frequenze elevate siano superiori a 1.
Come classificare un paziente vertiginoso che abbia guadagni del VOR bassi a frequenze basse (ove comunque risponde ancora bene il sistema di inseguimento visivo lento) e guadagni del VOR unitari a frequenze elevate ? Se in un caso come questo la vertigine è legata allo slip retinico alle frequenze basse, perché il paziente avverte vertigine proprio per i movimenti più rapidi?
12.) L’ Head Impulse Test (HIT); Head Thrust Test (Test di Halmagyi)
La perdita della funzione vestibolare periferica unilaterale determina due tipi di alterazione della funzionalità del Riflesso Vestibolo-Oculomotore (VOR):
a. Uno squilibrio statico dovuto al diverso input periferico sui nuclei vestibolari; la scarica di base dei neuroni di tipo i è assente dal lato leso, mentre dal lato sano l’attività dei neuroni nucleari è incrementata in virtù dell’inattivazione delle vie commissurali inibitone. Il risultato di questo squilibrio è il nistagmo spontaneo, la cui intensità è destinata a ridursi nel tempo per l’instaurarsi del compenso centrale (Figura 12-a).

Figura12-a – Esempio di lesione vestibolare periferica unilaterale sinistra. L’input dal Canale Semicircolare Laterale (CSL) e Anteriore (CSA) verso il Nucleo Vestibolare Superiore (NVS) e Mediale (NVM) sarà interrotto. IL NVS a sua volta invia proiezioni ai nuclei oculomotori (III) attraverso il Brachium Conjunctivum (BC) e il tratto tegmentale ventrale (TTV) Il NVM invia connessioni al nucleo abducente (VI) e al III attraverso il fascicolo longitudinale mediale (FLM). Il III è connesso ai muscoli retto superiore (RS), retto mediale (RM) e obliquo inferiore (OI), mentre Il VI è connesso con il retto laterale (RL) Nell’esempio (lesione a sinistra), la prevalenza dell’input vestibolare destro comporterà un nistagmo con fase rapida diretta a destra
b. Una perdita della sensibilità dinamica del VOR durante lo stimolo fisiologico (rotazione della testa) causato dalla perdita del meccanismo di push-pull che comporta un ridotto guadagno del VOR
questo aspetto della funzione vestibolare può essere studiato con 4 test non strumentali:
12. L’Head Impulse Test (HIT); Test Impulsivi per il VOR Angolare
14. L’Head Heave Test (HHT); Test Impulsivi per il VOR Lineare
15. L’Head Shaking Test (HST); Il Nistagmo da Scuotimento Cefalico
12.) HEAD IMPULSE TEST O HEAD THRUST TEST (TEST DI HALMAGYI)
Che cosa è il test impulsivo cefalico?
• Si tratta di un test specifico per l’orecchio che rileva i disturbi del riflesso oculo-vestibolare (VOR) e identifica l’orecchio coinvolto nei casi di perdita vestibolare periferica. I pazienti con perdita vestibolare presentano un movimento oculare saccadico di correzione (una saccade di “ripresa”)durante o dopo l’impulso al capo e il guadagno del capo rispetto all’occhio non è equivalente.
• È uno strumento che fornisce informazioni rapide e precise circa il riflesso oculo-vestibolare (VOR) agli stimoli nell’intervallo di alta frequenza.
• Fu identificato e descritto per la prima volta da Halmagyi e Curthoys nell’articolo del 1988 “A Clinical Sign of Canal Paresis” (Un’indicazione clinica di paresi di canale). Halmagyi disse: “Gli occhi sono i tachimetri dei canali semicircolari”.
Guarda i video delle applicazioni tecniche di HIT e le lezioni del dr. Halmagyi
su www.headimpulse.com/knowledge-center
Proposto da Halmagyi e Curthoys nel 1988 il test di Halmagyi o Head lmpulse Test (HIT) o Head Thrust Test (HIT) permette di testare i 3 canali semicircolari intorno ai 5 Hz. Rappresenta il metodo clinico più semplice per ricavare informazioni sull’efficienza del riflesso vestibolo-oculomotore (VOR) nel range delle alte frequenze e consente l’identificazione del lato ipofunzionante nell’ambito di una vestibolopatia periferica unilaterale (Deficit Vestibolare Acuto, DVA). Il VOR, che ha la finalità di stabilizzare il campo visivo durante i movimenti della testa e del corpo, è attivato dall’azione (in senso eccitatorio e inibitorio) di una coppia di canali semicircolari in risposta ad un’accelerazione angolare localizzata sul loro stesso piano e prevede un movimento dei globi oculari compensatorio a quello della testa, quindi di equivalente ampiezza e velocità ma di direzione opposta.
Se il sistema vestibolare è intatto e di conseguenza il VOR funziona correttamente, gli occhi del paziente rimangono fissi sulla mira, a conferma della stabilità dello sguardo durante i movimenti naturali della testa. Se ci troviamo di fronte ad un deficit labirintico da cui deriva una riduzione del guadagno del VOR, gli occhi perderanno la mira durante il movimento (la velocità della testa non può essere compensata da una corrispondente velocità dell’occhio a causa del deficit del VOR).
L’Head Impulse test (oppure Halmagyi-Curthoys test) è Il più semplice indicatore clinico di una funzione deficitaria dei canali semicircolari è l (altrimenti definito come Head Thrust test, o anche Halmagyi test). Ma la valutazione della risposta di questo semplice test clinico è affidata alla soggettività dell’operatore che lo esegue, il quale deve riuscire a riconoscere una piccola saccade di rifissazione che segue un brusco movimento del capo in un piano dello spazio, di solito quello orizzontale.
Come si effettua
Il medico esaminatore siede di fronte al paziente e tiene fermo tra le mani il capo del paziente (Figura 1). Il paziente guarda in avanti sul viso dell’operatore; gli viene chiesto di tenere sempre gli occhi fissi su un bersaglio, definito fisso al suolo, “earth-fixed target”, costituito dal naso dell’esaminatore (Halmagyi et al, 1988). A questo punto il medico, o l’operatore in genere, deve iniziare il test.
Egli deve ruotare la testa del paziente bruscamente ed in modo imprevedibile (questo passaggio del test è molto importante!) verso destra o verso
sinistra. Non è necessario che la rotazione del capo sia molto ampia (ed anche questo è estremamente importante!): al massimo 10-20 gradi (Figura 2) (Aw et al, 2001).
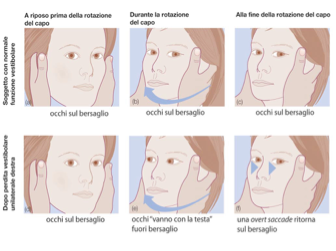
Figura 12-b.
Il disegno illustra la metodica del test impulsive del capo, altrimenti definito come Head Thrust test, oppure Halmagyi-Curthoys test o anche Halmagyi test. Nella prima sequenza 1a, b, c, e evidente la risposta oculomotoria di un soggetto normale. Nella seconda serie 1 d, ed invece è molto chiara ed evidente la dimostrazione clinica di una overt saccade facilmente riconoscibile dall’operatore senza presidi strumentali.
Se il riflesso vestibolo-oculomotore (VOR) dell’esaminando è normo funzionante, il soggetto sottoposto ad esame sarà in grado di compensare il movimento accelerativo/impulsivo del capo imposto dall’operatore e convergere con lo sguardo sul naso-bersaglio dell’operatore (vedi fig. 1). Invece, se il VOR è inadeguato perché il paziente è stato affetto da un evento patologico, gli occhi durante il movimento di rotazione perderanno il bersaglio, in quanto non ruoteranno/convergeranno ad una velocità esattamente contraria per compensare la rotazione del capo (Halmagyi et al, 1988; Schmid-Priscoveanu et al, 2001).
Così un VOR inadeguato o patologico sta a significare che gli “occhi vanno con la testa”, andando “fuori bersaglio” a causa della rotazione del capo. Risulterà perciò evidente che alla fine della rotazione impulsiva il paziente dovrà fare più o meno volontariamente una saccade di correzione per raggiungere nuovamente con lo sguardo il naso dell’esaminatore (Halmagyi et al, 1988; Aw et al, 2001; Schmid-Priscoveanu et al, 2001). Per quest’ultimo, che guarda gli occhi del paziente, questo movimento saccadico è molto chiaro e noi lo abbiamo definito saccade conclamata (Overt Saccade) (Black RA, et al, 2005; Weber et al, 2008).
Questo è il cosiddetto segno-spia di un’insufficiente funzione del canale semicircolare dal lato verso cui la testa è stata ruotata in modo impulsivo. Quindi, un paziente con una perdita vestibolare che abbia interessato per esempio il lato sinistro mette in mostra una overt saccade dopo una rotazione del capo verso sinistra. Invece, in un paziente con una perdita bilaterale della funzione vestibolare (Dandy’s syndrome) le saccadi saranno evidenti per entrambi i sensi di rotazione del capo, in tutti i piani dello spazio ed in tutti i piani dei sei canali semicircolari.
13) IL VIDEO HEAD IMPULSE TEST (vHIT ICS Fig. 13-a-b-c-d; vHIT IC Interacoustics
Fig.13-e-f-g-h; Snapsys di ULMER; Fig.13-i-l-m-n; vHIT Micromedical
Fig.13-o-p; BioMed vHIT Fig.13-q-r-s-t;)
[PROVE ROTO-ACCELERATORIE
ATTIVE; IL PAZIENTE RUOTA LA TESTA MENTRE IL CORPO RIMANE FERMO].
Le registrazioni oculari effettuate con tale metodicaforniscono prove documentate, non dipendenti all’interpretazione del clinico, che permettono una valutazione accurata, circa la funzione dinamica di tutti e sei i Canali Semicircolari in meno di 10 minuti La precisione,
del “video Head Impulse test” (esame ad alta frequenza ) nell’ identificazione del deficit vestibolare periferico, è equivalente a quella che viene studiato con le “prove caloriche” (esame a bassa frequenza ) [bilancio vestibolare calorico o BVC],che studia solo i 2 canali semicircolari orizzontali.
Essendo generalmente ben tollerato è anche l’esame di scelta per i bambini e può essere utilizzato anche in presenza di patologie dell’orecchio esterno e medio ed in caso di pazienti sottoposti ad interventi chirurgici sempre dell’orecchio.
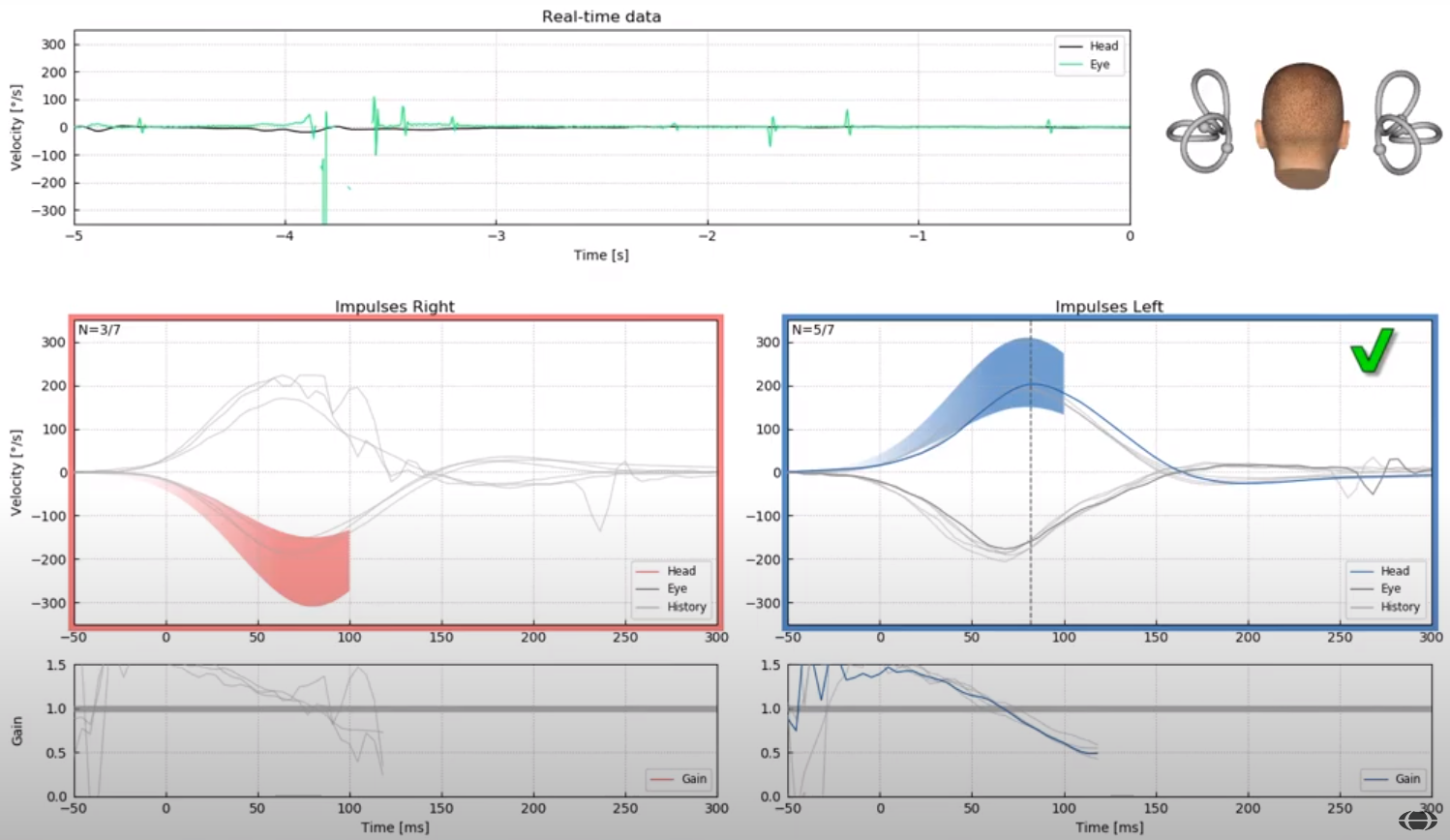
Il vHIT test è un nuovo metodo capace di fornire misure oggettive di risposta del rapporto tra la velocità dell’occhio e la velocità della testa e di mostrare il guadagno del riflesso vestibolo-oculomotore (VOR) per i due sensi di rotazione.
Il test vHIT documenta la presenza sia di saccadi manifeste (overt saccades) sia di saccadi nascoste (covert saccades).
Le
Le registrazioni oculari effettuate con tale metodica forniscono prove documentate, non dipendenti dall’interpretazione del clinico, circa la funzione dinamica dei 3 Canali Semicircolari.
La precisione del video Head Impulse test nell’identificazione del deficit vestibolare periferico è equivalente a quella della metodica “search coils” ma di impiego clinico più semplice, anche in pazienti con neurite vestibolare acuta
  |  |
|
Fig. 13-a nuovo vHIT ICS |
Fig. 13-b vecchio vHIT ICS
|
 | 
|
|
Fig. 13-c Registrazione simultanea con vHIT di tutti e 3 |
Fig. 13-d nuovo |

| 
|
|
Fig. 13-e vHIT https://youtu.be/kyPq6H6KaO8?t=2357
|
Fig. 13- f. Maschera vHIT IC Interacoustics
|

| 
|
|
Fig. 13- g Registrazione video con vHIT del test |
Fig. 13- h VHIT positivo in un paziente con Perdita Vestibolare |
 | 
|
|
Fig.13-i vHIT Snapsys |
Fig.13-l. Tracciato Normale vHIT Snapsys
|

|  |
|
Fig.13-m Registrazione |
Fig.13-n |
|  |
|
Fig.13-o vHIT Micromedical https://youtu.be/0YeovMQLq1o traduzione traduzione
|
Fig.13-p tracciati |

| 
|
|
Fig.13-q BioMed vHIT |
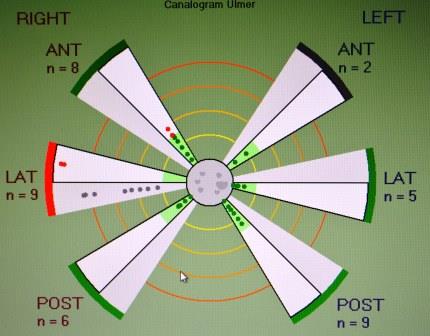
Fig.13-r canaligramma BioMed |

|
 |
|
Fig. 13-s biomed vHIT |
Fig. 13-t |
|
Fig. 13-t |
Varianti del vHIT:
I dispositivi vHIT Interacoustics e GN-Otometrics differiscono in modo sostanziale. Il dispositivo GN Otometric vHIT (ICS) è un occhiale che misura solo l’occhio destro. Se il paziente ha a destra una protesi oculare o un occhio destro più basso non funziona.
Il dispositivo Interacoustic è più regolabile, la telecamera può essere posizionato su entrambi gli occhi. Entrambi i dispositivi sono piuttosto fragili in quanto entrambi trasportano uno specchio attaccato alla testa, che si può rompere.
I telai del dispositivo Interacoustic devono essere molto stretti. Mentre il dispositivo ICS è più facile per fissare alla testa, alcuni tipi di facce sembrano causare asimmetria sinistra-destra in guadagno VOR.
Il Micromedical VHIT utilizza due telecamere poste all’interno degli stessi occhiali, come il loro sistema VNG.
Il dispositivo Synapsis è molto diverso.
A differenza degli altri sistemi per l’esame video-HIT in commercio, il VHIT Ulmer non richiede al paziente di indossare una maschera: tutti i risultati sono ricavati dall’analisi dei movimenti della testa e degli occhi del paziente, ripresi da una telecamera posta ad un metro di distanza che inquadra la sua faccia, mentre il medico effettua le manovre sulla sua testa.
A differenza degli altri sistemi VHIT, il VHIT Ulmer non richiede dunque che il paziente indossi una maschera, incrementando quindi il suo comfort e riducendo gli artefatti introdotti dai movimenti involontari della maschera. Non abbiamo avuto alcuna esperienza diretta con le implementazioni Micromedical o Synapsis del VHIT.
Basi
fisiopatologiche dell’HIT
L’HIT consente di esplorare la funzionalità del VOR di un singolo emisistema sfruttando l’asimmetrica espressione quantitativa della polarità funzionale del recettore ampollare, che come è noto, rappresenta il substrato fisiologico della seconda legge di Ewald; secondo tale legge nel canale semicircolare laterale (CSL) a elevate intensità di stimolazione il flusso endolinfatico ampullipeto provoca una risposta oculomotoria maggiore rispetto a un analogo flusso ampullifugo. Questo fenomeno è dovuto alla presenza di una scarica di base dei neuroni vestibolari afferenti (40 spikes/s nella scimmia). In relazione a ciò, una rotazione nel senso di un CSL comporta un incremento della frequenza di scarica, mentre una rotazione nel senso opposto ne determina una riduzione.
Utilizzando accelerazioni ad alta frequenza come quelle impiegate nell’HIT, qualora lo stimolo sia di tipo inibitorio, viene facilmente raggiunto il limite di saturazione dei neuroni vestibolari, in particolare delle cellule ciliate di tipo I localizzate al centro della cresta ampollare (Hullar e Minor, 1999). Pertanto, in presenza di un deficit, ad esempio destro, non compensato, la rotazione della testa sul piano orizzontale verso destra provoca uno stimolo ampullipeto ispilaterale inefficiente a causa della lesione periferica e uno ampullifugo sinistro che tuttavia, determinando una inibizione della scarica di base, non riesce a compensare adeguatamente il movimento della testa: gli occhi hanno quindi bisogno di saccadi correttive per raggiungere la mira (Palla e Straumann, 2004). Nell’esempio sopra descritto, il guadagno del VOR orizzontale è legato alla sola attività inibitoria del CSL sinistro e pertanto, in virtù dello stimolo acceleratorio di elevata intensità, sarà inferiore a 1 (velocità dell’occhio minore a quella della testa); all’opposto ruotando la testa verso sinistra non si evidenzieranno saccadici compensatori poiché lo stimolo eccitatorio sul CSL di sinistra (normalmente funzionante) garantirà un guadagno all’incirca pari a 1 (velocità dell’occhio uguale a quella della testa). In caso di deficit vestibolare unilaterale completo la sensibilità e la specificità dell’HIT raggiungono quasi il 100%. Laddove invece il deficit risulti parziale, i valori di sensibilità scendono significativamente, poiché la funzione vestibolare residua comporta un minor livello di asimmetria del VOR, non evidenziabile con le accelerazioni indotte dal test impulsivo (Tabella I). In effetti si ritiene che per ottenere un HIT positivo sia necessario un livello di deficit vestibolare superiore al 50% (Hamid, 2005). Al di sopra di un valore di preponderanza labirintica del 42.5% la sensibilità dell’HIT sale al 78%, confermando quindi una certa discrepanza tra test calorico e HIT che permette di concludere che questi due test non debbano essere considerati ridondanti, bensì complementari (Perez e Rarna-Lopez, 2003). In generale, in presenza di una preponderanza labirintica patologica (maggiore del 25%) la sensibilità dell’HIT è approssimativamente del 35%, mentre i valori di specificità si attestano sul 95% (Haruey et al., 1997; Beynon et al., 1998). Esiste tuttavia la possibilità di ottimizzare il test incrementandone in tal modo la sensibilità:
— flettendo di 30° in avanti la testa del paziente in modo da posizionare il canale semicircolare orizzontale esattamente sul piano del movimento;
— eseguendo i movimenti rotatori impulsivi in modo assolutamente imprevedibile (Grine et al., 2000); se i movimenti sono prevedibili il paziente può rapidamente imparare a compensare l’errore di mira attraverso piccoli movimenti saccadici anticipatori durante la rotazione della testa. Per lo stesso motivo l’HIT eseguito con movimenti rotatori attivi (eseguiti dal paziente) possono produrre risultati falsamente negativi (Black et al., 2005).
TABELI.A
13-I Percentuali di positività dell’v-HlT in rapporto al risultato del test calorico PL preponderanza labirintica.
|
Deficit |
N° |
HIT- |
HIT+ |
|
Assente |
76 |
76 |
0 |
|
Lieve |
23 |
23 |
0 |
|
Moderato |
21 |
9(90%) |
2 |
|
Severo |
30 |
7 |
23(77%) |
Tuttavia valutare comparativamente BVC e HIT può essere problematico in quanto questi due esami saggiano il VOR a diversi livelli di frequenza ed inoltre il compenso centrale, essendo frequenza dipendente, risulta più spesso incompleto per le elevate accelerazioni (fino a 5 Hz, testate dal HIT) che per quelle basse (circa 0.003 Hz, testate dal BVC) (Schmid-Priscoueanu et al., 2001) potendosi così realizzare una situazione in cui si assiste alla normalizzazione del test calorico pur in presenza di un HIT che permane alterato (Palla e Straumann, 2004).
Generalmente l’HIT viene eseguito con rotazioni sul piano orizzontale in modo da saggiare la funzionalità dei CSL; anche i canali verticali possono essere studiati con questo test attraverso movimenti sul piano rispettivamente del canale semicircolare anteriore (CSA) destro—canale semicircolare posteriore (CSP) sinistro e anteriore sinistro-posteriore destro (Figura 3). In pratica la testa è sottoposta ad un movimento direttamente dalla posizione centrale in uno di questi due piani; diversamente la testa viene prima ruotata di 300 a destra o sinistra per poi essere rapidamente inclinata in basso ed in alto (Cremer et al., 1998).

Figura 13-A I movimenti della testa per GRV (sinistra anteriore-destra posteriore) e RALP (destra posteriore anteriore-sinistra) e laterale stimolazione canale semicircolare (frecce), come visto dall’alto. Per le prove dei canali verticali, testa della persona sia girato come mostrato e il movimento della testa è una rotazione passo nel piano dei canali denominati come rappresentato dalle frecce. Si noti in particolare che la posizione sguardo per testare i canali verticali è importante (9) – deve essere vicino ad essere lungo una retta nel piano della coppia canale stimolata come mostrato dalle linee verdi.

Figura13-B. procedura Modificata per l’impuls test dei canali semicircolari verticali.
impuls test per RALP (destra anteriore – posteriore sinistra), GRV (anteriore sinistro – posteriore, destra) e la stimolazione canale laterale (frecce), come visto dal punto di fissazione. Per le prove dei canali verticali, una procedura modificata è stato usato, che suscita movimenti oculari prevalentemente verticali di fare a meno complessa elaborazione video dei movimenti oculari torsionali [7]: La testa del soggetto è posizionato rivolto rispetto al corpo, in modo che lo sguardo è diretto lungo il piano di rotazione della testa in direzione dei canali denominati come rappresentato dalle frecce verticali. Per testare canali orizzontali il movimento è nel piano dei canali orizzontali come mostrato. Queste immagini vengono modificati da iPhone libero o iPad ‘Avor’ sviluppato dal primo autore [19]. Per la procedura di esame, vedi anche il video collegato S1. mostra meno
I movimenti compensatori generati dal sistema dei saccadici si realizzano, nella fase acuta di una DVA, al termine del movimento della testa (saccadici” overt”); successivamente essi sembrano una sorta di pre-programmazione per la quale diminuiscono in ampiezza e si manifestano già durante il movimento impulsivo della testa, risultando quindi invisibili all’occhio del clinico (saccadici “covert”) (Tian, 2000). 7 In caso di deficit vestibolare unilaterale completo la sensibilità e la specificità dell’HIT raggiungono valori elevati. Laddove invece il deficit risulti parziale, i valori di sensibilità scendono significativamente.
Limiti del vHIT
Il vHIT non può essere utilizzato su tutti i soggetti. Alcune persone hanno il collo molto rigido (patologie, traumi o interventi chirurgici al collo) e non riescono a rilassare i muscoli del collo in misura sufficiente affinché il clinico possa imporre una rotazione imprevedibile alla testa. Se i problemi a livello del collo sono moderati, bisogna avere cautela nella velocità e nell’ampiezza con cui si compiono gli Head Impulse. Talvolta vi è una scarsa compliance a causa del discomfort provato soprattutto sui piani LARP e RALP. Può accadere poi che il paziente ammicchi frequentemente. Questo può costituire un problema per la registrazione – il paziente perciò deve essere invitato a tenere gli occhi ben aperti durante ogni rotazione della testa e cercare di continuo con lo sguardo il bersaglio di fissazione. Allo stesso modo se il paziente non riesce ad eseguire i comandi dell’operatore, si distrae e non mantiene la fissazione del bersaglio non si può compiere un valido vHIT. Questo capita soprattutto per lo studio dei piani verticali. Infine, gli occhi piccoli, soprattutto negli asiatici, possono ostacolare la registrazione dei movimenti oculari, in particolare i movimenti verticali. Il trucco sugli occhi può limitare la possibilità del software di riconoscere il segnale pupillare e di poter eseguire un adeguato tracking oculare. Patologie dell’oculomozione (paralisi internucleari) rendono impossibile l’applicazione del vHIT. Tuttavia, la maggior parte di questi problemi possono essere superati con la pratica dell’operatore. Molto importante è il training dell’operatore che deve ben istruire il paziente a tentare di mantenere la fissazione sul bersaglio e che deve eseguire correttamente il test compiendo gli Head Impulse con la giusta tecnica. Gli occhiali devono essere saldamente fissati al capo, perché il loro scivolamento altera il test. Infatti qualsiasi slittamento degli occhiali sarebbe registrato come un movimento degli occhi ed in tal modo si potrebbero generare e registrare artefatti
IL vHIT E GLI ALTRI ESAMI VESTIBOLOMETRICI
Il vHIT, le prove termiche [Bilancio Vestibolare Calorico (BVC)] e le prove con Sedia Rotatoria (RC) testano il VOR a frequenze diverse e per questo i risultati che otteniamo dai vari test danno informazioni complementari e non ridondanti, nonostante questo sono stati comparati tra loro per meglio capire l’informazione clinica e l’utilizzabilità del test nella diagnostica e nel follow-up. Per esempio il BVC misura il nistagmo in risposta a basse frequenze di stimolo (0,003 Hz), si ha infatti uno studio del LF-VOR, mentre RC con studio pendolare stimola in un range che va da 0.1 Hz a 0.64 Hz. Queste due tipologie di test non rappresentano stimoli nella frequenza fisiologica del movimento della testa. Il vHIT rappresenta un’esame più fisiologico poiché, nonostante si compiano movimenti passivi del capo per studiare selettivamente i canali semicircolari, copre una varia gamma di frequenze, 3-5 Hz, che permettono l’attivazione esclusiva del VOR di pertinenza canalare allo stesso modo dei movimenti della testa attivi svolti nelle normali attività quotidiane. Le cellule vestibolari rispondono a frequenze da 0 a 16 Hz, e sono particolarmente attive in un range che va da 0,1 a 10 Hz.
vHIT e Bilancio Vestibolare Calorico
Il Bilancio Vestibolare Calorico (BVC) è dai primi anni del 1900 (1909-1914) che si conosce grazie agli studi di Robert Barany, ed è un modo valido per stabilire l’esistenza di una asimmetria del sistema vestibolare andando a studiare però soltanto i canali semicircolari orizzontali (laterali). BVC: Convenzionale test bitermico calorico (30 e 44° C) entrambe le orecchie per ottenere risposte vestibolari. Le formule Jongkees sono state applicate per esprimere la preponderanza vestibolare (VP) e preponderanza direzionale (DP) in percentuali, sulla base della velocità della componente della fase-lenta del nistagmo evocato da ciascun organo vestibolare. Il BVC, ha un discreto numero di limitazioni, nonostante sia il metodo per valutare la funzione vestibolare più largamente utilizzato. Consente la valutazione indipendente di ogni labirinto e, per compiere la stimolazione calorica, nonostante sia necessario un sistema semplice, questo è ingombrante, anche se poco costoso. Il cHIT e il vHIT allo stesso modo permettono una valutazione indipendente di ogni labirinto.
Differentemente dal BVC che testa i canali semicircolari laterali, il vHIT esamina tutti e sei i canali semicircolari, risulta però essere una challenge tecnica più ardua del test calorico e richiede più esperienza. Gli stimoli calorici sono variabili e difficili da calibrare: nonostante lo stimolo sul meato acustico esterno sia lo stesso per tutti i pazienti, gli effetti sul labirinto differiscono da un soggetto all’altro. Il BVC può essere utilizzato solo comparando la risposta del labirinto destro e sinistro e non ci fornisce una misura assoluta della funzione del canale semicircolare; ed è perciò necessario che entrambe le orecchie ricevano uno stimolo equivalente. Dall’altra parte abbiamo il vHIT che è maggiormente ripetibile e misura precisamente il VOR dando risposte oggettive comparabili tra i soggetti della popolazione e studiabili nel tempo. Lo stimolo del BVC genera risposte del VOR equivalenti a movimenti della testa a bassissima frequenza, circa 0,003Hz. Lo stimolo del vHIT copre frequenze nel range fisiologico del movimento della testa. Per completare il BVC occorrono circa 20minuti, mentre al vHIT occorrono pochi minuti.
Considerando anche il distress e la non piacevole esperienza dei pazienti nei confronti del BVC, il vHIT è una procedura meglio tollerata e performabile in pazienti dai 3 agli 80 anni ad eccezione dei soggetti con severi problemi a livello del collo. Quando sono necessari test seriali (ad esempio nella Malattia di Ménière) è più adatto utilizzare il vHIT, laddove abbiamo perforazioni timpaniche e dove non è possibile eseguire un BVC può essere utilizzato il vHIT. Nonostante queste differenze il vHIT non deve essere considerato un esame che può sostituire il Test Calorico, in quanto le due informazioni ottenute non sono ridondanti, e soprattutto non sempre coincidenti.
Questi test procurano differenti informazioni sul VOR a diverse frequenze. La probabilità di osservare un vHIT patologico dipende dalla quantità della paresi canalare (CP, canal paresis), e il suo valore critico viene riportato al 42,5% di CP; la sensibilità, altrimenti 100%, di vHIT diminuisce quando il deficit vestibolare calorico è inferiore del 62,5% (superiore a 62,5% di CP la valutazione vHIT sempre anormale). (Mahringer A e Rambold HA, 2014). Il vHIT ha una specificità del 100% e una sensibilità del’86,7%, quando è anormale conferma l’esistenza di un deficit calorico superiore al 30%, ma la sua normalità non può escludere la presenza di un deficit calorico inferiore al 62,5% (Bartolomeo M et al, 2014). Se quindi si esegue come primo test il vHIT e si trova anormale non importa condurre il BVC, altrimenti eseguire un BVC di conferma.
Rispetto alle prove caloriche si è rivelato che il vHIT è un test molto specifico, piuttosto che sensibile per la rilevazione ipofunzione vestibolare. Van Esch invece ha trovato una sensibilità del 31% una specificità del 98%, un PPV del 90% e un valore NPV del 75% per la vHIT con VORgain cut-off <0,8 rispetto al BVC. Nel sottogruppo, utilizzando come cut-off un guadagno del VOR <0,6, la sensibilità si riduce al 22% e anche il NPV si riduce al 71%, ma la specificità e la PPV raggiungono il 100%. Conclude anche Van Esch che il vHIT è clinicamente utile come primo test per determinare l’ipofunzione vestibolare in pazienti con vertigini. (Van Esch BF et al, 2016).
Sia la vHIT che il BVC, non sono differenti solo in termini di frequenza, ma anche nel modo di stimolazione: il vHIT provoca, mediante un impulso testa rapida, un flusso endolinfatico fisiologico. Al contrario, il BVC induce un flusso endolinfatico a causa di un gradiente di temperatura da un solo lato del sistema vestibolare, stimola inoltre l’orecchio interno in modo non-gravità-dipendente. Nel caso di una vHIT normale, condurre un BVC in aggiunta rimane indicata e la vHIT non sostituisce il test calorico.
vHIT e Sedia Rotatoria
La sedia rotatoria (RC): l’apparecchiatura dispone di sedia rotatoria, ospitata in una struttura che consente che il test sia eseguito al buio. La testa del paziente è stata posizionata e trattenuta ferma inclinata di 30° verso il basso, in modo che entrambi i canali semicircolari orizzontali fossero perpendicolari al piano dello stimolo e il paziente è stato mantenuto in stato di allarme con conversazione leggera. Si possono eseguire diversi test tra i quali il più condotto è il test di accelerazione sinusoidale armonica, dove il paziente viene sottoposto ad oscillazioni sinusoidali attorno ad un asse di imbardata a varie frequenze (0,01, 0,02, 0,04, 0,08, 0,16, 0,32 e 0,64 Hz) con un picco di velocità angolare di 50°/s.
Con la misurazione della velocità sedia e della velocità oculare nella fase lenta, si possono calcolare i VORgain, VORasymmetry e VORphase: Guadagno e Simmetria e Fase sono stati considerati anomali quando i risultati erano anormali per tre frequenze adiacenti. Si può eseguire anche il test rotazionale impulsivo con rotazione ad una velocità costante per 60s e una decelerazione finale a 0°/s2. I risultati sono stati analizzati in termini di rotazione verso i lati destro e sinistro. Quando si compara con la Sedia Rotatoria, il vHIT offre una serie di vantaggi diagnostici. Anche nella RC possiamo studiare solo i canali semicircolari laterali, ma con questo test li studiamo contemporaneamente, e soltanto con delle accelerazioni elevate all’intero corpo possiamo riuscire a studiare un canale alla volta.
Lo stimolo utilizzato sui CSL è altresì molto preciso, ripetibile – e quindi anche questo esame può essere utilizzato per studiare il paziente nel tempo alle basse e medio-basse frequenze di stimolo –. La sedia rotatoria richiede però un grande spazio dove essere collocata ed è molto costosa. La sedia rotatoria è considerata il gold standard per diagnosticare e quantificare la presenza della disfunzione vestibolare bilaterale (bilateral vestibular loss BVL). Anche il vHIT può fornire informazioni sulla BVL e determinare se sia una perdita completa o parziale, tanto che nelle nuove linee guida il vHIT può essere utilizzato come nuovo gold standard difatti la diagnosi di labirintopatia periferica bilaterale è basata su: presenza di oscillopsia, instabilità, vHIT patologico su entrambi i lati, test dell’acuità visiva dinamica positivo. Nelle nuove linee guida la diagnosi di labirintopatia periferica bilaterale è basata su: presenza di oscillopsia, instabilità, vHIT patologico su entrambi i lati e su delle anomalie del test di acuità visiva (a testa ferma e scuotendo la testa, perdendo più di 5 righe). Grazie quindi ai vantaggi del vHIT ne consegue un utilizzo clinico sempre minore della sedia rotatoria, di nicchia solo in pazienti particolari.
14.) Head Heave
Test (HHT) – Tests impulsivi per il VOR lineare -Test
Impulsivo Traslatorio Fig-14a/b
https://youtu.be/KYI7eHhwhwk
FILMATO https://youtu.be/KYI7eHhwhwk?t=45
traduzione in italiano
|
|
|
Il test traslatorio è stato ideato per stimolare l’utricolo ed evocare il RVO traslazionale (Ramat, 2005). La risposta è considerata positiva quando una ampia saccade correttiva consegue ad una rapida traslazione della testa verso il lato patologico. Nelle primissime fasi di una paralisi vestibolare il test risulta chiaramente positivo in circa il 70% dei pazienti (Nuti, 2005), ma viene rapidamente compensato in pochi giorni-settimane. Il test traslatorio è da considerare come complementare al test impulsivo rotatorio per la diagnosi di deficit vestibolare acuto unilaterale e talora risulta utile quando la risposta ad HIT è dubbia. In associazione con l’HIT può anche essere efficace per la prognosi della neurite vestibolare, dato che quando entrambi segni sono positivi il recupero funzionale è spesso più lento ed incompleto (Mandalà, 2008).
-La funzione otolitica
1.Percezione delle accelerazioni lineari
2.Percezione del tilt gravitazionale
3.Movimenti di bilanciamento e compensatori degli occhi, della testa e del corpo
4.Risposte autonomiche
Il riflesso otolitico-oculare stabilizza l’immagine retinica generando movimenti oculari di compensazione in risposta all’accelerazione lineare della testa e all’orientamento della testa rispetto alla gravità. I pazienti con disfunzione otolitica spesso si presentano con una varietà di sintomi, tra cui false sensazioni di moto lineare o inclinazione (dell’ambiente o dell’auto), lateropulsione, sensazioni di caduta o attacchi di cadute improvvise, diplopia, oscillopsia, e percezioni visiva d’inclinazione (1). Nonostante una maggiore comprensione della fisiologia degli otoliti negli ultimi decenni, l’individuazione di lesioni otolitiche rimane una diagnosi impegnativa e spesso si fa la diagnosi sulla base della storia clinica e l’esclusione di altre possibili cause
I pazienti con sintomi tipici e ricorrenti otolitici ma con risultati normali ai test vestibolari standard di laboratorio (vale a dire, con la elettro-video-nistagmo grafia [ENG/VNG], con il test calorico bitermico, al test di Halmagyi-Curthoys, con i potenziali evocati vestibolari miogenici [VEMPs]), con la Verticale Soggettiva Visiva (SVV) potrebbe avere lesioni parziali del sistema otolitico che sfuggire ad un controllo da questi test convenzionali. (2).
Usando questo test, traslazionale anormale VOR (TVOR) le risposte sono state osservate in pazienti con gentamicina ototossicità (2) e neuriti vestibolari acute (3). Kessler, (4,5) e altri (6) hanno già dimostrato che la sensibilità di rilevamento disfunzioni canale orizzontale può essere aumentato testando la VOR rotazionale in un’alta e più fisiologica gamma di frequenze. Kessler et al. Hanno valutato se le prove con il TVOR, ad alta accelerazione interaurale, usando il Test Impulsivo Traslatorio/Head Heave Test (HHT) poteva rivelare una disfunzione completa o parziale degli otoliti in pazienti con i tipici sintomi otolitici.
Recentemente, allo scopo di evidenziare asimmetrie dinamiche della funzione utricolare, simili a quelle della funzione canalare soggette alla seconda legge di Ewald, in analogia a quanto eseguibile per la funzione canalare attraverso l’HIT, è stato ideato l’Head Heave Test (HHT) Test Impulsivo Traslatorio, per stimolare l’utricolo ed evocare il RVO traslazionale (Ramat, 2005). che è
•Uno stimolo otolitico (utricolare) con una veloce accelerazione lineare, secondo l’asse interaurale (da destra a sinistra e viceversa) determina una saccade correttiva a rapida traslazione verso il lato deficitario.
•un test clinico in grado di valutare la funzione otolitica dinamica
•Razionale e strategia identiche a quelle adottate per svelare asimmetrie dinamiche della funzione canalare (test impulsivo angolare.
•È possibile che nei pazienti con perdita unilaterale della funzione labirintica coesistano asimmetrie nella funzione utricolare che riflettono la seconda legge di Ewald, simili a quelle della funzione canalare.
• Saccade correttiva in risposta a rapida traslazione verso il lato deficitario (head heave sign).
Non esistono significative differenze tra risposte evocate da stimolo manuale e quelle ottenute con “head-sled”
Questo test permette di valutare la funzione utricolare e di conseguenza la porzione di nervo vestibolare superiore che riceve input da questa struttura attraverso rapidi movimenti traslazionali sul piano orizzontale (Nuti et al., 2005). Il soggetto deve fissare una mira posta di fronte mentre la testa viene rapidamente mossa in senso orizzontale sul piano interaurale per pochi centimetri (5-6 cm). In presenza di una corretta funzionalità otolitica utricolare lo sguardo si mantiene stabile; la comparsa di un saccadico correttivo alla fine del movimento indica una ridotta funzionalità dal lato verso il quale la testa viene spostata.
La sensibilità di questo test appare tuttavia ancor più bassa di quella dell’HIT, probabilmente poiché il VOR traslatorio compensa più facilmente rispetto al VOR rotazionale (Aw et al., 2003). Inoltre la risposta del VOR transazionale è generalmente ipocompensatoria per cui piccoli movimenti saccadici di correzione possono essere presenti in entrambe le direzioni. Pertanto per definire anomala la risposta dell’HHT è necessario evidenziare una asimmetria tra i due lati e questo non sempre è di agevole riscontro anche in virtù della relativa piccola ampiezza dei saccadici (Mandalà et al., 2008). Per questo motivo, nonostante l’introduzione di complesse metodiche computerizzate (Ramat e Zee, 2003), l’applicazione clinica dell’HHT è piuttosto limitata. La risposta è considerata positiva quando una ampia saccade correttiva consegue ad una rapida traslazione della testa verso il lato patologico.
Nelle primissime fasi di una paralisi vestibolare il test risulta chiaramente positivo in circa il 70% dei pazienti (Nuti, 2005), ma viene rapidamente compensato in pochi giorni-settimane. Il test traslatorio e da considerare come complementare al test impulsivo rotatorio per la diagnosi di deficit vestibolare acuto unilaterale e talora risulta utile quando la risposta ad HIT e dubbia In associazione con HIT può anche essere efficace per la prognosi della neurite vestibolare, dato che quando entrambi segni sono positivi il recupero funzionale e spesso più lento ed incompleto (Mandala, 2008).
Arch Otolaryngol Head Neck Surg. 2008 Feb;134(2):164-9. doi: 10.1001/archoto.2007.35. Effectiveness of careful bedside examination in assessment, diagnosis, and prognosis of vestibular neuritis. Mandalà M1, Nuti D, Broman AT, Zee DS. Acute vestibular neuritis: prognosis based upon bedside clinical tests (thrusts and heaves). Nuti D1, Mandalà M, Broman AT, Zee DS.
APPROFONDIMENTO https://youtu.be/KYI7eHhwhwk
FILMATO
Tests impulsivi per il VOR lineare: Head Heave Test (HHT) LA DIAGNOSI BEDSIDE DELLA VÈRTIGINE ACUTA
G Agus, D. Marongiu, E Carta; Bedside examination of acute vertigo a cura di Giacinto Asprella Libonati
Il possibile interessamento e la relativa espressività clinica, nell’ambito di una sofferenza vestibolare acuta, delle strutture maculari del labirinto vestibolare, delle fibre afferenti maculari delle divisioni della branca vestibolare dell’VIII° n.c. (nervo vestibolare superiore, nervo vestibolare inferiore) e delle strutture nucleari e sopra nucleari delle vie maculo-oculari, maculo-spinali e maculo-corticali, è diretta espressione del meccanismo patogenetico responsabile (infiammatorio, infettivo, vascolare ischemico o emorragico, traumatico, chiragrico, idropico, idiopatico), del grado di acuzie, di gravità e distensione anatomica della lesione neurale, dell’efficienza della messa in atto di meccanismi di recupero e di compenso centrale e del momento dell’osservazione clinica rispetto all’esordio temporale dell’evento lesivo.
Nell’ambito di una alterazione vestibolare acuta, l’espressività oggettiva e soggettiva di un interessamento maculare appaiono storicamente, clinicamente, costantemente sottostimati a causa di una serie di ragioni intrinseche alle peculiarità anatomo-funzionali delle funzioni maculari, rispetto alle corrispettive funzioni vestibolari canalari: maggiore difficoltà nella ricerca neurofisiologica di base con relativa più modesta sua applicabilità nella diagnostica clinica, minore espressività sul piano fisiopatologico e semeiologico oculomotorio, maggiori complessità, difficoltà e onere economico per lo studio sperimentale e clinico delle funzioni maculari. Ciò ha determinato un ritardo significativo nello studio e nelle conoscenze dei meccanismi fisiopatologici di una alterazione delle funzioni maculari e maggiore difficoltà nell’approccio alla comprensione ed alla valutazione clinica dei sintomi ad esse correlati.
Le conseguenze dirette ditali aspetti, nell’ambito dell’attività clinica routinaria otoneurologica, sono rappresentate dalla probabile e frequente sottovalutazione, da parte dell’operatore clinico, di sintomi spesso considerati “bizzarri”, poco credibili o scarsamente definiti e specifici, a causa della problematica o insufficiente comprensione, da parte dell’operatore, della difficoltà espressiva e semantica del paziente e dalla presenza di significative interferenze sensoriali extramaculari, cognitive ed emotive, da parte del paziente, oltre che della scarsa disponibilità di metodiche e di indicatori obiettivi sensibili specifici ed efficienti di deficit maculare.
Ciò è stato responsabile della relativa impossibilità di una adeguata valutazione funzionale e clinica, della conseguente e spesso mancata inadeguata o non corretta diagnosi clinica, del mancato accoglimento delle aspettative sia del paziente sia dello stesso operatore clinico e dei non sottovalutabili oneri in termini sociali e di costo sanitario. 7 Solo in tempi relativamente recenti, infatti, l’introduzione in ambito di diagnostica clinica di metodiche di valutazione elettrofisiologica con specificità di analisi sulle funzioni maculari (cVEMP’s, oVEMP’S) ha permesso l’acquisizione di informazioni di significato sia funzionale sia topo diagnostico con relativo, parziale ma significativo, recupero dello storico gap esistente tra funzione maculare da un lato e clinica correlata e capacità diagnostica dall’altro.
Relativamente al tema della presente esposizione e allorquando la valutazione della funzione maculare debba essere condotta senza l’apporto della semeiotica strumentale (per indisponibilità, per logistica con operatività ambulatoriale o in regime di urgenza), similmente a ciò che ha caratterizzato la evoluzione storica della semeiologia otoneurologica non strumentale (Bed-side examination) dei riflessi canalo-oculomotori, un approccio “physiology oriented” dei riflessi maculo-oculomotori ha potuto sviluppare, parzialmente sistematizzare e introdurre, in tempi relativamente recenti, alcune modalità operative cliniche non strumentali di basso costo, di facile applicabilità e di sufficiente sensibilità/specificità con la possibilità e la disponibilità di avere un indicatore obiettivo di alterata funzionalità maculo-canalare anche se solo limitato alla valutazione del riflesso visuo-vestibolo-oculomotore di genesi utricolare.
L’apporto di una semeiologia ‘physiology oriented” applicata alle funzioni maculari, similmente a ciò che avviene in qualsiasi altro approccio clinico e come anche più specificatamente per le funzioni vestibolari di origine canalare, rappresenta il secondo momento semeiologico dell’esame clinico, con riferimento specifico alla fisiologia dei riflessi maculari, alle sensazioni sensoriali soggettive fisiologiche e alla fisiopatologia correlata, con l’obiettivo della comprensione e della giustificazione dei sintomi lamentati dal paziente.
Il sistema maculare appare specificamente disegnato quale sistema sensoriale (accelerometri inerziali lineari) in cui lo stimolo adeguato fisiologico è rappresentato da accelerazioni gravito-inerziali sia relative a modificazioni nell’orientamento statico dell’estremo cefalico rispetto al vettore di accelerazione gravitazionale sia relative a condizioni dinamiche durante le quali i movimenti cefalici lineari nei tre assi dello spazio determinano, integrandosi con il vettore gravitazionale, risultanze vettoriali più complesse (Leigh, 2006).
Il significato funzionale del sistema, nella sua integrazione armonica con altri sistemi sensoriali (visivo, sonato-propriocettivo, uditivo, olfattivo) motori e cognitivi, è quello di permettere una corretta adeguata e cosciente sensazione di movimento, di posizione, di orientamento spaziale, di un corretto concetto di schema corporeo e di una organizzazione del comportamento oculare e posturale idonea e compensatoria ai movimenti cefalici lineari ed adeguata ad affrontare adattativamente in modo efficiente le necessità rappresentate nell’ambiente vitale.
quadro clinico caratterizzato dalla coesistenza di sintomi/segni di sofferenza canalare, etiopatogeneticamente correlati, che dimostrano una maggiore espressività clinica. Ciò rende ragione, insieme a quanto esposto in precedenza, del perché il danno maculare appaia ancora sottostimato e non pienamente sistematizzato sia sotto l’aspetto semeiologico sia sotto l’aspetto nosologico. Nell’ambito di una vertigine ad esordio acuto sostenuta da una significativa riduzione improvvisa unilaterale dell’input vestibolare (Bohmer, 1996) (Deficit Vestibolare Acuto, DVA) rappresentante il modello di quadri clinici di frequente osservazione e di possibEl modalità di esordio di una patologia grave quoad vitam, i segni definiti di una sofferenza vestibolare acuta periferica permettono spesso di esprimere un affidabile giudizio clinico indicativo per una condizione definita sotto l’aspetto topo diagnostico e caratterizzata da una buona prognosi (Nuti, 2005).
In questo ambito, la ricchezza espressiva semeiologica sia del deficit canalare sia del deficit maculare è condizionata dalla presenza di vari elementi significativi: stato anteriore all’evento patologico della funzione vestibolare, meccanismo patogenetico responsabile, mono-bilateralità, acuzie o progressività, globalità o settorialità, totalità o parzialità, irreversibilità o reversibilità della lesione, momento della osservazione clinica rispetto all’esordio ed intervento ed efficienza del compenso centrale.
In tale contesto, accanto ai segni statici di deficit unilaterale del riflesso vestibolo-oculomotore canalare (nistagmo spontaneo orizzontale-torsionale, persistente, diretto verso il lato non colpito dall’evento, biocutare coniugato, accentuato dallo sguardo diretto verso la fase rapida, inibito da luce e fissazione, dimostrante geotropismo nelle osservazioni condotte con il paziente nei decubiti laterali) possono essere presenti reperti di analogo significato relativi ad una asimmetria statica dei riflessi maculo-oculomotori- disallineamento oculare verticale (skew deviation), ciclotorsione bioculare disconiugata associati a tilt cefalico, configuranti una Ocular Tilt Reaction (OTR) testimone dell’imbalance delle informazioni di origine maculare.
Accanto a tali reperti, e similmente a quanto è possibile operare sul riflesso vestibolo-oculomotore (RVO) di genesi canalare, appare attuaImente sufficientemente sistematizzata, sul piano concettuale e metodologico, una operatività semeiologica indirizzata nel valutare il RVO di genesi maculare sotto l’aspetto dinamico attraverso l’impiego di stimoli impulsivi ad elevata frequenza applicati con una modalità rispettosa ed adeguata rispetto alla fisiologia del RVO maculare (accelerometro lineare con uscita oculomotoria) al fine di ricavare informatività sulla possibile presenza di una asimmetria dinamica del RVO di genesi utricolare.
Analogamente a quanto appare attualmente ben sistematizzato per il riflesso canalo-oculare (Head Impulse Test: HIT) con l’impiego di stimoli impulsivi angolari condotti sul piano del canale semicircolare testato, test impulsivi rappresentati da stimolo lineare (movimenti translazionali orizzontali di limitata escursione e di elevata accelerazione condotti sull’asse interaurale e applicati passivamente sull’estremo cefalico) possono essere impiegati al fine di valutare l’efficienza del riflesso maculo canalare di genesi utricolare (Head Heave Test: HHT) assumendo che un riflesso maculo-oculare efficiente debba compensare il movimento traslazionale cefalico attraverso un movimento oculare con guadagno, velocità e fase adeguati al mantenimento di una proiezione foveale stabile di una mira visiva presentata durante l’esecuzione del movimento cefalico (Ramat, 2001; Leigh, 2006). Ciò rappresenta quanto è possibile osservare nel soggetto con un normale ed efficiente RVO utricolare (vedi tabella 1, video 1)
| – Paziente seduto senza appoggio davanti all’esaminatore, uso di protesi diottriche solo se per ipermetropia/presbiopia, testa in flessione di 30°, ambiente con buona luminosità alle spalle dell’operatore o uso di spot frontale. |
| – Induzione di movimenti passivi translazionali impulsivi di elevata velocità sull’asse interaurale (5-10cm lineari in 1/lodi sec.), con direzione e timing non prevedibili per il Paziente, osservando il mantenimento dell’asse di gaze con fissazione visiva di una mira frontale (naso dell’esaminatore). |
| – Applicazione, salda ampia e simmetrica, delle mani dell’operatore sulle regioni laterali cranio-facciali con attenzione nell’esecuzione di una translazione quanto più priva possibile di componenti torsionali sui piani di tilt/ pitch/roll (ricerca di ottimizzazione nella specificità dello stimolo). |
| – Esecuzione di un numero sufficiente (normalmente non più di 5 per lato) di translazioni atte a condurre una osservazione affidabile (positività/negatività) del test. |
Tab. 1-15: Head Heave Test (HHT).
Analogamente a quanto osservabile nell’HIT condotto in condizioni di importante riduzione della funzione di ingresso del riflesso canalo-oculomotore angolare (per patologia dei recettori o delle fibre afferenti ampollari), in condizioni di una significativa ridotta funzione di afferenza delle informazioni maculari il segnale oculomotorio compensatorio del lato testato risulterà inefficiente e non sostituibile dal segnale integro inibitorio del riflesso utricolo-oculomotore del lato opposto (2° legge di Ewald) per poter compensare il movimento cefalico transazionale. L’asse di sguardo non cadrà più sulla mira visiva e lo shift retinico potrà essere compensato solo attraverso l’impiego del sistema visuo-oculomotore con un movimento bioculare saccadico condotto sullo stesso asse ed in direzione compensatoria opposta al movimento cefalico (Lempert, 1999; Ramat, 2001; Nuti, 2005; Crane, 2005) (video 2).
Il rationale fisiologico e fisiopatologico sotteso all’HHT rappresenta la trasposizione sul RVO lineare maculare di quanto viene applicato con l’HIT sul RVO canalare angolare: accelerazioni lineari impulsive condotte random e passivamente nelle due direzioni dell’asse interaurale con ricerca di una risposta oculomotoria (translational-VOR: t-VOR, o linear VOR I-VOR) efficiente (movimento cefalico accompagnato da un movimento oculare adeguato per il mantenimento dell’asse di sguardo sulla mira e per la sua proiezione foveale) o inefficiente (movimento oculare inadeguato e compensato da un movimento saccadico di rifissazione governato dall’informazione visiva).
L’HHT rappresenta una modalità semeiologica facilmente applicabile senza la necessità dell’ausilio di alcuna strumentazione, permette una valutazione con specificità “dilato” dell’efficienza della componente utricolare del RVO con il possibile rilievo di un deficit unilaterale o bilaterale del riflesso quale reperto isolato o associato ad un coesistente interessamento del RVO canalare e la possibilità di identificare con semplicità la presenza di un interessamento dell’afferenza utricolare in un contesto di reperti semeiologici in cui una tale informazione può rappresentare un aspetto di elevata informatività sotto il profilo funzionale e clinico (Nuti, 2005).
La sensibilità, la specificità e la informatività della metodica descritta non appaiono ancora valutate in casistiche sufficientemente ampie e sono state recentemente (Agus, 2011, 2015) ricercate in Pazienti presentanti patterns Semeiologici conformi al modello del DVA definiti da una riduzione primitiva persistente e unilaterale della funzione vestibolare.
sultati emersi dallo studio di questi Pazienti hanno rilevato, nei Pazienti in fase acuta, una sensibilità del 47% dell’HHT rispetto ad una positività del 57% del HIT e valori rispettivamente del 10% in ambedue i test nei Pazienti in fase post-acuta (follow-up ai 30 giorni dall’esordio), con assenza di positività canalare o maculare “isolata” o di discordanza direzionale (HHT positivo da un lato con HIT positivo controlateralmente o viceversa), permettendo di rilevare una buona sensibilità in fase acuta ed una bassa sensibilità in fase post-acuta dell’HHT, con l’osservazione aggiuntiva di nessun caso con deficit maculare dissociato da deficit canalare.
La significativa riduzione della sensibilità del test osservata nei Pazienti con DVA in fase post-acuta (30 giorni dall’esordio clinico) è compatibile con la messa in atto di meccanismi di compenso funzionale del riflesso utricolo-oculomotore, mostrando un andamento temporale simile a quanto osservabile per il RVO canalare. Osservazioni effettuate più precocemente, ma non sistematizzate temporalmente, condotte in questo gruppo di pazienti (dati non pubblicati), indicherebbero tuttavia una più precoce negativizzazione dell’HHT rispetto a quanto osservabile per il HIT, confermando un diverso time-course post-lesionale nel compenso dei due riflessi.
Le caratteristiche fisiche dello stimolo impiegato (impulsività, transitorietà, imprevedibilità) insieme alla specificità del suo orientamento spaziale rispetto alle strutture recettoriali labirintiche (translazioni orizzontali sull’asse interaurale) limitano questa modalità di esplorazione funzionale alla reflettività utricolo-oculomotoria per lo spettro delle alte frequenze. La specificità e la sensibilità del test, quale possibile indicatore di deficit mono/bilaterale a sede periferica della reflettività utricolo-oculomotoria, necessita di una validazione ottenuta dalle osservazioni ricavate in gruppi omogenei di Pazienti controllati per nosografia e sede di lesione.
Il test si è rivelato costantemente negativo in un gruppo di soggetti sani di controllo. Una risposta “debolmente positiva” (movimento oculare compensatorio bilateralmente di velocità ridotta senza una vera latenza dal termine del movimento di translazione) è stata osservata in un numero non quantificato di soggetti anziani e spesso correlata con un insufficiente stato di attenzione nella fissazione della mira visiva.
La limitazione dovuta a falsi negativi correlata alla possibilità della presenza di “cover saccades” non rilevabili, similmente a quanto è osservabile per il HIT, rappresenta una limitazione intrinseca di questa modalità esplorativa evitabile con l’impiego di osservazioni video assistite con software accelerometri dedicati. on si è osservata alcuna limitazione all’operatività, nella metodica applicata al suddetto gruppo di Pazienti, condizionata da intolleranza/ipersensibilità allo stimolo. L’impegno meccanico dello stimolo sull’estremo cefalico deve essere valutato relativamente allo stato specifico delle condizioni delle strutture anatomiche cranio-cervicali su cui viene ad esercitarsi, similmente alle attenzioni da osservarsi nell’applicazione manuale di altri stimoli impulsivi vestibolari (HIT, Head Shaking Test).
Le conclusioni di tale lavoro hanno permesso di affermare la probabile sottostima o il mancato rilievo di un interessamento maculare in Pazienti con DVA unilaterale, la facile esecuzione dell’HHT con la possibilità dì poter definire la presenza di una maculopatia associata a DVA “canalare” ottenuta in un contesto “bed-side” con valutazione “physiology oriented”, sottolineando la necessità e l’utilità di osservazioni condotte su casistiche più ampie, la necessità di definire la possibile interferenza di un deficit canalare sulla espressività e specificità dei segni maculari e del confronto di questi dati con i rilievi obiettivi ricavati con metodiche elettrofisiologiche specifiche sulla reflettività maculo-oculomotoria.
BibliografialReferences
BibliografialReferences 1. Agus G, Marongiu D. Atti VI incontro multidisciplinare di vestibologia. Perugia 18-19 nov 2011.
2. Agus G, Marongiu D. Atti 3°Congresso Nazionale della V.l.S. 30-31 oct 2015.
3. Bohmer A. Acute unilateral peripheral vestibulopathy. In: Baloh RW, Halmagyi MG Eds. Disorders of the vestibular system. Oxford University Press 1 996;31 8-327.
4. Crane BT, Tian JR, Ishiyama A, Demer JL. Initiation and cancellation of the human heave linear vestibulo-ocular reflex after unilateral vestibular deafferentation. Exp Brain Res 2005;161,519-526.
5. Leigh RJ, Zee DS. The neurology of eye movements. 4th edition. Oxford University Press, 2006.
6. Lempert T, Gresty MA, Bronstein AM. Horizzontal linear vestibulo-ocular reflex testing in patients with peripheral vestibular disorders. Ann N Y Acad Sci 1 999;871 232-247.
7. Nuti D, Mandalà M, Broman AT, Zee DS. Acute vestibular neuritis prognosis based upon bedside clinical tests (Thrusts and heaves). Ann N Y Acad Sci 2005;1 039,359-367.
8. Ramat 5, Zee DS, Minor LB. Translational vestibulo-ocular reflex evoked by a head heave” stimulation. Ann N YAcad Sci 2001 942,95-113. 259
15.)
Head Shaking Test(HST); IL Nistagmo da Scuotimento Cefalico https://youtu.be/glSJGnTMeHE FILMATO traduzione italiana
L’Head Shaking test (HST) sul piano orizzontale è un test molto utile per valutare l’equilibrio dinamico del sistema vestibolare e la integrità del meccanismo di “velocity storage”. È particolarmente efficace nel provocare un nistagmo nei pazienti con deficit vestibolare compensato, ma fornisce anche valide informazioni nei pazienti con vertigine o instabilità acute.
Il test provoca infatti un evidente incremento del nistagmo spontaneo dovuto a deficit vestibolare periferico, avvalorando così il sospetto diagnostico. In realtà, il test assume un valore diagnostico maggiore quando, in fase acuta, provoca una risposta anomala. In particolare è da sospettare fortemente una lesione cerebellare quando l’HST sul piano orizzontale provoca un nistagmo verticale (perverted) (Huh 2011; Kim, 2005), quando si realizza una (o più di una) inversione di direzione del nistagmo indotto da HST o quando provoca la inversione di un nistagmo spontaneo preesistente (Choi, 2007). Le caratteristiche di tipo centrale vengono di solito facilmente rilevate senza l’aiuto degli occhiali di Frenzel ed utilizzando poche e blande oscillazioni della testa.
È stato descritto per la prima volta da Barany nel 1907, Moritz ha definito “kopfschutteinnystagmus” (1951). Studi successivi (Borries 1923; Klestadt 1936; Vogel 1929) hanno descritte diverse tecniche di suscitare il nistagmo e Kamei nel 1964 ne ha standardizzato la tecnica introducendolo nella pratica clinica. Dopo aver conosciuto alterne manifestazioni di interesse,
Il test consisteva nello scuotimento sul piano orizzontale della testa del soggetto esaminato 30 volte:
a. sul piano orizzontale con la testa inclinata in avanti di trenta gradi;
b. sul piano orizzontale con la testa in posizione naturale;
c. sul piano coronale;
d. sul piano sagittale.
Il nistagmo così provocato veniva osservato sotto occhiali di Frenzel e considerato molto importante per stabilire se esistesse uno squilibrio di recente insorgenza tra i due emisistemi vestibolari e per distinguere i pazienti dai soggetti sani.
l’HST è oggi inserito nella batteria degli esami clinici sistematicamente eseguiti nel corso dell’esame obiettivo otoneurologico è evocato nella pratica clinica odierna in questa maniera (tabella 1):
|
|
Metodo di indurre Head Shaking Test (HSN)
|
|
| ||
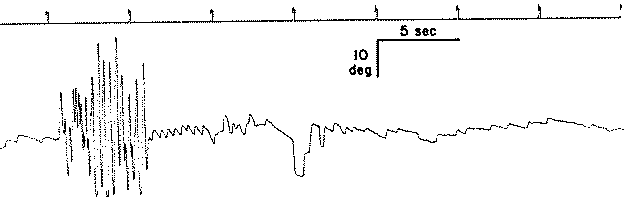
| Fig-15b Head-Shaking nistagmo – posizione di traccia. La testa è agitato come descritto nel testo, dopo di che un nistagmo segue, tipicamente per circa 15 secondi, con una velocità di picco di circa 15 gradi / sec. (Wei et al, 1989) |
Tab.1-15 Modalità di esecuzione del test di scuotimento cefalico.
| Posizione del paziente | Seduto |
| Posizione della testa | 20 gradi inclinata in avanti (ma va bene anche nella posizione naturale) |
| Numero di cicli destra-sinistra | 20 o 30 con una frequenza di 2 Hz (due cicli al secondo) sul piano orizzontale con una escursione di circa 90° |
| In | 10 secondi |
| Significativo se | Parte un nistagmo (almeno 4-5 scosse) o, se un nistagmo spontaneo è già presente, questo si modifica |
| movimento deve essere attivo o passivo? | È considerato indifferente |
La prova viene effettuata con occhiali di Frenzel ad occhi chiusi, Il capo del paziente, flesso in avanti di 20-30°, viene sottoposto ad una serie di 20-30 rotazioni orizzontali di circa ± 40°, ad una frequenza di circa 2 Hz. Al termine delle rotazioni si invita il soggetto ad aprire gli occhi e si osserva l’eventuale comparsa di un nistagmo transitorio (figura 1 )che verrà definito Head-Shaking Nystagmus (HSNy). La manovra può essere eseguita anche sul piano verticale con oscillazioni sagittali od anche sull’asse anteroposteriore della testa ma non sembra dare indicazioni aggiuntive dal punto di vista clinico, il valore clinico di questa metodica non è ben chiaro (Cherchi e Hain, 2007).
 |
| Fig.15-c Nistagmo da scuotimento cefalico sul piano orizzontale |
In realtà dunque non si tratta di un nistagmo da scuotimento cefalico ma di un nistagmo post-scuotimento cefalico.
In alternativa si può chiedere al paziente di eseguire da solo il movimento della testa (head shaking attivo invece che passivo) senza che questo influisca significativamente sul significato dell’esame.
Questo test deve essere effettuato in modo rigoroso, poiché altrimenti la sua interpretazione è difficile, o addirittura impossibile. In effetti, esso presenta due fasi, primaria e secondaria, nel corso delle quali il nistagmo cambia direzione (figura 2). In pratica, la testa del paziente è girata rapidamente nel piano orizzontale
Questo test deve essere effettuato in modo rigoroso, poiché altrimenti la sua interpretazione è difficile, o addirittura impossibile. In effetti, esso presenta due fasi, primaria e secondaria, nel corso delle quali il nistagmo cambia direzione (figura 2). In pratica, la testa del paziente è girata rapidamente nel piano orizzontale da sinistra a destra e da destra a sinistra per 20 secondi. Alla sospensione della stimolazione, sono analizzati i movimenti oculari potenzialmente indotti.
Ogni asimmetria funzionale dei vestiboli destro e sinistro si manifesterà con la comparsa di un nistagmo spontaneo di breve durata (inferiore il più delle volte a 10 secondi: fase primaria) in cui la direzione della fase rapida è orientata verso il lato intatto (un nistagmo destro è segno di un’iporeflessia sinistra). È seguito da un nistagmo secondario (recovery nystagrnus) di durata molto più lunga, in genere meno intensa della prima (oltre 60 secondi: fase secondaria) la cui fase rapida batte dal lato leso (Harvey et al., 1997).
Questo tipo di risposta viene definita bifasica. Non c’è accordo sui criteri per una corretta valutazione della risposta nistagmica dopo HST: alcuni Autori considerano significativa anche la comparsa di sole 3 scosse ben definite di nistagmo (Kim et al., 2012); altri utilizzano la registrazione oculo-video-nistagmografica affermando che l’HST può essere considerato positivo se compaiono almeno 5 scosse con velocità angolare di almeno 2°/s (Perez et al., 2004).. La fase primaria può passare inosservata ed è possibile che solo la fase secondaria sia chiaramente visibile. Il head shaking nystagmus deriva da un’asimmetria tra i due vestiboli destro e sinistro e da un’asimmetria dei segnali vestibolari sul meccanismo centrale di accumulo della velocità (velocity storage mechanism) . [Esso è orizzontale in caso di lesione periferica.
Se è disarmonico o di direzione verticale, indica un’origine centrale]. Sono descritti casi in cui, dopo scuotimento cefalico, compare un nistagmo non orizzontale ma verticale puro (Wu, 2005) o con componente verticale nettamente prevalente su quella orizzontale (più comunemente downbeat), o torsionale (Carifano, 2001), che viene definito nistagmo “pervertito” ed è considerato espressione di sofferenza centrale (figura 2). . Questa tipologia di risposta viene definita cross-coupled o perverted HSNv (Cherchi e Hain, 2010). Due sono le ipotesi relative alla fisiopatologia del perverted HSNy (Minagar et al., 2001):
— il segnale vestibolare generato sul piano orizzontale giunge in modo anomalo alle strutture centrali coinvolte nel VSM verticale. Il nucleo di Roller e il nucleo intercalato sono verosimilmente coinvolti in questo meccanismo visto le loro connessioni sia con i centri coinvolti nell’integrazione neurale del VOR orizzontale (nucleo proposito dell’ipoglosso) e verticale (nucleo interstiziale di Cajal);
— i nuclei di Roller e intercaiato inviano proiezioni alle regioni vestìboio-cerebellari. Queste aree hanno un’azione inibitoria nei confronti delle vie centrali che veicolano impulsi piovenienti dal canali semicircolare anteriore ma non dai posteriore. Pertanto il perverted HSNy potrebbe derivare da una disinibizione delle vie centrali conseguenti allo stimolo canalare.
Altri pattern di HSNy suggestivi di patologia vestibolare centrale sono rappresentati da:
— comparsa di evidente HSNy in assenza di deficit periferico unilaterale;
— evidenza di un HSNy particolarmente intenso (> a 40-50°!s);
— comparsa di intenso HSNy a seguito di stimolo debole, anche solo dopo 2-3 cicli di oscillazione della testa;
— presenza di un nistagmo secondario ampio e di lunga durata;
— comparsa di un HSNy polifasico.
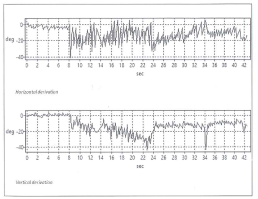
|
| Fig.15-d Nistagmo da scuotimento cefalico sul piano orizzontale e verticale (in basso),probabilmente da deficit centrale |
Utilità clinica
Nei deficit vestibolari periferici è frequentemente osservabile un nistagmo diretto verso il lato sano, giustificato dalla seconda legge di Ewald e dal “velocity storage”, meccanismo centrale che prolunga il segnale vestibolare periferico dopo la stimolazione. In fase acuta il velocity storage può essere lesionato, pertanto il nistagmo da head-shaking può risultare assente. La prova non consente, inoltre, con certezza la diagnosi del lato deficitario. Infatti, specialmente nella fase di recupero, è stato descritto un nistagmo battente verso il lato leso. In caso di lesioni centrali determinanti una lesione intrinseca del velocity storage può manifestarsi un nistagmo da HST anche in assenza di asimmetria vestibolare periferica. La comparsa di un ny verticale (soprattutto downbeat) dopo HST eseguito sul piano orizzontale è suggestiva di un deficit centrale.
L’HST pur non essendo molto sensibile, specialmente se eseguito a distanza dalla lesione, è accettato come utile test di screening per evidenziare asimmetrie vestibolari a livello periferico o centrale senza possibilità di precisazioni topodiagnostiche Fig. 15eA;15eB

.
15eA;15eB Head shaking test in un paziente che presenta un deficit vestibolare periferico sinistro. Dopo scuotimento della testa nel piano orizzontale per 20 secondi, si può osservare alla sospensione della rotazione un nistagmo primario seguito da un nistagmo secondario.
A. Fase primaria: le fasi rapide del nistagmo sono orientate verso destra; questa fase è di breve durata
B. Fase secondaria: le fasi rapide del nistagmo sono orientate verso sinistra; questa fase è di durata maggiore.
L’HSNy può essere spiegato probabilmente ricorrendo ad una combinazione della seconda legge di Ewald e del meccanismo di “Velocity storage”.
La seconda legge di Ewald stabilisce che uno stimolo eccitatorio è piLi efficiente, sul piano orizzontale, di uno stimolo inibitorio: nelle vestibolopatie periferiche lo scuotimento della testa sul piano orizzontale genera afferenze asimmetriche che verosimilmente si “accumulano” a livello del “velocity storage”, e si scaricano alla fine del movimento, in modo da generare un nistagmo la cui fase rapida è diretta verso il lato sano.
Se l’HSNy è:
1. particolarmente intenso;
2. evocabile con pochi movimenti di oscillazione della testa;
3. non associato a deficit di un emisistema vestibolare;
4. che si inverte rispetto al nistagmo spontaneo;
5. pervertito;
è probabile che ci troviamo di fronte ad un problema di tipo centrale (Huh, 2013) (tabella 2).
Tab, 2-15: Interpretazione del test da Gufoni Asprella Libonati (Quaderni monografici di aggiornamento)
| Nistagmo da scuotimento cefalico assente | . Normalita |
| Deficit vestibolare monolaterale compensato | |
| Deficit vestibolare bilaterale simmetrico | |
| Malfunzionamento del “velocity Storage” per disriflessia acuta | |
| Malfunzionamento del “velocity storage” per malattia del sistema nervoso centrale | |
| Malattia di Ménière intercritica in fase iniziale | |
| vertigine emicranico-equivalente in fase intercritica | |
| Nistagmo da scuotimento cefalico diretto verso il lato sano | Deficit vestibolare acuto, non ancora compensato (è possibile sia presente una componente verso I alto nelle primissime fasi ed una componente verso il basso nelle fasi di recupero) |
| Malattia del sistema nervoso centrale | |
| Malattia di Ménière in fase florida | |
| Nistagmo da scuotimento cefalico detto verso il lato ammalato | -Malattia di Meniere in fase irritativa |
|
| Malattia di Ménière in fase di recupero |
|
| Fase iniziale (irritativa) di deficit vestibolare periferico |
|
| Malattia del sistema nervoso centrale |
| Nistagmo da scuotimento cefalico bifasico (prima fase verso il lato sano) | Deficit vestibolare monolaterale non recente ma non ancora compensato |
| Nistagmo da scuotimento cefalico trifasico (prima fase verso il lato sano) | Deficit vestibolare monolaterale non recente ma non ancora compensato |
| Pervertito” (cross coupled) | Malattia del sistema nervoso centrale |
16) Il Functional Head Impulse Test (f-VHT) test rotatorio impulsivo funzionale
La stabilizzazione dell’immagine sulla retina durante i movimenti della testa nei tre piani dello spazio è strettamente correlata alla presenza di un Riflesso Vestibolo-Oculomotore perfettamente funzionante senza il quale la fissazione di un oggetto risulterebbe impossibile a causa dello scivolamento dell’immagine e del mancato mantenimento della proiezione della mira sulla fovea centrale della retina (area che permette la cosiddetta visione distinta). Per mantenere l’immagine fissa è pertanto indispensabile che ad ogni movimento della testa corrisponda un movimento degli occhi in senso uguale e contrario.
Affinché ai muscoli oculari estrinseci venga dato il comando giusto, è richiesta la percezione della velocità del movimento della testa su un piano e il suo integrale (spostamento in funzione del tempo), funzione che viene svolta con estrema precisione dagli elementi neurosensoriali dei canali semicircolari. Il SNC potrà in questo modo elaborare a livello tronco-encefalitico i corretti aggiustamenti della muscolatura oculare estrinseca. Pertanto il labirinto ha il compito di percepire istante per istante i movimenti cefalici ed inviare l’informazione al sistema nervoso centrale: il difetto di questa funzione può comportare un sintomo fastidiosissimo per il paziente che consiste nel veder muovere gli oggetti osservati durante la marcia (e specialmente per i movimenti rapidi della testa) con visione indistinta e occasionalmente nausea (oscillopsia).
Il Functional Head Impulse Test (test rotatorio impulsivo funzionale; fHIT) rappresenta l’evoluzione del Dynamic Visual Acuity test (DVA) seguita alle nuove conoscenze ottenute dall’introduzione dell’head impulse test clinico e strumentale (video head impulse test). Il test è stato introdotto nella pratica otoneurologica nel 20121. In particolare, il fHIT consente di misurare la capacità di identificare un ottotipo presentato per un brevissimo tempo su uno schermo (circa 80 msec) durante il picco di accelerazione imposta alla testa del paziente in modo attivo o passivo. Gli aspetti fondamentali di questo nuovo test sono rappresentati dalla rigorosa validazione e della possibilità di ottenere un risultato in termini di percentuali di ottotipi riconosciuti per singolo range di accelerazione/velocità della testa.


Fig16-a (A & B): A Il giroscopio a 3 assi e un accelerometro alloggiati in una piccola scatola (16-A) attaccata all’elastico che il paziente indossa(16-B)
Lo strumento si compone di un leggerissimo giroscopio triassiale Fig.16 (A&B) che si applica con una speciale fascia sulla fronte del paziente, un tastierino Fig.16a-A dove sono presenti tutti gli ottotipi tra i quali il paziente deve riconoscere quello corretto, un computer ed uno schermo ad elevato refresh-rate e tempo di risposta (Fig.16a-B). Lo strumento per compattezza e leggerezza non soffre dei comuni problemi di scivolamento dei sistemi di video-oculografia o il video head impulse (vHIT) associati al maggior peso delle maschere determinato dalla presenza di telecamere.
| Fig. 16-b: L’unità di risposta del paziente. Questo dispositivo a forma di calcolatrice ha gli otto tipi di Landolt ‘C’s che sono le repliche degli optotipi che appaiono sullo schermo del computer. Il paziente deve premere il tasto che corrisponde all’optotipo che appare sullo schermo. |
 Fig.16-c
Fig.16-c
La validazione del test, effettuata con il vHIT2 ha consentito di determinare in modo preciso la presentazione dell’ottotipo solo durante il picco di accelerazione della testa. Prima di iniziare il test l’acuità visiva viene normalizzata ed il test può essere effettuato anche indossando lenti o occhiali. I risultati del fHIT vengono rappresentati con un diagramma dove sull’ascissa sono rappresentati i range di accelerazione angolare (intervalli di ampiezza pari a 1000 °/sec2 compresi tra 1000 e 7000°/sec2) della testa e sull’ascissa le percentuali di risposte corrette fornite dal paziente per ogni singolo canale semicircolare (Fig. 1b). Tale output, definito “vestibologramma” consente di identificare con precisione le frequenze di stimolazione deficitarie per ogni lato e singolo canale semicircolare. Sono necessari circa 10-20 trial di stimolazione per ogni canale semicircolare in termini di impulsi sul corrispettivo piano.
Durante lo svolgimento del test, al termine di ogni trial, il software fornisce all’esaminatore un rapido riassunto del numero di trial eseguito in ogni tange di accelerazione al fine di incrementare o diminuire l’accelerazione delle rotazioni imposte alla testa del paziente e completare i trial necessari per ogni range di accelerazione. Inoltre, il fHIT presenta ad oggi un ampio database di dati normativi distribuiti per fasce di età e range di accelerazione angolare per singolo canale semicircolare. Il fHlT rappresenta un test funzionale complementare alla valutazione oggettiva del riflesso vestibolo oculare (RVO) che può essere effettuata con il test calorico, le prove rotatorie ed il vHIT. Se confrontato con gli equivalenti test audiologici, il fHIT potrebbe rappresentare l’audiometria vocale del sistema vestibolare, in particolare, essendo un test che valuta le performance funzionali del VOR, ovvero la capacità di identificare un ottotipo durante un rapido movimento della testa, fornisce informazioni circa l’integrazione del VOR e della vista.
Le applicazioni del test in ambito otoneurologico sono molteplici sia dal punto di vista clinico/diagnostico che riabilitativo,
Il Test: assetto clinico ed esecuzione
 Fig.16-d
Fig.16-d
Fig.16-d Il paziente è seduto ad un metro e mezzo di distanza dallo schermo del computer ed indossa un accelerometro montato sulla fronte attraverso un nastro elastico e tiene in mano l’unità di risposta del paziente. Questo sensore inerziale invia segnali al computer permettendo di misurare la velocità e l’accelerazione della testa sui tre piani dello spazio. Sullo schermo viene visualizzato l’Ottotipo C di Landolt, ma possono essere usate anche le lettere dell’alfabeto (tavola di Snellen); per i bambini è stato proposto l’utilizzo di caratteri Disney. Prima di iniziare il test viene valutata l’acuità visita diminuendo progressivamente le dimensioni dei simboli che fanno da mira: in questo modo si normalizzano le dimensioni dello stimolo visivo in funzione delle capacità visive del soggetto esaminato.
Successivamente l’esaminatore effettua movimenti rapidi alla testa del paziente (5-10 in ogni direzione), che per essere clinicamente utili devono essere compresi nell’intervallo tra i 2000 ed i 7000°/s2. Mentre il test viene eseguito l’operatore può monitorare i valori di accelerazione sullo schermo. Durante il movimento (appena l’accelerazione raggiunge un limite massimo fissato dal costruttore) viene visualizzato un simbolo sul monitor per un tempo di 33 millisecondi. Al paziente viene richiesto di riconoscere il simbolo comparso sul monitor durante il movimento della testa e di premere il tasto equivalente su di una mini tastiera modificata con C di Landolt (Fig. 16-d).
La misura di outcome del test corrisponde alla percentuale di risposte esatte (rispetto al totale di risposte presentate) per ogni banda di frequenza esaminata (accelerations bins). La metodica permette di ottenere una valutazione funzionale della capacità del VOR di mantenere a fuoco un’immagine quando la testa è sottoposta a movimenti impulsivi, senza dover ricorrere alla registrazione dei
 5I
5I
Figura 16-e – Il functional head impulse test.
movimenti oculari, rendendo il fHIT più semplice e richiedendo una strumentazione meno costosa. Il movimento della testa può essere eseguito sul piano orizzontale per studiare i canali semicircolari laterali, ma può essere eseguito
anche sul piano dei canali verticali: la testa viene ruotata di circa 45 gradi sulla destra per la valutazione della risposta del canale semicircolare anteriore di sinistra e posteriore di destra; la testa viene ruotata di circa 45 gradi sulla sinistra per la valutazione della risposta del canale semicircolare anteriore di destra e posteriore di sinistra. Il test può essere eseguito anche utilizzando un’immagine confondente in modo da valutare la presenza di una particolare suscettibilità ai movimenti della testa durante stimoli visivi complessi (Figura 5). I risultati vengono riportati su un grafico che indica (Figura 6):
la percentuale delle risposte corrette, dato che viene confrontato con i valori ottenuti in un campione di soggetti normali;
– il “Vestibologramma”, rispettivamente per il lato destro e per quello sinistro, in cui viene riportata la percentuale di risposte corrette in rapporto al numero totale di risposte, per le rotazioni verso un lato e verso il lato opposto e, per confronto, i valori normali in una popolazione confrontabile per sesso ed età di soggetti sani;
Il parametro Z, indice statistico utile per calcolare il livello di confidenza statistica attraverso il quale è possibile affermare che il livello globale delle risposte è simile a quello che ci aspetteremmo in un soggetto normale o meno: in questo caso il valore supera il livello di confidenza e viene colorato in rosso indicando la presenza di un problema funzionale nel canale esaminato (Fig.16-g).
La capacità del fHIT di evidenziare un deficit labirintico sia in fase acuta che nel follow-up, è stata valutata confrontando le risposte di questo test con quelle ottenute in pazienti affetti da nevrite vestibolare sottoposti a vHIT: il fHIT ha dimostrato di poter identificare sia il danno periferico così come il recupero funzionale indotto dal compenso vestibolare (Versino et al, 2014; Sjogren et al, 2018). Nonostante ciò il fHIT non deve essere considerato un test ridondante rispetto al vHIT, bensì complementare: dopo tre mesi dall’episodio di nevrite vestibolare il fHIT evidenzia una maggiore correlazione con gli indici psicometrici di disabilità nonché reperti patologici tuttora presenti, particolarmente in termini di indice di asimmetria tra i due labirinti (Versino et al, 201 9).
Anche nella vestibolopatia periferica bilaterale (VPB) il fHIT permette di evidenziare una percentuale più o meno ridotta di risposte corrette in entrambi i lati e rappresenta il gold standard per valutare la disabilità indotta dalla VPB in termini di oscillopsia: il risultato del fHIT è infatti strettamente correlabile al disturbo riportato dal paziente (misurato con questionari specifici) e più facilmente eseguibile rispetto ad altre metodiche quali la misura dell’acuità visiva eseguita su tapis roulant (Van Dooren et al, 2019). Il fHIT potrebbe aprire interessanti prospettive nella diagnosi di emicrania vestibolare (EV), laddove, come è noto, non esistono esami strumentali patognomonici. I pazienti affetti da EV riportano frequentemente una particolare sensibilità ai rapidi movimenti della testa ed agli stimoli visivi complessi. Questa condizione viene definita dipendenza visiva (Bronstein, 1995): –

Fig. 16-e Il f-HIT eseguito con schermo confondente.
Fig.16-f – Rappresentazione grafica dei risultati del f-VHT in un soggetto normale.
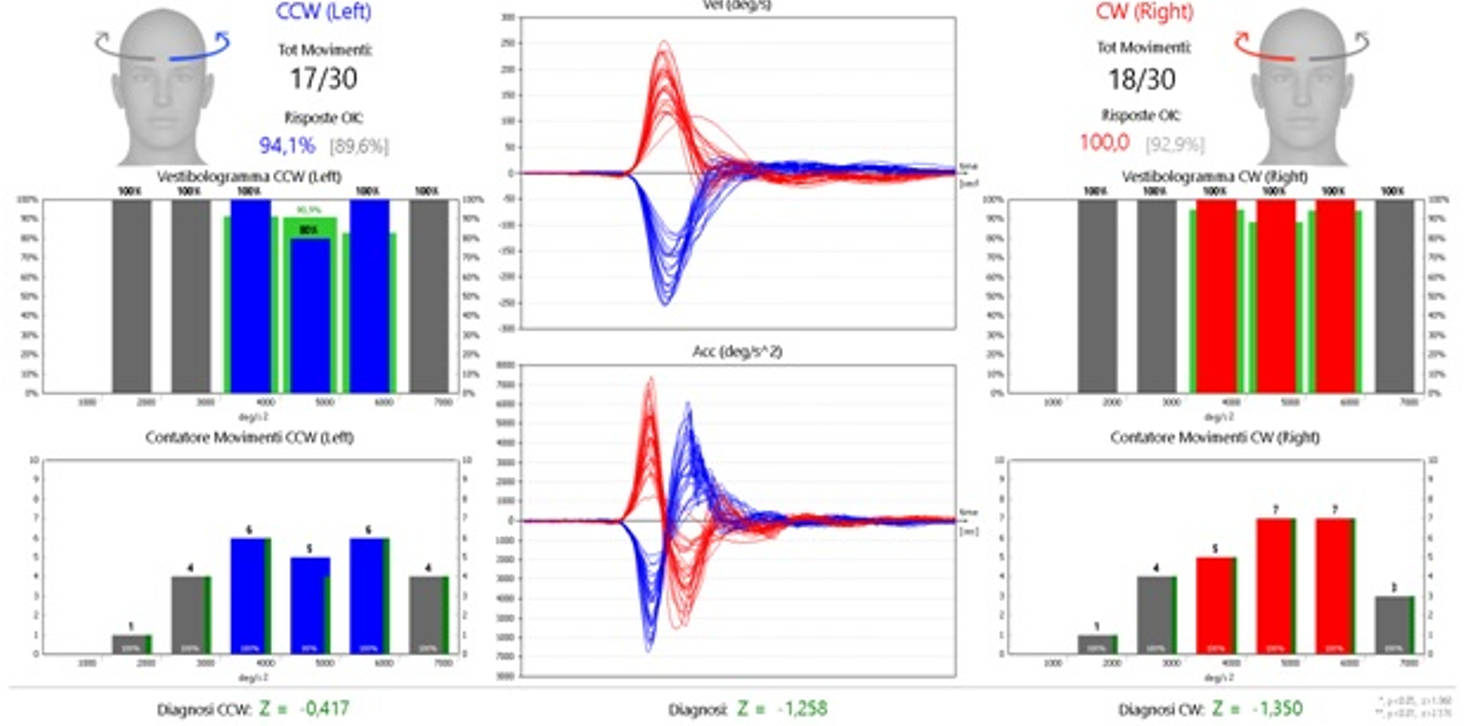
Fig 16-f: I risultati della fHIT dei canali laterali in un soggetto sano. Le barre grigie rappresentano dati che sono fuori dall’intervallo interessante per la diagnosi, che è considerato, per il test laterale, da 3000 a 6000 gradi / sec2. Le barre blu sono i risultati per il lato sinistro (canale laterale sinistro) e le barre rosse sono i risultati per il canale laterale destro. Le barre verdi su cui sono state sovrapposte le barre blu e rossa sono le gamme normali di età e sesso corrispondenti.
I due grafici a barre su ciascun lato rappresentano graficamente il test. I due superiori sono chiamati vestibologrammi di sinistra (in blu) e di destra (in rosso). I due inferiori sono il numero di movimenti della testa eseguiti in ciascun contenitore di accelerazione. Queste caselle inferiori sono chiamate contatori di movimento in modo che il medico possa sapere quanti movimenti della testa sono stati eseguiti in ciascuno dei contenitori di accelerazione. Idealmente, dovrebbero esserci circa dieci movimenti in ciascuno dei contenitori di accelerazione per entrambi i lati, cioè dieci movimenti rapidi della testa tra 3000 e 4000 gradi/sec2, dieci movimenti rapidi della testa tra 4000 e 5000 gradi/sec2, dieci movimenti rapidi della testa tra 5000 e 6000 gradi/sec2.
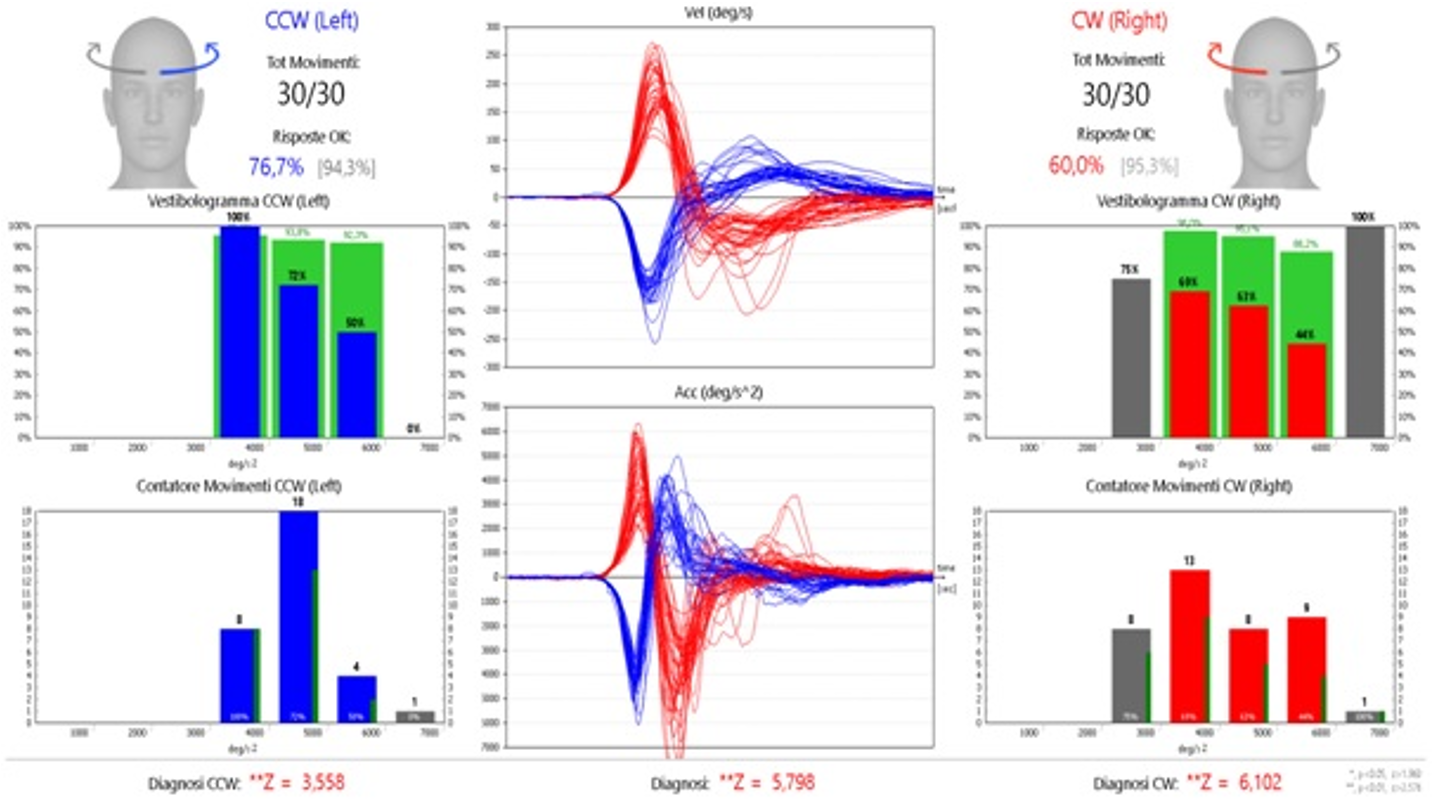
Ov,3,Ii”z4 4257 o,osCvS”Z 0.745 Fig16-g: La fHIT provoca un paziente con deficit bilaterale del canale laterale. Sul lato sinistro la risposta tracciata nel vestibologramma è subnormale solo alle alte frequenze, cioè ad accelerazioni da 3000 a 4000 gradi / sec2 e peggio a 4000 a 5000 gradi / sec2. Il test non è stato eseguito con un’accelerazione da 6000 a 7000 gradi / sec2. A destra, il vestibologramma per il canale laterale destro mostra un rVOR scarso in tutti e tre i contenitori di accelerazione poiché le barre verdi che raffigurano i valori normali corrispondenti età-sesso sono molto più alte delle barre rosse che raffigurano la percentuale di risposte corrette (cioè optotipi correttamente identificati) per il canale laterale destro nei diversi contenitori di accelerazione.
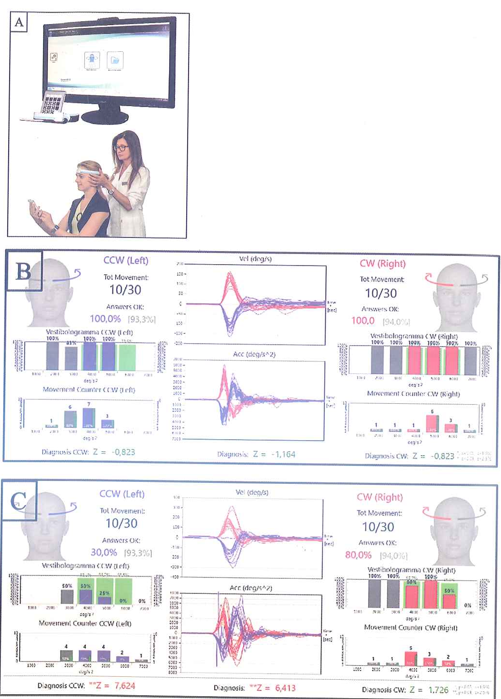
UN SOGGETTO NORMALE B IN UN PAZIENTE CON DEFICIT VESTIBOLARE UNILATERALE C fHIT in un caso di deficit vestibolare destro. Si noti il parametro Z patologico (in rosso) e le percentuali di risposte errate nella rotazione a destra che aumentano all’aumentare della velocità di movimento della testa.
nelle situazioni laddove c’è un conflitto tra gli input sensoriali coinvolti nell’orientamento spaziale (visione e input vestibolare) alcuni soggetti scelgono di basarsi solamente sull’input visivo. Questi soggetti sono più sottoposti ad essere disorientati o destabilizzati da stimoli visivi in movimento o oscillanti. I pazienti affetti da patologia vestibolare in cui la sintomatologia viene scatenata o peggiorata da questi stimoli visivi mostrano un incremento della dipendenza dal visus. Pertanto nei pazienti con EV è stato proposto di aggiungere una valutazione del paziente anche con “schermo confondente”, cioè con un background in movimento visualizzato sullo sfondo dello schermo mentre viene eseguito il test. Il confronto delle risposte senza e con sfondo confondente può dare un’indicazione dell’effetto visuo-vestibolare sulla capacità di risposta, con una netta riduzione della performance in caso di EV (Guerraz, 2001) (Fig. 16-e). Un comportamento analogo è stato riscontrato in paziente con “Persistent Postural Perceptual Dizziness” (PPPD) rispetto a gruppi di controllo di soggetti normali (Teggi, 2020).
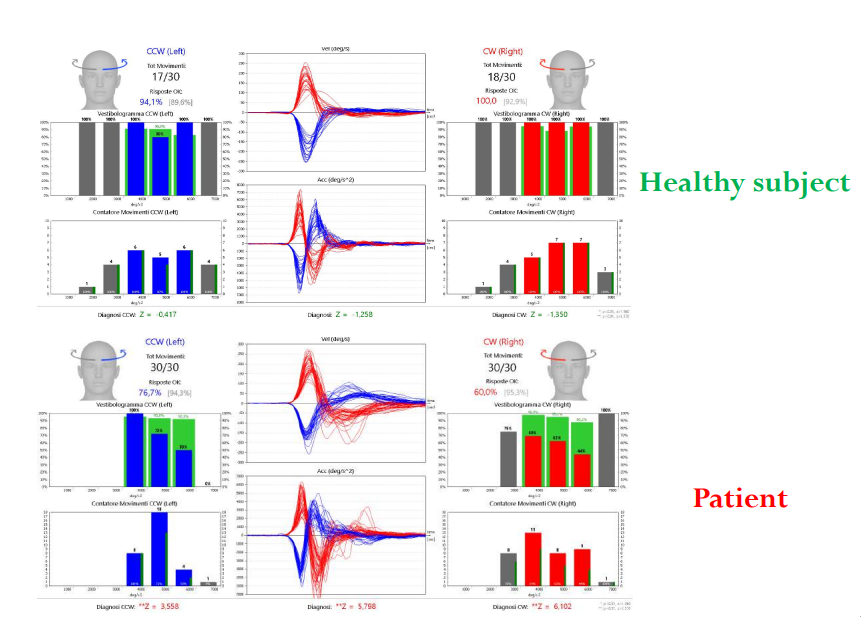
isposta normale: (sotto) netta riduzione della percentuale delle risposte corrette nella rotazione a destra con schermo confondente
Il fHIT rappresenta anche uno strumento utile nel valutare il compenso ed il progresso della riabilitazione vestibolare nei casi di deficit vestibolare monolaterale acuto [Sjogren J.et al 2018]. Utilizzando sia accelerazioni angolari passive (eseguite dall’esaminatore) che attive (eseguite dal paziente) è stato evidenziato da Sjogren et al., che i pazienti con migliori risultati al fHIT eseguito con rotazioni attive evidenziavano un miglior compenso della lesione in termini di sintomi vestibolari residui. Questo fenomeno può essere spiegato con dei movimenti oculari saccadici covert a bassissima latenza generati dal paziente che determinano un minor scivolamento retinico [Sjogren J.et al 2018] Il fHIT ha recentemente consentito anche di valutare l’efficacia di una protesi del sistema vestibolare evidenziando il miglioramento delle capacità di lettura di un paziente impiantato tra le condizioni di impianto spento e acceso’.
Il fHIT rappresenta anche uno strumento utile nel valutare il compenso ed il progresso della riabilitazione vestibolare nei casi di deficit vestibolare monolaterale acuto [Sjogren J.et al 2018]. Utilizzando sia accelerazioni angolari passive (eseguite dall’esaminatore) che attive (eseguite dal paziente) è stato evidenziato da Sjogren et al., che i pazienti con migliori risultati al fHIT eseguito con rotazioni attive evidenziavano un miglior compenso della lesione in termini di sintomi vestibolari residui. Questo fenomeno può essere spiegato con dei movimenti oculari saccadici covert a bassissima latenza generati dal paziente che determinano un minor scivolamento retinico [Sjogren J.et al 2018] Il fHIT ha recentemente consentito anche di valutare l’efficacia di una protesi del sistema vestibolare evidenziando il miglioramento delle capacità di lettura di un paziente impiantato tra le condizioni di impianto spento e acceso’.
Left acute vestibular neuritis Fig.16-l
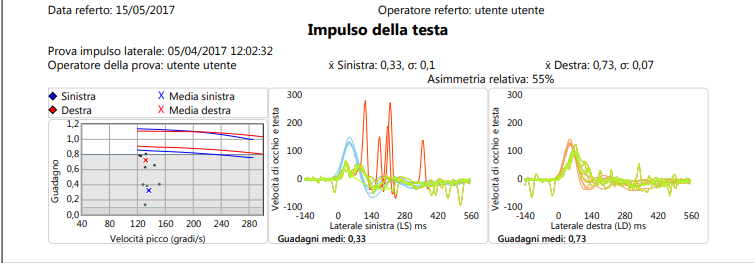
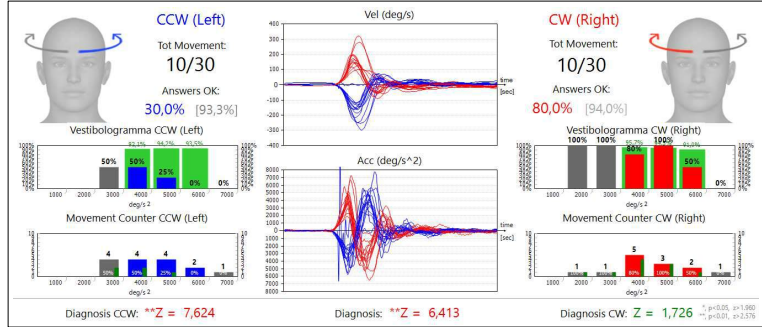
Left acute vestibular neuritis after 3 months Fig.16-m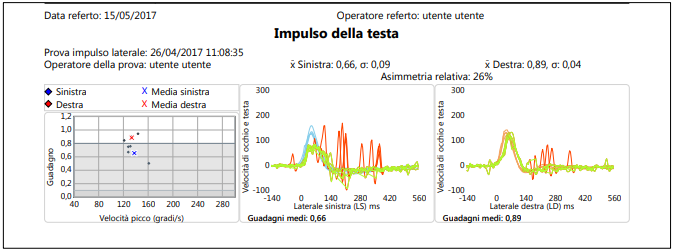
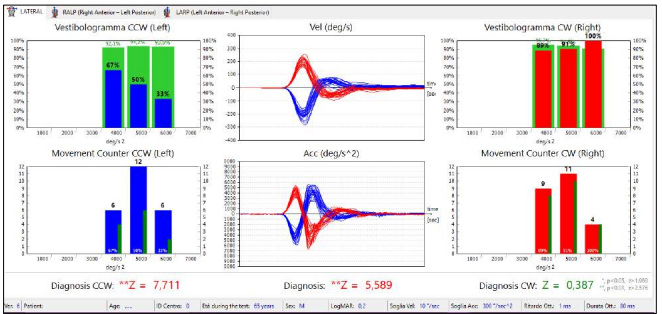
Left acute vestibular neuritis after 6 months Fig.16-n
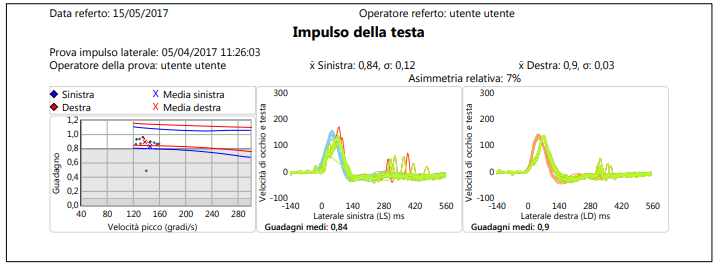
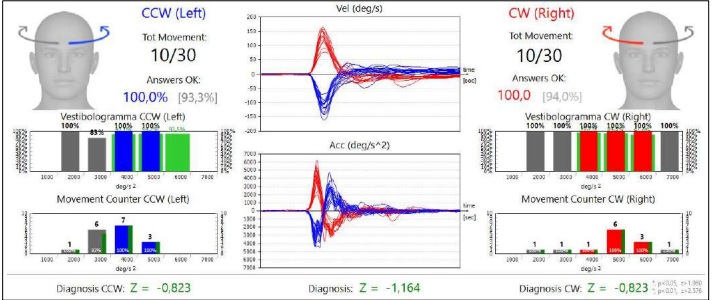
BILATERAL VESTIBULAR LOSS Fig.16-o
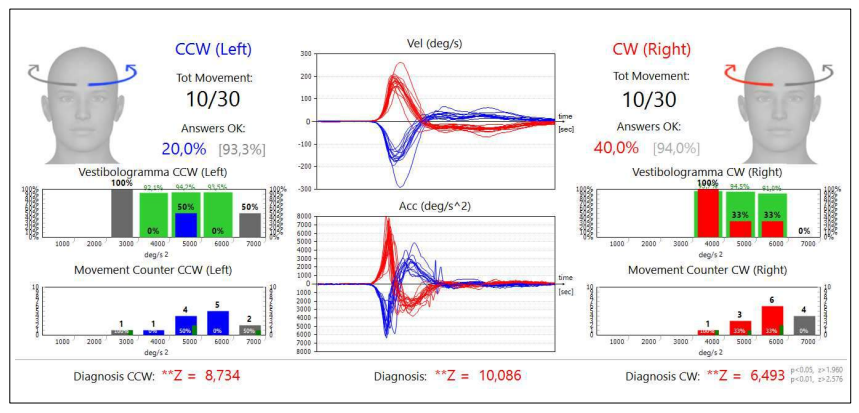
-VESTIBULAR “EFFECT” in
VESTIBULAR MIGRAINE Fig.16-p
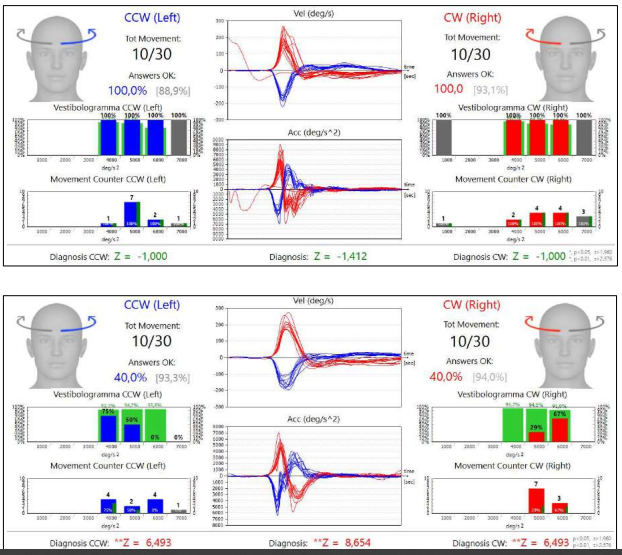
Van Dooren et al, nel 2019 hanno esaminato un numero significativo di pazienti con deficit vestibolare bilaterale con il fHIT definendolo il test migliore in questi soggetti insieme alla acuità visiva dinamica eseguita su un tapis roulant, per valutare l’oscillopsia e la qualità di vita. Tuttavia, il fHIT sembra superiore rispetto alla seconda metodica poiché non mette il paziente a rischio caduta [Van Dooren TS.et al 2019].
Negli atleti professionisti il fHIT è in grado di identificare quali sono i requisiti sport-specifici del VOR funzionale [Van Dooren TS et al 2019]. Su 268 sportivi professionisti testati, gli atleti della palla a mano hanno evidenziato i risultati migliori anche ad accelerazioni particolarmente elevate e non comunemente testate (6000.80000/2). Questi dati potrebbero essere importanti sia nel training specifico del VOR funzionale nei diversi sport professionistici che nel valutare eventuali riduzioni significative delle performance dopo traumatismi con concussione [Romano F.et al 2019].
Un recente sviluppo del fHIT ha consentito la definizione di un test diagnostico specifico per la dipendenza visiva che, nel caso di pazienti emicranici, consente l’identificazione di coloro affetti da emicrania vestibolare. Effettuando il test con e senza uno sfondo otticocinetico è possibile evidenziare, in circa il 90% dei pazienti con emicrania vestibolare, una netta riduzione delle performance al fHIT rispetto al test basale (Fig. 2). Questo fenomeno, noto con il termine di dipendenza visiva, è stato sviluppato con il fHIT in modo dinamico (dipendenza visiva dinamica) incrementandone la sensibilità e specificità nei pazienti affetti da emicrania vestibolare [Versino M.et al 2020]. In questi soggetti il guadagno del VOR misurato con il vHIT con e senza sfondo confondente non subisce variazione. Ad oggi, nell’emicrania vestibolare, il fHIT con l’ausilio dello sfondo otticocinetico rappresenta un test strumentale vestibolare utile in fase diagnostica e nel monitoraggio dell’efficacia della terapia.
Lo stesso paradigma sperimentale (fHIT associato allo sfondo otticocinetico) è stato utilizzato in pazienti con Persistent Postural Perceptual Dizziness (PPPD) [Versino M.et al 2020] Il test ha evidenziato una significativa riduzione della percentuale di ottotipi riconosciuti correttamente dal paziente affetto da PPPD. Questo dato correla significativamente con il livello di ansia dei soggetti, suggerendo che l’ansia possa avere un ruolo nelle interazioni visuo-vestibolari [Teggi R.et al 2020].
Dati preliminari in soggetti pediatrici con disturbi del neuro sviluppo (incluso l’autismo) evidenziano una riduzione significativa degli outcome al fHIT In tale ottica l’integrazione visuo-vestibolare durante il VOR sembrerebbe alterata in queste patologie.
In ambito riabilitativo, il fHIT apre nuovi scenari da esplorare. Il “vestibologramma” può consentire al riabitatole di lavorare principalmente sui range di accelerazione patologici e monitorare costantemente i risultati. Questa riabilitazione frequenza-specifica potrebbe rappresentare una ulteriore implementazione della riabilitazione vestibolare in termini di “precision medicine” ovvero sviluppare programmi riabitativi estremamente personalizzati e specifici per il singolo paziente, migliorando ed accelerando i risultati finali della stessa. Inoltre gli outcome del fHIT sembrano correlare anche con il rischio di cadute del paziente anziano. In questa ottica il test potrebbe essere utilizzato anche come screening.
In conclusione, il fHIT rappresenta uno sviluppo della diagnostica strumentale vestibolare importante per le informazioni funzionali che offre. Il test è rapido (circa 15 minuti) e ben tollerato anche da pazienti pediatrici. Rappresenta uno strumento complementare alla batteria di test diagnostici dove ad oggi il vHIT, offrendo informazioni oggettive e sulla funzionalità del VOR fisiologico, appare il gold standard, Le misure funzionali che correlano con la qualità di vita del paziente sono ad oggi sempre più studiate ed importanti.
In questa ottica il fHIT è lo strumento ideale. Il fHIT rappresenta un test quantitativo validato della acuità visiva dinamica, Non necessita di valutazione dei movimenti oculari e quindi non soffre degli artefatti tipici del vHIT come lo scivolamento della maschera con la telecamera e la difficoltà di registrazione dei movimenti sul piano verticale specialmente in pazienti con occhi piccoli. Il fi-ITT inoltre apre nuove frontiere nella ricerca in campo otoneurologico tra cui lo studio della presbistasia, la possibile definizione di un equivalente vestibolare della neuropatia uditiva, lo studio della residual dizziness nella vertigine posizionale parossistica benigna e nel deficit vestibolare acuto unilaterale, le nuove acquisizioni diagnostiche nell’emicrania vestibolare e la PPPD
Ramat S, Colnaghi S, Boehler A, et al. A Device for the Functional Evaluation of the VOR in Clinical Settings. Front Neurol. 2012 Mar 23 ;3 :39.
2. Versino M, Colnaghi S, Corallo G, et al. The functional head impulse test: Comparing gain and percentage of correct answers, Prog Brain Res. 2019; 248:241-248.
3. Corallo G, Versino M, Mandalà M, et al. The functional head impulse test: preliminary data J Neurol. 2018 Oct;265 (Suppl 1):35-39.
4. Sjogren J, Fransson PA, Karlberg M, et al. Functional Head Impulse Testing Might Be Useful for Assessing Vestibular Compensation After Unilateral Vestibular Loss. Front Neurol. 2018 Nov 19; 9:979.
5. Starkov D, Guinand N, Lucieer F, et al. Restoring the High Frequency Dynamic Visual Acuity with a Vestibular Implant Prototype in Humans. Audiol Neurotol. 2020;25 (1- 2) :91 95.
6. Van Dooren TS, Lucieer FMP, Duijn S, et al. The Functional Head Impulse Test to Assess Oscillopsia in Bilateral Vestibulopathy. Front Neurol. 2019 Apr 16; 10:365.
7. Romano F, Bertolini G, Agostino D, et al. Functional Head Impulse Test in Professional Athletes: Sport-Specific Normative Values and Implication for Sport-Related Concussion. Front Neurol. 2019 Apr 30; 10:387.
8. Versino M, Mandalà M, Colnaghi S, et al. The integration of multisensory motion stimuli is impaired in vestibular migraine patients. J Neurol. 2020 Oct;267(10):2842-2850.
9. Teggi R, Gatti O, Cangiano J, et al. Functional Head Impulse Test With and Without Optokinetic Stimulation in Subjects With Persistent Postural Perceptual Dizziness (PPPD): Preliminary Report. Otol Neurotol. 2020 Jan;41 (1): e70-e75.
10. Caldani S, Baghdadi M, Moscoso A, et al. Vestibular Functioning in Children with Nenrodevelopmental Disorders Using the Functional Head Impulse Test. Brain Sci. 2020 Nov
Bronstein AM. The visual vertigo syndrome. Acta Otolaryngol Suppl 1995; 520:45-8.
Corallo G, Versino M, Mandala M, et al, The functional head impulse test: prelimìnary data. J Neurol 2018; 65:35-9.
Sjògren J, Fransson PA, Karlberg M, et al. Functional Head Impulse Testing Might Be Useful for Assessing Vestibular Compensation After Unilateral Vestibular Loss. Fronr. Neurol 2018; 9:979.
Teggi R, Carri O, Cangiano J, or al, Functional Head Impulse Test with and Without
Optokinetic Stimulation in Subjects With Persistent Postural Perceptual Dizziness (PPPD). Otol Neurorol 2020; 41:70-5.
van Dooren TS, Lucieer FMP, Duijn S, et al. The Functional Head Impulse Test to Assess Oscillopsia in Bilateral Vestibulopathy. Front. Neurol 2019;10:365.
Versino M, Colnaghi S, Corallo G, et al. The functional head impulse test: Comparing gain and percentage of correct answers. Prog Brain Res 2019; 248:241-8.
17. Lo
Studio dell’Acuità Visiva Dinamica e Test di Lettura https://youtu.be/AfghWx3I filmato traduzione italiana
Per mantenere l'acuità visiva, mentre la testa è in movimento, lo sguardo di un individuo deve essere continuamente
diretto verso l’oggetto di interesse. Per massimizzare l’acuità visiva durante il movimento della testa, l’oggetto di interesse deve rimanere centrato sulla fovea, che è una piccola area retinica con una maggiore densità di recettori visivi. L’immagine deve muoversi attraverso la fovea a velocità inferiore a 2 gradi per secondo. Inoltre, poiché il cervello ha bisogno di 20-50 prende millisecondi per percepire un oggetto visivo, questi requisiti devono essere mantenuti per un periodo di tempo uguale o superiore a questo tempo di percezione.
Quando un individuo normale muove la testa, il riflesso vestibolo-oculare (VOR) è il principale meccanismo con cui gli oggetti visivi sono stabilizzati sulla fovea. Il VOR stabilizza lo sguardo, con un riflesso che indirizza gli occhi in una direzione uguale e contraria alla direzione di movimento della testa.
Quando il VOR è compromesso, l’acuità visiva degrada durante i movimenti della testa, perché cambia la direzione
dello sguardo rispetto agli oggetti nel l’ambiente. Di conseguenza, le misure oggettive di acuità visiva dinamica possono fornire utili informazioni cliniche sullo stato funzionale del VOR, come pure le informazioni sulle prestazioni sulla capacità di un individuo di mantenere l’acuità visiva durante l’esecuzione delle attività della vita quotidiana che coinvolgono il movimento della testa.
Per utilizzare in modo efficace l’acuità visiva dinamica come una misura della funzione del VOR, i metodi di prova devono tenere conto del fatto che, altri sistemi di movimento dell’occhio possono, in certe condizioni, compensare
la funzione del VOR compromessa. Nei movimenti della testa con velocità vettoriale inferiori a circa 20 gradi al secondo, il sistema inseguimento può essere usato per stabilizzare lo sguardo su oggetti visivi fissi. Nei movimenti della testa con velocità superiore, i movimenti saccadici predittivi e catch-up possono essere utilizzati per stabilizzare sguardo per periodi di tempo abbastanza lungo perché si verifichi la percezione. Pertanto, per isolare il componente di acuità visiva dinamica del VOR, il test deve essere progettato per escludere l’uso dei sistemi di ricerca di compensazione ed i saccadici
Un grafico LogMAR comprende file di lettere ed è utilizzato da optometristi, oftalmologi e scienziati di visione per stimare l’acuità visiva. Questo grafico è stato sviluppato presso l’Istituto Nazionale Vision Research of Australia nel 1976, ed è progettato per consentire una stima più accurata di acutezza rispetto ad altri grafici (ad esempio, il grafico Snellen). [1] Per questo motivo, si raccomanda il grafico LogMAR, particolarmente in un ambiente di ricerca. [2]
1.Bailey IL, Lovie JE. I (1976.) New design principles for visual acuity letter charts. Am J Optom Physiol Opt. 53 (11): pp. 740–745.
2. Jump up^ Grosvenor, Theodore (2007). Primary care Optometry. St. Louis, Missouri: ELSEVIER. pp. 174–175. ISBN 9780750675758.
IL TEST DI ACUITA’ VISIVA DINAMICA (DVA) Fig.17a-b fornisce ai medici un modo per valutare l’impatto funzionale della funzione VOR ridotta tramite una misurazione oggettiva di acuità visiva durante i movimenti della testa (Herdman, 2010). L’Acuità visiva viene dapprima misurata con la testa ancora fissa (acuità visiva statica, SVA) e poi con la testa in movimento (sul piano orizzontale o verticale) ad una velocità fissa. Con IL DVA computerizzato, i pazienti indossano un sensore di velocità per mantenere la velocità richiesta, tipicamente 120 ° / sec. per i movimenti della testa orizzontali. Durante il movimento della testa, il paziente riferisce l’orientamento di un ottotipo E (ad esempio, in quale senso sono dirette le gambe aperte della lettera E a destra, sinistra, in alto o in basso?) Visualizzate al centro di uno schermo di computer.
La dimensione della E diventa progressivamente più piccola finché il paziente identifica il più piccolo che può essere riconosciuto con precisione il 50% del tempo in risposta al movimento della testa verso destra e verso sinistra. Questi punteggi “dinamici” vengono poi confrontati con il SVA (il più piccolo ottotipo che può essere identificato con precisione) e riportati sulla scala LogMAR (vale a dire, logaritmo del minimo angolo di risoluzione). Il punteggio LogMAR può essere segnalato come un numero positivo o negativo, che descrive qualsiasi perdita di acuità visiva. I numeri positivi indicano una perdita di acuità visiva durante il movimento della testa; numeri negativi suggeriscono una migliore acuità visiva (McCaslin, Dundas, e Jacobson, 2008).
Quando la funzione VOR è normale, SVA e DVA dovrebbero essere uguali. Quando il VOR è compromesso, le prestazioni DVA è significativamente peggiore rispetto all’SVA. Ancora una volta, questo risultato è dovuto alla incapacità del VOR a mantenere l’immagine di interesse sulla retina, quando la testa si muove verso il lato colpito (s). Ad esempio, se il paziente ha una debolezza unilaterale, il DVA sarà peggiore durante i movimenti della testa verso il lato della debolezza(iporeflettività) unilaterale (≥ 15,6 ottotipi perduti; logMAR punteggio ≥ 0,28 sul lato interessato; Herdman et al., 1998). Se il paziente ha una iporeflettività bilaterale, il DVA peggiorerà, in confronto all SVA, con movimento della testa sia a destra che a sinistra (≥ 19.98 ottotipi perduti; logMAR punteggio ≥ 0,39 per entrambe le parti;
Herdman et al., 1998). Nel complesso, il test computerizzato DVA è un metodo sensibile per la rilevazione delle perdite di valore del VOR (94,5% di sensibilità / 95,2% di specificità; Herdman, 2010; Herdman et al, 1998) e fisioterapisti spesso utilizzano il DVA per monitorare l’efficacia della riabilitazione vestibolare (vale a dire, il processo di compensazione; Herdman, 2010). Alcuni sistemi VNG sono ora dotati di un sensore di frequenza e del software opportuno incorporando il test DVA nella valutazione vestibolare standard.
La relazione completa del DVA comprende: https://youtu.be/jDgYbvCX8OQ https://youtu.be/wNyp7E1ckeY?t=65 con traduzione italiana https://youtu.be/AfghWx3IInE?t=32 con traduzione in italiano
1.
Tempo Minimo Di Percezione (PTT). Perception Time Test è il tempo minimo richiesto per percepire con precisione l’orientamento degli ottotipi che sono più grande di 0,2 logMAR di quanto percepiti dal paziente.
2. Differenza Dell’acuità Visiva. Vengono visualizzate le Differenze tra acuità visiva statica(SVA) e dinamica(DVA) per una determinata movimento in asse della testa Le differenze sono espressi in logMAR, un’unità che descrive l’apparente dimensioni di un’immagine sulla base di un rapporto tra la sua dimensione assoluta e la distanza dall’occhio. Questa acuità visiva “dinamica” è stata quindi confrontata con l’acuità visiva “statica” per determinare la quantità di perdita della acuità visiva durante il movimento della testa. La perdita DVA è definita come la DVA meno la SVA (perdita DVA = DVA – SVA). Il punteggio perdita DVA è calcolata per la sinistra, destra, su, giù e movimenti della testa. L’esito del test DVA viene segnalato come il logaritmo del minimo angolo di risoluzione unità (LogMAR).
3. Il Gaze Stabilization Test(GST) Fig.4 misura la velocità massima che la testa del paziente può raggiungere, pur mantenendo una visione accurata
4. Velocità Media Raggiunta. La velocità soglia della testa presente nelle prove sono una media indipende per ogni direzione di movimento della testa.
 | 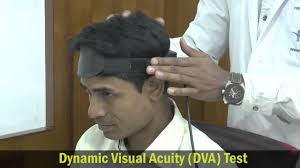
|
| Fig.17.a |
Fig.17.b : https://youtu.be/jDgYbvCX8OQ
|

| 
|
| Fig.17-c | Fig.17-d |
1:06 / 1:10
Dynamic Visual Acuity Test
Il test di acuità dinamica è u test funzionale altamente affidabile utilizzato per valutare la presenza di eventuali deformazioni o difetti della funzione maculare in pazienti che soffrono di una ipofunzione vestibolare periferica, quindi ciò che vogliamo fare per eseguire questo test è posizionare il nostro paziente a circa 3 metri di distanza da una tavola optometrica e di leggere la riga più chiara e più bassa possibile mentre la testa non si muove S i tratta di valutare l’acuità visiva statica il paziente riferisce di poter leggere la seconda riga in basso ,ora quello che chiederemo loro di fare e continuare a fissare quella seconda riga e cercare di leggere la riga più chiara e più bassa possibile mentre la testa si muove così andrò dietro al mio paziente ed andrò ad afferrare saldamente la testa e vado a muovere la testa a 2 cicli al secondo ll paziente riferisce una diminuzione dell’acuità visiva di una riga, un test positivo è maggiore di due righe di differenza quindi questo paziente ha dimostrato un test negativo e non soffre di eventuali deformazioni o difetti della funzione maculare .
in questo video si vede una versione diversa di dba, che utilizza uno schermo più grande, questo test particolare è per i movimenti verticali della testa, NEL PROSSIMO VIDEO vedete la progressione del test, mente il paziente identifica la direzione dell’ottotipo ed immette nel computer, il processo di inserimento dei dati può essere effettuato dal paziente o dal medico che ha visto per la prima vota l’acuità visiva di base la velocità visiva di target è di 100° al sec. Dopo aver completato il test orizzontale, viene testata l’acuità visiva dinamica per la direzione verticale
Bibliografia
Agrawal Y, Minor LB. Physiologic effects on the vestibular system in Méniere’s disease. Otolaryngol Clin North Am. 2010 Oct;43(5):985-93.
Agrawal Y, Minor LB. Ménière’s disease and other causes of episodic vertigo. In: Bronstein AM, editor. Oxford Textbook of Vertigo and Imbalance. Oxford, UK: Oxford University Press. 201
American Academy of Otolaryngology-Head and Neck Foundation, Inc. Committee on hearing and equilibrium guidelines for the diagnosis and evaluation of therapy in Ménière’s disease. Otolaryngol Head Neck Surg. 1995;113:181–5.
Anastasi G, Capitani S, Carnazza ML, Cinti S, De Caro R, Donato RF, Ferrario VF, Fonzi L, Franzi AT, Gaudio E, Raffaele Geremia R, Lanza GG, Grossi CE, Gulisano M, Manzoli FA, Mazzotti G, Michetti F, Miscia S, Mitolo V, Montella A, Orlandini G, Paparelli A, Renda T, Ribatti D, Ruggeri A, Sirigu P, Soscia A, Tredici G, Vitale M, Zaccheo D, Zauli G, Zecchi S. Trattato di Anatomia Umana. Edi-Ermes edizioni. 2009; 3:45-61,78-85,91101,404-432.
Angelaki D.E. Three-dimensional ocular kinematics during eccentric rotations: evidence for functional rather than mechanical constraints. J Neurophysiol 89: 2695-2696, 2003
Arriaga MA, Chen DA, Hillman TA, Kunschner L, Arriaga RY. Visually enhanced vestibulo-ocular reflex: a diagnostic tool for migraine vestibulopathy. Laryngoscope. 2006 Sep;116(9):1577-9.
Arriaga MA, Chen DA, Cenci KA. Rotational chair (ROTO) instead of electronystagmography (ENG) as the primary vestibular test. Otolaryngol Head Neck Surg. Sep 2005;133(3):329-33. [Medline].
Arslan M.: On the renewing of the methodology for stimulation of the vestibular appara -tus. Acta Otolaryngol., Suppl. 122, 1955
Asawavichiangianda S, Fujimoto M, Mai M, Desroches H, Rutka J. Significance of head-shaking nystagmus in the evaluation of the dizzy patient. Acta Otolaryngol Suppl. 1999; 540:27-33.
Aw ST, Halmagyi GM, Black RA, Curthoys IS, Yavor RA, Todd MJ. Head impulses reveal loss of individual semicircular canal function. J Vestib Res. 1999;9(3):173-80.
Aw ST, Haslwanter T, Halmagyi GM, Curthoys IS, Yavor RA, Todd MJ. Three-dimensional vector analysis of the human vestibulo ocular reflex in response to high-acceleration head rotations. I. Responses in normal subjects. J Neurophysiol 1996; 76:4009-20. (a)
Aw ST, Halmagyi CM, Haslwanter T, Curthoys IS, Yavor RA, Todd MJ. Three-dimensional vector analysis of the human vestibuloocular reflex in response to high-acceleration head rotations, II. Responses in subjects with unilateral vestibular loss and selective semicircular canal occlusion. J Neurophysiol 1996 Dec; 1976(6):4021-30
Aw ST, Fetter M, Cremer PD, Karlberg M, Halmagyi GM. Individual semicircular canal function in superior and inferior vestibular neuritis. Neurology. 2001; 57:76874.
Baloh R.W., Honrubia V., Konrad H.R.: Ewald ‘second law re-evaluated. Acta Otolaryngol; 83:475, 1977.
Baloh R.W., Konrad H.R., Honrubia V.: Vestibulo-ocular function in patients with cerebellar atrophy. Neurology, 25:160, 1977.
Baloh R.W., Sills A.W., Honrubia V.: Caloric testing: patients with peripheral and central vestibular lesions. Ann Otol Rhinol Laryngol (Suppl), 43: 24-30, 1977.
Baloh R.W., Sills A.W., Honrubia V.: Impulsive and sinusoidal rotatory testing. A comparison with results of caloric testing. Laryngoscope, 89:646, 1979.
Baloh R.W., Yee R. D., Honrubia V.: Optokinetic nystagmus and parietal lobe lesions. Ann Neurol, 7:269, 1980.
Baloh RW, Yee RD, Jenkins HA, Honrubia V. Quantitative assessment of Visual-Vestibular Interaction using sinusoidal rotatory stimuli. In Nystagmus and vertigo: clinical approaches to the patient with dizziness. Academic Press Inc 1982: 231-239.
Baloh R.W., et al.: Quantitative vestibular testing. Otolaryngol Head and Neck Surg, 92:145, 1984.
Baloh R.W., Honrubia V., Yee R.D., et al.: Changes in the human vestibulo-ocular reflex after loss of peripheral sensitivity. Ann Neurol; 16:222, 1984.
Baloh R.W., Jacobson K., Honrubia V.: Idiopathic bilateral vestibulopathy. Neurology, 39:272, 1989.
Baloh R.W., Honrubia V.: Clinical neurophysiology of the vestibular system. Philadelphia: FA Davis. 1990.
Baloh R.W., et al.: Caloric testing. I. Effect of different conditions of ocular fixation. Ann Otol Rhinol Laryngol (Suppl 43), 86:1, 1997.
Bartolomeo M, Biboulet R, Pierre G, Mondain M, Uziel A, Venail F. Value of the video head impulse test in assessing vestibular deficits following vestibular neuritis. Eur Arch Otorhinolaryngol.2014 Apr;271(4):681-8.
Batuecas-Caletrio A, Santacruz-Ruiz S, Muñoz-Herrera A, Perez-Fernandez N. The vestibulo-ocular reflex and subjective balance after vestibular schwannoma surgery. Laryngoscope. 2014 Jun;124(6):1431-5.
Belafsky P, Gianoli G, Soileau J, Moore D, Davidowitz S. Vestibular autorotation testing in patients with benign paroxysmal positional vertigo. Otolaryngol Head Neck Surg. Feb;122(2):163-7. 2000.
Bell SL, Barker F, Heselton H, MacKenzie E, Dewhurst D, Sanderson A. A study of the relationship between the video head impulse test and air calorics. Eur Arch Otorhinolaryngol. 2015 May;272(5):1287-94. doi: 10.1007/s00405-014-3397-4. Epub 2014 Nov 23.
Black RA, Halmagyi GM, Thurtell MJ, Todd MJ, Curthoys IS. The active head-impulse test in unilateral peripheral vestibulopathy. Arch Neurol 2005; 62:290-3.
Blatt P.J., Herdman S.J., Tusa R.J.: Sensitivity and specificity of the vestibular auto -rotation test. Neurology, 52, Suppl 2, 1999.
Blödow A, Pannasch S, Walther LE. Detection of isolated covert saccades with the video head impulse test in peripheral vestibular disorders. Auris Nasus Larynx. 2013 Aug;40(4):348-51.
Blödow A, Heinze M, Bloching MB, von Brevern M, Radtke A, Lempert T. Caloric stimulation and video-head impulse testing in Ménière’s disease and vestibular migraine. Acta Otolaryngol. 2014 Dec;134(12):1239-44.
Bell SL, Barker F, Heselton H, MacKenzie E, Dewhurst D, Sanderson A. A study of the relationship between the video head impulse test and air calorics. Eur Arch Otorhinolaryngol. 2015 May;272(5):1287-94.
Bronstein A.M., Mossman S., Luxon L.M.: The neck-eye reflex in patients with reduced vestibular and optokinetic function. Brain, 114, 1-11, 1991.
Büki B, Platz M, Haslwanter T, Jünger H, Avan P. Results of electrocochleography in Ménière’s disease after successful vertigo control by single intratympanic gentamicin injection. Audiol Neurootol. 2011;16(1):49-54.
Braswell J, Rine RM. Evidence that vestibular hypofunction affects reading acuity in children. Int J Pediatr Otorhinolaryngol. 2006 Nov;70(11):1957-65.
Burgio DL, Blakley BW, Myers SF. An evaluation of the head-shaking nystagmus test. Otolaryngol Head Neck Surg. 1991 Nov;105(5):708- 13.
Califano L, Capparuccia PG, Di Maria D, Melillo MG, Villari G. Sign-report: torsional nystagmus from head-shaking in patients with labyrinth lithiasis of the vertical canal. Acta Otorhinolaryngol Ital. 2001 Dec;21(6):337-40.
Califano L, Capparuccia PG, Bojano A, Di Maria D, Villari G. Vertical nystagmus induced by the head-shaking test: 10 cases. Acta Otorhinolaryngol Ital. 1999 Dec;19(6):297-302
Carey JP, Minor LB, Peng GC. Changes in the three-dimensional angular vestibulo-ocular reflex following intratympanic gentamicin for Ménière’s disease. J Assoc Res Otolaryngol. 2002 Dec;3(4):430-43.
Casani A., Ghilardi P.L., Fattori B., Pardini L., Raffi G., Piragine F.: Assessment of vestibular and postural testing in patients with bilateral vestibular paresis. In: Motta G. (ed) The new frontiers of Otorhinolaryngology in Europe. Monduzzi Ed., Bologna,1992.
Casani A, Fattori B, Nacci A. Posturografia e prove rotoacceleralorie. In: Patologia traumatica del sistema vestibolare: diagnosi e terapia. Valutazione del danno, Atti della XVII Giornata Italiana di Otoneurologia. A cura di A. Dufour. Ed. Comitato Simposi Scientifici Formenti, 2000; 95-116. 48.
Casani AP, Mora R, Dallan I, Barbieri M. Le prove rotatorie. Vestibolometria clinica e strumentale a cura di Vicini C. Quaderni Monografici di Aggiornamento AOOI, 2003;157-174,
Casani A, Nuti D, Franceschini SS, Gaudini E, Dallan I. Transtympanic gentamicin and fibrin tissue adhesive for treatment of unilateral Ménière’s disease: effects on vestibular function. Otolaryngol Head Neck Surg. 2005 Dec;133(6):929-35.
Casani AP, Nuti D, Pagnini P. Vestibologia Clinica. Eureka edizioni. 2013;129-142.
Casani AP, Cerchiai N, Navari E, Dallan I, Piaggi P, Sellari-Franceschini S. Intratympanic gentamicin for Ménière’s disease: Short- and long-term follow-up of two regimens of treatment.” Otolaryngol Head Neck Surg. 2014 May;150(5):847-52.
Cerchiai N, Navari E, Dallan I, Sellari-Franceschini S, Casani AP. Assessment of Vestibulooculomotor Reflex in Ménière’s Disease: Defining an Instrumental Profile. Otol Neurotol. 2016 Apr;37(4):380-4.
Cesarani A, Alpini D. Terapia delle vertigini e del disequilibrio: il metodo MCS. Springer- Verlag Italia, Milano 2000.
Clarke AH, Schönfeld U, Helling K: Unilateral examination of utricle and saccule function. J Vestib Res 2003; 13:215–225.
Clarke AH, Schonfeld U, Hamann C, Scherer H. Measuring unilateral otolith function via the otolith-ocular response and the subjective visual vertical. Acta Otolaryngol Suppl. 2001; 545:84-7. [Medline].
Clarke AH, Engelhorn A, Hamann C, Schönfeld U: Measuring the otolith-ocular response by means of unilateral radial acceleration. Ann NY Acad Sci 1999; 871:387–391.
Clarke AH, Engelhorn A: Unilateral testing of utricular function. Exp Brain Res 1998; 121:457–464.
Clarke AH, Engelhorn A, Scherer H: Ocular counterrolling in response to asymmetric radial acceleration. Acta Otolaryngol 1996; 116:652–656.
Cnyrim CD, Newman-Toker D, Karch C, Brandt T, Strupp M. Bedside differentiation of vestibular neuritis from central “vestibular pseudoneuritis”. J Neurol Neurosurg Psychiatry 2008;79:458-60. Coats A.C.: Directional preponderance and spontaneous nystagmus. Ann Otol Rhinol Laryngol; 75:1135, 1966.
Conraux C.: Les épreuves rotatoires. In: Troubles de l’équilibre et vertiges. Societè Francaise d’ORL et Patologie Cervico-Facciale Ed., Paris, 1997.
Crane BT, Viirre ES, Demer JL: The human horizontal vestibulo-ocular reflex during combined linear and angular acceleration. Exp Brain Re
Cremer PD1, Halmagyi GM, Aw ST, Curthoys IS, McGarvie LA, Todd MJ, Black RA, Hannigan IP. Semicircular canal plane head impulses detect absent function of individual semicircular canals. Brain. 1998;121 (Pt 4):699-716.
Curthoys I.S., Haslwanter T., Black R.A., Burgess A.M., Halmagyi G.M., Topple A.N. , e al. Off-center yaw rotation: effect of naso-occipital linear acceleration on the nystagmus response of normal human subjects and patients with unilateral vestibular loss Exp. Brain Res. 123 : 425-438 1998 [cross-ref]
Curthoys IS, MacDougall HG, Manzari L, Burgess AM, Bradshaw AP, McGarvie L, Halmagyi GM, Weber KP. Clinical application of a new objective test of semicircular canal dynamic function— the video head impulse test (vHIT)—a safe, simple and fast clinical vestibular test, head impulse testing.” Hennig Symposium. 2011 Nov;53-64.
Darlot C., Denise P., Droulez J., Cohen B., Berthoz A. Eye movements induced by off vertical axis rotation at small angles of tilt Exp. Brain Res. ; 73 : 91-105 1988 [cross-ref]
Darlot C., Toupet M., Denise P. Unilateral vestibular neuronitis with otolith signs and off vertical axis rotation. Acta Otolaryngol. 117 : 7-12 ,1997 [cross-ref]
Darlot C., Toupet M., Denise P. Unilateral vestibular neuronitis with otolith signs and off vertical axis rotation. Acta Otolaryngol. 117 : 7-12 ,1997 [cross-ref]
Della Santina CC and others. Comparison of head thrust test with head autorotation test reveals that the vestibulo-ocular reflex is enhanced during voluntary head movements. Arch Otolaryngol HNS 2002:128:1044-1054
Demer J.L., Crane B.T., Tian J.R., Wiest G. New tests of vestibular function. Ann N Y Acad Sci 942: 428-445,2001
D’Onofrio F. Vertical eye movements during horizontal head impulse test: a new clinical sign of superior vestibular neuritis. Acta Otorhinolaryngol Ital. 2013 Dec;33(6):418-24.
Dornhoffer J, Chelonis JJ, Blake D. Stimulation of the semicircular canals via the rotary chair as a means to test pharmacologic countermeasures for space motion sickness. Otol Neurotol. Sep 2004;25(5):740-5. [Medline].
Dufour A, Mira E, Pignataro O, Vicini C. Tavola Rotonda sulla Valutazione del Danno: risposte ai quesiti. In: Patologia Traumatica del Sistema Vestibolare: Diagnosi e Terapia. Atti delle XVII Giornate Italiane di Otoneurologica., a cura di Dufour A, Ed. Comitato Simposi Scientifici Formenti, 2000; 147-163.
Dufour A, Mira E. Pignataro O.: Otoneurologia Clinica. Centro Ricerche e Studi Amplifon, 1993; Milano.
Dufour A., Ponzi S.: Fisiopatologia del ritmo del nistagmo. Atti VI° Giornata Italiana di Nistagmografia Clinica, 1986; Formenti Ed., Milano,.
Eviatar L, Eviatar A. The normal nystagmic response of infants to caloric and perrotatory stimulation. Laryngoscope, 89: 1036-1045,1979
Eviatar L. Dizziness in children. Otolaryngologic Clinics of North America, 27: 557-571,1994
Fetter M, Zee DS, Koenig E, Dichgans J. Head-shaking nystagmus during vestibular compensation in humans and rhesus monkeys. Acta Otolaryngol. 1990 Sep-Oct;110(3-4):175-81.
Eza-Nuñez P, Fariñas-Alvarez C, Fernandez NP. Comparison of three diagnostic tests in detecting vestibular deficit in patients with peripheral vestibulopathy. J Laryngol Otol. 2016 Feb;130(2):145-50.
Fernández C, Baird RA, Goldberg JM. The vestibular nerve of the chinchilla. I. Peripheral innervation patterns in the horizontal and superior semicircular canals. J Neurophysiol. 1988 Jul;60(1):167-81.
Fernández C, Lysakowski A, Goldberg JM. Hair-cell counts and afferent innervation patterns in the cristae ampullares of the squirrel monkey with a comparison to the chinchilla. J Neurophysiology. 1995 Mar;73(3):1253-69.
Fife T.D., Tusa R.J., Furman J.M., Zee D.S., Frohman E., Baloh R.W., Hain T., Goebel J., Demer J., Eviatar L.: Assessment: vestibular testing techniques in adults and children. Report of the therapeutics and technology assessment subcommittee of the American Academy of Neurology. Neurology, 55, 1431-1441, 2000.
Fineberg R., O’Leary D.P., Davis L.L.: Use of active head movement for computerized vestibular testing. Arch. Otolaryngol., 113, 1063-1065, 1994.
Fitzgerald G., Hallpike C.S.: Studies in human vestibular function. Observation on the directional preponderance of caloric nystagmus resulting from cerebral lesions. Brain; 62 (part 2): 115, 1942.
Frohman TC, Frohman EM, O’Suilleabhain P, Salter A, Dewey RB, Jr., Hogan N, Galetta S, Lee AG, Straumann D, Noseworthy J, Zee D, Corbett J, Corboy J, Rivera VM and Kramer PD (2003). “Accuracy of clinical detection of INO in MS: Corroboration with quantitative infrared oculography.” Neurology 61(6): 848-850.
Fukushima M1,2, Oya R2, Nozaki K1, Eguchi H1, Akahani S1, Inohara H2, Takeda N3. Vertical head impulse and caloric are complementary but react opposite to Meniere’s disease hydrops. Laryngoscope. 2018 Dec 4. doi: 10.1002/lary.27580.
Furman JM, Schor RH, Kamerer DB. Off-vertical axis rotational responses in patients with unilateral peripheral vestibular lesions. Ann Otol Rhinol Laryngol. Feb 1993;102(2):137-43. [Medline].
Furman J.M., Kamerer D.B.: Rotational responses in patients with bilateral caloric reduction. Acta Oto-laryngol 1989; 108: 355, 1989.
Fineberg R, O’Leary DP, Davis LL. Use of active head movement for computerized vestibular testing. Arch. Otolaryngol Head Neck Surg, 113: 1063-1065,1987.
Ghilardi P.L., Guglielmino S., Casani A.: Vestibolometria mediante impulsi di accelerazione. In: Piragine F. et al. (eds.) La vestibolometria – Le disfonie di interesse foniatrico. Verduci Ed., Roma, 1987.
Ghilardi P.L., Guglielmino S., Casani A.: La prova pendolare. Atti III Giornata Italiana di Nistagmografia Clinica, Formenti Ed., Milano, 1985.
Ghilardi PL, Guglielmino S, Fattori B. Correlation between the head shaking test, the test for the detection of nystagmus of cervical origin and caloric test. Rev Otoneuroophtalmol. 1981 Jan-Feb;53(1):25-8.
Goebel JA, Hanson JM, Langhofer LR, Fishel DG. Head-shake vestibulo-ocular reflex testing: comparison of results with rotational chair testing. Otolaryngol Head Neck Surg. 1995 Feb;112(2):203-9.
Goebel J.A., Fortin M., Paige G.D. Headshake Versus Whole-Body Rotation Testing of the Vestibulo-Ocular Reflex. Laryngoscope 101: 695-698, 1991.
Goldberg JM. Afferent diversity and the organization of central vestibular pathways. Experimental Brain Research. 2000 Feb;130(3):277-97.
Greiner GF, Conraux C, Collard M. Vestibulométrie clinique. Editions Doin, Paris, 1969.
Guidetti G, Monzani D, Civiero N. Head shaking nystagmus in the follow-up of patients with vestibular diseases. Clin Otolaryngol Allied Sci. 2002 Apr;27(2):124-8
Guidetti G, Monzani D, Trebbi M, Balli R. Head shaking test and low-frequency rotation-acceleration test: comparison of sensitivity and specificity. Acta Otorhinolaryngol Ital. 2000 Oct;20(5):315-21.
Guidetti G.: Diagnosi e terapia dei disturbi dell’equilibrio. Marrapese Ed., Roma, 1997.
Hain TC, Fetter M, Zee DS. Head-shaking nystagmus in patients with unilateral peripheral vestibular lesions. Am J Otolaryngol. 1987 JanFeb;8(1):36-47.
Hall SF, Laird ME. Is head-shaking nystagmus a sign of vestibular dysfunction? J Otolaryngol. 1992 Jun;21(3):209-12.
Halmagyi GM, Curthoys IS. A clinical sign of canal paresis. Arch Neurol, 45(7): 737-739,1988–
Halmagyi GM, Curthoys IS, Todd MJ, D’Cruz DM, Cremer PD, Henderson CJ, Staples MJ. Unilateral vestibular neurectomy in man causes a severe permanent horizontal vestibulo-ocular reflex deficit in response to high-acceleration ampullofugal stimulation. Acta Otolaryngol Suppl. 1991; 481:411-4.
Hamid M. More than a 50% canal paresis is needed for the head impulse test to be positive. Otol Neurotol. 2005 Mar;26(2):318-9.
Harvey SA, Wood DJ, Feroah TR. Relationship of the head impulse test and head-shake nystagmus in reference to caloric testing. Am J Otol. 1997 Mar;18(2):207-13.
Haslwanter T. Mathematics of three-dimensional eye rotations. Vision Res 1995; 35:1727-39.
Honrubia V., et al.: Vestibulo-ocular reflexes in peripheral labirinthine lesions. III. Bilateral dysfunction. Am J Otolaryngol; 6:342, 1985.
Hülse R, Hörmann K, Servais JJ, Hülse M, Wenzel A. Clinical experience with video Head Impulse Test in children. Int J Pediatr Otorhinolaryngol. 2015 Aug;79(8):1288-93.
Hyden D., Istl Y.E., Schwarz D.W.F.et al.: Human visuovestibular interaction as a basis for quantitative clinical diagnosis. Acta Otolaryngol; 1982; 94:53,
Huygen P.L.M., Nicolasen M.G.M. Diagnostic Value of Velocity-Step Responses. ORL 1985;47; 249-261.
Huygen P. L. M., Verhagen W.I.M., Nicolasen M.G.M. Correlation between Velocity Step and Caloric Response Parameters. Acta Otolaryngol (Stockh), 1989;108: 368-371,
Jacobson GP, Newman CW, Safadi I. Sensitivity and specificity of the head-shaking test for detecting vestibular system abnormalities. Ann Otol Rhinol Laryngol. 1990 Jul;99(7 Pt 1):539-42.
Jenkins H.A.: Rotatory Testing. In: Hart C.W. (ed.) Manual of electronystagmography. AAO-HNS Ed., 1987;Washington,.
Jenkins H.R., Honrubia V., Baloh R.W.: Evaluation of multiple frequency rotatory testing in patients with peripheral labyrinthine weakness. Am J Otolaryngol; 1982; 3:182.
Joms-Haderli M, Straumann D, Palla A. Accuracy of the bedside head impulse test in detecting vestibular hypofunction. J Neurol Neurosurg Psychiatry 2007; 78:1113-8.
Jongkees L.B.W., Philpszoon A.J.: Electronystagmography. Acta Otolaryngol 1964; suppl 1998.
Kamei T, Kimura K, Kanenko H, Horo H. Reevaluation of the head-shaking test as a method of nystagmus provocation, part 1: its nystagmus-eliciting test. Jpn J Otolaryngol. 1964; 67:1530-1534.
Kamei T. The two-phase occurrence of head-shaking nystagmus. Arch Otorhinolaryngol 1975; 209(1):59-67.
Kamei T. Two types of head-shaking tests in vestibular examination. Acta Otolaryngol Suppl. 1988; 458:108-12.
Kamei T, Takegoshi T, Matsuzaki M. A quantitative analysis of head-shaking nystagmus of peripheral vestibular origin. Acta Otolaryngol Suppl. 1995; 520 Pt 1: 216-9.
Kamei T, Iizuka T, Matsuzaki M. Influence of lateral head tilting on head-shaking nystagmus. Eur Arch Otorhinolaryngol. 1997;254 Suppl 1: S58-60.
Kandel ER, Schwartz H, Jessel TM, Siegelbaum SA, Hudspeth AJ. Principles of Neural Science, Fifth Edition. 2015;913-933.
Kaphan G., Henin J., Fondarai J, Chau Huu D., Nicolai-Harter H.: Application a l’homme normal et pathologique d’une relation liant la frèquence des secous -ses nystagmiques et l’accèlèration au cours des stimolations rotatoires à accèlèration sinusoidale. Acta ORL Belg., 24, 746-758, 1970.
Katsarkas A, Smith H, Galiana H. Head-shaking nystagmus (HSN): the theoretical explanation and the experimental proof. Acta Otolaryngol. 2000 Mar;120(2):177-81.
Katsarkas A., Kirkham T.H.: Failure of suppression of post-caloric nystagmus by fixation. J Otolaryngol; 11: 57, 1982.
Kattah JC, Talkad AV, Wang DZ, Hsieh YH, Newman-Toker DE. HINTS to diagnose stroke in the acute vestibular syndrome: three-step bedside oculomotor examination more sensitive than early MRI diffusion-weighted imaging. Stroke. 2009 Nov;40(11):3504-10.
Kim BJ, Won YK, Hyun J, Na WS, Jung JY, Suh MW. Comparisons in Outcome and Subject Comfort between Rotation Chair Systems. J Audiol Otol. 2017 Jul. 21 (2):88-94. [Medline]. [Full Text].
Kondrachuk AV: Qualitative model of otolith-ocular asymmetry in vertical eccentric rotation experiments. Hearing Res 2003; 178:59–69.
Konrad HR, Sills AW, Baloh RW, Honrubia V, Ward P. The impulsive test in man. Trans Sect Otolaryngol Am Acad Ophthalmol Otolaryngol. Mar-Apr 1976;82(2):232-8. [Medline].
Kremmyda O, Kirchner H, Glasauer S, Brandt T, Jahn K, Strupp M. False-positive headimpulse test in cerebellar ataxia. Front Neurol. 2012 Nov 12; 3:162.
Lehnen N, Aw ST, Todd MJ, Halmagyi GM. Head impulse test reveals residual semicircular canal function after vestibular neurectomy. Neurology. 2004 Jun 22;62(12):2294-6.
Leigh R.J., Zee D.S.: The neurology of eye movements. Philadelphia, FA Davis, 1991.
Lezius F, Adrion C, Mansmann U, Jahn K, Strupp M. High-dosage betahistine dihydrochloride between 288 and 480mg/day in patients with severe Ménière’s disease: A case series. Eur Arch Otorhinolaryngol. 2011 Aug;268(8):1237-40.
Lin LI. A concordance correlation coefficient to evaluate reproducibility. Biometrics 1989; 45:255-68.
Lopez-Escamez JA, Carey J, Chung WH, Goebel JA, Magnusson M, Mandalà M, Newman-Toker DE, Strupp M, Suzuki M, Trabalzini F, Bisdorff A. Diagnostic criteria for Ménière’s disease. Acta Otorinolaringol Esp. 2016 Jan-Feb;67(1):1-7.
Longridge NS, Mallison AI. The dynamic illegible E-test. Acta Otolaryngol (Stockh); 103(3-4):273 -279,1987
McCall AA, Ishiyama GP, Lopez IA, Bhuta S, Vetter S, Ishiyama A. Histopathological and ultrastructural analysis of vestibular endorgans in Ménière’s disease reveals basement membrane pathology. BMC Ear Nose Throat Disord. 2009 Jun 3; 9:4.
McCaslin DL, Rivas A, Jacobson GP, Bennett ML. The dissociation of video head impulse test (vHIT) and bithermal caloric test results provide topological localization of vestibular system impairment in patients with ‘‘definite’’ Ménière’s disease. Am J Audiol. 2015 Mar;24(1):1-10.
MacDougall HG, Weber KP, McGarvie LA, Halmagyi GM, Curthoys IS. The video head impulse test: Diagnostic accuracy in peripheral vestibulopathy. Neurology 2009; 73:1134-41.
MacDougall HG, McGarvie LA, Halmagyi GM, Curthoys IS, Weber KP. The video Head Impulse Test (vHIT) detects vertical semicircular canal dysfunction. PLoS One. 2013 Apr 22;8(4):e61488.
McGarvie LA, Curthoys IS, MacDougall HG, Halmagyi GM. What does the head impulse test versus caloric dissociation reveal about vestibular dysfunction in Ménière’s disease? Ann N Y Acad Sci. 2015 Apr; 1343:58-62.
McGarvie LA, MacDougall HG, Halmagyi GM, Burgess AM, Weber KP, Curthoys IS. The Video Head Impulse Test (vHIT) of Semicircular Canal Function – Age-Dependent Normative Values of VOR Gain in Healthy Subjects. Front Neurol. 2015 Jul 8; 6:154.
McGarvie LA, Curthoys IS, MacDougall HG, Halmagyi GM. What does the dissociation between the results of video head impulse versus caloric testing reveal about the vestibular dysfunction in Ménière’s disease? Acta Otolaryngol. 2015 Sep;135(9
Maes L, De Kegel A, Van Waelvelde H, Dhooge I. Rotatory and collic vestibular evoked myogenic potential testing in normal-hearing and hearing-impaired children. Ear Hear. 2014 Mar-Apr. 35 (2):e21-32. [Medline].
Magliulo G, Gagliardi S, Ciniglio Appiani M, Iannella G, Gagliardi M. Selective vestibular neurolabyrinthitis of the lateral and superior semicircular canal ampulla and ampullary nerves. Ann Otol Rhinol Laryngol. 2012 Oct;121(10):640-4.
Magliulo G, Gagliardi S, Ciniglio Appiani M, Iannella G, Re M. Vestibular neurolabyrinthitis: a follow-up study with cervical and ocular vestibular evoked myogenic potentials and the video head impulse test. Ann Otol Rhinol Laryngol. 2014 Mar;123(3):162-73.
Magliulo G, Iannella G, Gagliardi S, Re M. A 1-year follow-up study with C-VEMPs, OVEMPs and video head impulse testing in vestibular neuritis. Eur Arch Otorhinolaryngol. 2015 Nov;272(11):3277-81.
Mahringer A, Rambold HA. Caloric test and video-head-impulse: a study of vertigo/dizziness patients in a community hospital. Eur Arch Otorhinolaryngol. 2014 Mar;271(3):463-72.
Maire R, Van Melle G. (2008 Aug). “Vestibulo-ocular reflex characteristics in patients with unilateral Ménière’s disease.” Otol Neurotol. 2008 Aug;29(5):693-8
Mandalà M, Nuti D, Broman AT, Zee DS. Effectiveness of careful bedside examination in assessment, diagnosis, and prognosis of vestibular neuritis. Arch Otolaryngol Head Neck Surg. 2008;Feb;134(2):164-9,
Manfrin M. L’esame otoneurologico clinico:altri esami complementari. In: Vestibolometria clinica e strumentale a cura di Vicini C. Quaderni monografici di aggiornamento AOOI. 2003; 109-116.
Mantokoudis G, Agrawal Y, Newman-Toker DE, Xie L, Saber Tehrani AS, Wong A, Schubert MC. Compensatory saccades benefit from prediction during head impulse testing in early recovery from vestibular deafferentation. Eur Arch Otorhinolaryngol. 2016 Jun;273(6):1379-85.
Manzari L, Ann M. Burgess, Hamish G. MacDougall HG, Andrew P. Bradshaw, G. Michael Halmagyi, Ian S. Curthoys Video Head Impulse Test (vHIT): una svolta nella diagnostica del deficit vestibolare. Otoneurologia 2000. 2010; 33:3-18.
Marques P, Manrique-Huarte R, Perez-Fernandez N. Single intra-tympanic gentamicin injection in Ménière’s disease: VOR change and prognostic usefulness. Laryngoscope. 2015 Aug;125(8):1915-20.
Mathog R.H. Sinusoidal harmonic acceleration. Ann. Otol. Rhinol. Laryngol., Suppl. 86,10-14, 1981.
Mathog R.H.: Testing of the vestibular system by sinusoidal angular acceleration. Acta Otolaryngol., 74, 96-103, 1972.
Matino-Soler E., Esteller-More E., Martin-Sanchez J.C. et al. Normative data on angular vestibulo-ocular responses in the yaw axis measured using the video head impulse test. Otol. Neurotol. 2015 Mar;36(3):466-71
Matsuzaki M, Kamei T. Stage-assessment of the progress of continuous vertigo of peripheral origin by means of spontaneous and head-shaking nystagmus findings. Acta Otolaryngol Suppl. 1995; 519:188-90
Matta FV, Enticott JC. The effects of state of alertness on the vestibulo-ocular reflex in normal subjects using the vestibular rotational chair. J Vestib Res. 2004;14(5):387-91. [Medline].
Meulenbroeks AA, Kingma H, Van Twisk JJ, Vermeulen MP. Quantitative evaluation of the vestibular autorotation test (VAT) in normal subjects. Acta-ORL-Suppl-Stockh., 1995;520: 327-333,
Mira E., Manfrin M.: Sensibilità e specificità dei nistagmi strumentali. Atti XIVGiornata Italiana di Nistagmografia Clinica , 1994;Formenti Ed., Milano,.
Mira E., Buizza A., Manfrin M., Poletti A. Le prove vestibolari rotatorie: revisione critica. In “X Giornata Italiana di Nistagmografia Clinica” 1990; a cura di A. Dufur, 159-172.
Mira E., Buizza A., Castelnuovo P., Mevio E., Liverani F.: Le prove vestibolari rotatorie. Rassegna critica. In: Piragine F. et al. (eds.) La vestibolometria – Le disfonie di interesse foniatrico. 1987; Verduci Ed., Roma.
Mira E. Le stimolazioni vestibolari di tipo rotatorio. In “III Giornata Italiana di Nistagmografia Clinica” a cura di A.Dufur, 139-159, 1983.
Mizukoshi K, Fabian P, Stahle J. Optokinetic test comprising both acceleration and constant velocity stimulation (ACV-OKN test). Acta Otolaryngol. 1977; Sep-Oct;84(3-4):155-65.
Modugno GC, Pirodda A, Truzzi M, Cappelli A, Rinaldi Ceroni A, Cenacchi V. Il ruolo del Test Rotatorio Impulsivo nella valutazione del deficit vestibolare. In “Aspetti diagnostici riabilitativi della patologia vestibolare: stato dell’arte” a cura di Mora E. 2001, 229-248.
Modugno G.C., Saggese D., Cenacchi V. Computerized analysis of the ENG-Recordings. Proceedings of XV World Congress of Otorhinolaryngology Head and Neck Surgery. Istambul, 1993; vol. 3, 1225-1227-.
Montandon A, Russbach A. L’épreuve giratoire liminaire. Pract. Oto-Rhino-Laryngol, 1955;17:224-236.
Montandon A. A new technique for vestibular investigation. Acta Otolaryngol. Sep-Dec 1954;44(5-6):594-6. [Medline].
Moore ST, Curthoys IS, McCoy SG. VTM—an image-processing system for measuring ocular torsion. Comput Methods Programs Biomed 1991; 35:219-30.
Mosca F, Sicignano S, Leone CA. Benign positional paroxysmal vertigo: videonystagmographic study using rotatory test. Acta Otorhinolaryngol Ital. 2003 Apr;23(2):67-72.
Mulder W. Quantitative betrekking tusschen prikkel en effekt by het statisch organ. Diss. Utrech 1908
Newman-Toker DE, Kattah JC, Alvernia JE, Wang DZ. Normal head impulse test differentiates acute cerebellar strokes from vestibular neuritis. Neurology 2008;70(24 Pt 2):2378-85.
Newman-Toker DE, Saber Tehrani AS, Mantokoudis G, Pula JH, Guede CI, Kerber KA, Blitz A, Ying SH, Hsieh YH, Rothman RE, Hanley DF, Zee DS, Kattah JC. Quantitative video-oculography to help diagnose stroke in acute vertigo and dizziness: toward an ECG for the eyes. Stroke. 2013 Apr;44(4):1158-61.
Newman-Toker DE, Kerber KA, Hsieh YH, Pula JH, Omron R, Saber Tehrani AS, Mantokoudis G, Hanley DF, Zee DS, Kattah JC. HINTS outperforms ABCD2 to screen for stroke in acute continuous vertigo and dizziness. Acad Emerg Med. 2013 Oct;20(10):986-96.
Nuti D, Mandala M, Broman AT, Zee DS. Acute Vestibular Neuritis: Prognosis Based upon Bedside Clinical Tests (Thrusts and Heaves). Ann N Y Acad Sci. 2005 Apr; 1039:359-67.
Ng M, Davis LL, O’Leary DP. Autorotation test of the horizontal vestibulo-ocular reflex in Menierès disease. Otolaryngol-Head-Neck-Surg., 109(3Pt1): 399-412,1993.
O’Leary D.P., Davis L.L., Maceri D.R.. Vestibular autorotation test asymmetry analysis of acoustic neuromas. Otolaryngol Head Neck Surg, 104:103, 1991.
O’Leary DP, Davis LL. Vestibular autorotation testing of Menierès disease. Otolaryngol-Head-Neck-Surg.,103 (1): 66-71,1990.
O’Leary DP, Davis LL, Maceri DR Vestibular autorotation test asimmetry analysis of acoustic neuromas. Otolaryngol-Head-Neck-Surg., 104 (1): 103-109,1991.
Oliva Dominguez M, Martin Garcia M, Danino Gonzales J, Danino Gonzales G, Bartual Pastor J. Reading test a qualitative method for evaluating the vestibulo-ocular reflex. Acta Otorrinolaringol Esp 1999, 50 (5):371-6.
Palla A, Straumann D. Recovery of the high-acceleration vestibulo-ocular reflex after vestibular neuritis. Jassoc Res Otolaryngol.2004 Dec;5(4):427-35.
Palla A, Marti S, Straumann D. Head-shaking nystagmus depends on gravity. J Assoc Res Otolaryngol. 2005 Mar;6(1):1-8. Epub 2005 Apr 22
Park HJ, Migliaccio AA, Della Santina CC, Minor LB, Carey JP. Search-coil head-thrust and caloric tests in Ménière’s disease. Acta Otolaryngol. 2005 Aug;125(8):852-7.
Perez N, Rama-Lopez J. Head-impulse and caloric tests in patients with dizziness. Otol Neurotol. 2003 Nov;24(6):913-7.
Perez P, Llorente JL, Gomez JR, Del Campo A, Lopez A, Suarez C. Functional significance of peripheral head-shaking nystagmus. Laryngoscope. 2004 Jun;114(6):1078-84.
Peterka RJ. Pulse-step-sine rotation test for the identification of abnormal vestibular function. J Vestib Res. 2005;15(5-6):291-311. [Medline].
Petersen JA, Straumann D, Weber KP. Clinical diagnosis of bilateral vestibular loss: three simple bedside tests. Ther Adv Neurol Disord. 2013 Jan;6(1):41-5.
Pignataro O., Felisati G., Bertazzoli M. Prove Rotoacceleratorie. In La diagnosi delle sindromi vertiginosa I, Cortesina G, Albera R. ed. Quaderni di Vestibologia, 2000; vol.3, 43-54,
Pignataro O., Felisati G., Merlo E. Semeiotica otoneurologica. Le prove rotoacceleratorie. In “Semeiologia otoneurologica” a cura di A. Dufur, 1997,163-175.
Pignataro O, Rossi L, Gaini R, Oldini C, Sambataro G, Nino L. The evolution of the vestibular apparatus according to the age of the infant. International Journal of Pediatric Otorhinolaryngology, 1979,1: 165-170.
Pirodda E. Le prove rotoacceleratorie con impiego di accelerazioni di valore costante (AD test). In “III Giornata Italiana di Nistagmografia Clinica” a cura di A. Dufur, 1983;120-138.
Pirodda E, Cenacchi V. Caratteristiche fondamentali dei reperti elettronistagmografici nei traumatizzati cranici, La clinica ORI., 1964; 2: 57-84.
Rigo S. I movimenti attivi del capo ad alta frequenza. Atti della prima edizione di Aggiornamenti di vestibologia” tenutosi a Fiuggi il 5-6 marzo 2004 a cura di Guidetti G, 2004; 133-144.
Riska KM, Murnane O, Akin FW, Hall C. Video Head Impulse Testing (vHIT) and the Assessment of Horizontal Semicircular Canal Function. J Am Acad Audiol. 2015 May;26(5):518-23.
Robinson DA. A method of measuring eye movement using a scleral search coil in a magnetic field. IEEE Trans Biomed Eng 1963; 10:137-45.
Ruckenstein MJ, Shepard NT. Balance function testing: a rational approach. Otolaryngol Clin North Am. Jun 2000;33(3):507-18. [Medline].
Saadat D., O’Leary DP. Pulec JL, Kitano H. Comparison of vestibular rotation and caloric testing. Otolaryngol Head Neck Surg, 1985, 113 (3): 215-222.
Sawyer RN, Thurston SE, Becker KR, Ackley CV, Seidman SH, Leigh RJ. The cervico-ocular reflex of normal human subjects in response to transient and sinusoidal trunk rotations. Journal of Vestibular Research, 1994,4(3):245-9.
Schmid-Priscoveanu A, Bohmer A, Obzina H, Straumann D. Caloric and search-coil head-impulse testing in patients after vestibular neuritis. J Assoc Res Otolaryngol 2001; 2:72-8.
Schubert MC, Tusa RJ, Grine LE, Herdman SJ. Optimizing the sensitivity of the head thrust test for identifying vestibular hypofunction. Phys Ther. Feb 2004;84(2):151-8.
Seidman S.H., Paige G.D., Tomlison R.D., Schmitt N. Linearity of canal-otolith interaction during eccentric rotation in humans Exp Brain Res 2002,147 : 29-37,.
Seo YJ, Park YA, Kong TH, Bae MR, Kim SH. Head position and increased head velocity to optimize video head impulse test sensitivity. Otology Eur Arch Otorhinolaryngol. 2016 Nov;273(11):3595-3602.
Seung Cheol Ahn Ah Fig.2-19 A n SC. Short-term vestibular responses to repeated rotations in pilots. Aviat Space Environ Med. Mar 2003;74(3):285-7. [Medline].
Sills A.W., Baloh R.W., Honrubia V.: Caloric testing. II. Results in normal subjects. Ann Otol Rhinol Laryngol 1977 (Suppl 43); 86: 7.
Silverstein H, Smouha E, Jones R. Natural history vs. surgery for Ménière’s disease. “Otolaryngol Head Neck Surg. 1989 Jan;100(1):6-16.
Sood AJ, Lambert PR, Nguyen SA, Meyer TA. Endolymphatic sac surgery for Ménière’s disease: A systematic review and meta- analysis. Otol Neurotol. 2014 Jul;35(6):1033-45.
Spindler J, Schiff M. Variations of biphasic head shake response: physiology and clinical significance. Adv Otorhinolaryngol. 1988; 42:95- 103.
Straumann D, off-line computing of slow-phase eye velocity profiles evoked by velocily steps or caloric stimulation. Int J Biomed Comput 1991 Oct; 29W: 61-5.
Sugita-Kitajima A, Azuma M, Hattori K, Koizuka I. Evaluation of the otolith function using sinusoidal off-vertical axis rotation in patients with benign paroxysmal positional vertigo. Neurosci Lett. Jul 5 2007;422(1):81-6. [Medline].
Tabak S., Colewijn H., Boumans L.J.J.M.,Van Der Steen J. Gain and Delay of Human Vestibulo-ocular Reflexes to Oscillation and Step of The Head by a Reactive Torque Helmet. Acta Otolaryngol (Stockh), 1997;785-795.
Tabak S., Collewijn H.,. Boumans L. J. M, Van Der Steen J.; Gain and Delay of Human Vestibulo-Ocular Reflexes to Oscillation and Steps of the Head by a Reactive Torque Helmet. Acta Otolaryngol (Stockh) 1997;117: 796-809.
Tabak S., Collewijn H. Evaluation of the Human Vestibulo-Ocular Reflex at High Frequencies with a Helmet, Driven by Reactive Torque. Acta Otolaryngol (Stockh) Suppl 520: 4-8, 1995. Takahashi S, Fetter M, Koenig E, Dichgans J. The clinical significance of head-shaking nystagmus in the dizzy patient. Acta Otolaryngol. 1990 Jan-Feb;109(1-2):8-14.
Takemori S.: Visual suppression test. Ann Otol Rhinol Laryngol; 1977; 86:80,
R, Lenarz T, Lesinski-Schiedat A. “Minimized rotational vestibular testing” as a screening procedure detecting vestibular areflexia in deaf children: screening cochlear implant candidates for Usher Syndrome Type I. Eur Arch Otorhinolaryngol. Jul: 2008;265 (7):759-63.
Tomlinson RD, Saunders GE, Schwarz DW. Analysis of Human Vestibulo-Ocular Reflex during Active Head Movements. Acta Otolaryngol 1980; 90:184-190.
Truzzi M., Cappelli A., Modugno G.C. Il test rotatorio impulsivo nella caratterizzazione della VPPB: possibile ruolo terapeutico? Atti della XVI Giornata Italiana di Oneurologia, Ed. Formenti Sorrento,1999; 351.
Uemura T., Cohen B.: Effects of vestibular nuclei lesions on vestibulo-ocular reflex and posture in monkeys. Acta Otolaryngol (Suppl) 1973; 315:1.
Ulmer E., Magnan J., Chays A. Bilateral vestibular areflexia: quantification is required Ann Otolaryngol Chir Cervicofac 2002;119: 216-226.
Ulmer E, Chays A. Curthoys and Halmagyi Head Impulse test: an analytical device. Ann Otolaryngol Chir Cervicofac 2005 Apr; 122(2): 84-90.
Valente LM. Assessment techniques for vestibular evaluation in pediatric patients. Otolaryngol Clin North Am. 2011 Apr. 44(2):273-90, vii. [Medline]
Van Egmond A.: Cupulometrie. Pratica ORL 1955; 17,206-213.
Van Esch BF, Nobel-Hoff GE, van Benthem PP, van der Zaag-Loonen HJ, Bruintjes TD. Determining vestibular hypofunction: start with the video-head impulse test. Eur Arch Otorhinolaryngol. 2016 Nov;273(11):3733-3739.
Vanni S, Pecci R, Casati C, Moroni F, Risso M, Ottaviani M, Nazerian P, Grifoni S, Vannucchi P. STANDING, a four-step bedside algorithm for differential diagnosis of acute vertigo in the Emergency Department. ACTA Otorhinolaryngologica Italica. 2014 Dec;34(6):419-26.
Vicini C, Casani A, Ghilardi P. Assessment of head shaking test in neuro-otological practice. ORL J Otorhinolaryngol Relat Spec. 1989;51(1):8-13.
Walther LE, Huelse R, Blättner K, Bloching MB, Blödow A. Dynamic Change of VOR and Otolith Function in Intratympanic Gentamicin Treatment for Ménière’s Disease: Case Report and Review of the Literature. Case Rep Otolaryngol. 2013; 2013:168391.
Weber KP, Aw ST, Todd MJ, Mc Garvie LA, Curthoys IS, Halmagyi GM. Head impulse test in unilateral vestibular loss: vestibulo-ocular reflex and catch-up saccades Neurology. Feb 2008;5;70(6):454-63.
Weber KP, Aw ST, Todd MJ, Mc Garvie LA, Curthoys IS, Halmagyi GM. Horizontal head impulse test detects gentamicin vestibulotoxicity. Neurology 2009; 72:1417-24. (a)
Weber KP, MacDougall HG, Halmagyi GM, Curthoys IS. Impulsive testing of semicircular canal function using video-oculography. Ann NY Acad Sci 2009; 1164:486-91. (b)
Wei D, Hain TC, Proctor LR. Head-shaking nystagmus: associations with canal paresis and hearing loss. Acta Otolaryngol. 1989 NovDec;108(5-6):362-7.
Wiener-Vacher S. Clinical application of the off vertical axis rotation test (OVAR) Adv Otorhinolaryngol 2001;58: 88-97.
Wolfe J.W., Engelken E.J., Kos C.M.: Low-frequency harmonic acceleration as a test of labyrinthine function: basic methods and illustrative cases. Trans Am. Acad. Ophthalmol. Otolaryngol., 1978;86, 130-142.
Yang CJ, Lee JY, Kang BC, Lee HS, Yoo MH, Park HJ. Quantitative analysis of gains and catch-up saccades of video-head impulse testing by age in normal subjects. Clin Otolaryngol. 2016 Oct;41(5):532-8.
Yip CW, Glaser M, Frenzel C, Bayer O, Strupp M. Comparison of the Bedside HeadImpulse Test with the Video Head-Impulse Test in a Clinical Practice Setting: A Prospective Study of 500 Outpatients. Front Neurol. 2016 Apr 20; 7:58.
Yoo MH, Kim SH, Lee JY, Yang CJ, Lee HS, Park HJ. Results of video head impulse and caloric tests in 36 patients with vestibular migraine and 23 patients with vestibular neuritis: A preliminary report. Clin Otolaryngol. 2015 Oct 9.
Zell Huber S, Mahringer A, Rambold HA. Relation of video-head-impulse test and caloric irrigation: a study on the recovery in unilateral vestibular neuritis. Eur Arch Otorhinolaryngol. 2014 Sep;271(9):2375-83.
Zuleika-Santos C, Lujan B, Manrique-Huarte R, Perez-Fernandez N. The vestibulo-ocular reflex assessment in patients with Ménière’s disease: Examining all semicircular canals. Acta Otolaryngol. 2014 Nov;134(11):1128-33.