POTENZIALI EVOCATI VESTIBOLARI MIOGENI CERVICALI (c-VEMPs)
(Cervical)c-VEMP’s
Che Cosa è Il Potenziali Evocati Vestibolari Miogeno (c-VEMPs)? pag.1
Il sistema vestibolare. pag.3
Quando si Dovrebbero Utilizzare i VEMPs ? pag.4
Utilità Clinica dei c-VEMP. pag.4 approfond.pag.41
A Che Cosa Serve Il c-VEMPs? pag.5
Quando si Deve Utilizzare? pag.6
Quando Non Si Può Utilizzare ? pag.6
SCD Patologie da Deiscenza del Canale Semicircolare Superiore pag.6 approfond.
Fenomeno di Tullio.pag.7/44 Sindrome della Terza Finestra.pag.8 approfond.
Patologie da Idrope Endolinfatica Malattia di Meniere.pag.9 approfond.pag.50
Neurite Vestibolare.pag.10 approfond. pag.45/59
Schwannoma vestibolare.pag.11 approfond. pag.47
Sclerosi Multipla.pag.12 approfond.pag.56
Disordini Vestibolari Centrali.pag.13 approfond.pag.55
I APPROFONDIMENTO pag.14
Metodica d’Esecuzione dei VEMP.pag.15
Varianti di stimolo dei VEMP
II APPROFONDIMENTO pag.19
Anatomia e Fisiologia dei VEMPs.pag.19
Metodologia: Montaggio degli elettrodi.pag.28
Problemi Tecnici nell’ Esecuzione dei VEMPs.pag.35
VEMPs per Via Ossea.pag.39
VEMP con Stimolazione Galvanica.pag.40
Utilità Clinica Dei VEMPs.pag.41
I VEMPs nella Perdita Vestibolare Bilaterale.pag.49
I VEMPs nella VPPB .pag.50
Bibliografia .pag.62
CHE COSA E’ IL POTENZIALE EVOCATO VESTIBOLARI MIOGENO (C-VEMPS)? CERVICAL-VEMP’s?
Il VEMPs potenziale evocato vestibolare miogenico (Vestibular Evoked Myogenic Potentials) è una tecnica neurofisiologica di valutazione utilizzata per determinare la funzione degli organi otolitici ( utricolo e sacculo ) del dell’orecchio interno . Essa integra le informazioni fornite dal test calorico e di altre forme di dell’orecchio interno ( apparato vestibolare test). Con il termine VEMPs si intende un potenziale evocato vestibolare miogenico inibitore, evocabile a livello del muscolo sternocleidomastoideo (SCM) in seguito ad una intensa stimolazione acustica del sacculo, attraverso l’attivazione di strutture recettoriali vestibolari; questo viene definito riflesso vestibolo-collico. Pertanto, la ricerca dei VEMP costituisce un nuovo, utile metodo non-invasivo di studio monolaterale della funzione otolitica e dell’integrità funzionale del nervo vestibolare inferiore. Si ritiene che i VEMPs siano dovuti ad un arco riflesso disinaptico costituito dai recettori otolitici principalmente sacculari, dai nuclei vestibolari (1″ Sinapsi), dai motoneuroni spinali (2″ Sinapsi) e dallo SCM.

Gli organi otolitici, contenuti nelle cavità labirintiche del sacculo e dell’utricolo, sono sensibili alle accelerazioni lineari cui è sottoposto il capo.

Questi stimoli comprendono le accelerazioni generate nel corso di movimenti di flessione o di traslazione lineare della testa e l’accelerazione di gravità, che esercita costantemente la sua azione sul corpo
Il riflesso origina a livello del sacculo. La via prosegue attraverso il nervo vestibolare inferiore fino al complesso dei nuclei vestibolari,  soprattutto il nucleo vestibolare laterale o di Deiters (1a Sinapsi). Da qui le informazioni sono veicolate, attraverso il tratto vestibolo-spinale laterale omolaterale, fino alle corna anteriori del midollo spinale a livello C2-C5 (2a Sinapsi). Quindi attraverso il nervo accessorio spinale, arrivano al muscolo sternocleidomastoideo omolaterale.
soprattutto il nucleo vestibolare laterale o di Deiters (1a Sinapsi). Da qui le informazioni sono veicolate, attraverso il tratto vestibolo-spinale laterale omolaterale, fino alle corna anteriori del midollo spinale a livello C2-C5 (2a Sinapsi). Quindi attraverso il nervo accessorio spinale, arrivano al muscolo sternocleidomastoideo omolaterale.
Lo stimolo sonoro agendo sui recettori otolitici sacculari determina l’attivazione del cosiddetto riflesso vestibolo-collico che viene registrato come “variazione di potenziale bioelettrico”.

Riflesso vestibolo-collico (VCR)
n Neuroni eccitatori – n Neuroni inibitori
Il riflesso origina a livello del sacculo; la via prosegue attraverso il nervo vestibolare inferiore fino al complesso dei nuclei vestibolari (soprattutto il nucleo vestibolare laterale). Da qui le informazioni sono veicolate, attraverso Il tratto vestibolo-spinale laterale omolaterale, fino alle corna anteriori del midollo spinale a livello di C2-C5. Quindi, attraverso il nervo accessorio spinale, arrivano al muscolo sternocleidomastoideo (SCM) omolaterale.
La via che origina dai recettori sacculari provoca un’inibizione degli alfamotoneuroni che innervano lo SCM ipsilaterale.
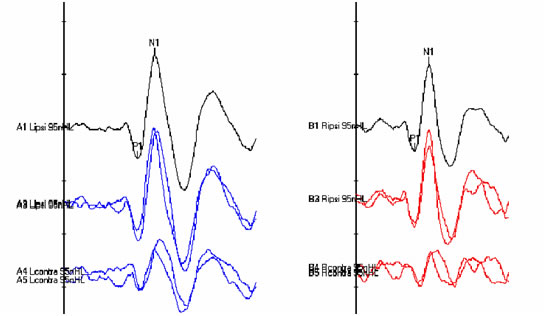
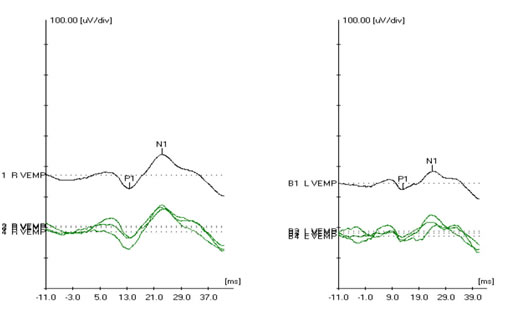
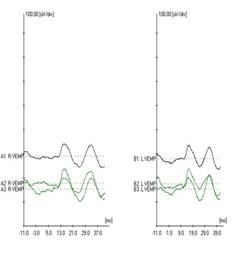
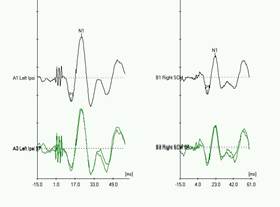
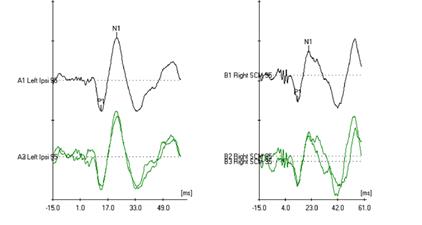
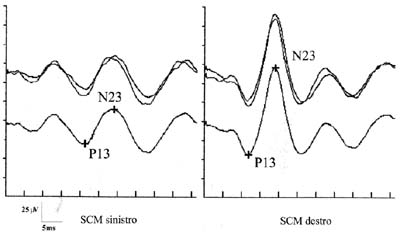
Il tracciato è caratterizzato da oscillazioni ondulatorie rispetto all’isoelettrica chiamate “p” quella al di sotto della isoelettrica ed “n” quella al di sopra (Figura 1).

Figura 1: tracciato VEMPs
Questi potenziali miogenici possono essere registrati da varie posizioni. Il sito di registrazione primario che viene utilizzato clinicamente è il muscolo sternocleidomastoideo (SCM) lungo la colonna vertebrale cervicale e questo è chiamato VEMPs cervicale (c-VEMPs).I VEMPs sono costituiti principalmente da due componenti. La prima componente è un picco positivo che si verificano attorno 13,3 ms (P13), mentre la secondo è un picco negativo si verificano circa 23 ms (N23) nel periodo post stimolo. 2 e 3 della prova .Il c-VEMPs determina se il sacculo e / o il nervo vestibolare inferiore e le connessioni centrali sono intatti e lavorare normalmente.
Il sistema vestibolare
Il sistema vestibolare aiuta una persona a mantenere: l’equilibrio, fissazione visiva, la postura, e minore controllo muscolare.
Ci sono sei organi recettori situati nell’orecchio interno: coclea, utricolo, sacculo, e canali semicircolari laterali, anteriori e posteriori. La coclea è un organo sensoriale con lo scopo primario di aiutare in udienza. l’ utricolo ed il sacculo sono sensori per la rilevazione di accelerazione angolare o lineare, e i tre canali semicircolari rilevano rotazione della testa.
Le cellule ciliate, situate all’interno del labirinto membranose del sistema vestibolare, sono in totale circa 67.000.Queste comprendono 7.000 cellule ciliate per ciascuno dei 3 canali semicircolari situati all’interno della cresta ampollare, ~ 30.000 cellule ciliate nell’ utricolo e ~16.000 cellule ciliate nel sacculo. Ogni cella ciliata ha circa 70 stereocilia (cellule ciliate i corte a bastoncino) e una Chinociglio(cell ciliata lunga).
Storia
Bickford et al. (1964) [1] e, successivamente, Townsend e Cody, [2] ha fornito le prove per una breve risposta di latenza nei muscoli del collo posteriori in risposta ai clic forti che sembravano essere mediata dall’attivazione dell’apparato vestibolare. Questi autori effettuate le osservazioni importanti aggiuntive che la risposta è stata generata da EMG (muscolare) attività e purché scalato con il livello di attivazione tonica. Il lavoro successivo ha portato al suggerimento che il sacculo era l’organo fine eccitato.
Nel 1992 Colebatch e Halmagyi [3] hanno riportato un paziente con una breve risposta di latenza per i clic forti studiate utilizzando un sito modificato registrazione (i muscoli sternocleidomastoidei: SCM) e che è stata abolita dalla sezione del nervo vestibolare selettivo. Colebatch et al. (1994) [4] descrive le proprietà di base della risposta. Questi erano: la risposta è verificato omolaterale all’orecchio stimolato, la soglia di scatto era alto, la risposta non dipende (dalla funzione dell’udito cocleare ) di per sé, è scalato in modo direttamente proporzionale al livello di contrazione tonica collo, la risposta era piccola ( sebbene grandi rispetto a molti potenziali evocati) e media richiesta, e solo la risposta iniziale positiva-negativa (p13-N23 dalla latenza) era in realtà vestibolare-dipendente. Successivamente è stato dimostrato essere generato da un breve periodo di inibizione di scarico gruppo motore. [5]
Quando si Dovrebbero Utilizzare i VEMPs ?
Come parte della batteria dei test vestibolare
Quando è l’unico test vestibolare si può fare
Nei bambini (Sheykholeslami et al. 2005;. Jin et al. ,2006)
Nei pazienti sordi / pazienti con sordità da grave a profonda
Monitoraggio delle funzioni del riflesso vestibulospinale nel corso del tempo
monitoraggio di processi patologici
Pre e post- interventi chirurgici ( rimozione di tumore Chen, Young & Tseng (2002). ; impianto cocleare( Jin et al. 2006)
Utilità clinica dei c-VEMP ed o-VEMP
Il più forte vantaggio del test c-VEMP e o-VEMP è la loro capacità di misurare una parte diversa del sistema vestibolare (cioè organi finali otolitici) mentre la videonistagmografia (VNG) ed i tests rotazionali valutano solo il canale semicircolare laterale (SCC) e le sue connessioni con il nervo vestibolare superiore. L’esame VEMPs valuta separatamente il labirinto di destra e sinistra, rendendo i VEMPs ulteriormente utili nel localizzare il lato della lesione. Un altro vantaggio è che entrambi questi test sono relativamente veloci e molto tollerati dai pazienti. Tuttavia, uno dei maggiori limiti dei test VEMP è che il tasso di risposta diminuisce nei pazienti anziani. In altre parole, anche in controlli sani, ma anziani , aumenta il tasso di VEMPs assenti , 6,7
Uno dei limiti dei test clinici VEMP è che, come la maggior parte delle prove vestibolari, i VEMPs valutano il sito di lesione, non necessariamente la presenza o assenza di malattia. Ad esempio, i c-VEMPs sono spesso anormali nei casi di neurite vestibolare inferiore, mentre gli o-VEMPs ed il test calorico (ad esempio, entrambe le misure di funzione nervosa superiore) sono di solito normali. 8 Tuttavia, la diagnosi di neurite del nervo vestibolare inferiore si basa in ultima analisi, sull’anamnesi clinica . Inoltre, i c-VEMPs sono ipotizzati per essere utile nella malattia di Meniere, un’altra diagnosi in base alla storia clinica e risultati audiometrici, perché il sacculo si crede di essere la struttura più coinvolti in idrope endolinfatico, seguendo la coclea. I tests Calorici e i tests con sedia rotatoria non valutano il sacculo e possono sottovalutare i disturbi vestibolari nella malattia di Meniere. Tuttavia, la sensibilità e la specificità di cVEMPs sono riferito solo nel 50% e 48,9%, rispettivamente, in pazienti con malattia monolaterale definitiva di Meniere.9 I VEMPs non sono essenziali per la diagnosi di emicrania, che è una diagnosi clinica, ma possono essere importante per quantificare il coinvolgimento vestibolare. Un recente rapporto ha suggerito che i VEMPs sono più spesso bilateralmente assenti nei pazienti con emicrania rispetto ai controlli. 10 Infine, è stato ipotizzato che i pazienti con menomazioni dell utricolo e sacculo, misurata utilizzando i tests cVEMP e oVEMP, possono essere più suscettibili alla BPPV in quanto gli otoconi responsabili della canalitiasi originano dagli organi otolitici. 11
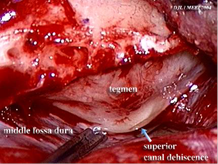
Nonostante le limitazioni, c’è almeno una patologia vestibolare dove test VEMP sono estremamente utile e, in effetti, misurare la presenza della malattia. Cioè, uno dei migliori usi del VEMP risiede nella sua capacità di aiutare nella diagnosi di deiscenza canale semicircolare superiore (SCD).
A CHE COSA SERVE IL c-VEMPs?
Ha applicazioni diagnostiche nella diagnosi di deiscenza canale semicircolare v superiore una condizione in cui ci possono essere sintomi e segni clinici di attivazione vestibolare in seguito a stimoli sonori intensi . In tali casi si ha una soglia patologicamente abbassata per i VEMPs evocati da stimoli acustici. Il test è anche di utilizzo nel dimostrare il successo del trattamento. [6] H in malattia di Ménière , neurite vestibolare , otosclerosi e disturbi centrali come la sclerosi multipla
- Bickford RG, Jacobson JL, Cody DTR (1964). Nature of average evoked potentials to sound and other stimuli in man. Ann NY Acad Sci 112:204-218.
- Townsend GL, Cody DTR (1971). The averaged inion response evoked by acoustic stimulation: its relation to the saccule. Ann Otol Rhinol Laryngol 80: 121-131.
- Colebatch JG, Halmagyi GM(1992). Vestibular evoked potentials in human neck muscles before and after unilateral deafferentation. Neurology 42: 1635-1636.
- Colebatch JG, Halmagyi GM, Skuse NF (1994). Myogenic potentials generated by a click-evoked vestibulocolic reflex. J Neurol Neurosurg Psychiatry 57:190-197.
- Colebatch JG, Rothwell JC (2004). Motor unit excitability changes mediating vestibulocolic reflexes. Clin Neurophysiol 115(11):2567-2573.
- Welgampola MS, Myrie OA, Minor LB, Carey JP (2008). Vestibular-evoked myogenic potential thresholds normalize on plugging superior canal dehiscence. Neurology 70:464-472.
– Quando si deve utilizzare?
• Come parte della batteria dei test vestibolari
• Quando è l’unico test vestibolare che si può fare nei bambini piccoli (Sheykholeslami et al. 2005; Jin et al. 2006)
Pazienti sordi / pazienti con grave a profonda HL
• Monitoraggio funzioni riflesse vestibulospinal nel tempo
Monitoraggio Processo di malattia
Chirurgia :asportazione del tumore (Chen, Young & Tseng 2002) o l’impianto cocleare ( Jin et al. 2006) pre e post-
– Quando non si può utilizzare ?
· Ipoacusia trasmissiva
· Lesioni del midollo spinale
· Atrofia muscolare
· I pazienti in trattamento con Valium o altri miorilassanti
-Patologie che possono causare VEMPs anormali
· Patologie del Labirinto
Sindrome da deiscenza del Canale Semicircolare Superiore(SCD)
Idrope Endolinfatica
Labirintite che coinvolge il sacculo
Ossificazione Labirintico (Meningite)
Connessina 26?
· Patologie VIII NC
Neurite vestibolare
Neuroma acustico
· Lesioni del tronco cerebrale
Sclerosi Multipla
Ictus
Tumori
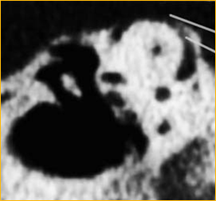
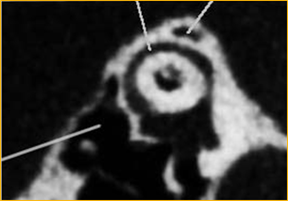
SCD Patologie da Deiscenza del Canale Semicircolare Superiore
Sommario
Il sintomo principale è il capogiro con i suoni forti e risposta ai cambiamenti di pressione statica applicata al canale uditivo , es., durante timpanometria (Segno di Hennebert ).
L’audiogramma può mostrare una componente trasmissiva
I C-VEMPs mostrano basse soglie e grandi ampiezze
La diagnosi definitiva deve essere fatta con la TAC
|
|
|
Fenomeno di Tullio
Il c-VEMPs in pazienti con fenomeno di Tullio
• Una sindrome in cui stimolazione acustica produce sintomi vestibolari ( vertigini , disequilibrio , nistagmo, oscillopsia ) ,
a volte combinati con segni di Hennebert durante la timpanometria
• Apparso in
– Canale Super deiscenza
– Perilymph fistole
– La malattia di Ménière
– La sordità congenita
– Staffa ipermobile
• risposta VEMP
– Intensità inferiore a chiarire VEMP ( tipico < 75 dB )
– Ampiezza superiore paragonato alla normalità
• Inoltre possono mostrare i movimenti oculari in risposta ai cambiamenti di pressione statica applicata al canale uditivo , ex . durante timpanometria (Segno di Hennebert )
• In pazienti con questo disturbo , la sezione dell osso temporale che si sovrappone sul canale semicircolare superiore è più sottile del normale , che crea una terza ” finestra mobile” ( Canal Superior Deiscenza ) . Ciò comporta una bassa impedenza nel percorso del suono e nell’orecchio interessato :
intensità più basse della norma suscitano VEMP,
alla stessa intensità dello stimolo si hanno ampiezze superiori ( in alcuni casi )
soglia inferiore dei c-VEMPs e maggiore ampiezza dei c-VEMPs
Rapporto VEMP asimmetria ( VAR ) forse anomalo

Sindrome della Terza Finestra
|
|
|
• Una terza finestra del labirinto comunicare con fossa cranica :
canale semicircolare superiore ( SCD ) ,
canale Posteriore, acquedotto vestibolare grande
• sintomi
– Tullio : vertigini / vertigini e oscillopsia in seguito a rumori e forti pressioni ( (sforzare , soffiarsi il naso , Valsalva )
– Autofonia e perdita trasmissiva dell’udito e iperacusia (catena ossiculare intatta)
• Diagnosi : segno di Tullio firma + HRCT dell’osso temporale + ipoacusia trasmissiva
+ anomalia dei c-VEMP
Patologie da Idrope Endolinfatica
VEMP Assente o diminuito in 22/42 punti (51%) w / malattia di Meniere (Murofushi T, et al. 2001)
VEMP Positivo al glicerolo (Shojaku H, et al. 2001)
Meniere unilaterale (8/15; 53%)
il 67% rilevato w / combinato disidratazione glicerolo EcochG transtimpanicc e c-VEMP
Idrope cocleare vs. sacculare
DPOAEs e VEMP nella ricerca dell’idrope iniziale
I VEMPs può essere meglio rispetto all’ EcochG quando il paziente ha una perdita uditiva troppo severa Magliulo et al. (2004)
Malattia di Meniere
|
|
|
DEWAELE et al. ( 1999) trovarono che i c-VEMPs erano assenti dal 54% dei pazienti con malattia di Meniere e correla con la perdita a bassa frequenza dell’udito ( de Waele et al. , 1999) ,riapparire o si allargata con farmaci ( glicerolo ,furosemide ) (Young et al. , 2003)
Young et al . ( 2003) trovarono che la ” differenza di ampiezza interaurale ( IAD ) Rapporto ” dipendeva da quale fase era la malattia di Meniere
Seo et al. ( 2003) trovarono che il 40 % di pazienti con malattia di Meniere
hanno mostrato un netto miglioramento dell’ampiezza dei c-VEMPs dopo la somministrazione di furosemide
Durante Le fluttuazioni dell’attacco acuto : i VEMPs scompaiono o si attenuano nelle prime 24 ore , ricompare dopo 48 ore
I c-VEMPs possono aumentare nei primi mesi della MD ( Tullio ) , forse da migliore sensibilità sacculare al suono forte, da idrope del sacculo che premendo contro la platina della staffa
(Young et al. , 2002)
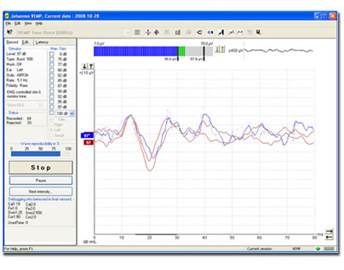
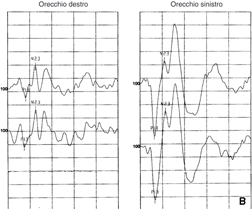
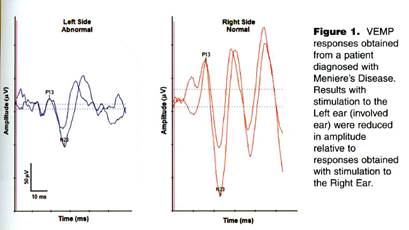
La figura seguente mostra una ridotta risposta ottenuto da un paziente con malattia di Meniere (che colpisce l’orecchio sinistro):
Neurite Vestibolare

VN colpisce ( Aw et al. , 2001)
– generalmente Nervo vestibolare superiore
– Meno spesso : sia superiore ed inferiore e nervi vestibolari
– Raramente nervo vestibolare inferiore
• AC c-VEMPs ( Kim et al , 2008; . Murofushi et
al. , 1996)
– Risposta nervo vestibolare Inferiore
– Abolito in 20 ~ 30 % delle orecchie VN
BC c-VEMP
AC c-VEMP
• AC c-VEMPs ( Brantberg et al. , 2003)
– Le risposte di nervi vestibolari superiori ed inferiori
– Più spesso assente che sono AC cVEMPs
• BC o-VEMP ( Iwasaki et al . 2009)
– Abolito in qualche VN ( nervo vestibolare superiore ), che conserva AC c-VEMP
– IBC o-VEMP rappresentano prevalentemente funzione utriculare
• Herpes zoster oticus ( Ramsay Hunt Sindrome )
– c-VEMP abolito in oltre il 50% di soggetti ( Lu e Young , 2003)
– Suggerendo coinvolgimento nervo vestibolare inferiore più comune in Ramsay Hunt di comune VN generalmente si ritiene che la neurite vestibolare colpisca la porzione superiore del nervo vestibolare , lasciando intatta la porzione inferiore
I sintomi del disturbo possono includere attacchi di vertigine grave , nausea , vomito , squilibrio , e nistagmo spontaneo
Questi pazienti in genere non presentano interessamento uditivo o insufficienze neurologiche
I pazienti con questo disturbo spesso presentano assenza o risultati calorici gravemente ridotta unilateralmente , oltre a mostrare segni di nistagmo spontaneo
Tuttavia , Halmagyi et al. (2002 ) hanno descritto due pazienti che avevano test calorico e ENG normale o solo risultati leggermente anomali, e nessun segno di nistagmo spontanea . In questi pazienti Il c-VEMPs non poteva essere evocato dal lato colpito . Gli autori hanno concluso che questi pazienti erano affetti da neurite
vestibolare che aveva colpito il nervo vestibolare inferiore

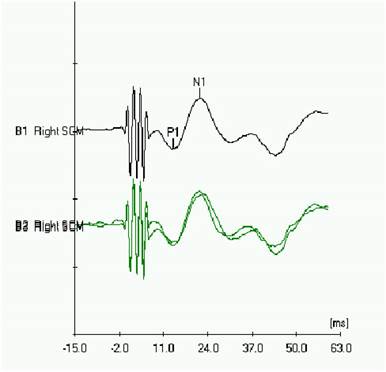
VEMP ottenuti in un individuo con sindrome di Ramsay-Hunt sinistra
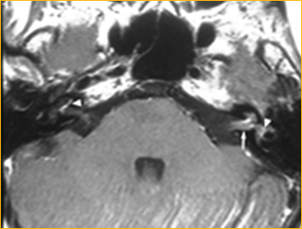
Schwannoma vestibolare
Poiché il percorso neurale per VEMP coinvolge il nervo vestibolare, VEMP è stato utilizzato nella valutazione del funzionamento del nervo in pazienti con neurinoma acustico (AN).
Murofushi et al. 21 (1998 ) hanno studiato il c-VEMPs in21 pazienti con diagnosi di un schwannoma vestibolare: Hanno trovato che l’80 % di questi pazienti prodotto un c-VEMPs anormale (71 % = senza risposta , 9 % = risposta con ampiezza ridotta ) In un altro studio di Murofushi et al (2000) hanno mostrato che il 77% dei 48 pazienti con AN aveva assente o diminuita VEMP ampiezza; 4 pazienti con tumori di grandi dimensioni hanno mostrato una prolungata latenza P1 suggestivo di lesione nel tratto vestibolo-spinale.
Gli autori hanno concluso che il c-VEMPs potrebbe essere utilizzato per diagnosticare quale porzione del nervo vestibolare è influenzata (superiore vs. inferiore) in pazienti con schwannoma vestibolare Inoltre, Wang, Hsu e Young (2005) studiati VEMP e risposte calorico nei pazienti con neurofibromatosi di tipo 2 (NF2) e hanno trovato 71% orecchie esposti risposte calorici anomale mentre solo il 14% orecchie visualizzati assente VEMP-una differenza significativa. Questo indica che i tumori NF2 originano dal nervo vestibolare superiore più spesso rispetto al nervo vestibolare. L’invasione nervo vestibolare inferiore è possibile se il tumore NF2 è sufficientemente grande. Così il VEMP può servire come un indicatore del grado di infiltrazione dell NF2 .
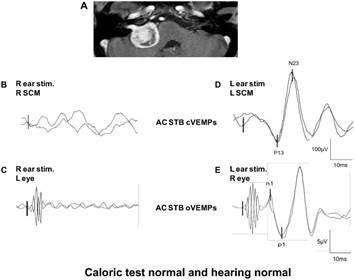
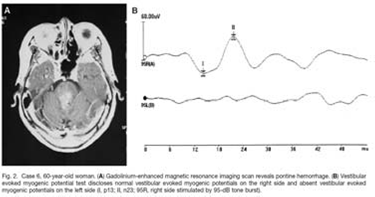
tumore ponto cerebellare destro con funzionalità uditiva e risposta calorica normale, assenza di c-VEMP sulla destra quando l’orecchio destro è stato stimolato: B) e disfunzione dei nervi inferiore (anormale o-VEMPs sull’occhio sinistro quando l’orecchio destro è stato stimolato: C ). Quando l’orecchio intatto sinistra è stata stimolata, normale c-VEMPs ( D) e normale o-VEMPs ( E ) sono stati osservati.
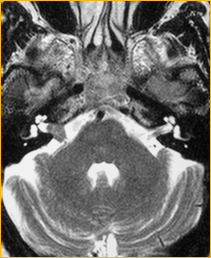
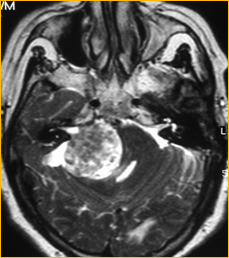
Schwannoma vestibolare
Sclerosi Multipla
Shimizu et al. ( 2000) ottenuto il c-VEMPs da tre pazienti con sclerosi multipla
Essi hanno riscontrato scoperto che, mentre tutte i soggetti hanno prodotto un c-VEMPs , le latenze di risposta sono aumentate rispetto ai dati normative
Disordini Vestibolari Centrali
Mesencefalo demielinizzante a placche (oftalmoplegia internucleare)
solo o-VEMP ( VOR )
• vestibolare zona di ingresso della radice nervosa : c-VEMP assente e
o-VEMP ( VSR + VOR )
• Abbassare tronco cerebrale infarto ( es sindrome midollare laterale
) : solo c-VEMP ( VSR )
• Sclerosi multipla : prolungata p13 e n23 ( 50 % del
pazienti)
• Rilevamento lesioni silenti in tronco encefalico , integrare BAER
• emicrania basilare : c-VEMP assente

APPROFONDIMENTO
La metodica di evocazione dei VEMP’s si basa sulla teoria che il vestibolo abbia conservato un’antica sensibilita’ agli stimoli acustici, questa sensibilita’ era già stata osservata da Tullio (1928) da Von Bekèsy (1935) e successivamente da altri diversi autori. La neurofisiotopografia dei VEMPs , per quanto sia nota o ipotizzabile si racchiude in un breve circuito “DISIMPATICO“ costituito dai recettori otolitici principalmente sacculari, dai nuclei vestibolari (1″ Sinapsi), dai motoneuroni spinali (2″ Sinapsi) e dallo SCM. Lo stimolo sonoro agendo sui recettori otolitici sacculari determina l’attivazione del cosiddetto riflesso vestibolo collico che viene registrato come “ variazione di potenziale bioelettrico “ ponendo gli elettrodi sulla clavicola, sul muscolo sternocleidomastoideo “ SCM ”, e sullo sterno.
Questi potenziali, registrati come oscillazioni ondulatorie rispetto all’isoelettrica, sono caratterizzati da un complesso bifasico p1-n1 (o p13-n23) che compare entro 30 msec dallo stimolo. La presenza di questo complesso indicherebbe l’integrità del riflesso e particolarmente della branca inferiore del nervo vestibolare. Al momento gli unici parametri su cui fare affidamento nella diagnostica vestibolare risultano le latenze di p1 ed n1 insieme alla presenza/assenza del potenziale.
I VEMP’s sono l’unico test in grado di indagare l’integrità selettiva del nervo vestibolare inferiore,con implicazioni già ben note in ambito di neurinoma dell’acustico e Della VPPB= Vertigine Parossistica Posizionale Benigna.
Il dato più interessante è senza dubbio in tal senso l’esistenza di neurinomi dell’acustico con ABR= (potenziali evocati uditivi del tronco encefalico). negativi e nel contempo VEMPs patologici.
Altra applicazione interessante che si fonda sulla esplorazione della integrità funzionale del nervo vestibolare inferiore studiando con il riflesso vestibolo-collico è quella della predizione di possibile VPPB tardiva dopo deficit vestibolare selettivo monolaterale, che, come noto, sovente ma non di regola si complica nella sua evoluzione con una VPPB. Già nel 1996 è stato dimostrato che dopo neurolabirintite vestibolare la persistenza di una attività VEMPs correlava con un successivo sviluppo di VPPB, mentre i casi con VEMPs non evocabili non si complicavano mai con VPPB. L’osservazione riveste particolare rilevanza poiché riconferma la selettività neurale vestibolare inferiore del pathway vestibolo-collico, spiega in maniera convincente come mai solo una parte di neurolabirintiti sia seguita da VPPB, e fornisce sul piano clinico pratico un buon indicatore prognostico. Altra applicazione di sicuro interesse pratico oltre che teorico è quella allo studio della malattia di Meniere. Ricordiamo come il sacculo sia una struttura anatomicamente a ponte tra chiocciola e otricolo con i suoi canali semicircolari. Ricordiamo inoltre come l’idrope tenda ad essere prevalente in ambito cocleare e pertanto a coinvolgere più facilmente le strutture vicine (sacculo) rispetto ai canali semicircolari. Nel 54% dei pazienti menierici i VEMPs erano assenti dal lato patologico. E’ stata documentata una correlazione statica molto significativa tra ipoacusia percettiva menieriforme ascendente ed alterazione dei VEMPs, confermando la elevata probabilità di avere come prima sub unità vestibolare coinvolta dall’idrope proprio il sacculo, anche in presenza di una perfetta reflettività calorica del CSL.
CSL=canale semicircolare laterale.
La risposta otolitica è registrabile anche in caso di severa ipoacusia percettiva che non inficia la prova. La topologia dello stimolo, sonoro ” LOGON “, e l’assenza di vertigine indotta, con un profilo di esame confortevole e non invasivo, ne raccomanda l’impiego:
· in ambito pediatrico al posto della stimolazione calorica, sopra il limite di età che consenta quel minimo di collaborazione indispensabile ed individuabile al di sopra dei 6-8 anni; è rapido per la facile stancabilità del bambino, assolutamente confortevole, non crea spavento e richiede un livello di minima collaborazione.
· in caso di otite cronica perforata con rischio di infezioni alla prova calorica o comunque diseguale stimolo da irrigazione e conseguente scarsa affidabilità nel confronto tra i lati. In questo caso è utile l’uso di un vibratore osseo, ma la sperimentazione non ha ancora dati certi.
· in caso di paziente che esplicitamente, per precedenti esperienze fastidiose, richiede di omettere il test calorico dal protocollo.
· In caso di gravidanza.
METODICA D’ESECUZIONE DEI VEMP PROCEDURE
Attrezzatura
Amplificatore Impostazione
Paziente Set- Up
Posizionamento / Postura
Montaggio elettrodi
Parametri dello stimolo
ATTREZZATURA VEMPs
Fondamentalmente possono essere usato Sistemi per registrazione di risposta evocate
Sistemi che possono registrare i VEMPs comprendono :
ICS CHARTR Evocati Sistema Potenziale
Bio – logic AEP
Sistemi Intelligent Hearing Smart EP
Nicolet Spirit
Varianti di stimolo dei VEMP

I VEMP possono essere evocati con tre tipi di stimoli:
ACUSTICI CLICK SHORT TONE BURST LOGON
HEAD TAPPING
GALVANICI
Primo passo – Calibrazione
ottenere i valori di SPL di picco per i vostri stimoli
POSIZIONAMENTO DEL PAZIENTE
Obiettivo è la contrazione del muscolo SCM
Nessun supporto per o contro qualsiasi particolare posizione della testa

MONTAGGIO ELETTRODI
|
Posizione degli elettrodi; Montaggio degli Elettrodi Elettrodi snap- on monouso elettrodi funzionano molto bene Elettrodo Attivo * Nel 1/3 superiore della SCM Elettrodo di Riferimento Allo sterno con un ponticello , o Ad ogni inserimento sternale Un alta impedenza è OK
|
|
1. elettrodi positivo sul terzo medio di ciascun SCM
2. elettrodi negativo sul terzo medio delle clavicole
3. elettrodo di terra sulla fronte.
Per ottenere una migliore registrazione si usano elettrodi per ECG da sforzo ( autoadesivi con spugnetta intrisa di gel conduttivo ), che per la loro composizione sono ottimali garantendo valori di impedenza migliore e costante nel tempo. Per pulire e sgrassare la pelle, meglio usare la piccola placchetta di carta abrasiva presente sulla confezione del singolo elettrodo da ECG, questo consente di avere impedenze migliori rispetto all’uso di alcool e etere.
Parametri di base d’analisi per il poligrafo, che nel nostro caso è un ICS OTOMETRICS
PARAMETRI DELLO STIMOLO
Parametri
· Stimolazione: frequenza : LOGON 500 Hz , polarita’ negativa , 130 db spl 5 Hz / s ( 200 ms intervallo )
· Stimolo : per via aerea : rarefazione 0.1 ms – click / tone – raffica (0,5/1kHz )
per via ossea : Tone Burst ( 200 Hz )
· Intensità : ≥ 95dB per click , 120 dB per la tone burst ( normale risposta controlaterale lo a soli ≥ 90 dB )
· Bandpass : 5 Hz ~ 1 kHz ( 20 ~ 20kHz )
· Windows : 50 ms
· Guadagno : 5000 ~ 10000
· Repetition rate 4 Hz , mono dx/sn.
Durata di ogni acquisizione 25 sec ( 100 ripetizioni) 50 sec. ( 200 ripetizioni )
Per la registrazione dei VEMPs il paziente deve stare supino senza alcun cuscino sotto la testa, viene invitato a sollevarla durante la durata del test 25-50 sec. “come gli viene meglio, ma almeno di circa 4 cm ” mantenendola perfettamente dritta e immobile, di solito per mantenere meglio tale posizione si consiglia al paziente di guardasi la punta dei piedi.
Le latenze significative sono le p23 e n23 mentre la n34 e la p44 non sono significative.
VALORI MEDI Le latenze hanno variabili legate a diversi fattori, si consiglia pertanto la taratura fisiologica con il proprio poligrafo. I valori qui riportati sono il risultato dello studio di due diverse cliniche ospedaliere.
LATENZE
p23 14,4 – 18,4 media 16,2 + – 1,36
n23 19,5 – 31,2 media 22,4 + – 2,4
p23 13,2 – 20,7 media 14 + – 9
n23 22,0 – 29,2 media 25,7 + – 2,09
AMPIEZZA
L’ampiezza non è necessariamente indice di sofferenza vestibolare, la sua valutazione diventa indicativa se valutata a seconda della patologia indagata.
p23-n23 14,13uV 414,5uV media 159,28 + – 97,228
rapporto tra i due lati 0,002% – 42% media 14,19% + – 12,93%
Trattandosi di una metodica che è appena uscita dalla sperimentazione, e che ha ancora diversi punti da chiarire, non può essere usata come unico esame diagnostico per la valutazione della funzionalità labirintica, ma bensì, associata ad altri test, diventa uno strumento diagnostico importante per una migliore topodiagnosi.
I°APPROFONDIMENTO
INTRODUZIONE
Lo scopo dell’esame con i VEMPs è determinare se il sacculo, che costituisce una parte degli organi otolitici(utricolo e sacculo), collegato a sua volta con il nervo vestibolare inferiore ed il sistema nervoso centrale, sia intatto e funzioni normalmente. Il sacculo, che è il più piccolo tra i due organi otolitici,è sensibile ai suoni e questa sensibilità può essere misurata. Si pensa che questa sensibilità sia un retaggio del sacculo,che negli animali filogenicamente più bassi,viene utilizzato come organo uditivo.
Anatomia e Fisiologia dei VEMPs
Per registrare le informazioni relative al movimento della testa l’apparato vestibolare è quindi dotato di due diverse strutture sensoriali: gli organi otolitici, che misurano i movimenti lineari, ed i canali semicircolari, che registrano quelli angolari. Più in particolare, i recettori degli organi otolitici rispondono ad accelerazioni lineari del capo, mentre quelli dei canali semicircolari sono sensibili ad accelerazioni angolari. Entrambi gli organi sensoriali contengono lo stesso tipo di cellula recettoriale, ma sono caratterizzati da una particolare struttura anatomica che ne determina la specificità nel rilevare i movimenti lineari o angolari.
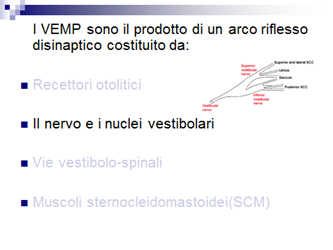
I VEMP sono il prodotto di un arco riflesso disinaptico costituito da:
· Recettori otolitici
· Nuclei vestibolari
· Vie vestibolo-spinali
· Muscoli sternocleidomastoidei (SCM)
Gli organi otolitici, macule, Fig.1a contenuti nelle cavità labirintiche del sacculo e dell’utricolo, sono sensibili alle accelerazioni lineari cui è sottoposto il capo. 
Questi stimoli comprendono le accelerazioni generate nel corso di movimenti di flessione o di spostamento lineare della testa e l’accelerazione di gravità, che esercita costantemente la sua azione sul corpo.
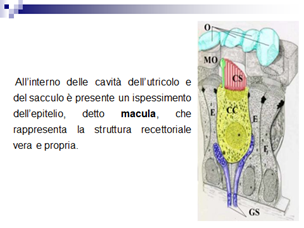
I ciuffi di ciglia dei recettori sporgono dalla superficie della macula e sono immersi in una sostanza gelatinosa al di sopra della quale è posta un membrana fibrosa, la membrana otolitica, che contiene numerosi cristalli di carbonato di calcio detti otoconi.

Gli otoconi rendono la membrana otolitica notevolmente più densa e pesante rispetto alle strutture ed ai liquidi circostanti, di modo che quando la testa si flette la forza di gravità determina uno spostamento relativo della membrana otolitica rispetto alla macula che si traduce in una deflessione dei ciuffi di ciglia.

Inoltre, ogni macula è divisa in due parti da una linea arbitraria detta striola, attorno alla quale sono orientati gli assi di polarizzazione dei ciuffi di ciglia: nell’utricolo i ciuffi sono orientati con il chinociglio rivolto verso la striola, mentre nel sacculo hanno orientamento contrario
La disposizione opposta dei ciuffi intorno alla striola fa sì che ogni stimolo induce la deflessione verso il chinociglio nelle cellule poste su un lato della striola e via dal chinociglio in quelle poste dall’altro lato. In altri termini, ogni stimolo indurrà contemporaneamente la depolarizzazione di alcune cellule e la iperpolarizzazione di altre.
Fisiologia sacculare
· Il sacculo è sensibile alle accelerazioni lineari tangenziali alla sua superficie curva (per lo più sul piano sagittale).
· Il 1/3 inferiore, eccitato dallo spostamento in basso degli otoconi è meno sensibile.
· I 2/3 superiori, eccitati dallo spostamento in alto degli otoconi, sono più sensibili ed hanno un maggior numero di cellule sensoriali.
· L’attivazione globale del sacculo è percepita come una caduta verso il basso e determina l’attivazione dei muscoli estensori di gambe e collo e l’inibizione dei rispettivi flessori.


Alcune terminano invece nel nucleo del Gruppo Y, altre nel vestibolare mediale o nel vestibolare laterale.Agli stessi neuroni di secondo ordine giungono afferenze dalla sostanza reticolare del tronco e dal cervelletto

Il fascio vestibolo-spinale mediale nasce nel nucleo vestibolare mediale e decorre nel cordone antero-mediale del midollo spinale fino a livello dei segmenti toracici.
Il fascio vestibolo-spinale laterale nasce invece principalmente dal nucleo vestibolare laterale e decorre nel cordone anteriore del midollo spinale per tutta la sua lunghezza.
Le vie vestibolo-spinali esercitano un controllo posturale, regolando il tono dei muscoli estensori e flessori del collo e degli arti.

Le fibre della radice spinale, nate dai motoneuroni dei primi 5-6 segmenti cervicali, entrano nel cranio attraverso il foro occipitale e si uniscono alle fibre della radice cranica, nate dal nucleo ambiguo.
Il nervo accessorio fuoriesce dal cranio nel foro lacero posteriore, nella guaina durale del nervo vago.
Le fibre della radice cranica, lasciano il tronco dell’XI come ramo interno dell’accessorio, si uniscono al nervo vago per formare poi il nervo laringeo ricorrente.
Il ramo esterno (o accessorio spinale) termina ai muscoli sterno-cleido-mastoideo e trapezio.

Muscolo bilaterale costituito inferiormente da due capi (sternale e clavicolare) che si uniscono in alto all’estremità mastoidea.

Il riflesso vestibolo-oculare (VOR) stabilizza l’immagine retinica muovendo gli occhi in direzione opposta a quella del movimento della testa
Il riflesso vestibolo-collico (VCR): mantiene la testa ferma quando si cammina.
Il riflesso vestibolo-spinale (VSR): rende possibile il mantenimento della stazione eretta e del controllo posturale anche durante l’ andatura.

Il riflesso origina a livello del sacculo; la via prosegue attraverso il nervo vestibolare inferiore fino al complesso dei nuclei vestibolari (soprattutto il nucleo vestibolare laterale). Da qui le informazioni sono veicolate, attraverso Il tratto vestibolo-spinale laterale omolaterale, fino alle corna anteriori del midollo spinale a livello di C2-C5. Quindi, attraverso il nervo accessorio spinale, arrivano al muscolo sternocleidomastoideo (SCM) omolaterale.
La via che origina dai recettori sacculari provoca un’inibizione degli alfamotoneuroni che innervano lo SCM ipsilaterale.
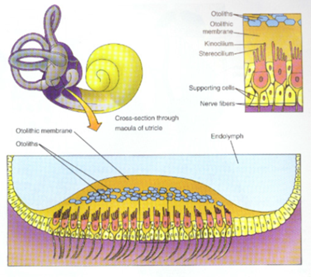
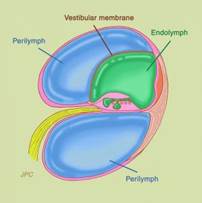
membrana otolitica, che contiene numerosi cristalli di carbonato di calcio detti otoconi. Gli otoconi rendono la membrana otolitica notevolmente più densa e pesante rispetto alle strutture ed ai liquidi circostanti, di modo che quando la testa si flette la forza di gravità determina uno spostamento relativo della membrana otolitica rispetto alla macula che si traduce in una deflessione dei ciuffi di ciglia. Un simile spostamento relativo della membrana otolitica rispetto alla macula avviene quando la testa eretta è sottoposta ad un movimento di traslazione lineare, come durante la deambulazione; la maggior massa relativa della membrana otolitica fa sì che questa rimanga temporaneamente indietro rispetto al movimento della macula, inducendo così un transitorio spostamento delle ciglia. Nella normale posizione anatomica del capo la macula dell’utricolo è posta sul piano orizzontale mentre quella del sacculo è posta su quello verticale
|
|
Fig.1b: Schema del utricolo e del sacculo. Questi organi sensoriali dell’orecchio interno principalmente rispondono alle accelerazioni lineari, come l’orientamento a causa della gravità, ma il sacculo è anche sensibile ai suoni. Questa è la base della prova VEMP. |
Inoltre, ogni macula è divisa in due parti da una linea arbitraria detta striola, attorno alla quale sono orientati gli assi di polarizzazione dei ciuffi di ciglia: nell’utricolo i ciuffi sono orientati con il chinociglio rivolto verso la striola, mentre nel sacculo hanno orientamento contrario (Figura 1). La disposizione opposta dei ciuffi intorno alla striola fa sì che ogni stimolo induca la deflessione verso il chinociglio nelle cellule poste su un lato della striola e dal lato opposto rispetto al chinociglio in quelle disposte controlateralmente. In altri termini, ogni stimolo indurrà contemporaneamente la depolarizzazione di alcune cellule e la iperpolarizzazione di altre. Inoltre, a causa del decorso arcuato della striola, l’orientamento dei ciuffi varia sistematicamente in modo da rilevare stimoli provenienti da tutte le direzioni. In particolare, l’utricolo è sensibile a movimenti della testa sul piano orizzontale, come flessioni laterali della testa o movimenti traslatori in senso laterale, mentre il sacculo risponde a movimenti sul piano verticale, come movimenti dal basso verso l’alto o in direzione antero-posteriore sul piano sagittale. Inoltre, le macule dell’utricolo e del sacculo dei due lati hanno una disposizione simmetrica e perciò all’eccitazione delle cellule cigliate di un lato corrisponde l’inibizione dei recettori contralaterali corrispondenti. In questo modo, le informazioni relative ai movimenti del capo nelle diverse direzioni che arrivano al sistema nervoso centrale sono il risultato dall’attività combinata degli organi recettoriali dei due lati
|
|
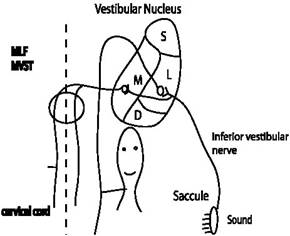
Fig.2 circuito del VEMP. Il suono attraverso l’orecchio medio stimola il sacculo, che attiva il nervo vestibolare inferiore,il nucleo vestibolare laterale, il nucleo del nervo XI° ed infine il muscolo sternocleidomastoideo (soprattutto ipsilaterale). |
Nella fig. 2 viene raffigurato il percorso che dovrebbe dare la risposta VEMP. Il suono stimola il sacculo, che attraverso il nervo vestibolare (inferiore) ed il ganglio vestibolare raggiunge il nucleo del tronco cerebrale. Da lì, gli impulsi vengono inviati ai muscoli del collo attraverso il tratto vestibulospinale mediale (MVST).Per la maggior parte dei muscoli, l’effetto netto della stimolazione sacculare è l’inibizione, ma l’eccitazione della stimolazione elettrica del sacculo è stata registrata in alcuni muscoli di qualche animale (Uchino et al., 1997; Kushiro et al., 1999).
Mentre la letteratura clinica relativa ai VEMPs suggerisse che essi sono quasi interamente di origine sacculare , la letteratura degli animali non supporta questa affermazione. Molti studi di scimmie Visualizza tutti i 5 endorgani vestibolare di fase serratura del forte fa clic (Xu et al., 2009). Tuttavia, in base alle pubblicazione di oggi (2011), sembra ragionevole supporre che, mentre le cose non sono completamente chiare , la principale fonte del VEMP è il sacculo. I VEMP’s evocati dai suoni e registrati dal collo sono per lo più quasi completamente unilaterali. (Colebach et al, 1994; Uchino et al, 1997; Kushiro et al, 2000; Murofushi et al, 1996; Wilson et al, 1995), ma in clinica pratica, questo non può essere conteggiato su (vedi esempio sotto).

|
|
|
Fig.3 a-b Breve descrizione: l’esame dei VEMP’s viene utilizzato per la valutazione soggettiva della forma d’onda del sacculo (parte dell’organo dell’equilibrio). |
|
|
|
Fig.3c VEMP test at 500Hz |
|
|
|
Fig.4: Le attrezzature utilizzate per la registrazione di un VEMP :ICS OTOMETRICS |
Metodologia:
I VEMP’s sono registrati da un computer per potenziali evocati, con generatore di suoni, e con gli elettrodi di superficie applicati sui muscoli del collo o su altri muscoli, se questo interessa. La figura n°4, sopra riportata, illustra il montaggio degli elettrodi che noi utilizziamo nel nostro laboratorio, , un computer ICS desktop,od un Interacoustics .od un Amplaid mk12
Non è difficile ricercare i VEMPs, ma ci sono diversi aspetti tecnici da considerare. Un tecnico (audiometrista) può imparare la tecnica di base in 30 minuti circa. La risposta registrata è molto grande e fintanto che l’audiometrista ,che fa il test, è attento ai dettagli [a:inviando il suono ad entrambe le orecchie,b:corretto posizionamento di inserti o cuffie, c: il paziente deve mantenere la testa sollevare per tutto l’esame,d:elettrodi che debbono mantenere una impedenza corretta)] è molto semplice. Ci sono poi degli accorgimenti che richiedo più tempo per essere appresi.
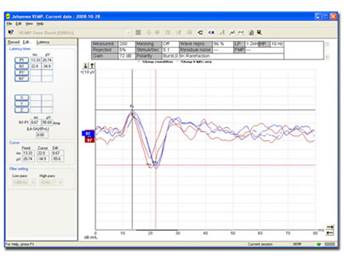
La figura sotto riportata mostra il report(la stampa) di un VEMP’s. La risposta VEMP’s consiste in una prima onda positività (P1 o P 13), seguita da una negatività (N1 o N23), vedi figura 4. Si tratta di un potenziale evocato. Il P1 è generalmente positivo, in alcuni VEMP’s può essere negativo, in base al posizionamento degli elettrodi. La misura più affidabile dei VEMP’s è l’ampiezza della risposta (Isaradisaikul et al, 2008).
I VEMPS più tardivi hanno una soglia di stimolo più bassa e non sembra siano di origine vestibolare. Non si è ben compreso il significato di queste onde e vi è qualche dubbio su quest’ultima interpretazione(potenziali non vestibolari) — potrebbero semplicemente fare parte dello stesso treno di onde(Spike). Siccome i VEMP’s sono facilmente evocati(prodotti), senza la necessità di una elaborazione elettromiografica (EMG ) e poichè i picchi EMG si producono più o meno con la stessa latenza delle onde VEMP, l’interpretazione delle onde tardive come: “parte un treno di onde” può essere una spiegazione ragionevole. In altre parole, le onde tardive possono fare parte della stessa risposta. Non vi è alcuna ragione di acquistare un sistema che rettifichi o normalizzi i VEMP. Avere uno strumento con “queste caratteristiche”è inutile.
Soglie superiori al normale o ampiezze più basse si possono trovare sia in pazienti con disturbi del sacculo, sia in pazienti con ipoacusie trasmissive. Si registrano comunemente ampiezze ridotte quando ci sono sofferenze del nervo vestibolare. Nei , pazienti con il fenomeno di Tullio (vertigini evocate da suoni intensi) si sono registrati VEMPS con soglie inferiori( soglia più bassa) a quelle normali, così come ampiezze asimmetriche. Un aumento della latenza P13 si può registrare in presenza di disturbi del sistema nervoso centrale(Murofushi et al, 2001), in realtà sono state rincontrate molto raramente, e la maggior parte delle latenze allungate è dovuta ad errori di tecnica.
|
|
|
Fig.5 VEMP’s normali. L’onda principale P1, è situata a circa 13 msec. L’ampiezza è di circa 250 microvolt (che è di gran lunga al di sopra del limite inferiore del normale, circa 70). E’ presente un artefatto elettrico visto a 0 msec. Su il lato sinistro. Questo può essere ignorato. |
La regola generale è che le ipoacusie trasmissive fanno scomparire i VEMP’s e che le ipoacusie neurosensoriali modificano poco o nulla per VEMP’s. I due grafici qui di seguito riportati illustrano questa regola.
Nei pazienti che soffrono di una neurite vestibolare e sottoposti a esame nei primi 8 giorni dopo la comparsa della grande crisi vertiginosa, noi abbiamo potuto dimostrare che questo esame era alterato solamente in due terzi dei pazienti. Questi risultati dimostrano che la lesione virale interessa il più delle volte solo il nervo vestibolare superiore e che il nervo sacculare e quindi il nervo vestibolare inferiore sono risparmiati. Essi corroborano i dati ottenuti in videonistagmografia che hanno dimostrato che, in molti di questi pazienti, il nistagmo oculare presenta una componente contemporaneamente orizzontale e verticale (vedi. sopra). La presenza di una componente verticale attesta l’assenza di coinvolgimento del nervo vestibolare posteriore e quindi possibilmente la conservazione del nervo vestibolare inferiore. Questo test ha qui un valore prognostico, in quanto il recupero di una normale attività del nervo vestibolare è più rapido e più frequente nelle lesioni limitate al nervo vestibolare superiore.
Numerosi pazienti portatori di neurinomi dell’acustico sono stati sottoposti a esame prima e dopo l’intervento. Questa lesione tumorale benigna è spesso responsabile di una disfunzione del nervo sacculare, il che conferma anche la nozione tipicamente ammessa che essa abbia origine nel nervo sacculare. Dal momento che lo stimolo click è maggiore dello stimolo short tone burst, è frequente che non si individuino le onde precoci in caso di test con gli stimoli click mentre sono riscontrate con l’aiuto di stimoli short tone burst (Figura 6 ). Nel postoperatorio, abbiamo dimostrato che questi potenziali precoci erano definitivamente aboliti, il che ha permesso di escludere la possibilità di un compenso centrale di questo riflesso sacculo-spinale.
Fig.6
Test dei potenziali evocati miogeni (PEM) indotti da suoni di 100 db (click et short tone bursts [STB]) in un paziente che soffre di un neurinoma dell’acustico. I PEM sono aboliti con lo stimolo click mentre sono presenti quando l’esame è effettuato con lo stimolo short tone burst, il che dimostra una disfunzione parziale del nervo sacculare dal lato del neurinoma.
Infine, nelle oscillopsie e nelle sensazioni di beccheggio non spiegate dai test che valutano il funzionamento del nervo canalare orizzontale, questo test può risultare anomalo, cosa che spiega dunque in parte la sintomatologia.
In conclusione, questo esame permette di valutare il funzionamento dei recettori sacculari e delle vie sacculo-spinali. Presenta un triplice interesse: diagnostico, prognostico e terapeutico. È importante rilevare che esso non presenta mai compensazione dopo lesione, a differenza del test della rotazione intorno a un asse inclinato (test RAIG), il che rappresenta il suo valore in caso di perizia.
|
|
|
|
Fig.7: VEMP’s ottenuti in un paziente con modesta ipoacusia trasmissiva sinistra. E’stato utilizzato un navigatore Bio-Logic Pro. I VEMP’s sulla destra sono normali, i VEMP’s sulla sinistra, del tutto assenti. P1 indica il potenziale che si registra a13 msec. (chiamato P13) |
|
|
Fig.8a: VEMP ottenuti in un individuo con una profonda ipoacusia neurosensoriale destra, utilizzando un navigatore Bio-Logic Pro. Ciò dimostra che per ottenere (neurosensoriale) un VEMP non è necessario un udito normale. Questa registrazione è stata ottenuta mediante stimolazione binaurale (vengono riportate le valutazioni su questa metodica). |
|
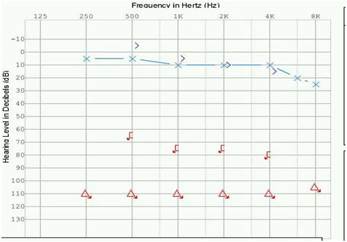
Fig.8b Viene riportato l’audiogramma del paziente a cui sono stati praticati i VEMP’s. Vi è una profonda perdita di udito, presumibilmente neurosensoriale.
Un potenziale errore, che si può commettere,in un paziente con una grave ipoacusia neurosensoriale, è che spesso non si è in grado di stabilire se nella perdita uditiva sia presente una componente trasmissiva: esempio, paziente con otosclerosi molto avanzata. Così, si potrebbe erroneamente concludere, in base all’assenza del VEMP’s,che la funzione vestibolare sia assente. I VEMP’s per via ossea sono un metodica che si può utilizzare per superare questo problema.
Montaggio degli elettrodi
I migliori risultati tecnici si hanno, come illustrato di seguito, posizionando gli elettrodi sulla metà del terzo anteriore dei muscoli del collo (sternocleidomastoideo) e con il paziente in posizione supina che mantiene la testa sollevata, utilizzando (questi) muscoli anteriori del collo. Gli esaminandi sono istruiti a tendere i muscoli durante la stimolazione acustica ed a rilassarli durante le pause. Se i muscoli del collo non sono attivati, non vengono prodotti VEMP’s. Il riflesso scatena un EMG tonico – ancora una volta – se non si attivano i muscoli del collo, non si ottengono risposte. Infine se si ottenere una risposta senza l’attivazione dei muscoli del collo, questa non è un VEMP (forse un PAM? Vedi sotto).
Gli elettrodi EMG non devono essere del il tipo che utilizzano un clip per collegare la placca all’elettrodo, perché la testa del clip si muove intorno durante il VEMP. Questi tipi di elettrodi producono con il movimento enormi quantità di rumore . Invece, i devono essere utilizzati gli elettrodi che sono saldati al cavo.
I pazienti con un collo grasso hanno risposte più bassa, poiché il segnale origina dal muscolo che è sotto il grasso e deve pertanto percorrere una distanza più lunga . Allo stesso modo, le persone con collo lungo hanno risposte più tardive , poiché in questi casi il segnale deve di nuovo percorrere una distanza più lunga (Chang et al., 2007)
Alcuni pazienti non sono in grado di tenere la testa con l’angolo indicato. In questo caso, alcuni esperti raccomandano semplicemente di inclinare l’intero corpo di circa 30 gradi, in modo che sia necessaria meno forza da parte del paziente per tenere la testa sollevata (Colebatch, comunicazione personale). Si ritiene questa un’ottima opzione, ma al momento ,con questa tecnica ,non sono state ancora stabilite le norme per determinare i gradi di sollevamento della testa.

Fig.9a

Fig.9b
Un altro (ma non buon ) metodo per ottenere l’attivazione è quello di avere i pazienti seduti in posizione verticale con il mento ruotato controlateralmente alla spalla con il muscolo SCM teso. Questa non sembra una buona tecnica, perché non si ha modo di stabilire quanta tensione il paziente sta producendo, è una tecnica faticosa, ed i pazienti possono involontariamente fare uno sforzo diverso sul lato destro rispetto al sinistro, senza che l’esaminatore riesca a riconoscere queste differenti applicazioni di forza muscolare. E’altresì noto che la posizione di testa sul corpo può cambiare le risposte VEMP. Questa è un ulteriore aggiunta alle variabili. Siccome la risposta è generalmente ipsilaterale,teoricamente si potrebbero utilizzare stimoli bilaterali e registrazione bilaterali per ridurre il numero di prove (Huang et al, 2006; Young, 2006). Si è utilizzata questa metodica, ma è stata poi scartata per i motivi che in seguito verranno illustrati . Questa tecnica ha il vantaggio di utilizzare (durante la registrazione),per ogni lato lo stesso stimolo ,il chè riduce notevolmente la variabilità. I limiti , per un’ampiezza normale ,con la tecnica di registrazione a testa flessa, variano da 70 a 700. Per quanto riguarda il limite superiore, al momento attuale,non vi è alcuna malattia che presenti dei VEMPs più ampi su entrambi i lati rispetto al normale e che pertanto possa essere diagnosticata, ma in base alla esperienza clinica, nei pazienti con iperacusia si possono riscontrare dei VEMPs particolarmente ampi.
|
|
|
Fig.9c.VEMP’s monoaurali che mostrano l’errore di utilizzare stimolazioni binaurali con registrazioni bilaterali. E’ presente una risposta sul lato controlaterale sinistro, si potrebbe erroneamente supporre la presenza di un VEMP’s sebbene il paziente abbia subito una sezione del nervo vestibolare. Si consiglia di non utilizzare la stimolazione binaurale. |
Tuttavia, si ritiene che sia errato utilizzare stimolazioni binaurali con registrazioni bilaterali. La figura n°8 ,sopra riportata,illustra il motivo per cui non viene utilizzata questa tecnica. I VEMPs sono “generalmente ipsilaterali”, questo non significa che essi siano sempre, al 100% ipsilaterali. Gli artefatti possono superare tutta la linea mediana, il che riduce di molto l’applicazione di uno stimolo acustico binaurale. Poiché lo sterno è molto vicino ai muscoli sternocleidomastoidei, ci può essere anche un artefatto, dovuto al “volume di conduzione”, nel senso che l’attività elettrica da un lato, può determinare confusione dall’altro lato (Li et al, 1999). Il fine della tecnica ipsilaterale è che-se si sta tentando di “escludere” ogni vestigio(ricordo) della rimanente funzione vestibolare – non bisogna utilizzare un VEMP bilaterale.
Stimoli sonori:
Clicks o tone bursts (tipicamente a 95-100 Db. nHL. od ad intensità maggiore) sono ripetutamente presentati in ciascun orecchio, ad intervalli di 200 msec (5/secondo). La frequenza ottimale è compreso tra 500 e 1000 Hz. Lo sterno è generalmente utilizzato come riferimento e la fronte come terra. E’stato evidenziato che i polsi potrebbe essere una scelta migliore per l’elettrodo di riferimento (Li et al, 1999).
Si raccomanda di non inviare mai il suono binauralmente. E’ certamente una tecnica più veloce, ma riduce la capacità di localizzare il lato della lesione a causa del crossover. Questa raccomandazione, si basa su alcune sfortunate esperienze cliniche in cui la stimolazione binaurale ha condotto a diagnosi errate, questa raccomandazione differisce dai dati di altri AA in letteratura (.Young, 2006).
I potenziali miogenici(muscolari) sono amplificati, bai-passati da filtri (5-1K Hz), ed in media elaborati per almeno 100 presentazioni. La risposta EMG evocata nel collo è elaborata e presentata come un VEMP (vedi figura 2). Per l’onda l’N23-P13 viene misurata la latenza, ampiezza e soglia. L’ampiezza è la misura più affidabile (Isaradisaikul et al, 2008).Le latenze sono meno affidabili, ma sono utili per decidere se una determinata forma d’onda è una “VEMP” o solo rumore.
Data l’elevata intensità del suono usato per evocare queste risposte, dovrebbero essere utilizzati inserti attentamente calibrati. Le cuffie sono meno affidabili degli inserti, perché anche piccoli errori di posizionamento delle cuffie potrebbero causare cambiamenti sostanziali nell’intensità del suono che raggiunge la Membrana Timpanica(MT), e pertanto determinare la perdita di uno VEMP.
Il VEMP è generalmente veloce e facile da ottenere perché si tratta di un forte potenziale e per elaborare 100 presentazioni basta solo un minuto di stimoli. Ciò significa che il VEMP’s può essere facilmente ripetuto. In base all’esperienza , come minimo su ciascun lato si dovrebbero effettuare e registrare almeno due ripetizioni (ciascuna di 100 presentazioni), per essere sicuri che il VEMP sia riproducibile o assente, come può accadere. Generalmente sono presentati tre volte. Quando le prime due ripetizioni sono di grande ampiezza e quasi identiche è inutile continuare. Normalmente viene utilizzata la registrazione monoaurale.
Si consigliano i toni puri,rispetto ai clicks, per motivo sotto riportati. Risposte simili vengono registrate utilizzando dei toni puri invece che dei clicks (Murofushi, Matsuzaki et al. 1999; Welgampola e Colebach, 2001; Cheng, Huang et al. 2003). Ciascun tono a 500 o 1000 Hz viene presentato ad una frequenza si 5/sec. Gli AA mensionati propongono di utilizzare una intensità di 120 dB. SPL. Ottimo è l’impulso della durata di 7 msec. Il vantaggio del tono puro(tone burst) rispetto a un clicks è che richiede uno stimolo di intensità assoluta minore. Ciò è importante se si utilizzano apparecchiature che non producono in maniera ottimale forti stimoli sonori. Si ha il sospetto che i clicks producano latenze maggiori e più variabili. Al momento attuale,si ha l’impressione che l’ampiezza sia più utile della latenza,il valore clinico della misurazione dell’ampiezza (per essere sicuri di avere un VEMP), resta un po’ dubbio.
Rauch et al (2004) utilizzando toni puri suggeriscono che la frequenza ottimale è 500 Hz .Questi AA propongono il monitoraggio dell’attività EMG nel corso dell’esame per essere sicuri che i muscoli SCM siano attivati e che se i muscoli non vengono attivati, non venga registrato un VEMP. Nel loro studio, uno VEMP è stato considerato assente quando la risposta non è ripetibile e che le risposte residua con meno di 3 µv siano da considerate rumore. Essi suggeriscono che le soglie sono più utili dell’ampiezza. Timothy C. Hain ritiene che le ampiezze siano più utili della soglia e che diano un protocollo ben standardizzato. La letteratura suggerisce che le ampiezze sono più affidabili delle soglie (Isaradisaikul et al, 2008).
A causa dell’affaticamento, non si possono fare entrambe le cose – 3 ripetizioni nonché ricerca delle soglie,. Timothy C. Hain ha anche trovato molti pazienti con bassa soglia, ma senza deiscenza del canale semicircolare. Ci sono molte discussioni, sui problemi delle soglie. dovute a problemi tecnici .
Problemi Tecnici nell’ Esecuzione dei VEMPs
Quasi tutti i problemi dei VEMPs sono causati da errori dell’operatore.
Il VEMP è un test,relativamente nuovo e finora, i costruttori non hanno realizzato dei protocolli che assicurino una garanzia di qualità. Quando i VEMP’s non hanno alcun senso nel contesto clinico generale, sarebbe bene ripeterli nella successiva visita, e riaggiornare il tecnico se vi è una grande discrepanza tra la clinica e gli esami. Il problema più grande è garantire l’attivazione dei muscoli del collo , da un lato si può eseguire un VEMP con molto successo se la testa del paziente verrà flessa verso l’alto contro gravità, dall’altro fare questo è faticoso. Un problema comune di controllo della qualità nella VEMP è quella del tecnico che consente al paziente di mettere la testa in giù durante la prova. I VEMPs possono essere eseguito con la testa rivolta attivamente verso un lato, affaticando così solo una parte piuttosto che entrambe, ma questa procedura è anche insidiosa, in quanto è meno affidabile e produce potenziali (risposte)più piccoli(Wang e Young, 2006). Un suggerimento per i produttori è che potrebbero aggiungere ,alla strumentazione ,un metodo per determinare se la testa è fuori dal tavolo (un semplice sensore di pressione potrebbe darci queste informazioni). Alcuni ulteriori commenti sulla biomeccanica dei VEMP sono qui trattati
Nei pazienti che non possono collaborare,un gran problema è quello di assicurasi che i muscoli del collo siano attivati. Si consideri, ad esempio, il tentativo di fare un VEMP in un bambino. Come assicurarsi che il muscolo del collo è attivata? Si tratta di un problema intrinseco con fare i VEMP’s nei bambini molto piccoli, e forse non dovrebbe essere eseguito su tutti. Al minimo, i VEMP’s eseguiti su pazienti che non collaborano dovrebbe essere praticato con apparecchiature che possino controllare l’EMG.
Un’altra tecnica “Gotcha” nei VEMP è il suono non inviato nell’orecchio. Questo è molto importante! E’ normale che ci sia qualche errore se gli inserti sono collocati asimmetricamente , se il cerume occlude un lato, o in presenza di un generatore di suono difettosi Poiché i VEMP’s vengono evocati a livelli sonori di gran lunga superiori alla soglia prevista dalla maggior parte dei potenziali evocati, piccole cose, come porre un’ inserto di misura sbagliata in un orecchio, come altri errori possono fare una grande differenza. Soli 10 Db. di differenza possono essere importanti. Per quanto riguarda il controllo degli inserti, ti suggeriamo di controllare un suono di ogni singolo VEMP. Il modo più semplice per farlo è di eseguire un primo VEMP senza muovere la testa – questo sia per valutare artefatto PAM (vedi sotto), come pure in grado di fornire un buon momento per fare un controllo del suono. Sarebbe opportuno per il protocollo dei VEMP’s effettuare un controllo di soglia di a 500 Hz, utilizzando gli inserti ed il trasduttore dell’apparecchiatura dei potenziale evocato, ma finora questo non è possibile.
Soglie può anche essere problematico. Ci sono diversi problemi importanti. La prima è che vi sia un elemento soggettivo per la registrazione della soglia. La risposta di una paziente potrebbe essere il rumore di un’altra persona. La seconda è che se ricerca la soglia, non si può ripetere a lungo (perché le persone si stancano). Il terzo è che non sempre funziona – basse soglie non sono sempre accompagnate da prove radiografiche di deiscenza del canale superiore. Abbiamo incontrato molti pazienti con soglie di 60, ma CT normale dell’osso temporale. La nostra posizione attuale è che ricercare le soglie non dovrebbe essere fatto di routine, in quanto impedisce di avere un’ ampiezza affidabile.
|
|
|
Fig.10 artefatto VEMP (presente prima della risposta), a causa di un errore in inserimento del generatore di suono(inserto) collocato troppo vicino agli i elettrodi. |
Artefatto Elettrico FIG 10 I VEMP’s sono enormi (rispetto al ABR o ECOG) e non ci dovrebbe essere artefatti elettrici casuali. Se si riscontra un artefatto dovuto allo stimolo, o ondulazioni sinusoidali nella traccia, è molto probabile che gli elettrodi non siano buoni, o che il generatore di suoni sia collocato troppo vicino agli elettrodi, che l’impedenza sia troppo alta, o che l’apparecchiature per i potenziali evocati abbia bisogno di assistenza.
Sopra la traccia dei VEMP riportati sopra, c’è un artefatto dovuto allo stimolo. Dopo che il generatore del suono è stato spostato l’artefatto e’ scomparso, ci siamo resi conto che il generatore di suono non può essere molto vicino alla porta EMG. Il generatore dei suono produce un campo magnetico che induce una forte artefatto, se uno lo mette vicino a uno dei componenti elettrici del preamplificatore
Altri artefatti. Occasionali pazienti hanno “VEMP come potenziali” (? VLP), che non sono VEMP’s.
In alcuni casi, questo è causato dal ” muscolo posteriore auricolare (PAM)”. Il PAM è un piccolo muscolo dietro l’orecchio che può “muovere”il padiglione auricolare. In realtà, ci sono tre di questi muscoli – muscoli auricolari posteriore, anteriore e superiore – tutti organi vestigiali, ma nel tempo la funzione si è ridotta o è scomparsa. Il PAM è innervato dal nervo facciale. La latenza della risposta è di circa 11 msec, il che determina la sovrapposizione con VEMP. (Funahashi et al, 1992). La letteratura su PAM è confusa – alcuni autori può avere confuso dei VEMP molto ampi per risposte PAM, e viceversa. Cfr. Gibson (1978) per una revisione della letteratura più anziani.
Per escludere un potenziale PAM, è possibile eseguire il VEMP’S in un primo tempo senza fare contrarre il SCM.
In altri casi, questo è dovuto al “volume di conduzione” – l’attività elettrica da un lato appare dall’altra parte. I problemi di “Volume di conduzione” si possono risolvere con la stimolazione monoaurale. Per le ragioni sopra riportate , riteniamo che stimolazione monoaurale è una buona idea.
Inferenza logica. Mentre i VEMP’s sono “generalmente ipsilaterali”, questo non significa che essi sono presenti sempre, al 100% unilateralmente . Se si sta tentando di “escludere” ogni vestigio di una funzione vestibolare rimanente – non utilizzare una stimolazione VEMP binaurale . Come quasi sempre se si sta cercando di localizzare il lato della lesione, riteniamo che sia meglio evitare un VEMP’s bilaterale. L’unica eccezione è quando si sta cercando di diagnosticare una perdita vestibolare bilaterale, in questo caso va bene la stimolazione bilaterale..
ALTRI METODI PER OTTENERE VEMP’s“
VEMP rettificato”
Il termine “rettifica” è usato in modo confuso da alcuni per indicare la normalizzazione – il segnale VEMP non rettificato proveniente è diviso da una media pre-stimulus superficie rettificata EMG Lee et al.(2008). Il ragionamento è che la dimensione del segnale EMG superficiale può variare a seconda del posizionamento dell’ elettrodo o della differente attivazione muscolare o composizione strutturale del corpo. Chang et al (2007) hanno dimostrato che i pazienti con grandi quantità di tessuto sottocutaneo (cioè grasso) nel collo hanno sovente VEMP’s più piccoli. Questo è ragionevole e solo di buon senso e un buon motivo per la normalizzazione.
La variabilità dovuta a questi problemi tecnici potrebbe essere ridotta utilizzando alcune modifiche quando ci sono questi fattori. Questa tecnica sembrerebbe abbastanza ragionevole per utilizzare un differente collocamento degli in base alla anatomia del collo. Non sembra ragionevole utilizzare una differente attivazione muscolare regolazione delle differenze di attivazione muscolare, perché questo potrebbe facilmente cambiare durante i due minuti di registrazione VEMP ..
Si è sperimentata questa tecnica e deciso che era peggio posizionare in maniera molto attenta gli elettrodi, collocandoli su e giù ( garantendo una uguale attivazione di entrambi i muscoli SCM ) . In altre parole, abbiamo scartato questa tecnologia.
D’altro canto, Lee et hanno riferito che, con questa rettifica si avevano migliori ben VEM’s (2008). Questi autori non hanno utilizzato la nostra tecnica favorita – invece di alzare la testa in posizione diritta, avevano soggetti che sollevavano e giravano le loro teste . Perché questo metodo introduce delle variabilità a causa della rotazione della testa, a nostro parere, il loro disegno sperimentale semplicemente era destinato a fallire. Nel complesso, ci sembra che il loro metodo possono essere migliore rispetto al metodo poveri di rotazione a destra. Attualmente, si è del parere che un VEMP ottenuto dalla sollevamento attento con la testa dritta sia superiore. Tuttavia, siccome la tecnologia migliora nel tempo, questa tecnologia potrebbe essere cambiata.
A questo proposito, ci piacerebbe vedere un output VEMP che fornisca al clinico più dati – l’ampiezza VEMP “grezza”, il “VEMP grezzo” integrato e l’EMG rettificata e i valori “normalizzati”. Si vorrebbe anche vedere una macchina VEMP che stampa l’intero raster di attivazione EMG durante il processo – per assicurarsi che il paziente stia attivando il collo e che gli elettrodi stiano saldamente fissati.
Non c’è spazio per altri miglioramenti,per esempio, uno stimolo VEMP che ha delle “lacune” nello stimolo sonoro potrebbe permettere un algoritmo intelligente che ha utilizzato le lacune per calcolare un segnale di normalizzazione più utile. Inoltre, il termine “VEMP rettificato”, dovrebbe essere sostituito con la più ragionevole termine “VEMP normalizzato”. Il termine ” VEMP corretto” è ragionevole, invece che “VEMP con correzione”
VEMPs dei muscoli oculari, o-VEMP’s.
Recentemente si è sostenuto che tone bursts inviati per via ossea attivano il sistema vestibolare, producendo potenziali nei muscoli extraoculari ( Jombic e Bahyl, 2005). Ci sono alcune prove che questi potenziali siano di origine utricolare . E’ necessario molto più lavoro per caratterizzare queste risposte. Mentre sarebbe molto utile avere un test utricolare, si ha qualche dubbio che le cose siano così semplici.
VEMPs nei muscoli degli arti.
Si sono studiati i VEMP’s generati con stimolazioni acustiche nel gastrocnemio e nei tricipiti (Ruddissil et al., 2008; Cherchi et al., 2009). Queste risposte si verificano a molto più lunga latenza rispetto di SCM VEMP. Resta ancora da stabilire la loro utilità.
VEMPs per via ossea
Toni per via ossea possono essere utilizzato per ottenere VEMP’s. I potenziali possono essere evocati stimolando per via ossea fronte o mastoide,con alcune differenze di polarità e di lateralizzazione del potenziale che ne deriverà. Si possono evocare VEMP’s utilizzando per via ossea toni di frequenze di circa 200 Hz. I vibratori clinici per via ossa ,generalmente richiedono un’ulteriore amplificazione per produrre stimoli abbastanza forti per ottenere VEMP’s .I VEMP’s per via ossea non sono così ben lateralizzati come i VEMP’s evocati dai click . (Sheykholeslami, Murofushi et al. 2000)
![]() Le sordità di trasmissione costituiscono un limite potenziale di questo esame quando gli stimoli sonori sono trasmessi per via aerea. In effetti, in questi casi, l’onda sonora erogata a 100 dB non arriva all’orecchio interno a intensità sufficiente a provocare un’attivazione sacculare. Le onde P13 e N23 non sono pertanto riscontrate dal lato della sordità di trasmissione anche quando la funzione sacculare può essere normale (falsi negativi). Tuttavia, l’applicazione di short tone bursts per via ossea (applicazione sulle mastoidi di short tone bursts con l’aiuto di un vibratore) (Figura 11) permette di valutare la funzione del recettore sacculare e di eliminare anche i falsi negativi
Le sordità di trasmissione costituiscono un limite potenziale di questo esame quando gli stimoli sonori sono trasmessi per via aerea. In effetti, in questi casi, l’onda sonora erogata a 100 dB non arriva all’orecchio interno a intensità sufficiente a provocare un’attivazione sacculare. Le onde P13 e N23 non sono pertanto riscontrate dal lato della sordità di trasmissione anche quando la funzione sacculare può essere normale (falsi negativi). Tuttavia, l’applicazione di short tone bursts per via ossea (applicazione sulle mastoidi di short tone bursts con l’aiuto di un vibratore) (Figura 11) permette di valutare la funzione del recettore sacculare e di eliminare anche i falsi negativi
Fig.11 Test dei potenziali evocati miogeni indotti con short tone bursts erogati per via ossea con l’aiuto di un vibratore.
In presenza di disfunzioni del sacculo (labirinto) ci sia attende che i potenziali evocati vestibolari siano alterati indipendentemente dal fatto che lo stimolo sia inviato per via aerea o per via ossea, mentre in caso di otosclerosi, ad esempio, ad una risposta assente se lo stimolo viene inviato attraverso la cuffia corrisponde una risposta del tutto normale quando lo stimolo giunge direttamente al labirinto attraverso la vibrazione posta sull’osso dietro l’orecchio. L’esame è molto importante in presenza di componenti trasmissive all’esame audiometrico ed in particolare di sospetta otosclerosi, per verificare la possibile presenza di una disfunzione labirintica associata (evenienza frequente) così come per verificare la reale responsabilità dell’alterazione labirintica nel determinare la mancata risposta. In pratica viene eseguito ogni volta che si evidenzi una alterazione del tracciato per via aerea, eseguito di routine in tutti i pazienti.
A questo esame viene anche applicato l’OTR con VNG 3D
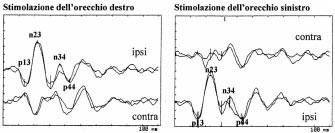
Fig.12
Ocular Tilt (Counterrolling)Reaction = “Reazione di controrotazione oculare” L’OTR o OCR è un metodo affidabile, se si esclude lo studio della verticale soggettiva, meno riproducibile, per appurare lo stato funzionale dell’utricolo, importante area del labirinto, la cui alterazione è la principale causa, sempre dimostrabile se la si cerca, di disequilibrio e vertigine soggettiva, con o senza vere e proprie crisi di vertigine rotatoria. Richiede indispensabilmente l’impiego di un sofisticato sistema di analisi dei movimenti torsionali dell’occhio, registrabili attraverso l’analisi delle irregolarità dell’iride con la VNG 3D. Viene eseguito quando il paziente riferisce disturbi dell’equilibrio accompagnati o meno da vertigini ricorrenti a crisi.
VEMP con stimolazione galvanica
Uno stimolo Galvanico può anche produrre un VEMP’s (Watson e Colebatch 1998). Questa tecnica baipassa il sacculo e quindi potrebbe essere usato per separare il sacculo,dalle fibre nervose e da lesioni più prossimale. Tecnicamente è complicato perché vi è una grande artefatto elettrico associato con lo stesso stimolo. Ciò richiede una metodologia di sottrazione.
Siccome tutto il nervo vestibolare viene stimolato da un impulso galvanico, ci si aspetterebbe che il VEMPs galvanico sia insensibile alle lesioni nervose parziali (cioè non sezione del nervo vestibolare), ma anche molto sensibile alla perdita completa del nervo vestibolare. Così un VEMP’s galvanico assente potrebbe essere utilizzato come un metodo razionale per evitare di fare più chirurgia. Per lo stesso motivo,un VEMP’s galvanico non dovrebbe essere in grado di distinguere tra un danno endorganico (sacculo) ed un danno nervoso del vestibolare inferiore, perché ci si aspetterebbe che il VEMP’s galvanico dovrebbe essere presenti anche se il nervo vestibolare inferiore è danneggiato.
Un VEMP’s Galvanico può tuttavia rivelarsi utile utilizzando la informazione di soglia o di latenza. I VEMP’s Galvanici non sono soppressi dalla corrente anodale , il che fa pensare che i VEMP’s non richiedono una afferenza irregolare (Bacsi e Colebach, 2003). Sono necessarie più ricerche.
VOR evocato da ClicK
Una prova strettamente collegata con i VEMP’s è stata descritta molto recentemente da Halmagyi e altri (2003). Un evento innescato con il computer viene utilizzato per rilevare una risposta elettro-oculografica ad un intenso clicks – di intensità variabile da 80 a 110 dB. 128 clicks sono stati inviati ad una frequenza di 5 / sec. da 60 a 110 dB, con steps di 10 dB . Questa prova non è generalmente disponibile, ma sembra promettente. La tecnologia è molto simile a VEMP’s, e forse potrebbe anche essere ottenuti con la strumentazione simile. Esso può essere un buon candidato per sostituire la prova di Tullio.
Utilità Clinica dei VEMP’s
Che cosa si prova con il test?
La figura 2 illustra il percorso per la risposta VEMP’s, che comprende la sacculo, il nervo vestibolare inferiore, il nucleo vestibolare, il tratto vestibulospinale mediale, il nucleo ‘accessorio, l’ XI° nervo, ed infine il muscolo .sternocleidomastoideo. Un VEMP’s anomalo potrebbero essere dovuto ad una anomalia in una qualsiasi di queste strutture. Il suono che determina un VEMP’s richiede la trasmissione del suono nell’orecchio interno, il che significa che è necessario un’ orecchio medio intatto. Mentre VEMP’s sono attualmente attribuito al sacculo, i dati presentati finora suggeriscono che la funzionalità uditiva non è necessaria per i VEMP’s. Ciò non esclude la possibilità che la funzionalità uditiva è sufficiente per un basso livello di VEMP’s, in quanto è raro incontrare un soggetto umano con una ben documentata lesione vestibolare che si limita al sacculo. Ci sono però alcuni dati che suggeriscono che la sezione del nervo vestibolare abolisce i VEMP’s, che sarebbe in contrasto con questa idea (Watson e Colebatch, 1998). È anche possibile che l’udito sia sinergico con l’input vestibolare – vale a dire ottenere di più di una risposta con una convergenza multisensoriale. Attualmente concordiamo con questa idea, ma queste sono questioni che devono essere ulteriormente elaborate.
I valori normali
Nella nostra impostazione clinica , riteniamo che i VEMP’s siano anormali quando sono molto asimmetrici (un’ VEMP più grande di 2 o più volte dell’ altro – un RVR del 33% o superiore), a basso contenuto di ampiezza (meno di 70 per un popolazione giovane), o assente (onda non riproducibili, o P1 latenza al di fuori della nostra normativa). Usiamo un tone-burst VEMPs, che producono risposte leggermente più grande dei clicks. Lo facciamo perché i nostri impianti (Bio-Nav-Logic Pro), non producono uno stimolo forte, come si preferisce (solo 95 dB). Come accennato in precedenza, si è iniziato con registrazioni e stimoli bilaterali, successivamente si sono effettuati stimoli monoaurali a causa di alcune cattive esperienze diagnostiche in cui è emerso che vi è stato un VEMP con stimolazione binaurale, ma non chiari come i VEMP’s con stimolazione monaurale.
|
|
|
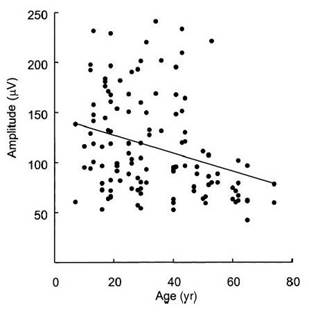
Fig.13: ampiezza dei VEMP ai di click, in funzione dell’età, da Su ed al. (2004). |
Per scegliere VEMPs, diminuito ampiezze (circa un fattore di due) sono considerati a 70 persone e più anziani (Su et al, 2004).
|
Autore |
Rapporto |
Stimolo |
|
|
Latenza (p13) |
Su et al |
11,33 + -. 82 |
click di rarefazione |
|
Latenza n23 |
Su et al |
18,24 + – 1,33 |
click di rarefazione |
|
Ampiezza p13-n23 |
Su et al |
126 + -49,6 |
click |
|
IAD rapporto |
Su et al. |
0,16 + – ,12 |
click |
Al momento attuale (2011), sembra che in soggetti normali e utilizzando un Bio-logic-Nav-Pro, l’ampiezza media dei VEMP si riduce da circa 150 a 20 anni a circa 75 all’età di 70 anni.
Che cosa riporta la letteratura riguardo a particolari disturbi ?
La letteratura sui VEMP sta aumentando rapidamente e sembra che si siano ottenute preziose informazioni diagnostiche. Vengono riportate brevi discussioni sui VEMPS, illustrato in base alla nostra esperienza.
- Deiscenza del canale semicircolare superiore
- Sofferenze del nervo vestibolare
- Ramsay-Hunt
- Nevrite Vestibolare
- Neurinoma dell’acustico
- Perdita Vestibolare bilaterale (ad esempio, dopo somministrazione causa di gentamicina)
- Vertigine parossistica posizionale benigna (BPPV)
- Patologia vestibolare centrale
- Malattia di Meniere
- Disturbi uditivi
I VEMPs nella sindrome da deiscenza del Canale Semicircolare Superiore-funzionano
|
|
|
|
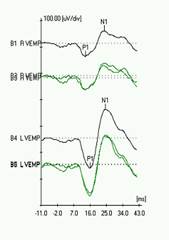
Fig.14a sinistra: VEMP ottenuti in un individuo con deiscenza sinistro del canale semicircolare superiore .E’ stato utilizzato un navigatore Bio-Logic Pro. – soglia dei VEMP’s a destra nella stessa persona. |
|
I VEMP’s finora non sono stati particolarmente utili per documentare soglie anormalmente basse in pazienti con il fenomeno di “Tullio”, che in gran parte si verifica nelle persone con fistola o sindrome con Deiscenza del Canale semicircolare Superiore (SCD) (Brandtberg et al, 1999). Se uno non ricerca le soglie (non le ricerchiamo di routine), non si trova sempre un’asimmetria di ampiezza in questa sindrome. La rivalutazione concettuale del fenomeno della “terza finestra”, avvenuta con la scoperta della patologia da deiscenza del canale semicircolare superiore (DCSS), ha rappresentato una tappa fondamentale anche nello sviluppo dei VEMPs. Si deve a Brantberg l’osservazione di come in caso di DCSS la soglia di detezione del c-VEMPs fosse significativamente ridotta per la riduzione dell’impedenza dell’orecchio interno (Brantberg et al., 1999). Lo stesso Autore descrisse inoltre la presenza del potenziale in caso di deficit trasmissivo e la normalizzazione della soglia dopo plugging del CSS (Brantberg et al, 2001). Inoltre, per primo suggerì come fosse del tutto inappropriato considerare, ai soli fini diagnostici, i soli reperti radiologici. Solo l’attenta valutazione dei dati elettrofisiologici è infatti in grado di svelare i possibili falsi positivi TC.
Per quanto concerne lo studio di correlazione tra i c-VEMPs e le variabili morfo—strutturali e clinico—strumentali della DCSS, gli studi più interessanti confermano che DCSS sintomatiche hanno c-VEMPs più ampi e soglie ridotte, rispetto a quelle non sintomatiche o paucisintomatiche (Roditi et al., 2009) e che DCSS più ampie inducono una sintomatologia caratteristica cocleo-vestibolare e soglie di detezione c-VEMPs più basse rispetto a deiscenze di entità inferiore (Pfammatter et al., 2010). E stato infine proposto un test di screening per individuare pazienti con ipersensibilità vestibolare, utilizzando uno stimolo click di 90 dB nHL (Brantberg e Verrecchia, 2009). L’analisi di soglia dei c-VEMPs si è ovviamente dimostrata utile anche nella diagnostica delle altre patologie da terza finestra che comprendono le deiscenze localizzate negli alti i canali semicircolari (primitive o da erosione giugulare), nel canale cocleare ed anche quadri patologici di origine malformativa (acquedotto vestibolare allargato, malformazioni Mondini-simili, patologie X-linked) o post-traumatica (fistola perilinfatica) (Sheykloleslami et al,, 2004; Modugno ET al, 2006). I VEMP’s si normalizzano dopo l’intervento chirurgico sul canale semicircolare superiore (Welgampola et al, 2008). Questo può essere interpretato in vari modi – il sacculo e/o il canale semicircolare potrebbero essere meno stimolati dopo la riparazione della deiscenza del canale,.
Tuttavia, essi sembrano essere molto più utile di quanto sopra riportato, perché offrono un metodo oggettivo di valutazione del nervo vestibolare, compresi una parte dello stesso nervo, per le quale non ci sono a disposizione altri test clinici. Le informazioni più importanti che possono essere utilizzate sono: 1). se il VEMP è presente a soglia anormalmente bassa su una o entrambe le parti? 2). se il VEMP è assente su di un lato a soglia elevata? Questi due tipi di informazioni ci diranno se è presente il fenomeno di Tullio, ed anche se vi possono essere danni al sacculo, al nervo vestibolare inferiore od alle sue proiezioni. La presenza di VEMP’s in una persona con un’ ipoacusia trasmissiva è anche suggestiva di SCD.
Non abbiamo trovato l’utilità dei VEMPs nella diagnostica, delle piccole fistole della finestra , che abbiamo incontrano più frequentemente nella nostra pratica. I VEMP’s (con stimoli binaurali , metodo binaurale), utilizzando i criteri di ampiezza, non sempre sono riusciti ad individuare SCD bilaterali Per questo, si ha la necessità di una CT dell’osso temporale o soglia dei VEMP’s. Consigliamo di ricercare la soglia VEMP in ogni persona con una vertigine indotta dal suono (Tullio).
VEMP e Fenomeno di Tullio
Il fenomeno di Tullio si riferisce a pazienti che hanno sintomi vestibolari in risposta alla stimolazione acustica, come vertigini, squilibrio e disagio. Colebatch, Rothwell, Bronstein e Ludman (1994) hanno testato sette pazienti con fenomeno di Tullio ed hanno dimostrato che tutti i pazienti avevano una soglia migliore(ridotta) evocato della dai click – VEMP; una soglia < 70 dB NHL potrebbe essere utilizzato come criterio diagnostico per evidenziare l’effetto Tullio. Pensavano che la soglia migliore potrebbe essere dovuto ad una maggiore efficacia della trasmissione di energia sonora ai recettori sacciformi ed a questa iperattivazione probabilmente hanno contribuito i sintomi vestibolari presenti in questi pazienti.
Una delle condizioni che causano il fenomeno Tullio è una deiscenza del canale semicircolare superiore (SCD), ossia un difetto della capsula ossea che forma il tetto del canale semicircolare superiore. Watson, Halmagyi e Colebatch (2000) hanno studiato con TAC ad alta risoluzione e VEMPs quattro pazienti con fenomeno di Tullio. Le soglie VEMPs sono state inferiori (migliori) per tutte le orecchie colpite e normali per tre orecchi non affetti. Tutte le orecchie hanno mostrato SCD alla TAC. Essi hanno proposto che i pazienti con fenomeno di Tullio dovrebbero essere sottoposti sia ad HRCT ,che ai VEMPs. Se entrambi rivelano deiscenza, non sono richiesti ulteriori indagini, come l’esplorazione dell’orecchio medio per escludere una lussazione della staffa o una fistola perilinfatica . Risultati simili con soglie VEMPs inferiori sono anche riportati in pazienti con perilinfa fistola.
Risposta di Tullio nei VEMPs Contra-laterali
• Tullio , L’ orecchio t
• 95 – click dB in R’t
( invariato) orecchio
– Ipsi : normale
– Contra : più piccolo
ampiezza
J Neurol Neurosurg Psychiatry 1998; 65; 670-678
• 95 dB – click a L’ t ( influenzato ) orecchio
• Ipsi : ampiezza maggiore
• Contra : una risposta incrociata con p13 simile e N23
latenze , ma inizia con una negatività .
• Sempre una breve risposta di latenza di polarità opposta
( negativo – positivo ) onda
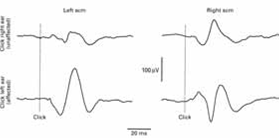
I VEMP’s sono speso una prova di sofferenza del nervo vestibolare – a volte funzionano(sono utili)
|
|
FIG.15.VEMP ottenuti in un paziente con sindrome di Ramsay-Hunt a sinistra, , è stato utilizzato un navigatore bio-Logic Pro. La sofferenza del facciale di Ramsay Hunt- è spesso associata ad una neurite dell VIII°nervo, come recidiva dell’ Herpes Zoster (virus del vaiolo) . |
Lo studio della Neurite Vestibolare (NV) rappresenta non solo l’ambito di maggior interesse, ma anche il modello su cui i principali autori hanno delineato le modalità di stimolazione clinicamente più appropriate ed i criteri interpretativi più validi.
La neurite vestibolare (NV) è stato uno dei primi quadi i clinici in cui è stato possibile valutare il potere topo-diagnostico dei c-VEMPs , individuando la dissociazione tra i test di funzionalità canalare ed i test di funzionata maculare. Sia i primi studi che quelli più recenti hanno infatti e evidenziato Lome nella maggior parte delle NV risulti risparmiata la funzione sacculare (70-80% dei casi) (Murofushi et al, 1996; Kim et al, 2008). I c-VEMPs , quindi, fin da subito hanno fornito un valore aggiunto importante nella quantificazione della lesione vestibolare, permettendo di differenziare una deficit totale canalo-maculare da un deficit selettivo di funzione (canalare o maculare). Alla definizione della neurite del nervo vestibolare superiore verrà, infatti, presto affiancata quella della neurite del nervo vestibolare inferiore: la conservazione della funzionalità canalare al test calorico e al HIT per il CSL e l’alterazione di quella sacculare ai c-VEMPs (associata al deficit dell’HIT per il CSP è stata infatti documentata) (Halmagyi et al., 2002; Iwasaki et al., 2005).
Nell’ambito della NV, l’utilizzo dei c-VEMPs può inoltre offrire valutazioni prognostiche importanti. L’assenza di una risposta c-VEMPs comporta una scarsa probabilità di sviluppare una labirintolitiasi tardiva, mentre nei casi di labirintolitiasi secondaria a NV i c-VEMPs risultano conservati, a conferma che il nervo vestibolare inferiore ed il CSP rimangono in questo caso funzionalmente intatti (Murofushi et al., 1996). Inoltre i c-VEMPs permettono di analizzare il recupero funzionale in caso di una lesione/disfunzione sia canalare che sacculare: la risposta c-VEMPs sembra ricomparire più spesso (30%) e più precocemente (6m-2aa) rispetto a quella calorica (7%). I VEMP’s sono sensibili alle malattie del sacculo, Ochi e collaboratori (2003) segnalano l’uso di VEMPs per diagnosticare la neurite vestibolare che interessa la branca inferiore del nervo vestibolare. Poiché il sacculo è innervato dalla branca inferiore,i VEMP’s dovrebbe essere assenti in questa situazione. I VEMP non distinguono tra il sacculo ed il nervo vestibolare inferiore, e non sembrano ci siano tecniche disponibili in grado di risolvere l’interessamento dell’uno o dell’altro. Poiché la maggior parte delle neurite vestibolare interessa il nervo vestibolare inferiore, i VEMP’s non dovrebbe essere generalmente normali. Quando VEMP’s sono anormali, essi riconoscono più rapidamente il nervo (Kim et al, 2008). Nei pazienti che soffrono di una neurite vestibolare e sottoposti a esame nei primi 8 giorni dopo la comparsa della grande crisi vertiginosa, noi abbiamo potuto dimostrare che questo esame era alterato solamente in due terzi dei pazienti. Questi risultati dimostrano che la lesione virale interessa il più delle volte solo il nervo vestibolare superiore e che il nervo sacculare e quindi il nervo vestibolare inferiore sono risparmiati. Essi corroborano i dati ottenuti in videonistagmografia che hanno dimostrato che, in molti di questi pazienti, il nistagmo oculare presenta una componente contemporaneamente orizzontale e verticale (vedi. sopra). La presenza di una componente verticale attesta l’assenza di coinvolgimento del nervo vestibolare posteriore e quindi possibilmente la conservazione del nervo vestibolare inferiore. Questo test ha qui un valore prognostico, in quanto il recupero di una normale attività del nervo vestibolare è più rapido e più frequente nelle lesioni limitate al nervo vestibolare superiore.
I VEMP da stimolazione galvanica stimolano tutto il nervo vestibolare e di conseguenza, dovrebbero essere normali, anche se il nervo vestibolare inferiore era stato danneggiate. Così un VEMP assente alla stimolazione acustica e un VEMP presente alla galvanica- non ci fà distinguere una lesione del sacculo da una lesione del nervo vestibolare inferiore.
Recentemente è stato suggerito che una prolungata latenza dei VEMPs sia un segno di una lesione retrococleare (nervo vestibolare), come si trova nella neurite vestibolare. Ci sono un pò di dubbi su questo e in questi casi si può pensare semplicemente che si sia persa la prima onda del VEMP, ma che l’onda tardiva sia collegata ad una funzione cocleare conservata. VEMPs anomali (asimmetrico o con latenza allungata) sono riportate in circa il 25% delle persone con diagnosi di neurite vestibolare (Murofuschi et al, 1996).
|
|
|
Fig. 16 VEMP asimmetria in paziente con piccolo neurinoma acustico intracanaliculare, senza deficit di udito. |
Nelle neuriti vestibolari, i VEMP’s tendono a normalizzarsi più rapidamente rispetto al canale testato(Kim et al, 2008). Tuttavia, per questa conclusione si sospetta che la tecnica VEMP utilizzata in questo studio (rotazione della testa) sia viziata .
I VEMPS sono generalmente assenti o ridotti nelle persone con neurinoma acustico (vedi figura sopra).
Numerosi pazienti portatori di neurinomi dell’acustico sono stati sottoposti a esame prima e dopo l’intervento. Questa lesione tumorale benigna è spesso responsabile di una disfunzione del nervo sacculare, il che conferma anche la nozione tipicamente ammessa che essa abbia origine nel nervo sacculare. Dal momento che lo stimolo click è maggiore dello stimolo short tone burst, è frequente che non si individuino le onde precoci in caso di test con gli stimoli click mentre sono riscontrate con l’aiuto di stimoli short tone burst (Figura 17) Nel postoperatorio, abbiamo dimostrato che questi potenziali precoci erano definitivamente aboliti, il che ha permesso di escludere la possibilità di un compenso centrale di questo riflesso sacculo-spinale.
Fig.17
Test dei potenziali evocati miogeni (VEMP’s) indotti da suoni di 100 db (click et short tone bursts [STB]) in un paziente che soffre di un neurinoma dell’acustico. I VEMP’s sono aboliti con lo stimolo click mentre sono presenti quando l’esame è effettuato con lo stimolo short tone burst, il che dimostra una disfunzione parziale del nervo sacculare dal lato del neurinoma
Infine, nelle oscillopsie e nelle sensazioni di beccheggio non spiegate dai test che valutano il funzionamento del nervo canalare orizzontale, questo test può risultare anomalo, cosa che spiega dunque in parte la sintomatologia.
In conclusione, questo esame permette di valutare il funzionamento dei recettori sacculari e delle vie sacculo-spinali. Presenta un triplice interesse: diagnostico, prognostico e terapeutico. È importante rilevare che esso non presenta mai compensazione dopo lesione, a differenza del test della rotazione intorno a un asse inclinato (test RAIG), il che rappresenta il suo valore in caso di perizia.
Potenziali evocati vestibolari miogenici nel neurinoma acustico
Anche chiamati potenziali evocati otolitici (PEO) o sacculocollici, sono l’espressione dei potenziali inibitori della contrazione muscolare dello sternocleidomastoideo, generati dal vestibolo e partecipano alla postura. Sono riscontrabili in clinica con una stimolazione sonora di 95-100 dB del sacculo. Essi interrogano principalmente il sacculo e la via vestibolospinale, valutando il nervo vestibolare inferiore, che è il nervo maggioritariamente invaso in questi casi. [63
] I potenziali evocati vestibolari miogenici (PEVM) sono assenti o notevolmente ridotti di ampiezza nell’88% dei casi (esperienza personale su 100 casi) e questo in pazienti tra cui alcuni hanno altre prove alterate (PEU oppure al calore) e altri hanno solo questo test anomalo (Figura 18 ). Sembra invero che la sua combinazione con i PEU e la videonistagmografia aumenti in modo considerevole la capacità di individuazione dell’esame otoneurologico (solo 1% di falsi negativi nella nostra personale esperienza su 100 casi). Per altri AA le aspettative sono, però, rimaste disattese, poiché i numerosi studi effettuati hanno riscontrato valori di sensibilità e di specificità di tale metodologia pari a quella del test calorico, nemmeno integrando l’analisi con i risultati dei potenziali evocati uditivi. Inoltre, non è stata evidenziata alcuna correlazione con le dimensioni della neoplasia.
Esempi di tracciati di potenziali evocati vestibolari miogenici (PEVM) in uno Schwannoma vestibolare destro. Figura 18
A. Assenza di risposta ai due stimoli a destra mentre il tracciato è chiaro e ben sincronizzato a sinistra
Fig. 18
B. Semplice diminuzione di ampiezza delle risposte a destra in rapporto al lato sinistro sano.
Fig. 18
Nella sezione del nervo vestibolare i VEMP’s non funzionano:
I VEMP’s dovrebbero essere e quasi sempre assenti nelle persone alle quali il nervo vestibolare è stato sezionato.
|
|
|
Fig. 19 VEMP previsto assente in persona con sezione del nervo vestibolare destro . |
La sezione del nervo vestibolare , in circa il 5% dei pazienti ,non riesce a controllare le vertigine intrattabile della malattia di Meniere. Quando ciò si verifica, il problema può essere dovuto ad una sezione incompleta del nervo . VEMPs potrebbe, in teoria, essere utili per individuare una funzione residua del nervo vestibolare inferiore, in quanto questo ramo del nervo vestibolare è talvolta mescolato con le fibre cocleari (Lehnen et al, 2004). Tuttavia, siccome i VEMP’s richiedono uno stimolo molto forte, sembra improbabile che possano essere molto sensibile. Il test impulsivo della testa rivela la funzione residua del canale posteriore più frequentemente rispetto ai VEMP’s (Lehnen et al, 2004 )sono necessari ulteriori ricerche su questo argomento. Un potenziale ostacolo nel praticare VEMP in pazienti con VNS sono le risposte controlaterali e le risposte estranee(principalmente risposte dei muscoli auricolari posteriori). Non si dovrebbe fare stimolazioni VEMP’s bilaterali in persone con VNS. Si dovrebbe anche verificare la PAM (facendo una prova con il capo appoggiato sul tavolo) se vi è qualcosa che sembra essere una risposta sul lato sezionato.
I VEMP’s funzionano come prova per la perdita vestibolare bilaterale !
|
|
|
Fig. 20 VEMP di un paziente con una perdita vestibolare bilaterale completa dovuta alla gentamicina, ma con qualche residuo uditivo. I potenziali dimostrato di essere ripetibili, ma manca la loro caratteristica spostamento per P1 al di sotto della linea di base. |
I VEMPs dovrebbero essere ridotti o assenti nelle persone con perdita vestibolare bilaterale, come ad esempio a causa della ototossicità dei farmaci aminoglicosidici. Gentamicina cancella i VEMPs nelle cavie. (Cheng et al, 2010) Solo pochi pazienti sono stati studiati finora (Murofushi et al, 1998). Nella nostra pratica, abbiamo testato molti pazienti con perdita vestibolare bilaterale e udito normale, e scoperto che è una buona prova (Hain et al, 2006). Abbiamo anche testato due pazienti sordi con perdita bilaterale, uno sordo a causa della sindrome di Cogan e un altro a causa di una malformazione Mondini, e trovato risposte assenti o quasi assenti in entrambi. Questo è quanto ci si aspetterebbe se si ritiene che il sacculo sia interessato in queste condizioni. Tuttavia, questa conclusione può essere messa in discussione come un problema intrinseco nel testare persone con sordità bilaterale è che non si sa se si può anche avere sovrapposto alla perdita neurosensoriale un con disturbo trasmissivo. Siccome la perdita trasmissiva riduce i suoni che producono i VEMPs, non si può chiaramente in questa situazione collegare un VEMP assente ad una funzione assente del sacculo. I VEMP’s sembrano essere assenti dopo trattamento unilaterale con gentamicina utilizzata nella Malattia di Meniere (Helling et al, 2007). Posso essere utili nel decidere quando il farmaco non è più indicato. Un problema che può essere possibile causa di confusione è che ci può essere un interessamento dell’orecchio medio dopo le iniezioni di gentamicina transtimpanica. che richiedono una perforazione della membrana
I VEMPs nella VPPB – non funzionano.
Si potrebbe pensare che i VEMP’s valutino il sacculo (un organo Otolitico ) poiché si pensa che nella VPPB , causata da un’altra malattia otolitica, (gli otoconi sciolti nel utricolo) ci potrebbe essere dei VEMP’s anormali. Yang et al (2008) si sono posti questa domanda ed hanno riferito che la latenza è leggermente aumentata. Vi è qualche dubbio che latenza sia una misura utile per tutto , vi è anche qualche dubbio sulla utilità dei VEMP’s in VPPB. In merito alla patologia otolitica per definizione, la labirintolitiasi, le potenzialità diagnostiche e prognostiche dei c-VEMPs potrebbero, in teoria, essere numerose. In realtà, esaminando i numerosissimi studi pubblicati, si nota una estrema eterogeneità delle metodologie utilizzate (fase acuta vs fase quiescente, coinvolgimento canalare, ecc.) e solamente pochi di questi analizzano risultati age-matched. In sintesi, vengono riscontrate asimmetrie sia in termini di ampiezza (ridotta) che di latenza (aumentata) del potenziale, ma i dati emersi appaiono essere quantitativamente molto disomogenei. In generale, non emerge una differenza significativa di risposta c-VEMPs in labirintolitiasi con coinvolgimento del CSP rispetto ad un coinvolgimento del CSL. Nonostante la molteplicità degli studi prodotti, nessuno di questi ha ancora analizzato la risposta c-VEMPs ad uno stimolo per VO che potrebbe, invece, caratterizzare il coinvolgimento utricolare da labirintolitiasi, soprattutto nella fase acuta della malattia. Inoltre, fino ad ora, solamente un gruppo di studio (Longo et al., 2012) ha preso in considerazione l’analisi di soglia in pazienti affetti da labirintolitiasi, pur non avendo riscontrato differenze rispetto al gruppo di controllo. Si sottolinea che questo tipo di analisi potrebbe essere utile nella diagnosi differenziale dei casi con ricorrenza ed in particolare nell’identificazione dei casi correlati alla patologia da terza finestra.
I VEMP nella otosclerosi dovrebbe essere assente.
Nella Otosclerosi, i VEMP’s dovrebbe essere assenti. Una persona con un VEMP presenti e ipoacusia trasmissiva può avere SCD.
I VEMP’s nella malattia di Meniere: funzionano(Fig. 21)
![]()
Fig.21
Un altro quadro patologico in cui lo studio dei c-VEMPs è stato ampiamente sviluppato è senza dubbio la MdM. La disamina della Letteratura in merito risulta assai complessa sia per la cospicua quantità di lavori pubblicati, sia per l’estrema eterogeneita di metodologia utilizzata (campione di studio, metodo di stimolazione, ecc). In sintesi, i c-VEMPs hanno contribuito a delineare alcuni importanti elementi utili sia a fini diagnostici (diagnosi differenziale, test depletivi e stadiazione) che terapeutici (verifica del danno maculate dopo slabirintazione chimica).
La figura seguente Fig.22 mostra una ridotta risposta ottenuto da un paziente con malattia di Meniere (che colpisce l’orecchio sinistro):
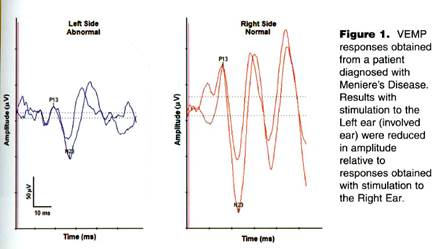
Fig.22
VEMP è uno strumento utile per la valutazione di pazienti con DM ,in quanto il sacculo è un luogo frequente di idrope endolinfatico. MD può portare a mancanza di complessi P1-N1 sul lato interessato o possa influenzare la sua ampiezza; tuttavia la latenza di P1 e N1 non è influenzato dalle idrope. Murofushi et al (2001) hanno mostrato che il 51% dei loro 43 pazienti con MD mostrava ampiezze anomale dalla loro parte interessata con normali risposte in 21 casi. Young et al 18 ha scoperto che VEMP erano normali in 24 orecchie, aumentata in 3 spighe, depresso in 6 orecchie e assente in 7 orecchie in 40 pazienti con MD. Latenze non erano significativamente in ritardo, in ogni caso. Essi hanno anche studiato come le diverse fasi di MD colpiti risultati VEMP. VEMP era normale in 83% di stage I orecchie di MD che indicano che il riflesso sacculocollico mantiene normale velocità di conduzione nelle prime fasi di MD. I VEMPs Aumentati sono state spiegate da questi autori come dovuti a dilatazione del sacculo causa della idrope, estendendo a premere contro la platina della staffa migliorando così la sensibilità di macula sacculare ai suoni intensi . Un sacculo dilatato con atrofia della macula sacculare potrebbe essere la spiegazione per un VEMPs ridotto. I VEMPs assenti nello stadio IV di MD potrebbe risultare dal crollo della parete sacculare sulla membrana otolitica. Essi hanno dimostrato che la relazione annuale di attività dei VEMP aumenta significativamente con la fase di MD ed era meglio correlata con malattia in stadio di test calorico.
Molti ricercatori hanno usato i VEMPs come parte del test al glicerolo Fig.23 ,le ampiezze dei VEMPs nei pazienti con MD sono stati misurati prima e dopo l’assunzione di glicerolo Cianfrone, Gagliardi, Cuiuli e D’Amico 2004 hanno studiato i prodotti di distorsione delle otoemissioni acustiche usate (DPOAE) ed i VEMPs per monitorare le prestazioni della coclea e del sacculo in 29 pazienti con precoce MD prima e dopo l’assunzione di glicerolo . Dopo l’analisi dei risultati delle DPOAE e VEMPs, hanno diviso i loro pazienti in 4 gruppi; il primo gruppo ha avuto un miglioramento dopo l’assunzione di glicerolo con entrambe le misure suggestivo di idrope sia nel labirinto anteriore che posteriore . Nel secondo e terzo gruppo, c’è stato un miglioramento in una delle due misure che indicano che un solo vano endolinfatico è stato coinvolto. Nell’ ultimo gruppo tutti i pazienti avevano la prova al glicerolo positiva con DPOAE su un lato e con VEMP sull’altro lato. Così, hanno evidenziato l’importanza di entrambi i test per la diagnosi precoce di idrope endolinfatico.
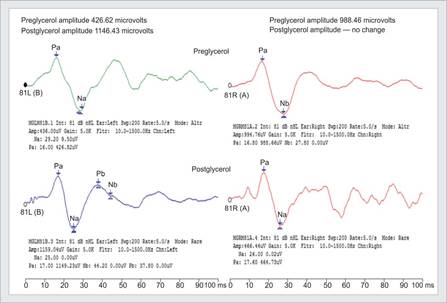
Fig.23
Sono state riscontrate risposte c-VEMPs assenti o ridotte nel 40-50% dei pazienti, quando ancora la funzione canalare appare intatta; inoltre è stata individuata una correlazione con l’ipoacusia per i toni gravi a conferma che la prima struttura dopo la coclea ad essere interessata dall’idrope è il sacculo (de Waele et al., 1999). Si distinguono, invece, altri Autori che documentano come in caso di risposte c-VEMPs presenti bilateralmente, in stati precoci di malattia, la risposta più ampia corrisponda al lato affetto, mentre in quelli tardivi possa essere questa ridotta (Young et al., 2002) ed anche come in corso di una crisi menierica, possa avvenire la fluttuazione del c-VEMPs. Spesso vi è asimmetria tra i 2 lati. E ‘ stato riportato che nell’orecchio interessato si possono trovare VEMPs di bassa ampiezza (Waele, 1999) e una gran parte dei pazienti non mostrano alcun VEMP, oppure una soglia più elevata (Rauch et al., 2004). L’ampiezza dei VEMP’s può essere aumentata nelle fasi precoci della malattia di Meniere, come pure fluttuano in modo opposto alla funzionalità uditiva , forse a causa della dilatazione sacculare (Young et al., 2002). Una assenza dei VEMPs nella fase avanzata della malattia può essere dovuta al crollo del sacculo. Si potrebbe anche logicamente supporre che ci dovrebbe essere un punto in cui il sacculo è normale in dimensione, nel mezzo. Ci sembra che proprio queste osservazioni suggeriscono che i VEMP’s possono essere di qualsiasi dimensione nella malattia di Meniere – normali, grandi o piccoli, e che è improbabile che sia utile per la diagnosi.
Il capitolo più interessante nell’ambito della MdM è quello che riguarda lo studio della cosiddetta tuning curve. Per quanto concerne i pazienti menierici è stato dimostrato che questi mostrano uno shift frequenziale verso frequenze maggiori di 500 Hz: rispetto ai controlli, infatti, presentano soglie di detezione inferiori per tone burts di 1000 Hz (best frequency) rispetto a quelle relative ai 500 Hz (flat tuning) (Rauch et al., 2004). La severità dell’alterazione della tuning curve è parallela alla severità dei sintomi, come ad esempio nelle fasi tardive della MdM (specialmente in presenza di crisi otolitiche di Tumarkin) in cui la curva appare sempre più alta e piatta. Lo shift frequenziale in corso di idrope sarebbe il risultato dell’aumento della tensione del compartimento sacculare, che si traduce in ultima analisi in un aumento della frequenza di risonanza alla sollecitazione meccanica (balloon expanded theory). Il pattern simil menierico descritto è stato altresì individuato anche nel 30% delle orecchie controlaterali. Tale reperto è stato confermato da studi istopatologici che hanno documentato la presenza di idrope sacculare controlaterale nel 35% casi (Lin et al., 2006). In termini prognostici, quindi, lo studio della funzione sacculare sembra importante per predire una eventuale evoluzione idropica controlaterale. Rauch e soci hanno riferito che VEMP mostrano un diverso “tuning” nella malattia di Meniere. L’idea sembra sia dovuto al fatto che, siccome i pazienti con la Meniere hanno una ipoacusia per le frequenze basse , i VEMP’S potrebbero anche mostrare una alterazione alle basse frequenze .Questa idea non sembra molto logica, in quanto la coclea ed il sacculo hanno un’organizzazione meccanica molto diversa. Tuttavia, in diversi documenti, Rauch e colleghi hanno dimostrato che il tono burst di 500 Hz- VEMP ha la soglia più bassa e che questo “miglioramento” dei 500 Hz sui 250 e 1000 Hz. sia In gran parte perduta nei pazienti con malattia di Meniere (Rauch et al., 2004 ) . Si ha la sensazione che questa tecnica sia semplicemente impraticabile. È semplicemente troppo difficile ottenere soglie VEMP a 3 frequenze.
È stato recentemente proposto che l’aumento dei VEMPs con la somministrazione di glicerolo o con iniezioni di furosemide sia suggestivo di malattia di Meniere (Shojaku et al., 2002; SEO et al., 2003). Al momento attuale piacerebbe che tutto ciò sia confermato da parte di altri autori. Se un allargamento dei VEMPs sia dovuto ad una dilatazione sacculare, si dovrebbe aspettare l’effetto opposto. Rauch et al riferiscono che la differenza di soglia nei VEMPs, in particolare a 250 Hz, aveva una accuratezza di circa l’80% , nel rilevare il lato della lesione nei pazienti, che già erano noti, per avere la malattia di Meniere da dati audiometrici e clinici (Rauch et al., 2004). In mancanza di una diagnosi patologica “gold standard”, tuttavia, è difficile sapere come interpretare questa osservazione. Osei-Lah e altri (2008) recentemente hanno segnalato che il rapporto di differenza di ampiezza interaurale media è significativamente più alto nella malattia di Meniere stabile rispetto alla malattia di Meniere in fase acuta. Soglie e latenze non erano utili.
Altri aa hanno realizzato questo test in diverse popolazioni di pazienti. In 60 soggetti che soffrono di una malattia di Ménière, si è potuto dimostrare che l’idrope endolinfatica induceva una disfunzione sacculare nel 54% dei casi e che questa disfunzione sacculare era correlata alla gravità della sordità media sulle frequenze da 250 a 1000 Hz: [58
] una sordità di percezione di 60 dB in media sulle frequenze da 250 a 1000 Hz o più è generalmente associata a un’areflessia sacculare. Una tale correlazione non è stata osservata per quanto riguarda la sordità sulle frequenze più elevate di 4000 e 8000 Hz e l’interessamento dell’ampolla del canale semicircolare orizzontale valutata con i test calorici. Inoltre, abbiamo dimostrato grazie all’equitest che i pazienti sofferenti di un interessamento sacculare presentano dei punteggi d’equilibrio più bassi in condizione 5 di quelli che hanno una funzione sacculare normale. Sembra quindi essenziale realizzare tale esame nei pazienti che soffrono di questa patologia al fine di individuare una eventuale interessamento sacculare e orientarli verso una rieducazione vestibolare.
Per quanto concerne l’utilizzo dei c-VEMPs per il follow-up funzionale dopo gentamicina, si è visto che il sacculo è più sensibile al farmaco rispetto alle altre strutture vestibolari, ma anche che una eventuale risposta c-VEMPs assente non è correlata al successo terapeutico. I VEMP’s possono essere utile nel monitorare, il trattamento di gentamicina a basso dosaggio, nella la malattia di Meniere , poiché i VEMP’s si riducono in questa situazione (Helling et al., 2007; Picciotti et al., 2005).fig Fino ad oggi, quest’idea e stata confermata. Si è osservato che i potenziali precoci indotti da questi click sonori di forte intensità scomparivano nel 100% dei pazienti trattati mentre la loro funzione canalare orizzontale, valutata con i test calorici, poteva rimanere normale per parecchi mesi dopo il trattamento. Questo ci ha permesso di concludere per una più alta sensibilità alla gentamicina del sacculo rispetto al canale orizzontale nell’uomo.
Sarebbe una buona idea ottenere un VEMP prima di ITG
Abbiam o provvisoriamente pensiamo che sia una buona idea per ottenere un VEMP prima ITG, e un altro se ci sembra essere un fallimento del trattamento.
Caso: c-VEMPs nella malattia di Meniere.
Si potrebbe ipotizzare che VEMPs sarebbe in gran parte normale nella malattia di Meniere, ma ridotto dopo intra (trans) gentamicina timpanica. Gentamicina riduce VEMP di sistemica, e dovrebbe logicamente anche di ridurre VEMP del dopo somministrazione locale.
Questo caso illustra una situazione:
Prima di gentamicina (a basso dosaggio), questo uomo aveva una differenza 14 tra le orecchie.
Un anno dopo, ha avuto una differenza del 63% tra le orecchie.

Così, questo esempio dimostra che c’è stata una sostanziale riduzione dell’ampiezza VEMP per questo particolare individuo.
Ha avuto un ottimo risultato, senza ulteriori attacchi di vertigine. Caso: MM.
Alla ricerca di un comune denominatore patogenetico alcuni autori hanno studiato la tuning curve sia in pazienti menierici che in pazienti affetti da vertigine emicranica (VE): 1/3 delle VE sembrano mostrare uno shi[t frequenziale simile a quello della maggior parte dei menierici (Murofushi et al., 2009). Altri Autori, invece, si sono limitati a studiare le ampiezze e latenze del potenziale, evidenziando più che altro differenze di ampiezza rispetto ai controlli, percentualmente simili a quelle del gruppo di MdM (Baier e Dietericb, 2009).
I VEMPs nei disordini centrali–raramente sono utili.
I non sono sensibili nei disordini centrale quali ad esempio un TIA del tronco. La difficoltà sembra sia dovuto al fatto che le latenze dei VEMPs ( almeno con i tone bursts ) , sono così variabile che la sensibilità è inadeguata alla malattia. Questo può essere un artefatto della metodologia (tone burst ) , che temporalmente è uno stimolo più a lungo rispetto a un click. Non si ha alcun esempio da mostrare qui, così verrà accennato solo quanto riportato dalla letteratura.
I VEMPs sono spesso asimmetrici in torcicollo spasmodico (Colebatch, Di Lazzaro et al 1995 ) .
I VEMP sono ridotti nella paralisi sopranucleare progressiva (PSP), secondo Liao et al (2008). La PSP è una rara malattia degenerativa del sistema nervoso centrale che generalmente provoca la morte entro 5 anni dalla diagnosi. E’ stata segnalata una ‘ampiezza media dei VEMP’s di 54 , con una range compreso tra 16,8-214. Questo intervallo si sovrappose sostanzialmente con i controlli per l’ età, ma può essere un altro metodo utile per identificare la PSP. Non sono attualmente disponibili dati riguardanti la progressione dei VEMP’s, nei pazienti PSP , nel tempo. Ci si aspetterebbe un declino. Questi pazienti sono tuttavia rari i e non è facile effettuare uno studio longitudinale.
I VEMPS, come gli altri test con i potenziali evocati, possono essere anche anormali in malattie centrali, come la sclerosi multipla (SM). ( Shimizu, Murofushi et al. 2000; Versino, Colnaghi et al., 2002; Murofuschi et al, 2001 ) e nello stroke tronco encefalico (Chen et al 2003). L’esame VEMPs misura principalmente la funzione del tronco encefalico inferiore , mentre l’ABR studia anche il mesencefalo e la funzione del tronco encefalico superiore (midollo, ponte e tronco medio ). Sembra che qui, le misure di latenza siano più logiche rispetto alle misure di ampiezza.
![]()
FIG 21 VEMP normale in paziente con malattia di Machado-Joseph (Sca-3). L’ampiezza è basso (30-50) ma la latenza è normale in questo individuo di mezza età con sca3 geneticamente provata per 5 anni, con andatura atassica andatura, un piccolo tronco encefalico, e salendo bilaterale dita dei piedi vengono segnalati VEMP’s anormali in certe degenerazioni cerebellare (ad esempio nella malattia di Machado Joseph), ma normali in altre malattie (ad esempio nella OPCA, degenerazione cerebellare corticale). (Tagegoshi e Murofushi, 2000). Siccome la circuiteria dei VEMP’s si pensa non coinvolga il cervelletto, sarebbe sorprendente trovare di VEMP anormale in qualsiasi condizione puramente cerebellare. Nella pratica (vedi sopra), si sono studiati solo due pazienti e trovato una ampiezza anormalmente ridotta per l’età in uno ed un VEMP assente nell’altro.. Siccome la Machado-Joseph colpisce il tronco cerebrale, il meccanismo di un VEMP ridotto potrebbe essere avuto ad danni provocati in altre posizioni rispetto il cervelletto.
In particolare, nella sclerosi multipla si riscontra un allungamento delle latenze del potenziale in circa il 50% dei pazienti imputabile al rallentamento di conduzione dovuto alla demielinizzazione (Murofushi et al., 2001; Versino et al., 2002), Le alterazioni sembrano più comuni in pazienti con lesioni troncali documentate, ma possono ser vire ad individuare lesioni “silenti” alla RM. Per la localizzazione dei nuclei vestibolari, una placca demielinizzante od un insulto ischemico a livello del circolo posteriore vertebro-basilare possono indurre lesioni o disfunzioni del riflesso vestibolo-collico. Infatti, i c-VEMPs, insieme ad altri esami neurologici ed anche ai potenziali evocati uditivi del tronco, sono stati utilizzati per tentare una correlazione topografica di lesioni infartuali troncali e/o bulbari. Shimizu, Murofushi, Sakurai e Halmagyi (2000) hanno testato 3 pazienti con sclerosi multipla (SM) con VEMP e trovato che la latenza P1 è ritardata in modo significativo. Hanno attribuito questo ritardo alla demielinizzazione di entrambi assoni afferenti primari presso la zona di ingresso principale e le vie vestibulospinal secondarie e hanno concluso che i VEMP potrebbe essere un test clinico utile per valutare la funzione delle vie vestibulospinal. Tu e Young (2004) hanno valutati un paziente MS con ABR, test calorico e VEMP e trovato che tutte le prove sono utile nel monitoraggio del funzionamento cocleovestibolare nella MS. Essi hanno ipotizzato che un VEMPs assente implica un processo di demielinizzazione progressivo che provoca gravi danni alla guaina mielinica, mentre una prolungata latenza P1 è attribuibile alla riduzione della velocità di conduzione lungo le fibre demielinizzate. Patko, Simo e Aranyi( 2007) hanno condotto un ampio studio in 30 pazienti con SM per determinare i fattori di anomalia dei VEMP nei pazienti con SM. Essi hanno scoperto che l’ampiezza di VEMP era significativamente più bassa e la latenza del picco P1 era maggiore nel gruppo MS rispetto al gruppo tipico. Tuttavia, la sensibilità dei VEMP nell’identificazione di MS era del 39%, ossia inferiore agli altri potenziali evocati. Essi hanno affermato che i VEMP sono in grado di dimostrare la disfunzione subclinica nella maggioranza dei loro pazienti con VEMP anormali senza vertigini o di altri segni clinici di disfunzione vestibolare. La maggior parte dei pazienti con VEMP anormali avevano avuto una vasta anomalia morfologica nel tronco cerebrale come mostrato a risonanza magnetica; la correlazione è risultata statisticamente significativa. Inoltre le possibilità di anomalia dei VEMP era maggiore nelle fasi avanzate della malattia.
VEMPs nell’ Emicrania -si ha bisogno di molti più dati.
Alla ricerca di un comune denominatore patogenetico alcuni autori hanno studiato la tuning curve sia in pazienti menierici che in pazienti affetti da vertigine emicranica (VE): 1/3 delle VE sembrano mostrare uno shi[t frequenziale simile a quello della maggior parte dei menierici (Murofushi et al., 2009). Altri Autori, invece, si sono limitati a studiare le ampiezze e latenze del potenziale, evidenziando più che altro differenze di ampiezza rispetto ai controlli, percentualmente simili a quelle del gruppo di MdM (Baier e Dietericb, 2009).Hong et al (2011) riportarono VEMPs erano anormali in alcuni dei 30 soggetti con vertigine emicranica. Questa è “strano”, perché l’emicrania è un disturbo del cervello caratterizzata da threshold ridotti, e uno non si aspetterebbe una riduzione in qualsiasi risposta vestibolare. Noi pensiamo che sia necessario uno studio di più soggetti.
Allo stesso modo, Liao e Young (2004) hanno riportato VEMPs erano anormali in circa un terzo dei 20 pazienti con emicrania dell’arteria basilare. Questo documento ha anche riferito di test anormale OKN, test calorico, e preponderanza direzionale. Ancora una volta, siamo dubbia. Poiché l’emicrania è estremamente comune, abbiamo ancora una volta vorremmo vedere uno studio molto più grande.
Una possibile spiegazione per i risultati di cui sopra è che “emicrania” non è una singola malattia, e che una frazione apprezzabile di loro hanno anche danni dell’orecchio interno.
I VEMP’s nei disturbi dell’udito ;sono necessari ulteriori dati.
Anche se i VEMPs possono essere ottenuti in pazienti con perdita uditiva completa, la perdita dell’udito deve essere di tipo neurosensoriale. Solo il fatto che i VEMP’s possano essere “ottenuti” questo non significa che i VEMP’s non siano correlati i con la perdita dell’udito e nella nostra esperienza, udito e funzione vestibolare correlano con l’ampiezza dei VEMP’s. Tuttavia, questa conclusione non è (finora) ben documentata nella letteratura.
Pazienti con ipoacusia trasmissiva, anche solo di piccola entità , ad esempio 10-15 dB, spesso non hanno VEMPs, presumibilmente perché lo stimolo sonoro, convenzionalmente trasportato dagli auricolari, non arriva al sacculo. Il sacculo ha una soglia alta, e se si stimola l’orecchio vicino a tale soglia ( cioè 95 dB ) , è facile che l’intensità sonora sia più bassa . Tutto ciò significa che i che VEMPs sono meno utili per le persone anziane, che spesso hanno nella ipoacusia una componente di tipo trasmissivo dovuta ad esempio ad una otosclerosi rotto a di disturbi correlati ed inoltre devono essere interpretati con un audiogramma recente, in cui sia stata effettuata sia la via di ossea che la via aerea. Un modo per aggirare quanto sopra potrebbe essere quello di effettuare dei VEMPs per via ossea, quando i VEMP’s per via aerea sono assenti . Mentre questo sostituisce l’audiogramma per via ossea, richiede ulteriori test e potenzialmente può affaticare il paziente. Inoltre, gli stimoli per conduzione ossea in genere non sono molto intensi.
|
|
|
Figura: VEMP ottenuti in un individuo con una modesta perdita uditiva del lato sinistro, utilizzando un navigatore Bio-Logic Pro. Il VEMP sulla destra era normale, e il VEMP a sinistra, del tutto assente. P1 indica il potenziale che si verifica a 13 msec (spesso chiamato P13) |
Diversi gruppi( Wang e Young 2007; Akin et al, 2012) hanno riferito che i VEMP’s sono ridotti nei pazienti che hanno una perdita uditiva da trauma acustico. Questi autori attribuiscono questo effetto a danni del sacculo Essi attribuito questo effetto a danni al sacculo. Pur teoricamente possibile, si ha qualche dubbio che una struttura che richiede 70db per suscitare una minima risposta sia molto sensibile al rumore. Il sacculo sarebbe più ragionevolmente danneggiato da eccessivi cambiamenti nella accelerazione lineare, come avviene per gli otoconi.
Invece è probabile che ci sia semplicemente una riduzione dei VEMP’s per una riduzione dell’udito. Similmente, Zhou, Kenna, Stevens e Licameli (2008) segnalati VEMP’s ridotti nei bambini con perdita neurosensoriale dell’udito e attribuito questo effetto a danni alla sacculo. È probabile che questi autori abbiano fatto lo stesso errore logico di Wang e Young (2007) . I VEMP test sono generalmente normali nella perdita improvvisa dell’udito (Wu e Young, 2002).
|
|
Figura: VEMP ottenuti in un individuo con una profonda perdita dell’udito neurosensoriale destra, con un . Navigator Bio-Logic Pro Questo dimostra che (neurosensoriale) audizione non è necessaria per ottenere un VEMP. Questa registrazione è stata ottenuta usando la stimolazione binaurale (vedi commenti questo metodo). |
|
|
Audiogram in persona con il VEMP mostrato a destra. C’è una sordità profonda, presumibilmente neurosensoriale. |
VEMP e improvvisa perdita dell’udito
Stamatiou, Gkorista, Xendlis, Riga e Korres (2009) hanno valutati risultati VEMP in 86 pazienti con perdita uditiva unilaterale idiopatica improvvisa e confrontato i risultati con risposte calorici. Essi hanno scoperto che il 30,2% dei pazienti ha mostrato VEMPs anormali, mentre il 52,3% ha avuto risposte caloriche anomale. Combinando i risultati di queste due prove hanno dato un quadro più chiaro del coinvolgimento vestibolare. I pazienti con risultati normali in entrambe le prove hanno avuto una lesione limitata alla coclea, mentre quelli con esiti anormali in entrambe le prove hano avuto lesioni estese che coinvolgono la coclea, il sacculo ed i canali semicircolari. La prevalenza delle vertigini come un sintomo clinico era maggiore nei pazienti con lesioni sia del sacculo che dei canali semicircolari.
VEMP e neurite vestibolare
La neurite vestibolare è una causa frequente di vertigine diagnosticata sulla storia clinica e il test calorico che mostra un deficit unilaterale. Il Nervo Vestibolare Superiore (NVS) è quello più frequentemente colpito oltre al Nervo Vestibolare Inferiore (NVI), quindi molti ricercatori non hanno trovato il VEMP strumento utile nella valutazione di pazienti con neurite vestibolare. Tuttavia, se il è interessato il NVI , il VEMPs può rivelare l’assenza di risposta o significativa AAR o latenza prolungata. Halmagyi e Colebatch(1995) hanno studiato 22 pazienti con neurite vestibolare con VEMP e test calorico. Tutti i pazienti non avevano risposte caloriche sul lato interessato indicano una disfunzione dei canali semicircolari laterali mentre i VEMPs hanno mostrato una riduzione di ampiezza in cinque pazienti, le risposte assenti in 11 pazienti che indicano un coinvolgimento del NVI ; sono stati osservate risposte normali in sei pazienti. Così, i VEMPs possono aiutare a localizzare lesioni in caso di neurite vestibolare. Inoltre, Murofushi et al (1996) hanno rilevato che nei pazienti con neurite vestibolare, la presenza o assenza dei VEMPs era prognostico di probabile futura BPPV . In 47 pazienti con neurite vestibolare acuta, 10 hanno sviluppato successivamente VPPB del canale posteriore dallo stesso lato della neurite. Tutti questi pazienti avevano VEMP normale nonostante la neurite vestibolare, mentre non si è verificata VPPB in nessuno dei 16 pazienti con risposte VEMP assenti. Essi hanno concluso che se dopo la neurite vestibolare il VEMPs è assente, è improbabile che si sviluppi VPPB in quanto in questi casi è interessato NVI.
Fujomoto, Murofushi, Chihara, Suzuki, Yamasha e Iwasaki(2009) hanno segnalato tre pazienti con VEMP assenti bilateralmente in presenza di risposte caloriche normali.
Consideravano questi casi ad essere un sottotipo di vestibolopatia bilaterale idiopatica che aveva colpito selettivamente il NVI e risparmiato il NVS. Lo studio della Neurite Vestibolare (NV) rappresenta non solo l’ambito di maggior interesse, ma anche il modello su cui i principali autori hanno delineato le modalità di stimolazione clinicamente più appropriate ed i criteri interpretativi più validi.
In caso di neurite vestibolare superiore in fase acuta si può assistere infatti ad una riduzione (o assenza) di risposta degli o-VEMPs del lato interessato e ad una consensuale ipo-areflessia canalare al test Calorico bitermico; risultano preservati invece i c-VEMPs, indicando la corretta funzionalità del nervo vestibolare inferiore (Iwasaki et al., 2009). Ciò avverrebbe indipendentemente dalla modalità di stimolazione utilizzata per evocare i potenziali indicando quindi una specificità funzionale “in efferenza”: gli o-VEMPs sembrerebbero esprimere essenzialmente la funzionalità della componente fasica utricolare mentre i c-VEMPs di quella sacculare. Se da un lato i primi studi sulla nevrite vestibolare superiore hanno previsto per gli o-VEMPs il solo utilizzo dello stimolo meccanico frontale (tone burst 500 Hz erogato mediante un vibratore clinico applicato su Fz), più recentemente accanto a questa modalità è stato affiancato anche lo stimolo per via aerea riscontrando a favore della sua ipotesi analoghe percentuali di alterazione della risposta perioculare (Curthoys et al., 2011).
Al contrario, studiando pazienti affetti da nevrite vestibolare superiore in fase acuta con protocolli di stimolazione per via aerea (clicks o short tone burst) ed ossea (stimolo impulsivo per via mastoidea o taps frontali/mastoidei), altri Autori hanno riscontrato percentuali diverse di alterazione delle risposte cervicali ed oculari a seconda degli stimoli utilizzati (Govender et al., 2011). Se risulta chiara la dissociazione tra c-VEMPs ed o-VEMPs dopo stimolo condotto per via aerea, analoghe percentuali di alterazione di entrambi i tipi di potenziali sono stati riscontrati dopo stimolo impulsivo mastoideo, confermando che anche a livello clinico non è possibile considerare in senso assoluto la visione di Curthoys, in quanto non si può escludere anche una dipendenza dello stimolo nella genesi della risposta: così come lo stimolo meccanico può influenzare l’utricolo nella genesi dei c-VEMPs, è verosimile che anche il sacculo contribuisca alla genesi degli o-VEMPs dopo stimolazione condotta per via aerea (specificità funzionale “in afferenza”). Nonostante queste due visioni in parte contrastanti abbiano contribuito alla fioritura di un proficuo dibattito scientifico, ancora non si è giunti ad una visione universalmente condivisa.
Sempre seguendo la teoria della specificità funzionale in efferenza, è stato dimostrata su 59 casi di sospetta neurite vestibolare inferiore una dissociazione tra c-VEMPs (assenti o ridotti in ampiezza in corrispondenza del lato patologico) ed o-VEMPs (nei limiti della normalità) evocati dal solo stimolo vibratorio su Fz (Manzari et al., 2012).
Analogamente a quanto avviene per i c-VEMPs, in caso di DCSS si può assistere ad una notevole riduzione della soglia di evocazione e ad un aumento di ampiezza dei potenziali perioculari in corrispondenza del lato patologico. Ciò sembra essere ancora più significativo per gli o-VEMPs, in quanto essendo potenziali eccitatori, non sembrerebbero andare incontro a saturazione ad elevati livelli di stimolazione act.ìstica. In particolare il solo criterio assoluto di ampiezza del potenziale perioculare (> 5 pV) può essere virtualmente diagnostico dopo un’intensa stimolazione condotta per via aerea (Rosengren et al., 2008).
La tuning curve degli o-VEMPs in pazienti con DCSS presenta un aumento della differenza di ampiezza (lei potenziale tra lato patologico e lato sano incrementando la frequenza di stimolazione per via aerea ed ossea fino a 2 kHz (Taylor et al, 2012). Ciò sembrerebbe indicare che i cambiamenti nella DCSS non sono legati solamente ad una riduzione della soglia di eccitabilità del vestibolo, bensì ad una facilitazione complessiva dell’attività vestibolare, in particolare del CSS deiscente, che contribuirebbe in modo determinante in questo pattern di risposta degli o-VEMPs.
Analogamente alla DCSS, anche nella Sindrome da Acquedotto Vestibolare Allargato è possibile assistere e ad un aumento sostanziale di ampiezza del potenziale perioculare in corrispondenza del lato patologico con una differenza (li ampiezza tra lato parotogico e sano molto più significati a rispetto ai c-VEMPs .
Sebbene non esista un parrerii di risposta degli o—VLN1P5 patogno— monico pci MdM alcuni Autori hanno evidenziato un aumento significato di ampiezza della risposta perioculare in corrispondenza del lato patologico in corso di attacco acuto ed in generale durante fasi precoci della patologia (Manzari et al., 2010). Questa alterazione della risposta, accompagnata non da un aumento consensuale dei c-VEMPs, bensì da una loro riduzione in ampiezza nella maggior parte dei casi, sembrerebbe indicare modificazioni opposte della dinamica degli organi otolitici nelle prime fasi della malattia.
Studiando la tuning curve degli o-VEMPs è stata riscontrata la presenza degli o-VEMPs in pazienti affetti da MdM sino ad una frequenza di stimolazione per via aerea di 4 kHz (Sandhu et al., 2012). Sebbene l’alterata tuning curve possa rappresentare un reperto strumentale interessante, non può ancora essere considerata come criterio diagnostico di MdM.
Recentemente diversi Autori hanno valutato la possibilità di differenziare la MdM dalla VE in base alle risposte dei c-VEMPs ed o-VEMPs.
Utilizzando diversi protocolli di stimolazione per via aerea ed ossea, è stata riscontrata una riduzione dell’ ampiezza dei c-VEMPs ed o-VEMPs nei soggetti affetti da MdM e VE solo dopo stimolazione per via aerea. In particolare, l’o-VEMPs dopo tone burst a 500 Hz per via aerea permetterebbe di evidenziare differenze significative tra MdM e VE (minor ampiezza dell’o-VEMPs per i pazienti con MdM), senza comunque definire un criterio certo di diagnosi differenziale tra i due quadri clinici (Zuniga et al., 2012).
I lavori riguardanti lo studio degli o-VEMPs in pazienti affetti da Neurinoma dell’acustico hanno confermato la concordanza tra questo test ed il test calonico bitermico nella valutazione della funzionalità del nervo vestibolare superiore. La sensibilità degli o-VEMPs nell’individuare alterazioni indicative di lesioni precoci (al di sotto dei 20 mm) risulta comunque bassa e fortemente dipendente dal tipo di stimolazione utilizzata per evocare il potenziale (Piras et al., 2013).
BIBLIOGRAFIA:
AKIN FW, MURNANE OD. Vestibular evoked myogenic potentials: Preliminary report. J Am Acad Audiol 2001;12:445-52.
AKIN et al. The effects of click and tone-burst stimulus parameters on the vestibular evoked myogenic potential (VEMP). JAAA, 2003;14(9), 500-509.
AKIN et al. The influence of voluntary tonic EMG level on the vestibular-evoked myogenic potential. J Rehabil Res Dev, 2004;41(3B), 473-80.
AKIN FW, MURNANE OD, TAMPAS JW, CLINARD C, BYRD S, KELLY JK.The effect of noise exposure on the cervical vestibular evoked myogenic potential. Ear Hear. 2012 Jul-Aug;33(4):458-65.
AL-ABDULHADI K, ZEITOUNI AG, AL-SEBEIH K, KATSARKAS A. Evaluation of vestibular evoked myogenic potentials. The J. Of Otolaryngol, 31 (2), 93-96, 2002.
BACKSI AM, WATSON SRD, COLEBATCH JG. Galvanic and acoustic vestibular stimulation activate different populations of vestibular afferents. Clin Neurophysiology 114 (2003) 259-365.
BACSI AM, COLEBATCH JG. Anodal vestibular stimulation does not suppress vestibular reflexes in human subjets. EBR (2003) 150:525-528
BASTA D, TODT I, ERNST A. Characterization of age-related changes in vestibular evoked myogenic potentials. J Vestib Res. 2007;17(2-3):93-8.
BATH AP, HARRIS N, MCEWAN J,YARDLEY MP. Effect of conductive hearing loss on the vestibulo-collic reflex. Clin Otolaryngol 1999 Jun;24(3): 181- 3.
BICKFORD, JACOBSON & CODY. (). Nature of averaged evoked potentials to sound and other stimuli in man. Ann N.Y. Acad Sci., 1964;112, 204-223.
BRANTBERG K 1 , WESTIN M , L LÖFQVIST , VERRECCHIA L , TRIBUKAIT A . Vestibular evoked myogenic potentials in response to lateral skull taps are dependent on two different mechanisms. Clin. Neurophysiol (2009) [Pubmed] Clin Neurophysiol. 2009 Maggio; 120 (5): 974-9
BRANDTBERG K, BERGENIUS J, TRIBUKAIT A. Vestibular-evoked myogenic potentials in patients with dihiscence of the superior semicircular canal. Acta Otolaryngol (Stockh) 1999:119:633-640.
BRANTBERG, K., BERGENIUS, J., MENDEL, L., WITT, H., TRIBUKAIT, A., & YGGE, J. (). Symptoms, findings, and treatment in patients with dehiscence of the superior semicircular canal. Acta Otolaryngology, 2001;121, 68–75.
BATH AP, HARRIS N, MCEWAN J,YARDLEY MP. Effect of conductive hearing loss on the vestibulo-collic reflex. Clin Otolaryngol 1999 Jun;24(3): 181- 3.
BATH AP, HARRIS N, YARDLEY MP. E vestibulo-collic reflex. Clin Otolaryngol Allied Sci. 1998 Oct;23(5):462-6
BEKTAS D, GAZIOGLU S, ARSLAN S, COBANOGLU B, BOZ C, CAYLAN R. VEMP responses are not affected in non-insulin-dependent diabetes mellitus patients with or without polyneuropathy. Acta Otolaryngol. 2008 Jul;128(7):768-71.
BHAGAT SP. Properties of binaural vestibular evoked myogenic potentials elicited with air-conducted and bone-conducted tone bursts. Int J Audiol. 2006 Oct;45(10):609-16.
BICKFORD RG, JACOBSON JL, CODY DTR. Nature of averaged evoked potentials to sound and other stimuli in man. Ann NY Acad Sci 1964; 112: 204-23.
BOLEAS-AGUIRRE M, SÁNCHEZ-FERRÁNDIZ N, ARTIEDA J, PÉREZ N. Vestibular evoked myogenic potentials and benign paroxysmal positional vertigo. Acta Otorrinolaringol Esp. 2007 May;58(5):173-7.
BRANDT T. Man in motion. Historical and clinical aspects of vestibular function. A review. Brain 1991;114 (Pt 5):2159-74.
BRANDTBERG K, FRANSSON PA. Symmetry measures of vestibular evoked myogenic potentials using objective detection criteria. Scand Audiol; 30(3): 189-96, 2001.
BRONSTEIN AM, FAULDON M, ROTHWELL J, GRESTY MA,COLEBATCH JG, LUDMAN H. Clinical and electrophysiological finding in the Tullio phenomenon. Acta Otolaryngol (Stockh) 1995; 520: 209-11.
CARLETON SC, CARPENTER MB. Afferent and efferent connections of the medial inferior and lateral vestibular nuclei in the cat and monkey. Brain Res 1983; 278:29-51.
CAZALS Y, ARAN JM, ERRE JP, GUILHAUME A. Acoustic responses after total destruction of the cochlear receptor: brainstem and auditory cortex. Science 1980; 210:83-6.
CAZALS Y, ERRE JP, AUROUSSEAU C. Eight nerve auditory evoked responses recorded at the base of the vestibular nucleus in the guinea pig. Hear Res 1987; 31: 93-7.
CESARO P, KERAVEL Y, OLLAT H, PESCHANSKI M, SINDOU M. In: Neuroanatomie fonctionnele, vol 2: Le cerveau et la moelle épinière. ANNP (eds). Lyon, 1995; 66-75.
CHANG CH, YANG TL, WANG CT, YOUNG YH. Measuring neck structures in relation to vestibular evoked myogenic potentials. Clin Neurophysiol. 2007 May;118(5):1105-9.
CHEN, YOUNG, & TSENG. Preoperative versus postoperative role of vestibular-evoked myogenic potentials in cerebellopontine angle tumor. Laryngoscope, 2002;112(2), 267-71.
CHEN CH AND YOUNG YH (2003). “Vestibular evoked myogenic potentials in brainstem stroke.” Laryngoscope 113(6): 990-3.
CHEN CN, WANG SJ, WANG CT, HSIEH WS, YOUNG YH. Vestibular evoked myogenic potentials in newborns. Audiol Neurotol. 2007;12(1):59-63.
CHEN CW, YOUNG YH, WU CH. Vestibular neuritis: three-dimensional videonystagmography and vestibular evoked myogenic potential results. Acta Otolaryngol 2000¸120: 845-848.
CHEN PW, MUROFUSHI T. The effect of rise/fall time on vestibular-evoked myogenic potential trigge-red by short tone bursts. Acta Otolaryngol; 121: 696-699, 2001.
CHEN PW, MUROFUSHI T. The effects of plateau time on vestibular-evoked myogenic potentials triggered by tone bursts. Acta Otolaryngol., 2001;121; 935-938,.
CHENG, P. W., T. W. HUANG, ET AL. (2003). “The influence of clicks versus short tone bursts on the vestibular evoked myogenic potentials.” Ear Hear 24(3): 195-7.
CHENG, PW, JH LUE, et al. (2010). “Assessment of gentamicin-induced vestibulo toxicity by click and galvanic vestibular-evoked myogenic potentials: a guinea pig investigation.” Neurotoxicology 31(1): 121-125.
CHERCHI, M., N. P. BELLINASO, ET AL. “Sound evoked triceps myogenic potentials.” Otol Neurotol 2009;30(4): 545-50.
CHIAPPA KH. Pattern-shift visual, brainstem auditory and short latency and somatosensory evoked potentials in multiple sclerosis. Ann New York Acad of Sci 1984;436:315-27.CODY DTR, BICKFORD RG. Averaged evoked myogenic responses in normal man. Laryngoscope 1969; 79: 400-46.
CHOU CH, WANG SJ, YOUNG YH. Feasibility of the simultaneous ocular and cervical vestibular evoked myogenic potentials in unilateral vestibular hypo function. Clin Neurophysiol 2009; 120(9):1699-705.
CIANFRONE G, GAGLIARDI M, CUIULI G, D’AMICO R. Vestibular evoked myogenic potentials and distortion product Otoacoustic emissions combined with glycerol testing in endolymphatic hydrops: Their value in early diagnosis. Ann Otol, Rhinol and Laryngol 2004;113:1000-04.
COLEBATCH JG, HALMAGYI GM. Vestibular evoked potentials in human neck muscles before and after unilateral vestibular deafferentation. Neurology 1992; 42: 2159.
COLEBATCH JG, HALMAGYI GM, SKUSE NF. Myogenic potentials generated by a click-evoked vestibulocolic reflex. J Neurol Neurosurg Psychiatry 1994; 57: 190-7.
COLEBATCH JG, DI LAZZARO V, QUARTARONE A, ROTHWELL JC, GRESTY M. Click-evoked vestibulocolic reflexes in torticollis. Mov Disord. 1995 Jul;10(4):455-9
COLEBATCH, J. G., B. L. DAY, ET AL. “Vestibular hypersensitivity to clicks is characteristic of the Tullio phenomenon.” J Neurol Neurosurg Psychiatry. 1998;65(5): 670-8.
COLEBATCH JG, ROTHWELL JC. Vestibular-evoked EMG responses in human neck muscles. J Physiol(Lond) 1993; 473: 18.
COLEBATCH JG, ROTHWELL JC, BRONSTEIN A, HUDMAN H. Click-evoked vestibular activation in the Tullio phenomenon. J Neurol Neurosurg Psychiatry 1994; 57: 1538-40.
COX, LEE, CAREY, & MINOR . Dehiscence of bone overlying the superior semicircular canal as a cause of an air-bone gap on audiometry: a case study. Am J Audiol, 2003;12, 11-6.
CRANE BT, MINOR LB, CAREY JP. Three-dimensional computed tomography of superior canal dehi-scence syndrome. Otol Neurotol. 2008 Aug;29(5):699-705.
CURTHOYS IS, MANZARI L, SMULDERS YE, BURGESS AM. A review of the scientific basis and prsctical application of a new test of utricular function -ocular vestibular evoked myogenic potentials to bone-conducted vibration. Acta Otolaryngologica Italica 2009;29(4):179-86.
CURTHOYS IS. A critical review of the neurophysiological evidence underlying clinical vestibular testing using sound, vibration and galvanic stimulate. Clin Neurophysiol 2010;121(3):132-44.
DA COSTA, DE SOUSA, & PIZA . Meniere’s disease: overview, epidemiology, and natural history. Otolaryngol Clin North Am, 2002;35(3), 455-95.
DERIU F, TOLU E, ROTHWELL JC. A short latency vestibulomasseteric reflex evoked by electrical stimulation over the mastoid in healthy humans. J Physiol. 2003 Nov 15;553(Pt 1):267-79. Epub 2003 Aug.
DERIU F, TOLU E, ROTHWELL JC. A sound-evoked vestibulomasseteric reflex in healthy humans. J Neurophysiol. 2005 May;93(5):2739-51. Epub 2004 Dec 15.
DE WAELE C, Tran Ba HUY TB, DIARD JP, FREYSS G, VIDAL PP. Saccular dysfunction in Ménière’s disease. The Am J of Otology 1999; 20 : 223-232,.
DE WAEL C, TRAN BA HUY P, DIARD JP, FREYSS G, VIDAL PP: Saccular dysfunction in Meniere’ s patients. A vestibular-evoked myogenic potential study.. Am N Y Acad Sci 1999, May 28;871:392-7.
DEFTEREOS SN, PANAGOPOULOS G, GRYLLIA M, GEORGONIKOU D, POLYZOI M, KECHAGIAS E, AES¬SOPOS A, KARAGEORGIOU CE. Neurophysiological monitoring of brainstem function in a patient with Wallenberg syndrome, using Vestibular Evoked Myogenic Potentials. Neurol Neurophysiol Neurosci. 2006 Jun 29:3.
DESMOND, AL. Vestibular evaluation. Vestibular function: Evaluation and treatment. Thieme Medical and Scientific Publishers: New York 2004;85-110.
DÌ LAZZARO V, QUARTARONE A, HIGUCHI K, ROTHWELL JC. Short-latency trigemino-cervical reflexes in man. Exp Brain Res 1995; 102: 474-82.
DIDIER A, CAZALS Y , AUROUSSEAU C. Brainstem connections of the anterior and posterior parts of the saccule of the guinea pig. Acta Otolaryngol (Stockh) 1987; 104: 385-91
DURRANT JD, FURMAN JMR. Long-latency rotational evoked potentials in subjects with and without bilateral vestibular loss. Electroencephalogr Clin Neurophysiol 1988; 71: 251-6.
ELEFTHERIADOU A, DEFTEREOS SN, ZARIKAS V, PANAGOPOULOS G, KORRES S ET AL. Vestibular evoked myogenic potential eliciting in normal subjects: comparison of four different methods. J Otolaryngol Head Neck Surg 2008; 37(5): 704-11
ELIDAN J, LEIBNER E, FREEMAN S, SELA M, NITZAN M, SOHMER H. Short and middle latency vestibular evoked responses to acceleration in man. Electroencephalogr Clin Neurophysiol 1991; 80: 140-5.
ERBEK S, ERBEK SS, YILMAZ S, YUCEL E, OZLUOGLU LN. Vestibular evoked myogenic potentials in Behcet’s disease. Eur Arch Otorhinolaryngol. 2008 Mar 26.
ERBEK S, GOKMEN Z, OZKIRAZ S, ERBEK SS, TARCAN A, OZLUOGLU LN. Vestibular Evoked Myogenic Potentials in Preterm Infants. Audiol Neurootol. 2008 Jul 29;14(1):1-6.
ERNST A, TODT I, SEIDL RO, EISENSCHENK A, BLÖDOW A, BASTA D. The application of vestibular-evoked myogenic potentials in otoneurosurgery. Otolaryngol Head Neck Surg. 2006 Aug;135(2):286- 90. Exp Brain Res 1986; 50: 149-52.
FARALLI M, MOLINI E, RICCI G, SCARDAZZA R, TRABALZINI F, ALTISSIMI G, FRENGUELLI A. Study of vestibular evoked myogenic potentials in unilateral vestibulopathy: Otolithic versus canal function testing. Otol Neurotol. 2006 Dec;27(8):1115-9.
FELDON SE, BURDER SK. The oulomotor system. In Adler’s Physiology of the eye. Chapter 5 Section 2, Edited y WM Hart (Mosby Year Book, St Louis), pp134-183.
FELIPE L, SANTOS MA, GONÇALVES DU. Vestibular evoked myogenic potential (VEMP) : evaluation of responses in normal subjects. Pro Fono 2008; 20(4): 249-54.
FERBER-VIART C, DUBREUIL C, DUCLAUX R, COLLET L. Réflexe sonomoteur vestibulaire dans les neurinomes de l’acoustique. Rev Laryngol Otol Rhinol 1995; 116:47-5l.
FERBER-VIART C, DUCLAUX R, COLLEAUX B, DUBREUIL C. Myogenic vestibular evoked potentials in normal subjects: comparison between responses obtained on sternomastoid and trapezius muscles. Acta Otolaryngol(Stockh) 1997; 117: 472-81.
FERBER-VIART C, SOULIER N, DULREUIL C, DUCLAUX R. Cochleovestibular afferent pathways of trapezius muscle responses to clicks in human. Acta Otolaryngol(Stockh) 1998; 118: 6- 10.
FERBER-VIART C, DUBREUIL C, DUCLAUX R. Vestibular evoked myogenic potentials in human: a review. Acta Otolaryngol(Stockh) 1999; 119: 6- 15.
FERNANDEZ C, GOLDBERG JM. Physiology of peripheral neurons innervating otolith organs on the squirrel monkey. I. Response to static tilts and long-duration centrifugal force. J Neurophysiol 1976; 39: 970-84. Formenti, Milano 2001.
FETTER M. Assessing vestibular function: which tests, when?J Neurol. 2000 May;247(5):335-42
FUJOMOTO C, MUROFUSHI T, CHIHARA Y, SUZUKI M, YAMASHA T, IWASAKI S. Novel subtype of idiopathic bilateral vestibulopathy: Bilateral absence of vestibular evoked myogenic potentials in the presence of normal caloric responses. J Neurol 2009; 256:1488-92.
FUNAHASHI, K., S. IMAE, T. KUWATA, et al. “Post auricular response in motor paresis with intracranial lesions.” Neurol Med Chir (Tokyo) 1992;32 (8): 566-71.
GARG BP, MARKAND ON, DEMYER WE, WARREN C JR. Evoked response studies in patients with adrenoleuko dystrophy and heterozygous relatives. Arch Neur. 1983;40:356-59.
GEISLER CD, FRISHKOPF LS, ROSENBLITH WA. Extracranial responses to acoustic clicks in man. Science 1958;128: 1210-11.
GIBSON WPR (1978). Essentials of clinical electric response audiometry. “The myogenic (sonomotor) responses”, chapter 6. Churchill Livingstone, New York
HAIN TC, YOO H, RUDISILL H, TANAKA-CAMERON A. VEMP testing in bilateral vestibular loss. Poster at ANA annual meeting, Chicago Oct 9, 2006.
HALMAGYI GM and others. The click-evoked vestibulo-ocular reflex in superior semicircular canal dehiscence. Neurology 2003:60:1172-1175
HALMAGYI GM, COLEBATCH JG. Vestibular evoked myogenic potentials in the sternomastoid muscle are not of lateral canal origin. Acta Otolaryngol (Stockh) 1995;Suppl 520: 1 -3.
HALMAGY GM, CURTHOYS I.S. Clinical testing of otolith function. Ann. N.Y. Sciences, 1999; 871: 195-204. HELLING K, SCHÖNFELD U, CLARKE AH. Treatment of Ménière’s disease by low-dosage intratympa¬nic gentamicin application: effect on otolith function. Laryngoscope. 2007 Dec;117(12):2244-50.
HEIDE G, FREITAG S, WOLLENBERG I, IRO H, SCHIMRIGK K, DILLMANN U. Click evoked myogenic potentials in the differential diagnosis of acute vertigo. J Neurol Neurosurg Psychiatry. 1999 Jun;66(6):787-90
HELLING K, SCHÖNFELD U, CLARKE AH. Treatment of Ménière’s Disease by Low-Dosage Intratympanic Gentamicin Application: Effect on Otolith Function. Laryngoscope. 2007 Sep 28;
HIRSCH A, ANDERSON H. Elevated stapedial reflex threshold and pathologic reflex decay. Acta Otolaryngologica, Supplement 1980;368:1-28.
HOFFERBERTH B. Evoked potentials to rotatory stimulation. Preliminary results. Acta Otolaryngol(Stockh) 1984; Suppl 406: 134-6.
HONG SM, PARK DC, YEO SG, CHA CI. Vestibular evoked myogenic potentials in patients with benign paroxysmal positional vertigo involving each semicircular canal. Am J Otolaryngol. 2008 May-Jun;29(3):184-7.
HONRUBIA & HOFFMAN. Practical anatomy and physiology of the vestibular system. In: Jacobson,Newman, & Kartush. (Eds). 1997;Handbook of Balance Function
Testing. San Diego, CA: Singular.
HU YF, CHENG PW, YOUNG YH. Comparison of vestibular function between large
HUANG, SU, & CHENG. Effect of click duration on vestibular-evoked myogenic potentials. Acta Otolaryngologica, 2005;125(2), 141-144.cerebellopontine angle meningioma and schwannoma.
HUANG, T. W., P. W. CHENG AND H. C. SU (2006). “The influence of unilateral versus bilateral clicks on the vestibular-evoked myogenic potentials.” Otol Neurotol27(2): 193-6.
IIDA M, AIHARA H, TAKAHASHI H, HITOUJI K, NOMURA K: EMG potentials elicited by forehead taps in the sternocleidomastoid muscles and lower leg muscles±a study on patients with vestibular lesions. Tokai J Exp Clin Med 1998, Nov; 23(5):225-30.
IIDA M: Short-latency EMG potentials elicited by head taps insternocleidomastoid muscles: a study on normal human subjects and patients with central or vestibular lesions. Auris Nasus Larynx 1998,Dec;25(4):355-9
ISARADISAIKUL S AND OTHERS. Reliability of vestibular evoked myogenic potentials in healthy subjets. Otol Neurotol 29:542-544, 2008
ITO K, ISHIMOTO S, MUROFUSHI T. Narrow Internal Auditory Meatus. An idiopathic case confirming the origin and pathway of vestibular evoked myogenic potentials in humans. Arch Otolaryngol Head Neck Surg; 127: 275-78, 2001.
ITO K, KARINO S, MUROFUSHI T. Effect of head position on vestibular evoked myogenic potentials with toneburst stimuli. Acta Otolaryngol. 2007 Jan;127(1):57-61.
IWASAKI S, SMULDERS YE, BURGESS AM, MCGARVIE LA, MACDOUGALL HG, HALMAGYI GM, CURTHOYS IS. Ocular vestibular evoked myogenic potentials to bone-conducted vibration of the midline forehead at Fz in healthy subjects. Clin Neurophysiol 2008;119:2135-47.
IWASAKI S , SMULDERS YE , BURGESS AM , MCGARVIE LA , MACDOUGALL HG , HALMAGYI GM , CURTHOYS IS . Clin Neurophysiol. 2008 Sep; 119 (9): 2135-47. IWASAKI S., CHIHARA Y., SMULDERS Y.E., BURGESS A.M., HALMAGYI G.M., CURTHOYL I.S., MUROFUSHI T., The role of the superior vestibular nerve in generating ocular vestibular-evoked myogenic potentials to bone conducted vibration at Fz Clinical neurophysiology. March 2009;Volume 120, Issue 3, Pages 588–593
IWASAKI S, MUROFUSHI T, CHIHARA Y, USHIO M, SUZUKI M, CURTHOYS IS, YAMASOBA T. Ocular vestibular evoked myogenic potentials to bone conducted vibration in vestibular schwannomas. Otol Neurotol 2010;31(1):147-52.
JAGADEESH RK, GORE GB. ABR-clinical application: Cochlear vs retrocochlear sites of lesion testing 2002. Paper presented at the first neuroaudiology conference held at ISH, Bangalore.
JANZEN J, SCHLINDWEIN P, BENSE S, BAUERMANN T, VUCUREVIC G, STOETER P, DIETERICH M. Neural correlates of hemispheric dominance and ipsilaterality within the vestibular system. Neuroimage. 2008 Jul 2.
JERGER J, JERGER S, MAULDIN L. Studies in impedance audiometry. I. Normal and Sensorineural ears. Arch Otolaryngol 1972;96:513-23.
JEWETT D, WILLISTON J. Auditory evoked far fields averaged from positive scalp of humans. Brain 1971;94:681-96.
JIN, et al. Vestibular-evoked myogenic potentials in cochlear implant children. Acta Otolaryngol, 2006;126(2):164-9.
JIN Y, SHINJO Y, AKAMATSU Y, OGATA E, NAKAMURA M, KIANOUSH S, YAMASOBA T, KAGA K. Vestibular evoked myogenic potentials evoked by multichannel cochlear implant influence of C levels. Acta Otolaryngol. 2008 Mar;128(3):284-90.
JOMBIK P, BAHYL V. Short latency responses in the averaged electro-oculogram elicited by vibrational impulse stimuli applied upon the skull: could they reflect the vestibulo-ocular reflex function ? JNNP 2005;76:222-228,
KIANG NYS, CRIST AH, FRENCH MA, EDWARDS AG. Postauricular electric response to acoustic stimuli in humans. Q Progr Report 44 Research Laboratory of Electronics, Massachusetts Institute of Technology, Cambridge. Mass 1963; 68: 218-25.
KIM HA, HONG JH, LEE H, YI HA, LEE SR, LEE SY, JANG BC, AHN BH, BALOH RW. Otolith dysfunction in vestibular neuritis: recovery pattern and a predictor of symptom recovery. Neurology. 2008 Feb 5;70(6):449-53.
KUSHIRO, K., M. ZAKIR, ET AL. “Saccular and utricular inputs to single vestibular neurons in cats.” Exp Brain Res. 2000;131(4): 406-15.
LANDIS C, HUNT W A. The startle pattern. New York, NY: Farrar and Rinehart, 1939.
Lee KJ and others. The usefulness of rectified VEMP. Clinical and Experimental Otolaryngology. 2008; 1:3,143-147,
Lehnen N and others. Head impulse test reveals residual semicircular canal function after vestibular neurectomy. Neurology 2004:62:2294-2296
Li MW, HOULDEN D, TOMLINSON RD. Click evoked EMG responses in sternocleidomastoid muscles: characteristics in normal subjects. J Vestib Res 1999:9(5):327-34
LI G, ELIDAN J, SOHMER H. Peripheral generators of the vestibular evoked potentials in the cats. Arch Otolaryngol Head Neck Surg 1995; 121: 34-8.
LIAO K, WAGNER J, JOSHI A, ESTROVICH I, WALKER MF, STRUPP M, LEIGH RJ. Why do patients with PSP fall? Evidence for abnormal otolith responses. Neurology. 2008 Mar 4;70(10):802-9.
LIM CL, CLOUSTON P, SHEEAN G, YIANNIKAS C. The influence of voluntary EMG activity and click intensity on the vestibular click evoked myogenic potential. Muscle Nerve 1995; 18: 1210-3.
LIN KY, HSU YS, YOUNG YU. Brainstem lesion in benign paroxysmal vertigo in children: Evaluated by a combined ocular and cervical vestibular evoked myogenic potential test. Int J Pediat Otorhinolaryngol 2010;74(5):523-27.
LIO L, YOUNG Y. Vestibular evoked myogenic potentials in basilar artery migraine. The Laryngoscope, 2004;114:1305–1309,
LOWENSTEIN O, ROBERTS TDM. The localization and analysis of the responses to vibration from the isolated elasmobranch labyrinth. A contribution to the problem of the evaluation of hearing in vertebrates. J Physiol (Lond) 1951; 114: 471 -89.
LUTMAN ME. Diagnostic Audiometry. In Stephens D (Ed): Adult Audiology, pp.12/1-31. In Scott-Brown’s Otolaryngology (6th ed). Oxford: Butterworth-Heinemann. (Indian edition: KM Varghese Company, Mumbai.) 1997;2.
MAGLIULO G, CUIULI G, GAGLIARDI M, CINIGLIO-APPIANI G, D’AMICO R. Vestibular evoked myogenic potentials and glycerol testing. Laryngoscope 2004;114(2):338-43.
MAGLIULO G, PARROTTO D, GAGLIARDI M. Vestibular evoked myogenic and periocular potentials after vestibular schwannoma surgery. Ann Otol Rhinol Laryngol. 2008 Jan;117(1):11-4.
MANZARI L., TEDESCO A.-R., BURGESS A.M., CURTHOYS I.S. Ocular and cervical vestibular-evoked myogenic potentials to bone conducted vibration in Ménière’s disease during quiescence vs during acute attacks .Clinical neurophysiology July 2010Volume 121, Issue 7, Pages 1092–110
MANZARI L, BURGESS AM, CURTHOYS IS. Ocular and cervical vestibular evoked myogenic potentials in response to bone-conducted vibration in patients with probable inferior vestibular neuritis. J Laryngol Otol. 2012 Jul;126(7):683-91.
MANZARI L, BURGESS AM, MCGARVIE LA, CURTHOYS IS. Ocular and cervical vestibular evoked myogenic potentials to 500 Hz fz bone-conducted vibration in superior semicircular canal dehiscence. Ear Hear. 2012 Jul-Aug;33(4):508-20.
MANZARI L, BURGESS AM, MCGARVIE LA, CURTHOYS IS. An indicator of probable semicircular canal dehiscence: ocular vestibular evoked myogenic potentials to high frequencies. Otolaryngol Head Neck Surg. 2013 Jul;149(1):142-5. doi: 10.1177/0194599813489494. Epub 2013 May 14.
MAGLIULO ET AL. Vestibular evoked myogenic potentials and distortion-product otoacoustic emissions combined with glycerol testing in endolymphatic hydrops: their value in early diagnosis. Ann Otol Rhinol Laryngol, 2004;113(12),1000-5.
MATSUZAKI M, MUROFUSHI T. Vestibular evoked myogenic potentials in patients with idiopathic bila-teral vestibulopathy. Report of three cases. ORL J Otorhinolaryngol Relat Spec; 63(6), 349-52, 2001.
MATSUZAKI M, MUROFUSHI T., MIZUNO M. Vestibular evoked myogenic potentials in acoustic tumor patients with normal auditory brainstem responses. Eur Arch Otorhinolaryngol 1999; 256:1-4.
MC CUE M.P., GUINAN J.J. 1997: Sound-evoked activity in primary afferent neurons of a mammalian vestibular system. Am. J. Otol. 18: 355- 360.
MC CUE MP, GUINAN JJ. Acoustically responsive fibers in the vestibular nerve of the cat. J Neurosci 1994; 14:6058-70.
MCNERNEY KM, BURKARD RF. The vestibular evoked myogenic potential (VEMP): air- versus bone-conducted stimuli. Ear Hear. 2011 Nov-Dec;32(6):e6-e15.
MCGEE TM, OLSZEWSKI J. Streptomycine sulfate and dihydrostreptomycin toxicity: behavioral and histopathologic studies. Arch Otolaryngol 1962; 75: 295-311.
MELVIN TA, DELLA SANTINA CC, CAREY JP, MIGLIACCIO AA. The effects of coclhlear implantation on vestibular function. Otol Neurotol 2009; 30(1): 87-94.
MERCHANT SN, NAKAJIMA HH, HALPIN C, NADOL JB JR, LEE DJ, INNIS WP, CURTIN H, ROSOWSKI JJ. Clinical investigation and mechanism of air-bone gaps in large vestibular aqueduct syndrome. Ann Otol Rhinol Laryngol. 2007 Jul;116(7):532-41.
MIRA E., VICINI C. Introduzione generale. Atti della XVIII Giornate Italiane di Otoneurologia. Palermo, 30 marzo 2001. Ed Formenti, Milano 2001.
MIRA E., VICINI C. Prospettiva storica. Atti della XVIII Giornate Italiane di Otoneurologia, Palermo, 30 marzo 2001 – Ed Formenti, Milano 2001.
MODUGNO GC, MAGNANI G, BRANDOLINI C, et al. Could vestibular evoked myogenic potentials (VEMPs) also be useful in the diagnosis of perilymphatic fistula? … J Otol 1999;20:174–8.
MONOBE H, MUROFUSHI T.Vestibular testing by electrical stimulation in patients with unilateral vestibular deafferentation: galvanic evoked myogenical responses testing versus galvanic body sway testing. Clin. Neurophysiol. 2004 Apr;115(4):807-11.
MORAWIEC-BAJDA A. Personal experiences with vestibular evoked myogenic potentials as a modern method of diagnosing vestibular organ lesion and monitoring treatment. Int Tinnitus J. 2005;11(2):150-7.
MORAWIEC-BAJDA A, GRYCZYNSKI M. Function of sensorimotor equilibrium function in ederly patients on the basis of vestibular evoked myogenic ptentials. Otolaryngol Pol; 54(6): 685-9, 2000.
MORAWIEC-BAJDA A, ZIELINSKA M: recording of vestibular myogenic evoked potentials in patients with disturbed inner function. Neurol Neurochir Pol 1999, Sep-Oct;33(5):1053-62.
MORAWIEC-BAJDA A: Examination of averaged EMG potentials from the neck muscles after vestibular organ activation by acoustic stimulus. Otolaryngol Pol 1998;52(5):571-8.
MURNANE OD, AKIN FW. Vestibular evoked myogenic potentials. Seminars in Hearing 2009;30(4):267-80.
MUROFUSHI T, CURTHOYS DA, TOPPLE AN. Responses of guinea pig primary vestibular neurons to clicks. Exp Brain Res 1995; 103: 174-8.
MUROFUSHI T, HALMAGYI GM, YAVOR RA, COLEBACH JG. Absent vestibular evoked myogenic potentials in vestibular neurolabyrinthitis: an indicator of inferior vestibular nerve involvement?. Arch Otolaryngol Head Neck Surg 1996;122: 845-48.
MUROFUSHI T, MATSUZAKI M, MIZUNO M. Vestibular evoked myogenic potentials in patients with acoustic neuromas. Arch Otolaryngol Head Neck Surg 1998;124: 509- 12..
MUROFUSHI T, MATSUZAKI M, MIZUNO M. Vestibular evoked myogenic potentials in acoustic tumor patients with normal auditory brainstem responeses. Eur Arch Otorhinolaryngol.1999; 256: 1-4,.
MUROFUSHI, T., M. MATSUZAKI, ET AL. . “Short tone burst-evoked myogenic potentials on the sternocleidomastoid muscle: are these potentials also of vestibular origin?” Arch Otolaryngol Head Neck Surg. 1999;125(6): 660-4.
MUROFUSHI T, SHIMIZU K, TAKEGOSHI H, CHENG PW. Diagnostic value of prolonged latenties in the vestibular evoked myogenic potentials. Arch Otolaryngol Head and Neck Surg, 2001;127(9): 1069-72,.
MUROFUSHI T, TAKEGOSHI H, OHKI M, OZEKI H. Galvanic-evoked myogenic responses in patients with an absence of click-evoked vestibulo-collic reflexes. Clin Neurophysiol, 2002;113(2): 305-9.
MUROFUSHI T, MONOBE H, OCHIAI A, OZEKI H. The site of lesion in “vestibular neuritis”: study by galvanic VEMP.Neurology.2003,12;61(3):417-8.
MUROFUSHI T, USHIO M, TAKAI Y, IWASAKI S, SUGASAWA K. Does acute dysfunction of the saccular afferents affect the subjective visual horizontal in patients with vestibular neurolabyrinthitis? Acta Otolaryngol Suppl. 2007 Dec;(559):61-4.
NATOUT NHY, TERR LI, LINTHICUM FH, HOUSE WF. Topography of vestibulocochlear nerve fibers in the posterior cranial fossa. Laryngoscope 1987; 97: 954-8.
NERI W., GUIDI A., VICINI C. I VEMPs da head tapping. Atti della XVIII Giornate Italiane di Otoneurologia, Palermo, 30 marzo 2001 – Ed Formenti, Milano 2001.
NUTI D, VICINI C, MIRA E, VALLI P, VALLI S, MONTEVECCHI F: I potenziali evocati vestibolari nella pratica clinica: la nostra esperienza con i VEMPs. Otoneurologia 2000 Feb 2:: 7-13.
NONG DX, URA M, KYUNA A, OWA T, NODA Y. Saccular origin of acoustically evoked short latency negative response. Otol Neurotol. 2002 Nov;23(6):953-7.
OCHI K, OHASHI T, WATANABE S. Vestibular-evoked myogenic potential in patients with unilateral vestibular neuritis: abnormal VEMP and its recovery. J Laryngol Otol 2003; 117: 104-8
OHKI M, MATSUZAKI M, SUGASAWA K. Vestibular evoked myogenic potentials in patients with controlateral delayed endolymphatic hydrops. Eur. Arch Otorhinolaryngol; 259:24-26, 2002.
OSEI-LAH V, CERANIC B, LUXON LM. Clinical value of tone burst vestibular evoked myogenic potentials at threshold in acute and stable Ménière’s disease, : J Laryngol Otol. 2008 May;122(5):452-7. Epub 2007 Jul 3
OZEKI H, MATSUZAKI M, MUROFUSHI I. Vestibular evoked myogenic potentials in patients with bilateral profound hearing loss. ORL 1999;61:80-83.
OZEKI H, IWASAKI S, USHIO M, TAKEUCHI N, MUROFUSHI T. The lesion site of vestibular dysfunction in Ramsay Hunt syndrome: a study by click and galvanic VEMP. J Vestib Res. 2006;16(4-5):217-22.
OZLUOGLU LN, AKKUZU G, OZGIRGIN N, TARHAN E. Reliability of the vestibular evoked myogenic potential test in assessing intratympanic gentamicin therapy in Ménière’s disease. Acta Otolaryngol. 2008 Apr;128(4):422-6.
PAPATHANASIOU ES, THEOCHARIDOU EK, PAPACOSTAS SS. Parallel auditory vestibular evoked neurogenic and myogenic potential results in a case of peripheral vestibular dysfunction, showing that the former originates from the vestibular system. Electromyogr Clin Neurophysiol. 2006 Mar¬Apr;46(2):105-11.
PATKÓ T, SIMÓ M, ARÁNYI Z. Vestibular click-evoked myogenic potentials: sensitivity and factors determining abnormality in patients with multiple sclerosis. Mult Scler. 2007 Mar;13(2):193-8.
PATKÓ T., VIDAL P.P., VIBERT N., TRAN BA HUY P., DE WAELE C. Vestibular evoked myogenic potentials in patients suffering from an unilateral acoustic neuroma: a study of 170 patients Clin Neurophysiol 2003 ; 114 : 1344-1350
PICCIOTTI PM, FIORITA A, DI NARDO W, QUARANTA N, PALUDETTI G, MAURIZI M. VEMPs and dynamic posturography after intratympanic gentamycin in Menière’s disease.1: J Vestib Res. 2005;15(3):161-8.
PICCIOTTI PM, FIORITA A, DI NARDO W, CALÒ L, SCARANO E, PALUDETTI G. Vestibular evoked myogenic potentials in children. Int J Pediatr Otorhinolaryngol. 2007 Jan;71(1):29-33. Epub 2006 Sep 22.
PIRODDA E, GHIDINI S, ZEMETI MA. Investigations into vestibular evoked responses.Acta Otolaryngol (Stockh) 1987; 104: 77-84.
POLLAK L, KUSHNIR M, STRYJER R. Diagnostic value of vestibular evoked myogenic potentials in cerebelar and lower-brainstem strokes. Neurophysiol Clin. 2006 Jul-Aug;36(4):227-33.
PSILLAS G, CONSTANTINIDIS J, TRIARIDIS S, VITAL V. Acute unilateral total deafness and vestibular findings after gunshot noise. Laryngorhinootologie. 2007 Dec;86(12):879-82.
RAUCH SD and others. Vestibular evoked myogenic potentials show altered tuning in patients with Meniere’s disease. Otol Neurotol. 2004:25:333-338,
Rauch SD and others. Vestibular evoked myogenic potentials versus vestibular test battery in patients with Meniere’s disease. Otol Neurotol. 200;425:981-986,
RICHMOND FJR, ABRAHAMS VC. Morphology and distribution of muscle spindles in dorsal muscles of the cat neck. J Neurophysiol 1975; 38: 1322-39.
ROBERTSON DD, IRELAND DJ. Vestibular evoked myogenic potentials. J Otolaryngol 1995; 24: 3-7.
RODIONOV V, ELIDAN J, SELA M, NITZAN M, SOHMER H. Vertical plane short and middle latency vesti¬bular evoked potentials in humans. Ann Otol Rhinol Laryngol 1996; 105: 43-8.
ROSE PK, SPROTT N. Proprioceptive and somatosensory influences on neck muscle motoneurons. Progr Brain Res 1979; 50: 255-62.
ROSENGREN SM, TODD NP, COLEBATCH JG. Vestibular evoked extraocular potentials produced by stimulation with bone-conducted sound. Clin Neurophysiol 2005;116:1938-48.
ROSENGREN SM, NOGAJSKI JH, CREMER PD, COLEBATCH JG. Delayed vestibular evoked responses to the eyes and neck in a patient with an isolated brainstem lesion. Clin Neurophysiol. 2007 Sep;118(9):2112-6.
ROSENGREN SM, AW ST, HALMAGYI GM, TODD NP, COLEBATCH JG. Ocular vestibular evoked myo¬genic potentials in superior canal dehiscence. J Neurol Neurosurg Psychiatry. 2008 May;79(5):559-68.
ROSENGREN SM, HALMAGYI GM, COLEBATCH JG. Vestibular hypersensitivity to sound in superior canal dehiscence: large evoked responses in the legs produce little postural sway. Clin Neurophysiol. 2008 Jul;119(7):1674-82.
RUDISILL, HE AND TC HAIN (). “Lower extremity myogenic potentials evoked by acoustic stimuli in healthy adults.” Otol Neurotol. 2008;29 (5): 688-92.
SAIDEL WM, POPPER AN. The saccule may be the transducter for directional hearing of nonostario-physine teleosts. Exp Brain Res. 1983; 50(1):149-52.
SALVINELLI F, TRIVELLI M, D’ASCANIO L. Early diagnosis of otosclerosis: possible role of VEMPs. Acta Otolaryngol. 2007 Sep;127(9):1008.
SANDHU JS, BELL SL. Effects of eye position on the vestibular evoked myogenic potential. Acta Otolaryngol. 2008 Jun 11:1-4.
SARTUCCI F, LOGI F. Vestibular-evoked myogenic potentials: a method to assess vestibulo-spinal conduction in multiple sclerosis patients. Brain Res Bull; 59 (1), 59, 2002.
SATO H, IMAGAWA M, SASAKI M, IKEGAMI H, UCHINO Y. Connections between the saccular nerve and neck extensor and flexor motoneurons in decerebrate cats. Soc Neurosci 1994; 20: 1192.
SAZGAR AA, AKRAMI K, AKRMI S, MEHDIZADEH J, FEZI A. Evaluation of brainstem function in patients with spasmodic dysphonia using vestibular evoked myogenic potentials and auditory brainstem responses. Acta Otolaryngol. 2008 Feb;128(2):177-80.
SHEYKHOLESLAMI et al. Vestibular-evoked myogenic potentials in infancy and early childhood. Laryngoscope, 2005;115(8), 1440-4.
SCHLINDWEIN P, MUELLER M, BAUERMANN T, BRANDT T, STOETER P, DIETERICH M. Cortical representation of saccular vestibular stimulation: VEMPs in f MRI. Neuroimage. 2008 Jan 1;39(1):19-31.
SCHMIDT R, SATALOFF R, NEWMAN J, SIEGEL J, MYERS D. The sensitivity of auditory brainstem response testing for the diagnosis of acoustic neuromas. Arc Otolaryngol-Head Neck Surg 2001;127:19-22.
SEO T and others. Furosemide loading vestibular evoked myogenic potential for unilateral Meniere’s disease. Otol Neurotol. 2003;24:283-288,
SEO T, MIYAMOTO A, SAKA N, SHIMANO K, NISHIDA T, HASHIMOTO M, SAKAGAMI M. Vestibular evo¬ked myogenic potential induced by bone-conducted stimuli in patients with conductive hearing loss. Acta Otolaryngol. 2008 Jun;128(6):639-43.
SHEYKHOLESLAMI K, MUROFUSHI T, KERMANY MH, KAGA K. Bone-conducted evoked myogenic potentials from sternocleidomastoid muscle. Acta Otolaryngol; 120. 731-734, 2000.
SHIMIZU K, MUROFUSHI T, SAKURAI M, HALMAGYI M. Vestibular evoked myogenic potentials in mul¬tiple sclerosis. J Neurol Neurosurg Psychiatry. 2000 Aug;69(2):276-7
SHINJO Y, JIN Y, KAGA K. Assessment of vestibular function of infants and children with congenital and acquired deafness using the ice-water caloric test, rotational chair test and vestibular-evoked myogenic potential recording. Acta Otolaryngol. 2007 Jul;127(7):736-47.
SHOJAKU H, TAKEMORI S, KOBAYASHI K, WATANABE Y. Clinical usefulness of glicerol vestibular evoked myogenic potentials: preliminary report. Acta Otolaryngol suppl; 2001;545: 65-68,.
SHOJAKU H, and others. Glyerol VEMP. Barany society meeting abstracts, Seattle, 2002
SINGBARTL F, BASTA D, SEIDL RO, ERNST A, TODT I. Preoperative recordings of vestibular-evoked myogenic potentials in otosclerosis. Otol Neurotol. 2006 Dec;27(8):1070-3.
SIRRI M., CASADIO P., CIUFFOLOTTI R., PARI M., CAMPANINI A., VICINI C. L’ esperienza forlivese nei VEMPs. Atti della XVIII Giornate Italiane di Otoneurologia, Palermo, 30 marzo 2001 – Ed Formenti, Milano 2001.
STAMATIOU G, GKORISTA E, XENELLIS J, RIGA M, KORRES S. Semicircular canal versus otolithic involvement in idiopathic sudden hearing loss. J Laryngol Otol 2009;123:1325-30.
STARR A, HAMILTON A. Correlation between confirmed sites of neurological lesions and abnormalities of far field auditory brainstem responses. EEG and Clin Neurophyshol 1976;41: 596-608.
STEIN M B, CARPENTER MB. Central projections of portions of the vestibular ganglia innervating spe-cific parts of the labyrinth in the rhesus monkey. Am J Anat 1967;120: 281-318.
SU and others. Aging effect on vestibular evoked myogenic potentials. Otol and Neurotol, 2004;24:977-980,.
SU CH, YOUNG YH. Differentiating cerebellar and brainstem lesions with ocular vestibular evoked myogenic potential test. Eur Arch Otolaryngol 2011;268(6):923-30.
SUZUKI JI, COHEN B. Head eye body and limb movements from semicircular canal nerves. Expl Neurol 1964; 10: 393-405.
SUZUKI M, SAITO Y, USHIO M, YAMASOBA T, HATTA I, NAKAMURA M. Vestibulo-ocular reflex (VUR) preserved in bilateral severe vestibular malformations with internal auditory canal stenosis. Acta Otolaryngol. 2007 Nov;127(11):1226-30.
TAKEGOSHI H, MUNROFUSHI T. Vestibular evoked myogenic potentials in patients with spinocerebellar degeneration. Acta Otolaryngol, 2000;120(79, 821-4,.
TAYLOR, RL, AP BRADSHAW, et al. “Augmented ocular vestibular evoked myogenic potentials to air-conducted sound in large vestibular aqueduct syndrome.” Ear Hear, 2012;33(6): 768-771.
TIMMER FC, ZHOU G, GUINAN JJ, KUJAWA SG, HERRMANN BS, RAUCH SD. Vestibular evoked myogenic potential (VEMP) in patients with Ménière’s disease with drop attacks. Laryngoscope. 2006 May;116(5):776-9.
TODD NP, ROSENGREN SM, COLEBATCH JG. A short latency vestibular evoked potential (VEMP’s) produced by bone-conducted acoustic stimulation. J Acoust Soc Am. 2003 Dec;114(6 Pt 1):3264-72
TODD NP, ROSENGREN SM, COLEBATCH JG. Vestibular evoked ocular responses to AC/BC sound III: a neuroanatomical and physiological interpretation of BC-UVEMPS. J Vest Res 2004;14:216-7
TODD NP, ROSENGREN SM, COLEBATCH JG. A source analysis of short-latency vestibular evoked potentials produced by air- and bone-conducted sound. Clin Neurophysiol. 2008 Aug;119(8):1881-94. TOWNSEND GL, CODY DTR. The averaged inion response evoked by acoustic stimulation: its relation to the saccule. Ann Otol 1971; 80: 121-32.
TOWSEND GL, CODY DTR. 1971. The averaged inion response evoked by acoustic stimulation: its relation to the saccule. Ann Otol 80: 121-32.
TRIVELLI M, VICINI C, D’ASCANIO L, GRECO F, SALVINELLI F. The effects of logon versus click on vestibular evoked myogenic potentials. Acta Otolaryngol. 2008 Mar;128(3):314-7.
TSUBOTA M, SHOJAKU H, HORI E, FUJISAKA M, HAYASHI N, KURIMOTO M, HATAKEYAMA N, YAMA¬ZAKI M, NISHIJO H, ONO T, YAMAMOTO H, WATANABE Y. Effects of vestibular nerve section on sound-evoked myogenic potentials in the sternocleidomastoid muscle of monkeys. Clin Neurophysiol. 2007 Jul;118(7):1488-93.
TSUBOTA M, SHOJAKU H, HORI E, FUJISAKA M, NISHIJO H, ONO T, YAMAMOTO H, WATANABE Y. Sound-evoked myogenic potentials on the sternocleidomastoid muscle in monkeys. Acta Otolaryngol. 2006 Dec;126(11):1171-5.
TSUTSUMI T, KOMATSUZAKI A, NOGUCHI Y, TOKANO H, KITAMURA K. Postoperative vestibular-evo¬ked myogenic potentials in cases with vestibular schwannomas. Acta Otolaryngol; 121: 490-93, 2001.
TSUTSUMI T, TSUNODA A, NOGUCHI Y, KOMATSUZAKI A. Preditcion of the nerves of origin of vestibular schwannomas with vestibular evoked myogenic potentials. The Am. J of Otology; 21: 712-715, 2000.
TU CE, YOUNG YH. Audiovestibular evolution in a patient with multiple sclerosis. Ann Otol Rhinol Laryngol 2004;113:726-29.
TULLIO P. Das Uhr und die Entstehung der Sprache und Schrift. Urban and Scharzenberg 1929; Munchen, Germany.
UCHINO Y, SATO H, SASAKI M, IMAGAWA M, LKEGAMI H,ISU N, GRAL. W. Saculocollic reflex arcs in cats. J Neurophysiol 1997; 77: 3003-12.
USHIO M, IWASAKI S, SUGASAWA K, MUROFUSHI T. Superficial siderosis causing retrolabyrinthine involvement in both cochlear and vestibular branches of the eighth cranial nerve. Acta Otolaryngol. 2006 Sep;126(9):997-1000.
USHIO M, MATSUZAKI M, TAKEGOSHI H, MUROFUSHI T. Click- and short tone burst-evoked myogenic potentials in cerebellopontine angle tumors. Acta Otolaryngol 545: 133-135, 2001.
WAELE CD and others. Saccular dysfunction in Meniere’s disease. Am J Otol 1999:20:223-32
VALLI P., VALLI S., VICINI C. Basi neuro-anatomo-fisiologiche. Atti della XVIII Giornate Italiane di Otoneurologia, Palermo, 30 marzo 2001 – Ed Formenti, Milano 2001
VALLI P., VALLI S., VICINI C. I VEMPs in letteratura. Atti della XVIII Giornate Italiane di Otoneurologia, Palermo, 30 marzo 2001 – Ed Formenti, Milano 2001
VALLI P., VALLI S., VICINI C. Il nostro contributo metodologico. Atti della XVIII Giornate Italiane di Otoneurologia, Palermo, 30 marzo 2001 – Ed Formenti, Milano 2001.
WANG CHI-TE, YI-HO YOUNG, Comparison of the Head Elevation Versus Rotation Methods in Eliciting Vestibular Evoked Myogenic Potentials,Ear & Hearing. 27(4):376-381, August 2006
WANG YP, YOUNG YH. Vestibular-evoked myogenic potentials in chronic noise-induced hearing loss..Otolaryngol Head Neck Surg. 2007 Oct;137(4):607-11.
WATSON, SR AND JG COLEBATCH (). “Vestibulocollic reflexes evoked by short-duration galvanic stimulation in man.” J Physiol. 1998;513 (Pt 2): 587-97.
WELGAMPOLA MS, COLEBACH JG. Characteristics of tone burst-evoked myogenic potentials in the sternocleidomastoid muscles. Otol Neurotol. 2001;22:796-802,
WELGAMPOLA et al. Vestibular-evoked myogenic potential thresholds normalize on plugging superior canal dehiscence. Neurology 2008;70:464-472
WELGAMPOLA MS, CAREY JP. Waiting for the evidence: VEMP testing and the ability to differentiate utricular versus saccular function. Otolaryngol Head Neck Surg 2010;143(2):281-83.
VERSINO M, COLNAGHI M, CALLIECO R, BERGAMASCHI R, ROMANI A, COSI V. Vestibular evoked myo¬genic potentials in multiple sclerosis patients. Clin Neurophysiol, 2002;113(9): 1464-9,.
VERSINO M, COLNAGHI M, CALLIECO R, COSI V. Vestibular evoked myogenic potentials: test-retest reliability. Funct Neurol, 2001;16(4), 299-309,.
VICINI C., SIRRI M., CASADIO P., FRASCONI PC., FRASSINETI S. Interpretazione dei tracciati. Atti della XVIII Giornate Italiane di Otoneurologia, Palermo, 30 marzo 2001 – Ed Formenti, Milano 2001.
VICINI C., VALLI P., VALLI S., CAMPANINI A. Il nostro assetto di registrazione dei VEMPs. Atti della XVIII Giornate Italiane di Otoneurologia, Palermo, 30 marzo 2001 – Ed Formenti, Milano 2001.
VICINI C., VALLI P., VALLI S., MODUGNO G. Sviluppi futuri. Atti della XVIII Giornate Italiane di Otoneurologia, Palermo, 30 marzo 2001 – Ed Formenti, Milano 2001.
VICINI C., VALLI S., VALLI P. Indicazioni e limiti dei VEMPs. Atti della XVIII Giornate Italiane di Otoneurologia, Palermo, 30 marzo 2001 – Ed Formenti, Milano 2001.
VICINI V, VALLI S, MONTEVECCHI F, GUIDI C: VEMPs e VPPB: quali applicazioni? 1999 In Revisione critica di venti anni di vertigine parossistica posizionale benigna (VPPB).
VON BÉKÉSY G. Uber akustishe Reizung des vestibularapparates. Arch F D Ges Physiol 1935; 236: 59.
WANG CP, HSU WC, YOUNG YH. Vestibular evoked myogenic potentials in neurofibromatosis. Ann Otol Rhinol Laryngol 2005;114:69-73.
WANG CT, YOUNG YH. Comparison of the head elevation versus rotation methods in eliciting vestibu-lar evoked myogenic potentials. Ear Hear. 2006 Aug;27(4):376-81.
WANG YP, HSU WC, YOUNG YH. Vestibular evoked myogenic potentials in acute acoustic trauma. Otol Neurotol. 2006 Oct;27(7):956-61.
WANG MC, LEE GS. Vestibular evoked myogenic potentials in middle ear effusion. Acta Otolaryngol. 2007 Jul;127(7):700-4.
WANG SJ, CHEN CN, HSIEH WS, YOUNG YH. Development of vestibular evoked myogenic potentials in preterm neonates. Audiol Neurotol. 2008;13(3):145-52.
WATSON SRD, COLEBATCH JG. Vestibulocollic reflexes evoked by short-duration galvanic stimulation in man. Journal of Physiology 1998; 513: 587-597.
WATSON SRD, HALMAGYI M, COLEBATCH J. Vestibular hypersensitivity to sound (Tullio phenomenon)- structural and functional assessment. Am Acad Neurol 2000;54:722-28.
WELGAMPOLA MS, MYRIE OA, MINOR LB, CAREY JP. Vestibular-evoked myogenic potential thresholds normalize on plugging superior canal dehiscence. Neurology. 2008 Feb 5;70(6):464-72.
WILSON VJ, WYLIC RM, MARCO LA. Projection to the spinal cord from the medial and descending vestibular nuclei of the cat. Nature 1967; 215: 429-30.
WILSON VJ, GACEK RR, MAEDA M, UCHINO Y. Saccular and utricular input to cat neck motoneurons. J Neurophysiol 1977; 40: 63-73.
WILSON VJ, SCHOR RH. The neural substrate of the vesti bulocollic reflex. Whatneeds to be learn ed. Exp Brain Res 1999;129:483-493.
WINTERS SM, BERG IT, GROLMAN W, KLISS SF. Ocular vestibular evoked myogenic potentials: Frequency tuning to air-conducted acoustic stimuli in healthy subjects and Meniere’s disease. Audiol Neurotol 2012;17(1):12-19.
WITT HP, BLEECKER JD, MULDER HH. Response of pigeon vestibular nerve to sound and vibration with audiofrequencies. J Acoust Soc Am 1984; 75: 202-8.
WO C, YOUNG Y, MUROFUSHI I. Tone burst-evoked myogenic potentials in human neckflexor and exstensors. Acta Otolaryngol (Stockh) 1999; 119:741-744.
WUCH, MUROFUSHI T.The effect of click repetition rate on vestibular evoked myogenic potential. Acta Otolaryngol 1999¸119: 29-32.
YANG CS, YOUNG YH. Clinical investigation on hypotensive patients with vertigo. Eur Arch Otorhinolaryngol. 2006 Sep;263(9):804-8.
YANG TL, YOUNG YH. Vestibular-evoked myogenic potentials in patients with otosclerosis using air-and bone-conducted tone-burst stimulation. Otol Neurotol. 2007 Jan;28(1):1-6.
YANG WS, KIM SH, LEE JD, LEE WS. Clinical significance of vestibular evoked myogenic potentials in benign paroxysmal positional vertigo. Otol Neurotol 2008; 29(8):1162-6.
YOSHIE N, OKUDAIRA T. Myogenic evoked potential responses to clicks in man. Acta Otolaryngol 1969;Suppl 252: 89- 103.
YOUNG ED, FERNANDEZ C, GOLDBERG JM. Responses of squirrel monkev vestibular neurons to audiofrequency sound and head vibration. Acta Otolaryngol 1977; 84:352-60.
YOUNG Y, WU C, WU C. Augmentation of vestibular evoked myogenic potentials: An indication for distended saccular hydrops. Laryngoscope. 2002;112:509-512,
YOUNG YH, HUANG TW, CHENG PW. Assessing the stage of Meniere’s disease using vestibular evoked myogenic potentials. Arch Otolaryngol Head Neck Surg 2003;129:815-18.
YOUNG YH, CHEN CN, HSIEH WS, WANG SJ. Development of vestibular evoked myogenic potentials in early life. Eur J Paediatr Neurol. 2008 Jun 19.
YOUNG YH. Vestibular evoked myogenic potentials: optimal stimulation and clinical application. J Biomed Sci. 2006 Nov;13(6):745-51.
WILSON, VJ, R. BOYLE, et al. (). “The vestibulocollic reflex.” J Vestib Res. 1995;5;(3): 147-70.
WU CC, YOUNG YH. vestibular evoked myogenic potentials are intact after sudden deafness. Ear and Hearing. 2002;, 235-238
ZAGÓLSKI O, JURKIEWICZ D. Functional evaluation of the vestibular organ in infants with risk factors for hearing loss occurring in the perinatal period. Med Sci Monit. 2006 Jun;12(6):CR248-52.
ZAGÓLSKI O. An acousticaly evoked short latency negative response in profound hearing loss infants. Auris Nasus Larynx. 2008 Sep;35(3):328-32.
ZAGÓLSKI O. Vestibular system in infants after systemic aminoglycoside therapy. Int J Pediatr Otorhinolaryngol. 2007 Nov;71(11):1797-802
ZHOU G, KENNA MA, STEVENS K, LICAMELI G. Assessment of saccular function in children with sensorineural hearing loss. Arch Otolaryngol Head Neck Surg 2009; 135(1): 40-44.
ZHOU G, COX LC. Vestibular evoked myogenic potentials: History and overview. Am J Audiol 2004;13:135-43.